
 , 刘友德1,3, 邓丽霞2, 邹志强2
, 刘友德1,3, 邓丽霞2, 邹志强2

1. 中国科学院烟台海岸带研究所, 山东 烟台 264003;
2. 山东省烟台市奇山医院, 山东 烟台 264001;
3. 中国科学院海洋大科学研究中心, 山东 青岛 266071;
4. 中国科学院大学, 北京 101407
收稿日期:2020-05-18;接收日期:2020-08-10;网络出版时间:2020-09-03
基金项目:中国科学院青年创新促进会(No. 2018246)资助
摘要:乙型肝炎病毒感染引起的慢性乙型肝炎(Chronic hepatitis B,CHB)是一种全球性流行疾病,严重时可引起肝功能衰竭,甚至发展成肝硬化和肝癌。也已发现CHB的发生和发展与肠道菌群的组成和结构的变化密切相关。为进一步探究肠道菌群结构与肝脏生化指标之间的联系,文中随机纳入14名CHB患者和11名健康对照者(Control group,CN),分析其肝脏生化指标和肠道菌群的结构以及两者的相关性。结果发现CHB患者肝脏生化指标丙氨酸转氨酶(Alanine transaminase,ALT)、总胆红素(Total bilirubin,TBIL)和γ-谷氨酰转移酶(Gamma glutamyl transferase,GGT)等的水平发生显著变化;普雷沃氏菌属Prevotella、劳特氏菌属Blautia、瘤胃球菌属Ruminococcus、Eubacterium eligens group等菌属失调;单形拟杆菌Bacteroides uniformis和Ruminococcus sp. 5_1_39BFAA可能与CHB患者的肝损伤相关,提示这些菌可能成为治疗CHB的新“切入点”。
关键词:慢性乙型肝炎肠道菌群16S rRNA肝脏生化指标
Correlation between gut microbiota and liver biochemical indicators in patients with chronic hepatitis B
Zhifang Zhao1,3,4, Song Qin1,3, Li Wang1,3, Lili Li2

 , Youde Liu1,3, Lixia Deng2, Zhiqiang Zou2
, Youde Liu1,3, Lixia Deng2, Zhiqiang Zou2

1. Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai 264003, Shandong, China;
2. Yantai City Hospital for infectious Diseases, Yantai 264001, Shandong, China;
3. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, Shandong, China;
4. University of Chinese Academy of Sciences, Beijing 101407, China
Received: May 18, 2020; Accepted: August 10, 2020; Published: September 3, 2020
Supported by: Youth Innovation Promotion Association CAS (No. 2018246)
Corresponding author: Lili Li. Tel: +86-535-2109077; E-mail: llli@yic.ac.cn;
Zhiqiang Zou. Tel: +86-535-6606100; E-mail: zhiqiangzou@126.com.
Abstract: Chronic hepatitis B (CHB) is a global epidemic disease caused by hepatitis B virus that can lead to hepatic failure, even liver cirrhosis and hepatocellular carcinoma. The occurrence and development of CHB are closely related to the changes in the gut microbiota communities. To explore the relationship between the structure of gut microbiota and liver biochemical indicators, 14 CHB patients (the CHB group) and 11 healthy people (the CN group) were randomly enrolled in this study. Our results demonstrate that CHB caused changes in the gut microbiota communities and biochemical indicators, such as alanine transaminase, total bilirubin and gamma glutamyl transferase. Furthermore, CHB induced imbalance of the gut microbiota. Prevotella, Blautia, Ruminococcus, Eubacterium eligens group, Bacteroides uniformis and Ruminococcus sp. 5_1_39BFAA were associated with the critical biochemical indicators and liver injury, suggesting a new approach to CHB treatment.
Keywords: chronic hepatitis Bgut microbiota16S rRNAliver biochemical indicators
慢性乙型肝炎病毒(Hepatitis B virus,HBV)感染是威胁人类健康的全球性问题。HBV感染容易导致一些严重的并发症,如肝功能衰竭和肝硬化,甚至肝细胞癌[1]。肠道是一个庞大而充满活力的细菌群落的自然栖息地,它影响宿主的新陈代谢并保护宿主的健康。肠道菌群结构的变化与肝病的发生和发展关系密切,随着科学家对肝-肠轴机制的深入研究,慢性肝病与肠道菌群之间的联系成为研究的焦点。据报道,肠道菌群的变化对肝脏疾病的发生具有重要的诱导和促进作用,肠道菌群的多样性与CHB、酒精性肝病、自身免疫性肝病、肝硬化和肝癌相关[2]。
肠道菌群领域的研究为HBV感染的防治提供了新的靶点。中国台湾****指出肠道菌群可能决定急性乙型肝炎和CHB的发病。特别是肠道菌群的组成和结构影响宿主对HBV的免疫应答,当肠道菌群处于异常状态时,急性乙型肝炎易转化为慢性感染[3]。因此,肠道菌群结构改变引起的免疫损伤对HBV感染的发展具有重要的影响。研究发现,与健康对照组相比,CHB患者肠中普拉梭菌Faecalibacterium prausnitzii、粪肠球菌Enterococcus faecalis和肠杆菌科Enterobacteriaceae细菌丰度显著增高[4-5]。最新研究表明肝硬化患者体内的肠杆菌科细菌丰度异常增高,其大量增殖产生的内毒素分泌到肠腔中,抑制上皮细胞中蛋白质的合成,从而破坏肠道屏障,出现肠道菌群失调[5]。Rios-Covian等[6]发现CHB患者的粪便胆汁酸水平明显较低,且与普拉梭菌、双歧杆菌Bifidobacterium和产乳酸的细菌丰度呈正相关,与肠杆菌科细菌丰度呈负相关。
研究发现,CHB患者的肝功能受损后,可以通过肝-肠轴减少肠道的蠕动和血液供应、影响胆汁的分泌,从而破坏肠道的黏膜,导致肠道菌群失调[7]。而肠道菌群的紊乱可造成促炎菌属和抗炎菌属的失衡,进而导致促炎物质,比如脂多糖(Lipopolysaccharide,LPS)、菌毛蛋白等增多,抗炎物质,比如乙酸、丁酸等短链脂肪酸减少,然后这些物质通过肠-肝轴和全身循环系统导致肝脏炎症。因此,肠道菌群与肝脏的作用是相互的,肠道菌群的改变可导致肝脏炎症,而肝脏炎症反过来也可以影响肠道菌群的结构和功能。
本研究共收集了25份来自烟台市传染病医院的粪便样本,进行16S rRNA基因测序分析;另外收集了他们的血液样本进行肝脏生化指标的测定;对14名CHB患者和11名CN组的肠道菌群结构进行了特征描述,研究CHB患者和CN组肠道菌群结构的差异和肝脏生化指标的差异,进而发现肠道菌群与肝功能之间的关系。
1 材料与方法1.1 研究对象本研究从2018年3月至2019年12月招募了14例CHB患者和11名没有慢性疾病或胃肠道疾病史的健康受试者。CHB患者的诊断标准以HBV感染为依据。排除标准包括:过去3–6个月内使用抗生素或饮酒,有胃肠手术史,有其他肝营养性病毒或有艾滋病病毒(Human immunodeficiency virus,HIV)感染史和生活方式不健康的人。本研究方案符合1975年“赫尔辛基宣言”的伦理标准,经烟台市传染病医院人类伦理委员会批准,并获得所有受试者的书面知情同意。
1.2 肝脏生化指标测定取受试者5 mL清晨空腹静脉血,凝固后以3 000 r/min的转速离心10 min,分离后的血清于?20 ℃保存。使用自动生化分析仪(Model LX-20;Beckman,Fullerton,USA)测量丙氨酸转氨酶(Alanine transaminase,ALT),天冬氨酸转氨酶(Aspartate aminotransferase,AST)、谷氨酰转移酶(Gamma glutamyl transferase,GGT)、碱性磷酸酶(Alkaline phophatase,ALP)、总胆红素(Total bilirubin,TBIL)、总胆汁酸(Total bile acid,TBA)、血糖(Glucose,GLU)、甘油三酯(Triglyceride,TG)、极低密度脂蛋白胆固醇(Very low density lipoprotein,VLDL)、低密度脂蛋白胆固醇(Low density lipoprotein-cholesterol,LDL-C)、高密度脂蛋白胆固醇(High density lipoprotein-cholesterol,HDL-C)、高敏C反应蛋白(High-sensitivity C-reactive protein,HsCRP)、乙型肝炎表面抗原(Hepatitis B surface antigen,HBsAg)、国际标准化比率(International normalized ratio,INR)、白蛋白(Albumin,ALB)、总胆固醇(Cholesterol,CHOL)和白细胞计数(White blood cell count,WBC)的血清水平。
1.3 粪便样本的采集及基因组DNA的提取和扩增采集新鲜粪便时使用一次性采样勺,并将新鲜粪便放入冰盒,立即转运至实验室。在实验室称取约200–250 mg,分装于EP管中,迅速转移至?80 ℃冰箱保存。样品中的总基因组DNA的提取使用CTAB/SDS方法。采用琼脂糖凝胶电泳分析DNA浓度和纯度,使用无菌水将DNA浓度调至1 ng/μL。使用特异性引物(16S V4:515F-806R)扩增出不同区域的16S rRNA基因(V3–V4/16S)。所有PCR反应均在Phusion?高保真PCR预混液进行,最后一个文库在Illumina HiSeq 2500平台上测序,并生成末端配对序列,大小250 bp。
1.4 高通量测序分析对测序结果进行多路解编和筛选。以相似性临界值为97%选择操作分类单位(Operational taxonomic units,OTU),然后使用Greengenes数据库(V.13.8)对已识别的OTU进行比对。鉴定并删除嵌合序列。从OTU表中删除序列数量少于序列总数的0.005%的OTU。使用对应于序列最少的样品的序列号标准对OTU的丰度信息进行归一化处理。随后基于该输出的标准化数据进行α多样性和β多样性的分析。对于每个代表序列,均根据RDP分类器算法(http://sourceforge.net/projects/rdp-classifier/)使用GreenGene数据库来注释分类信息。使用PICRUSt从16S rRNA序列推导出肠道微生物组的元基因组。接下来,通过16S rRNA基因拷贝数对所得的OTU表进行标准化,预测每个个体的基因含量。预测的概况和功能基因被归类于京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)。在Majorbio I-Sanger Cloud的免费在线平台(www.i-sanger.com)上进行数据分析。
1.5 统计学方法使用SPSS进行数据分析。CHB组和CN组之间的差异采用单因素方差分析,数据用x±s表示。各组数据间比较采用样本均数t检验分析,P值小于0.05被视为具有统计学意义(*:0.01 < P≤0.05;**:0.001 < P≤0.01;***:P≤0.001)。Spearman’s rank测试用于相关性分析。
2 结果与分析2.1 CHB患者的肝脏生化指标分析在CHB患者中,TBIL、GGT、INR和ALT含量显著性增高(图 1A),HDL-C含量显著性降低(图 1B),差异具有统计学意义(P≤0.05)。以上均为肝功能检查的常规项目,对于判断肝脏病变情况有较大的临床意义。
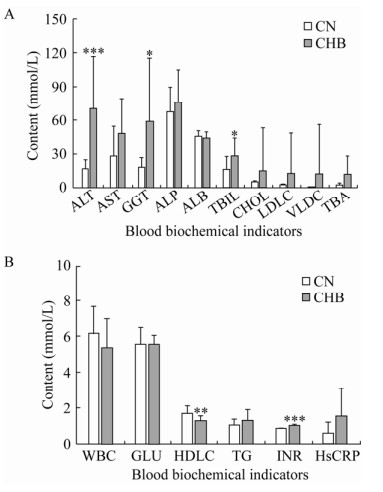 |
| 图 1 慢性乙肝患者(CHB)与健康对照组(CN)血液生化因子差异 Fig. 1 Differences in blood biochemical indicators between patients with chronic hepatitis B (CHB) and controls (CN). *: P < 0.05; **: P < 0.01; ***: P < 0.001. |
| 图选项 |
2.2 CHB患者和CN组肠道菌群的OTUs差异分析共获得1 613 861条有效序列(总长599 420 384 bp),平均长度为371.42 bp。随后,对测序有效数据进行OTUs聚类和丰度统计。为了分析CHB患者和CN组肠道菌群OTUs组成的差异程度,我们进行了基于Bray-Curtis距离的非度量多维尺度分析(Non-metric multidimensional scaling,NMDS) (图 2)。结果显示,CHB患者和CN组之间的样本分为两个簇集且Stress < 0.2,说明CHB患者和CN组肠道菌群的结构存在显著差异。
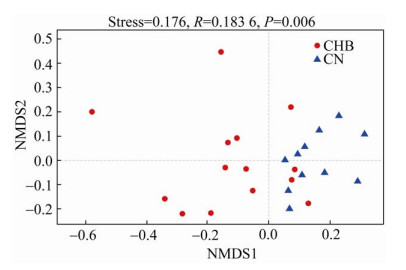 |
| 图 2 OUT水平上的NMDS分析 Fig. 2 NMDS analysis at the OUT level. Stress value reflects the pros and cons of NMDS analysis results. It is generally considered that when stress < 0.2, it can be represented by a two-dimensional dot plot of NMDS, and its graph has an explanatory meaning. |
| 图选项 |
2.3 CHB患者和CN组肠道菌群的结构差异分析门水平上,变形菌门Proteobacteria、厚壁菌门Firmicutes和拟杆菌门Bacteroidetes是两个组中的优势种(图 3)。科水平上,毛螺菌科Lachnospiraceae、拟杆菌科Bacteroidaceae和疣微菌科Ruminococcaceae是两个组的优势种(图 4)。图 4可知CHB患者中普雷沃氏菌科Prevotellaceae丰度显著增高,而疣微菌科丰度显著降低。
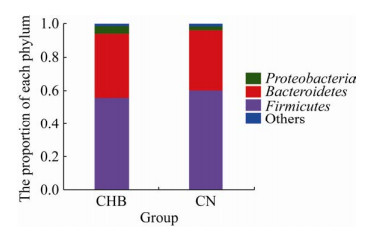 |
| 图 3 门水平上的肠道菌群结构 Fig. 3 Construction of gut microbiota at the phylum level. Others: less than 0.01% of the phylum were merged into others. |
| 图选项 |
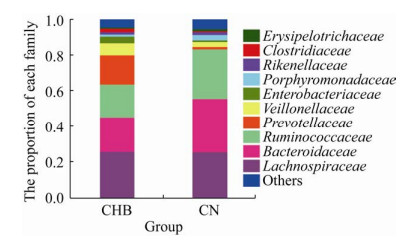 |
| 图 4 科水平上的肠道菌群结构 Fig. 4 Construction of gut microbiota at the family level. Others: less than 0.01% of the family were merged into others. |
| 图选项 |
我们对CHB患者与CN组各样本中物种相对丰度排名前15的属和种水平的物种丰度进行了差异分析。根据群落丰度数据,进行组间差异显著性检验并评估观察到的差异的显著性(图 5和图 6)。CHB患者中丰度高于CN组的属有6个(图 5),包括普雷沃氏菌属、巨单胞菌属Megamonas、Roseburia,其中普雷沃氏菌属、巨单胞菌属和Eubacterium eligens group丰度显著增高,差异具有统计学意义(P≤0.05)。CHB患者中丰度低于CN组的属有9个(图 5),包括拟杆菌属Bacteroides、粪杆菌属Faecalibacterium和劳特氏菌属等,其中劳特氏菌属、瘤胃球菌属和Fusicatenibacter丰度显著降低,差异具有统计学意义(P≤0.05)。CHB患者中丰度高于CN组的种有8个(图 6)。CHB患者中丰度低于CN组的种有7个(图 6),其中单形拟杆菌和瘤胃球菌属的Ruminococcus sp. 5_1_39BFAA丰度显著降低,差异具有统计学意义(P≤0.05)。
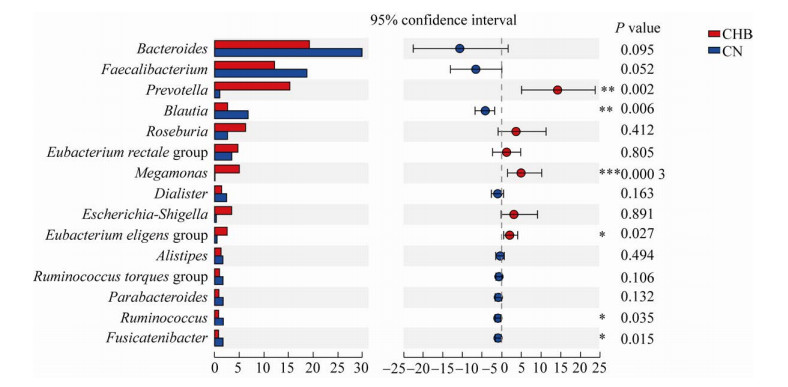 |
| 图 5 属水平上的物种间丰度差异分析 Fig. 5 Analysis of interspecies abundance differences at the genus level. *: P < 0.05; **: P < 0.01; ***: P < 0.001. |
| 图选项 |
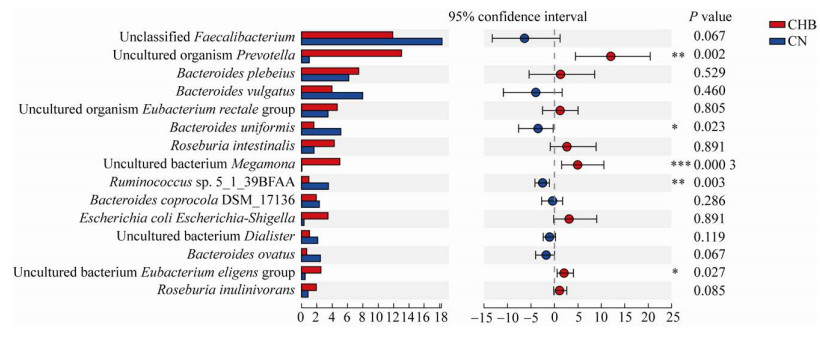 |
| 图 6 种水平上的物种间丰度差异分析 Fig. 6 Analysis of interspecies abundance differences at the species level. *: P < 0.05, **: P < 0.01, ***: P < 0.001. |
| 图选项 |
2.4 肠道菌群与CHB患者肝脏生化指标的相关性分析肝脏生化指标与肠道菌属的相关性分析(图 7)显示,普雷沃氏菌属与Hepatitis B surface antigen,HBsAg、INR、TBA水平呈显著正相关(r > 0,P≤0.05);Eubacterium eligens group与HBsAg、INR、GGT水平呈显著正相关(r > 0,P≤0.05),与ALB水平呈显著负相关(r=?0.48,P=0.01);巨单胞菌属与AST、TBIL、HBsAg、INR、ALT、TBA和HsCRP水平呈显著正相关(r > 0,P≤0.05);拟杆菌属与LDLC水平呈显著负相关(r=?0.41,P=0.04);劳特氏菌属与HBsAg、INR、ALT和HsCRP水平呈显著负相关(r < 0,P≤0.01);瘤胃球菌属与HBsAg、INR和TBA水平呈显著负相关(r < 0,P≤0.05)。
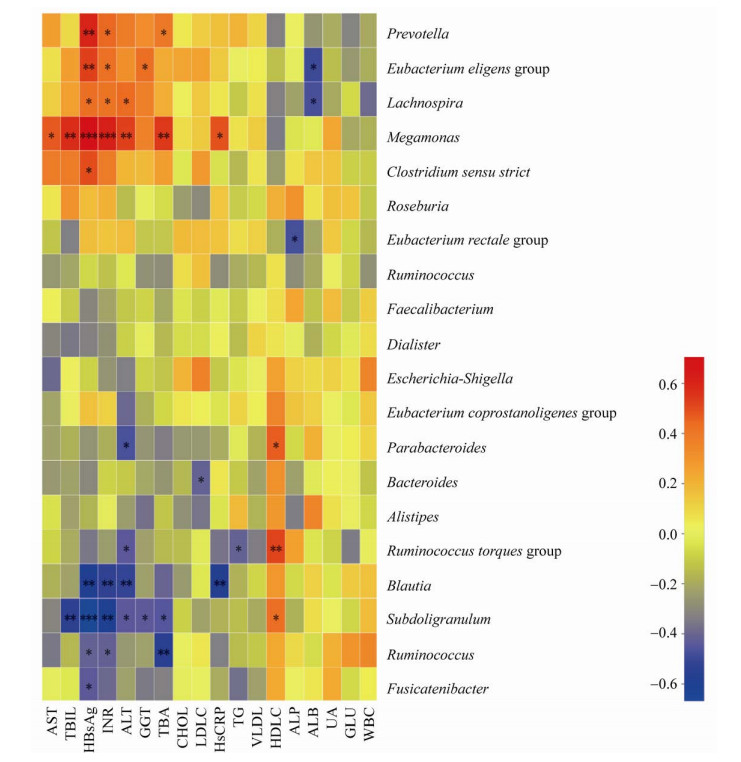 |
| 图 7 慢性乙肝(CHB)与对照组(CN)属水平肠道菌群与肝脏生化指标相关性分析 Fig. 7 Correlation analysis of gut microbiota and liver biochemical indicators in chronic hepatitis B (CHB) and control (CN) at the genus level. UA: Uric acid; HBsAg: Hepatitis B surface antigen. *: P < 0.05; **: P < 0.01; ***: P < 0.001. |
| 图选项 |
肝脏生化指标与肠道菌种的相关性分析(表 1),Ruminococcus sp. 5_1_39BFAA与ALT、HsCRP和INR水平呈显著负相关(r < 0,P≤0.05);单形拟杆菌与TBA和GGT水平呈显著负相关(r < 0,P≤0.05);罗氏弧菌Roseburia intestinalis与ALT水平呈显著负相关(r=?0.42,P=0.02);普通拟杆菌Bacteroides vulgatus与LDLC水平呈显著负相关(r=?0.51,P=0.01);罗氏菌Roseburia inulinivorans与HsCRP和INR水平呈显著正相关(r > 0,P≤0.05),与LDLC水平呈显著负相关(r=?0.46,P=0.02);Bacteroides coprocola DSM_17136与ALT水平呈显著正相关(r=0.46,P=0.02)。
表 1 慢性乙肝(CHB)与对照组(CN)种水平肠道菌群与肝脏生化指标相关性分析Table 1 Correlation analysis of gut microbiota and liver biochemical indicators in chronic hepatitis B (CHB) and control (CN) at the species level
| Species | TBA | ALT | HsCRP | GGT | INR | TBIL | LDLC | HDLC | |||||||||||||||
| R value | P value | R value | P value | R value | P value | R value | P value | R value | P value | R value | P value | R value | P value | R value | P value | ||||||||
| Bacteroides stercoris ATCC_43183 | –0.04 | 0.85 | –0.32 | 0.12 | –0.08 | 0.70 | –0.28 | 0.17 | –0.16 | 0.46 | –0.43 | 0.03 | –0.13 | 0.55 | 0.60 | 0.001 | |||||||
| Ruminococcus sp. 5_1_39BFAA | –0.33 | 0.11 | –0.49 | 0.01 | –0.48 | 0.01 | –0.19 | 0.37 | –0.48 | 0.02 | –0.17 | 0.43 | –0.16 | 0.46 | 0.35 | 0.08 | |||||||
| Bacteroides ovatus | –0.46 | 0.02 | –0.42 | 0.04 | –0.19 | 0.37 | –0.33 | 0.11 | –0.30 | 0.15 | –0.35 | 0.09 | –0.42 | 0.04 | 0.37 | 0.07 | |||||||
| Bacteroides uniformis | –0.45 | 0.02 | –0.39 | 0.06 | 0.005 | 0.98 | –0.54 | 0.005 | –0.35 | 0.09 | –0.19 | 0.36 | –0.19 | 0.35 | 0.39 | 0.055 | |||||||
| Roseburia intestinalis | –0.36 | 0.08 | –0.47 | 0.02 | –0.17 | 0.42 | –0.28 | 0.17 | 0.04 | 0.85 | 0.15 | 0.47 | –0.14 | 0.51 | 0.33 | 0.10 | |||||||
| Bacteroides vulgatus | –0.12 | 0.56 | –0.03 | 0.90 | 0.12 | 0.58 | –0.06 | 0.77 | 0.03 | 0.88 | –0.12 | 0.55 | –0.51 | 0.01 | 0.24 | 0.25 | |||||||
| Roseburia inulinivorans | 0.33 | 0.11 | 0.17 | 0.42 | 0.40 | 0.05 | 0.20 | 0.33 | 0.42 | 0.04 | 0.35 | 0.08 | –0.46 | 0.02 | –0.02 | 0.93 | |||||||
| Bacteroides coprocola DSM_17136 | 0.18 | 0.39 | 0.46 | 0.02 | 0.13 | 0.54 | 0.19 | 0.35 | 0.23 | 0.27 | 0.08 | 0.71 | 0.22 | 0.30 | –0.24 | 0.25 | |||||||
表选项
3 讨论ALT反映了肝细胞的损害程度,被视为肝脏损伤的敏感标志物。肝细胞受损越严重,ALT排放到血液中的量就越多[8]。各种病毒性肝炎都可能导致ALT升高。GGT反映了胆管细胞的损伤程度,并与肝纤维化程度有关。在急性肝炎期间,如果GGT持续升高,则提示肝炎慢性化;在CHB患者中,GGT检测值常常高于正常值1–2倍,如长期升高,可能是病变活动或病情恶化。TBIL能够反映胆红素代谢是否发生障碍。如果肝细胞受损,肝脏将间接胆红素转化为直接胆红素的能力下降,这时会引起直接胆红素和间接胆红素同时偏高的现象,且总胆红素也偏高。我们的研究表明CHB会导致TBIL、GGT、INR和ALT含量显著增高,这与Rebort、Sherman等[9-10]的研究结果一致。HDLC是通过血脂反映肝脏功能的指标。王延君等[11]发现,HDLC含量与TBIL、ALT含量呈负相关,且与TBIL的相关性较ALT高。研究发现CHB会导致HDLC含量显著降低,这与Ramcharran等[12]的研究结果一致。总之,TBIL、GGT、INR、ALT和HDLC是肝功能强弱的重要反映指标。
瘤胃球菌能够发酵复杂的碳水化合物,如纤维素、果胶和抗性淀粉[13],是乙酸和丙酸的生产者[14],它很好地适应了肠道环境,是存在于90%的人类消化道中的“57种核心微生物”之一[15]。Bajaj等[16]在探究肠道微生态失衡与肝性脑病之间关系时,发现患者肠道中瘤胃球菌属丰度显著降低。此外,相关性分析显示瘤胃球菌属与炎症呈负相关。有研究报道三氯蔗糖能够降低肠道中的瘤胃球菌属的丰度[17]。瘤胃球菌属产生的乙酸和丙酸等短链脂肪酸,可以减少致炎因子一氧化氮(NO)、肿瘤坏死因子(TNF-α)、白细胞介素(IL-1β、IL-6)的产生,同时可以刺激抗炎因子IL-10的增多[18]。当肠道中瘤胃球菌属丰度显著降低时,它抑制NO、TNF-α等致炎因子的能力下降,同时促进抗炎因子分泌的能力也下降,导致致炎因子增多,抗炎因子减少,可能会诱导肝脏等炎症的发生。研究发现CHB患者粪便中瘤胃球菌属丰度显著降低,与Gou等[19]的研究结果一致。由此推测,CHB患者体内瘤胃球菌属丰度显著降低可能与肝脏炎症增加有关。而长时间的肝脏炎症会诱发肝损伤,导致INR水平升高,与瘤胃球菌呈显著负相关,进一步说明粪便中瘤胃球菌属与CHB患者的肝损伤可能存在一定的相关性。
Ridlon等[20]研究发现,普雷沃氏菌表面的LPS可诱导促炎基因IL-8的表达,增加炎症反应。并且已有20种普雷沃氏菌属的细菌被发现会引起人体多部位炎症[21]。研究表明粘膜部位的普雷沃氏菌种类增多与局部和全身性疾病有关,包括牙周炎、细菌性阴道炎、类风湿关节炎、代谢紊乱和低度系统炎症等。这是因为普雷沃氏菌属丰度的增加能够增强Th17介导的粘膜炎症[22]。当肠道中普雷沃氏菌属丰度显著增高时,可能会促进促炎基因的表达,比如IL-8。促炎基因过度表达,一些免疫细胞,比如Th17,产生促炎因子,就可能会诱导肝炎的发生。研究发现CHB患者粪便中普雷沃氏菌属丰度显著增高,与Gou等[19]的研究结果一致。由此推测,CHB患者体内普雷沃氏菌属丰度显著增高可能与肝脏炎症增加有关。而长时间的肝脏炎症会诱导肝脏生化指标INR水平升高,与普雷沃氏菌属呈显著正相关,进一步说明粪便中普雷沃氏菌属与CHB患者的肝损伤可能存在一定的相关性。
拟杆菌属于革兰氏阴性菌,当其死亡溶解后会释放出细胞壁中的LPS[23]。LPS是一种来自革兰氏阴性细菌外膜的内毒素,可以导致促炎细胞因子(IL-6和TNF-α)的分泌增多,诱导炎症反应。研究显示CHB患者粪便中拟杆菌属丰度低于CN组,这与Lu等[5]的结果一致。这可能说明CHB患者中拟杆菌属的降低与肝脏炎症有关。Arumugam等[24]曾对22个人的肠道菌群宏基因组进行测序对比,发现人体的肠道菌群可以分为普雷沃氏菌属、瘤胃球菌属和拟杆菌属3个类型。后来对更大规模的人群(154名美国人和85名丹麦人)进行调查也得到了同样的结论。2018年,29位研究肠道菌群的世界顶级科学家,提出了肠道分型的统一标准,并制作了肠型在线分类器,但肠型分类仍以3个菌属为流行分类方法[25]。本研究中,CN组中拟杆菌属丰度较高,CHB患者的普雷沃氏菌属丰度增高而拟杆菌属丰度降低。我们的结果表明CN组的肠道菌群属于1类肠型,而CHB患者的菌群属于2类肠型。分析CHB与肠型之间的联系,可以为CHB的预防和诊治提供一定的依据。
有研究发现Eubacterium eligens DSM3376能够利用苹果果胶并编码广泛的果胶水解酶,裂解低聚糖,从而发挥抗炎作用[26]。当肝脏炎症导致人体肝脏组织受损,肝脏生化指标GGT和INR含量显著增高,诱导Eubacterium eligens group属丰度也显著增高,裂解低聚糖,发挥抗炎作用,说明Eubacterium eligens group与CHB患者的肝损伤可能存在一定的相关性。此外,有研究发现与CHB患者相比,肝癌患者粪便中劳特氏菌属的丰度进一步降低[27]。劳特氏菌属是一种抗炎性菌属[27],能够产生丁酸,通过降低过氧化物酶和环氧合酶等减轻炎症反应[28],具有抗炎和免疫调节功能,且抗炎特性比乙酸和丙酸更强。当肠道中劳特氏菌属丰度显著降低时,人体肠道菌群甚至肝脏抵抗病原体入侵的能力也随之下降,从而使肠道和肝脏发生炎症反应的可能性增加,导致CHB甚至肝硬化的发生。我们的结果发现CHB患者粪便中劳特氏菌属丰度显著降低。CHB的发展会导致人体肝脏组织受损,INR和ALT含量显著增高,与劳特氏菌属呈显著负相关,这与Guo等[29]的研究结果一致。故粪便中劳特氏菌属与CHB患者的肝损伤可能存在一定的相关性。
赵少倩等[30]研究发现单形拟杆菌能够减少肝脏和肌肉组织的脂质异位沉积和内质网应激,从而改善小鼠的脂肪代谢,并且该菌株丰度在肥胖人群中普遍降低。Cano等[31]发现单形拟杆菌可改善高脂饮食诱导的肥胖小鼠的脂肪代谢,缓解其免疫失衡状态。我们的结果发现CHB患者粪便中单形拟杆菌丰度显著降低。当肠道中单形拟杆菌丰度显著降低时,可能导致肝脏脂肪代谢受阻,引起脂肪肝的同时合并CHB,导致进一步的肝脏受损,GGT水平升高。其水平与单形拟杆菌呈显著负相关。故粪便中单形拟杆菌与CHB患者的肝损伤可能存在一定的相关性。关于Ruminococcus sp. 5_1_39BFAA研究得较少,蒋兴宇等[32]发现适度的运动可以增加这种菌种的丰度,为改善CHB提供了一种新思路。Ruminococcus sp. 5_1_39BFAA属于瘤胃球菌属,是一种可产生短链脂肪酸的益生菌。且该菌能够产生D-阿洛酮糖3-差向异构酶,将D-果糖转化为D-阿洛酮糖,在不受信号肽的引导下将其分泌到细胞外。研究发现D-阿洛酮糖能够促进脂肪的代谢,能够降低脂肪合成相关的PPAR-7、C/EBPα基因表达量,同时降低与炎症反应相关的基因TNF-α及IL-6的表达量[33]。我们的结果发现CHB患者粪便中Ruminococcus sp. 5_1_39BFAA丰度显著降低。当肠道中Ruminococcus sp. 5_1_39BFAA丰度显著下降时,就可能会导致肝脏等炎症的发生,ALT和INR水平升高,与Ruminococcus sp. 5_1_39BFAA呈显著负相关,故粪便中Ruminococcus sp. 5_1_39BFAA与CHB患者的肝损伤和炎症可能存在一定的相关性。
关于肠道菌群中的某个属或者种在调节肝脏疾病上的具体作用机制目前并没有阐明,这是因为肠道菌群是一个相互作用的调节网络,在共同调节人体的新陈代谢以及某些器官的功能方面相互影响、密不可分。目前关于肠道菌群对肝脏炎症的作用机制,主要包括促炎菌属和抗炎菌属两个方面。
总之,CHB会导致肠道菌群结构以及肝脏生化指标的水平发生显著变化;失调菌属,比如普雷沃氏菌属、劳特氏菌属、瘤胃球菌属、Eubacterium eligens group,单形拟杆菌和Ruminococcus sp. 5_1_39BFAA可能与CHB患者的肝损伤有关,这些关联微生物的发现可为CHB患者肠道菌群的研究和诊治提供一定的参考。
参考文献
| [1] | Beckebaum S, Malagó M, Dirsch O, et al. Efficacy of combined lamivudine and adefovir dipivoxil treatment for severe HBV graft reinfection after living donor liver transplantation. Clin Transplant, 2003, 17(6): 554-559. DOI:10.1046/j.0902-0063.2003.00097.x |
| [2] | Castelnau C, Gal FL, Ripault MP, et al. Efficacy of peginterferon alpha-2b in chronic hepatitis delta: relevance of quantitative RT-PCR for follow-up. Hepatology, 2006, 44(3): 728-735. DOI:10.1002/hep.21325 |
| [3] | Chou HH, Chien WH, Wu LL, et al. Age-related immune clearance of hepatitis B virus infection requires the establishment of gut microbiota. Proc Natl Acad Sci USA, 2015, 112(7): 2175-2180. DOI:10.1073/pnas.1424775112 |
| [4] | Pan C, Gu Y, Zhang W, et al. Dynamic changes of lipopolysaccharide levels in different phases of acute on chronic hepatitis B liver failure. PLoS ONE, 2012, 7(11): e49460. DOI:10.1371/journal.pone.0049460 |
| [5] | Lu HF, Wu ZW, Xu W, et al. Intestinal microbiota was assessed in cirrhotic patients with hepatitis B virus infection. Intestinal microbiota of HBV cirrhotic patients. Microb Ecol, 2011, 61(3): 693-703. DOI:10.1007/s00248-010-9801-8 |
| [6] | Ríos-Covián D, Ruas-Madiedo P, Margolles A, et al. Intestinal short chain fatty acids and their link with diet and human health. Front Microbiol, 2016, 7: 185. |
| [7] | Othman M, Agfiero R, Lin HC. Alterations in intestinal microbial flora and human disease. Curt Opin Gastroenter, 2008, 24(1): 6-11. |
| [8] | Yun Y, Chang Y, Kim HN, et al. Alterations of the gut microbiome in chronic hepatitis B virus infection associated with alanine aminotransferase level. J Clin Med, 2019, 8(2): 173. DOI:10.3390/jcm8020173 |
| [9] | Robert PM, Tainturier MH, Ratziu V, et al. Prediction of liver histological lesions with biochemical markers in patients with chronic hepatitis B. J Hepatol, 2003, 39(2): 222-230. DOI:10.1016/S0168-8278(03)00171-5 |
| [10] | Sherman M, Yurdaydin C, Simsek H, et al. Entecavir therapy for lamivudine-refractory chronic hepatitis B: improved virologic, biochemical, and serology outcomes through 96 weeks. Hepatology, 2008, 48(1): 99-108. DOI:10.1002/hep.22323 |
| [11] | Wang YJ, Li Q, Yang LM. Detection and clinical significance of blood lipid related indexes in patients with chronic hepatitis B. Acta Academ Med Weifang, 2015, 37(2): 138-140 (in Chinese). 王延君, 李群, 杨丽敏. 慢性乙型肝炎患者血脂相关指标检测与临床意义. 潍坊医学院学报, 2015, 37(2): 138-140. |
| [12] | Ramcharran D, Wahed AS, Conjeevaram HS, et al. Associations between serum lipids and hepatitis C antiviral treatment efficacy. Hepatology, 2010, 52(3): 854-863. DOI:10.1002/hep.23796 |
| [13] | Ze XL, Duncan SH, Louis P, et al. Ruminococcus bromii is a keystone species for the degradation of resistant starch in the human colon. ISME J, 2012, 6(8): 1535-1543. DOI:10.1038/ismej.2012.4 |
| [14] | Christopherson MR, Dawson JA, Stevenson DM, et al. Unique aspects of fiber degradation by the ruminal ethanologen Ruminococcus albus 7 revealed by physiological and transcriptomic analysis. BMC Genomics, 2014, 15: 1066. DOI:10.1186/1471-2164-15-1066 |
| [15] | Hattori M, Taylor TD. The human intestinal microbiome: a new frontier of human biology. DNA Res, 2009, 16(1): 1-12. DOI:10.1093/dnares/dsn033 |
| [16] | Bajaj JS, Hylemon PB, Ridlon JM, et al. Colonic mucosal microbiome differs from stool microbiome in cirrhosis and hepatic encephalopathy and is linked to cognition and inflammation. Am J Physiol Gastrointest Liver Physiol, 2012, 303(6): G675-G685. DOI:10.1152/ajpgi.00152.2012 |
| [17] | Bian XM, Chi L, Gao B, et al. Gut microbiome response to sucralose and its potential role in inducing liver inflammation in mice. Front Physiol, 2017, 8: 487. DOI:10.3389/fphys.2017.00487 |
| [18] | Vinolo MAR, Rodrigues HG, Hatanaka E, et al. Short-chain fatty acids stimulate the migration of neutrophils to inflammatory sites. Clin Sci, 2009, 117(9): 331-338. DOI:10.1042/CS20080642 |
| [19] | Guo RY, Chen ZJ, Chen N, et al. Quantitative real-time PCR analysis of intestinal regular fungal species in fecal samples from patients with chronic hepatitis B virus infection. Lab Med, 2010, 41(10): 591-596. DOI:10.1309/LMMC0WVZXD13PUJG |
| [20] | Ridlon JM, Kang DJ, Hylemon PB. Isolation and characterization of a bile acid inducible 7α-dehydroxylating operon in Clostridium hylemonae TN271. Anaerobe, 2010, 16(2): 137-146. DOI:10.1016/j.anaerobe.2009.05.004 |
| [21] | Shan HN, Collins DM. NOTES: Prevotella, a new genus to include Bacteroides melaninogenicus and related species formerly classified in the genus bacteroides. Inter J Systemat Bacteriol, 1990, 40(2): 205-208. DOI:10.1099/00207713-40-2-205 |
| [22] | Larsen JM. The immune response to Prevotella bacteria in chronic inflammatory disease. Immunology, 2017, 151(4): 363-374. DOI:10.1111/imm.12760 |
| [23] | Han DW. Intestinal endotoxemia as a pathogenetic mechanism in liver failure. World J Gastroenterol, 2002, 8(6): 961-965. DOI:10.3748/wjg.v8.i6.961 |
| [24] | Arumugam M, Raes J, Pelletler E, et al. Enterotypes of the human gut microbiome. Nature, 2011, 473(7346): 174-180. DOI:10.1038/nature09944 |
| [25] | Costea PI, Hildebrand F, Arumugam M, et al. Enterotypes in the landscape of gut microbial community composition. Nat Microbiol, 2018, 3(1): 8-16. DOI:10.1038/s41564-017-0072-8 |
| [26] | Chung WSF, Meijerink M, Zeuner B, et al. Prebiotic potential of pectin and pectic oligosaccharides to promote anti-inflammatory commensal bacteria in the human colon. FEMS Microbiol Ecol, 2017, 93(11). DOI:10.1093/femsec/fix127 |
| [27] | Ponziani FR, Bboori SB, Castelli C, et al. Hepatocellular carcinoma is associated with gut microbiota profile and inflammation in nonalcoholic fatty liver disease. Hepatology, 2019, 69(1): 107-120. DOI:10.1002/hep.30036 |
| [28] | Leonel AJ, Alvarez-Leite JI. Butyrate: implications for intestinal function. Curr Opin Clin Nutr Metab Care, 2012, 15(5): 474-479. DOI:10.1097/MCO.0b013e32835665fa |
| [29] | Guo C, Li YH, Wang PP, et al. Alterations of gut microbiota in cholestatic infants and their correlation with hepatic function. Front Microbiol, 2018, 9: 2682. DOI:10.3389/fmicb.2018.02682 |
| [30] | Zhao SQ, Liu W, Shi J, et al. Bacteroides uniformis supplementation improves glucose homeostasis by alleviating lipid accumulation and endoplasmic reticulum stress in liver/muscle in chow-diet mice. J Diagnost Concepts Pract, 2016, 15(3): 263-267 (in Chinese). 赵少倩, 刘文, 石娟, 等. 单形拟杆菌减轻组织脂质沉积及内质网应激改善小鼠葡萄糖代谢. 诊断学理论与实践, 2016, 15(3): 263-267. |
| [31] | Cano PG, Santacruz A, Moya á, et al. Bacteroides uniformis CECT 7771 ameliorates metabolic and immunological dysfunction in mice with high-fat-diet induced obesity. PLoS ONE, 2012, 7(7): e41079. DOI:10.1371/journal.pone.0041079 |
| [32] | Jiang XY, Zhao X, Zou LY, et al. Moderate exercise induces shift in the composition of human gut microbiota. J Third Military Medic Univ, 2017, 39(18): 1824-1831 (in Chinese). 蒋兴宇, 赵霞, 邹凌云, 等. 适度运动对人体肠道菌群结构的影响. 第三军医大学学报, 2017, 39(18): 1824-1831. |
| [33] | Shen XM, Wang J, Zhang Y, et al. Research progress of D-psicose: function and its biosynthesis. Chin J Biotech, 2018, 34(9): 1419-1431 (in Chinese). 沈雪梅, 王靖, 张媛, 等. D-阿洛酮糖的功能及其生物合成研究进展. 生物工程学报, 2018, 34(9): 1419-1431. |
