

中国计量大学 生命科学学院 浙江省海洋食品品质及危害物控制技术重点实验室 浙江省生物计量及检验检疫技术重点实验室,浙江 杭州 310018
收稿日期:2019-07-09;接收日期:2019-09-25;网络出版时间:2019-11-12
基金项目:浙江省重点研发计划课题(No. 2015C03020-4),国家重点研发计划子课题(No. 2017YFD0801104-5),浙江省自然科学基金(No. LQ18C020001),浙江省大学生科技创新活动计划(No. 2018R409044)资助
作者简介:朱诚 ??博士,二级教授,博士生导师,1984–2010年在浙江大学生命科学科学院工作,2010年起任中国计量大学生命科学学院院长,2016年起任中国计量大学人事处处长。“海洋食品加工质量控制技术与仪器”国家地方工程实验室常务副主任,浙江省“海洋食品品质及危害物控制技术”重点实验室副主任,浙江省”食品科学”重点学科负责人,浙江省植物生理与分子生物学学会副理事长,浙江省“农产品安全标准与检测技术”重点科技创新团队带头人,浙江省食品安全专家委员会委员。主持国家重点基础研究发展规划(973计划)项目课题、国家自然科学基金、国家科技支撑计划、省自然科学基金重点项目等国家省部级项目35项,在国内外期刊上发表论文120余篇,其中在Autophagy、PlantPhysiol、Plant Cell、J Exp Bot、Planta等期刊上发表论文60余篇,编著4本,授权国家发明专利15项。获浙江省科学技术进步二等奖与三等奖各1项,浙江省高等学校科研成果一等奖1项.
通讯作者:Cheng Zhu. Tel: +86-571-86836090; E-mail: pzhch@cjlu.edu.cn.
摘要:通过盆栽和大田试验研究扫帚菜Kochia scoparia对土壤中镉(Cd)的富集效率,并利用盆栽试验将其与4个白菜品种进行轮作试验,验证扫帚菜对土壤Cd污染的修复效果。结果表明,扫帚菜各部位富集能力表现为叶 > 根 > 茎,富集系数分别为15.07、5.44和2.96;种植扫帚菜后土壤总Cd降低6.02%?13.60%;土壤脲酶和酸性磷酸酶活性也有所提高。盆栽轮作结果表明,扫帚菜-白菜轮作系统中白菜地上部Cd含量与未轮作的对照组相比平均降低17.21%,生物量有略微增加,地上部对Cd的转运系数无明显变化。结果显示,通过扫帚菜与白菜轮作不仅可以增加白菜产量,而且可以有效降低白菜可食部Cd含量,实现边生产边治理的绿色农业理念。
关键词:镉植物修复轮作扫帚菜白菜
Effects of Kochia scoparia-Brassica rapa rotation on Cd uptake by Brassica rapa
Hexigeduleng Bao*, Jiayue Wan*, Jiamin Yang, Yanfei Ding, Feijuan Wang, Qiong Jiang, Cheng Zhu


Key Laboratory of Marine Food Quality and Hazard Controlling Technology of Zhejiang Province, Zhejiang Provincial Key Laboratory of Biometrology and Inspection & Quarantine, College of Life Sciences, China Jiliang University, Hangzhou 310018, Zhejiang, China
Received: July 9, 2019; Accepted: September 25, 2019; Published: November 12, 2019
Supported by: Key Research and Development Project of Zhejiang Province (No. 2015C03020-4), National Key Research and Development Plan Sub-topic (No. 2017YFD0801104-5), Natural Science Foundation of Zhejiang Province (LQ18C020001), Zhejiang Province University Student' Research and Innovation Program Support Project (No. 2018R409044)
*These authors contributed equally to this study.
Abstract: In this study, pot and field experiments were conducted to study the enrichment of soil cadmium by Kochia scoparia. Further, rotations in pot experiments were carried out with four varieties of Brassica rapa to verify the remediation effect of Kochia scoparia on cadmium contamination in soil. The enrichment capacity of Kochia scoparia was leaf > root > stem with bioconcentration factors (BCFCd) of 15.07, 5.44 and 2.96, respectively. The total cadmium in soil decreased by 6.02% to 13.60% after planting Kochia scoparia, and the activities of soil urease and acid phosphatase also increased. The results of pot cultivation shows that the above-ground cadmium content of Brassica rapa in Kochia scoparia-Brassica rapa rotation system decreased by 17.21% on average compared with the control group without rotation, whereas the biomass increased slightly, and the above-ground translocation factors (TFCd) did not change significantly. These results suggest that the rotation of Brassica rapa with Kochia scoparia could increase the yield of Brassica rapa, and effectively reduce the cadmium content in edible parts of Brassica rapa, toward the purpose of realizing the green agricultural concept of "harnessing while producing".
Keywords: cadmiumphytoremediationcrop rotationKochia scopariaBrassica rapa
面对我国蔬菜地Cd污染日趋严重的现状,在筛选并推广Cd低积累蔬菜品种的基础上,加以开展Cd高积累植物修复技术等研究,满足我国农业安全、高效和可持续发展的迫切需要[1]。植物修复技术在我国的研究虽然开展较晚,但近年来已有不少成功案例被报道,累计发现了几十种对重金属具有超富集能力的植物,并开始对其修复机制进行探究[2]。
扫帚菜,学名地肤Kochia scoparia,属于双子叶植物纲石竹目藜科地肤属,一年生草本植物,在我国分布极广,是传统山野菜之一[3-4]。由于其生物量大、根系发达、抗逆性强、自播能力强等特点,被认为是具有修复土壤重金属污染潜力的植物[5-6]。而轮作(Rotation)作为我国传统的精耕细作的种植模式之一,长期以来被用来提高土地利用率和生产效率,且通过轮作可以达到提高土壤酶活性及作物产量的效果[7-8]。据报道,土壤酶活与土壤中Cd的生物有效性密切相关,最终可能对植物吸收土壤中的Cd产生影响[9]。
本研究通过盆栽和大田试验探究了扫帚菜对土壤Cd污染的修复效果,并结合对Cd富集能力较强的芸薹属蔬菜——白菜Brassica rapa与其轮作,以土壤中Cd含量、土壤酶活性及白菜体内Cd含量的变化来评价其调控白菜吸收土壤中Cd的效果。
1 材料与方法1.1 材料与试剂供试扫帚菜种子由浙江省台州农科院提供,白菜种子购于浙江省杭州市种子站。选用试验前期筛选出的Cd相对高、低积累的小白菜和大白菜品种各两个,小白菜品种分别选用Cd相对高积累品种夏绿2号(Brassica rapa subsp. chinensis Xialv 2)和Cd相对低积累品种上海青(Brassica rapa subsp. chinensis Shanghaiqin);大白菜品种分别选用Cd相对高积累品种早熟五号(Brassica rapa subsp. pekinensis Zaoshu 5)和Cd相对低积累品种四季快菜(Brassica rapa subsp. pekinensis Sijikuaicai)。
盆栽供试土壤采自台州临海后山村(N28°52′23.38″,E121°08′11.14″)未被污染水稻土(Paddy soil),使用前铺开晾干,去石子、植物残体等杂质后,磨碎过50目筛(0.3 mm),备用。土壤理化性质见表 1,土壤颗粒组成为11.2%沙粒(0.02-2 mm),52.7%粉粒(0.002-0.02),36.1%黏粒(< 0.002 mm)。
表 1 供试土壤理化性质Table 1 Physical and chemical properties of soil used in experiment
| pH | Organic matter (g/kg) | Total nitrogen (%) | Exchangeable K (mg/kg) | Available P (mg/kg) | Total Cd (mg/kg) | |
| a | 6.32 | 14.4 | 0.09 | 120.0 | 57.2 | 0.02 |
| b | 5.74 | 28.3 | 0.12 | 204.9 | 81.2 | 0.83 |
| c | 5.57 | 26.8 | 0.11 | 175.6 | 96.4 | 0.59 |
| a: potted soil; b, c: field soils. | ||||||
表选项
盆栽试验根箱选用PE材料的加厚塑料箱,箱规格为520 cm×380 cm×270 cm,共计20只,每个根箱装入风干土壤25 kg。用CdSO4溶液进行Cd胁迫处理,分别加入等量稀释的CdSO4溶液,以渗入土壤后刚漫过土壤2 cm左右高度为准。处理后,将根箱土壤搅拌均匀,之后每隔1周彻底翻一次土,根据气候情况适当加水(土壤湿度控制在田间土壤含水量的65%左右),以确保Cd分布均匀,直至稳定至60 d。稳定后测定土壤Cd含量为2.96 mg/kg。
大田地点位于台州温岭市百亩坦村(N28°35′12.45″,E121°52′88.12″),选择了两处土壤Cd含量分别为0.83 mg/kg和0.59 mg/kg的田块(表 1中b、c)。大田试验分小区进行,每个小区面积为5.0 m×2.0 m,各种植10株扫帚菜,每个田块分别设4个小区。
1.2 试验方法1.2.1 扫帚菜与白菜栽培与轮作方式扫帚菜于2018年3月播种,直接播种于农科院大棚内,待幼苗长至15 cm左右后(大约20 d)移栽到盆栽根箱中,每盆定苗2株,共种植20盆,同时在温岭大田移栽两处,每处移栽10株,移栽过程中尽量不损伤根部,定苗后适当浇灌去离子水。待作物成熟时收获采样(120 d)。
扫帚菜收获后,采用直播方式种植白菜,每个根箱均匀播种2行白菜种子(约40颗),待幼苗长出4片真叶后进行一次间苗,小白菜每盆留6株幼苗,每行3株,大白菜每盆留4株幼苗,每行2株,对照组在未种植扫帚菜的根箱中进行,处理方法一致,所有处理均设4个重复。试验期间根据天气和作物生长情况适当浇灌去离子水、施加复合肥、喷洒农药。待作物成熟时开始收获,小白菜成熟期为30 d,大白菜成熟期为55 d。
1.2.2 土壤及植物样品采集处理土壤:待作物采集后用五点法在每个根箱中采集土壤样品并混匀,置于干燥通风处待自然风干,再压碎、去杂物、过筛,待测。
植物:扫帚菜样品分为根、茎、叶三部分,白菜样品分为地上部和地下部,根部在EDTA溶液中浸置20 min以螯合吸附在根表面的重金属,各部分采用四分法充分混匀后,置于烘箱中105 ℃杀青30 min,70 ℃烘干至恒重,用研磨机将烘干的样品研碎,待消化。
1.2.3 土壤pH值与土壤酶活性测定pH值:称取10.0 g过50目筛风干土样,放入50 mL高型烧杯,加入25 mL水,剧烈振荡5 min,静置2 h。测定时充分搅动样品溶液后将电极插入,待读数稳定后读取pH值。
脲酶活性:土壤酶活测定均用过50目筛的土壤。土壤脲酶活性用Solarbio公司的土壤脲酶(S-UE)活性检测试剂盒进行测定。测定步骤如下。
1) 样品培养。按照要求配置培养体系后,放入37 ℃水浴培养24 h,10 000×g常温离心10 min,取上清液。
2) 稀释。将上清液用蒸馏水稀释10倍,若计算得到的ΔA仍大于0.5继续稀释。
3) 标准品的准备。吸取适量的标准溶液,稀释至10、8、6、4、2、1、0.5、0 μg/mL。
4) 测氨量。于630 nm处读吸光值,计算ΔA= A测定-A对照,并根据标准管的浓度(y)和吸光度做标准曲线。
5) 脲酶活性计算。计算公式如下:
 |
酸性磷酸酶活性:土壤酸性磷酸酶用Solarbio公司的土壤酸性磷酸酶(S-ACP)活性检测试剂盒进行测定。测定前先进行粗酶液的提取,称取风干混匀土壤0.1 g,加入反应试剂后摇匀,置于37 ℃恒温培养箱催化反应24 h;反应到时后迅速加入试剂盒中配置好的试剂二溶液1 mL并充分混匀,以终止酶催化反应。7 500×g、25 ℃离心10 min,取上清液待测。测定步骤如下:1)预热可见分光光度计,蒸馏水调零;2)测定分测定管、空白管、标准管,分别按照体系加入1 mL玻璃比色皿;3)待反应体系混匀,显色后再加入830 μL蒸馏水,室温静置30 min,于660 nm处测定吸光度,分别记为A测定、A空白、A标准;4)酸性磷酸酶活性计算。计算公式如下:
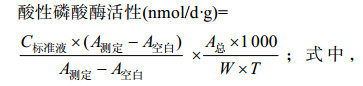 |
1.2.4 Cd含量测定植物样品中Cd含量测定参照《食品安全国家标准食品中镉的测定》 (GB 5009.15-2014)[10]石墨炉法,试样消解采用微波消解法。土壤中Cd含量测定参照《土壤质量铅、镉的测定石墨炉原子吸收分光光度法》 (GB/T 17141-1997)[11],试样消解采用微波消解法。
植物样品称取0.3 g至消化管中,加入6 mL HNO3和0.50 mL H2O2,静置2 h后,采用微波消解仪消解。土壤需称取0.2 g过200目筛风干样品至消化管中,加入4 mL HNO3和2 mL HF,静置过夜后,采用微波消解仪消解。样品消解完均需置于加热器赶酸至1 mL,加超纯水定容至10 mL,用带滤头(水系Φ13 mm×0.45 μm)的针管将消化液转移至15 mL离心管中,存储于4 ℃冰箱待测。若样品消解不彻底,可适当延长消解时间或多加适量硝酸,直至消化液澄清为止。
利用原子吸收分光光度计测定样品中总Cd的含量,同时做试剂空白,进样量为10 μL。经测定,镉的标准曲线呈良好的线性关系,r=0.998 3;样品回收率测试结果显示RSD在1.1%-3.6%之间,回收率为92.5%-104.9%之间,说明该方法精密度较高[12]。
1.2.5 数据处理数据处理与分析主要利用Excel 2016和SPSS Statistics软件,图形绘制主要由GraphPad Prism 5完成。利用单因素方差分析(LSD)比较检测数据的差异性,当P < 0.05时具有显著性差异。
2 结果与分析2.1 扫帚菜Cd吸收效率及其土壤修复效果2.1.1 扫帚菜各部位Cd含量如图 1所示,3种Cd污染条件下,扫帚菜各部位Cd含量分布极为相似,均表现为叶部 > 根部 > 茎部,且三者间差异显著,叶部与根茎部差异达到极显著水平。
 |
| 图 1 不同土壤背景下扫帚菜各部位Cd含量 Fig. 1 Cd content in different parts of Kochia scoparia under different soil background. a: Potted soil with Cd content of 2.96 mg/kg; b, c: field soils with Cd contents of 0.83 mg/kg and 0.59 mg/kg, respectively. Different lower-case letters represent significant differences (P < 0.05). |
| 图选项 |
在土壤Cd含量为2.96 mg/kg的盆栽试验中(图 1a),扫帚菜根、茎、叶的干重Cd含量分别为13.16 mg/kg、8.65 mg/kg和39.30 mg/kg;在土壤Cd含量分别为0.83 mg/kg和0.59 mg/kg。大田试验中(图 1b、c),三者干重Cd含量分别为4.36、2.22、11.62、3.91、1.95和10.37 mg/kg。总体而言,根部Cd含量是茎部的2倍左右,叶部Cd含量大约是根部的3倍,茎部的6倍。
2.1.2 扫帚菜各部位对Cd的富集能力及转运效率在不同Cd污染水平下,扫帚菜各部位对Cd的富集系数均大于1,表现为叶>根>茎(表 2),且随着Cd污染水平的降低根和叶部的富集系数呈上升趋势。叶部的转运系数是茎部的转运系数的4-6倍,表明叶部对Cd的迁移能力比茎部强。从单株总Cd来看,3种污染水平下单株扫帚菜分别能吸收6.45 mg、2.32 mg和2.01 mg的Cd,等于吸收了对应土壤中2.19 kg、2.79 kg和3.41 kg土壤中的Cd。
表 2 不同Cd污染水平下扫帚菜各部位Cd富集系数、转运系数和单株总CdTable 2 BCFCd, TFCd and total Cd per plant of Kochia scoparia under different levels of Cd pollution
| Cd content in soil (mg/kg) | Bioconcentration factors (BCFCd) | Ttranslocation factors (TFCd) | Total Cd (mg) | |||
| Root | Stem | Leaf | Stem | Leaf | ||
| 2.96 | 4.44±0.05a | 2.92±0.68a | 13.60±1.31b | 0.65±0.15a | 2.98±0.25a | 6.45±0.22a |
| 0.83 | 5.25±0.15a | 2.67±0.14a | 13.96±0.25b | 0.50±0.02a | 2.66±0.10a | 2.32±0.01b |
| 0.59 | 6.62±0.17a | 3.31±0.27a | 17.66±0.24a | 0.50±0.05a | 2.65±0.10a | 2.01±0.01b |
| Note: different lower-case letters represent significant difference between the same column of data (P < 0.05). | ||||||
表选项
2.1.3 土壤Cd含量变化如图 2所示,种植扫帚菜后3种条件下土壤Cd含量均有所下降。盆栽土壤Cd含量从2.96 mg/kg降至2.68 mg/kg,下降9.46 %;两处大田试验土壤Cd含量分别从0.83 mg/kg降至0.78 mg/kg,从0.59 mg/kg降至0.51 mg/kg,下降6.02%和13.60%。扫帚菜对大田Cd含量为0.59 mg/kg的土壤修复效率最好,其次是盆栽试验。通过对修复前后土壤Cd含量差异分析,发现盆栽试验修复前后土壤Cd含量变化显著,但大田试验中分别呈现无显著差异和极显著差异,表明在不同土壤条件下,扫帚菜对土壤Cd污染的修复效率存在差异。
 |
| 图 2 扫帚菜修复前后土壤Cd含量变化 Fig. 2 Changes of soil Cd content before and after Kochia scoparia remediation. a: Potted soil with Cd content of 2.96 mg/kg; b, c: field soils with Cd contents of 0.83 mg/kg and 0.59 mg/kg, respectively. "*", "**" and "ns" represent the significant level of P < 0.05, P < 0.01 and P≥0.05, respectively. |
| 图选项 |
2.2 扫帚菜对土壤pH值与土壤酶活性的影响2.2.1 土壤pH值如图 3所示,扫帚菜修复前后盆栽(a)土壤pH略微增加,从6.25增至6.31;两处大田(b,c)土壤pH均呈下降趋势,分别从6.53降至6.41和从5.92降至5.80。pH变化均未达显著水平,说明种植扫帚菜对土壤的pH无明显影响。
 |
| 图 3 扫帚菜修复前后土壤pH变化 Fig. 3 Changes of soil pH before and after Kochia scoparia remediation. a: Potted soil with Cd content of 2.96 mg/kg; b, c: field soils with Cd contents of 0.83 mg/kg and 0.59 mg/kg, respectively. "ns" represent the significant level of "P≥0.05" between CK and treatment group. |
| 图选项 |
2.2.2 土壤脲酶与酸性磷酸酶活性如图 4A所示,3种土壤条件下扫帚菜修复后土壤脲酶活性均有增加。其中,盆栽(a)土壤脲酶活性平均增加46.08%,大田(b,c)土壤脲酶活性平均分别增加25.60%和17.70%。盆栽土壤脲酶活性平均增加最多,但样本间差异较大,变化仍未达显著水平。只有大田(c)在扫帚菜种植前后脲酶活性表现为显著增加。
 |
| 图 4 扫帚菜修复前后土壤脲酶(A)和酸性磷酸酶(B)活性变化 Fig. 4 Changes of soil urease (A), acid phosphatase (B) activities before and after Kochia scoparia remediation. a: Potted soil with Cd content of 2.96 mg/kg; b, c: field soils with Cd contents of 0.83 mg/kg and 0.59 mg/kg, respectively. "*" and "ns" represent the significant level of P < 0.05 and P≥0.05 between CK and treatment group, respectively. |
| 图选项 |
如图 4B所示,3种土壤条件下扫帚菜修复后土壤酸性磷酸酶活性变化与土壤脲酶活性相似,均表现为修复后大于修复前。其中,盆栽(a)土壤酸性磷酸酶活性平均增加44.86%,大田(b,c)土壤酸性磷酸酶活性平均分别增加21.76%和27.03%。盆栽土壤酸性磷酸酶活性平均增加最多,大田(c)其次,两者变化量均达到显著水平。大田(b)酸性磷酸酶活性平均增加最少,且变化仍未达显著水平。
通过对两种土壤酶活性变化分析可知,种植扫帚菜能影响土壤中土壤脲酶和酸性磷酸酶活性变化,主要表现为促进作用,但在不同土壤条件下变化程度存在一定差异。
2.3 轮作模式下白菜Cd吸收积累、转运效率及生物量变化2.3.1 白菜体内Cd含量如图 5A所示,轮作组(LZ)与对照组(CK)相比,LZ组上海青地上部干重Cd含量(13.75 mg/kg)略微低于CK组(14.15 mg/kg),相比CK组下降2.82%,未达到显著水平。另外3种白菜LZ组地上部干重Cd含量与CK组对比均显著下降,其中夏绿2号从41.22 mg/kg下降至35.86 mg/kg,下降13.00%;四季快菜从26.27 mg/kg下降至21.70 mg/kg,下降17.40%;早熟五号从35.56 mg/kg下降至22.90 mg/kg,下降35.60%。
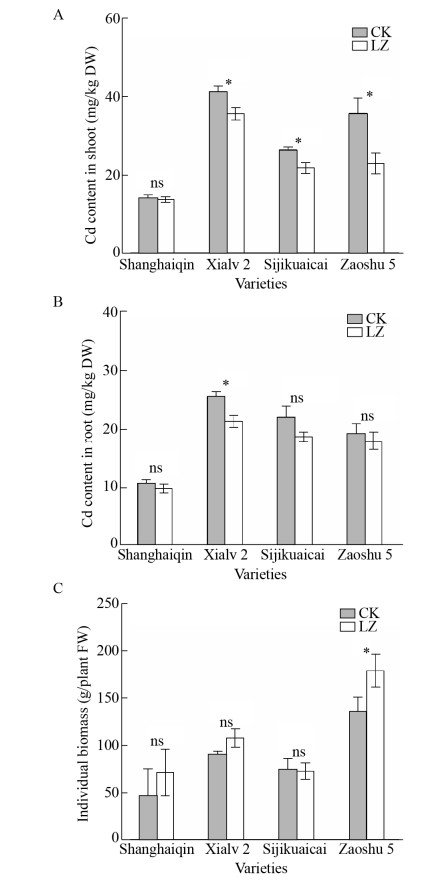 |
| 图 5 轮作对四种白菜地上Cd含量(A)、地下部Cd含量(B)及单株生物量(C)的影响 Fig. 5 Effects of rotation on Cd content in shoot (A), root (B) and biomass (C) of four Chinese cabbages. "*" and "ns" represent the significant level of P < 0.05 and P≥0.05 between CK and LZ treatment (rotation) group, respectively. |
| 图选项 |
如图 5B所示,轮作组(LZ)与对照组(CK)相比,4种白菜中只有夏绿2号地下部干重Cd含量显著下降,从25.46 mg/kg降至21.27 mg/kg,下降16.46%。其余3种地下部干重Cd含量有下降趋势,但未达到显著水平。说明轮作对白菜地下部Cd含量的影响比地上部小。
相比于扫帚菜对盆栽土壤的修复效果(土壤总Cd含量下降9.46%),LZ组上海青地上部Cd含量下降率反而低于扫帚菜对土壤的修复率,表明轮作并未降低上海青对土壤中Cd的吸收。反之,另外3种白菜地上部Cd含量下降率高于扫帚菜的修复率,表明这3种白菜地上部Cd含量降低不仅是由修复后土壤总Cd下降这一单一原因引起的。
2.3.2 白菜生物量如图 5C所示,轮作组(LZ)与对照组(CK)相比,上海青、夏绿2号和早熟五号单株生物量分别从92.67 g、90.01 g、135.12 g增至99.98 g、107.50 g、178.75 g,分别增加2.52%、19.44%和32.41%,仅有早熟五号的增加量达到显著水平。四季快菜的单株生物量无明显变化。
2.3.3 白菜各部位Cd富集能力及转运效率轮作组(LZ)与对照组(CK) 4种白菜地上、地下部对Cd的富集系数,地上部转运系数及单株总Cd见表 3。轮作后,与CK对照组相比,夏绿2号地上、地下部富集系数均显著下降;四季快菜与早熟五号地上部富集系数显著下降,地下部富集系数无显著变化;上海青的地上、地下部富集系数均无显著变化。
表 3 轮作后白菜各部位Cd富集系数、转运系数和单株总CdTable 3 BCFCd, TFCd and total Cd per plant in various parts of Chinese cabbage after rotation
| Varieties | Treatment | Bioconcentration factors (BCFCd) | Translocation factors (TFCd) | Total Cd (μg) | |
| Shoot | Root | Shoot | |||
| Shanghaiqin | CK | 4.78±0.49 | 3.58±0.46 | 1.35±0.20 | 60.86 |
| LZ | 4.65±0.44 | 3.30±0.47 | 1.44±0.30 | 75.76 | |
| Xialv 2 | CK | 13.93±0.87 | 8.60±0.60 | 1.63±0.15 | 174.38 |
| LZ | 12.11±1.02* | 7.19±0.60* | 1.69±0.01 | 181.18 | |
| Sijikuaicai | CK | 8.87±0.57 | 7.44±1.22 | 1.23±0.28 | 76.13 |
| LZ | 7.33±0.92* | 6.31±0.52 | 1.16±0.09 | 61.84 | |
| Zaoshuwuhao | CK | 12.01±2.26 | 6.47±1.01 | 1.86±0.22 | 90.24 |
| LZ | 7.74±1.78* | 6.06±1.02 | 1.30±0.35 | 110.52 | |
| Note: * represents the significant level between CK and LZ treatment (rotation) group at P < 0.05. | |||||
表选项
四种白菜地上部对Cd的转运系数在1.16-1.86之间,所有LZ组与CK组间均无显著差异。轮作后,与CK对照组相比,2种大白菜四季快菜和早熟五号地上部转运系数有所下降,而2种小白菜上海青和夏绿2号地上部转运系数有增加的趋势。表明轮作可能降低Cd从大白菜地下部向地上部的转运能力,但对小白菜体内Cd向地上部转运的作用与之相反。
从单株总Cd来看,与CK对照组相比,除四季快菜外其他3种白菜单株总Cd在轮作模式下均有所增加。结合轮作对4种白菜各部位Cd含量及生物量的影响,可以分析发现单株总Cd的增加是由生物量增加引起的。生物量未发生明显变化的四季快菜,地上、地下部Cd含量均呈现下降趋势,从而引起其单株总Cd降低。
3 讨论由于我国人口众多,相对可利用的土壤资源较少,利用植物轮作修复成为了经济、环保、高效的新途径之一[13]。本试验对Cd高积累植物——扫帚菜对土壤的修复效果进行探讨,并开展扫帚菜与白菜轮作试验研究其轮作模式对白菜吸收土壤中Cd的影响。扫帚菜对土壤中Cd的积累能力表现为叶部最强,根部其次,茎部最低,与较多已被发现的重金属超积累植物相似,地上部都具备超强的富集能力[14-16]。从扫帚菜对土壤Cd污染的修复效果来看,经过一轮扫帚菜的种植后土壤Cd含量在盆栽试验中下降了9.46%,两块大田试验分别下降了6.02%和13.6%,分别从土壤中吸附了6.45 mg、2.32 mg和2.01 mg的Cd。虽然不同土壤条件下扫帚菜对土壤修复的效果差异较大,但根围土壤Cd含量都具有一定程度降低,且Zhao等[17]研究认为扫帚菜还能对Pb、Cr污染土壤进行修复。张然然等[18]也通过调查发现扫帚菜是一种较有效的土壤重金属复合污染修复植物,综合富集系数达到3.65,但修复能力低于蓖麻、荆芥Nepeta cataria、滨蒿Artemisia scoparia等植物。
种植扫帚菜后其根系周围土壤pH变化较小,趋势不明显,但土壤脲酶及土壤酸性酶活性均呈增加趋势,部分土壤条件下该变化达到显著水平。土壤脲酶和酸性磷酸酶都是土壤中的重要酶类,土壤脲酶可通过水解尿素产出氨和碳酸,其中的氨在有氧条件下会经细菌转化最终氧化成硝酸,其活性高低能反映土壤氮素状况[19]。而土壤酸性磷酸酶的功能是催化水解磷酸单酯以及释放无机磷酸,为植物提供可吸收形态的磷,也是土壤磷素状况的重要指标[20]。有报道指出土壤脲酶与酸性磷酸酶具有降低Cd等重金属毒害植物的功能[21]。部分Cd高积累耐受作物在Cd胁迫的情况下根围脲酶和酸性磷酸酶活性会明显增加,以恢复由Cd引起的对两者活性的抑制作用[22]。扫帚菜对土壤中Cd的吸收富集能力大于一般植物且在污染较严重的矿区也能正常生长也可能是由土壤酶活性的恢复引起的[23-24]。
通过种植扫帚菜不仅降低了土壤中的总Cd含量,而且恢复的土壤酶活性能降低土壤中的Cd对白菜的毒害作用,对继续轮作的白菜起到一定保护作用[13, 25]。本试验中,4种白菜轮作种植后地上、地下部分Cd含量与未种植过扫帚菜的对照组相比均有不同程度的下降,说明白菜与扫帚菜的轮作模式能有效降低白菜体内Cd的吸收积累。白菜的生物量大部分与对照组相比未有明显差异,但都有所增加,表明轮作不影响白菜正常的生长发育甚至可能对其生长有一定促进作用,Jetton等[26]的研究也得出了相似结论。但本研究同时也发现轮作模式并不会影响白菜体内对Cd的转运,这可能是由于植物对重金属的转运是由遗传性原因决定的。安婧等[27]通过研究发现超积累植物体内具有对重金属耐受的基因,且对重金属有极强的转运能力,并可通过基因工程手段利用超积累植物优良性状实现土壤修复效果[28]。通常这类作物的根系分泌物在根细胞质膜上的专一性金属还原酶的作用下,还能还原土壤中的高价重金属离子,从而使其溶解性增加,促进作物吸收[29]。本试验中的扫帚菜也是一种对Cd具有高耐性的植物,本研究也发现利用其轮作可以有效降低其他植物对土壤中Cd的积累,但目前关于其对Cd的耐性机制的研究甚少,还有待深入研究与探索。
总体来说,扫帚菜可以达到土壤Cd污染修复的效果,且能恢复土壤中脲酶与酸性磷酸酶活性,利用其与白菜轮作能降低白菜体内Cd含量,增加其生物量。但由于扫帚菜的生物量较大,整个生长周期较长,只能与作物轮作,在修复土壤的同时也降低了土壤的利用效率[6, 30],因此需要利用土壤活化剂提高其短期内对土壤的修复效果或利用基因工程技术改良其性状以满足“边生产,边修复”的绿色农业理念。
参考文献
| [1] | Xiao WD, Ye XZ, Zhang Q, et al. Evaluation of cadmium transfer from soil to leafy vegetables: Influencing factors, transfer models, and indication of soil threshold contents. Ecotox Environ Safe, 2018, 164: 355-362. |
| [2] | Kr?mer U. Metal hyperaccumulation in plants. Annu Rev Plant Biol, 2010, 61(2): 517-534. |
| [3] | Weiner J, Wright DB, Castro S. Symmetry of below-ground competition between Kochia scoparia individuals. Oikos, 1997, 79(1): 85-91. |
| [4] | Zand AD, Hoveidi H. Evaluation of the potential of burningbush (Kochia scoparia (L.) Schard) and maize (Zea mays L.) and the role of soil organic amendment in phytoremediation of gasoline- contaminated soils. Int J Environ Res, 2018, 12(1/3): 327-336. |
| [5] | Hao GX, Guo WC, Wang FR, et al. The physicochemical properties of reclaiming matrices and effects on growth of Kochia scoparia. J Anhui Agri Sci, 2016, 44(19): 137-140 (in Chinese). 郝桂喜, 郭文昌, 王芙蓉, 等. 复垦基质的理化性质及其对地肤生长的影响. 安徽农业科学, 2016, 44(19): 137-140. |
| [6] | Chen BH, Guo WL, Wang GY, et al. Research of remediation effect of Kochia scoparia on heavy metal contaminated vegetable field soil in plastic shed. Northern Hortic, 2016(7): 170-174 (in Chinese). 陈碧华, 郭卫丽, 王广印, 等. 地肤对大棚菜田土壤重金属的修复效应研究. 北方园艺, 2016(7): 170-174. |
| [7] | Shentu JL, He ZL, Yang XE, et al. Accumulation properties of cadmium in a selected vegetable- rotation system of southeastern China. J Agric Food Chem, 2008, 56(15): 6382-6388. |
| [8] | Xue B, Yin ZY, Xiao Q, et al. Effects of long-term straw returning on soil fertility under rice rape rotation system. Chin Agric Sci Bull, 2017, 33(7): 134-141 (in Chinese). 薛斌, 殷志遥, 肖琼, 等. 稻-油轮作条件下长期秸秆还田对土壤肥力的影响. 中国农学通报, 2017, 33(7): 134-141. |
| [9] | Xin J, Zhao XH, Tan QL, et al. The effects of cadmium exposure on cadmium fractionation and enzyme activities in the rhizosphere of two radish cultivars (Raphanus sativus L.). Bull Environ Contam Tox, 2017, 98(2): 290-295. |
| [10] | GB 5009.15-2014. National food safety standard- Determination of cadmium in foods (in Chinese). GB 5009.15-2014. 食品安全国家标准食品中镉的测定. |
| [11] | GB/T 17141-1997. Soil quality-Determination of lead, cadmium-Graphite furnace atomic absorption spectrophotometry (in Chinese). GB/T 17141-1997. 土壤质量铅、镉的测定石墨炉原子吸收分光光度法. |
| [12] | Njaka NA, Elise OR, Herinirina NR, et al. Dealing with outlier in linear calibration curves: A case study of graphite furnace atomic absorption spectrometry. World J Appl Chem, 2018, 3(1): 10-16. |
| [13] | Shahid M, Arshad M, Kaemmerer M, et al. Long-term field metal extraction by Pelargonium: phytoextraction efficiency in relation to plant maturity. Int J Phytoremediat, 2012, 14(5): 493-505. |
| [14] | Stolpe C, Kr?mer U, Müller C. Heavy metal (hyper) accumulation in leaves of Arabidopsis halleri is accompanied by a reduced performance of herbivores and shifts in leaf glucosinolate and element concentrations. Environ Exp Bot, 2017, 133: 78-86. |
| [15] | Liang SX, Ning G, Li ZC, et al. Investigation of correlativity between heavy metals concentration in indigenous plants and combined pollution soils. Chem Ecol, 2016, 32(9): 1-12. |
| [16] | Hao GX, Guo WC, Wang FR. The physicochemical properties of reclaiming matrices and effects on growth of Kochia scoparia. J Anhui Agri Sci, 2016, 44(19): 137-140 (in Chinese). 郝桂喜, 郭文昌, 王芙蓉. 复垦基质的理化性质及其对地肤生长的影响. 安徽农业科学, 2016, 44(19): 137-140. |
| [17] | Zhao SL, Shang XJ, Duo LA. Effects of ethylenediaminetetraacetic acid and ammonium sulfate on Pb and Cr distribution in Kochia scoparia from compost. Int J Environ Sci Technol, 2015, 12(2): 563-570. |
| [18] | Zhang RR, Luo PL, Liu YH, et al. Determination of heavy metal enrichment capacity of dominant herb plants in Tonglvshan Mine. Chem Bioeng, 2016, 33(11): 63-70 (in Chinese). 张然然, 罗鹏林, 刘远河, 等. 大冶铜绿山矿区优势草本植物重金属富集能力测定. 化学与生物工程, 2016, 33(11): 63-70. |
| [19] | Li ZP, Wu FZ, Yang WQ, et al. Soil invertase and urease activities at different periods in subalpine forest gap in western Sichuan. Acta Ecol Sin, 2015, 35(12): 3919-3925 (in Chinese). 李志萍, 吴福忠, 杨万勤, 等. 川西亚高山森林林窗不同时期土壤转化酶和脲酶活性的特征. 生态学报, 2015, 35(12): 3919-3925. |
| [20] | Wang J, Evangelou BP, Nielsen MT, et al. Computer, simulated evaluation of possible mechanisms for sequestering metal ion activity in plant vacuoles: Ⅱ. Zinc. Plant Physiol, 1992, 99(2): 621-626. |
| [21] | Wang SQ, Wei SH, Ji DD, et al. Co-planting Cd contaminated field using hyperaccumulator Solanum nigrum L. through interplant with low accumulation Welsh Onion. Int J Phytoremediat, 2015, 17(9): 879-884. |
| [22] | Zhang J, Yang SY, Yang HF, et al. Comparative study on effects of four energy plants growth on chemical fractions of heavy metals and activity of soil enzymes in copper mine tailings. Int J Phytoremediat, 2018, 20(6): 616-623. |
| [23] | Wang YP, Shi JY, Wang H, et al. The influence of soil heavy metals pollution on soil microbial biomass, enzyme activity, and community composition near a copper smelter. Ecotoxicol Environ Safe, 2007, 67(1): 75-81. |
| [24] | An LY. The effect and mechanism of crop intercropping on heavy metal absorption[D]. Hangzhou: Zhejiang University, 2012 (in Chinese). 安玲瑶.作物间作对重金属吸收的影响及其机制的研究[D].杭州: 浙江大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10335-1012338295.htm |
| [25] | Klose S, Tabatabai MA. Urease activity of microbial biomass in soils as affected by cropping systems. Biol Fert Soils, 2000, 31(3/4): 191-199. |
| [26] | Jetton RM, Robison DJ. Effects of artificial defoliation on growth and biomass accumulation in short-rotation sweetgum (Liquidambar styraciflua) in North Carolina. J Insect Sci, 2014, 14: 107. |
| [27] | An J, Gong XS, Wei SH. Research progress on technologies of phytoremediation of heavy metal contaminated soils. Chin J Ecol, 2015, 34(11): 3261-3270 (in Chinese). 安婧, 宫晓双, 魏树和. 重金属污染土壤超积累植物修复关键技术的发展. 生态学杂志, 2015, 34(11): 3261-3270. |
| [28] | Prakash A, Singh BK, Bhojak N, et al. Synthesis and characterization of bioactive zinc(Ⅱ) and cadmium(Ⅱ) complexes with new Schiff bases derived from 4-nitrobenzaldehyde and acetophenone with ethylenediamine. Spectrochim Acta A, 2010, 76(3/4): 356-362. |
| [29] | Xu WH, Huang H, Wang AH, et al. Advance in studies on activation of heavy metal by root exudates and mechanism. Ecol Environ, 2006, 15(1): 184-189 (in Chinese). 徐卫红, 黄河, 王爱华, 等. 根系分泌物对土壤重金属活化及其机理研究进展. 生态环境学报, 2006, 15(1): 184-189. |
| [30] | Krzciuk K, Ga?uszka A. Prospecting for hyperaccumulators of trace elements: a review. Crit Rev Biotechnol, 2015, 35(4): 522-528. |
