
 , 崔继哲
, 崔继哲

哈尔滨师范大学 生命科学与技术学院,黑龙江 哈尔滨 150025
收稿日期:2020-06-25;接收日期:2020-10-28
基金项目:哈尔滨市科技创新人才项目(No. 2016RAXXJ083)资助
作者简介:卢倩 ??理学博士,哈尔滨师范大学生命科学与技术学院讲师。主要从事固体废物堆肥资源化与多环芳烃污染土壤修复及其机制研究。针对生活垃圾、农业废物等资源化技术问题,重点开展堆肥资源化过程中有机物质转化机理、微生物群落共生机理等相关研究;针对土壤多环芳烃污染问题,重点开展堆肥过程及腐熟肥料对土壤多环芳烃的降解作用、功能微生物的识别及其降解机制研究;
崔继哲 ??理学博士,哈尔滨师范大学生命科学与技术学院教授。中国生物化学与分子生物学会教学专业委员会委员,黑龙江省生物化学与分子生物学会副理事长。曾在日本大阪大学、加拿大阿尔伯塔大学访问研究。近年来主要从事植物抗逆基因挖掘和非生物胁迫下植物固有无序蛋白质的功能分析、多环芳烃污染土壤的菌植联合修复体系构建及其作用机制研究.
摘要:探究睾丸酮丛毛单胞菌(Comamonas testosteroni,C.t)联合羊草修复多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)污染土壤过程中,羊草根际土PAHs降解及根际微生物的变化。用气相色谱-质谱法(GC-MS)检测C.t联合羊草时根际PAHs的降解,通过高通量测序技术测定羊草根际土壤细菌群落及多样性,采用冗余分析及网络分析评价PAHs降解与细菌群落组分之间的相关性,用PICRUSt软件预测PAHs降解潜力。结果表明,C.t的接入在修复后期(60–120 d)促进PAHs降解,使羊草根际细菌丰富度、多样性以及细菌与PAHs的相关性发生改变,并且提高了羊草根际PAHs的降解潜力。C.t主要通过影响变形菌门属水平中鞘氨醇单胞菌(Sphingomonas)、MND1和Nordella,放线菌门属水平上红色杆菌(Rubrobacter)和Gaiella,酸杆菌门属水平中RB41以及拟杆菌门中黄杆菌(Flavobacterium),从而加快羊草根际土中萘(Nap)、菲(Phe)、苯并芘(BaP) 3种PAHs的降解。研究以期为C.t联合植物降解土壤PAHs污染提供理论依据,为微生物联合植物修复土壤PAHs提供新的微生物选择。
关键词:睾丸酮丛毛单胞菌羊草多环芳烃细菌群落结构根际土壤
Effects of Comamonas testosteroni on PAHs degradation and bacterial community structure in Leymus chinensis rhizosphere soil
Qiao Wang, Rui Zheng, Xueting Sun, Ziwei Jiang, Fanghui Yang, Qian Lu

 , Jizhe Cui
, Jizhe Cui

College of Life Science and Technology, Harbin Normal University, Harbin 150025, Heilongjiang, China
Received: June 25, 2020; Accepted: October 28, 2020
Supported by: Special Fund Project for Harbin Science and Technology Innovation Talents (No. 2016RAXXJ083)
Corresponding author: Qian Lu. Tel: +86-451-88060576; E-mail: lq87618@163.com;
Jizhe Cui. Tel: +86-451-88060576; E-mail: cuijz@hrbnu.edu.cn.
Abstract: To investigate the degradation of polycyclic aromatic hydrocarbons (PAHs) and the changes of rhizosphere microorganisms in the rhizosphere soil of Leymus chinensis during the remediation of PAHs contaminated soil by Comamonas testosteroni (C.t)-assisted Leymus chinensis, we evaluated the removal of PAHs in the rhizosphere of Leymus chinensis using gas chromatography-mass spectrometry (GC-MS), analyzed the bacterial community and the diversity in Leymus chinensis rhizosphere soil by high-throughput sequencing technology, characterized the correlation among PAHs degradation and bacterial community components performing redundancy analysis (RDA) and network analysis, and predicted PAHs degradation potential via PICRUSt software in this paper.The degradation of PAHs in the rhizosphere of Leymus chinensis was promoted, the abundance and diversity of bacteria and the correlation among bacteria and PAHs were changed, and the degradation potential of PAHs in Leymus chinensis rhizosphere soil was enhanced in the later stage of phytoremediation (60-120 d) due to the incorporation of C.t. The accelerated degradation of three PAHs (Nap, Phe, BaP) was accompanied by the differ abundance and correlation of Proteobacteria (Sphingomonas, MND1, Nordella), Actinomycetes (Rubrobacter, Gaiella), Acidobacteria (RB41) and Bacteroides (Flavobacterium) affected by C.t.The results provide new insight into the microorganism choices for microbial assisted plant remediation of soil PAHs and the mechanisms of enhanced PAHs degradation via the combination of Comamonas testosteroni engineering bacteria and plants.
Keywords: Comamonas testosteroniLeymus chinensispolycyclic aromatic hydrocarbonsbacterial community structurerhizosphere soil
多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)是一类具有两个或多个苯环结构化合物的总称,因其“三致”特性,严重危害人类及生态系统的安全,并且因其溶解度低、难降解、易吸附于固体颗粒等特点,而被归类为持久性有机污染物[1],我国已将其列为优先控制的污染物之一[2]。由于近年来人们对能源物质的大量使用,导致土壤中PAHs的污染日趋严重[3]。尤其是我国东北地区土壤中PAHs的含量高达1 467 μg/kg,已达到严重污染程度[3-5],因此土壤中PAHs的修复极为必要。
生物修复是如今修复PAHs污染土壤的重要手段。微生物降解是去除环境中PAHs的主要途径,目前从不同环境中已分离鉴定了许多属于不同菌属的PAHs降解菌,但不同微生物对不同PAHs的降解能力存在着很大差别[6]。丛毛单胞菌属Comamonas对一些难以被降解的多环芳烃、杂环芳烃以及取代芳烃等污染物都有较好的降解效果,是现在发现的PAHs降解菌种类最多、降解范围最广的菌属[7-10]。在我们前期的研究中,发现睾丸酮丛毛单胞菌(Comamonas testosteroni,C.t)具有高效降解萘和菲的能力,显著降低菲对拟南芥毒害的作用,说明其具有用于实际环境修复污染的能力[11],但目前尚未发现用C.t联合植物修复PAHs污染土壤的研究。
植物修复是一种生态友好型的原位修复技术[12-13]。但在PAHs污染土壤修复时选用的修复植物较为单一[14]。羊草Leymus chinensis为禾本科赖草属多年生优质牧草,主要分布于我国内蒙古自治区、东北三省、河北省等地,是欧亚大陆草原区东部草甸草原及干旱草原上的重要建群种。研究表明羊草能在含有PAHs环境中生长并对PAHs具有吸附作用,然而对于羊草降解土壤PAHs的机制研究较少[15-17]。由于土壤中PAHs的低生物有效性和缺乏PAHs降解菌等因素的限制,单纯的植物修复对PAHs污染土壤的修复效率难以一步到位[18-19]。在植物修复的同时,向土壤中接种PAHs专性降解菌可有效提高植物修复效率[20-24]。
根际是植物与土壤微生物相互作用的区域,也是植物修复时土壤中PAHs降解最迅速的区域,植物修复PAHs污染主要通过根际微生物发挥作用[12, 25]。因此,本研究选择我国东北地区草原的优势建群种植物羊草为PAHs修复植物,以C.t为降解微生物,通过高通量测序技术,探究C.t对羊草根际细菌群落结构及多样性的影响,同时使用气相色谱-质谱法(GC-MS)测量羊草根际PAHs的降解情况,以分析C.t与羊草联合降解PAHs的可行性,并通过PAHs的降解与土壤中细菌群落组成的变化,确定PAHs降解的相关微生物,使用PICRUSt推测C.t联合羊草的PAHs降解潜力,以期为C.t联合植物降解土壤PAHs污染提供理论依据,并且为微生物联合植物修复土壤PAHs提供新的微生物选择。
1 材料与方法1.1 PAHs污染土壤的制备试验所用土壤取自哈尔滨师范大学试验田,为黑钙土。土壤基础理化性质为pH值6.9、铵态氮38.25 mg/kg、速效磷14.82 mg/kg、速效钾141.19 mg/kg、有机质14.21 mg/kg。土壤样品用4 mm筛网过筛后风干。将萘(Nap)、菲(Phe)、苯并芘(BaP)分别溶解于丙酮,与一定量风干的土壤混合,待丙酮完全挥发后,将其均匀混拌入剩余土壤样品中。土壤中PAHs的含量分别是Nap为4 800 μg/kg、Phe为1 600 μg/kg、BaP为700 μg/kg,3种PAHs总量为7.1 mg/kg。以上所用有机试剂均为色谱纯。
1.2 实验用羊草和菌种羊草种子由黑龙江省农业科学院提供。将羊草种子用3% H2O2溶液表面消毒20 min,纯水清洗干净后浸种16 h,供播种用。
睾丸酮丛毛单胞菌(C.t)由中山大学任政华教授提供。将C.t在固体LB培养基上活化(28 ℃培养12 h)后,取单菌落于液体LB培养基中28 ℃、180 r/min恒温摇床中培养,待A600为0.5时将菌液在4 000 r/min离心10 min得到沉降菌体。将菌体重悬制成菌悬液,用平板菌落计数法测定菌液浓度。
1.3 实验设计与处理实验设立播种羊草不接菌(P)和播种羊草接菌(MP) 2个处理组,每个处理均设置3次生物学重复,进行盆栽,每盆中装入PAHs污染土4.5 kg。MP组土壤中C.t的接菌量为1.09×106 CFU/g,土壤接菌后放置6 h进行微生物平衡,平衡后播种羊草。浸种后的羊草种子均匀播种于各花盆中,每盆定苗140株。所有处理置于塑料棚中,试验期间土壤水分保持在田间持水量的60%左右。播种当日留取土样(记为P0d、MP0d),并分别于播种60 d、120 d采集处理组羊草的根际土壤。根际土壤的采集参照Lu等[26]的方法进行,具体步骤如下:将羊草从盆中取出,剔除根部大块土壤,随后将羊草根部附近的土壤轻轻敲碎,缓慢抖动羊草,去除根部松散附着的土壤。然后将紧密附着于羊草根部的土壤取下,收集于无菌袋中即为根际土。将采集的土样分别标记为P60d、MP60d、P120d和MP120d。土样过2 mm筛后,液氮速冻保存于?80 ℃低温冰箱中备用。
1.4 土壤PAHs的含量测定土壤中Nap、Phe、BaP的含量采用GC-MS测定。取经冷冻干燥处理的土样各10 g,用快速溶剂萃取法(ASE)提取PAHs。使用正己烷︰二氯甲烷(1︰1,V/V)混合溶剂,经2次静态萃取循环(5 min),萃取温度100 ℃,压力10.34 MPa,获得提取液。提取液经旋转蒸发浓缩至1 mL,用硫酸镁硅胶柱对浓缩液进行净化,通过氮气除去剩余溶剂,将纯化后的待测液定容至1 mL后,使用GC-MS检测待测液中Nap、Phe和BaP浓度,GC-MS仪器参数参照Li等[27]实验方法。采用外标法对Nap、Phe和BaP进行回收率测定,其回收率分别为61.2%、64.9%和60.6%。
各处理中土壤PAHs的降解率按下列公式[12]计算。
 |
1.5 PCR扩增及高通量测序首先将同一处理组中3次生物学重复的土壤样品进行充分混合,之后使用Qubit? dsDNA HS Assay Kit试剂盒,对混合土壤样品的DNA进行提取并检测其浓度。以20 ng DNA为模板,使用细菌通用引物341F (5′-CCTACGGRRBGCASCA GKVRVGAAT-3′)和806R (5′-GGACTACNVGG GTWTCTAATCC-3′),对16S rRNA基因的V3–V4可变区进行PCR扩增。另外,通过PCR向16S rRNA基因的PCR产物末端加上带有Index的接头,以便进行NGS测序。PCR反应体系(25 μL):TransStart Buffer 2.5 μL;dNTPs 2 μL;Primer1 1μL;Primer2 1 μL;DNA模板20 ng;ddH2O补充总体系至25 μL。反应程序为:94 ℃预变性3 min;94 ℃ 5 s,57 ℃ 90 s,72 ℃ 10 s,共进行24个循环,72 ℃终延伸5 min。PCR结束后,用1.5%琼脂糖凝胶对PCR产物进行电泳检测。
使用酶标仪对PCR产物所构建的文库进行浓度检测,将文库定量到10 nmol/L,用Illumina MiSeq (Illumina,San Diego,CA,USA)仪器进行PE250/PE300双端测序,用MiSeq Control Software (MCS)读取序列信息。测序由苏州金唯智生物科技有限公司进行。
1.6 数据统计分析将双端测序的数据进行两两拼接,保留长度大于200 bp的序列。经过质量过滤及去除嵌合体等处理,得到高质量序列用于操作分类单元(Operational taxonomic unit,OTU)聚类。使用VSEARCH (1.9.6)进行序列聚类,以97%的一致性将序列聚类为OTUs,采用RDP classifier算法对OTU的代表性序列进行物种分类学分析,得到不同物种分类水平下每个样本的群落组成。利用QIIME (1.9.1)软件进行样品α多样性和β多样性分析。计算α多样性中ACE、Chao1、香农指数、辛普森指数等物种多样性指数。β多样性选择利用加权遗传距离矩阵计算,并进行主成分分析。使用PICRUSt进行KEGG微生物基因功能预测分析。
利用Microsoft Excel 2013、Origin 2018将数据进行可视化展示,Cytoscape 3.6.1绘制PAHs与细菌群落变化之间网络分析,TB tools绘制细菌属水平热图,用Canoco 5.0展示PAHs与细菌群落变化相关性冗余分析(RDA),用SPSS 25.0进行相关数据处理与统计分析。
2 结果与分析2.1 C.t对羊草根际土中PAHs降解的影响经过为期120 d的修复,播种羊草组(P组)和播种羊草并接菌组(MP组)土壤中PAHs的含量及其降解率变化如图 1所示。初始土壤中测出3种PAHs (Nap、Phe、BaP)的总量为6 700 μg/kg。修复60 d时,P组和MP组土壤中3种PAHs的总量显著减少,两个处理组对PAHs的降解效率均达50%以上(图 1A)。P组Nap、Phe和BaP的降解率分别为56.2%、42.4%和61.3%,而MP组为54.8%、38.9%和56.3%,P组的3种PAHs降解率均高于MP组,其中两个处理组间Phe和BaP的降解率存在显著差异(P < 0.05) (图 1B)。修复后期(60–120 d),P组和MP组对PAHs的降解幅度明显减弱,降解120 d时,P组Nap、Phe和BaP的降解率分别为56.9%、76.0%和58.9%,MP组为60.1%、79.2%和62.6%,MP组的3种PAHs的降解率均显著高于P组(P < 0.05),并且两个处理组中3种PAHs的降解率均呈Phe > BaP > Nap。
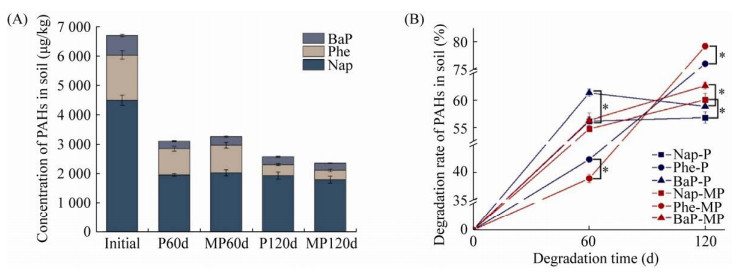 |
| 图 1 土壤中PAHs的含量变化(A)及3种PAHs降解率(B) Fig. 1 Changes of PAHs content (A) and degradation rate of three PAHs (B) in soil. Fig. A, Changes in the content of total PAHs in the soil under two treatments at different times, Fig. B, the degradation rates (B) of the three PAHs (Nap, Phe, BaP) under two treatments at different times, the color of the broken line represents different processing, blue represents P treatment, and red represents MP treatment. The different shapes in the figure represent three different PAHs, square for Nap, circle for Phe, and triangle for BaP. The results were expressed as the x±s (bars) of three independent exposures. "*" means that there are significant differences in the degradation rate of the three PAHs between the two treatments (P < 0.05). |
| 图选项 |
在0–120 d的降解过程中,两个处理组内Phe的降解率均随修复时间的增加而升高,在降解后期(60–120 d) MP组中Phe降解率的升高幅度大于P组,这可能导致了修复结束时Phe的降解率MP组高于P组,进而可看出C.t的接入在降解后期提高了Phe的降解率。而Nap和BaP的降解率变化趋势在P组与MP组间存在差异,Nap和BaP的降解率在MP组中随时间的增加而升高,P组中前期(0–60 d)此两种PAHs的降解率变化趋势与MP组相同,但后期(60–120 d)此两种PAHs的降解率均未升高。这可能导致了在修复结束时P组土壤中3种PAHs的含量高于MP组。以上结果表明,经过120 d的修复,C.t的接入促进了羊草根际对3种PAHs的降解,其表现为降解后期C.t小幅提升Nap与BaP的降解,而显著提升Phe的降解效率(P < 0.05),因此降解结束时MP组土壤中PAHs的含量低于P组。
2.2 根际土壤中细菌多样性及群落结构分析2.2.1 根际土壤细菌测序结果分析为研究C.t的接入对羊草根际土壤中细菌群落结构的影响,对两个处理组不同时间的土壤中细菌16S rRNA基因进行了高通量测序。经测序各处理土样分别得到76 218–107 372条原始序列,经优化后各土样分别得到63 984–78 940条优化序列,每条序列的平均长度为450.89 bp,最后剔除线粒体及叶绿体序列,按照最低样本的序列数进行抽平,抽平后每个样本的序列数为53 363。以有效序列数和OTU数目为横纵坐标,构建样品稀释曲线(图 2A),其变化趋势为先快速上升后趋于平缓,并且测序的覆盖率均大于92% (表 1),说明本实验测序深度合理,所得数据已覆盖样品中的绝大多数的物种,该测序量可代表样品中的微生物的真实情况。基于相似度大于97%的原则,将优化后的序列进行OTU聚类,两个处理共得到17 634个OTU (图 2B),其中P组独有OTU的个数为2 361个,MP组独有的OTU个数为2 407个,两个处理共有的OTU有6 433个。
 |
| 图 2 不同处理不同时间点土壤样品稀释曲线(A)和不同处理基于OTU的韦恩图(B) Fig. 2 Different treatments at different time points of soil sample dilution curve (A) and different treatments based on OTUs Veen diagram (B). Different colors in b figure represent different treatment groups, yellow is P treatment, blue is MP treatment. |
| 图选项 |
表 1 不同修复时间下C.t对羊草根际土壤微生物α多样性指数的影响Table 1 The effect of C.t on the microbial α diversity index of rhizosphere soil of Leymus chinensis under different repair time
| Sample | Ace | Chao1 | Shannon | Simpon | Coverage (%) |
| P0d | 13 807 | 13 486 | 9.513 | 0.986 | 92.6 |
| MP0d | 13 755 | 13 285 | 9.061 | 0.980 | 92.9 |
| P60d | 6 345 | 6 300 | 9.357 | 0.988 | 97.1 |
| MP60d | 6 737 | 6 700 | 9.477 | 0.989 | 96.8 |
| P120d | 6 080 | 6 024 | 8.474 | 0.977 | 97.0 |
| MP120d | 6 704 | 6 678 | 9.616 | 0.991 | 96.8 |
表选项
2.2.2 根际土壤细菌的主成分及α多样性分析对两个处理组不同时期土壤样品细菌序列进行主成分分析(图 3),第1主成分(PC1)解释了变量方差的44.91%,第3主成分(PC3)解释了变量方差的10.07%,累积贡献率达54.98%,可以反映变量之间的成分差异[28]。P0d与P60d、P120d在坐标轴中的位置较为分散,MP组中也观察到同样现象。两个处理中60 d与120 d的样品间距离较小,而在坐标系中60 d、120 d两处理组间的样品位置存在一定距离。此结果表明,两处理的0 d土壤中细菌群落与修复后的土壤中细菌的群落存在差异,并且经过120 d的修复,C.t的接入可能引起羊草根际土壤中细菌的群落结构发生改变。
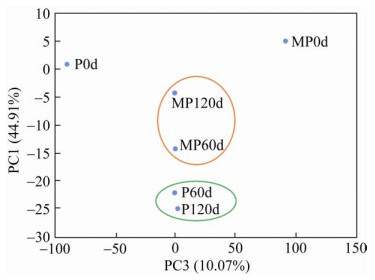 |
| 图 3 两个处理组不同时间点羊草根际土壤细菌群落的主成分分析 Fig. 3 Principal component analysis of soil bacterial communities in the rhizosphere of Leymus chinensis in the two treatment groups at different time points. |
| 图选项 |
为研究不同修复时间下,C.t对羊草根际土壤细菌群落的丰富度和多样性影响,对P组和MP组6种土壤样品的α多样性指数进行分析(表 1)。Ace指数和Chao1指数可说明土壤细菌群落的丰富度大小,辛普森指数(Simpon)和香农指数(Shannon)可代表土壤细菌群落多样性的高低[17]。Ace指数及Chao1指数的结果可以看出,两个处理组的土壤细菌群落的丰富度随修复时间的增加而降低,修复初始(0 d) P组的细菌群落的丰富度大于MP组,修复后期(60–120 d) MP组的细菌群落的丰富度大于P组。辛普森指数和香农指数的结果与Ace指数和Chao1指数结果相似(表 1)。此结果与土壤中PAHs的降解变化一致,修复前期P组总PAHs的降解量大于MP组,修复后期MP组的总PAHs的降解量大于P组,在120 d时MP组土壤中总PAHs的含量小于P组。从以上结果可看出,在修复后期,C.t的加入提高了PAHs污染的羊草根际土中细菌微生物群落的丰富度及多样性,并且在修复过程中,两处理组的α多样性变化情况与土壤PAHs含量变化一致。因此,土壤微生物的丰富度及多样性可能影响土壤中PAHs的降解。
2.2.3 根际土壤细菌群落结构组成分析在门分类水平上对两个处理不同时间点的土壤细菌群落结构组成进行分析(图 4A)。优势菌群门包括厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadetes)、梭杆菌门(Fusobacteria)、硝化螺旋菌门(Nitrospirae),占门水平总丰度的95%以上。由图中可以看出,0 d时P组与MP组中优势菌门的丰度存在差异,在修复60 d和120 d的时间下,MP组中拟杆菌门和绿弯菌门的相对丰度均高于P组。MP组中变形菌门、酸杆菌门和芽单胞菌门均随时间的增加而积累,但此3种菌门在P组中随修复时间的增加呈先升高后降低的趋势,此3种菌门的相对丰度变化情况与Nap和BaP的降解率变化一致。厚壁菌门和梭杆菌门的相对丰度在P组中均随修复时间的增加而呈现出先降低后升高的趋势,在MP处理组中则呈现随修复时间的增加而降低的趋势,此两种菌门与变形菌门、酸杆菌门、拟杆菌和芽单胞菌门的变化趋势相反。在120 d的修复过程中,P组中放线菌门和硝化螺旋菌门的相对丰度均高于MP组。由以上结果可看出,C.t的接入使羊草根际土壤门水平中变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)和芽单胞菌门(Gemmatimonadetes)相对丰度发生改变,上述菌门丰度的改变可能会影响土壤中PAHs的降解。
 |
| 图 4 门水平(A)和纲水平(B)土壤细菌群落结构 Fig. 4 Soil bacterial community structure at the phylum level (A) and class level (B). The numbers on the bar graph represent the relative abundance values of bacteria. |
| 图选项 |
在纲分类水平上对两个处理不同时间点的土壤细菌群落结构组成分析如图 4B。优势菌纲包括梭菌纲(Clostridia)、红蝽菌纲(Coriobacteriia)、γ-变形菌(Gammaproteobacteria)、Subgroup_6、α-变形菌纲(Alphaproteobacteria)、芽球菌纲(Blastocatellia)、丹毒丝菌纲(Erysipelotrichia)、拟杆菌纲(Bacteroidia)、β-变形菌纲(Deltaproteobacteria),占纲水平总丰度的68%以上。结果表明,在修复的后期,芽球菌纲、拟杆菌纲和β-变形菌纲在MP组中的相对丰度大于P组。在0–120 d中,MP组内Subgroup_6、α-变形菌纲和芽球菌纲的相对丰度均随修复时间的增加而增大。梭菌纲、红蝽菌纲和丹毒丝菌纲,其相对丰度在P组中均随修复时间的增加呈先降低后升高的变化过程,而此3种菌纲在MP组中则随着修复时间的增加其相对丰度呈下降趋势,此变化与Nap和BaP的降解率变化趋势相反。由以上结果可看出,C.t的接入影响了羊草根际土壤细菌纲水平的相对丰度,不同微生物类群的作用效果不同,C.t的接入可能通过影响Subgroup_6、α-变形菌纲(Alphaproteobacteria)、芽球菌纲(Blastocatellia)、拟杆菌纲(Bacteroidia)和β-变形菌纲(Deltaproteobacteria)的相对丰度而影响土壤中PAHs的降解。
进一步对细菌在属分类水平进行分析(图 5)。共统计30个已分类的优势菌属,与P0d相比,MP0d的土壤样品中梭菌属(Fusobacterium)、韦永氏球菌属(Veillonella)、嗜胨菌属(Peptoniphilus)、硝化螺菌属(Nitrospira)、肠杆菌属(Enterobacter)、产气单孢菌属(Aeromonas)、Bryobacter、消化球菌属(Peptococcus)、微枝形杆菌属(Microvirga)、锥形杆菌属(Pyramidobacter)、Massilia、Nordella、类诺卡氏菌属(Nocardioides)等13个菌属的相对丰度提高。修复后期与P组相比,MP组中相对丰度高的菌属有RB41、硝化螺菌属(Nitrospira)、红色杆菌属(Rubrobacter)、芽胞杆菌属(Bacillus)、Subgroup_10、微枝形杆菌属(Microvirga)、Terrimonas、Nordella、类固醇杆菌属(Steroidobacter)、链霉菌属(Streptomyces)、非甲烷氧化菌(Ramlibacter)、类诺卡氏菌属(Nocardioides)共12个菌属。其中RB41、鞘氨醇单胞菌属(Sphingomonas)、黄杆菌属(Flavobacterium)、红色杆菌属(Rubrobacter)、MND1、Gaiella、Ellin6067、Nordella等8个菌属,在修复的120 d内,MP组中其相对丰度随修复时间的增加而升高,P组中其相对丰度随修复时间的增加呈先升高后降低的趋势,这8个菌属在两个处理中的变化趋势与Nap及BaP的降解率变化一致。由以上结果可以看出,C.t的接入使羊草根际细菌群落属水平的相对丰度发生改变,C.t的接入可能通过影响RB41、鞘氨醇单胞菌属(Sphingomonas)、黄杆菌属(Flavobacterium)、红色杆菌属(Rubrobacter)、MND1、Gaiella、Ellin6067、Nordella的相对丰度的变化从而影响土壤中PAHs的降解。
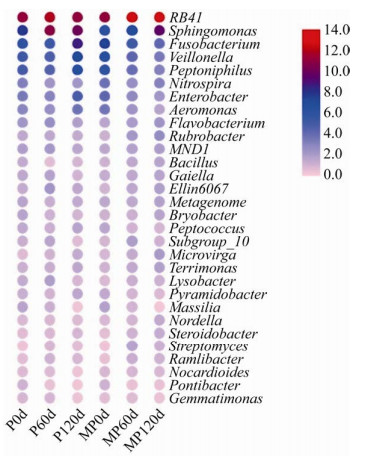 |
| 图 5 属水平上土壤细菌群落结构的变化情况 Fig. 5 Changes in soil bacterial community structure at the genus level. |
| 图选项 |
2.3 PAHs降解与细菌群落组成相关性分析将两个处理组中细菌属分类水平的相对丰度与土壤中3种PAHs含量进行RDA分析(图 6),从图中可以看出各处理菌属之间以及菌属与3种PAHs之间的相关性。如图 6A所示,两个处理组中3种PAHs彼此之间的夹角均为锐角呈正相关,未接菌的羊草根际土中在Nap、Phe和BaP的正投影值范围内的菌属包括红色杆菌属、Gaiella、芽单胞菌属、类诺卡氏菌属、Massilia、海洋杆菌属、硝化螺菌属、Bryobacter、芽胞杆菌属,表明上述9个菌属与PAHs呈正相关关系。在Nap、Phe和BaP的负投影值范围内的菌属有RB41、Ellin6067、链霉菌属、非甲烷氧化菌、鞘氨醇单胞菌属、类固醇杆菌属、微枝形杆菌属、Terrimonas、韦永氏球菌属、肠杆菌属、梭菌属,说明上述11个菌属与PAHs呈负相关。从图 6B可看出,MP组中与PAHs正相关的细菌增加了产气单孢菌属、梭菌属、锥形杆菌属、肠杆菌属、韦永氏球菌属、消化球菌属、嗜胨菌属共7个菌属。MP组与PAHs负相关的细菌增加了类诺卡氏菌属、Subgroup_10、溶杆菌属(Lysobacter)、红色杆菌属、黄杆菌属、MND1、Nordella、Bryobacter、Gaiella、Ellin6067共10个菌属。RDA结果表明,接入C.t会使羊草根际土内细菌的分布由分散变聚集,表明C.t的接入可能改变了羊草根际细菌间相关性,并且提升细菌与PAHs间的相关性。
 |
| 图 6 P组(A)和MP组(B)中3种PAHs与属水平细菌的冗余分析(RDA) Fig. 6 Redundancy analysis (RDA) of three PAHs and genus-level bacteria in P treatment (A) and MP treatment (B). The red arrows in the figure represent the three PAHs (Nap, Phe, BaP), and the blue arrows represent the 30 genera of relative abundance. |
| 图选项 |
基于皮尔森相关性,将两个处理组的属水平根际细菌与3种PAHs进行网络分析(图 7)。将P组(图 7A)和MP组(图 7B)比较可发现,MP组中与3种PAHs均呈负相关的细菌为17种,P组中为13种,其中两个处理组共有的负相关细菌为7种,包括RB41、鞘氨醇单胞菌属、Ellin6067、微枝形杆菌属、Terrimonas、链霉菌属、非甲烷氧化菌。MP组独有的与PAHs呈负相关的细菌有9种:黄杆菌属、红色杆菌属、MND1、芽胞杆菌属、Gaiella、Bryobacter、Subgroup_10、Massilia、类诺卡氏菌属。MP组较P组中与PAHs负相关的细菌数明显增多,说明C.t的接入可能使羊草根际微生物与PAHs之间负相关的细菌增多,并且增强二者间的相关性,此结果与RDA分析一致。
 |
| 图 7 P组(A)和MP组(B)中3种PAHs与属水平细菌的网络分析 Fig. 7 Network analysis of three PAHs and genus-level bacteria in P treatment (A) and MP treatment (B). The size of the dots represents the relative abundance of bacteria, the thickness of the line represents the correlation, and the color of the line represents the positive and negative correlation: orange is negative correlation, black is positive correlation. |
| 图选项 |
2.4 根际细菌基因功能预测分析KEGG可对微生物中差异表达基因进行分析,以确定其具有的主要生物学功能,以及其参与的生化代谢及信号转导途径。使用PICRUSt软件对修复120 d时MP组与P组羊草根际菌群进行KEGG功能预测分析(图 8),基因功能主要富集在代谢、遗传信息处理、环境信息处理、细胞过程、生物系统等功能类群,其中代谢功能占比最大可达50%以上。经过KEGG二级代谢通路分析,MP组与P组共匹配到41个代谢通路,选取相对丰度大于1%的代谢通路共23个,通过这23个代谢通路对P组与MP进行比较分析(图 8B)。从图 8B中可以看出,这23个代谢通路中MP组均高于P组。KEGG三级代谢通路中,选取13个与PAHs相关的代谢通路对两个处理组进行比较分析(图 8C),其中多环芳烃降解途径、萘降解途径、三羧酸(TCA)循环、药物代谢-细胞色素P450代谢途径、细胞色素P450对外源物质的代谢途径等5个代谢通路与PAHs降解有关,其余8个为芳香族化合物降解的代谢通路,修复120 d时13个三级代谢通路MP组均高于P组。由KEGG的结果可看出,KEGG的二级与三级代谢通路中MP组均高于P组,其可能与120 d时MP组中微生物丰度及多样性高于P组有关,导致MP组较P组中微生物的代谢更为活跃,进而使MP组的KEGG代谢通路高于P组。KEGG三级代谢通路中,MP组的PAHs相关代谢通路均高于P组,其可能是修复结束时MP组土壤PAHs含量低于P组的原因之一。
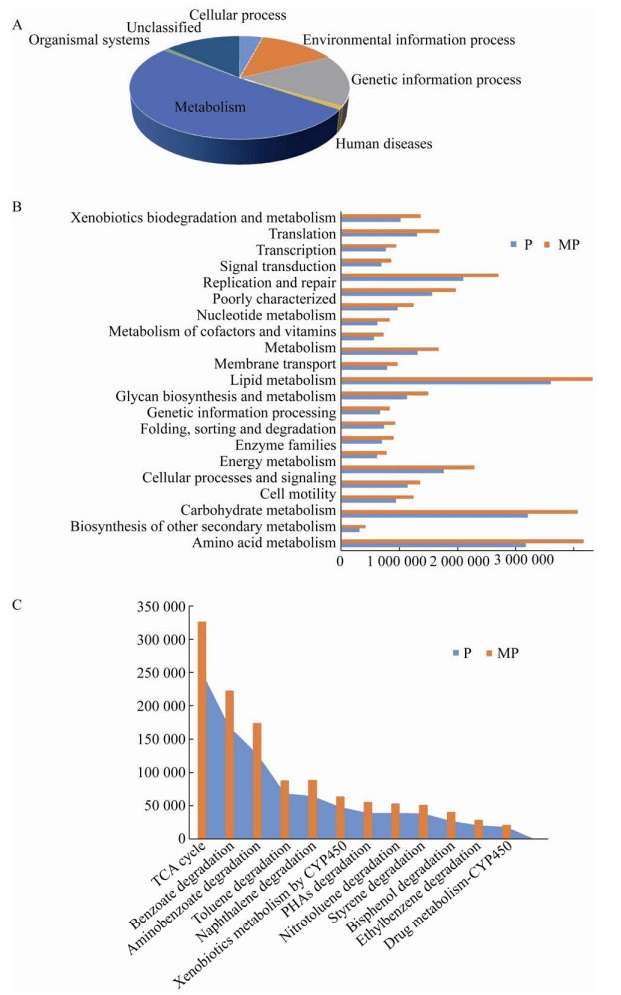 |
| 图 8 不同处理组120 d土壤细菌KEGG一级(A)、二级(B)、三级(C)功能预测分析 Fig. 8 Functional prediction analysis of KEGG KL1 (A), KL2 (B), and KL3 (C) soil bacteria in different treatment groups for 120 days. |
| 图选项 |
3 讨论微生物联合植物修复PAHs污染土壤是一种绿色、环保、经济有效的方式,其克服了单一植物降解周期长以及微生物降解易受环境因素影响等缺点而被人们广泛使用[19-24]。植物修复过程中,根际区域由于其特定的根际作用使其降解速率明显高于非根际区域[13, 26]。本研究将C.t联合羊草进行土壤PAHs污染修复,修复120 d后,接菌与未接菌的两组中3种PAHs (Nap、Phe、BaP)降解率均表现为Phe > BaP > Nap,接菌的羊草根际土中3种PAHs的含量均低于未接菌的处理组。由于PAHs降解过程中,高环PAHs会向低环PAHs进行转化,即BaP、Phe会转化为Nap[29],因此,推测这可能是本研究中检测的Nap降解率较低的主要原因。修复后与Nap的含量相比,土壤中Phe与BaP的含量较为接近,而Phe的化学结构较BaP更简单,因此Phe比BaP更易降解。Minkina等[29]通过人工加标方式研究BaP降解时发现,随着土壤中BaP含量的下降其余低环PAHs (芘、荧蒽、菲及萘)含量不断增加。丛枝菌根真菌及根瘤菌联合豆科植物降解PAHs的研究发现,接菌处理组与未接菌组相比低分子量PAHs的降解明显增强[19]。PAHs降解菌(Alcaligenes sp.)联合凤尾蕨进行降解时,前期PAHs降解率为69.2%,修复后期PAHs降解率仅增加17.1%,前期降解迅速而后期降解率的增加量明显减慢[30],本实验结果与此一致,C.t联合羊草的根际降解也表现为前期快速降解,而后期降解率增加减慢。与未接菌处理组相比,C.t的接入在降解后期(60–120 d)表现更好,这可能与土壤中微生物的变化有关。
本研究中基于α多样性变化的分析表明,P组与MP组土壤中PAHs的降解量与土壤中细菌的丰富度及多样性的变化一致。本实验中,降解前期P组的降解率高于MP组,可能是由于P0d与MP0d中微生物组成的差异所导致,因为接菌后C.t使土壤中原有细菌群落发生快速变化。Rodríguez-Caballero等[31]将丛植菌根真菌接入到4种植物根际土中,4种植物接种1 d后,发现接菌组与未接菌组的土壤微生物组成存在明显差异,丛植菌根真菌的接入会快速影响原有微生物的群落结构,与本实验结果一致。在植物修复过程中,PAHs的降解常伴随着土壤微生物丰富度及多样性的变化[12, 30],在降解过程中PAHs降解菌的富集是降解的关键。C.t联合羊草根际降解PAHs时,门水平中优势菌为厚壁菌门、变形菌门、放线菌门、酸杆菌门、拟杆菌门。本实验结果与Chen等[17]研究一致,羊草根际中优势菌门也包含此5种菌。并且其中变形菌门、酸杆菌门、拟杆菌门均与PAHs降解有关,已有研究表明上述菌门广泛存在于PAHs污染土壤中[32-34]。Dai等[32]使用禾本科植物高羊茅(Festuca L.)修复PAH-Cd污染土壤时,变形菌门、放线菌门、酸杆菌门、拟杆菌门均与PAHs的降解有关。Lu等[34]对PAHs污染老化土中PAHs降解菌进行富集发现,大部分PAHs降解菌来自变形菌门和放线菌门。本实验中与PAHs降解有关的菌纲为Subgroup_6、α-变形菌纲、芽球菌纲、拟杆菌纲和β-变形菌纲,其中Subgroup_6和芽球菌纲属于酸杆菌门,α-变形菌纲和β-变形菌纲属于变形菌门,此结果与门水平一致。
通过对微生物群落间各种细菌丰度变化的分析,发现一个有趣的现象,C.t接入后丛毛单胞菌在属水平并不是优势菌属,土壤中加入C.t经微生物平衡后,微生物群落中丛毛单胞菌属的丰度快速下降至消失,并且未接菌土壤中也未检测出其丰度。Zhang等[35]认为细菌丰度的快速变化与细菌间的相互作用有关,细菌间的相互作用受互作范围、互作强度以及原始微生物群落组成的影响,其中原始的微生物群落组成不仅影响细菌的互作还会影响细菌间的共存,因此C.t的迅速消失可能与其土著微生物的互作关系有关。同时,细菌丰度易受pH、温度、土壤营养物质含量等众多非生物因素的影响,Singha等[36]利用植物修复BaP污染土壤时发现,土壤中pH随BaP的降低而升高,土壤中细菌群落结构也会随pH的变化而发生改变;Dominguez等[37]也发现,pH微弱变化导致微生物群落结构发生明显改变,甚至影响部分细菌丰度快速下降。因此我们推测土壤中的pH、含水量、温度或营养物质组成等因素影响接入的C.t生长及繁殖,所以接菌后C.t丰度的快速下降可能是生物因素与非生物因素共同作用而导致。虽然土壤中加入C.t后其丰度迅速减少,但接菌后使原有微生物群落结构发生改变,进而可能影响了羊草根际土中降解菌的丰度及多样性发生变化,最终使接菌组中PAHs的降解也发生变化。
经过RDA及皮尔森相关性分析可发现,C.t的接入使羊草根际土壤中与PAHs呈负相关的微生物种类增加,Guo等[38]认为PAHs的含量与细菌多样性呈负相关,因此我们推测C.t的接入有助于降低土壤中PAHs的含量,使微生物所受PAHs的毒性胁迫下降,进而土壤中更多的微生物得以生存,所以与未接菌处理相比,接菌组土壤中与PAHs含量变化呈负相关的微生物种类增加。营养物质是微生物之间互作的主要驱动力,营养物质减少会增加微生物之间的负相互作用[39]。修复后期接入C.t的土壤中微生物的丰富度增多,修复土壤中的营养物质有限,进而可能使土壤中微生物间的互作增强,所以与PAHs含量变化呈负相关的微生物种类的增加,也可能是由于C.t接入与其他微生物间的互作导致。将属水平相对丰度变化、RDA及皮尔森相关性分析进行结合,C.t通过影响RB41、鞘氨醇单胞菌属(Sphingomonas)、黄杆菌属(Flavobacterium)、红色杆菌属(Rubrobacter)、MND1、Gaiella和Nordella而促进土壤中PAHs降解,上述7种菌属与PAHs呈负相关。其中鞘氨醇单胞菌、MND1和Nordella均属于变形菌门,RB41属于酸杆菌门,黄杆菌属于拟杆菌门,红色杆菌属与Gaiella均属于放线菌门,其结果与门水平的分析基本一致。RB41广泛存在于PAHs污染土壤中,张江红等[40]使用桃树对苯酚及苦杏仁苷进行污染土壤修复时发现,土壤中的优势菌有Subgroup_6、固氮菌、RB41、亚硝化单胞菌科;Shen等[41]使用草本植物对石油污染土壤进行修复时,发现放线菌、RB41、MND1及红螺菌目为土壤中优势菌。鞘氨醇单胞菌广泛存在于PAHs的污染土壤中,且诸多研究均发现鞘氨醇单胞菌对PAHs具有良好的降解效果[25-27]。比较与羊草均为禾本科植物的苏丹草、黑麦草、高羊草对PAHs的降解作用[13],发现苏丹草对PAHs的降解作用最显著,原因在于苏丹草根际可有效富集鞘氨醇单胞菌。红色杆菌属也是一种常见的PAHs降解菌,该菌属能产生乳化剂,提高非极性的PAHs生物利用度,利于快速降解土壤中的PAHs[24]。本研究发现,C.t通过改变土壤中细菌与PAHs的相关性,使土壤中PAHs降解菌增多,进而促进土壤中PAHs的降解。此外,羊草的根际可能通过释放根系分泌物促进了微生物的生长,最终更有效地降解根际土壤中PAHs。
Crampon等[42]发现通过对KEGG代谢通路分析可预测PAHs的降解潜力。对PAHs有明显降解作用的代谢通路包括多环芳烃降解途径、萘降解途径、三羧酸(TCA)循环、药物代谢-CYP450代谢途径、CYP450对外源物质降解的代谢途径。细菌在对PAHs的好氧降解过程中,首先通过双加氧酶或单加氧酶的作用,将PAHs转化为二氢二醇化合物,然后在脱氢酶的作用下,生成二醇中间产物,再经过一系列酶的催化形成邻苯二酚,最终转化为TCA循环中的小分子物质,达到完全降解[43-46]。CYP450是一种单加氧酶,其对PAHs的作用主要是提升PAHs的生物利用度,从而促进PAHs的分解,而TCA循环则是PAHs降解的必经代谢过程[42-47]。本研究中,羊草根际土中C.t的接入,除影响PAHs降解菌的群落结构外,还会促进KEGG代谢通路,其中包括多环芳烃降解途径、萘降解途径、三羧酸(TCA)循环、药物代谢-CYP450代谢途径、CYP450对外源物质降解的代谢途径,此结果与Crampon等[42]的研究一致。因此羊草根际土中C.t的加入,可能通过促进羊草根际土中细菌的代谢活性,进而提高PAHs的降解潜力,促进了PAHs的降解效果。
综上所述,C.t通过影响羊草根际土中细菌群落丰度,改变根际细菌与PAHs相关性及互作强度,使羊草根际土壤中PAHs降解菌增加,提高了羊草根际土壤中细菌的代谢活性及PAHs的降解潜力,使羊草根际中3种PAHs (Nap、Phe、BaP)的降解率增加,从而使PAHs污染的羊草根际土达到更好的修复效果。
参考文献
| [1] | Ren XY, Zeng GM, Tang L, et al. Sorption, transport and biodegradation - An insight into bioavailability of persistent organic pollutants in soil. Sci Total Environ, 2018, 610/611: 1154-1163. DOI:10.1016/j.scitotenv.2017.08.089 |
| [2] | Syed JH, Iqbal M, Zhong GC, et al. Polycyclic aromatic hydrocarbons (PAHs) in Chinese forest soils: profile composition, spatial variations and source apportionment. Sci Rep, 2017, 7(1): 2692-2702. |
| [3] | Han J, Liang YS, Zhao B, et al. Polycyclic aromatic hydrocarbon (PAHs) geographical distribution in China and their source, risk assessment analysis. Environ Pollut, 2019, 251: 312-327. DOI:10.1016/j.envpol.2019.05.022 |
| [4] | Zhang P, Chen YG. Polycyclic aromatic hydrocarbons contamination in surface soil of China: a review. Sci Total Environ, 2017, 605/606: 1011-1020. DOI:10.1016/j.scitotenv.2017.06.247 |
| [5] | Maliszewska-Kordybach B. Polycyclic aromatic hydrocarbons in agricultural soils in Poland: preliminary proposals for criteria to evaluate the level of soil contamination. Appl Geochem, 1996, 11(1/2): 121-127. |
| [6] | Wu YC, Arumugam K, Tay MQX, et al. Comparative genome analysis reveals genetic adaptation to versatile environmental conditions and importance of biofilm lifestyle in Comamonas testosteroni. Appl Microbiol Biotechnol, 2015, 99(8): 3519-3532. DOI:10.1007/s00253-015-6519-z |
| [7] | Huang Z, Ni B, Jiang CY, et al. Direct sensing and signal transduction during bacterial chemotaxis toward aromatic compounds in Comamonas testosteroni. Mol Microbiol, 2016, 101(2): 224-237. DOI:10.1111/mmi.13385 |
| [8] | Wald J, Hroudova M, Jansa J, et al. Pseudomonads rule degradation of polyaromatic hydrocarbons in aerated sediment. Front Microbiol, 2015, 6: 1268. |
| [9] | He FG, Ren ZH, Mi XJ, et al. Advances in degradation of petroleum pollutants by Comamonas testosteroni. Chin Bull Life Sci, 2013, 25(1): 106-112 (in Chinese). 赫法贵, 任政华, 弭晓菊, 等. 睾丸酮丛毛单胞菌降解石油污染物的研究进展. 生命科学, 2013, 25(1): 106-112. |
| [10] | Wang YH, Huang Z, Liu SJ. Chemotaxis towards aromatic compounds: insights from Comamonas testosteroni. Int J Mol Sci, 2019, 20(11): 2701. DOI:10.3390/ijms20112701 |
| [11] | He FG. Research on degradation of PAHs by Comamonas testosteroni[D]. Harbin: Harbin Normal University, 2013 (in Chinese). 赫法贵.睾丸酮丛毛单胞菌降解多环芳烃的研究[D].哈尔滨: 哈尔滨师范大学, 2013. |
| [12] | Al-Mansoory AF, Idris M, Abdullah SRS, et al. Phytoremediation of contaminated soils containing gasoline using Ludwigia octovalvis (Jacq.) in greenhouse pots. Environ Sci Pollut Res Int, 2017, 24(13): 11998-12008. DOI:10.1007/s11356-015-5261-5 |
| [13] | Dominguez JJA, Bacosa HP, Chien MF, et al. Enhanced degradation of polycyclic aromatic hydrocarbons (PAHs) in the rhizosphere of sudangrass (Sorghum×drummondii). Chemosphere, 2019, 234: 789-795. DOI:10.1016/j.chemosphere.2019.05.290 |
| [14] | Ni N, Song Y, Wang F, et al. A Review of researches on intensified bio-remediation of polycyclic aromatic hydrocarbons contaminated soils. Acta Pedol Sin, 2016, 53(3): 561-571 (in Chinese). 倪妮, 宋洋, 王芳, 等. 多环芳烃污染土壤生物联合强化修复研究进展. 土壤学报, 2016, 53(3): 561-571. |
| [15] | Chu LS, Li HY, Yang YF. Vegetative reproduction characteristics of Leymus chinensis in heterogeneous habitats in Songnen Plain, China. Chin J Appl Ecol, 2020, 31(1): 83-88 (in Chinese). 初丽爽, 李海燕, 杨允菲. 松嫩平原异质生境羊草种群营养繁殖特征. 应用生态学报, 2020, 31(1): 83-88. |
| [16] | Chao ZW, Yu ZZ, Zhang HB, et al. Pollutant residue of crude oil in Aneurolepidium chinensis. J Northeast For Univ, 2007, 35(2): 55-56 (in Chinese). 曹文钟, 余政哲, 张宏波, 等. 石油污染物在羊草中的残留. 东北林业大学学报, 2007, 35(2): 55-56. DOI:10.3969/j.issn.1000-5382.2007.02.021 |
| [17] | Chen J, Xu DL, Chao LM, et al. Microbial assemblages associated with the rhizosphere and endosphere of an herbage, Leymus chinensis. Microb Biotechnol, 2020, 31(5): 1390-1402. |
| [18] | Hang H, Zhang CL, Zhou YX, et al. Effect of Rhizobium-plant remediation on pyrene contaminated soil. Eco Environ Sci, 2019, 28(7): 1466-1472 (in Chinese). 黄河, 张超兰, 周永信, 等. 芘污染土壤的根瘤菌-植物修复效应研究. 生态环境学报, 2019, 28(7): 1466-1472. |
| [19] | Ren CG, Kong CC, Bian B, et al. Enhanced phytoremediation of soils contaminated with PAHs by arbuscular mycorrhiza and rhizobium. Int J Phytoremediation, 2017, 19(9): 789-797. DOI:10.1080/15226514.2017.1284755 |
| [20] | Yao LF, Teng Y, Liu F, et al. Influence of Trichoderma reesei and Rhizobium meliloti on phytoremediation of PAH-contaminated soil by Alfalfa. Eco Environ Sci, 2014, 23(5): 890-896 (in Chinese). 姚伦芳, 腾应, 刘方, 等. 多环芳烃污染土壤的微生物-紫花苜蓿联合修复效应. 生态环境学报, 2014, 23(5): 890-896. DOI:10.3969/j.issn.1674-5906.2014.05.025 |
| [21] | Chen F, Tan M, Ma J, et al. Efficient remediation of PAH-metal co-contaminated soil using microbial-plant combination: A greenhouse study. J Hazard Mater, 2016, 302: 250-261. DOI:10.1016/j.jhazmat.2015.09.068 |
| [22] | García-Sánchez M, Ko?ná? Z, Mercl F, et al. A comparative study to evaluate natural attenuation, mycoaugmentation, phytoremediation, and microbial-assisted phytoremediation strategies for the bioremediation of an aged PAH-polluted soil. Ecotoxicol Environ Saf, 2018, 147: 165-174. DOI:10.1016/j.ecoenv.2017.08.012 |
| [23] | Guo MX, Gong ZQ, Miao RH, et al. Microbial mechanisms controlling the rhizosphere effect of ryegrass on degradation of polycyclic aromatic hydrocarbons in an aged-contaminated agricultural soil. Soil Biol Biochem, 2017, 113: 130-142. DOI:10.1016/j.soilbio.2017.06.006 |
| [24] | Kong FX, Sun GD, Liu ZP. Degradation of polycyclic aromatic hydrocarbons in soil mesocosms by microbial/plant bioaugmentation: Performance and mechanism. Chemosphere, 2018, 198: 83-91. DOI:10.1016/j.chemosphere.2018.01.097 |
| [25] | Guo MX, Gong ZQ, Miao RH, et al. Enhanced polycyclic aromatic hydrocarbons degradation in rhizosphere soil planted with tall fescue: Bacterial community and functional gene expression mechanisms. Chemosphere, 2018, 212: 15-23. DOI:10.1016/j.chemosphere.2018.08.057 |
| [26] | Lu HN, Wang W, Li F, et al. Mixed- surfactant-enhanced phytoremediation of PAHs in soil: Bioavailability of PAHs and responses of microbial community structure. Sci Total Environ, 2019, 653: 658-666. DOI:10.1016/j.scitotenv.2018.10.385 |
| [27] | Li X, Zheng R, Bu QH, et al. Comparison of PAH content, potential risk in vegetation, and bare soil near Daqing oil well and evaluating the effects of soil properties on PAHs. Environ Sci Pollut Res Int, 2019, 26(24): 25071-25083. DOI:10.1007/s11356-019-05720-y |
| [28] | Huang WJ, Sun DL, Fu JT, et al. Effects of continuous sugar beet cropping on rhizospheric microbial communities. Genes (Basel), 2019, 11(1): 13. DOI:10.3390/genes11010013 |
| [29] | Minkina T, Sushkova S, Yadav BK, et al. Accumulation and transformation of benzo[a]pyrene in haplic chernozem under artificial contamination. Environ Geochem Health, 2020, 42(8): 2485-2494. DOI:10.1007/s10653-019-00362-y |
| [30] | Sun L, Zhu GH, Liao XY. Enhanced arsenic uptake and polycyclic aromatic hydrocarbon (PAH)- dissipation using Pteris vittata L. and a PAH-degrading bacterium. Sci Total Environ, 2018, 624: 683-690. DOI:10.1016/j.scitotenv.2017.12.169 |
| [31] | Rodríguez-Caballero G, Caravaca F, Fernández- González AJ, et al. Arbuscular mycorrhizal fungi inoculation mediated changes in rhizosphere bacterial community structure while promoting revegetation in a semiarid ecosystem. Sci Total Environ, 2017, 584-585: 838-848. DOI:10.1016/j.scitotenv.2017.01.128 |
| [32] | Dai YY, Liu R, Zhou YN, et al. Fire Phoenix facilitates phytoremediation of PAH-Cd co-contaminated soil through promotion of beneficial rhizosphere bacterial communities. Environ Int, 2020, 136: 105421. DOI:10.1016/j.envint.2019.105421 |
| [33] | Delgado-Balbuena L, Bello-López JM, Navarro-Noya YE, et al. Changes in the bacterial community structure of remediated anthracene- contaminated soils. PLoS ONE, 2016, 11(10): e160991. |
| [34] | Lu C, Hong Y, Liu J, et al. A PAH-degrading bacterial community enriched with contaminated agricultural soil and its utility for microbial bioremediation. Environ Pollut, 2019, 251: 773-782. DOI:10.1016/j.envpol.2019.05.044 |
| [35] | Zhang ZJ, Kleunen MV, Becks L, et al. Towards a general understanding of bacterial interactions. Trends Microbiol, 2020, 28(10): 783-785. DOI:10.1016/j.tim.2020.05.010 |
| [36] | Singha LP, Pandey P. Rhizobacterial community of Jatropha curcas associated with pyrene biodegradation by consortium of PAH-degrading bacteria. Appl Soil Ecol, 2020, 155: 103685. DOI:10.1016/j.apsoil.2020.103685 |
| [37] | Dominguez JJA, Inoue C, Chien MF. Hydroponic approach to assess rhizodegradation by sudangrass (Sorghum x drummondii) reveals pH- and plant age-dependent variability in bacterial degradation of polycyclic aromatic hydrocarbons (PAHs). J Hazard Mater, 2020, 387: 121695. DOI:10.1016/j.jhazmat.2019.121695 |
| [38] | Guo YT, Rene ER, Wang JJ, et al. Biodegradation of polyaromatic hydrocarbons and the influence of environmental factors during the co-composting of sewage sludge and green forest waste. Bioresour Technol, 2020, 297: 122434. DOI:10.1016/j.biortech.2019.122434 |
| [39] | Banerjee S, Kirkby CA, Schmutter D, et al. Network analysis reveals functional redundancy and keystone taxa amongst bacterial and fungal communities during organic matter decomposition in an arable soil. Soil Biol Biochem, 2016, 97: 188-198. DOI:10.1016/j.soilbio.2016.03.017 |
| [40] | Zhang JH, Peng FT, Jiang XM, et al. Effects of peach branches returning on autotoxins and microbes in soil and tree growth of peaches. Chin J Plant Ecol, 2016, 40(2): 140-150 (in Chinese). 张江红, 彭福田, 蒋晓梅, 等. 桃树枝条还田对土壤自毒物质、微生物及植株生长的影响. 植物生态学报, 2016, 40(2): 140-150. |
| [41] | Shen YY, Ji Y, Li CR, et al. Effects of phytoremediation treatment on bacterial community structure and diversity in different petroleum- contaminated soils. Int J Environ Res Public Health, 2018, 15(10): 2168. DOI:10.3390/ijerph15102168 |
| [42] | Crampon M, Bodilis J, Portet-Koltalo F. Linking initial soil bacterial diversity and polycyclic aromatic hydrocarbons (PAHs) degradation potential. J Hazard Mater, 2018, 359: 500-509. DOI:10.1016/j.jhazmat.2018.07.088 |
| [43] | Zhou ZK, Cui J, Xu P, et al. Progress in biodegradation of low molecular weight polycyclic aromatic hydrocarbons. Chin J Biotech, 2019, 35(11): 2069-2080 (in Chinese). 周子康, 崔洁, 许平, 等. 细菌降解低分子量多环芳烃的研究进展. 生物工程学报, 2019, 35(11): 2069-2080. |
| [44] | Haritash AK, Kaushik CP. Biodegradation aspects of polycyclic aromatic hydrocarbons (PAHs): a review. J Hazard Mater, 2009, 169(1/2/3): 1-15. |
| [45] | Kadri T, Rouissi T, Brar SK, et al. Biodegradation of polycyclic aromatic hydrocarbons (PAHs) by fungal enzymes: A review. J Environ Sci-China, 2017, 51: 52-74. DOI:10.1016/j.jes.2016.08.023 |
| [46] | Loss EMO, Lee MK, Wu MY, et al. Cytochrome P450 monooxygenase-mediated metabolic utilization of Benzo[a]Pyrene by Aspergillus Species. mBio, 2019, 10(3): e00558-19. DOI:10.1128/mBio.00558-19 |
| [47] | Vieira GAL, Magrini MJ, Bonugli-Santos RC, et al. Polycyclic aromatic hydrocarbons degradation by marine-derived basidiomycetes: optimization of the degradation process. Braz J Microbiol, 2018, 49(4): 749-756. |
