

1 河南农业大学 生命科学学院,河南 郑州 450002;
2 河南农业大学 河南粮食作物协同创新中心,河南 郑州 450002;
3 河南农业大学 省部共建小麦玉米作物学国家重点实验室,河南 郑州 450002
收稿日期:2017-05-31;接收日期:2017-08-01; 网络出版时间:2017-09-06 基金项目:国家重点研发计划支持项目(No. 2016YFD0300205),河南省现代农业(小麦)产业技术体系技术创新团队项目(No. S2010-01-G04)资助
摘要:谷氨酰胺合成酶(GS)是植物氮同化的关键酶,为了研究小麦GS同工酶的结构及其表达特点,我们构建了小麦GS1、GSr、GSe、GS2和GS2前体GS2p的原核表达载体,并对表达条件进行了优化。结果表明,尽管小麦GS同工酶氨基酸序列同源性达70%–80%,蛋白质表达却各具特点。30 ℃诱导3 h后,GSr、GSe及GS2表达量达最大,诱导7 h后GS1表达量达最大,GS2p不表达,表达量依次为GS1 (22%) > GSr (15%) > GS2 (12%) > GSe (5%);且GSe可溶性表达,GS1主要为可溶性表达,而GSr和GS2为包涵体。30 ℃诱导3 h,GS同工酶相对转录量为GSr (7.59) > GS2 (1.84) > GS2p (1.66) > GSe (1.46) > GS1 (1.00),酶蛋白质翻译水平与转录水平不一致。mRNA结构分析显示,GS同工酶翻译起始区稳定二级结构的自由能不同:GS1 (14.4) < GSr (17.2) < GS2 (22.6) < GSe (25.4) < GS2p (31.6),自由能越小,翻译起始区结构越不稳定,蛋白表达水平越高。GS1、GSr、GSe和GS2可溶性表达的最佳诱导条件不同,分别是30 ℃诱导5 h、16 ℃诱导15 h、37 ℃诱导5 h及25 ℃诱导7 h;可溶性表达量为GS1 (20%) > GSr (13%) > GS2 (10%) > GSe (7%),酶活性为GS1 > GSe > GS2,GSr无活性。可见,GS同工酶的基因序列决定了蛋白质在原核细胞中的表达量、状态及其活性。
关键词:谷氨酰胺合成酶 同工酶 原核表达 表达特点
Expression characteristics of glutamine synthetase of wheat in Escherichia coli
Mingxin Gu1, Yihao Wei2, Xiting Ji1, Shuping Xiong2, Xinming Ma2, Xiaochun Wang1,2,3


1 Department of Biochemistry, College of Life Sciences, Henan Agricultural University, Zhengzhou 450002, Henan, China;
2 Collaborative Innovation Center of Henan Grain Crops, Henan Agricultural University, Zhengzhou 450002, Henan, China;
3 State Key Laboratory of Wheat and Maize Crop Science in China, Henan Agricultural University, Zhengzhou 450002, Henan, China
Received: May 31, 2017; Accepted: August 1, 2017; Published: September 6, 2017
Supported by: National Key Research and Development Program of China (No. 2016YFD0300205), Modern Agricultural Technology System in Henan Province (No. S2010-01-G04)
Corresponding author:Xiaochun Wang. Tel: +86-371-63555790; E-mail: xiaochun.w@163.com
Abstract: Glutamine synthetase is a key enzyme in plant nitrogen assimilation. To study the structure of wheat glutamine synthetase isoenzymes, GS1, GSr, GSe, GS2 and GS2p of wheat were cloned into pET-21a, and the expression condition was optimized. Although wheat glutamine synthetase isoenzymes had 70%–80% amino acid sequence homology, the isoforms expressed with different characteristics. Induced at 30 ℃, the most expression level of GSr, GSe and GS2 was after 3 h, and of GS1 was at the 7 h whereas no GS2p was expressed, and the GS isoenzymes showed different expression level, with the order of GS1 (22%) > GSr (15%) > GS2 (12%) > GSe (5%). GSe expressed as soluble protein, and GS1 expressed mainly as soluble protein whereas GSr and GS2 expressed as insoluble proteins. Induced at 30 ℃ for 3 h, mRNA transcript levels of GS isoforms were different, with the order of GSr (7.59) > GS2 (1.84) > GS2p (1.66) > GSe (1.46) > GS1 (1.00). The levels of mRNA transcription were not consistent with the level of the protein translation. The analysis of mRNA secondary structure showed the free energy of translation initiation region of glutamine synthetase isoforms was different, with the order of GS1 (14.4) < GSr (17.2) < GS2 (22.6) < GSe (25.4) < GS2p (31.6), the smaller freed energy, the more unstable mRNA secondary structure of translation initiation region and the higher level of protein expression. Soluble expression condition of glutamine synthetase isozymes was also different, with GS1, GSr, GSe and GS2 induced at 30 ℃ for 5 h, 16 ℃ for 15 h, 37 ℃ for 5 h, and 25 ℃ for 7 h respectively. The soluble protein showed different expression level with GS1 (20%) > GSr (13%) > GS2 (10%) > GSe (7%), and different activities with GS1 > GSe > GS2, and the activity of GSr was not detected. The gene sequence of glutamine synthetase isoenzymes determines the amount, status and activity of proteins expressed in prokaryotic cells.
Key words: glutamine synthetase isozyme prokaryotic expression expression characteristics
大肠杆菌表达系统因遗传背景清晰、培养条件简单、生长速度快、成本低、产量高、表达产物纯化过程简单、产物稳定性好及不易污染等优点,成为基因工程中应用最广泛的原核表达系统,取得了巨大的科研价值及经济效益[1-3]。但原核表达也存在一些缺点,表达产物常以包涵体形式存在,部分真核基因表达量低,而且由于缺乏翻译后加工修饰机制,表达产物生物活性低等[4-6]。大肠杆菌表达系统的局限性目前已有一些相应的解决方法,如携带pRARE2质粒的BL21衍生菌株Rosetta,补充了稀有密码子对应的tRNA,可提高稀有密码子多的真核基因在原核细胞中的表达量[7-8];通过改变5′端的稀有密码子降低翻译起始区二级结构的稳定性,促进核糖体与mRNA结合,增强翻译起始效率以提高表达量[9];通过降低诱导温度[10],或通过融合表达增加目的蛋白溶解性。雷荣悦等将人源BMP6分别与5种融合标签构建重组表达载体,发现只有MBP能增强rhBMP6的溶解性[11]。
谷氨酰胺合成酶(Glutamine synthetase,GS)是植物氮素同化的关键酶[12],依据细胞定位分为胞液型GS (GS1)和质体型GS (GS2)两大类,它们在作物生长发育和产量形成中具有重要作用[13]。栽培小麦的胞液型GS1有TaGS1 (TaGS1.1)、TaGSr (TaGS1.2)和TaGSe (TaGS1.3)三种,基因序列同源性65%–75%,氨基酸序列同源性约80%,亚基约39 kDa;质体型GS只有TaGS2一种,与GS1基因序列同源性为50%–60%,与GS1氨基酸序列同源性为70%–75%,亚基约42 kDa[14-15]。GS同工酶在植物氮素代谢中功能不同,TaGS1和TaGSr主要参与小麦衰老叶片的氮素再利用[16];大麦根部HvGSe能缓解高浓度NH4+的毒害,籽粒HvGSe参与种子发育过程中的氮素同化[17];GS2则参与光呼吸释放NH4+和硝酸根还原产生NH4+的同化[18]。深入研究小麦GS同工酶结构及其调控机制有助于阐明提高小麦氮素利用效率的理论基础,但是GS同工酶氨基酸序列,尤其是胞液型GS同工酶氨基酸序列同源性太高,在蛋白质水平难以区分,目前基因特异性表达分析多局限在mRNA水平上。小麦组织中GS同工酶量低,加之胞液型GS同工酶难以区分,从小麦中纯化GS同工酶难以满足深入研究的需求。在原核细胞中表达GS同工酶,可获得足量的高纯度的酶蛋白,便于进行结构解析,或筛选特异性抗体开展特异性表达或免疫组化等深入研究。
本研究利用无缝克隆技术将小麦GS同工酶TaGS1、TaGSr、TaGSe、TaGS2的编码区基因序列及TaGS2前体TaGS2p的编码区基因序列(含叶绿体定位的信号肽的基因序列)插入pET-21a表达载体,分析了小麦GS在原核细胞中的表达特点及其原因,探索了GS同工酶可溶性表达的条件,为研究小麦GS同工酶结构及其表达调控机制奠定了基础。
1 材料与方法1.1 质粒和菌株菌株 Escherichia coli DH5α和Rosetta、载体pET-21a均由本实验室保存。
1.2 克隆载体构建从NCBI获得小麦GS1 (DQ124209)、GSr (AY491968)、GSe (AY491970)及GS2p (DQ124212)基因序列,设计特异性克隆引物(表 1),提取叶片、籽粒等不同部位RNA,利用HiscriptⅡ1st Strand cDNA Synthesis Kit (Vazyme)逆转录为cDNA。以此为模板,利用Phanta EVO Super-Fidelity DNA Polymerase (TaKaRa)进行PCR扩增:95 ℃预变性3 min;95 ℃变性15 s,GS1 67 ℃/GSr 51 ℃/GSe 60 ℃/GS2p 57 ℃退火15 s,72 ℃延伸35 s,循环35次后72℃延伸7 min。利用Mini BEST DNA Fragment Purification Kit Ver.4.0 (TaKaRa)纯化扩增产物,然后连接T载体,转化DH5α,筛选阳性克隆送华大基因公司测序鉴定。
表 1 GS同工酶克隆的特异性引物Table 1 The specific cloning primers of GS isoenzymes
| Primer | Primer sequence (5'–3') |
| GS1a-S | ACCCGCCTTCCTTCCTGC |
| GS1a-A | CGATGATGCGACCTACCTAAGC |
| GSr1-S | CATTCCCTCCTTGCGAG |
| GSr1-A | AAATGGAAACACGAAACG |
| GSe1-S | GAAGAAGAAGAAGAGGTAGCCATG |
| GSe1-A | AACAGAACCCATCAAAGCCAC |
| GS2a-S | GCGGAGTAAGTAAGTAAGCAGC |
| GS2a-A | CATGCGGAGCGGTTCTAC |
表选项
1.3 表达载体构建据测序结果设计无缝克隆引物(表 2)。以重组质粒为模板进行PCR扩增:95 ℃预变性2 min;95 ℃变性15 s,72 ℃退火25 s,72 ℃延伸35 s,30个循环后72 ℃延伸7 min。PCR产物纯化后,使用Clon Express One Step Cloning Kit (Vazyme)构建pET-21a重组载体,转化DH5α,筛选阳性克隆并进行DNA测序鉴定。提取pET-21a重组质粒转化Rosetta,挑取阳性单克隆,接种于5 mL LB液体培养基(含1 mmol/L羧苄青霉素Car、34 μg/mL氯霉素Cm),37 ℃、220 r/min培养过夜,将菌种分管保存于–80 ℃。
表 2 GS同工酶无缝克隆引物Table 2 One step cloning primers of GS isoenzymes
| Primer | Primer sequence (5'–3') |
| GS1-S | CTTTAAGAAGGAGATATACATATGGCGCTCCTCACCGATCTCC |
| GS1-A | TGCTCGAGTGCGGCCGCAAGCTTGGGCTTCCACAGGATGGTGGTCTC |
| GSr-S | CTTTAAGAAGGAGATATACATATGGCCAGCCTCGCCGACC |
| GSr-A | TGCTCGAGTGCGGCCGCAAGCTTGAGGAGGAGCGTGGTCTCGGCG |
| GSe-S | CTTTAAGAAGGAGATATACATATGTCTCCGCTCGCCGACCTTC |
| GSe-A | TGCTCGAGTGCGGCCGCAAGCTTCTTGCCATTGGAGAGACCGGCC |
| GS2-S | CTTTAAGAAGGAGATATACATATGCTCGGCCCGGAGACCACCG |
| GS2-A | TGCTCGAGTGCGGCCGCAAGCTTTACCTTCAGCGCCAGCTTCTTGGC |
| GS2p-S | CTTTAAGAAGGAGATATACATATGGCGCAGGCGGTGGTGC |
| GS2p-A | TGCTCGAGTGCGGCCGCAAGCTTTACCTTCAGCGCCAGCTTCTTGGC |
表选项
1.4 GS同工酶原核表达取上述菌种5 μL接入5 mL LB液体培养基(含1 mmol/L Car、34 μg/mL Cm),于37 ℃、220 r/min过夜活化。取活化菌液4 mL接入100 mL LB液体培养基(含上述浓度抗生素),扩大培养至OD600达0.6时,加入IPTG至终浓度1 mmol/L。分别于30 ℃、180 r/min诱导3 h、5 h、7 h后取样10 mL,离心收集菌体,用1 mL裂解液(含10 mmol/L Tris, 10 mmol/L MgCl2,0.05% Triton X-100,100 μg/mL PMSF,pH 7.5)悬浮菌体,超声波破碎后于4 ℃、13 000 r/min离心30 min,取出上清;沉淀用1 mL裂解液悬浮。利用SDS-PAGE分离菌体裂解液、菌体裂解液上清和沉淀中的蛋白质,利用Quantity One分析目的蛋白含量。在37 ℃、30 ℃、25 ℃、16 ℃等不同温度下诱导表达,并利用SDS-PAGE检测诱导后不同时间点菌体裂解液上清和沉淀中的蛋白表达情况,以确定最佳诱导条件。
1.5 RNA提取和RT-qPCR分析取诱导3 h后的上述菌液1 mL,离心沉淀菌体,用细菌总RNA提取试剂盒(生工生物工程(上海)有限公司)提取RNA,逆转录获得相应的cDNA。利用SYBR Green Mix (Vazyme)进行RT-qPCR扩增:95 ℃预变性5 min;95 ℃变性15 s,55 ℃退火30 s,72 ℃延伸20 s,共40个循环,利用iQ5 Multicolor Real-Time PCR Detection system (Bio-Rad)检测产物荧光信号(引物见表 3)。以 E. coli RecA基因为内参,采用2–??Ct法计算基因的相对表达量。
表 3 GS同工酶qPCR引物Table 3 qPCR primers of GS isoenzymes
| Primer | Primer sequence (5'–3') |
| GS1-qPCR-S | AAGGACGGCGGGTTCAA |
| GS1-qPCR-A | GCGATGTGCTCCTTGTGCTT |
| GSr-qPCR-S | GAGGACAGCGAAGTCATCCTCTA |
| GSr-qPCR-A | AGGTTGTCACCCCTCCTGAA |
| GSe-qPCR-S | CTGTGACTGCTATGCGCCTAAC |
| GSe-qPCR-A | CCGCGTTGTACCGCTTGT |
| GS2-qPCR-S | GGTTGACAGGGCTACACGAGA |
| GS2-qPCR-A | GAGCAGCCACGGTTCGC |
| RecA-S | CTTGCGGCACGTATGATGAG |
| RecA-A | GCAGCGTGTTGGACTGCTTC |
表选项
1.6 翻译起始区二级结构预测利用RNA Structure 5.3对GS同工酶重组载体翻译起始区100 nt (–30 nt–+70 nt)的mRNA二级结构和自由能(?G)进行分析预测[19-20]。
1.7 Western blotting鉴定GS同工酶利用SDS-PAGE分离蛋白样品,然后转移至PVDF膜上,利用小麦GS多克隆抗体检测GS同工酶的特异表达,使用Bio-Rad Clarity Western ECL试剂盒显色[21-22],用Chemi DocTM XRS+ Imaging System (Bio-Rad)扫描试验结果。
1.8 酶活测定分别挑3个含GS同工酶的阳性克隆,在最佳诱导条件下诱导,取10 mL菌液离心,沉淀菌体加入1 mL裂解液悬浮,超声破碎后离心取上清(方法同前)测定GS酶活[23]。
2 结果与分析2.1 GS同工酶在大肠杆菌中的表达特点30 ℃下,GS同工酶在Rosetta菌株中表达特点各不相同(图 1A)。与诱导前(0)相比,诱导后GS1和GSr在约41 kDa处出现大量特异表达的蛋白,与融合蛋白理论值一致,且GS1于诱导7 h后表达量达最大,约占细菌总蛋白的22%;GSr于诱导3 h后表达量达最大,约占菌体总蛋白的15%。GSe在41 kDa处出现一条微弱的蛋白带,与融合蛋白理论值一致。GS2在44 kDa处出现诱导蛋白带,与融合蛋白理论值一致,且诱导后3–7 h差异不大,约占细菌总蛋白的12%。GS2p没有出现特异的诱导蛋白带。Western blotting进一步证明,GSe的确微量表达,而GS2p无表达(图 1B)。可见,高度同源的GS同工酶在原核细胞中的表达水平存在明显差异,这些差异可能与基因序列的差异有关。
 |
| 图 1 GS同工酶在表达菌株E. coli Rosetta中的表达(A)及Western blotting鉴定(B) Figure 1 Prokaryotic expression of GS isoenzymes in E. coli Rosetta cell (A) and identification of recombinant protein GS by Western blotting (B) |
| 图选项 |
2.2 GS同工酶在大肠杆菌中的转录水平由于GS同工酶在Rosetta菌株中表达量差异很大,我们提取了诱导3 h的细菌RNA,利用RT-qPCR检测了GS同工酶的相对转录水平。结果显示,GSr的mRNA表达量为7.59,远远高于GS1 (1.00)、GSe (1.46)、GS2 (1.84)及GS2p (1.66),后4个基因的mRNA水平相近。可见,GS同工酶的蛋白质翻译与转录水平不一致,原核生物蛋白质表达量不是由相应的mRNA量决定。
2.3 GS同工酶翻译起始区二级结构预测原核生物基因表达没有时空差异,即转录与翻译同时进行。只有出现像终止子那样稳定的二级结构才会影响蛋白质的翻译。利用RNA Structure 5.3预测了GS同工酶原核表达载体翻译起始区mRNA二级结构及维持二级结构的自由能。结果表明,同工酶翻译起始区二级结构的自由能为:GS1 (14.4) < GSr (17.2) < GS2 (22.6) < GSe (25.4) < GS2p (31.6)。GS1的mRNA二级结构自由能最小,最不稳定,蛋白质表达量最高;GS2p的mRNA二级结构自由能最大,在SD序列及ATG附近都形成了稳定的发夹结构,蛋白质翻译无法起始(图 2)。可见,mRNA二级结构越不稳定,越有利于暴露核糖体结合位点和起始密码子ATG,有利于核糖体与mRNA结合,从而提高翻译起始效率[24]。
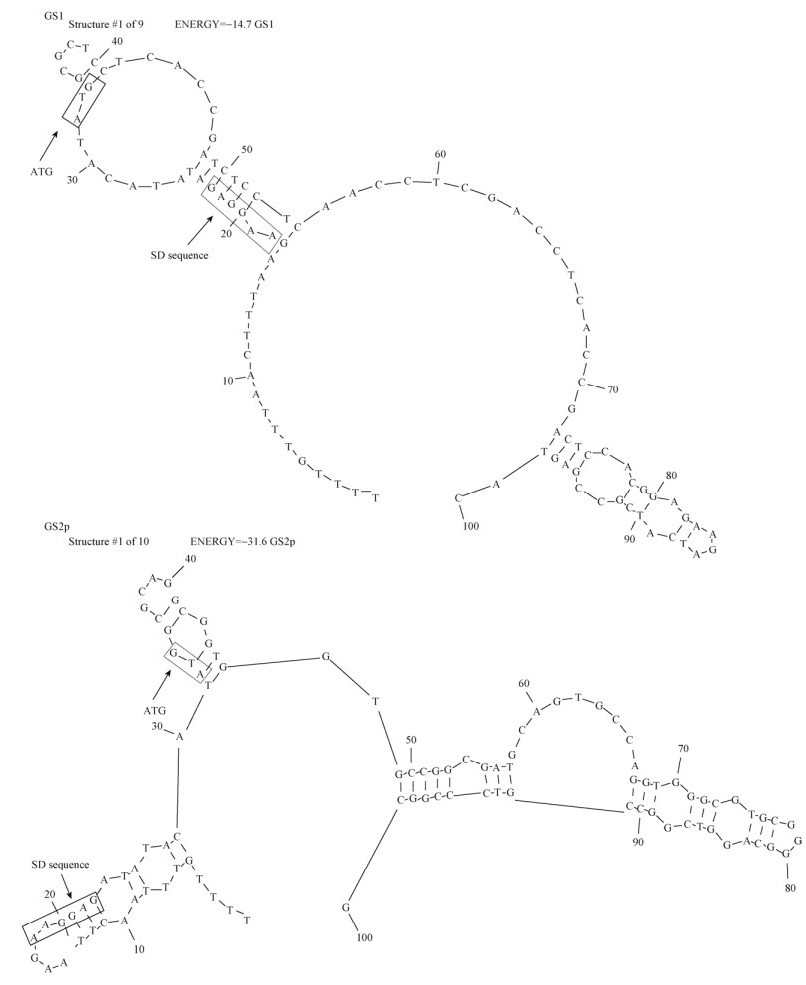 |
| 图 2 GS1和GS2p翻译起始区mRNA二级结构 Figure 2 The secondary structure of mRNA translation initiation region of GS1 and GS2p |
| 图选项 |
2.4 GS同工酶原核表达条件优化及可溶性分析翻译起始区稳定的mRNA二级结构不利于起始翻译,影响蛋白表达量。适当升高温度可能有助于打开mRNA的二级结构,提高翻译起始效率,增加蛋白表达量。但是,如果外源蛋白表达过快可能形成包涵体,影响蛋白质的活性,需要降低培养温度以降低外源蛋白表达速率,增加外源蛋白的可溶性。
GS1于30 ℃诱导5 h后不仅有较大的表达量,且可溶性蛋白含量最高。在30 ℃下诱导,GSr大量表达且为包涵体;在25 ℃及20 ℃下诱导,GSr主要表达产物为包涵体;16 ℃诱导6 h以后,GSr可溶性表达量逐渐升高,诱导15 h后可溶性GSr占比达到最大。尽管降低诱导温度可以增加外源蛋白的可溶性,但随着诱导温度的降低,外源蛋白表达量减少,需要延长诱导时间以获得较多的外源蛋白。GSe在37 ℃下诱导的表达量明显高于30 ℃,且主要为可溶性蛋白,并于诱导后5 h含量达最高。在30 ℃下诱导,GS2主要为包涵体;在25 ℃下诱导,GS2的可溶性表达比例增加,并于诱导7 h后蛋白量达最大(图 3)。GS2p在37 ℃、30 ℃、25 ℃及20 ℃下诱导均无表达。
 |
| 图 3 重组GS同工酶在Rosetta中诱导表达条件的优化(s指上清,p指沉淀) Figure 3 Optimization of induction conditions for inducible expression of GS isoenzymes. "s" is supernatant, and "p" is precipitation |
| 图选项 |
2.5 原核表达GS同工酶的活性收获最佳表达条件下的菌体1 mL,破碎后测定上清液中相应的GS同工酶活性。结果表明,GS1、GSe及GS2均有活性,GSr无活性;酶活性大小为GS1 > GSe > GS2 (图 4A)。Western blotting分析显示,GS1含量最高,GSe含量最低,GS2与GSr蛋白含量相近(图 4B)。可见,原核表达GS同工酶蛋白含量与酶活性不一致,可能与小麦中GS同工酶修饰有关。
 |
| 图 4 最佳诱导条件下重组GS的全酶活测定(A)及表达量鉴定(B) Figure 4 Determination of recombinant protein GS activity (A) and identification of recombinant protein GS by Western blotting (B) under the condition of the best induction |
| 图选项 |
3 讨论同源性很高的GS同工酶在相同的原核表达载体、受体菌株及诱导条件下,蛋白表达却差异极大,推测GS同工酶基因存在调控位点控制蛋白质的表达。首先是稀有密码子的数量与分布,稀有密码子分析发现,GSr、GSe和GS2p基因5′端均存在连续的稀有密码子。当受体菌株是BL21(DE3) plyss时,GS1和GS2表达,而GSr、GSe和GS2p不表达(图 5);当受体菌株为Rosetta时,显著提高GSr和GSe的表达。但是突变GSe基因中的稀有密码子AGGAGG (又似SD序列)为大肠杆菌偏爱的密码子(CGTCGT),并没有提高其表达量(图 6)。其次是翻译起始区mRNA的二级结构。由于GSr转录水平远高于GSe、GS2及GS2p,均高于GS1,与蛋白表达水平不一致,鉴于原核生物基因边转录边翻译的特点,推测翻译起始区mRNA的二级结构影响翻译效率。利用RNA Structure 5.3分析包含载体SD序列到起始密码子下游的100 nt序列,发现GS1翻译起始区的mRNA二级结构最不稳定,GS1表达量最高;GS2p翻译起始区的mRNA二级结构最稳定,GS2p无表达。当将GS2p构建在PET28a载体时,由于N端含有载体的融合肽,即使在BL21(DE3) plyss菌株中也大量表达(图 7),进一步证明mRNA二级结构的稳定性影响翻译效率。尽管原核与真核基因表达调控机制不同,但在小麦中GS2、GSr和GS1表达量较高,与原核表达相似,是否基因编码区序列本身也参与真核基因表达调控是一个非常有趣的科学问题。
 |
| 图 5 GS同工酶在BL21(DE3) plyss菌株中的表达 Figure 5 Prokaryotic expression of GS isoenzymes in BL21(DE3) plyss cell |
| 图选项 |
 |
| 图 6 PET-21a-GSe-tu在Rosetta菌株中的表达(s指上清,p指沉淀) Figure 6 Prokaryotic expression of PET-21a-GSe-tu in Rosetta cell. "s" is supernatant, and "p" is precipitation |
| 图选项 |
 |
| 图 7 PET-28a-GS2p在BL21(DE3) plyss菌株中的表达 Figure 7 Prokaryotic expression of PET-28a-GS2p in BL21(DE3) plyss cell at 16℃ |
| 图选项 |
GS同工酶基因不仅影响其在原核中的蛋白质表达量,还影响蛋白质表达方式。GS1在30 ℃下诱导5 h主要为可溶性蛋白,GSr在20–30 ℃诱导均表达为包涵体蛋白,在16 ℃诱导15 h为可溶性蛋白,但表达量极少;37 ℃诱导提高GSe的表达,且为可溶性蛋白。推测温度升高有利于打开mRNA的二级结构,提高翻译效率,温度降低抑制蛋白质翻译,促进蛋白质可溶表达。也可能是GS同工酶组装的方式不同,原核细胞没有GSr组装的条件,所以才以包涵体形式存在。
真核生物新生蛋白质需要不同程度的加工修饰才能变为有活性的成熟蛋白,大肠杆菌缺少蛋白加工修饰机制,这可能就是原核表达的GS在酶活性水平与蛋白水平不一致的原因。GSe虽然蛋白含量低,但却具有较高的酶活水平,可能是GSe在小麦中修饰的较少;GSr虽然表达量高,却没有GS催化活性,可能是GSr在小麦中翻译后需要较多的加工修饰才能形成有活性的结构。
目前,利用原核表达GS并成功解析其结晶三维结构的基因有玉米GS1和苜蓿GS1[25-26],其他GS同工酶的三维结构尚未见报道,可能是由于原核表达的结构不稳定。植物中GS表达量少,纯化复杂,很少用天然蛋白来研究其结构。本研究构建了GS同工酶的原核表达载体,分析了其原核表达特点及其原因,探索了其可溶性表达的条件,为GS同工酶结构研究及特异性抗体的筛选奠定了基础,也为深入研究小麦GS同工酶调控机制奠定了基础。
参考文献
| [1] | Lee PS, Lee KH. Escherichia coli—a model system that benefits from and contributes to the evolution of proteomics.Biotechnol Bioeng, 2003, 84(7): 801–814.DOI: 10.1002/(ISSN)1097-0290 |
| [2] | Nuc P, Nuc K. Recombinant protein production in Escherichia coli.Postepy Biochemii, 2006, 52(4): 448–456. |
| [3] | Dong X, Tang B, Li J, et al. Expression and purification of intact and functional soybean (Glycine max) seed ferritin complex in Escherichia coli.J Microbiol Biotechnol, 2008, 18(2): 299–307. |
| [4] | Daly R, Hearn MT. Expression of heterologous proteins in Pichia pastoris: a useful experimental tool in protein engineering and production.J Mol Recognit, 2005, 18(2): 119–138.DOI: 10.1002/(ISSN)1099-1352 |
| [5] | Chaudhuri TK, Horii K, Yoda T, et al. Effect of the extra N-terminal methionine residue on the stability and folding of recombinant alpha-lactalbumin expressed in Escherichia coli.J Mol Biol, 1999, 285(3): 1179–1194.DOI: 10.1006/jmbi.1998.2362 |
| [6] | Wang JY, Wang TN, Lu L, et al. Research advances in secretary production of recombinant protein using Escherichia coli typeⅠsecretion system and strategies for enhancement of secretion of typeⅠpathway.China Biotechnol, 2014, 34(6): 98–104.(in Chinese). 王靖瑶, 王天女, 卢磊, 等. 大肠杆菌Ⅰ型分泌表达系统研究进展及提高蛋白表达量的策略.中国生物工程杂志, 2014, 34(6): 98-104. |
| [7] | Lu JB, Wei D, Wang YF, et al. High-level expression and single-step purification of recombinant Bacillus anthracis protective antigen from Escherichia coli.Biotechnol Appl Biochem, 2009, 52(2): 107–112.DOI: 10.1042/BA20070245 |
| [8] | Ivanov AV, Korovina AN, Tunitskaya VL, et al. Development of the system ensuring a high-level expression of hepatitis C virus nonstructural NS5B and NS5A proteins.Protein Expr Purif, 2006, 48(1): 14–23.DOI: 10.1016/j.pep.2006.02.011 |
| [9] | Zhang SH, Xing JL, Yao XY, et al. Non-fused expression of HAb18GEF by reducing stability of translational initiation region in mRNA.Chin J Biotech, 2004, 20(2): 175–180.(in Chinese). 张思河, 邢金良, 姚西英, 等. 降低mRNA翻译起始区的稳定性原核非融合表达HAb18GEF.生物工程学报, 2004, 20(2): 175-180. |
| [10] | Qu YP, Zhang ZJ, Wang CL, et al. Expression, purification and characterization of arabinose-5-phosphate isomerase from Arabidopsis thaliana.Chin J Biotech, 2016, 32(8): 1060–1069.(in Chinese). 屈亚平, 张智俊, 王超莉, 等. 拟南芥阿拉伯糖-5-磷酸异构酶的原核表达、纯化及酶催化特性.生物工程学报, 2016, 32(8): 1060-1069. |
| [11] | Lei RY, Qiao YH, Yan JD, et al. Soluble expression of recombinant human BMP6 in Escherichia coli and its purification and bioassay in vitro.Chin J Biotech, 2008, 24(3): 452–459.(in Chinese). 雷荣悦, 乔玉欢, 闫继东, 等. 重组人BMP6在大肠杆菌中可溶表达、纯化及活性分析.生物工程学报, 2008, 24(3): 452-459. |
| [12] | Kusano M, Tabuchi M, Fukushima A, et al. Metabolomics data reveal a crucial role of cytosolic glutamine synthetase 1; 1 in coordinating metabolic balance in rice.Plant J, 2011, 66(3): 456–466.DOI: 10.1111/j.1365-313X.2011.04506.x |
| [13] | Miflin BJ, Habash DZ. The role of glutamine synthetase and glutamate dehydrogenase in nitrogen assimilation and possibilities for improvement in the nitrogen utilization of crops.J Exp Bot, 2002, 53(370): 979–987.DOI: 10.1093/jexbot/53.370.979 |
| [14] | Bernard SM, M ller AL, Dionisio G, et al. Gene expression, cellular localisation and function of glutamine synthetase isozymes in wheat (Triticum aestivum L.).Plant Mol Biol, 2008, 67(1/2): 89–105. |
| [15] | Forde BG, Cullimore JV. The molecular biology of glutamine synthetase in higher plants.J Postgrad Med, 1989, 34(2): 67–71. |
| [16] | Bernard SM, Habash DZ. The importance of cytosolic glutamine synthetase in nitrogen assimilation and recycling.New Phytol, 2009, 182(3): 608–620.DOI: 10.1111/nph.2009.182.issue-3 |
| [17] | Goodall AJ, Kumar P, Tobin AK. Identification and expression analyses of cytosolic glutamine synthetase genes in barley (Hordeum vulgare L.).Plant Cell Physiol, 2013, 54(4): 492–505.DOI: 10.1093/pcp/pct006 |
| [18] | Keys AJ. The re-assimilation of ammonia produced by photorespiration and the nitrogen economy of C3 higher plants.Photosynth Res, 2006, 87(2): 165–175.DOI: 10.1007/s11120-005-9024-x |
| [19] | Zhang J, Shi XF, Liu CQ. Secondary structure of Yeast genomic downstream region and polyadenylation signals.Prog Biochem Biophys, 2001, 28(4): 523–527.(in Chinese). 张静, 石秀凡, 刘次全. Yeast基因下游二级结构与多聚腺苷作用信号.生物化学与生物物理进展, 2001, 28(4): 523-527. |
| [20] | Ganoza MC, Kofoid EC, Marlière P, et al. Potential secondary structure at translation-initiation sites.Nucleic Acids Res, 1987, 15(1): 345–360.DOI: 10.1093/nar/15.1.345 |
| [21] | Zhang ZY, Xiong SP, Wei YH, et al. The role of glutamine synthetase isozymes in enhancing nitrogen use efficiency of N-efficient winter wheat.Sci Rep, 2017, 7: 1000.DOI: 10.1038/s41598-017-01071-1 |
| [22] | Zhang YW, Ye J, Shi N, et al. Experimental research on protein immunoblot assay.Exp Technol Manag, 2008, 25(10): 35–37.(in Chinese). 张燕婉, 叶珏, 时那, 等. 蛋白质免疫印迹技术的实验研究.实验技术与管理, 2008, 25(10): 35-37.DOI:10.3969/j.issn.1002-4956.2008.10.010 |
| [23] | Ma XM, Li L, Zhao P, et al. Effect of water control on activities of nitrogen assimilation enzymes and grain quality in winter wheat.Acta Phytoecol Sin, 2005, 29(1): 48–53.(in Chinese). 马新明, 李琳, 赵鹏, 等. 土壤水分对强筋小麦"豫麦34"氮素同化酶活性和籽粒品质的影响.植物生态学报, 2005, 29(1): 48-53. |
| [24] | Li SX, Han R, Yuan LL, et al. Analysis of rare codon and mRNA structure about ustilago maydis CYP51 and molecular docking with fungicide tebuconazole.Prog Biochem Biophys, 2011, 38(8): 751–758.(in Chinese). 李书祥, 韩睿, 袁利玲, 等. 玉米黑粉菌CYP51稀有密码子和mRNA二级结构分析及与杀菌剂戊唑醇分子对接.生物化学与生物物理进展, 2011, 38(8): 751-758. |
| [25] | Unno H, Uchida T, Sugawara H, et al. Atomic structure of plant glutamine synthetase: a key enzyme for plant productivity.J Biol Chem, 2006, 281(39): 29287–29296.DOI: 10.1074/jbc.M601497200 |
| [26] | Torreira E, Seabra AR, Marriott H, et al. The structures of cytosolic and plastid-located glutamine synthetases from Medicago truncatula reveal a common and dynamic architecture.Acta Crystallogr D Biol Crystallogr, 2014, 70: 981–993.DOI: 10.1107/S1399004713034718 |
