

复旦大学 生命科学学院, 上海 200438
收稿日期:2018-07-11;接收日期:2018-09-13; 网络出版时间:2018-10-18 基金项目:教育部“基础学科拔尖学生培养计划”研究课题经费(Nos.20180202, 20160804), 复旦大学本科生学术研究资助计划(FDUROP)资助
摘要:转录因子及启动子是基因回路的基础。相较于原核启动子, 真核启动子作用机制复杂, 增加了全新设计与改造的难度。目前有限数量的真核转录因子及启动子成为在哺乳动物细胞中设计并实现复杂基因回路以满足各类临床或工业应用需求的瓶颈。文中介绍了基于能够结合特定DNA序列的DNA结合结构域, 通过柔性连接肽连接到转录抑制模块KRAB, 构建抑制型转录因子以及通过在SV40启动子下游插入结合序列构建对应启动子的方法。而后, 在哺乳动物细胞系中通过流式细胞术对其抑制转录的强度、不同转录因子及启动子对之间的正交性进行了测定。文中提供了一套标准化的、可调节的转录因子及启动子的全新设计与构建方案。基于该方案所构建的5对抑制型转录因子及启动子对能够在哺乳动物细胞中起到不同程度的抑制效果且相互正交。文中构建的哺乳动物转录因子及启动子对扩充了哺乳动物生物元件库, 为构建复杂真核基因回路打下了基础; 运用该设计方法能够根据需求构建更多正交的人工转录因子及启动子对。
关键词:真核转录调控人工转录因子人工启动子合成生物学生物元件
De novo construction of mammalian synthetic inhibitory transcription factor and promoter pairs
Yang Zijie, Pan Yijie, Cai Yiming, Fu Tong, Feng Ao, Liu Yan, Wang Yiheng, Xiong Xinxuan, Cai Liang


School of Life Sciences, Fudan University, Shanghai 200438, China
Received: July 11, 2018; Accepted: September 13, 2018; Published: October 18, 2018
Supported by: National Top Talent Undergraduate Training Program of Ministry of Education of China (Nos.20180202, 20160804), Fudan's Undergraduate Research Opportunities Program
Corresponding author:Liang Cai.Tel:+86-21-31246727; E-mail:cail@fudan.edu.cn
*These authors contributed equally to the study.
Abstract: Transcriptional regulation is crucial for regulated gene expression.Due to the complexity, it has been difficult to engineer eukaryotic transcription factor (TF) and promoter pairs.The few availabilities of eukaryotic TF and promotor pairs limit their practical use for clinical or industrial applications.Here, we report a de novo construction of synthetic inhibitory transcription factor and promoter pairs for mammalian transcriptional regulation.The design of synthetic TF was based on the fusion of DNA binding domain and Kruppel associated box transcription regulating domain (KRAB).The synthetic promoter was constructed by inserting the corresponding TF response element after SV40 promoter.We constructed and tested five synthetic inhibitory transcription factor and promoter pairs in cultured mammalian cells.The inhibition capability and orthogonality were verified by flow cytometry.In summary, we demonstrate the feasibility of constructing mammalian inhibitory TF and promoter pairs, which could be standardized for advanced gene-circuit design and various applications in the mammalian synthetic biology.
Keywords: eukaryotic transcription regulationsynthetic transcription factorsynthetic promotersynthetic biologyBio-Brick
真核转录因子及启动子是真核生物基因表达调控的基础元件之一;在各层次的调控中,转录水平的调控十分重要[1]。大部分真核启动子受结合其特定DNA序列的蛋白质调控[2]。启动子作为转录网络信息节点,不仅对基因的表达起到了开关的作用,同时也影响着转录的动力学[3]。
真核转录因子及启动子对基因表达的调控主要分为两种方式:1)转录因子招募RNA聚合酶并起始转录[4]的激活型转录调控;2)阻碍RNA聚合酶与DNA结合以阻碍转录发生[5]的抑制型调控。相较于激活型转录调控,抑制型转录调控在实现细胞内复杂的基因回路中具有更加重要意义。近些年,合成生物学研究的进展,实现了利用抑制型转录调控元件构建负反馈信号通路从而加速信号达到稳态的时间[6]、双稳态开关[7]、振荡器[8]、基于三节点非协调前馈环的带通信息传递[9]、布尔逻辑运算[10]等,然而上述的进展多集中在原核细胞中,真核细胞尤其是在哺乳动物细胞中能够被使用的抑制型转录调控元件十分有限。
在构建人工基因回路时,需要考虑宿主的内源信号对构建的基因回路的干扰;通过使用跨物种启动子或者使用人工合成的启动子,使得设计的基因回路信号与宿主基因回路信号正交,是维持系统鲁棒性的关键[11]。在设计转录因子及启动子时,需要关注不同转录因子及启动子间的正交性,以确保网络间的节点不会相互干扰。
通过结合特异DNA序列的蛋白,比如锌指蛋白(Zinc finger,ZF)[12],或者转录激活因子样效应物(Transcription activator-like effector,TALE)[13]以及规律成簇间隔短回文重复(Clustered regularly interspaced short palindromic repeats,CRISPR)[14]技术都能够构建特异识别某个DNA位点并实现转录激活或者抑制的元件,即实现人工设计的转录因子及启动子对。因为转入到哺乳动物细胞中的外源基因大小是有限的,小尺寸的ZF有望在有限长度的回路中实现更复杂的调控网络,成为本研究的首选。本研究中使用的三重复的ZF在理论上最多能够识别49个不同序列的DNA结合结构域(DNA binding domain,DBD),提供了极大的可能性来满足系统的正交性。
本研究基于人工合成的ZF并融合了转录抑制模块KRAB,配合在SV40启动子后插入能够被人工合成的ZF所特异性结合的DNA序列,构建了能够在哺乳动物细胞中应用的抑制型人工转录因子及启动子对。文中总结了人工转录因子启动子对的设计范式,并检验了其在哺乳动物细胞系中应用的抑制能力以及正交性。这样的人工转录因子及启动子对的构建为实现复杂的真核转录网络提供了崭新的机遇。
1 材料与方法1.1 菌株、细胞系与载体大肠杆菌DH5α感受态细胞购自天根生物公司;HeLa及293T细胞由实验室保存;pSB1C3载体取自2017 iGEM distribution kit (plate 4 4B,BBa_J04450);pML2-EGFP-P2A和pML2-mCherry-N1载体由实验室保存。
1.2 试剂及耗材DNA限制性内切酶EcoRⅠ、SpeⅠ、XbaⅠ、PstⅠ、MfeⅠ、Hind Ⅲ、AgeⅠ和T4 DNA连接酶、DNA marker购自NEB公司;Phanta高保真PCR酶购自Vazyme公司;细胞转染试剂Lipofectamine 2000购自Thermo公司;质粒小提试剂盒和胶回收试剂盒购自Axygen公司;高糖DMEM培养基购自Gibco公司;NaCl购自BBI公司;蛋白胨和酵母膏购自OXOID公司。
1.3 抑制型启动子(SynPro)构建人工合成抑制型启动子(SynPro)由SV40启动子与不同重复数量的转录因子结合位点(REs)组成,其序列如表 1所示。在启动子及REs前端加上前缀序列(GAATTCGCGGCCGCTTCT AG),包含保护碱基以及EcoRⅠ、XbaⅠ酶切位点;在后端加上后缀序列(TACTAGTAGCGGCC GCTGCAG),包含保护碱基以及SpeⅠ、PstⅠ酶切位点。将REs分成两份:一份使用EcoRⅠ、SpeⅠ内切酶37 ℃酶切1 h并胶回收得到前置片段;一份使用XbaⅠ、PstⅠ内切酶37 ℃酶切1 h并胶回收得到后置片段;将pSC1C3载体利用EcoRⅠ、PstⅠ内切酶37 ℃酶切1 h并胶回收得到线性化载体;将前置片段与后置片段以及线性化pSC1C3载体利用T4 DNA连接酶在16 ℃连接10 h以上。
表 1 DBD序列以及对应转录因子结合位点(RE)序列Table 1 DBDs and their corresponding REs
| DBD | GI/PMID | RE | RE sequence (5′–3′) |
| Gal4 | 1145799716 | UAS | GGAGCACTGTCCTCCGAACG |
| PIP | 11062442 | PIR | GAAATAGCGCTGTACAGCGTATGGGAATCTCTTGTACGGTGTACGAGTATCTTCCCGTACACCGTAC |
| ZFHD1 | 1063691901 | ZFHD1RE | TAATGATGGGCG |
| ZF21-16 | 22323524 | ZF21-16RE | ATTAGAAGTGA |
| ZF42-10 | 22323524 | ZF42-10RE | AGACGCTGCTC |
| ZF43-8 | 22323524 | ZF43-8RE | AGAGTGAGGAC |
| ZF54-8 | 22323524 | ZF54-8RE | ATGGGTGGCAT |
表选项
由于SpeⅠ与XbaⅠ是同尾酶,所以能够将前置序列与后置序列连接在载体上形成两次重复的转录因子结合位点(2×Es),并且2×REs的前后缀都被保留。利用前缀引物与后缀引物进行PCR得到2×REs序列,重复上述过程并替换前后置序列得到N次重复转录因子结合序列(N×REs)。将前置序列替换为SV40启动子,后置序列为N×REs,能够得到抑制型启动子pSV40-N×REs。在本研究中,利用上述方法构建了2×RES、4×REs、8×REs片段。
其中,SV40启动子由PCR扩增自pQM6.2质粒(本实验室保存),4×UAS由PCR扩增自LR041质粒(iGEM 2017 Tsinghua-A队伍提供),其余REs片段由IDT公司以gBlock形式合成。连接产物转化到DH5α感受态细胞中并涂布于含氯霉素抗性的固体LB培养基上,37 ℃下培养14 h。重组克隆都通过Sanger测序验证正确。
1.4 人工合成抑制型转录因子(Syn-TFs)构建在KRAB序列前添加核定位信号(PKKKRKV)与柔性连接肽G4S (GGGGS),构成(G4S)-NLS- KRAB片段。转录因子DNA结合结构域(DNA binding domain,DBD)的DNA序列如表 1所示,通过PCR将DBD与(G4S)-NLS-KRAB片段融合,构成抑制型转录因子编码序列DBD-(G4S)-NLS- KRAB。其中,KRAB (RTLVT FKDVF VDFTR EEWKL LDTAQ QIVYR NVMLE NYKNL VSLGY QLTKP DVILR LEKGE EPWLV)片段由PCR扩增自LR041 (iGEM 2017 Tsinghua-A队伍提供),DBD片段由IDT公司以gBlock形式合成。
1.5 表达载体构建通过PCR在抑制型启动子pSV40-N×REs 5′端加上AgeⅠ酶切位点以及保护碱基;利用EcoRⅠ、AgeⅠ内切酶37 ℃酶切1 h并胶回收合成启动子片段;用EcoRⅠ、AgeⅠ内切酶37 ℃酶切1 h并胶回收得到pML2-mCherry-N1线性化的载体;用T4 DNA连接酶在16 ℃连接10 h以上,得到由抑制型启动子驱动mCherry表达的pML2-pSV40-N×REs真核表达载体(质粒B;图 2A)。
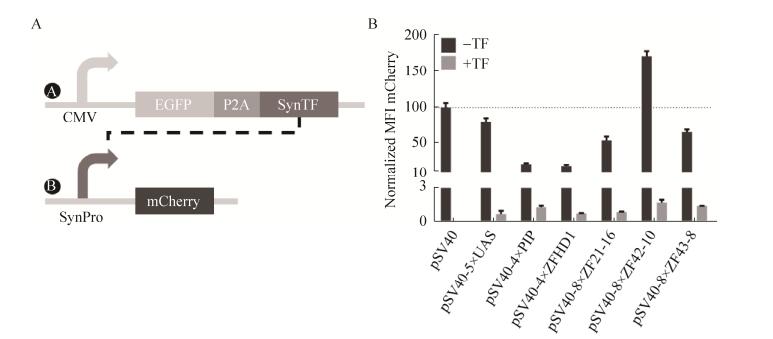 |
| 图 2 双质粒双荧光测试系统示意图以及测试结果 Figure 2 2-plasmid 2-fluorescence test for SynTF-SynPro. (A) The 2-plasmid 2-fluorescence test for SynTF-SynPro transcriptional inhibition capability. (B) Basal and silenced expression of SynPro(S) by cognated SynTF. The mCherry fluorescent intensity was normalized (n=3, data presented are x±s). |
| 图选项 |
通过PCR在抑制型转录因子DBD-(G4S)-NLS- KRAB 3′端加上MfeⅠ酶切位点及保护碱基,在5′端加上Hind Ⅲ酶切位点以及保护碱基;用MfeⅠ、Hind Ⅲ内切酶37 ℃酶切1 h并胶回收合成转录因子片段;用MfeⅠ、Hind Ⅲ内切酶37 ℃酶切1 h并胶回收得线性化载体pML2-EGFP-P2A;用T4 DNA连接酶在16 ℃连接10 h以上,得到EGFP-P2A与DBD-(G4S)-NLS-KRAB编码序列融合的真核表达载体pML2-EGFP-P2A- DBD-(G4S)-NLS-KRAB (质粒A;图 2A)。
1.6 细胞培养293T细胞和HeLa细胞都是在含有10% FBS的DMEM (Gibco)中培养,培养基中还添加有终浓度为每毫升100单位青霉素、100 μg链霉素和2 mmol/L谷氨酸。培养条件为37 ℃、5% CO2。
1.7 流式细胞分析HeLa细胞或293T细胞在密度达70%左右的时候对其进行pML2-pSV40-N×REs与pML2-EGFP- P2A-DBD-(G4S)-NLS-KRAB质粒的两两配对共转染。在转染24 h后报告基因mCherry的表达量由流式细胞仪(FASCJazz,BD)对红色荧光强度测量(每种实验条件至少记录20 000个双色细胞的荧光强度)。流式数据使用FlowJo 10软件进行分析。以共转染了CMV-EGFP和pSV40-mCherry的细胞群体的EGFP平均荧光强度(MFI,Mean fluorescence intensity)作为内参,按照如下公式对各组的mCherry MFI进行校正处理:
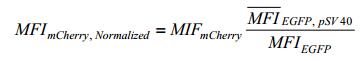 |
 |
| 图 1 SynTF-SynPro的设计 Figure 1 Design SynTF-SynPro. (A) Wiring silencing- and activating-form SynTF-SynPro. G4S, a flexible protein linker. NLS, SV40 nuclear localization signal. N×RE, responding elements in N repeat. (B) Synthetic DBD based on synthetic ZF. Three ZF motifs were illustrated. The 4 oligo DNA sequences outlined are the RE sequences corresponding to ZF21-16, ZF43-8, ZF42-10 and ZF54-8. |
| 图选项 |
设计高性能人工转录因子及启动子即SynTF-SynPro对的关键步骤是寻找特异性高、结合力强的DBD。为了扩充可以供哺乳动物细胞使用的DBD,将在其他物种中研究较为透彻的转录因子优化后应用到哺乳动物细胞中是很好的策略。通过这种方法选择出了3个不同来源的DBD序列Gal4[19]、PIP[20]、ZFHD1[21]用于构建SynTF。此外,已被良好表征的DBD数量不能满足构建多种SynTF-SynPro对的需求,故而利用能够对3个相邻碱基进行特异性识别的锌指蛋白(Zinc finger,ZF)的顺序连接来实现对多种特异的多位DNA位点进行识别[12],构建可在哺乳动物细胞应用的合成ZF (Synthetic ZF)。通过将三串联Cys2-His2 ZF[22]作为锌指蛋白底盘,替换ZF[22]上和DNA相互作用有关的氨基残基[23],构建了多种ZF以便进一步的测试(图 1B)。
2.2 SynTF-SynPro的分子克隆和抑制能力测试表 2列出了所有完成的SynTF-SynPro对。为方便描述,以pSV40-N×RE的形式命名SynPro(S),其中,N指插入RE的重复数,RE的名称用DBD-KRAB的名称替代。
表 2 完成的SynTF-SynPro对Table 2 Completed SynTF-SynPros
| SynTF (S) | SynPro (S) |
| SynTF(S)-Gal4-KRAB | pSV40-4×Gal4 |
| SynTF(S)-PIP-KRAB | pSV40-2×PIP |
| pSV40-4×PIP | |
| pSV40-8×PIP | |
| SynTF(S)-ZFHD1-KRAB | pSV40-4×ZFHD1 |
| SynTF(S)-ZF21-16-KRAB | pSV40-8×ZF21-16 |
| SynTF(S)-ZF42-10-KRAB | pSV40-8×ZF42-10 |
| SynTF(S)-ZF43-8-KRAB | pSV40-2×ZF43-8 |
| pSV40-4×ZF43-8 | |
| pSV40-8×ZF43-8 | |
| SynTF(S)-ZF54-8-KRAB | pSV40-8×ZF54-8 |
表选项
通过双质粒双荧光测试系统(图 2A)能够检测SynTF-SynPro对是否工作。其中,质粒A搭载有强启动子CMV所转录的EGFP和SynTF,使得SynTF表达充分。P2A将EGFP与SynTF相连,使得SynTF的表达量和EGFP相同[24]。由此,通过测量EGFP的表达量能够表征SynTF的表达量。质粒B搭载由SynPro所转录的mCherry,通过测量mCherry的表达量能够表征SynPro在不同条件下的表达强度。EGFP和mCherry的荧光强度由流式细胞仪测量;在设备参数一致的情况下,可以通过比较样品间的荧光强度衡量彼此间表达量的差异。
在构建的7个SynTF(S)-SynPro(S)对中,有6对通过了双质粒双荧光的抑制能力测试(图 2B)。能够工作的SynPro(S)在共转染对应SynTF(S)的情况下(图 2B的浅色柱状图),相较于未转染对应的SynTF(S)的情况下(图 2B的深色柱状图) mCherry的表达水平显著降低。说明SynTF(S)的存在降低了SynProS(S)所转录的mCherry的表达量,即抑制了对应的SynPro(S)的转录。未被抑制的SynPro(S)的表达强度较被抑制的组相比要高15–106倍不等(5×UAS:106倍;4×PIP:15倍;4×ZFHD1:22倍;8×ZF21-16:57倍;8×ZF42-10:98倍;8×ZF43-8:44倍)。除了ZF42-10,其余SynPro(S)基础表达水平相对于pSV40都有所降低。
2.3 SynTF-SynPro对正交性测试在同时使用多个SynTF-SynPro对设计复杂回路时,为了能够在转录水平实现回路间的互不干扰,SynTF-SynPro对需要互相正交。使用交叉配对的双质粒双荧光测试,即分别向HeLa细胞中共转染配对与非配对的SynTF(S)与SynPro(S),使用流式细胞仪器测量mCherry的荧光强度并计算出抑制效果,对5对能正常工作的SynTF-SynPro对进行了正交性测试。在正交性热图中,每一个格子的颜色深浅和数值代表了在共同转染了SynTF后的归一化SynPro表达水平。其中,左上到右下对角线上的网格最暗,代表了只有在共转染配对SynTF时,SynPro的表达水平最低,即非配对SynTF的抑制效果总是比配对SynTF的抑制效果差:因此,这5个SynTF-SynPro对都是互相正交的(图 3)。其中常用的3种DBD (Gal4、PIP、ZFHD1)正交表现良好。与依赖于ZF构建的SynTF(S)-SynPro(S)对相比,搭载了天然DBD对应RE的SynPro(S)的表达水平相对较低。值得注意的是,右下角的灰色框内的pSV40-8×ZF21-16和pSV40-8×ZF43-8在配对的SynTF存在的情况下,表达被充分抑制,但在加入非对应的SynTF时,仍维持较高的基本表达。图底两行右侧的格子说明基于合成ZF设计的几种SynPro(S)在非配对的SynTF存在的情况下有较高的表达水平,但是在存在配对的ZF时维持着较低的表达水平。综上,基于ZF设计的SynPro(S)几乎不会与非对应DBD相互作用,具有较好的特异性和较大的抑制倍率。
 |
| 图 3 SynTF-SynPro对的正交性测试结果 Figure 3 SynTF-SynPro orthogonality testing. Each grids stand for the expression fold of mCherry after normalized (n=3, data are x±s). Data are recorded by FACS at 24 h after co-transfecting the corresponding SynTF and SynPro. Grids with dark grey background show a tight inhibition, while light grey grids show a high expression level and low interaction. |
| 图选项 |
ZF42-10在没有共转染对应转录因子的时候,其表达水平就显著高于pSV40启动子的基础表达水平,无法使用(图 2B)。ZF42-10基础表达水平高,有可能是因为细胞内源蛋白能够和ZF42-10相互作用,起到转录激活的效果。
3 结论与讨论基于天然转录因子的DBD或人工ZF以及其对应的RE,文中提供了一套标准化的人工转录因子及启动子的设计方案。利用这一套方案,成功构建了若干抑制型的人工合成的转录因子及启动子。通过双质粒双荧光测试,共有5对SynTF-SynPro对(Gal4、PIP、ZFHD1、ZF21-16、ZF43-8)具有较好的抑制效果并且相互正交。本研究完成的转录因子及启动子对扩充了哺乳动物细胞能够利用的合成生物学元件库。同时,这些SynTF-SynPro对具有不同的抑制强度,可利用类似的方法设计更多性质不同的SynTD-SynPro对,用于设计复杂的哺乳动物基因回路。
在此基础上,利用激活型的转录调节结构域,例如VP64[4],能够构建正交的激活型SynTF-SynPro对(图 1A);相较于在酵母中利用锌指蛋白构建可定制的激活型转录因子及启动子[23],本研究拓宽了构建转录因子时DBD的选择范围,并将抑制型人工转录因子及启动子应用到了哺乳动物细胞中并验证了其可用性,扩大了人工转录因子及启动子的应用范围。
本研究的工作仅局限在对转录因子的抑制稳态进行测试,缺乏转录动力学性质的测试,有待后续实验进一步完善。此外,RE的重复数量、RE到启动子的距离对转录强度的影响是两个值得关注的问题,能否通过调节重复数量或者启动子与编码框的距离,实现对抑制型转录因子的抑制效果的调整,也是值得跟进的研究。
随着ZF的高通量开发技术OPEN[25-26]和CoDA[27]的实现以及锌指蛋白数据库(Zinc finger database) [28]的建立,今后人们能够更好地利用ZF高度模块化的特性,通过选择不同的DBD和RE组合,构建出数量庞大且性能优异的哺乳动物人工转录因子及启动子对,从而在哺乳动物细胞中利用合成生物学手段实现复杂的功能,如哺乳动物逻辑门的构建、细胞水平的计算等。现阶段的原核生物逻辑门的构建利用了启动子组合构建二元布尔逻辑门[10];在真核生物中,利用特定启动子配合转录后调控也能实现多种逻辑运算[29]。利用SynTF-SynPro对的转录活性的正交性,本研究中构建的标准化、可调节的转录因子及启动子设计方案,有望为将来复杂回路的构建打下基础,实现真核细胞内完全的逻辑计算。
团队简介:
iGEM 2017 Fudan团队是于2017年代表复旦大学参加iGEM大赛的代表队之一。团队内学生共计8人,包括队长杨子杰和7名队员(潘祎杰、蔡毅鸣、傅彤、冯骜、刘燕、王一恒、熊心旋);主要为2015级复旦大学本科生。团队指导老师蔡亮和卢大儒,来自生命科学学院。团队于2017年初成立。在2017年iGEM大赛准备中,团队成员积极合作,相互促进,共同进步,最终夺得2017年最佳治疗项目。赛后,团队成员继续致力于iGEM理念的推广,在校内外多项活动中表现突出。
 |
参考文献
| [1] | Thieffry D, Huerta AM, Pérez-Rueda E, et al. From specific gene regulation to genomic networks:a global analysis of transcriptional regulation in Escherichia coli.Bioessays, 1998, 20(5): 433–440.DOI: 10.1002/(SICI)1521-1878(199805)20:5<>1.0.CO;2-T |
| [2] | Latchman DS. Transcription factors:an overview.Int J Biochem Cell Biol, 1997, 29(12): 1305–1312.DOI: 10.1016/S1357-2725(97)00085-X |
| [3] | Voss TC, Hager GL. Dynamic regulation of transcriptional states by chromatin and transcription factors.Nat Rev Genet, 2014, 15(2): 69–81.DOI: 10.1038/nrg3623 |
| [4] | Beerli RR, Segal DJ, Dreier B, et al. Toward controlling gene expression at will:specific regulation of the erbB-2/HER-2 promoter by using polydactyl zinc finger proteins constructed from modular building blocks.Proc Natl Acad Sci USA, 1998, 95(25): 14628–14633.DOI: 10.1073/pnas.95.25.14628 |
| [5] | Witzgall R, O'leary E, Leaf A, et al. The Krüppel-associated box-A (KRAB-A) domain of zinc finger proteins mediates transcriptional repression.Proc Natl Acad Sci USA, 1994, 91(10): 4514–4518.DOI: 10.1073/pnas.91.10.4514 |
| [6] | Mangan S, Itzkovitz S, Zaslaver A, et al. The incoherent feed-forward loop accelerates the response-time of the gal system of Escherichia coli.J Mol Biol, 2006, 356(5): 1073–1081.DOI: 10.1016/j.jmb.2005.12.003 |
| [7] | Gardner TS, Cantor CR, Collins JJ. Construction of a genetic toggle switch in Escherichia coli.Nature, 2000, 403(6767): 339–342.DOI: 10.1038/35002131 |
| [8] | Elowitz MB, Leibler S. A synthetic oscillatory network of transcriptional regulators.Nature, 2000, 403(6767): 335–338.DOI: 10.1038/35002125 |
| [9] | Basu S, Gerchman Y, Collins CH, et al. A synthetic multicellular system for programmed pattern formation.Nature, 2005, 434(7037): 1130–1134.DOI: 10.1038/nature03461 |
| [10] | Tamsir A, Tabor JJ, Voigt CA. Robust multicellular computing using genetically encoded NOR gates and chemical 'wires'.Nature, 2011, 469(7329): 212–215.DOI: 10.1038/nature09565 |
| [11] | Andrianantoandro E, Basu S, Karig DK, et al. Synthetic biology:new engineering rules for an emerging discipline.Mol Syst Biol, 2006, 2(1): 2006.0028. |
| [12] | Lohmueller JJ, Armel TZ, Silver PA. A tunable zinc finger-based framework for Boolean logic computation in mammalian cells.Nucleic Acids Res, 2012, 40(11): 5180–5187.DOI: 10.1093/nar/gks142 |
| [13] | Szulc J, Wiznerowicz M, Sauvain MO, et al. A versatile tool for conditional gene expression and knockdown.Nat Methods, 2006, 3(2): 109–116.DOI: 10.1038/nmeth846 |
| [14] | Gaber R, Lebar T, Majerle A, et al. Designable DNA-binding domains enable construction of logic circuits in mammalian cells.Nat Chem Biol, 2014, 10(3): 203–208.DOI: 10.1038/nchembio.1433 |
| [15] | Farzadfard F, Perli SD, Lu TK. Tunable and multifunctional eukaryotic transcription factors based on CRISPR/Cas.ACS Synth Biol, 2013, 2(10): 604–613.DOI: 10.1021/sb400081r |
| [16] | Chen XY, Zaro JL, Shen WC. Fusion protein linkers:property, design and functionality.Adv Drug Deliv Rev, 2013, 65(10): 1357–1369.DOI: 10.1016/j.addr.2012.09.039 |
| [17] | Urrutia R. KRAB-containing zinc-finger repressor proteins.Genome Biol, 2003, 4(10): 231.DOI: 10.1186/gb-2003-4-10-231 |
| [18] | Morsut L, Roybal KT, Xiong X, et al. Engineering customized cell sensing and response behaviors using synthetic notch receptors.Cell, 2016, 164(4): 780–791.DOI: 10.1016/j.cell.2016.01.012 |
| [19] | Fussenegger M, Morris RP, Fux C, et al. Streptograminbased gene regulation systems for mammalian cells.Nat Biotechnol, 2000, 18(11): 1203–1208.DOI: 10.1038/81208 |
| [20] | Pomerantz JL, Sharp PA, Pabo CO. Structure-based design of transcription factors.Science, 1995, 267(5194): 93–96.DOI: 10.1126/science.7809612 |
| [21] | Moore M, Klug A, Choo Y. Improved DNA binding specificity from polyzinc finger peptides by using strings of two-finger units.Proc Natl Acad Sci USA, 2001, 98(4): 1437–1441.DOI: 10.1073/pnas.98.4.1437 |
| [22] | Klug A. The discovery of zinc fingers and their applications in gene regulation and genome manipulation.Ann Rev Biochem, 2010, 79(1): 213–231. |
| [23] | Khalil AS, Lu TK, Bashor CJ, et al. A synthetic biology framework for programming eukaryotic transcription functions.Cell, 2012, 150(3): 647–658.DOI: 10.1016/j.cell.2012.05.045 |
| [24] | Szymczak-Workman AL, Vignali KM, Vignali DA. Design and construction of 2A peptide-linked multicistronic vectors.Cold Spring Harb Protoc, 2012, 2012(2): 199–204. |
| [25] | Maeder ML, Thibodeau-Beganny S, Sander JD, et al. Oligomerized pool engineering (OPEN):an 'open-source' protocol for making customized zinc-finger arrays.Nat Protoc, 2009, 4(10): 1471–501.DOI: 10.1038/nprot.2009.98 |
| [26] | Maeder ML, Thibodeau-Beganny S, Osiak A, et al. Rapid "Open-Source" engineering of customized zinc-finger nucleases for highly efficient gene modification.Mol Cell, 2008, 31(2): 294–301.DOI: 10.1016/j.molcel.2008.06.016 |
| [27] | Sander JD, Dahlborg EJ, Goodwin MJ, et al. Selection-free zinc-finger-nuclease engineering by context-dependent assembly (CoDA).Nat Methods, 2011, 8(1): 67–69.DOI: 10.1038/nmeth.1542 |
| [28] | Fu F, Voytas DF. Zinc Finger Database (ZiFDB) v2.0:a comprehensive database of C2H2 zinc fingers and engineered zinc finger arrays.Nucleic Acids Res, 2013, 41(D): D452–D455. |
| [29] | Ausl?nder S, Ausl?nder D, Müller M, et al. Programmable single-cell mammalian biocomputers.Nature, 2012, 487(7405): 123–127.DOI: 10.1038/nature11149 |
