
 , 康振1,2
, 康振1,2

1 江南大学 生物工程学院 工业生物技术教育部重点实验室,江苏 无锡 214122;
2 江南大学 生物工程学院 糖化学与生物技术教育部重点实验室,江苏 无锡 214122
收稿日期:2018-02-07;接收日期:2018-04-25; 网络出版时间:2018-05-14 基金项目:轻工技术与工程国家一流学科项目(No. LITE2018-16),****和创新团队发展计划(No. IRT_15R26)资助
摘要:葡萄糖二酸是一种高附加值天然有机酸,已经广泛应用于疾病防治、生产聚合物材料等领域。在葡萄糖二酸的合成途径中,肌醇加氧酶MIOX所催化的肌醇转换为葡萄糖醛酸的过程是整个途径的限速步骤。通过应用将葡萄糖二酸浓度与绿色荧光蛋白荧光强度相结合的筛选系统,从突变体文库中筛选出3株有潜力的肌醇加氧酶突变体(K59V/R60A、R171S和D276A),使MIOX活性得到提高。重组菌株Escherichia coli BL21(DE3)/MU-R171S的葡萄糖二酸产量相比于未突变菌株提高了36.5%。
关键词:葡萄糖二酸 肌醇加氧酶 生物传感器 高通量筛选
Construction of a glucaric acid biosensor for screening myo-inositol oxygenase variants
Cui Wang1, Ye Liu1, Xu Gong1, Long Liu1,2

 , Zhen Kang1,2
, Zhen Kang1,2

1 Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu, China;
2 Key Laboratory of Carbohydrate Chemistry and Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu, China
Received: February 7, 2018; Accepted: April 25, 2018; Published: May 14, 2018
Supported by: The National First-class Discipline Program of Light Industry Technology and Engineering (No. LITE2018-16), the Program for Chang Jiang Scholar and Innovative Research Team in University (No. IRT_15R26)
Corresponding author:Long Liu. Tel: +86-510-85918312; Fax: +86-510-85918309; E-mail: longliu@jiangnan.edu.cn
Zhen Kang. Tel: +86-510-85918307; Fax: +86-510-85918309; E-mail: zkang@jiangnan.edu.cn
Abstract: Glucaric acid (GA), a top value-added chemical from biomass, has been widely used for prevention and control of diseases and the production of polymer materials. In GA biosynthesis pathway, the conversion of inositol to glucuronic acid that catalyzed by myo-inositol oxygenase is the limiting step. It is necessary to improve MIOX activity. In the present study, we constructed a high-throughput screening system through combing the concentration of GA with the green fluorescent protein fluorescence intensity. By applying this screening system, three positive variants (K59V/R60A, R171S and D276A) were screened from the mutant library. In comparison, the recombinant strain Escherichia coli BL21(DE3)/MU-R171S accumulated more GA, 136.5% of that of the parent strain.
Keywords: glucaric acid Myo-inositol oxygenase biosensor high-throughput screening
葡萄糖二酸在一些水果、蔬菜及哺乳动物中均有发现,特别是在一些十字花科蔬菜(如花椰菜、苜蓿芽等)、水果(樱桃、葡萄柚、柑橘等)中含量丰富[1]。葡萄糖二酸与其衍生物早在1996年就已被证实在疾病防治方面具有潜在应用价值,包括降低胆固醇[2]、用于癌症化疗,并能以葡萄糖二酸钙的形式作为一种膳食补充剂[3-4]。葡萄糖二酸已成功用于生产一种羟基化的尼龙,产生可降解的纤维[5]。众多附加应用使得葡萄糖二酸在2004年被美国能源部确认为“最具价值的生物炼制产品”之一[6]。
葡萄糖二酸的生产主要依赖使用硝酸为氧化剂的葡萄糖化学氧化法[7],该方法存在耗费大量试剂、污染环境等问题,故国内外研究人员纷纷寻求通过生物法生产该物质。Prather团队通过在大肠杆菌Escherichia coli中异源表达途径酶肌醇加氧酶MIOX和醛酸脱氢酶Udh,成功构建了葡萄糖二酸合成途径,实现了葡萄糖二酸在E. coli中的生物合成[8] (图 1)。随后该团队研究人员将该葡萄糖二酸合成途径转移至酿酒酵母Saccharomyces cerevisiae中,使以葡萄糖为底物的产量提高至0.98 g/L[9]。Liu等以毕赤酵母Pichia pastoris为宿主构建葡萄糖二酸合成途径,通过添加肌醇使产量达到(6.61±0.30) g/L[10]。Lee等通过构建环形支架聚合木聚糖内切酶Xyn、α-葡萄糖醛酸酶AG和醛酸脱氢酶Udh,提高了半纤维素水解率并氧化获得葡萄糖二酸[11]。
 |
| 图 1 重组E. coli葡萄糖二酸合成途径[8] Figure 1 The glucaric acid biosynthesis pathway in recombinant E. coli[8]. |
| 图选项 |
在重组E. coli葡萄糖二酸合成途径中,葡萄糖首先通过磷酸烯醇式丙酮酸依赖性磷酸转移酶系统(Phosphoenolpyruvate-dependent phosphotransferase)形成葡萄糖-6-磷酸,之后葡萄糖-6-磷酸通过肌醇-1-磷酸合成酶(Inositol-1-phosphate synthase,Ino1)的作用异构化为肌醇-1-磷酸。在脱磷酸酶(Inositol monophosphate 1-phosphatase)水解作用下肌醇-1-磷酸脱去磷酸基团生成肌醇。肌醇通过来自小鼠的肌醇氧化酶(Myo-inositol oxygenase,MIOX)和来自丁香假单胞菌Pseudomonas syringae的醛酸脱氢酶(Udh)的催化氧化生成葡萄糖二酸。此外,E. coli中存在葡萄糖醛酸和葡萄糖二酸的代谢途径,uxaC基因编码的糖醛酸异构酶(Glucuronate isomerase)催化葡萄糖醛酸生成果糖醛酸,果糖醛酸进一步转化后进入磷酸戊糖途径;gudD基因编码的葡萄糖二酸脱水酶(Glucarate dehydratase)催化葡萄糖二酸生成5-脱氢-4-脱氧-D-葡萄糖二酸,进一步反应进入二羧酸代谢途径。
葡萄糖二酸的人工合成途径中,催化肌醇转换为葡萄糖醛酸的MIOX的活性与Ino1和Udh相比较低,同时稳定性差[12]、容易失活,发酵培养过程中只在对数生长期具有较高活性,进入稳定期后活性迅速降低[8],故MIOX所催化的反应被认为是二酸合成途径中的限速步骤。研究人员采取了一些策略来提高代谢通量:Dueber等利用合成支架将Ino1、MIOX和Udh按比例装配成聚合体,强化前体肌醇的合成,提高了葡萄糖二酸的产量[13];Shiue等在MIOX的N端添加蛋白融合标签提高其水溶性[14];Liu等使用连接肽将MIOX和Udh进行融合表达,提高MIOX的比酶活[10]。目前,这些改造策略都能提高葡萄糖二酸的产量,但对MIOX的活力及稳定性提高有限,依然无法满足应用要求,因此,通过蛋白质工程策略,构建突变体文库,通过大规模筛选获得最佳的MIOX突变体对于提高葡萄糖二酸的产量具有很大意义。
MIOX酶活力的检测需要菌体裂解制备酶液,与底物反应后进行地衣酚显色测670 nm吸光度。这一过程操作繁琐、耗时且具有破坏性[8]。研究结果表明提高MIOX酶活力可提高葡萄糖二酸的产量,应用不同来源的MIOX时葡萄糖二酸的产量也不同,可通过葡萄糖二酸的产量来反映MIOX突变体的酶活力[15-16]。常用的葡萄糖二酸含量检测方法是利用硼酸凝胶结合葡萄糖二酸,与发酵液中的杂质分离后用高效液相色谱检测[8],该方法操作也较复杂,且硼酸凝胶价格昂贵,不适用于大规模筛选。若能将胞内代谢物与相应传感器和报告基因进行偶联,使胞内代谢物浓度转化为便于检测的荧光信号,就可对胞内代谢物浓度进行实时监测[16]。每个细胞以正比于其生产特定化合物的速度表达荧光蛋白或抗生素抗性基因,就可通过内部代谢物浓度和报告基因表达之间的联系来筛选最理想的细胞[17],从而缩短设计-构建-检测的周期。与之相比,已有的多数诱导系统缺乏对感应速度和程度的表征而只能以0或1的形式运作,产生的信息足以用于过表达潜在的毒性基因,却无法用于探测细胞行为、精确控制基因表达[18]。
荧光检测方法可利用已知的变构转录调节蛋白响应一些常见的代谢中间体,如丙酮酸[19]、磷酸烯醇丙酮酸[20]、柠檬酸盐[21]、乳酸[22]、不饱和脂肪酸[23]等。通过小分子传感器的选择或筛选,已经产生了新的酶和基因组来提高目标代谢产物的产量[24-27]。已得到良好表征并应用较广泛的传感器有LacI[28]、TetR[29]、AraC[30]、LuxR[31]等,其他可用的有PrpR[32]、RhaRS[33]、CymR[34]、XylS[35]、AcuR[36]、CdaR、MphR[37]、TtgR[38-39]等。
其中CdaR (Carbohydrate diacid regulator)是一种来自E. coli的转录激活因子,参与调节E. coli葡萄糖二酸和粘酸分解代谢酶的表达。这些酶的编码基因分布于3个转录单元中,包括葡萄糖二酸脱水酶、粘酸脱水酶、5-酮-4-脱氧-D-葡糖二酸醛缩酶、羟基丙二酸半醛还原酶和己糖二酸转运蛋白[40]。对不同碳源存在下的葡萄糖二酸脱水酶、粘酸脱水酶、甘油酸激酶和羟基丙二酸半醛还原酶的活性分析发现葡萄糖二酸和粘酸代谢系统受协同调节。通过对E. coli MC4100进行甲基磺酸乙酯突变和蓝白斑筛选、测序,最终在3个转录单元之外找到了葡萄糖二酸和粘酸代谢的共同调节基因——cdaR [41]。对其进行Tn5插入失活会损伤E. coli对葡萄糖二酸、粘酸和甘油酸的代谢[42],此外计算机分析显示该基因产物是具有保守螺旋-转角-螺旋结构域的蛋白,可与其他基因调节蛋白如XylR[43]被归为一类。cdaR基因编码的是非活性的变构转录激活蛋白,受葡萄糖二酸、粘酸或甘油酸激活后转变为活性形式,结合到gudP启动子的调控序列后发挥变构调节作用,启动下游基因的转录。
据此,本研究以绿色荧光蛋白为报告基因,在E. coli中构建响应葡萄糖二酸的指示系统,测试诱导物浓度与荧光强度的关系,并构建葡萄糖二酸合成途径,将葡萄糖二酸指示系统应用于对mMIOX突变体的高通量筛选。
1 材料与方法1.1 材料1.1.1 质粒与菌株本研究所用菌株和质粒均为作者所在实验室购买和保藏,详见表 1。
表 1 本研究所用质粒和菌株Table 1 Plasmids and strains used in this study
| Name | Description | Source |
| Plasmids | ||
| pHTC-gfp | pHTC derivate with gene gfp following P43 | [44] |
| pUC57-mM | pUC57 carrying codon-optimized MIOX from mouse, Apr | [10] |
| pRSFDuet-gudP-gfp | pRSFDuet-1 Carrying gene gfp driving by gudP promoter | This study |
| pRSFDuet-Pgfp-cdaR | pRSFDuet-1 Carrying gene gfp driving by gudP promoter and coding sequence of cdaR | This study |
| pETDuet-mM-U | pETDuet-1 carrying gene mMIOX and udh | This study |
| Strains | ||
| E. coli BL21 (DE3)/pRSFDuet-1 | E. coli BL21 (DE3) derivate, harboring plasmid pRSFDuet-1 | This study |
| E. coli BL21 (DE3)/gudP-gfp | E. coli BL21 (DE3) derivate, harboring plasmid pRSFDuet-gudP-gfp | This study |
| E. coli BL21 (DE3)/Pgfp-cdaR | E. coli BL21 (DE3) derivate, harboring plasmid pRSFDuet-Pgfp-cdaR | This study |
| E. coli BL21 (DE3) /Pgfp-cdaR-MU | E. coli BL21 (DE3) derivate, harboring plasmid pRSFDuet-Pgfp-cdaR and pETDuet-mM-U | This study |
| E. coli BL21 (DE3)/MU | E. coli BL21 (DE3) derivate, harboring plasmid pETDuet-mM-U | This study |
表选项
1.1.2 试剂PrimerSTAR Max DNA聚合酶、DNA marker、Solution I、E. coli Competent Cell Preparation Kit均购自TaKaRa (大连);2×Taq PCR Master Mix购自南京诺唯赞科技有限公司;限制性内切酶、GeneJET Gel Extraction Kit及GeneJET PCR Purification Kit购自Thermo Fisher Scientific公司;PCR引物(见表 2)由上海睿迪有限公司合成;SanPrep柱式质粒小量抽提试剂盒购自上海Sangon有限公司;易错PCR试剂盒购自Agilent Technologies有限公司。肌醇、葡萄糖二酸钾色谱级标准品购自Sigma-Aldrich公司。其他试剂均购自国药控股有限公司。
表 2 本研究中所用引物序列Table 2 Primers used in this study
| Primers | Sequences (5′–3′) |
| p23119-CdaR-F | TGCACTGCAGTTGACAGCTAGCTCAGTCCTAGGTATAATGCTAGCGGATCCAAGGAGGAAAAAAAATGGCTGGCTGGCATCTTGATA |
| p23119-CdaR-R | CCGCTCGAGCTACCGCTCTTCATCCAGTTGTA |
| gudP-F | CGGACTAGTATGCTGTTGATTGACGCCAGTG |
| gudP-R | TGTTGCACTCCTGAAAATTCGC |
| gfp-F | GCGAATTTTCAGGAGTGCAACAATGGGTAAGGGAGAAGAACTTTT |
| gfp-R | AAAAGTACTTTATTTGTATAGTTCATCCATGCCA |
| MIOX-F | CATGCCATGGGCATGAAGGTCGACGTAGGTCCAGATC |
| MIOX-R | CCCAAGCTTTTACCAGGACAGAGTGCCAGGG |
| Udh-F | GGGAATTCCATATGATGACCACTACCCCCTTCAATCGC |
| Udh-R | CGGGGTACCTTAGTTGAACGGGCCGGCCAC |
| Mut-MIOX-F | AAGAAGGAGATATACCATGGGCATG |
| Mut-MIOX-R | TTATGCGGCCGCAAGCTTTTA |
表选项
1.1.3 培养基LB培养基(g/L):胰蛋白胨10,酵母粉5,氯化钠10。制备固体培养基时添加2%的琼脂。
1.2 方法1.2.1 基因的扩增和质粒的构建以E. coli MG1655基因组为模板,利用引物对p23119-CdaR-F/R扩增得到带有启动子P23119的调节蛋白基因cdaR,用引物gudP-F和gudP-R扩增启动子序列gudP。以pHTC-gfp为模板,用引物gfp-F和gfp-R扩增基因gfp。将扩增得到的片段gudP和gfp进行融合PCR,得到融合片段gudP-gfp,使用限制性酶切位点SpeⅠ和ScaⅠ对其进行双酶切,连接到具有相应切口的质粒pRSFDuet-1上,连接后得到质粒pRSFDuet-gudP- gfp。使用限制性酶切位点PstⅠ和XhoⅠ对cdaR片段进行双酶切,连接到具有相应切口的质粒pRSFDuet-gudP-gfp上,连接后的质粒命名为pRSFDuet-Pgfp-cdaR。
以从恶臭假单胞菌Pseudomonas putidaKT2440中提取的基因组DNA为模板,用引物对Udh-F/R扩增得到基因udh,将此片段使用限制性酶切位点NdeⅠ和KpnⅠ进行双酶切,连接到具有响应切口的质粒pETDuet-1上,连接后得到质粒pETDuet-U;以pUC57-mM质粒为模板,用引物对MIOX-F/R扩增得到小鼠来源的MIOX基因,将该片段使用限制性酶切位点NcoⅠ和Hind Ⅲ进行双酶切,连接到具有相应切口的质粒pETDuet-U上,连接后得到质粒pETDuet-mM-U。
1.2.2 E. coli的转化E. coli感受态制备参见E. coli Competent Cell PreparationKit (TaKaRa大连)使用说明书。
1.2.3 突变MIOX和筛选以pUC57-mM质粒为模板,使用引物对Mut-MIOX-F/R对mMIOX进行易错PCR,将得到的片段使用限制性酶切位点NcoⅠ和Hind Ⅲ进行双酶切,连接到具有相应切口的质粒pETDuet-U上,连接产物转化E. coli BL21 (DE3)/ Pgfp-cdaR后,挑选单菌落接种到每孔带有200 μL LB液体培养基的96浅孔板中,以未突变的E. coli BL21 (DE3)/Pgfp-cdaR-MU为对照,37 ℃、220 r/min过夜培养后,以10%接种量(V/V)转接到含有IPTG的96孔板LB培养基中,培养12 h后用酶标仪检测,筛选荧光较强的突变株。
1.2.4 MIOX酶活的测定以肌醇作为底物,根据MIOX转化肌醇生成葡萄糖醛酸的含量,检测MIOX的催化活性。MIOX单位酶活定义:1 min内生成1 nmol/L葡萄糖醛酸所需要的酶量。取样将发酵液离心弃上清(5 000 r/min、4 ℃、5 min),用Tris-Cl缓冲液(10 mmol/L,pH 8.0)清洗2遍菌体以消除发酵液中杂质的影响,将菌体重悬在清洗缓冲液中,同时加入等体积1.0 mm硅珠,采用FastPrep-24均质破碎仪破碎,破壁后离心取上清100 μL至1.5 mL EP管内,加入900 μL反应液,立即放入30 ℃恒温金属浴中反应1 h,加入100 μL的30%三氯乙酸终止反应。取上述反应液1 mL加入玻璃比色管内,然后加入2 mL苔黑素试剂,混匀后,在沸水中反应15 min。当反应物冷却至室温时,在670 nm下测量吸光度。
葡萄糖醛酸标准曲线的绘制:分别配置浓度为4、8、12、16、20、24 mg/L的葡萄糖醛酸标准溶液及苔黑素试剂(在10 mL的浓盐酸中加入40 mg苔黑素和5.4 mg FeCl3)。在玻璃比色管内加入1 mL的葡萄糖醛酸标准溶液及2 mL苔黑素试剂,混匀后,在沸水中反应15 min。当反应物冷却至室温时,在670 nm下测量吸光度。以葡萄糖醛酸的浓度作为X轴,以测得的670 nm的吸光度作为Y轴,绘制标准曲线。
将以含有肌醇反应液的吸光度减去不含肌醇反应液的吸光度,得到的差值根据葡萄糖醛酸标准曲线计算得出葡萄糖醛酸的含量,从而计算MIOX酶活。
底物反应液:含有50 mmol/L Tris-HCl (pH 8.0)、2 mmol/L L-半胱氨酸、1 mmol/L Fe(NH4)2(SO4)2和10 g/L肌醇。以不添加肌醇的反应液作为对照。
1.2.5 葡萄糖二酸的测定标准样品的准备:称取一定质量的葡萄糖二酸钾标样,溶于0.1 mol/L磷酸钾缓冲液中,配置终浓度为1 g/L的葡萄糖二酸溶液,将其用0.1 mol/L磷酸钾缓冲液稀释,配置终浓度分别为0.8、0.6、0.4、0.2、0.1 g/L的葡萄糖二酸溶液。
样品的Affi-Gel凝胶处理:取1 mL发酵液在12 000 r/min下离心5 min。取0.9 mL发酵液上清或葡萄糖二酸溶液加入2 mL EP管内,然后加入0.1 mL 1 mol/L磷酸钾缓冲液及50 mg Affi-Gel,漩涡振荡5次,每次停20 min (室温下),然后将样品5 000 r/min离心5 min,弃上清。用1 mL 80 mmol/L磷酸钾-20 mmol/L硼酸缓冲液(pH 7.0)加入到沉淀中,漩涡振荡,离心弃上清(重复3次)。用0.375 mL 0.1 mol/L HCI洗脱2次,混合离心,将上清转移到1.5 mL EP管中,用1 mol/L NaOH调中性(75 μL),加去离子水(75 μL)补足到0.9 mL。经0.22 μm滤膜过滤,供液相分析[8]。
HPLC分析条件:流动相为5 mmol/L稀硫酸,色谱柱为Aminex HPX-87H (美国Bio-Rad),流速0.5 mL/min,柱温55 ℃,进样量10 μL,检测器为紫外检测器(210 nm)。
2 结果与分析2.1 葡萄糖二酸指示系统的构建2.1.1 葡萄糖二酸指示系统重组质粒的构建E. coli MG1655来源的cdaR编码非活性激活蛋白,被葡萄糖二酸激活后结合到启动子调控序列,开启下游基因的转录(图 2)。本研究所构建的质粒应用启动子P23119使得cdaR基因得以组成型表达。培养基中的葡萄糖二酸经酶转运进入胞内后激活CdaR使其转变为活性形式,进而与操纵子区域结合,启动下游结构基因转录,即本研究中作为报告基因的gfp。构建的质粒经过测序验证,命名为pRSFDuet-Pgfp-cdaR (图 3)。
 |
| 图 2 葡萄糖二酸指示系统示意图 Figure 2 Schematic diagram of glucaric acid biosensor. |
| 图选项 |
 |
| 图 3 葡萄糖二酸指示系统重组质粒pRSFDuet-Pgfp-cdaR图谱 Figure 3 The map of glucaric acid biosensor recombinant plasmid pRSFDuet-Pgfp-cdaR. |
| 图选项 |
将带有该指示系统质粒的菌株E. coli BL21 (DE3)/Pgfp-cdaR在LB培养基中培养,以菌株E. coli BL21 (DE3)/pRSFDuet-1和E. coli BL21 (DE3)/gudP-gfp为对照,加入葡萄糖二酸进行诱导后使用酶标仪检测荧光强度,结果如图 4所示,只有同时具有调节蛋白基因cdaR和受其调控的gudP启动子序列的菌株E. coli BL21 (DE3)/Pgfp-cdaR可以在葡萄糖二酸的诱导下产生荧光,表明该指示系统成功构建。在培养基中添加前体物质肌醇和葡萄糖醛酸,与不添加葡萄糖二酸的对照都没有观察到荧光反应,验证了调节蛋白CdaR在该途径中结合葡萄糖二酸的专一性。
 |
| 图 4 不同菌株对葡萄糖二酸的荧光响应 Figure 4 The fluorescence response of different strains to glucaric acid supplement. |
| 图选项 |
2.1.2 葡萄糖二酸浓度与荧光反应强度关系的测定为了研究该指示系统响应葡萄糖二酸的浓度范围,在E. coli BL21 (DE3)/Pgfp-cdaR培养基中加入了梯度浓度的葡萄糖二酸进行诱导。用酶标仪测定了荧光值和600 nm吸光度,归一化荧光值由实验测得的荧光值除以吸光度所得,应用此比值以补偿时间和批次之间细胞密度差异。使用12 h时的归一化荧光值来反映诱导物葡萄糖二酸浓度与荧光反应强度之间的关系,结果如图 5A所示,在0–600 mg/L浓度范围内,绿色荧光蛋白荧光强度与所加的葡萄糖二酸浓度之间呈良好的线性关系,在600–4 000 mg/L浓度范围内(图 5B),荧光反应强度继续随着葡萄糖二酸浓度的增加而增强,外加葡萄糖二酸响应的上限约为4 000 mg/L (19.1 mmol/L),葡萄糖二酸浓度达到4 000 mg/L以上时影响菌体生长。
 |
| 图 5 葡萄糖二酸指示系统的荧光分析 Figure 5 Fluorescence assay of glucaric acid biosensor. |
| 图选项 |
2.2 葡萄糖二酸合成途径的构建为了方便对突变肌醇加氧酶MIOX进行筛选,首先需要在E. coli BL21 (DE3)中构建以肌醇为底物的葡萄糖二酸合成途径。构建表达载体pETDuet-mM-U,以T7启动子分别驱动小鼠来源的肌醇加氧酶(MIOX)和恶臭假单胞菌来源的醛酸脱氢酶(Udh),如图 6所示,并进行了测序验证。
 |
| 图 6 葡萄糖二酸合成途径重组质粒图谱 Figure 6 The map of glucaric acid biosynthesis pathway plasmid pETDuet-mM-U. |
| 图选项 |
将重组菌株E. coli BL21 (DE3)/Pgfp-cdaR-MU接种至液体LB培养基,37 ℃、220 r/min培养过夜,10%接种量(V/V)转接至含有肌醇的LB培养基中(以不添加肌醇为对照),加IPTG后30 ℃、220 r/min培养,24 h取发酵液上清进行液质检测,结果见图 7,在发酵液中检出葡萄糖二酸峰,表明重组菌株中催化肌醇生产葡萄糖二酸的途径构建成功。IPTG诱导后每3 h取样,用酶标仪检测荧光和OD600,菌株E. coli BL21 (DE3)/Pgfp-cdaR-MU添加肌醇的荧光值明显高于未添加肌醇的对照(图 8),表明该菌株中MIOX和Udh实现活性表达,并与葡萄糖二酸指示系统成功偶联,使重组E. coli中葡萄糖二酸的生产转化为荧光信号。
 |
| 图 7 葡萄糖二酸标准品和重组E. coli发酵液上清的质谱检测 Figure 7 Mass spectrum of standard glucaric acid sample and the culture supernatant from recombinant E. coli. (A) Standard GA sample. (B) Culture supernatant of recombinant E. coli BL21 (DE3)/Pgfp-cdaR-MU. |
| 图选项 |
 |
| 图 8 E. coli BL21 (DE3)/Pgfp-cdaR-MU的荧光分析(肌醇10 g/L) Figure 8 Fluorescence assay of E. coli BL21 (DE3) /Pgfp-cdaR-MU (myo-inositol 10 g/L). |
| 图选项 |
2.3 MIOX突变体的筛选使用易错PCR对MIOX进行突变,初筛时使用Qpix挑菌机将突变体接种到96孔板中过夜培养,以10%接种量转接到含有肌醇的LB液体培养基中,IPTG诱导培养12 h后用酶标仪检测,筛选荧光较强的突变株。初筛从3 900株菌中得到7株,经测序后分别为:K59V/R60A、K70E、R171S、Q180V、N205F、P269E、D276A。以未突变菌株E. coli BL21 (DE3)/Pgfp-cdaR-MU作为对照,将初筛得到的菌株采用地衣酚显色法测酶活进行复筛,得到突变体K59V/R60A、R171S、D276A,它们与野生型的酶活分别为(43.17±1.68) U/mL、(54.14±1.02) U/mL、(40.25±1.24) U/mL、(34.71± 0.89) U/mL (图 9)。SDS-PAGE分析结果表明MIOX与其突变体的表达量无明显差异(图 10)。因此,MIOX突变体酶活的增加可能归因于其比活力的提高。
 |
| 图 9 MIOX突变体的酶活及荧光响应 Figure 9 Enzyme activity and fluorescence of MIOX variants. |
| 图选项 |
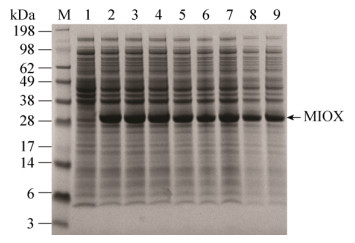 |
| 图 10 SDS-PAGE分析MIOX的表达 Figure 10 SDS-PAGE assay for the expression of MIOX. 1: negative control, E. coli BL21 (DE3)/Pgfp-cdaR cell lysis supernatant; 2: positive control, E. coli BL21 (DE3)/Pgfp- cdaR-MU cell lysis supernatant; 3: E. coli BL21 (DE3)/Pgfp-cdaR-MU-K59V/R60A cell lysis supernatant; 4: E. coli BL21 (DE3)/Pgfp- cdaR-MU-K70E cell lysis supernatant; 5: E. coli BL21 (DE3)/Pgfp-cdaR-MU-R171S cell lysis supernatant; 6: E. coli BL21 (DE3)/Pgfp-cdaR- MU-Q80V cell lysis supernatant; 7: E. coli BL21 (DE3)/Pgfp-cdaR-MU-N205F cell lysis supernatant; 8: E. coli BL21 (DE3)/Pgfp-cdaR-MU-P269E cell lysis supernatant; 9: E. coli BL21 (DE3)/Pgfp-cdaR- MU-D276A cell lysis supernatant. |
| 图选项 |
由于突变体库初筛时采用的是96孔板与摇瓶培养复筛在体积、溶氧等参数方面存在较大的差异,导致初筛获得的突变体在两种不同体系下表现出不同的性状。最终,我们选择在初筛和复筛中都表现较好的突变体K59V/R60A、R171S、D276A开展进一步的研究。
2.4 MIOX突变体对葡萄糖二酸产量的影响将上述突变位点K59V/R60A、R171S、D276A引入E. coli BL21 (DE3)/MU,得到菌株E. coli BL21 (DE3)/MU-K59V/R60A、E. coli BL21 (DE3) /MU-R171S和E. coli BL21 (DE3)/MU-D276A,在含有肌醇的LB培养基中IPTG诱导48 h后葡萄糖二酸产量如图 11所示,依次为(126.69±8.66) mg/L、(172.97±6.08) mg/L、(146.39±6.39) mg/L、(134.65± 8.07) mg/L,提高程度与酶活相近,从而进一步证明MIOX酶活力的提高有助于提高重组菌葡萄糖二酸的产量。
 |
| 图 11 MIOX突变对重组E. coli BL21 (DE3)葡萄糖二酸产量的影响 Figure 11 Effect of MIOX variants on the glucaric acid production in recombinant E. coli BL21 (DE3). |
| 图选项 |
3 结语本研究构建了葡萄糖二酸指示系统,通过结合绿色荧光蛋白和识别葡萄糖二酸的变构调节蛋白CdaR,将重组E. coli中葡萄糖二酸的生产与荧光信号偶联起来。验证了该指示系统与外加的葡萄糖二酸浓度间存在良好的线性关系,并将其应用于肌醇加氧酶MIOX突变体文库的高通量筛选,得到3株具有潜力的突变体,经测序分别为K59V/R60A、R171S和D276A,其中R171S酶活提升最显著,将其应用于重组E. coli中,使葡萄糖二酸的产量提高了36.5%。本研究结果同时说明MIOX在转化肌醇生成葡萄糖二酸的过程中起着重要作用。在前体物质肌醇的合成途径中肌醇- 1-磷酸合成酶(Ino1)也是重要的限速酶,为进一步提高葡萄糖二酸产量,同时降低生产成本,下一步研究可在E. coli中表达肌醇-1-磷酸合成酶基因,构建从葡萄糖到葡萄糖二酸的合成途径,应用葡萄糖二酸指示系统对肌醇-1-磷酸合成酶突变体进行筛选,同时可抑制或敲除各支路代谢途径酶(如糖醛酸异构酶、葡萄糖二酸脱水酶等,图 1),以减少中间产物的消耗,进而增加葡萄糖二酸的积累。
参考文献
| [1] | Dwivedi C, Heck WJ, Downie AA, et al. Effect of calcium glucarate on β-glucuronidase activity and glucarate content of certain vegetables and fruits.Biochem Med Metab Biol, 1990, 43(2): 83–92.DOI: 10.1016/0885-4505(90)90012-P |
| [2] | Walaszek Z, Szemraj J, Hanausek M, et al. D-Glucaric acid content of various fruits and vegetables and cholesterol-lowering effects of dietary D-glucarate in the rat.Nutr Res, 1996, 16(4): 673–681.DOI: 10.1016/0271-5317(96)00045-0 |
| [3] | Singh J, Gupta KP. Calcium glucarate prevents tumor formation in mouse skin.Biomed Environ Sci, 2003, 16(1): 9–16. |
| [4] | Singh J, Gupta KP. Induction of apoptosis by calcium D-Glucarate in 7, 12-Dimethyl Benz.J Environ Pathol Toxicol Oncol, 2007, 26(1): 63–73.DOI: 10.1615/JEnvironPatholToxicolOncol.v26.i1 |
| [5] | Kiely DE, Chen L, Lin TH. Simple preparation of hydroxylated nylons-polyamides derived from aldaric.Polym Agric Coproducts, 1994, 575: 149–158.DOI: 10.1021/symposium |
| [6] | Werpy T, Petersen G, Aden A, et al. Top value added chemicals from biomass. volume 1: results of screening for potential candidates from sugars and synthesis gas.Washington, DC: US Department of Energy, 2004. |
| [7] | Kochkar H, Lassalle L, Morawietz M, et al. Regioselective oxidation of hydroxyl groups of sugar and its derivatives using silver catalysts mediated by tempo and peroxodisulfate in water.J Catal, 2000, 194(2): 343–351.DOI: 10.1006/jcat.2000.2927 |
| [8] | Moon TS, Yoon SH, Lanza AM, et al. Production of glucaric acid from a synthetic pathway in recombinant Escherichia coli.Appl Environ Microbiol, 2009, 75(3): 589–595.DOI: 10.1128/AEM.00973-08 |
| [9] | Gupta A, Hicks MA, Manchester SP, et al. Porting the synthetic D-glucaric acid pathway from Escherichia coli to Saccharomyces cerevisiae.Biotechnol J, 2016, 11(9): 1201–1208.DOI: 10.1002/biot.201500563 |
| [10] | Liu Y, Gong X, Wang C, et al. Production of glucaric acid from myo-inositol in engineered Pichia pastoris.Enzyme Microb Technol, 2016, 91: 8–16.DOI: 10.1016/j.enzmictec.2016.05.009 |
| [11] | Lee CC, Kibblewhite RE, Paavola CD, et al. Production of glucaric acid from hemicellulose substrate by rosettasome enzyme assemblies.Mol Biotechnol, 2016, 58(7): 489–496.DOI: 10.1007/s12033-016-9945-y |
| [12] | Arner RJ, Prabhu KS, Reddy CC. Molecular cloning, expression, and characterization of myo-inositol oxygenase from mouse, rat, and human kidney.Biochem Biophys Res Commun, 2004, 324(4): 1386–1392.DOI: 10.1016/j.bbrc.2004.09.209 |
| [13] | Moon TS, Dueber JE, Shiue E, et al. Use of modular, synthetic scaffolds for improved production of glucaric acid in engineered E. coli.Metab Eng, 2010, 12(3): 298–305.DOI: 10.1016/j.ymben.2010.01.003 |
| [14] | Shiue E, Prather KLJ. Improving D-glucaric acid production from myo-inositol in E. coli by increasing MIOX stability and myo-inositol transport.Metab Eng, 2014, 22: 22–31.DOI: 10.1016/j.ymben.2013.12.002 |
| [15] | Rogers JK, Church GM. Genetically encoded sensors enable real-time observation of metabolite prodcution.Proc Natl Acad Sci USA, 2016, 113(9): 2388–2393.DOI: 10.1073/pnas.1600375113 |
| [16] | Rogers JK, Guzman CD, Taylor ND, et al. Synthetic biosensors for precise gene control and real-time monitoring of metabolites.Nucleic Acids Res, 2015, 43(15): 7648–7660.DOI: 10.1093/nar/gkv616 |
| [17] | van Sint Fiet S, van Beilen JB, Witholt B. Selection of biocatalysts for chemical synthesis.Proc Natl Acad Sci USA, 2006, 103(6): 1693–1698.DOI: 10.1073/pnas.0504733102 |
| [18] | Balagaddé FK, Song H, Ozaki J, et al. A synthetic Escherichia coli predator-prey ecosystem.Mol Syst Biol, 2008, 8: 187. |
| [19] | Ogasawara H, Ishida Y, Yamada K, et al. PdhR (pyruvate dehydrogenase complex regulator) controls the respiratory electron transport system in Escherichia coli.J Bacteriol, 2007, 189(15): 5534–5541.DOI: 10.1128/JB.00229-07 |
| [20] | Cortay JC, Nègre D, Galinier A, et al. Regulation of the acetate operon in Escherichia coli-purification and functional-characterization of the IclR repressor.Embo J, 1991, 10(3): 675–679.DOI: 10.1002/embj.1991.10.issue-3 |
| [21] | Martin MG, Magni C, de Mendoza D, et al. CitI, a transcription factor involved in regulation of citrate metabolism in lactic acid bacteria.J Bacteriol, 2005, 187(15): 5146–5155.DOI: 10.1128/JB.187.15.5146-5155.2005 |
| [22] | Gao C, Hu CH, Zheng ZJ, et al. Lactate utilization is regulated by the fadr-type regulator LldR in Pseudomonas aeruginosa.J Bacteriol, 2012, 194(10): 2687–2692.DOI: 10.1128/JB.06579-11 |
| [23] | Henry MF, Cronan JE, J r. Escherichia coli transcription factor that both activates fatty acid synthesis and represses fatty acid degradation.J Mol Biol, 1991, 222(4): 843–849.DOI: 10.1016/0022-2836(91)90574-P |
| [24] | Dietrich JA, Shis DL, Alikhani A, et al. Transcription factor-based screens and synthetic selections for microbial small-molecule biosynthesis.ACS Synth Biol, 2013, 2(1): 47–58. |
| [25] | Tang SY, Cirino PC. Design and application of a mevalonate-responsive regulatory protein.Angew Chem Int Edit, 2011, 50(5): 1084–1086.DOI: 10.1002/anie.v50.5 |
| [26] | Tang SY, Qian S, Akinterinwa O, et al. Screening for enhanced triacetic acid lactone production by recombinant Escherichia coli expressing a designed triacetic acid lactone reporter.J Am Chem Soc, 2013, 135(27): 10099–10103.DOI: 10.1021/ja402654z |
| [27] | Yang J, Seo SW, Jang S, et al. Synthetic RNA devices to expedite the evolution of metabolite-producing microbes.Nat Commun, 2013, 4: 1413.DOI: 10.1038/ncomms2404 |
| [28] | Gilbert W, Müller-Hill B. Isolation of the lac repressor.Proc Natl Acad Sci USA, 1966, 56(6): 1891–1898.DOI: 10.1073/pnas.56.6.1891 |
| [29] | Lutz R, Bujard H. Independent and tight regulation of transcriptional units in Escherichia coli via the LacR/O, the TetR/O and AraC/I1-I2 regulatory elements.Nucleic Acids Res, 1997, 25(6): 1203–1210.DOI: 10.1093/nar/25.6.1203 |
| [30] | Guzman LM, Belin D, Carson MJ, et al. Tight regulation, modulation, and high-level expression by vectors containing the arabinose PBAD promoter.J Bacteriol, 1995, 177(14): 4121–4130.DOI: 10.1128/jb.177.14.4121-4130.1995 |
| [31] | Canton B, Labno A, Endy D. Refinement and standardization of synthetic biological parts and devices.Nat Biotechnol, 2008, 26(7): 787–793.DOI: 10.1038/nbt1413 |
| [32] | Lee SK, Keasling JD. A propionate-inducible expression system for enteric bacteria.Appl Environ Microbiol, 2005, 71(11): 6856–6862.DOI: 10.1128/AEM.71.11.6856-6862.2005 |
| [33] | Wegerer A, Sun TQ, Altenbuchner J. Optimization of an E. coli L-rhamnose-inducible expression vector: test of various genetic module combinations.BMC Biotechnol, 2008, 8: 2.DOI: 10.1186/1472-6750-8-2 |
| [34] | Choi YJ, Morel L, Le Fran?ois T, et al. Novel, versatile, and tightly regulated expression system for Escherichia coli strains.Appl Environ Microbiol, 2010, 76(15): 5058–5066.DOI: 10.1128/AEM.00413-10 |
| [35] | Mermod N, Ramos JL, Lehrbach PR, et al. Vector for regulated expression of cloned genes in a wide range of gram-negative bacteria.J Bacteriol, 1986, 167(2): 447–454.DOI: 10.1128/jb.167.2.447-454.1986 |
| [36] | Sullivan MJ, Curson ARJ, Shearer N, et al. Unusual regulation of a leaderless operon involved in the catabolism of dimethylsulfoniopropionate in Rhodobacter sphaeroides.PLoS ONE, 2011, 6(1): e15972.DOI: 10.1371/journal.pone.0015972 |
| [37] | Noguchi N, Takada K, Katayama J, et al. Regulation of transcription of the mph(A) gene for macrolide 2'-phosphotransferase Ⅰ in Escherichia coli: characterization of the regulatory gene mphR(A).J Bacteriol, 2000, 182(18): 5052–5058.DOI: 10.1128/JB.182.18.5052-5058.2000 |
| [38] | Terán W, Felipe A, Segura A, et al. Antibiotic-dependent induction of Pseudomonas putida DOT-T1E TtgABC efflux pump is mediated by the drug binding repressor TtgR.Antimicrob Agents Chemother, 2003, 47(10): 3067–3072.DOI: 10.1128/AAC.47.10.3067-3072.2003 |
| [39] | R?ssger K, Charpin-El-Hamri G, Fussenegger M. A closed-loop synthetic gene circuit for the treatment of diet-induced obesity in mice.Nat Commun, 2013, 4: 2825.DOI: 10.1038/ncomms3825 |
| [40] | Hubbard BK, Koch M, Palmer DRJ, et al. Evolution of enzymatic activities in the enolase superfamily: characterization of the (D)-glucarate/galactarate catabolic pathway in Escherichia coli.Biochemistry, 1998, 37(41): 14369–14375.DOI: 10.1021/bi981124f |
| [41] | Blattner FR, Plunkett Ⅲ G, Bloch CA, et al. The complete genome sequence of Escherichia coli K-12.Science, 1997, 277(5331): 1453–1462.DOI: 10.1126/science.277.5331.1453 |
| [42] | Monterrubio R, Baldoma L, Obradors N, et al. A common regulator for the operons encoding the enzymes involved in D-galactarate, D-glucarate, and D-glycerate utilization in Escherichia coli.J Bacteriol, 2000, 182(9): 2672–2674.DOI: 10.1128/JB.182.9.2672-2674.2000 |
| [43] | Koonin EV, Tatusov RL, Rudd KE. Sequence similarity analysis of Escherichia coli proteins: functional and evolutionary implications.Proc Natl Acad Sci USA, 1995, 92(25): 11921–11925.DOI: 10.1073/pnas.92.25.11921 |
| [44] | Yang S, Kang Z, Cao WL, et al. Construction of a novel, stable, food-grade expression system by engineering the endogenous toxin-antitoxin system in Bacillus subtilis.J Biotechnol, 2016, 219: 40–47.DOI: 10.1016/j.jbiotec.2015.12.029 |
