
 , 孙蕾1,2
, 孙蕾1,2

1 中国科学院微生物研究所 病原微生物与免疫学重点实验室,北京 100101;
2 中国科学院大学,北京 100049
收稿日期:2017-03-13;接收日期:2017-06-05; 网络出版时间:2017-07-05 基金项目:国家自然科学基金(Nos. 31472178,36172531),中国科学院重点研究计划(No. KSZD-EW-Z-005-001),国家科技支撑计划(No.2015BAD11B02)资助
摘要:亲环素A(Cyclophilin A,CypA)是肽基脯氨酰顺/反异构酶家族成员,主要分布于细胞质中,当细胞受到外界刺激时会分泌到细胞间隙,与CD147以配体-受体形式结合,促进炎症细胞的趋化。利用大肠杆菌BL21表达并纯化CypA蛋白,利用该蛋白刺激小鼠的骨髓来源巨噬细胞(BMDM)。实时荧光定量PCR和ELISA试验结果发现,BMDM分泌的IL-1β等炎症因子的表达水平均显著上调,表明胞外CypA具有促进炎症发生的作用。同时以CypA蛋白为免疫原制备多克隆抗体,用于LPS诱导的小鼠急性肺炎的治疗试验。与未治疗组相比,anti-CypA抗体治疗组小鼠的肺组织表面出血点较少,损伤程度减轻,肺组织和血液中IL-1β的表达量显著下降,表明anti-CypA抗体对LPS诱导的炎症具有一定的治疗效果。本研究以胞外CypA-CD147的相互作用为靶点,利用anti-CypA抗体抑制炎症反应,为开发抗炎症药物提供了一种新的思路和策略。
关键词:亲环素A 炎症 抗体治疗
Effect of extracellular cyclophilin A on inflammatory response and anti-inflammatory activity of antibody against cyclophilin A
Wenbo Li1,2, Wei Liu1,2, Can Chen1,2, Wenhui Fan1, He Zhang1, Wenjun Liu1,2

 , Lei Sun1,2
, Lei Sun1,2

1 Key Laboratory of Pathogenic Microbiology and Immunology, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China;
2 University of Chinese Academy of Sciences, Beijing 100049, China
Received: March 13, 2017; Accepted: June 5, 2017; Published: July 5, 2017
Supported by: National Natural Science Foundation of China (Nos. 31472178, 31672531), Key Research Program of the Chinese Academy of Sciences (No. KSZD-EW-Z-005-001), National Key Technology Support Program (No. 2015BAD11B02)
Corresponding author:Wenjun Liu. Tel: +86-10-64807497; E-mail: liuwj@im.ac.cn
Lei Sun. Tel: +86-10-64807503; E-mail: sunlei362@im.ac.cn
Abstract: Cyclophilin A (CypA) is a member of peptidyl prolylisomerases (PPIase) family. CypA is best known as a ubiquitously distributed intracellular protein. It has also been shown to be secreted by cells in response to inflammatory stimuli and oxidative stress. Extracellular CypA (eCypA) interacts with CD147 to initiate inflammatory responses via recruiting leucocytes into inflamed tissue. Recombinant CypA was expressed in Escherichia coli and then purified using Superdex 75TM 16/60. The results of Real-time PCR and ELISA showed that the expression levels of proinflammatory cytokines, such as IL-1β, secreted by eCypA stimulated BMDM were significantly up-regulated, indicating that eCypA played an important role in promoting inflammatory responses. In addition, anti-CypA antibody was prepared using purified CypA protein for therapeutic evaluation in a mouse model of LPS-induced acute lung inflammation. Antibody-treated mice showed reduced lung injury and the expression levels of IL-1β in the lung tissue and blood were decreased significantly, indicating that anti-CypA antibody exerted a potent anti-inflammatory activity. Our findings provide a potential therapeutic antibody for inflammation-mediated diseases.
Key words: cyclophilin A inflammation therapeutic antibody
亲环素A (Cyclophilin A,CypA)具有肽基脯氨酰顺/反异构酶(PPIase)活性,是一种在生物界广泛存在、高度保守的蛋白质[1]。细胞在静息状态时,CypA主要分布在细胞质中,只有当受到活性氧等外界刺激或发生炎症反应时才会分泌到细胞外[2-3]。胞外CypA (eCypA)表现出促炎活性和趋化活性,在炎症发生的过程中发挥着重要作用。例如,脂多糖(Lipopolysaccharides,LPS)刺激的巨噬细胞分泌大量的eCypA,参与宿主的炎症反应[3];在类风湿关节炎[4-5]、败血病[6]、动脉粥样硬化[7]、莱姆病[8]等炎症相关疾病的发生过程中,eCypA表达量明显上升。
近年来研究发现,eCypA可以调节细胞膜上细胞外基质金属蛋白酶诱导子(Extracellular matrix metalloproteinase inducer,emmprin,CD147)的表达水平[9],并与CD147以配体-受体形式结合,参与单核细胞、中性粒细胞、T淋巴细胞的趋化,诱导炎症反应中的白细胞渗入病变组织。CD147是一种高度糖基化的跨膜糖蛋白,属于免疫球蛋白超家族成员,可以与多种蛋白相互作用,促进肿瘤的侵袭和转移[10],参与调节生殖与视觉功能以及发育早期神经系统功能等[11],同时也参与多种疾病发生发展的病理过程。
目前,以eCypA或CD147为靶点,利用免疫抑制剂Cyclosporin A (CsA)和FK-506、anti-CD147抗体、CD147拮抗肽或者RNA干扰技术等抑制eCypA-CD147相互作用,均可在体内或体外实验中显示出很好的治疗效果,一定程度上延缓疾病的发展[12],这充分揭示了这一药物设计靶点的应用前景。在LPS诱导的小鼠急性肺炎模型中,经anti-CD147抗体或CsA处理后,小鼠支气管肺泡灌洗液中中性粒细胞渗出比例下降到50%,减轻病变组织的炎症反应。而联合使用anti-CD147抗体和CsA两种药物与单独使用其中一种相比治疗效果差别不大,表明anti-CD147抗体和CsA都是针对eCypA-CD147复合物起作用[13]。此外,干扰eCypA-CD147的相互作用也可减少急性过敏性哮喘中嗜酸性细胞和CD4+ T细胞Th2细胞因子的产生[14]。然而,上述药物或抗体在使用过程中不仅会阻断eCypA-CD147的结合,还有可能产生一些副作用。例如,针对PPIase活性的免疫抑制剂CsA和FK-506的特异性较差,可同样作用于除CypA之外的其他亲环素家族成员(例如CypB)[1],而且会引起机体的免疫抑制;anti-CD147抗体封闭CD147使其失活的同时可能会导致CD147其他的正常生理功能受到影响。
由于anti-CypA抗体只在细胞外针对eCypA发挥作用,不会影响细胞内CypA的正常功能,因此,anti-CypA抗体作为一种抗炎症药物,用于阻断eCypA-CD147相互作用并治疗炎症的可行性远远高于其他药物,将极大地增强药物的特异性并减少副作用的产生。已有研究将抗华支睾吸虫亲环素A抗体用于小鼠脓毒血症的治疗,发现其可以通过减轻炎症反应、抑制弥散性血管内凝血保护内皮细胞等多方面发挥保护作用,从而降低死亡率[15]。而本研究利用LPS诱导的炎症反应和小鼠急性肺炎模型证明了eCypA促进炎症发生的作用,并进一步探讨了能够特异性阻断eCypA-CD147相互作用的人anti-CypA抗体在抑制小鼠急性肺炎中的作用。
1 材料与方法1.1 实验动物6-8周龄雌性C57BL/6小鼠购自北京维通利华实验动物技术有限公司;新西兰白兔由中国科学院遗传与发育生物学研究所动物实验中心饲养及免疫。
1.2 质粒、菌株及细胞株表达人CypA的重组质粒pET-30a-CypA、用于联合免疫的质粒pcDNA3.0-CypA由本实验室构建并保存;大肠杆菌TOP10、BL21 (DE3)由本实验室保存;小鼠骨髓衍生的巨噬细胞(Bone marrow-derived macrophage,BMDM)取自C57BL/6小鼠股骨骨髓,原代培养经巨噬细胞集落刺激因子(M-CSF)诱导后使用。
1.3 主要试剂及仪器α-糜蛋白酶、N-Succinyl-Ala-Ala-Pro-Phe p-nitroanilide四肽底物、脂多糖、LPS、弗氏完全佐剂购自Sigma公司;Trizol购自Invitrogen公司;AMV反转录酶、RNase抑制剂购自Promega公司;兔白细胞介素(IL-1β)多克隆抗体购自Santa Cruz公司;DMEM培养基、胎牛血清(FBS)购自Gibco公司;ROX Reference DyeⅡ、SYBR Premix DimerEraser购自TaKaRa公司;ToxinEraserTM内毒素去除试剂盒、ToxinSensorTM Chromogenic LAL内毒素检测试剂盒购自金斯瑞生物科技有限公司;Quantikine ELISA Mouse IL-1β试剂盒购自R & D公司;Superdex 75TM 16/60及HiTrap Protein G HP柱购自GE Healthcare并使用其AKTA FPLC蛋白纯化系统;紫外分光光度计Spectrophotometer ND-1000为NanoDrop公司产品;TECAN infinite M200 PRO酶标仪购自瑞士Sunrise公司;7500实时定量PCR仪购自美国应用生物系统公司(Applied Biosystems);实验中所用盐酸胍、醋酸、辛酸、硫酸铵、葡萄糖、柠檬酸钠、柠檬酸、乙醇、二甲苯、冰醋酸等试剂均为国产分析纯。所有引物均由生工生物工程(上海)股份有限公司合成。
1.4 CypA蛋白表达、纯化及稳定性检测将pET-30a-CypA重组质粒转化大肠杆菌BL21 (DE3),37 ℃平板倒置培养过夜。挑取单菌落接入含1‰卡那霉素的LB液体培养基中,振荡培养6 h后1:100接入2 L 1‰卡那霉素的LB液体培养基中,37 ℃、200 r/min振荡培养至菌液OD600在0.6-0.8之间,留取少量诱导前全菌作为对照,在剩余培养液中1:2 000加入异丙基硫代半乳糖苷(Isopropyl-beta-D-thiogalactopyranoside,IPTG),37 ℃、200 r/min诱导4 h。500 r/min离心15 min收集菌体,取诱导前后菌体破碎并收集沉淀进行SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析,鉴定目的蛋白的表达。包涵体经洗涤后使用6 mol/L盐酸胍变性,12 000 r/min离心取上清,所得产物复性换液至含20 mmol/L Tris、20 mmol/L NaCl的缓冲液中。利用Superdex 75TM 16/60分子筛纯化,收集产物进行SDS-PAGE分析以确定目的蛋白,使用Bicinchoninic acid (BCA)法测定蛋白含量。
将纯化CypA蛋白分别置于37 ℃培养箱中3、6、12、24、36、48、72 h后取样进行SDS-PAGE分析,观察其降解情况。
1.5 纯化CypA蛋白PPIase活性检测及内毒素含量检测1.5.1 纯化蛋白PPIase活性检测采用Fischer等[16]建立的糜蛋白酶偶联法,略为改进,建立2 mL反应体系,包含10 μmol/L α-糜蛋白酶,78 μmol/L N-Succinyl-Ala-Ala-Pro-Phe p-nitroanilide四肽底物(溶于含0.47 mol/L LiCl的三氟乙醇中),10 nmol/L纯化CypA蛋白。取1 860 μL 0.1 mol/L Tris-HCl (pH 8.0)与100 μL 200 μmol/L α-糜蛋白酶溶液,混合后在0 ℃下预平衡10 min以达到热平衡。加入纯化所得的1μmol/L CypA蛋白20 μL,5 min后加入20 μL的7.8 mmol/L四肽底物N-Succinyl-Ala-Ala-Pro-Phe p-nitroanilide,迅速混合引发反应。用分光光度计记录390 nm处OD值在60 s内的变化,以含20 mmol/L Tris、20 mmol/L NaCl的缓冲液为对照,0.1 mol/L Tris-HCl (pH 8.0)为空白,整个实验过程温度需控制在0 ℃。
1.5.2 纯化蛋白内毒素去除及残余量测定使用以修饰过的粘菌素B (PMB)为配体制成的内毒素去除树脂装填柱子,纯化蛋白经0.22 μm膜过滤除菌后上样,经洗脱去除内毒素后收集淋洗液,使用ToxinSensorTM Chromogenic LAL内毒素检测试剂盒测定内毒素含量。
1.6 anti-CypA多克隆抗体制备及纯化1.6.1 动物免疫新西兰白兔正常饲养至体重为2 000-2 500 g,观察7-10 d,身体状态无异常备用。第一次免疫(1 d)取质粒pcDNA3.0-CypA 0.5 mg和纯化CypA蛋白1 mg与等体积弗氏完全佐剂(Sigma公司)乳化至混合物在水中不扩散,家兔背部皮下6-8点、双后脚皮下注射以联合免疫。第二次免疫(22 d)和第三次免疫(36 d)均使用0.5 mg纯化蛋白和等体积弗氏不完全佐剂乳化至混合物在水中不扩散,家兔背部皮下4-6点免疫。检测血清效价,使用1 mg纯化蛋白加强免疫一次(50 d)。10 d后,家兔颈动脉放血至死亡,取全血大约100 mL置于4 ℃冰箱过夜,离心分血清约40 mL,分装后-80 ℃保存备用。
1.6.2 多克隆抗体纯化血清离心取上清,用4倍体积60 mmol/L醋酸缓冲液稀释,调至pH 4.5。1:40加入辛酸,室温搅拌30 min,4 ℃静置2 h以上。离心收集上清,加入1/10体积的10×PBS,调至pH 7.4,在4 ℃条件下,以0.277 g/mL加入硫酸铵,搅拌30 min,静置过夜。离心收集沉淀,溶于20 mmol/L磷酸钠缓冲液(pH 7.0)中,使用HiTrap Protein G HP亲和层析,以20 mmol/L磷酸钠缓冲液(pH 7.0)上样冲洗,0.1 mol/L Gly-HCl (pH 2.7)洗脱。收集纯化抗体,透析换液至PBS中,BCA法测定含量。
1.6.3 Western blotting鉴定抗体的有效性制备小鼠BMDM细胞,加入M-CSF诱导,于37 ℃、5% CO2条件下培养至细胞分化贴壁,用细胞裂解液(150 mmol/L NaCl,20 mmol/L 4-羟乙基哌嗪乙磺酸(Hepes),1 mmol/L EDTA,1% TritonX-100,10%甘油,蛋白酶抑制剂)收取细胞,4 ℃裂解30 min,12 000 r/min离心取上清,加入5×上样缓冲液,95 ℃处理样品10 min。同时,取菌体超声破碎后离心分离得到的包涵体,初步洗涤后于少量PBS中加入5×上样缓冲液,经上述处理后与细胞裂解液一同进行SDS-PAGE,将蛋白转移至PVDF膜(15 V,25 min)。用含1% BSA和5%脱脂奶的TBST封闭过夜,使用纯化后抗体以1:20 000作为一抗,以鼠单抗β-tubulin (1:2 000)为内参,室温孵育1 h,TBST洗3次,每次10 min。二抗为羊抗兔和羊抗鼠,1:5 000稀释,室温孵育1 h,TBST洗3次,每次10 min,使用底物显色试剂盒曝光显影。
1.7 eCypA对小鼠BMDM中炎症因子表达水平的影响1.7.1 细胞培养及处理将在含10% FBS的DMEM培养基中原代培养经M-CSF诱导分化的BMDM使用细胞刮刀刮下,吹打混匀后计数,稀释至1×106/mL后接入12孔培养板中,37 ℃、5% CO2过夜培养至细胞贴壁。换为无血清DMEM培养基,加入不同剂量eCypA刺激其炎症因子产生。
1.7.2 BMDM中炎症因子表达水平检测移去细胞培养基,使用Trizol提取RNA,以oligo(dT18)作为引物,AMV反转录酶(Promega公司)经反转录反应获得cDNA,反应体系包括12 μL RNA、4 μL oligo (dT18)、16 μL 2.5 mmol/L dNTPs、1 μL AMV反转录酶、10 μL 5×AMV缓冲液、1 μL RNase抑制剂,加双蒸水补充至50 μL。使用实时荧光定量PCR (qPCR)方法检测IL-1β、IL-6、TNFα的表达水平,反应体系包括2 μL cDNA、0.2 μmol/L引物、0.4 μL ROX Reference DyeⅡ、10 μL SYBR Premix DimerEraser (TaKaRa),加入双蒸水补足到20 μL。使用7500实时定量PCR仪进行qPCR反应,Ct值反应程序为第一步95 ℃ 30 s,第二步共40个循环,包括95 ℃ 5 s,60 ℃ 31 s。每个样品重复3次,以甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,利用公式2-△△Ct计算其相对表达量。
用细胞裂解液收取细胞,SDS-PAGE后将蛋白转移至PVDF膜,封闭过夜,一抗为兔多抗IL-1β (1:2 000),二抗为羊抗兔(1:5 000),以鼠单抗β-tubulin (1:2 000)为内参,利用Western blotting检测IL-1β表达水平,具体方式同1.6.3。
1.7.3 BMDM上清中IL-1β表达量检测收集每组细胞上清液,采用酶联免疫吸附试验(ELISA)测定各组细胞上清中炎性因子IL-1β的含量。测定方法按Quantikine ELISA Mouse IL-1β试剂盒说明书进行,每组设3个重复,于490 nm处读取OD值,绘制标准曲线并得出蛋白含量。
1.8 anti-CypA抗体对LPS诱导的小鼠急性肺炎治疗效果评价1.8.1 实验动物分组及LPS诱导急性肺炎模型建立取6-8周龄雌性C57BL/6小鼠随机分为空白组(PBS)、未治疗组(LPS)、治疗组(LPS+anti-CypA) 3组,每组5只。空白组每只小鼠经鼻腔滴注50 μL PBS,未治疗组和治疗组小鼠经乙醚麻醉后,每只小鼠经鼻腔滴注3 μg LPS (溶于50 μL PBS)。
1.8.2 治疗组anti-CypA抗体给药取anti-CypA抗体200 μg溶于300 μL PBS中,于LPS诱导24 h前腹腔注射给药一次,LPS诱导后随即再给药一次,共计两次。
1.8.3 血液和肺组织中IL-1β表达水平检测末次给药18 h后小鼠眼球取血,1:1加入阿氏液(Alsever’s solution)中,使用Trizol提取RNA。同时取小鼠肺脏,称重后加入Trizol研磨,3 000 r/min离心5 min去除沉淀后依照说明书操作提取RNA。经RT-PCR后利用实时定量PCR仪进行qPCR反应,以GAPDH为内参,利用公式2-△△Ct计算IL-1β相对表达量,实验方法及体系同1.7.2。
1.8.4 肺指数检测及病理切片制作记录小鼠体重和肺重量,利用公式(肺指数=肺重/体重×100)计算肺指数。拍照记录小鼠肺表面形态,并沿支气管向肺叶中充入10%甲醛。分离肺叶于10%甲醛中固定48 h,经脱水透明后包埋于石蜡中以制作病理切片,将切片经H & E染色后于镜下观察并记录。
2 结果与分析2.1 重组CypA蛋白的表达和纯化将pET-30a-CypA转化大肠杆菌BL21并进行诱导表达,收集所得菌体经超声破碎后离心,沉淀洗涤后加入6 mol/L盐酸胍变性,SDS-PAGE检测包涵体中重组CypA蛋白的表达情况。如图 1A所示,蛋白以包涵体形式表达,分子量约为24 kDa,与预期大小相符。所得变性蛋白复性浓缩后,利用Superdex 75TM 16/60层析柱分离目的蛋白,利用SDS-PAGE鉴定蛋白纯度。如图 1B所示,所得蛋白仅在24 kDa存在目的条带,无其他杂带,其纯度在90%以上。
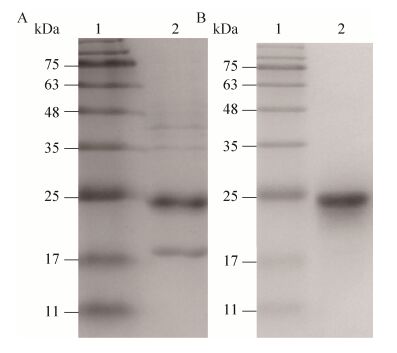 |
| 图 1 重组CypA蛋白的SDS-PAGE结果 Figure 1 SDS-PAGE analysis of the recombinant CypA. (A) 1: protein molecular weight marker; 2: pellet of the post-induced bacterial lysates from ultrasonic disruption. (B) 1: protein molecular weight marker; 2: purified recombinant protein by molecular sieve. |
| 图选项 |
2.2 CypA蛋白的稳定性检测将纯化蛋白置于37 ℃恒温培养箱中,分别于3、6、12、24、36、48、72 h后取样进行SDS-PAGE,结果如图 2所示。CypA蛋白在37 ℃ 24 h内可保持稳定,在后续的CypA刺激细胞实验中,作用时间均在12 h以内,排除了由于CypA蛋白降解对实验结果的影响。
 |
| 图 2 SDS-PAGE检测CypA蛋白的稳定性 Figure 2 Determination of CypA stability by SDS-PAGE. 1: protein molecular weight marker; 2-9: protein samples incubated at 37 ℃ for 0, 3, 6, 12, 24, 36, 48 and 72 hours, respectively. |
| 图选项 |
2.3 CypA蛋白的PPIase活性检测CypA蛋白具有PPIase活性,可催化含脯氨酸的底物肽从反式到顺式构象的转换。利用糜蛋白酶偶联法建立2 mL反应体系,记录60 s内390 nm处OD值变化,以OD390对t (s)作图。由图 3可见,与空白对照相比,加入CypA样品的体系中酶反应加快,表明2个CypA蛋白样品均具有PPIase活性。
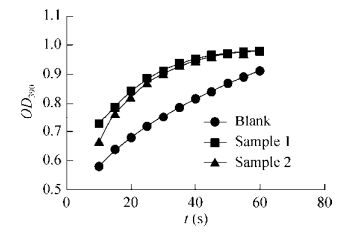 |
| 图 3 CypA蛋白的PPIase活性检测 Figure 3 Determination of PPIase activity of CypA. |
| 图选项 |
2.4 CypA蛋白中内毒素的去除PMB可与内毒素特异性结合,以修饰过的PMB为配体制成内毒素去除树脂,可特异性地去除内毒素。将纯化蛋白分3次去除内毒素,其去除效果由鲎试验验证。鲎试剂与样品内毒素反应过程中产生的凝固酶使特定底物显色,通过比对其与标准品其释放出的呈色团的多少而测定内毒素含量。所得结果如表 1所示,3份样品内毒素含量均低于0.000 3 EU/μg,在细胞实验中可有效避免因内毒素存在而诱发细胞免疫反应。
表 1 CypA蛋白内毒素含量的测定Table 1 Determination of endotoxin contamination
| Sample | Endotoxin concentration (EU/mL) | Protein concentration (μg/mL) | Endotoxin contamination (EU/μg) |
| 1 | 0.041 16 | 143.651 7 | 0.000 29 |
| 2 | 0.032 44 | 113.314 6 | 0.000 29 |
| 3 | 0.044 39 | 218.932 6 | 0.000 20 |
表选项
2.5 anti-CypA抗体的Western blotting分析将兔血清经辛酸-硫酸铵初步纯化后,利用HiTrap Protein G HP柱亲和层析,获得纯化后抗体。PBS中透析过夜,测得含量为3.3 mg/mL。为了鉴定抗体的有效性,将纯化后anti-CypA抗体1:20 000稀释作为一抗,利用Western blotting对BMDM的细胞裂解液和表达CypA蛋白的大肠杆菌包涵体进行检测。由图 4可见,anti-CypA抗体可特异性地识别BMDM中约为18 kDa的CypA蛋白。在针对包涵体的检测中,虽然可检测到其他非特异性条带,但在24 kDa处条带更为明显,识别度更高。因此,我们制备的anti-CypA抗体能够有效地识别真核及原核表达系统中表达的CypA蛋白。
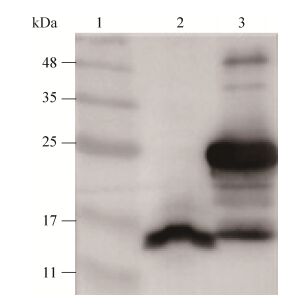 |
| 图 4 Anti-CypA抗体有效性鉴定 Figure 4 Identification of anti-CypA antibody by Western blotting analysis. Lane 1: protein molecular weight marker; Lane 2: CypA protein expressed in BMDM cells; Lane 3: pellet of the post-induced bacterial lysates from ultrasonic disruption. |
| 图选项 |
2.6 eCypA对小鼠BMDM中炎症因子表达的影响在C57BL/6小鼠BMDM中加入eCypA,终浓度分别为0.1、0.5、1、2 μmol/L,9 h后收集细胞,利用qPCR检测IL-1β表达量的变化。由图 5A可见,eCypA在0-1 μmol/L范围内随着剂量加大,IL-1β表达量也随之提高,表明IL-1β表达量对eCypA剂量存在依赖性。但当eCypA浓度达到2 μmol/L时,IL-1β表达量显著下降,可能与高剂量eCypA对细胞产生毒害作用有关。加入eCypA 12 h后收集细胞上清,利用ELISA方法检测BMDM分泌的IL-1β的含量。由图 5B可见,空白样品和0.1μmol/L样品中未能检到IL-1β,1 μmol/L样品中IL-1β含量显著高于0.5 μmol/L样品。当eCypA浓度达到2 μmol/L时,上清中IL-1β的含量显著下降。细胞裂解后利用Western blotting方法检测细胞中pro-IL-1β表达量的变化。由图 5C可见,细胞中pro-IL-1β表达量的变化趋势与图 5B中细胞分泌的IL-1β含量的变化趋势一致。
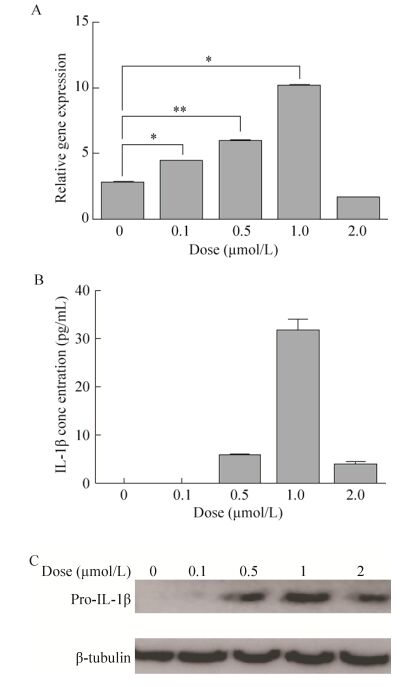 |
| 图 5 eCypA剂量对IL-1β表达水平的影响 Figure 5 Effect of eCypA's dose on expression level of IL-1β. (A) qPCR analysis of IL-1β expression level in BMDMs stimulated by eCypA with different doses for 9 h. (B) ELISA analysis of IL-1β concentration in supernatant of BMDMs stimulated by eCypA with different doses for 12 h. (C) Western blotting analysis of IL-1β expression level in supernatant of BMDMs stimulated by eCypA with different doses for 12 h. |
| 图选项 |
以1 μmol/L eCypA刺激BMDM细胞,分别在3、6、9 h后收集细胞,利用qPCR方法检测炎症因子IL-1β、IL-6、TNFα表达水平变化,结果如图 6所示。eCypA可诱导IL-1β的表达,eCypA刺激BMDM 9 h后,IL-1β的表达量与空白对照相比有极显著的提高(P<0.001) (图 6A)。IL-6在BMDM中本底表达较低,eCypA刺激后IL-6的表达量上升更为明显,刺激后3 h和9 h,IL-6的表达量有显著提高(P<0.01),6 h时差异极显著(P<0.001) (图 6B)。TNF-α为早期炎症因子,其表达水平在eCypA刺激3 h后便迅速达到高峰,而后随时间下降,与空白对照相比同样差异显著(P<0.01,图 6C)。
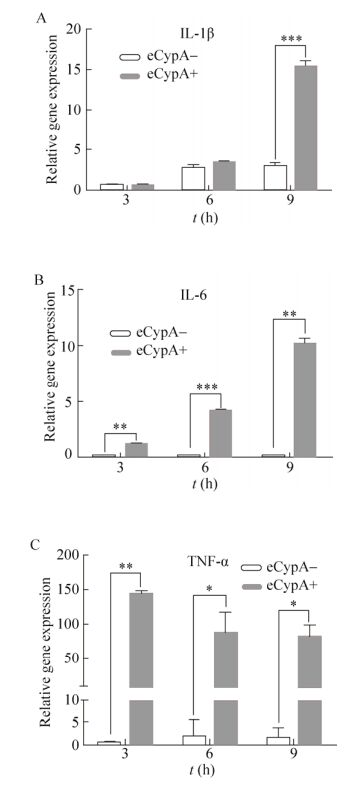 |
| 图 6 eCypA对炎症因子表达水平的影响 Figure 6 Effect of eCypA on expression levels of inflammatory factors. (A) qPCR analysis of IL-1β expression level in BMDMs stimulated by eCypA for 3, 6, 9 h, respectively. (B) qPCR analysis of IL-6 with the same treatment. (C) qPCR analysis of TNF-α with the same treatment. |
| 图选项 |
以上研究结果表明,小鼠BMDM中炎症因子IL-1β的表达水平对eCypA存在一定的剂量依赖性,当eCypA浓度为1 μmol/L时基因表达水平最高。以1 μmol/L eCypA刺激BMDM后,炎症因子IL-1β、IL-6、TNFα的表达量与空白对照相比均显著上升。可见,eCypA能够促进小鼠BMDM中炎症相关细胞因子的表达。
2.7 anti-CypA抗体治疗LPS诱导的小鼠急性肺炎的效果评价如图 7A所示,空白组肺组织表面无损伤,光滑,红润,无出血点;未治疗组肺组织表面可见明显出血点,血管纹路明显;治疗组肺组织表面虽存在少量出血点,但较未治疗组相比程度明显减轻。肺指数可在一定程度上指示肺损伤强度,由图 7B可见,未治疗组肺指数显著高于对照组(P<0.01),LPS诱导的急性肺炎模型建立成功。治疗组肺指数较未治疗组降低了约30%,二者差异显著(P<0.05)。肺组织病理切片H & E染色结果可见(图 7C),空白组无明显损伤,肺泡腔完整,无炎性细泡分泌浸入,肺泡间隙无炎性细胞浸润,肺泡壁未见明显增厚,纤维结缔组织无增生,组成气管壁的柱状细胞排列规则紧密,气管内无粘液。未治疗组肺组织损伤明显,可观察到大量单核细胞渗入肺泡中,肺泡完整性遭到破坏,可见肺泡内出血,邻近肺泡融合为一体,气管上皮细胞界限模糊,排列不规整,呈现急性炎症表现,其病理形态证实小鼠急性肺炎模型建立成功。治疗组小鼠肺组织同样可观察到白细胞浸润,但程度远不及未治疗组,可观察到少量单核细胞进入肺泡,肺泡有充血但结构完整,边界清晰,气管上皮细胞排列较为紧密,气管中未见粘液。结合肺部病变和肺指数计算结果,可以认为LPS诱导的小鼠急性肺炎模型建立成功,并且经过anti-CypA抗体的治疗,小鼠肺部炎症程度减轻。
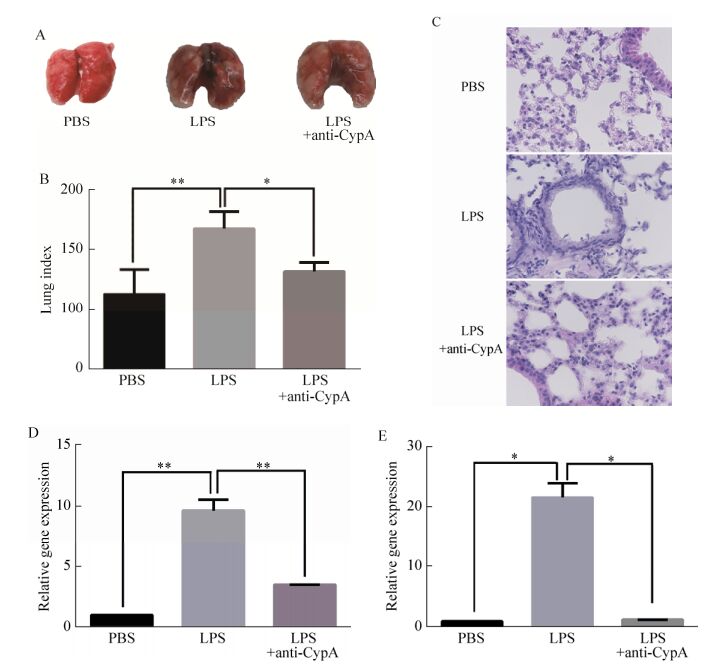 |
| 图 7 anti-CypA抗体对LPS诱导小鼠急性肺炎治疗效果的评价 Figure 7 Therapeutic evaluation of anti-CypA antibody in LPS-induced inflammation. (A) Gross lesion of lungs. (B) Lung index (100× lung/body weight). (C) Lung tissue was fixed in 10% formalin, sectioned, and stained with H & E for histological analysis. Representative histological sections from the following groups are shown: PBS alone; LPS alone; LPS plus anti-CypA treatment. The magnification was 800×. (D) Relative gene expression of IL-1β in lung tissue. (E) Relative gene expression of IL-1β in peripheral blood. |
| 图选项 |
未治疗组小鼠肺组织中IL-1β显著高于对照组(P<0.01) (图 7D),同样表明LPS诱导的急性肺炎模型建立成功。经anti-CypA抗体治疗后小鼠肺组织中IL-1β表达量下降约60%,与未治疗组差异显著(P<0.01)。由于IL-1β主要存在于血液中,故小鼠血液样本中其表达量变化更为明显。经anti-CypA抗体治疗的小鼠血液中IL-1β低于未治疗组,二者的差异具有统计学意义(P<0.05,图 7E)。
以上试验结果表明,经LPS诱导的未治疗组小鼠肺表面可见明显出血点,肺指数较空白组显著上升,肺组织及血液中IL-1β表达水平较空白组显著增高,表明LPS诱导的小鼠急性肺炎模型建立成功。经anti-CypA抗体两次给药后的治疗组与未治疗组相比,肺表面出血点较少,损伤程度较轻,肺指数下降。其肺组织和血液中IL-1β表达水平与未治疗组相比下降显著,说明anti-CypA抗体在一定程度上阻止了LPS对小鼠肺脏损伤,减轻和缓解了LPS诱发的炎症反应,具有一定治疗效果。
3 讨论大部分与CypA相关的研究认为,CypA是一种广泛存在的胞内蛋白,主要在蛋白折叠过程中作为分子伴侣起作用[17],也有研究表明其在细胞通讯中起着转导作用[18]。与此同时,研究人员发现细胞在受到炎症刺激[3, 19]或者氧化应激[2, 20]状态下会分泌CypA,活化的血小板同样会分泌CypA[7]。由于CypA不具有一般分泌型蛋白所具有的穿膜信号肽,其外泌主要是通过小泡途径[20]。已有研究表明,胞外CypA与CD147以配体-受体形式结合,在炎症反应中起着重要作用。Suzuki等[21]发现CD147胞外结构域中Pro180-Gly181位点在CypA特异性的信号通路中起关键作用。细胞表面的肝素率先与eCypA结合,将其呈递给CD147,使下游ERK通路被激活。IL-1β属于白细胞介素-1家族,主要通过刺激炎症相关基因的表达来诱导效应蛋白表达,在免疫调节及炎症进程起着重要作用。在使用eCypA刺激小鼠BMDM细胞后,IL-1β表达量受到影响,随着eCypA剂量的增加而上调,并在1 μmol/L剂量下达到巅峰。在该eCypA剂量下,早期炎症因子TNFα表达水平最先出现上调,IL-6及IL-1β随之出现表达量上升的现象。进一步肯定了eCypA作为促炎因子在炎症反应中的作用和地位,为以其为靶点的炎症药物设计提供了理论依据。
由于目前与eCypA相关的炎症反应研究中,CypA蛋白主要由原核细胞表达获得,其所含有的LPS可能同样会对细胞产生刺激,诱发炎症反应,使实验结果不能清晰表达。因此,我们利用原核表达系统表达纯化出高浓度CypA蛋白后,检测其稳定性,并做内毒素去除,检测其残余含量,以避免细胞实验中存在的不确定因素。
特异性地阻断eCypA-CD147通路的新型药物设计思路可以分为针对eCypA和针对CD147两个部分,这样的药物可同样对其他与eCypA或者CD147有关的疾病起到作用,如癌症和HIV感染[22-24]。与以往的利用免疫抑制剂CsA和FK-506、CD147抗体、CD147拮抗肽或者RNA干扰技术等抑制eCypA-CD147相互作用不同,本研究以eCypA为靶点,使用特异性anti-CypA抗体阻断eCypA-CD147的相互作用,从而抑制下游的炎症反应,这也不失为一种药物设计思路。
本研究选用C57BL/6小鼠构建LPS诱导的急性肺炎模型。LPS与TLR4结合后,主要激活两条信号通路:髓样分化因子88 (Myeloid differentiation factor 88,MyD 88)依赖的信号通路和MyD 88非依赖的信号通路,促使相关炎症细胞因子的合成及释放,最终导致全身炎症的发生[25]。胞外CypA与CD147以配体-受体形式结合,在炎症反应中起促进作用。CypA与CD147的作用机制可能为:在高尔基体囊泡腔内Cyp60作用于CD147的Pro211,促进了CypA从高尔基体分泌到细胞外。细胞外的CypA与细胞表面的硫酸肝素蛋白多糖与CD147胞外区Pro180及跨膜区Pro211结合,引起脯氨酸异构化,启动细胞内信号事件[18]。然而,细胞内信号通路起始的具体过程和机制,仍需要进一步研究。使用anti-CypA抗体特异性地阻断eCypA与CD147的结合,可以抑制CD147下游信号事件启动,干预eCypA-CD147介导的炎症反应产生,避免机体炎症反应加剧。
我们成功建立了LPS诱导的小鼠急性肺炎模型,使用anti-CypA抗体进行治疗后,可以在一定程度上减轻和缓解炎症反应。本研究为促进anti-CypA抗体药物的临床应用进行了一次有益的探索,同时也为开发抗炎症药物提供了一种新的思路和策略。
参考文献
| [1] | Handschumacher RE, Harding MW, Rice J, et al. Cyclophilin: a specific cytosolic binding protein for cyclosporin A.Science, 1984, 226(4674): 544–547.DOI: 10.1126/science.6238408 |
| [2] | Jin ZG, Melaragno MG, Liao DF, et al. Cyclophilin a is a secreted growth factor induced by oxidative stress.Circ Res, 2000, 87(9): 789–796.DOI: 10.1161/01.RES.87.9.789 |
| [3] | Sherry B, Yarlett N, Strupp A, et al. Identification of cyclophilin as a proinflammatory secretory product of lipopolysaccharide-activated macrophages.Proc Natl Acad Sci USA, 1992, 89(8): 3511–3515.DOI: 10.1073/pnas.89.8.3511 |
| [4] | Wang L, Wang CH, Jia JF, et al. Contribution of cyclophilin A to the regulation of inflammatory processes in rheumatoid arthritis.J Clin Immunol, 2010, 30(1): 24–33.DOI: 10.1007/s10875-009-9329-1 |
| [5] | Billich A, Winkler G, Aschauer H, et al. Presence of cyclophilin A in synovial fluids of patients with rheumatoid arthritis.J Exp Med, 1997, 185(5): 975–980.DOI: 10.1084/jem.185.5.975 |
| [6] | Tegeder I, Schumacher A, John S, et al. Elevated serum cyclophilin levels in patients with severe sepsis.J Clin Immunol, 1997, 17(5): 380–386.DOI: 10.1023/A:1027364207544 |
| [7] | Coppinger JA, Cagney G, Toomey S, et al. Characterization of the proteins released from activated platelets leads to localization of novel platelet proteins in human atherosclerotic lesions.Blood, 2004, 103(6): 2096–2104.DOI: 10.1182/blood-2003-08-2804 |
| [8] | Kratz A, Harding MW, Craft J, et al. Autoantibodies against cyclophilin in systemic lupus erythematosus and Lyme disease.Clin Exp Immunol, 1992, 90(3): 422–427. |
| [9] | Yurchenko V, Pushkarsky T, Li JH, et al. Regulation of CD147 cell surface expression: involvement of the proline residue in the CD147 transmembrane domain.J Biol Chem, 2005, 280: 17013–17019.DOI: 10.1074/jbc.M412851200 |
| [10] | Biswas C, Zhang Y, DeCastro R, et al. The human tumor cell-derived collagenase stimulatory factor (renamed EMMPRIN) is a member of the immunoglobulin superfamily.Cancer Res, 1995, 55(2): 434–439. |
| [11] | Muramatsu T, Miyauchi T. Basigin (CD147): a multifunctional transmembrane protein involved in reproduction, neural function, inflammation and tumor invasion.Histol Histopathol, 2003, 18(3): 981–987. |
| [12] | Yurchenko V, Constant S, Eisenmesser SC, et al. Cyclophilin-CD147 interactions: a new target for anti-inflammatory therapeutics.Clin Exp Immunol, 2010, 160(3): 305–317.DOI: 10.1111/cei.2010.160.issue-3 |
| [13] | Arora K, Gwinn WM, Bower MA, et al. Extracellular cyclophilins contribute to the regulation of inflammatory responses.J Immunol, 2005, 175(1): 517–522.DOI: 10.4049/jimmunol.175.1.517 |
| [14] | Gwinn WM, Damsker JM, Falahati R, et al. Novel approach to inhibit asthma-mediated lung inflammation using anti-CD147 intervention.J Immunol, 2006, 177(7): 4870–4879.DOI: 10.4049/jimmunol.177.7.4870 |
| [15] | Song TZ, Yang M, Chen JT, et al. Prognosis of sepsis induced by cecal ligation and puncture in mice improved by anti-Clonorchis sinensis cyclopholin a antibodies.Parasites Vectors, 2015, 8: 502.DOI: 10.1186/s13071-015-1111-z |
| [16] | Fischer G, Bang H, Mech C. Determination of enzymatic catalysis for the cis-trans-isomerization of peptide binding in proline-containing peptides.Biomed Biochim Acta, 1984, 43(10): 1101–1111. |
| [17] | Schiene C, Fischer G. Enzymes that catalyse the restructuring of proteins.Curr Opin Struct Biol, 2000, 10(1): 40–45.DOI: 10.1016/S0959-440X(99)00046-9 |
| [18] | Bukrinsky MI. Cyclophilins: unexpected messengers in intercellular communications.Trends Immunol, 2002, 23(7): 323–325.DOI: 10.1016/S1471-4906(02)02237-8 |
| [19] | Xu Q, Leiva MC, Fischkoff SA, et al. Leukocyte chemotactic activity of cyclophilin.J Biol Chem, 1992, 267(17): 11968–11971. |
| [20] | Suzuki J, Jin ZG, Meoli DF, et al. Cyclophilin a is secreted by a vesicular pathway in vascular smooth muscle cells.Circ Res, 2006, 98(6): 811–817.DOI: 10.1161/01.RES.0000216405.85080.a6 |
| [21] | Yurchenko V, Zybarth G, O'Connor M, et al. Active site residues of cyclophilin A are crucial for its signaling activity via CD147.J Biol Chem, 2002, 277(25): 22959–22965.DOI: 10.1074/jbc.M201593200 |
| [22] | Pushkarsky T, Yurchenko V, Laborico A, et al. CD147 stimulates HIV-1 infection in a signal-independent fashion.Biochem Biophys Res Commun, 2007, 363(3): 495–499.DOI: 10.1016/j.bbrc.2007.08.192 |
| [23] | Pushkarsky T, Zybarth G, Dubrovsky L, et al. CD147 facilitates HIV-1 infection by interacting with virus-associated cyclophilin A.Proc Natl Acad Sci USA, 2001, 98(11): 6360–6365.DOI: 10.1073/pnas.111583198 |
| [24] | Obchoei S, Wongkhan S, Wongkham C, et al. Cyclophilin A: potential functions and therapeutic target for human cancer.Med Sci Monit, 2009, 15(11): RA221–RA232. |
| [25] | Lu YC, Yeh WC, Ohashi PS. LPS/TLR4 signal transduction pathway.Cytokine, 2008, 42(2): 145–151.DOI: 10.1016/j.cyto.2008.01.006 |
