

西南大学 家蚕基因组生物学国家重点实验室,重庆 400716
收稿日期:2017-02-05;接收日期:2017-05-19; 网络出版时间:2017-09-27 基金项目:国家自然科学基金(No. 31672496),重庆自然科学基金(No. cstc2016jcyjA0425),重庆高校创新团队建设计划(No. CXTDX201601010)资助
摘要:整合素作为一种跨膜糖蛋白,与生物体的生理和病理等多个过程密切相关。为了探究其在家蚕中扮演的角色,通过PCR及RACE技术克隆得到了家蚕整合素β家族成员Bmintegrin β1,通过结构域预测网站对其结构域进行了预测,并构建进化树对其进化关系进行分析,此外通过原核表达系统及蛋白纯化方法获得其重组蛋白,使用重组蛋白免疫小鼠获得其多克隆抗体,并采用半定量PCR及Western blotting方法检测Bmintegrin β1的时空表达。文中得到家蚕整合素Bmintegrin β1的3种剪切形式,且这3种剪切体具有长为2 502 bp的开放阅读框架,编码833个氨基酸。根据预测该蛋白含有Integrin-B-tail、跨膜区等一系列整合素家族保守的结构域。进化树结果表明该蛋白与同为鳞翅目成员的烟夜蛾和黑脉金斑蝶的整合素蛋白最为接近。此外我们通过原核表达系统及亲和层析技术获得了高纯度的Bmintegrin β1蛋白,进一步制得多克隆抗体。并通过免疫印迹反应证明该抗血清能特异识别Bmintegrin β1重组蛋白。之后通过半定量PCR及免疫印迹检测,结果显示该蛋白在家蚕的各组织以及血细胞各时期均有较高表达且在血液中表达量最高。总之,这项研究为家蚕整合素家族的研究提供了基础。
关键词:Bmintegrin β1 家蚕 时空表达分析 原核表达 多克隆抗体制备
Cloning and expression of Bmintegrin β1 in silkworm Bombyx mori
Chongyang Li*, Kui Zhang*, Li Shen, Yuzu Zhao, Guangzhao Pan, Man Xu, Jingjing Su, Hongjuan Cui


State Key Laboratory of Silkworm Genome Biology, Southwest University, Chongqing 400716, China
Received: February 5, 2017; Accepted: May 19, 2017; Published: September 27, 2017
Supported by: National Natural Science Foundation of China (No. 31672496), Natural Science Foundation of Chongqing (No. cstc2016jcyjA0425), the Chongqing University Innovation Team Building Program Funded Project (No. CXTDX201601010)
Corresponding author:Hongjuan Cui. Tel: +86-23-68251713; Fax: +86-23-68251128; E-mail: Hongjuan.cui@gmail.com; hcui@swu.edu.cn
*These authors contributed equally to this study
Abstract: Integrins are transmembrane glycoproteins, closely related to many physiological and pathological processes. In order to explore its role in silkworm, by PCR and Rapid-amplification of cDNA ends (RACE) technology, the full-length cDNA of Bmintegrin β1 in silkworm was acquired. The domain was predicted by domain prediction website. Phylogenetic tree was constructed to analyze its evolutionary relationship. By prokaryotic expression system, protein purification method and immunizing mouse, the antibody against Bmintegrin β1 recombinant protein was obtained. The spatial-temporal expression profile of Bmintegrin β1 was investigated by semi quantitative PCR and Western blotting. Then we identified all 3 different spliceosomes, and they shared a common open reading frame of 2 502 bp, encoding 833 amino acids. Bmintegrin β1 contained all the classic domains of the integrin family, such as Integrin-B-tail, transmembrane domain etc. Phylogenetic analysis indicated that Bmintegrin β1 was close to the homologous proteins from Heliothis assulta and Danaus plexippus. In order to understand the function of Bmintegrin β1 further, we generated the antibody. In addition, Western blotting demonstrated that the antibody recognized the Bmintegrin β1 recombinant protein. Then, semi quantitative PCR and Western blotting results showed that Bmintegrin β1 was widely expressed in most of tissues, among of them, it's exhibited the highest expression level in hemacyte. Overall, this study provides a foundation for the study of silkworm integrin family.
Key words: Bmintegrinβ1 silkworm temporal and spatial expression prokaryotic expression antibody preparation
整合素蛋白作为一种跨膜受体,不仅是细胞与外界环境之间联系的纽带,还参与了很多生理与病理反应,其广泛存在于细胞表面,与细胞信号的转导、细胞形态及细胞周期的改变等过程息息相关[1]。该蛋白作用于细胞骨架来调节细胞粘附、变形,并在细胞凋亡、存活等过程扮演着重要角色[2]。目前已经在哺乳动物中共发现18个α亚基和8个β亚基,它们以不同形式组成了至少24种整合素蛋白分子[3]。整合素单独的α亚基或单独的β亚基均不能定位到细胞膜上,只有通过α和β两个亚基相结合为异源二聚体才能发挥其功能[4]。α亚基胞外域的β螺旋结构和β亚基的Hybrid结构对这一过程起到了至关重要的调节作用[5]。整合素的两个亚基之间具有一定的特异性,只有特殊表面分子结构的α亚基和β亚基才能形成二聚体,一般细胞中β亚基是过量存在的,所以定位到细胞膜上的配体数量是由α亚基的数量决定的[6]。在昆虫中,整合素最早是在果蝇中被鉴定的,随后在果蝇中相继发现了5种α亚基、3种β亚基,并证明其在果蝇的生长、发育及免疫中发挥了重要作用[7]。之后在其他昆虫如烟草天蛾、大豆夜蛾、亚洲玉米螟等相继发现整合素基因,并进行了鉴定、克隆与研究分析。根据研究报道昆虫体内的整合素在血细胞对外源物的包囊反应等免疫过程中起关键作用[8-9]。整合素蛋白可能参与到了细胞的免疫反应中,研究整合素蛋白的功能将对家蚕疾病的防治起到一定的积极作用,并为人类血液疾病的治疗提供参考。
家蚕既是重要的经济昆虫,也是具有研究价值的鳞翅目模式生物。2009年,有研究人员在家蚕中克隆出了BGIBMGA006878 (β1)和BGIBMGA006002 (β2)。到2014年,在家蚕中整合素家族共鉴定出11种亚基,包括6个α亚基和5个β亚基,比其他无脊椎动物有更多的家族成员[10]。我们团队也参与了整合素家族的鉴定,并且对α亚基与β亚基怎样结合发挥功能很感兴趣,但是该难题一直未解决,而Bmintegrin β1蛋白区别于家族外的其他成员,在各组织均有表达,其可能发挥重要功能。在前人研究的基础上,为了进一步探索整合素家族的具体功能,我们选取Bmintegrin β1作为研究对象。系统地克隆与分析了Bmintegrin β1的基因全长,通过原核表达、蛋白纯化免疫小鼠等一系列技术获得该蛋白鼠源的多克隆抗体,为进一步研究该基因在家蚕血淋巴细胞的增殖分化、家蚕个体的生长发育中所扮演的角色及研究其参与的免疫反应奠定了基础。
1 材料与方法1.1 材料与试剂1.1.1 实验昆虫家蚕(品种P50)来自西南大学[11-12]。家蚕在27 ℃、相对湿度80%左右的恒温培养箱中催青并饲养[13]。
1.1.2 实验主要试剂本实验所使用的Rosetta表达菌株PET-32、PET-28、PET22-b表达载体由本实验室保存。提取RNA的试剂盒购自Omega公司;提取质粒的试剂盒购自Qiagen公司;胶回收试剂盒由Axygen公司提供;RACE试剂盒由Invitrogen公司提供;HiFi酶、限制性内切酶、载体PMD19-T、DNA marker、SolutionⅠ连接酶购自TaKaRa公司;多聚甲醛购买于上海生工生物工程有限公司;反转录试剂是Promega公司产品;抗荧光淬灭剂和DAPI为碧云天公司产品;引物由北京华大基因科技股份有限公司合成。
1.2 方法1.2.1 蚕体RNA的提取及cDNA的合成从家蚕四龄4 d起一直到其上簇,在各时期各取6头家蚕500 μL血液,离心去上清,加适量Trizol于–80 ℃裂解[11]。在家蚕五龄3 d时,取家蚕各组织(头、皮、中肠、血液、马氏管、丝腺、精巢、卵巢、脂肪体),快速放入液氮冷冻研磨后加Trizol进行裂解。之后使用苯酚与氯仿进行总RNA的抽提[11],根据说明进行反转录,得到cDNA模板。
1.2.2 RACE法扩增Bmintegrinβ1的全长序列在NCBI上下载晚期智人、果蝇、烟夜蛾以及其他昆虫的integrin β1的mRNA序列。根据Blast比对,在SilkDB (http://www.silkdb.org/silkdb/)网站上下载预测的Bmintegrin β1的mRNA序列[11]。参考预测序列设计扩增引物Bmintegrin β1-F、Bmintegrin β1-R (见表 1),以五龄3 d家蚕血液cDNA为模板扩增其部分中间序列,经测序得到已知片段,据此设计RACE特异引物GSP1、GSP2、NGSP1、NGSP2 (表 1)对Bmintegrin β1的3′和5′端进行扩增。测序成功后,将已知序列进行拼接,获得完整的Bmintegrin β1的cDNA序列。
表 1 引物序列Table 1 Primer seuences
| Primer name | Primer sequence (5'–3') |
| Bmintegrinβ1-F | CGATGTTTTAATCCCGCA |
| Bmintegrinβ1-R | CCCGTATCCCATTTGGC |
| GSP1 | TGCCCAAAGCACTGAGCTTCTCTT |
| NGSP1 | GCCGAGCCTGTTGCCATTCCCAT |
| GSP2 | GCCGATCATAGAGGAAGGCAGGAT |
| NGSP2 | CCAAGACACTCGGAAAGTGGTCAT |
| Bmintegrinβ1-YH-F (BamHⅠ) | GGATCCGCAGAATCCTTGCTCGAGTAAA |
| Bmintegrinβ1-YH-R (NotⅠ) | GCGGCCGCTGGTACCTTTTTAGGGCATT |
| Bmintegrinβ1-CDS-F | ATGTACATAAAACGAACGAGTT |
| Bmintegrinβ1-CDS-R Actin3 F Actin3 R | TTTTCCGGCGTAAGTTG TTCGTACTGGCTCTTCTCGT CAAAGTTGATAGCAATTCCCT |
| The underlined sequences are restriction enzyme sites. | |
表选项
1.2.3 Bmintegrin β1蛋白序列分析根据获得的全长序列,使用在线预测网站ORF Finder预测出该基因的开放阅读框[11]。同样运用在线SignalP 4.1 Server[14]、TMHMM Serverv.2.0网站对其信号肽与跨膜结构位点进行了预测,使用SMART、ExPasy等对该蛋白的分子量、等电点、糖基化位点等信息进行预测[14-15]。
1.2.4 Bmintegrin β1蛋白进化分析根据ORF在线预测得到Bmintegrin β1编码的蛋白,在NCBI中进行蛋白序列比对后下载了烟夜蛾、脐橙螟、亚洲玉米螟、甜菜夜蛾、果蝇等24个物种的同源序列。通过Clustalx软件对蛋白序列进行比对,将比对结果导入MEGA 6.0软件,通过该软件使用NJ法构建进化树[16]。
1.2.5 Bmintegrin β1表达谱分析以反转录得到的家蚕各组织与各时期的血液cDNA为模板,以肌动蛋白3 (BmActin3)为内参对Bmintegrin β1进行半定量PCR检测[12]。通过琼脂糖凝胶电泳分析,得到转录水平表达谱[17-18]。使用获得的抗体,通过免疫印迹实验获得其蛋白水平的表达谱。
1.2.6 Bmintegrin β1原核表达参考蛋白结构域预测结果,选取家蚕Bmintegrinβ1蛋白32aa–780aa这段整合素结构域保守序列,使用Primer5.0设计特异引物Bmintegrin β1-YH-F、Bmintegrin β1-YH-R,并在引物两端分别加上BamHⅠ、NotⅠ酶切位点及其保护碱基(引物序列见表 1)。通过PCR扩增及测序验证后,将特异片段分别连接到原核表达载体pET-32(a)、pET-28(a)上,然后导入Rosseta感受态,细菌扩大培养后提取质粒,进行酶切验证[11, 19]。成功后分别将阳性克隆在试管中小规模放大,放大后各取50 μL菌液接种到3只装有30 mL含抗生素的LB培养基的试管中(试管编号分别为A、B、C、A1、B1、C1),通过测量OD值将细菌培养到对数生长期,之后向其中4只试管(A、B、A1、B1)加入诱导剂IPTG至终浓度为1.0 mmol/L,其中两只试管(C、C1)不加诱导剂处理作为阴性对照。将(A、A1、C、C1)在37 ℃、220 r/min摇床培养7 h,将(B、B1)在16 ℃、220 r/min摇床培养22 h。分别收集实验组和对照组菌液用冷冻高压仪进行高压冲击破碎,4 ℃离心后收集上清液与沉淀,通过SDS-PAGE后,经考马斯亮蓝染色观察,选出表达效率最高的原核表达载体以及表达的最适温度。之后用同样的方法进行IPTG最适浓度的筛选,最后将最适表达载体菌株调至最适IPTG浓度,在最适温度下大规模诱导。
1.2.7 Bmintegrin β1蛋白纯化细菌进行大规模诱导后,离心收集菌体并将其溶于50 mmol/L Tris-HCl中,同时加入溶菌酶0.2 mg/mL和MgCl21 g/L。使用冷冻高压破碎仪将菌液反复高压破碎4次。收集上清与沉淀。进行SDS-PAGE检测[19]。结果目的蛋白在包涵体中,使用洗涤剂将包涵体进行洗涤。最后将包涵体溶解于pH值为12.0的8 mol/L尿素、25 mmol/L Tris-HCl、0.3 mol/L NaCl混合液中,搅拌过夜,次日离心,吸取上清进行凝胶电泳,结果显示上清液中含有目的蛋白。将上清液进行过滤除杂后压入装有Ni+亲和层析的填料中,由于目的蛋白上挂有His组氨酸的标签,该标签可以和Ni+相互吸附,再根据咪唑具有与His标签相似的结构可以竞争将目的蛋白洗脱下来的原理,我们用不同浓度的咪唑洗脱层析柱,分别收取洗脱液并进行凝胶电泳和考马斯亮蓝染色,挑选单一并且大小合适的条带进行透析、脱盐、浓缩。之后根据His标签做免疫印迹,检测该条带是否为重组的目的蛋白。验证成功后,加30%甘油冷冻保存。
1.2.8 Bmintegrin β1多克隆抗体制备将纯化的蛋白分5次注入8周左右的昆明鼠体内,5次注射所用蛋白量依次上升,分别为每只50、60、70、90、120 μg,每次注射前先测定蛋白浓度,根据浓度计算出每次要注射的体积[11]。并且第一次与同体积比的费式完全佐剂混合后注射,后三次与同体积比的费式不完全佐剂混合后注射,最后一次不加佐剂进行注射[11]。最后一次注射3–5 d后取血,取血后先室温静置4 h,然后1 100、4 000、8 000、13 500 r/min各33 min,进行梯度离心收集上清液,最后将收集的上清液加入30%左右的甘油进行分装并于–80 ℃保存。
1.2.9 Bmintegrin β1多克隆抗体效价检测根据ELISA说明书要求,分别进行特异性抗原的包被,封闭,加含抗体目的血清、加无抗体阴性血清,添加酶标抗体,显色,终止反应,用分光光度计测定仪各孔OD值,计算后得出抗体效价。
1.2.10 利用免疫印迹方法检测Bmintegrin β1蛋白抗血清特异性首先制备一块12% SDS-PAGE胶,以得到的重组蛋白作为上样样品,经跑胶后转膜,再用BSA室温封闭3 h,4 ℃孵育一抗(即Bmintegrin β1抗血清和阴性对照血清)过夜,TBST洗涤后二抗孵育,最后加化学反应液曝光分析[20]。
2 结果2.1 家蚕Bmintegrin β1全长克隆与分析以提取的五龄3 d家蚕血液cDNA作为模板进行PCR扩增,使用Bmintegrin β1-F、R引物扩增获得了一个2 300 bp左右的片段(图 1A)。利用RACE技术根据特异引物GSP1、NGSP1、GSP2、NGSP2 (参照表 1)扩增3′、5′端cDNA序列。经RACE扩增得到了Bmintegrin β1的全长[21]。Bmintegrin β1共有3个剪切体,其mRNA全长分别为3 647、3 606、3 785 bp。三种剪切体具有共同的开放阅读框,其长为2 502 bp,共编码833个氨基酸,预测蛋白分子量为91.14 kDa,等电点为5.507。位于10号染色体且与基因组序列比对显示该基因组全长14.61 kb,包括18个外显子和17个内含子。
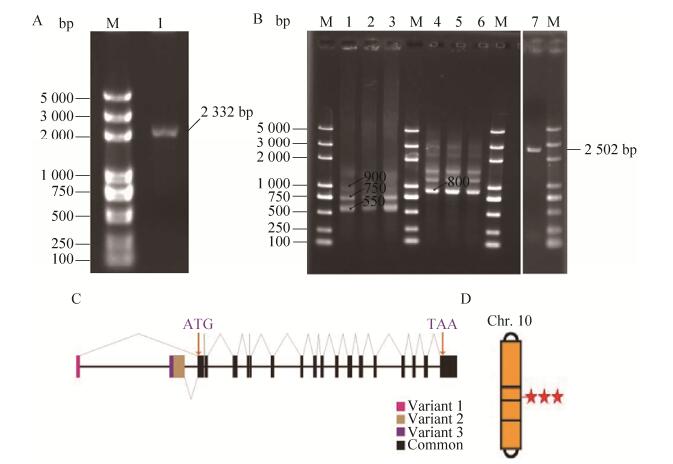 |
| 图 1 家蚕Bmintegrin β1全长序列分析 Figure 1 The complete sequence analysis of Bmintegrin β1 in silkworm, Bombyx mori. (A) 1% Agar gel analysis of the Bmintegrin β1 PCR product. M: marker; 1: PCR product of partial fragment; 2: 5′ RACE product; 3: 3′ RACE product. (B) Total length of CDs. (C) The three kinds of shear of mRNA. (D) Chromosome location analysis. |
| 图选项 |
2.2 Bmintegrin β1蛋白结构分析通过在线工具SignalP对其信号肽进行分析预测,该蛋白在1–32区域为1个信号肽区域(图 2B)[21]。根据TMHMM Server v.2.0对Bmintegrinβ1表达蛋白的跨膜区域进行了在线预测,发现其含有一个跨膜区域且其位置为764–786 aa,并且1–763 aa在细胞膜外,只有787–833 aa在细胞膜内侧,并且含有4个糖基化位点、6个结构域。
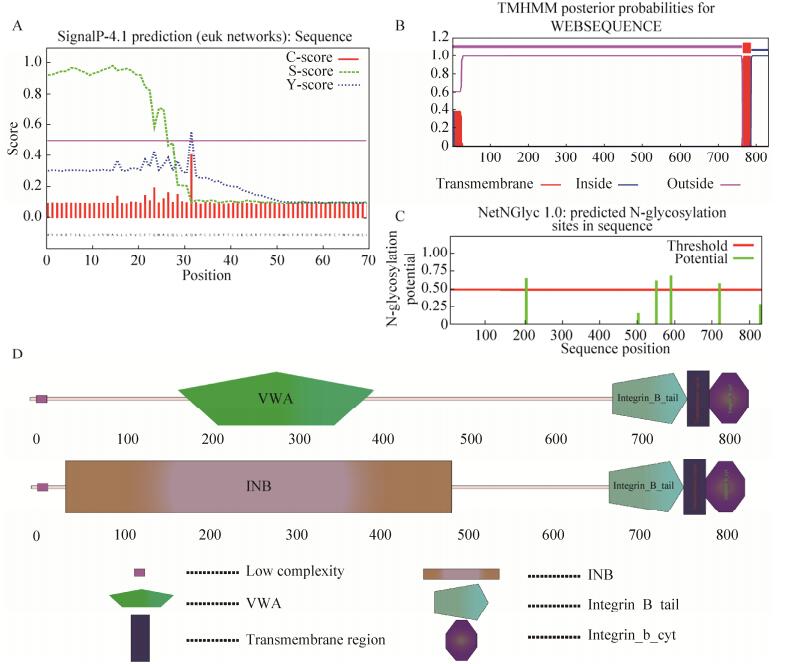 |
| 图 2 家蚕Bmintegrin β1蛋白结构预测与分析 Figure 2 Prediction and analysis of the Bmintegrin β1 protein's structure. (A) The prediction of the Bmintegrin β1 protein signal peptide. (B) The prediction of Bmintegrin β1 transmembrane helices protein. (C) The prediction of the Bmintegrin β1 protein's position of Hydroxylation. (D) The prediction of the Bmintegrin β1 protein domain. |
| 图选项 |
2.3 Bmintegrin β1同源进化分析使用Clustalx软件对24种与Bmintegrin β1具有同源序列的物种进行聚类分析,根据MEGA6.0中的NJ法构建进化树,结果如图 3所示。通过进化树分析,我们发现家蚕Bmintegrin β1与同鳞翅目的烟夜蛾和黑脉金斑蝶的整合素基因相似性最高。
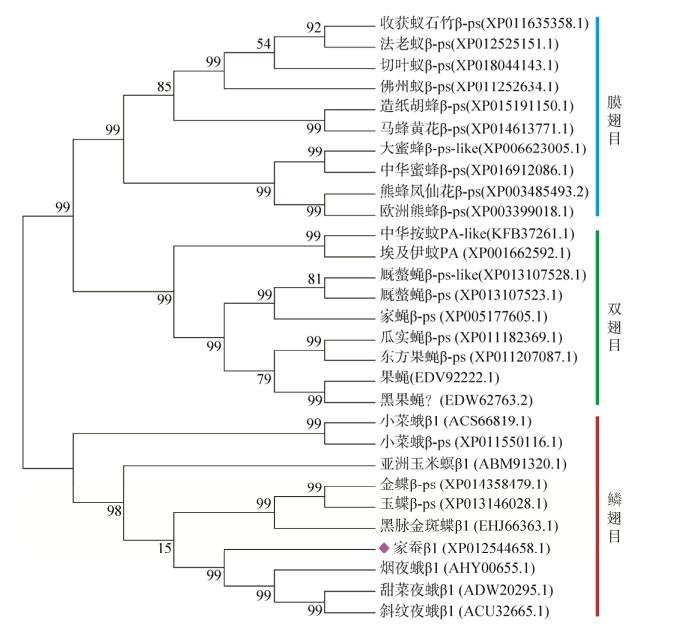 |
| 图 3 Bmintegrin β1蛋白进化分析 Figure 3 The phylogenetic tree of the Bmintegrin β1 family. |
| 图选项 |
2.4 Bmintegrin β1原核表达载体的构建根据设计的特异性引物Bmintegrin β1-YH-F (BamHⅠ)、Bmintegrin β1-YH-R (NotⅠ)进行PCR扩增。测序验证后,将该片段分别连接到pET-28a(+)、pET-32a(+)载体上。将表达质粒导入感受态细胞Trans1T1后,扩大培养,提取质粒并使用BamHⅠ与NotⅠ进行双酶切验证,分别获得2 532 bp和5 300 bp左右的条带。证明成功获得重组表达质粒pET-28a(+)-Bmintegrin β1、pET-32a(+)-Bmintegrin β1。将表达质粒分别导入Rosseta表达菌株中,加入带有抗性的LB培养基进行培养,成功获得表达菌株[23]。
2.5 Bmintegrin β1原核诱导表达及诱导条件优化将以上得到的两株表达菌种pET-28a(+)-Bmintegrin β1、pET-32a(+)-Bmintegrin β1分别编号为A与B,并分别接种于3只装有抗性的LB培养基中,命名为A1、A2、A3和B1、B2、B3。按照材料与方法中的操作进行培养之后提取总蛋白进行凝胶电泳,经考马斯亮蓝染色观察到pET-28a(+)-Bmintegrin β1菌株在37 ℃条件下包涵体中的诱导表达量最高(图 3A)。之后我们又根据pET-28a(+)-Bmintegrin β1菌株设计了不同的IPTG诱导浓度,结果发现该菌株在0.8 mmol/L IPTG诱导浓度下表达量最高(图 3B)。得出最优的诱导表达条件后,我们将pET-28a(+)-Bmintegrin β1菌株在0.8 mmol/L IPTG、37 ℃的条件下扩大培养与诱导。
2.6 Bmintegrin β1蛋白纯化以及抗血清的制备以及Western blotting验证经过以上大规模培养与诱导、离心菌液、冷冻高压破碎细菌、离心、洗涤、上柱等一系列处理后,通过Ni+柱亲和层析法初步纯化蛋白,再经脱盐柱洗脱与透析液透析得到纯度 > 99%的Bmintegrin β1重组蛋白(图 4C)。再通过Western blotting方法,使用His标签抗体与纯化出的蛋白进行孵育,成功确定纯化出的蛋白为我们需要的重组蛋白(图 4D)。之后用纯化的家蚕Bmintegrin β1重组蛋白免疫昆明鼠,2个月后取血,获得鼠源抗血清。用纯化出的重组蛋白作为上样样品,进行Western blotting分析,结果显示在85 kDa左右有单一的条带(图 4E),以上结果表明我们自制的抗体能够特异性识别Bmintegrin β1蛋白[13]。
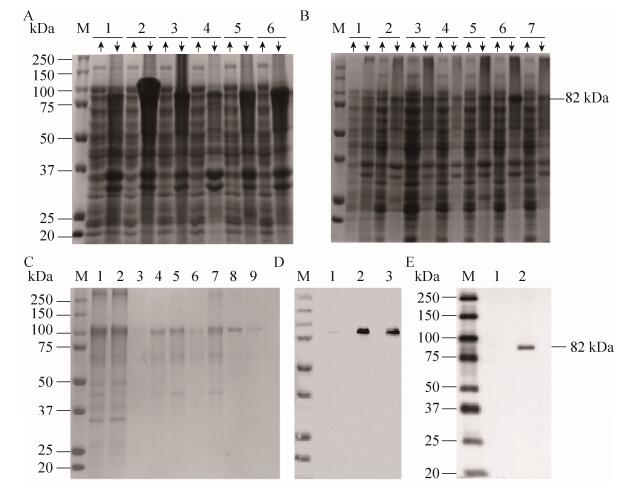 |
| 图 4 pET28 (32)a-Bmintegrin β1的诱导表达、纯化与验证 Figure 4 The expression, purification and verification of pET28(32)a-Bmintegrin β1. (A) The temperature gradient induction of Bmintegrin β1 (The concentration of IPTG is 1 mmol/L). M: marker; 1: the non-induced supernatant and sediment of pET-28a(+)-Bmintegrin β1 (IPTG free); 2: the induced supernatant and sediment of pET-28a (+)-Bmintegrin β1 at 37 ℃; 3: the induced supernatant and sediment of pET-28a(+)-Bmintegrin β1 at 16 ℃; 4: the non-induced supernatant and sediment of pET-32a(+)-Bmintegrin β1 (IPTG free); 5: the induced supernatant and sediment of pET-32a(+)-Bmintegrin β1 at 37 ℃; 6: the induced supernatant and sediment of pET-32a(+)-Bmintegrin β1 at 16 ℃. (B) The IPTG concentrate gradient induction of pET-28a(+)-Bmintegrin β1 (37 ℃, 7 h). M: marker; 1: non-induced supernatant and sediment (IPTG free); 2: induced supernatant and sediment by 0.1 mmol/L IPTG 3: induced supernatant and sediment by 0.2 mmol/L IPTG; 4: induced supernatant and sediment by 0.4 mmol/L IPTG; 5: induced supernatant and sediment by 0.6 mmol/L IPTG; 6: induced supernatant and sediment by 0.8 mmol/L IPTG; 7: induced supernatant and sediment by 0.10 mmol/L IPTG. (C) The purification of Bmintegrin β1 recombinant protein (37 ℃ for 7 h) M: marker; 1: the inclusion body induced by 0.8 mmol/L IPTG; 2: penetrating liquid; 3: the solution of multiple equilibria; 4–9: the eluent of 40–500 mmol/L. (D) Detection of purified protein by His tag M: marker; 1: the non-induced sediment of pET-28a(+)-Bmintegrin β1; 2, 3: the induced sediment of pET-28a(+)-Bmintegrin β1. (E) The detection of Bmintegrin β1 anti-serum. 1: negative serum; 2: the Bmintegrin β1 anti-serum. |
| 图选项 |
2.7 Bmintegrin β1在家蚕各组织以及血液不同时期的表达谱为了查看该基因在家蚕不同组织以及血细胞不同时期中是否有表达差异,我们在五龄3 d时收集了家蚕各组织,在四龄3 d到熟蚕各时期收集家蚕血液,制备cDNA模板,以肌动蛋白3 (BmActin3)为内参对Bmintegrin β1进行半定量PCR检测[24]。半定量结果显示Bmintegrin β1在以下各组织中均有较高表达,尤其在血液中表达量最高,其次是头与表皮(图 5A)。并且Bmintegrin β1在四龄3 d到熟蚕时期持续性高表达(图 5B)。随后我们使用制备的抗体通过Western blotting实验获得了家蚕各组织的蛋白表达谱,如图 5C所示,其结果与半定量结果基本相似。
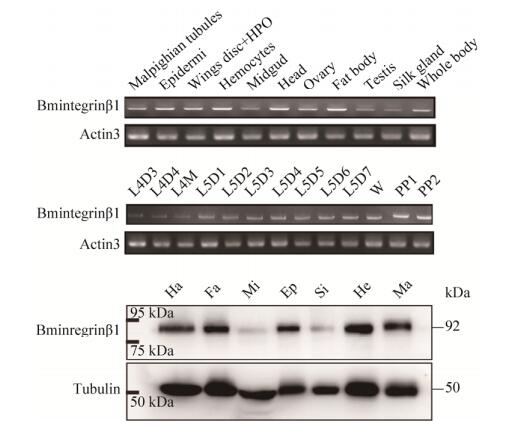 |
| 图 5 各组织与各时期Bmintegrin β1表达谱 Figure 5 Tissue and stage expression profile of Bmintegrin β1. (A) The expression of Bmintegrin β1 mRNA in the different tissues of the 3rd day of the 5th larvae. (B) The expression of Bmintegrin β1 mRNA in hemocytes from the molting period of the 4th larvae to the 2st day of spinning. L4D3: day 3 of the fourth instar larval; L4M: molting stage of the fourth instar larval; L5M: molting stage of the fifth instar larval; W: wandering stage; PP1: day 1 of prepup; PP2: day 2 of prepup. (C) The expression of Bmintegrin β1 protein in the different tissues of the 3rd day of the 5 th larvae. |
| 图选项 |
2.8 Bmintegrin β1抗血清效价的评定使用间接ELISA法对我们制备的抗血清进行检测并进行效价评定。简略步骤如下:1)抗原的包被;2)洗涤酶标板;3)用5%BSA进行封闭处理;4)孵育一抗4 ℃过夜;5)孵育二抗室温2 h;6)显色曝光处理;7)抗体效价的计算。经过以上实验步骤我们计算出制备的抗血清效价高达1 542 300。
3 讨论整合素是由α、β两个亚基组成的一类跨膜异二聚体蛋白,在生物体的生理和病理等诸多生命过程中起着重要的调节作用[5]。在哺乳动物中,整合素在免疫反应、细胞粘附、细胞的迁移等许多反应过程发挥着关键作用[25-31]。除此之外,整合素也与炎症反应、血栓的形成、动脉硬化、免疫功能障碍以及肿瘤的发生、发展、转移及侵袭密切相关[32-33]。总之,整合素不仅在生物体中发挥着关键作用,还是肿瘤治疗的一个潜在的重要靶标。
在家蚕中,整合素的研究虽有一定的进展,但是仍然停留在较低的水平上。在前人研究的基础上,我们应用PCR及RACE技术系统克隆及分析了Bmintegrin β1全长。该基因共有3种具有相同开放阅读框的剪切体。我们根据其蛋白序列利用NJ法进行了进化树分析,发现其与同鳞翅目的烟夜蛾和黑脉金斑蝶进化关系最为接近,探究该基因的功能也将为以鳞翅目为主的病虫害防治提供一定的参考价值。随后,我们进行了蛋白序列分析,预测到其有4个羟基化位点和5个保守的整合素家族结构域,也验证了该蛋白为保守的整合素β家族成员。通过软件预测到该蛋白含有信号肽,预示着其为一个跨膜蛋白,根据前人研究发现整合素中单独的α亚基或β亚基均不能直接定位到细胞膜上来发挥作用[34]。为了进一步分析其功能,我们构建了原核表达载体,通过对原核表达条件的优化,成功获得了高度纯化的蛋白[35]。重组后的蛋白比我们预测的蛋白偏大,我们猜测可能因为His-tag带有较强的正电荷,降低了蛋白在SDS-PAGE中的泳动速率,导致了表观分子量的变大。经过His标签验证我们确认得到了家蚕整合素β1的重组蛋白,经文献报道其可能参与了昆虫的免疫反应,之后我们也将设计细菌凝集、细菌吞噬等免疫相关实验验证该蛋白在免疫方面的功能。随后我们用该纯化得到的重组蛋白对小鼠进行免疫注射,成功获得了该蛋白的多克隆抗体,为进一步揭示该蛋白的功能提供了有效的抗体工具。我们也将通过免疫荧光实验,使用获得的多克隆抗体,查看该蛋白的细胞定位。通过半定量PCR及Western blotting分析均显示该基因持续在血细胞中高量表达,同样预示其可能在昆虫的免疫反应中发挥作用[36],之后我们也将进一步在家蚕血液、中肠、脂肪体等免疫组织中进行免疫应答反应的研究。研究整合素蛋白的功能将对家蚕疾病的防治起到一定的积极作用,并对人类血液疾病的治疗提供参考。
4 结论从家蚕中克隆得到整合素家族β1基因全长,该基因共有3个剪切体,长度分别为3 647、3 606、3 785 bp,从进化树来看,家蚕Bmintegrin β1与同鳞翅目的烟夜蛾和黑脉金斑蝶同源关系最高。该基因在家蚕各组织中都有较高表达,尤其在血液各时期中持续高表达。我们利用大肠杆菌构建了原核表达载体,成功表达并纯化出Bmintegrin β1蛋白。我们用该蛋白免疫小鼠成功获得了该重组蛋白的特异抗体。这为进一步研究家蚕Bmintegrin β1以及整合素家族功能奠定了基础。
参考文献
| [1] | Zhou XH. Progress of integrin research.Res Progr Integrins, 1995, 15(2): 84–86.(in Chinese). 周晓虹. 整合素的研究进展.国外医学(生理、病理科学与临床分册), 1995, 15(2): 84-86. |
| [2] | Sun YL. cDNA Cloning and gene expression of integrin β subunits from Bombyx mori[D]. Wuhan: Huazhong Normal University, 2009 (in Chinese). 孙亚兰. 家蚕整合蛋白β基因的克隆及其表达分析[D]. 武汉: 华中师范大学, 2009. |
| [3] | Schlaepfer DD, Hanks SK, Hunter T, et al. Integrin-mediated signal transduction linked to Ras pathway by GRB2 binding to focal adhesion kinase.Nature, 1994, 372(6508): 786–791.DOI: 10.1038/372786a0 |
| [4] | Giancotti FG, Ruoslahti E. Integrin signaling.Science, 1999, 285(5430): 1028.DOI: 10.1126/science.285.5430.1028 |
| [5] | Campbell ID, Humphries MJ. Integrin structure, activation, and interactions.Cold Spring Harb Perspect Biol, 2011, 3(3): a004994. |
| [6] | Santala P, Heino J. Regulation of integrin-type cell adhesion receptors by cytokines.J Biol Chem, 1991, 266(34): 23505–23509. |
| [7] | Liu J. Functional study of integrin in hemocytes of Asian corn borer (Ostrinia furnacacalis) during the course of encapsulation[D]. Harbin: Northeast Agricultural University, 2008 (in Chinese). 刘佳. 亚洲玉米螟整合素在血细胞包囊外源物过程中的功能研究[D]. 哈尔滨: 东北农业大学, 2008. |
| [8] | Zhao HF. Studies on adhesion and encapsulation of Ostrinia furnacalis larval hemocytes and cloning of its integrin β1 gene[D]. Guangdong: Sun Yat-Sen University, 2007 (in Chinese). 赵华福. 亚洲玉米螟幼虫血细胞黏附和包囊行为研究及整合素β1亚基的克隆[D]. 广州: 中山大学, 2007. |
| [9] | Zhang K, Xu M, Su J, et al. Characterization and identification of the integrin family in silkworm, Bombyx mori.Gene, 2014, 549(1): 149–155.DOI: 10.1016/j.gene.2014.07.060 |
| [10] | Zhao YZ, Zhang K, Tang M, et al. Cloning and expression of scavenger receptor class B BmSCRB8 in silkworm Bombyx mori.Chin J Biotechnol, 2016, 32(10): 1408–1421.(in Chinese). 赵羽卒, 张奎, 唐梅, 等. 家蚕B类清道夫受体BmSCRB8基因的克隆及表达.生物工程学报, 2016, 32(10): 1408-1421. |
| [11] | Xu HF, Xia QY, Liu C, et al. Construction and expression of the transgenic vector pBacA3EG in the silkworm Bombyx mori.Acta Entomol Sin, 2005, 48(5): 799–803.(in Chinese). 徐汉福, 夏庆友, 刘春, 等. 家蚕转基因载体pBacA3EG的构建及其表达.昆虫学报, 2005, 48(5): 799-803. |
| [12] | Yang W, Qi DW, Yu QY, et al. Cloning, sequence analysis and expression of carboxylesterase gene Bmae35 in the silkworm, Bombyx mori.Acta Entomol Sin, 2011, 54(6): 634–641.(in Chinese). 杨微, 齐登伟, 余泉友, 等. 家蚕羧酸酯酶基因Bmae35的克隆、序列分析及表达.昆虫学报, 2011, 54(6): 634-641. |
| [13] | Li YD. Analysis of the diversity of rumen microbes and cloning and expression of a new β-glucosidase encoding gene from Miscanthus sinensis and fed Xiangxi yellow cattle (Bos taurus)[D]. Changsha: Hunan Agricultural University, 2012 (in Chinese). 李亚丹. 芒草驯养湘西黄牛(Bos taurus)瘤胃微生物多样性及β-葡萄糖苷酶新基因的克隆与表达研究[D]. 长沙: 湖南农业大学, 2012. |
| [14] | Chen GZ, Sun Y, Zhan WH, et al. Sequencing of a homologue of mmpL3 from Gordonia bronchialis and prediction of its function.J Pathog Biol, 2016, 11(2): 147–150.(in Chinese). 陈高瞻, 孙妍, 占卫红, 等. 戈登菌mmpL3同源基因序列分析及功能预测.中国病原生物学杂志, 2016, 11(2): 147-150. |
| [15] | Wu M, Han SN, Chen Y, et al. Molecular identification of 11 stem borer species based on the mitochondrial CO Ⅰ gene.J Plant Protect, 2016, 42(4): 94–98.(in Chinese). 吴敏, 韩盛楠, 陈阳, 等. 基于COⅠ基因序列的11种蛀茎害虫的分子鉴定.植物保护, 2016, 42(4): 94-98. |
| [16] | Liang HH, Gao HY, Xu M, et al. Cloning and characterization of BmBrat in silkworm, Bombyx mori.Chin J Biotech, 2016, 32(3): 375–384.(in Chinese). 梁航华, 高洪燕, 徐曼, 等. 家蚕BmBrat基因的克隆与鉴定.生物工程学报, 2016, 32(3): 375-384. |
| [17] | Qiu NS, Liu C, Yan YJ, et al. Cloning and development expression of Allatotropin receptor gene in Bombyx mori.J Hefei Univ Technol (Nat Sci), 2012, 35(8): 1117–1121.(in Chinese). 邱娜莎, 刘畅, 严雅静, 等. 家蚕促咽侧体素受体基因克隆及发育表达.合肥工业大学学报(自然科学版), 2012, 35(8): 1117-1121. |
| [18] | Luo CP, Li JH, Xie YM, et al. Cloning and expression of conserved sequences of cry-type gene in rosetta (DE3).J Anhui Agric Sci, 2012, 40(2): 648–651.(in Chinese). 罗翠平, 李金华, 谢烨明, 等. cry基因保守序列克隆及其在大肠杆菌Rosetta (DE3)中的表达.安徽农业科学, 2012, 40(2): 648-651. |
| [19] | Chen HF, Wang X, Xie K, et al. Gene cloning and expression characteristics of vacuolar-type ATPase subunit B in Bombyx mori.Chin J Biotechnol, 2016, 32(4): 487–496.(in Chinese). 陈慧芳, 王鑫, 谢康, 等. 家蚕Ⅴ型ATP酶B亚基的克隆及表达特征.生物工程学报, 2016, 32(4): 487-496. |
| [20] | Yu S, Su JJ, Xu M, et al. Identification and characterization of a novel hemocyte specific gene Bm04862 in silkworm, Bombyx mori.Chin J Biotechnol, 2016, 32(2): 241–249.(in Chinese). 余霜, 苏晶晶, 徐曼, 等. 家蚕血细胞特异表达新基因Bm04862的鉴定及表达.生物工程学报, 2016, 32(2): 241-249. |
| [21] | Jiang LP, Zhang J, Li XY, et al. Gene cloning and expression of Huwen toxin-XV Ⅱa from the spider Ornithoctonus huwena.J Pathog Biol, 2016, 11(7): 603–606.(in Chinese). 蒋立平, 章洁, 李先耀, 等. 虎纹捕鸟蛛毒素-XVⅡa的基因克隆及在酿酒酵母中的表达.中国病原生物学杂志, 2016, 11(7): 603-606. |
| [22] | Tian QL, Lin YL, Zheng QY, et al. Cloning and expression regulation analysis of longan DlPPO1 gene.Acta Bot Boreal-Occident Sin, 2016, 36(6): 1098–1104.(in Chinese). 田奇琳, 林玉玲, 郑庆游, 等. 龙眼DlPPO1基因的克隆及其表达调控分析.西北植物学报, 2016, 36(6): 1098-1104. |
| [23] | Meredith Jr JE, Schwartz MA. Integrins, adhesion and apoptosis.Trends Cell Biol, 1997, 7(4): 146–150.DOI: 10.1016/S0962-8924(97)01002-7 |
| [24] | Brooks PC, Montgomery AMP, Rosenfeld M, et al. Integrin αvβ3 antagonists promote tumor regression by inducing apoptosis of angiogenic blood vessels.Cell, 1994, 79(7): 1157–1164.DOI: 10.1016/0092-8674(94)90007-8 |
| [25] | Hood JD, Cheresh DA. Role of integrins in cell invasion and migration.Nat Rev Cancer, 2002, 2(2): 91–100.DOI: 10.1038/nrc727 |
| [26] | Hughes AL. Evolution of the integrin α and β protein families.J Mol Evol, 2001, 52(1): 63–72.DOI: 10.1007/s002390010134 |
| [27] | Huttenlocher A, Horwitz AR. Integrins in cell migration.Cold Spring Harb Perspect Biol, 2011, 3(9): a005074. |
| [28] | Chan KT, Cortesio CL, Huttenlocher A. Integrins in cell migration.Methods Enzymol, 2007, 426: 47–67.DOI: 10.1016/S0076-6879(07)26003-3 |
| [29] | Li DD. The Study about value of 99mTc-HYNIC-PEG4-E[PEG4-c (RGDfK)]2 in esophageal tumor[D]. Changchun: Jilin University, 2012 (in Chinese). 李丹丹. 99mTc-HYNIC-PEG4-E[PEG4-c (RGDfK)]2在食管肿瘤中的价值研究[D]. 长春: 吉林大学, 2012. |
| [30] | Desgrosellier JS, Cheresh DA. Integrins in cancer: biological implications and therapeutic opportunities.Nat Rev Cancer, 2010, 10(1): 9–22.DOI: 10.1038/nrc2748 |
| [31] | Jin H, Varner J. Integrins: roles in cancer development and as treatment targets.Br J Cancer, 2004, 90(3): 561–565.DOI: 10.1038/sj.bjc.6601576 |
| [32] | Barczyk M, Carracedo S, Gullberg D. Integrins.Cell Tissue Res, 2010, 339(1): 269–280.DOI: 10.1007/s00441-009-0834-6 |
| [33] | Feng D. Prokaryotic expression and characterizaction of DNA-protein interaction for GlnR factor from Streptococcus agalactiae[D]. Liuzhou: Guangxi University of Science and Technology, 2013 (in Chinese). 冯丹. 无乳链球菌GlnR因子的原核表达及其与DNA的相互作用研究[D]. 柳州: 广西科技大学, 2013. |
| [34] | Tan J, Zhang K, Xu M, et al. Identification and subcelluar localization of Bmintegrin αPS3 from silkworm (Bombyx mori).Sci Agric Sin, 2013, 46(22): 4808–4815.(in Chinese). 谈娟, 张奎, 徐曼, 等. 家蚕整合素基因Bmintegrin αPS3的鉴定及亚细胞定位.中国农业科学, 2013, 46(22): 4808-4815.DOI:10.3864/j.issn.0578-1752.2013.22.019 |
| [35] | Zhuang SF, Kelo L, Nardi JB, et al. Multiple α subunits of integrin are involved in cell-mediated responses of the Manduca immune system.Dev Comp Immunol, 2008, 32(4): 365–379.DOI: 10.1016/j.dci.2007.07.007 |
| [36] | Mahairaki V, Lycett G, Blass C, et al. Beta-integrin of Anopheles gambiae: mRNA cloning and analysis of structure and expression.Insect Mol Biol, 2001, 10(3): 217–223.DOI: 10.1046/j.1365-2583.2001.00259.x |
