
 , 钱国英
, 钱国英浙江万里学院 生物与环境学院,浙江 宁波 315000
基金项目:国家海洋公益性行业科研专项(No.201405015),浙江省公益性技术应用研究计划项目(No.2014C32072)资助
摘要: 近年来,胶原蛋白因其良好的生物学性能在生物材料应用中得到越来越多的关注,为了建立一种快速高效的鳖源胶原蛋白纯化方法和探究其在生物材料中的应用价值,首先用Van Gieson 染色法和苦味酸-天狼星红染色法观察裙边胶原纤维组织结构,发现裙边胶原纤维含量非常高且类型主要是Ⅰ型。采用不同截留分子量的透析袋对裙边胶原蛋白粗提液进行直接透析纯化,发现截留分子量为100 kDa的透析袋在透析48 h后对裙边胶原蛋白的纯化效果最好,SDS-PAGE检验显示几乎没有杂带。对裙边胶原蛋白生物学性能包括吸水性、体外降解性进行考察,其吸水力和持水力分别高达12.06 g/g和98.21%,且在72 h后被完全降解;对裙边胶原蛋白海绵的溶血性、皮肤致敏性、肝部创伤止血性、促创伤皮肤愈合性进行了研究,并和交联胶原进行比较,发现裙边胶原蛋白和交联胶原均不会造成SD大鼠溶血和皮肤过敏,二者均具有良好的止血效果,且裙边胶原蛋白能显著缩短创伤皮肤愈合时间,具有良好的促创伤皮肤愈合性,而交联胶原效果欠佳。本研究表明裙边胶原蛋白表现出了优良的生物学性能,在生物材料领域具有很大应用价值。
关键词: 中华鳖裙边 胶原蛋白 纯化 生物学性能 生物材料
Isolation, purification of collagen from soft-shelled turtle calipash for application in biomaterial
Yang Ya'nan, Li Caiyan

 , Qian Guoying
, Qian Guoying College of Biological and Environmental Sciences, Zhejiang Wanli University, Ningbo 315000, Zhejiang, China
Received: December 25, 2015; Accepted: April 25, 2016
Supported by:State Oceanic Administration of China (No. 201405015), Research Project of Public Welfare Technology Application in Zhejiang Province (No. 2014C32072)
Corresponding authors:Caiyan Li. Tel/Fax: +86-574-88222991; E-mail: licy82@163.com
Abstract: Recently,research on collagen attracts more interests due to its good biological compatibility. The present study attempted to establish a fast and efficient method to purify collagen from soft-shelled turtle and to explore its application in biological materials. The structure and type of collagen fiber in calipash were determined by van Gieson staining and Picrosirius red staining,which could contribute to the isolation of collagen from soft-shelled turtle Calipash (STCC). Collagen fibers were in high content and the main collagen fiber was type Ⅰ in STCC. The crude STCC solution was purified by dialysis with different cut-off molecular weight. SDS-PAGE demonstrated that the best purification was in applying 100 kDa dialysis bags after 48 h. The water absorbing capacity and holding capacity of STCC were up to 12.06 g/g and 98.21%,respectively. STCC can be degraded by collagenase in vitro entirely after 72 h. The hemolysis,skin sensitization,hemostatic and wound healing of STCC were determined by using SD rat model,and the collagen cross-linked by glutaric dialdehyde was set as a comparison. STCC and STCC cross-linked did not result in destructed red blood cell,inflamed and sensitized skin. Both materials exhibited good hemostatic effect. Thus,STCC improved the wound healing efficiently. This study implies a potential of STCC in the field of biomaterial.
Key words: soft-shelled turtle calipash collagen purification biological properties biomaterial
近年来,胶原蛋白因其良好的生物相容性在生物材料的应用中得到越来越多的关注[1],传统提取胶原蛋白所使用的原料主要来自猪和牛等动物的皮肤等结缔组织[2]。但由于疯牛病、禽流感、口蹄疫等问题[3],我国政府目前禁止进口所有以牛的组织为原料提取的胶原蛋白产品。与陆生动物相比,水产胶原蛋白在原料来源、安全性和产品成本等方面均具有很大的优势,因此,探索利用水产胶原替代现有传统胶原蛋白产品在生物医学材料领域中具有重要的科学意义和实用价值[4]。
目前人们已经从海参[5]、鲟鱼[6]等多种水产品中提取到了胶原蛋白,相关报道越来越多。但对于我国传统的营养滋补佳品,本身就富含胶原蛋白的水产动物——中华鳖作为新型生物胶原蛋白来源的研究却比较缺乏。鳖甲周围的结缔软组织通常被称为“裙边”,胶原蛋白含量十分丰富,经前期实验表明,其干重含量超过70%,可以提供丰富的胶原蛋白来源。另外,胶原蛋白热稳定性是影响其在生物材料应用中的重要因素,而鳖源胶原蛋白的热稳定性优于其他水产胶原蛋白[7]。因此,中华鳖裙边胶原蛋白由于其丰富易得的来源和优良的热稳定性、安全性将在生物材料领域的开发和转化具有更广阔的前景,还具有重要的经济价值和社会意义。本研究通过分析中华鳖裙边胶原纤维的组织结构特点,阐明裙边中胶原纤维的含量和类型,为裙边胶原蛋白的提取和纯化建立一定的基础,并直接用透析袋纯化建立了一种较为有效的纯化方法,在对裙边胶原蛋白的生物学性能包括吸水性、持水性、体外降解性、皮肤致敏性、止血作用、促创伤皮肤愈合作用等生物学性能进行研究之后发现中华鳖裙边胶原蛋白是一种较优良的生物材料基。
1 材料与方法1.1 材料与主要试剂 中华鳖 (购于宁波本地人工养殖场,体重约为500 g),SD大鼠 (雌雄不限,周龄10周左右,购于浙江省动物实验中心),透析袋 (截留分子量25 kDa、50 kDa、100 kDa,Solarbio),医用纱布敷料 (江西华强医疗器械有限公司),胃蛋白酶 (Sangon Biotech,1:3 000);多聚甲醛、石蜡、二甲苯、苏木素、Van-Gieson染色剂、苦味酸、天狼星红染液、无水乙醇、无水乙醚、草酸钾、酚酞、戊二醛、柠檬酸钠等均为分析纯。
1.2 主要仪器 XSP-13C偏光显微镜,上海长方光学仪器有限公司;FD-1A-50真空冷冻干燥机,北京博医康实验仪器有限公司;YD-6D石蜡包埋机,上海泰益医疗仪器设备公司;165-8001垂直电泳仪,美国BIO-RAD;Gel DocTM凝胶成像仪,美国BIO-RAD;UV-1600紫外分光光度计,上海美谱达有限公司。
1.3 裙边胶原纤维组织结构观察1.3.1 Van-Gieson石蜡切片染色流程 1) 取中华鳖裙边组织大小0.5 cm×0.5 cm× 0.5 cm,用4%多聚甲醛固定24 h;2) 脱水、透明、浸蜡、包埋;3) 石蜡切片,厚度6 μm;4) 二甲苯脱蜡至水洗;5) 苏木素染色;6) 自来水流水冲洗;7) Van-Gieson染色;8) 各级浓度乙醇内脱水;9) 二甲苯透明、中性树胶封片;10) 光学显微镜下观察拍照[8]。
1.3.2 天狼星红苦味酸石蜡切片染色流程 1) 取中华鳖裙边组织大小0.5 cm×0.5 cm× 0.5 cm,用4%多聚甲醛固定24 h;2) 脱水、透明、浸蜡、包埋;3) 石蜡切片厚度6 μm;4) 二甲苯脱蜡至水洗;5) 置0.1%苦味酸天狼星红染液中染色;6) 自来水流水冲洗;7) 苏木素染色;8) 各级浓度乙醇内脱水;9) 二甲苯透明、中性树胶封片;10) 偏振光显微镜下观察拍照[9]。
1.4 裙边胶原蛋白的提取纯化 取中华鳖裙边打碎匀浆,冷冻干燥之后加入2.5% NaCl和0.1 mol/L NaOH 于4 ℃下放置24 h,以去除杂蛋白;再加入10%异丙醇溶液于4 ℃浸泡24 h,以去除脂肪;将已去杂的中华鳖裙边置于0.5 mol/L乙酸中,料液比1:25,添加胃蛋白酶浓度为2 mg/mL,4 ℃下提取24 h,得到裙边胶原蛋白粗提液[10];分别取相同体积裙边胶原蛋白粗提液直接置于截留分子量为 25 kDa、50 kDa、100 kDa的透析袋中,在4 ℃下透析24 h、48 h,透析液为纯水,分别将透析过的裙边胶原蛋白溶液冷冻干燥得到裙边胶原蛋白海绵;用SDS-PAGE垂直电泳比较不同透析袋在不同透析时间对裙边胶原蛋白粗提液的纯化效果,胶浓度的选择是分离胶8%,浓缩胶5%。
1.5 吸水性与持水性1.5.1 吸水性 取定量的裙边胶原蛋白海绵放置在装有蒸馏水的培养皿中,分别在2,10,20,30 min……取出两种材料,称其重量,观察其重量的变化,直至稳定[11]。吸水率按下式计算:
吸水率=(W1-W0) /W0
式中,W0为裙边胶原蛋白海绵初重量;W1为裙边胶原蛋白海绵和吸收水分的总重量。
1.5.2 持水性 分别取1.5.1充分吸水的裙边胶原蛋白海绵装入离心管,2 000 r/min离心5 min,然后称其质量。观察两种材料重量的变化。持水率按下式计算:
持水性=W3/W2
式中,W3为离心后裙边胶原蛋白和吸收水分的总重量;W2为离心前裙边胶原蛋白和吸收水分的总重量。
1.6 体外降解性 称一定量的裙边胶原蛋白海绵,加入胶原蛋白酶,在37 ℃水浴锅中进行酶解,分别于4 h、8 h、12 h、24 h……准确吸取裙边胶原蛋白海绵的降解液,用甲醛滴定法[12]测定水解液中游离氨基酸含量,直至降解完全。
降解率=V/Vm
式中,V是各个时间点消耗的0.05 mol/L氢氧化钠体积数;Vm是指裙边胶原蛋白海绵完全降解后消耗的0.05 mol/L氢氧化钠体积数。
1.7 交联胶原的制备 取一定量的裙边胶原蛋白海绵溶于0.5 mol/L乙酸配置成一定质量浓度的裙边胶原蛋白溶液,加入一定量的戊二醛溶液进行磁力搅拌充分混合,然后放置4 ℃下交联消泡24 h,将交联液倒在模具中放在-80 ℃下冻存24 h,最后进行冷冻干燥,即得交联胶原海绵成品[13]。
1.8 溶血试验 取SD大鼠的鲜血8 mL,加入0.5 mL 4%柠檬酸钠抗凝,加入10 mL生理盐水稀释。分别取一定量的裙边胶原蛋白海绵和交联胶原海绵放入10 mL生理盐水中制备梯度浓度溶液 2 g/L、4 g/L、6 g/L、8 g/L、10 g/L,阳性对照是蒸馏水,阴性对照组是生理盐水;将各个试管均放在37 ℃水浴箱中水浴30 min,然后向试管中加入0.2 mL已稀释的大鼠血液,轻轻混匀,再在37 ℃水浴箱中水浴60 min,取出上述所有试管进行低速离心 (1 000 r/min,5 min),吸取上清液,用紫外分光光度计在波长545 nm处测定吸光度,用生理盐水调零,计算溶血率。
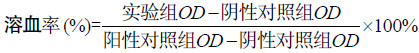 |
1.9 皮肤致敏性 将SD大鼠随机分组,每组10只,分3组,乙醚麻醉,用脱毛膏对大鼠背部脊柱两侧对称脱毛,并用70%酒精擦洗干净,对称暴露皮肤约2 cm×2 cm作为实验及对照区域。取一定浓度的裙边胶原蛋白溶液、交联胶原溶液、生理盐水充分浸润面积为2 cm×2 cm的医用纱布,将裙边胶原蛋白组和生理盐水组的纱布对称贴敷在大鼠背部去毛皮肤上,并用纱布包裹包扎固定,同理交联胶原组,6 h后将纱布取下,于12 h、24 h、48 h、72 h观察大鼠去毛皮肤上是否有致敏现象产生[15]。
1.10 止血性 将裙边胶原蛋白海绵、交联胶原海绵、纱布3种材料均剪成面积约为2 cm×2 cm。将SD大鼠随机分组,分3组,每组10只。乙醚麻醉大鼠,用70%酒精对大鼠腹部擦拭消毒,用已消毒灭菌的手术刀和手术剪开腹,使大鼠肝脏呈现,用手术刀在大鼠肝脏上制造长约0.5 cm、深约2-3 mm的创面,当有血液涌现后,使其自有出血5 s,然后迅速将材料敷压于创面之上,观察材料止血情况,同时秒表计时材料止血时间,并在止血后观察创面是否还有出血现象[14-15]。
1.11 促创伤皮肤愈合性 将裙边胶原蛋白海绵、交联胶原海绵、纱布3种材料均剪成面积约为2 cm×2 cm。将SD大鼠随机分组,每组10只,分3组。乙醚麻醉SD大鼠,用脱毛膏对SD大鼠背部脱毛,裸露皮肤约2 cm×2 cm,用70%酒精对SD大鼠裸露皮肤擦拭消毒,用已消毒灭菌的手术刀去掉全皮约1.5 cm×1.5 cm,制作全皮层缺损动物模 型[16-17],将各组材料贴敷于已去皮部位,用纱布包扎固定,分别于术后3 d、7 d、14 d,对各组材料SD大鼠创伤皮肤愈合情况拍照记录,并用软件Image-Pro Plus Version6.0计算SD大鼠创伤皮肤面积[18-22]。
 |
2 结果与分析2.1 裙边胶原纤维组织结构2.1.1 Van-Gieson染色 中华鳖裙边中胶原纤维Van-Gieson染色结果如图 1所示,根据Van-Gieson染色原理,胶原纤维呈红色,肌原纤维呈黄色[8]。可见图 1中红色纤维分布整个视野,未发现黄色的肌原纤维和其相连交叉,由此图可直接看出中华鳖裙边中胶原纤维含量非常高,这说明中华鳖裙边中蛋白质主要由胶原蛋白组成,肌蛋白含量非常低,不仅方便中华鳖胶原蛋白的提取及纯化,还为中华鳖裙边胶原蛋白的高含量提供有利的依据。
 |
| 图1 中华鳖裙边Van-Gieson染色 (光镜20×) Figure1 Van-Gieson staining of soft-shelled turtle calipash (Light microscope 20×). |
| 图选项 |
2.1.2 天狼星红苦味酸染色 由图 2看出中华鳖裙边中胶原纤维在偏光镜下紧密排列,显示很强的双折光性,且均为红色,根据天狼星红苦味酸染色原理得知中华鳖裙边胶原纤维类型主要为Ⅰ型[9],研究发现,Ⅰ型胶原的免疫原性比Ⅱ型、Ⅲ型、Ⅳ型、Ⅴ型、Ⅵ型等类型胶原都要低得多[23],在生物医药材料中应用最广泛,这为中华鳖裙边胶原蛋白作为生物医药材料基提供了有利的依据。
 |
| 图2 中华鳖裙边天狼星红苦味酸染色 (左:光镜20×;右:偏光镜20×) Figure2 Sirius red staining of soft-shelled turtlecalipash. Left: light microscope 20×; Right: polarizing microscope 20×. |
| 图选项 |
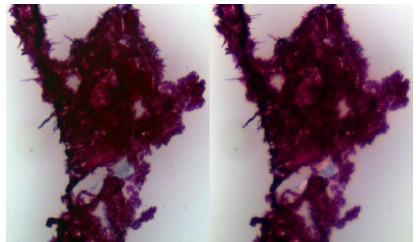
2.2 裙边胶原蛋白纯化 由图 3胶原蛋白SDS-PAGE 图谱中泳道1、3、5看出截留分子量100 kDa的透析袋相对于25 kDa、50 kDa透析袋纯化效果最好,由泳道1与2、3与4、5与6各自对比发现透析48 h后的纯化效果比24 h好,说明时间对透析纯化效果也有一定的影响,综合评价以上各个透析条件的纯化效果,发现透析袋截留分子量为 100 kDa的透析袋在对裙边胶原蛋白粗提液透析48 h后的纯化效果最好,可见,用透析袋直接对裙边胶原蛋白粗提液进行纯化不仅纯化效果好,还可以省去胶原蛋白盐析、透析除盐等步骤,减少了工作量和缩短了试验时间,操作简单方便、经济。
 |
| 图3 透析纯化效果SDS-PAGE检验 Figure3 SDS-PAGE test for purification effect of dialysis (0 channel: calipash collagen extracted crudely; 1 and 2 channels: calipash collagen dialyzed by 25 kDa MWCO for 24 h and 48 h,recpectively; 3 and 4 channels: calipash collagen dialyzed by 50 kDa MWCO for 24 h and 48 h,recpectively; 5 and 6 channels: calipash collagen dialyzed by 100 kDa MWCO for 24 h and 48 h,recpectively). |
| 图选项 |
并且可观察到清晰的α1链和α2链,α1链分子量约为130 kDa,α2链分子量约为110 kDa;且α1链比α2链要粗,所以α1链比α2链浓度大,二者含量比例大约为2:1,组成形式是[α1(I)]2α2(I),分子量约为350 kDa,可见裙边胶原蛋白是典型的I型胶原蛋白,与文献报道相符;同时可以看到γ链和β链,可见裙边胶原蛋白在提取及纯化过程中保持了较为完整的三螺旋结构。
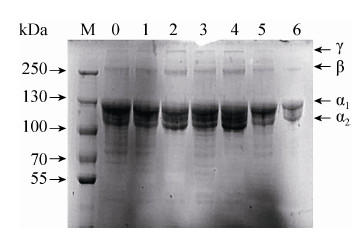
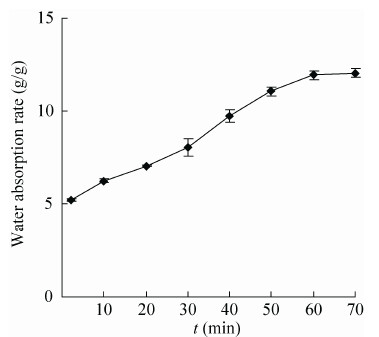
2.3 吸水性与持水性 由图 4所示,裙边胶原蛋白海绵的吸水量随着时间呈线性增长趋势,达到充分吸水需要60 min,充分吸水量是12.06 g/g,在蒸馏水中浸润2 min之后就能达到5.23 g/g的吸水量,说明裙边胶原蛋白海绵具有快速吸水的能力且吸水量非常大,在将充分吸水的裙边胶原蛋白离心之后称重发现,持水率分别是98.21%,可见裙边胶原蛋白持水能力非常强,不仅为裙边胶原蛋白海绵在止血应用中奠定了有力的物理基础,还能为伤口愈合提供一定的水润环境。
 |
| 图4 裙边胶原蛋白海绵吸水性 Figure4 Water absorption ability of calipash collagen sponge. |
| 图选项 |
2.4 体外降解性 由图 5所示,裙边胶原蛋白海绵在体外是可降解的,其降解率随着时间的延长逐渐增大,在72 h时达到100%降解,可降解性是胶原蛋白在生物医学材料中应用的重要指标,裙边的降解率和底物浓度、酶添加量具有重要关系,胶原蛋白的降解率在其作为体外细胞培养支架和体内植入材料时具有重要影响。体内降解性具有更复杂的生物环境,其降解率很难控制,Zulkifli等[24]将胶原蛋白和Hec/Pva交联之后发现胶原蛋白的降解速率降低了,而且在降解时间延长至12周后,复合支架的结构也没有发生变化,说明胶原蛋白在和其他高分子交联之后降解速率减慢。
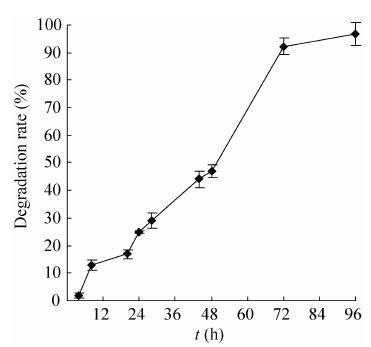 |
| 图5 裙边胶原蛋白体外降解性 Figure5 Degradation of calipash collagen sponge in vitro. |
| 图选项 |
2.5 溶血性 由肉眼观察到阳性对照组即蒸馏水组变成红色均一液体,而阴性对照组和实验组均是上清液澄清,试管底部有大量的沉淀,说明在离心的过程中蒸馏水使红细胞破裂,而阴性对照组和实验组均保持了红细胞的完整性,由表 1可见各个浓度的裙边胶原蛋白和交联胶原溶血率均小于5%,两组之间没有显著性差异 (P>0.05),说明裙边胶原蛋白和交联胶原均不会造成大量溶血,且材料浓度也不会对溶血率造成较为明显的影响,综上说明裙边胶原蛋白海绵和交联胶原均具有良好的血液相容性,符合国家标准对材料溶血性的要求。
表1 溶血率Table1 Scoring of skin sensitization results
| Material | Concentration (g/L) | Hemolysis rate (%) | Material | Concentration (g/L) | Hemolysis rate (%) |
| STCC | 2 | 1.20±0.02 | STCC cross-linked | 2 | 1.17±0.01 |
| 4 | 1.29±0.02 | 4 | 1.22±0.02 | ||
| 6 | 1.67±0.03 | 6 | 1.75±0.04 | ||
| 8 | 1.45±0.01 | 8 | 1.34±0.02 | ||
| 10 | 1.63±0.03 | 10 | 1.58±0.03 |
表选项
2.6 皮肤致敏性 肉眼观察到SD大鼠裸露背部皮肤在被浸有生理盐水、胶原蛋白溶液、交联胶原溶液的无菌医用纱布贴敷3 h后均无红斑、水肿过敏现象,而且在24 h、48 h、72 h时也均无红斑或水肿现象,根据3种待测样品对SD大鼠皮肤致敏结果记录致敏反应的分数如表 2所示,胶原蛋白和交联胶原在3 h、24 h、48 h、72 h的分数均为0,说明提取的中华鳖裙边胶原蛋白和交联蛋白均不会造成皮肤致敏,符合国家生物材料的致敏要求标准。
表2 皮肤致敏反应结果记分Table2 Scoring of skin sensitization results
| Group | Red and swollen | Edema | Sensitization rate (%) | ||||||
| 3 h | 24 h | 48 h | 72 h | 3 h | 24 h | 48 h | 72 h | ||
| Normal saline | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| STCC | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| STCC cross-linked | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
表选项
2.7 止血性 纱布组:肉眼观察到纱布对于肝部创面没有止血作用,在经过多次纱布止血之后,在大约260 s (图 6) 时才能使肝部创面流血情况有所减缓,但仍有少量血液流出,可见纱布对肝部创面没有止血效果。
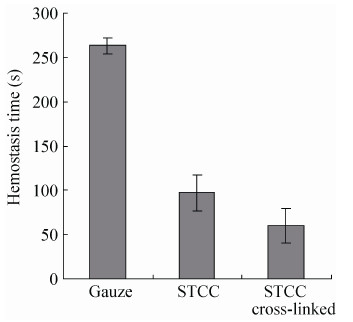 |
| 图6 不同材料止血时间比较 Figure6 Comparison of different materials on hemostasis time. |
| 图选项 |
胶原蛋白组:肉眼观察到胶原蛋白对于肝部创面止血效果非常好,在止血100 s (图 6) 之后肝部创面不再有血液流出,相对于纱布组显著性缩短止血时间 (P < 0.05),而且能够保持肝部的整洁和润滑,呈现一个干净的肝部创面,但是,胶原蛋白在止血之后发生了形变收缩,可能是由于新鲜血液的温度 (37 ℃) 高于胶原蛋白的热变性温度 (35.1 ℃) 使其发生了变形收缩,可见胶原蛋白在未进行交联改性的情况下,其热稳定性和机械性能较差,直接作为止血生物材料运用有一定的局限性。
交联胶原组:肉眼观察到交联胶原蛋白对肝部创面止血效果也非常好,在止血62 s (图 6) 之后肝部创面就不再有血液流出,不仅相对于纱布组具有显著性提高 (P < 0.01),相对于胶原蛋白组也显著性缩短止血时间 (P < 0.05),但是在使用交联胶原止血之后,肝部呈现出干燥表面,可以通过调节胶原蛋白的交联度来改善交联胶原对肝部创面整洁度造成的影响;交联胶原海绵和血液接触的一面快速形成了血痂,这可能是因为胶原蛋白在经过戊二醛交联后形成更为紧密的结构,在接触到血液后能够快速使血小板聚集,达到止血的效果,而且交联胶原也没有发生较大的形态变化,这是由于胶原蛋白在交联之后其热稳定性得到了显著的提高,可见胶原蛋白需要经过交联改性才能达到更好的止血效果。
2.8 促进创伤愈合性 纱布组:肉眼观察到SD大鼠术后3 d,创伤皮肤表面没有发生过敏感染现象,且形成血痂,但没有明显愈合 (图 7),愈合率为15% (图 8);SD大鼠术后7 d,创伤皮肤表面边缘的基底细胞开始有细胞增生现象,且有明显愈合现象,愈合率达到63%;SD大鼠术后14 d,创伤皮肤表面还有较少部分没有愈合,愈合率达到90%,形成的新生皮肤上还有部分痂皮未脱落,而且毛发还未长出。可见小鼠创伤皮肤在自然状态下也能愈合,但是愈合速度较慢。
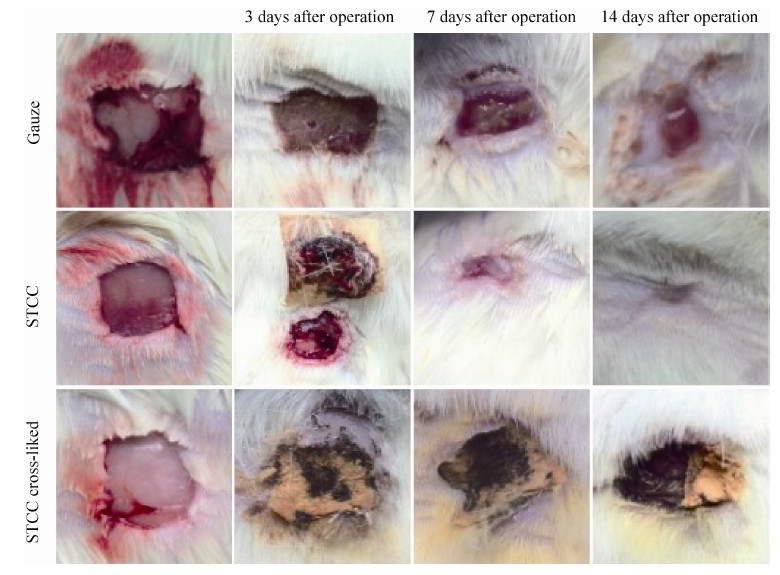 |
| 图7 不同材料对SD大鼠创伤皮肤愈合作用的病理观察比较 Figure7 Pathological observation and comparison of different materials on skin wound healing in SD rats. |
| 图选项 |
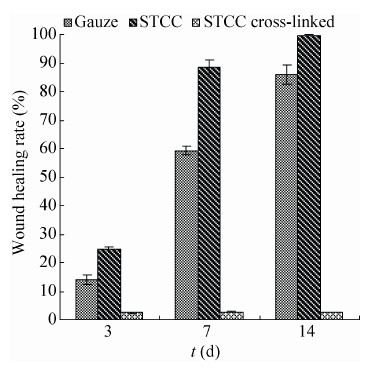 |
| 图8 不同材料对SD大鼠创伤皮肤愈合率的比较 Figure8 Comparison of different materials on skin wound healing rate in SD rats. |
| 图选项 |
胶原蛋白组:肉眼观察到SD大鼠术后3 d,创伤皮肤表面没有发生过敏感染现象 (图 7),且愈合率达到28% (图 8),相对于纱布组和交联胶原组均显著提高创伤愈合率 (P < 0.05),而且能明显看到创伤皮肤表面边缘形成隆起状,基底细胞开始有细胞增生现象;SD大鼠术后7 d,创伤皮肤几乎达到完全愈合,表皮基本形成,且创伤皮肤周围毛发也随之生长出来,愈合率达到90%,相对于纱布组和交联胶原组均显著提高创伤愈合率 (P < 0.01),而SD大鼠创面皮肤在自然生长状态下愈合时,其愈合率在14 d才达到90%,可见胶原蛋白大大地促进了创伤皮肤的愈合,缩短了创伤愈合的时间,这可能是由于胶原蛋白不仅可以刺激细胞生长因子IGF-1和FGF-2的生成,还能为细胞的增生提供细胞支架的生长环境[25];SD大鼠术后14 d,可以看到创伤皮肤表面完全愈合,愈合率达到100%,相对于纱布组和交联胶原组均显著提高创伤愈合率 (P < 0.01)。
交联胶原组:肉眼观察到SD大鼠术后3 d、7 d、14 d后均没有表现出愈合现象 (图 7),交联胶原在创伤表面形成坚硬的血痂阻碍了新生皮肤的生长,而且其对创伤皮肤的粘附性很强,很难将其和创伤皮肤分离,这可能是因为胶原蛋白在经过戊二醛交联后形成更为紧密的结构,在接触到血液后能够快速使血小板聚集,形成了血痂,所以抑制了皮肤细胞的增生。
3 讨论 胶原蛋白的分离纯化工艺是获得高纯度安全有效胶原材料的重要环节,本文通过利用透析袋对胶原蛋白粗提液直接进行透析纯化,得到了一种高效、快捷、简单易操作的纯化方式,主要是利用胶原蛋白的大分子量特点,在用胃蛋白酶提取分离胶原蛋白时,不会造成胶原蛋白的分解,但会将其他类型的蛋白质降解成小分子肽,透析袋可直接将小分子肽透析出去就可达到纯化效果。本课题也尝试运用超滤方法对胶原蛋白进行纯化,但是纯化效果不理想,因为胶原蛋白粘度非常大,在超滤过程中容易造成胶原蛋白快速粘附超滤膜,造成超滤膜的堵塞,影响纯化效果,而透析是通过静置使胶原蛋白分子自由运动透析,不会造成透析袋的截留孔堵塞。
本文对裙边胶原蛋白及交联胶原在生物材料中的应用进行了初步探索,对它们的部分生物相容性进行了检测,但对于以后的批量生产应用还有许多工作要做,需严格按照ISO 10993对医疗器械生物学评价的规定对它们进行更全面的生物安全性检测,如遗传毒性、致癌性和生殖毒性试验[26]、细胞外毒性[27]、植入后局部反应试验[28]、全身毒性试验[29]等。
近年来,胶原蛋白因其良好的止血效果在生物医药材料领域得到越来越多的关注,本文冷冻干燥获得的裙边胶原海绵具有强吸水力,这为其用于止血海绵材料提供了有力的物理基础,而且不仅止血效果好,还能够保持创面的整洁度及湿度,这为其运用于临床提供了良好的基础。但是在实验过程中发现裙边胶原蛋白遇到新鲜的大鼠血液发生了热收缩的形态变化,这说明胶原蛋白直接用于止血还存在热变性温度不够高的缺点,所以,裙边胶原蛋白还不能够直接作为止血海绵,需要进行交联改性以增强其热稳定性和机械性能。本文获得的交联胶原不仅能够快速吸收血液达到止血的效果,还能够保持形态不发生变化,应用于止血具有很好的效果。目前,我国市场已有的止血胶原海绵销售,但这些胶原蛋白大多数都是从牛皮、牛肌腱、猪皮等陆生动物组织中提取的,我国对胶原蛋白的动物来源具有严格的规定,陆生来源的胶原蛋白具有更高的风险,而鳖源胶原蛋白作为水产品生物安全性相对较高;而且对于陆生胶原海绵,在未进行交联的情况下止血时也会发生收缩形变的现象,这也是各种来源胶原蛋白直接运用于止血海绵面临的限制,所以胶原蛋白需要在交联提高热稳定后运用于止血海绵效果更佳。此外,基于原料和营养价值的考虑,中华鳖裙边来源丰富,从中取得胶原蛋白及其相关产品,还可以提高经济附加值。因此,功能优良、安全性好且低廉易得是水产生物胶原蛋白的一大优势,其在生物材料领域的开发和转化前景广阔。
胶原蛋白不仅具有良好的止血效果,还具有促进创伤愈合的作用,这主要可能是由于胶原蛋白不仅为创伤皮肤细胞的生长提供了支架作用,还为其提供了生物活性分子,本文获得的胶原海绵能显著促进创伤皮肤快速愈合,而交联胶原不仅没有促进创伤愈合,相对于空白医用纱布组,反而阻碍了创伤皮肤的愈合,这说明胶原蛋白在交联之后可能失去了生物活性,不具备促进创伤愈合的作用。
本文通过对中华鳖裙边胶原纤维组织结构形态、胶原蛋白的分离纯化及生物学性能的研究,得到了纯度较高的胶原蛋白止血材料及创伤愈合敷料,为其在生物医药材料中的应用奠定了基础。
参考文献
| [1] | Forni MF, Loureiro RR, Cristovam PC, et al. Comparison between different biomaterial scaffolds for limbal-derived stem cells growth and enrichment.Curr Eye Res, 2013, 38(1): 27–34(in Chinese). |
| [2] | Santos MH, Silva RM, Dumont VC, et al. Extraction and characterization of highly purified collagen from bovine pericardium for potential bioengineering applications.Mater Sci Eng: C, 2013, 33(2): 790–800(in Chinese). |
| [3] | Uriarte-Montoya MH, Arias-Moscoso JL, Plascencia-Jatomea M, et al. Jumbo squid (Dosidicus gigas) mantle collagen: extraction, characterization, and potential application in the preparation of chitosan-collagen biofilms.Bioresour Technol, 2010, 101(11): 4212–4219(in Chinese). |
| [4] | Zhang R, Xu YA. Research advance in properties and application of aquatic collagen.J Fujian Fish, 2011, 33(2): 79–83(in Chinese). 张锐, 许永安. 水产胶原蛋白的特性及应用研究进展.福建水产,2011,33(2):79–83. |
| [5] | Adibzadeh N, Aminzadeh S, Jamili S, et al. Purification and characterization of pepsin-solubilized collagen from skin of sea cucumber Holothuria parva.Appl Biochem Biotech, 2014, 173(1): 143–154(in Chinese). |
| [6] | Liang QF, Wang L, Sun WH, et al. Isolation and characterization of collagen from the cartilage of Amur sturgeon (Acipenser schrenckii).Process Biochem, 2014, 49(2): 318–323(in Chinese). |
| [7] | Nagai N, Kobayashi H, Katayama S, et al. Preparation and characterization of collagen from soft-shelled turtle (Pelodiscus sinensis) skin for biomaterial applications.J Biomater Sci Polym Ed, 2009, 20(5/6): 567–576(in Chinese). |
| [8] | Zhang SX, Li H, Chen DF. Study on the method of Van Gieson for collagen fiber staining.J Pract Med Technol, 2007, 14(12): 1580–1581(in Chinese). 张赛霞, 黎晖, 陈东风. Van Gieson胶原纤维染色方法的探索.实用医技杂志,2007,14(12):1580–1581. |
| [9] | Luo CJ, Mo MQ, Zhong JM. Comparative study on collagen fiber staining between sirius red in saturated carbazotic acid staining and MASSON trichrome staining on rat kidney specimen.Clin Med Eng, 2009, 16(8): 15–16(in Chinese). 罗灿峤, 莫木琼, 钟觉民. 天狼星红苦味酸染色法和MASSON染色法在显示大鼠肾脏胶原纤维的比较应用.临床医学工程,2009,16(8):15–16. |
| [10] | Song W, Chen W, Yang YN, et al. Extraction optimization and characterization of collagen from the lung of soft-shelled turtle Pelodiscus sinensis.Int J Nutr Food Sci, 2014, 3(4): 270–278(in Chinese). |
| [11] | Chen RC, Zheng BD. Study on the physicochemical properties of pepsin-solubilised collagen from scale of silver carp.J Chin Inst Food Sci Technol, 2013, 13(12): 83–88(in Chinese). 陈日春, 郑宝东. 鲢鱼鱼鳞酶溶性胶原蛋白理化特性研究.中国食品学报,2013,13(12):83–88. |
| [12] | Cui M, Fu J, Chi YL, et al. Comparison of ninhydrin colorimetry and formaldehyde titration in determination of collagen hydrolysate.China Leather, 2011, 40(7): 1–4(in Chinese). 崔敏, 傅婕, 迟原龙, 等. 茚三酮比色法和甲醛滴定法测定水解胶原的比较.中国皮革,2011,40(7):1–4. |
| [13] | Kim SG, Lee DS, Lee S, et al. Osteocalcin/fibronectin-functionalized collagen matrices for bone tissue engineering.J Biomed Mater Res Part A, 2015, 103(6): 2133–2140(in Chinese). |
| [14] | ISO 10993-4: 2002, Biological evaluation of medical devices-Part 4: selection of tests for interactions with blood. |
| [15] | ISO 10993-10: 2002, Biological evaluation of medical devices-Part 10: tests for irritation and sensitization. |
| [16] | Qerimi B, Baumann P, Hüsing J, et al. Collagen hemostat significantly reduces time to hemostasis compared with cellulose: COBBANA, a single-center, randomized trial.Am J Surg, 2013, 205(6): 636–641(in Chinese). |
| [17] | Xu ZX, Zhao X, Zou ZR, et al. Study on application of collagen from squid skin as medical hemostatic material.Chin J Mar Drugs, 2014, 33(5): 64–70(in Chinese). 徐志霞, 赵昕, 邹峥嵘, 等. 鱿鱼皮胶原蛋白医用止血材料的研究.中国海洋药物,2014,33(5):64–70. |
| [18] | Moura LIF, Dias AMA, Suesca E, et al. Neurotensin-loaded collagen dressings reduce inflammation and improve wound healing in diabetic mice.Biochim Biophys Acta-Mol Basis Dis, 2014, 1842(1): 32–43(in Chinese). |
| [19] | Ramasamy P, Shanmugam A. Characterization and wound healing property of collagen-chitosan film from Sepia kobiensis (Hoyle, 1885).Int J Biol Macromol, 2015: 93–102(in Chinese). |
| [20] | Kim KO, Lee YJ, Hwang JW, et al. Wound healing properties of a 3-D scaffold comprising soluble silkworm gland hydrolysate and human collagen.Colloids Surf B, 2014: 318–326(in Chinese). |
| [21] | Huang R, Li WZ, Lv XX, et al. Biomimetic LBL structured nanofibrous matrices assembled by chitosan/collagen for promoting wound healing.Biomaterials, 2015: 58–75(in Chinese). |
| [22] | Tan Q, Chen B, Yan X, et al. Promotion of diabetic wound healing by collagen scaffold with collagen-binding vascular endothelial growth factor in a diabetic rat model.J Tissue Eng Regen Med, 2014, 8(3): 195–201(in Chinese). |
| [23] | Lei J, Li YH, Liu XZ, et al. Cellular immune response and immune toxicity to BALB/c mice for animal-based collagen.Chin J Tissue Eng Res, 2015, 19(34): 5506–5512(in Chinese). 雷静, 李奕恒, 刘旭昭, 等. 动物源Ⅰ型胶原蛋白可引起BALB/c小鼠细胞免疫反应和组织免疫毒性.中国组织工程研究,2015,19(34):5506–5512. |
| [24] | Zulkifli FH, Hussain FSJ, Rasad MSBA, et al. In vitro degradation study of novel Hec/Pva/Collagen nanofibrous scaffold for skin tissue engineering applications.Polym Degrad Stab, 2014: 473–481(in Chinese). |
| [25] | Muthukumar T, Anbarasu K, Prakash D, et al. Effect of growth factors and pro-inflammatory cytokines by the collagen biocomposite dressing material containing Macrotyloma uniflorum plant extract-In vivo wound healing.Colloids Surf B, 2014: 178–188(in Chinese). |
| [26] | ISO 10993-3: 2003, Biological evaluation of medical devices-Part 3: tests for genotoxicity, carcinogenicity and reproductive toxicity. |
| [27] | ISO 10993-5: 2009, Biological evaluation of medical devices-Part 5: tests for in vitro cytotoxicity. |
| [28] | ISO 10993-6: 2007, Biological evaluation of medical devices-Part 6: tests for local effects after implantation. |
| [29] | ISO 10993-11: 2006, Biological evaluation of medical devices-Part 11: tests for systemic toxicity. |
