罗雪1,2, 刘颂蕊1, 马晓平2, 陈欣1, 李碧1, 邓泽帅1, 张东升1, 李运莉1, 苏小艳1, 李林1, 燕霞1, 侯蓉1, 曹随忠2

 , 岳婵娟1
, 岳婵娟1

1. 成都大熊猫繁育研究基地, 四川省濒危野生动物保护生物学重点实验室, 四川省大熊猫科学研究院, 四川 成都 610081;
2. 四川农业大学动物医学院, 四川 成都 611130
收稿日期:2021-01-08;修回日期:2021-04-08;网络出版日期:2021-06-17
基金项目:成都大熊猫繁育研究基地自立课题(2020CPB-B04)
*通信作者:曹随忠, Tel/Fax: +86-28-86296382, E-mail: suizhongcao@sicau.edu.cn;
岳婵娟, Tel/Fax: +86-28-83517047, E-mail: Chanjuan_Yue@163.com.
摘要:[目的] 大熊猫是我国国家一级保护动物,其种群面临着传染病和栖息地破碎化等持续威胁,其中生殖系统的细菌感染和菌群失衡会影响大熊猫生殖健康,严重者可导致流产,是引起大熊猫繁殖障碍的原因之一。本研究对精液与包皮分泌物样本的菌群组成情况及分离培养潜在致病菌开展研究。[方法] 通过采集13份大熊猫包皮分泌物和12份精液样本,采用16S rRNA扩增子测序技术、细菌培养及PCR鉴定的方法,确定样本中的细菌种类。[结果] 菌群组成分析结果显示,在门水平上,厚壁菌门(Firmicutes)的细菌丰度在大熊猫包皮与精液中均为最高; 在属水平上,不同时期的雄性大熊猫包皮的菌群可能会发生改变,棒状杆菌属(Corynebacterium)和Dolosicoccus是Ⅰ期包皮样本中最丰富的微生物菌群,相对丰度分别为15.45%和12.40%;链球菌属(Streptococcus)和埃希氏菌属(Escherichia)是Ⅱ期包皮样本中最丰富的微生物菌群,相对分度分别为37.94%和9.68%;拟杆菌属(Bacteroides)和普雷沃氏菌属(Prevotella)是精液样本中最丰富的微生物菌群,相对丰度分别为14.40%和12.88%。菌群多样性分析结果显示,精液样品高于Ⅰ期包皮样品和Ⅱ期包皮样品,Ⅰ期包皮样品和Ⅱ期包皮样品之间无显著差异。通过细菌分离培养得到肺炎克雷伯菌(Klebsiella pneumonia)在内的多种潜在性致病菌。[结论] 本研究分析了大熊猫精液和不同时期包皮分泌物的菌群组成,其优势菌属存在差异,大熊猫包皮与精液中存在潜在性致病菌,这可能对大熊猫的生殖系统健康带来威胁,其致病性有待进一步研究。
关键词:大熊猫包皮精液16S rRNA扩增子测序菌群
Investigation on the bacterial community composition of the semen and prepuce and potentially pathogenic bacteria of giant pandas
Xue Luo1,2, Songrui Liu1, Xiaoping Ma2, Xin Chen1, Bi Li1, Zeshuai Deng1, Dongsheng Zhang1, Yunli Li1, Xiaoyan Su1, Lin Li1, Xia Yan1, Rong Hou1, Suizhong Cao2

 , Chanjuan Yue1
, Chanjuan Yue1

1. Sichuan Key Laboratory of Conservation Biology for Endangered Wildlife, Chengdu Research Base of Giant Panda Breeding, Sichuan Academy of Giant Panda, Chengdu 610081, Sichuan Province, China;
2. College of Veterinary Medicine, Sichuan Agricultural University, Chengdu 611130, Sichuan Province, China
Received: 8 January 2021; Revised: 8 April 2021; Published online: 17 June 2021
*Corresponding author: Suizhong Cao, Tel/Fax: +86-28-86296382, E-mail: suizhongcao@sicau.edu.cn;
Chanjuan Yue, Tel/Fax: +86-28-83517047, E-mail: Chanjuan_Yue@163.com.
Foundation item: Supported by the Chengdu Research Base of Giant Panda Breeding (2020CPB-B04)
Abstract: [Objective] Giant panda is one of the first-class protected animals in China, which the population is facing continuous threats such as infectious diseases and habitat fragmentation. Bacterial infection and imbalance of bacterial community in the genitourinary system of giant panda could affect the reproductive health, in severe cases, it can also lead to abortion, which is one of the causes of reproductive disorders in giant panda. In this study, our aim was to examine the bacterial community composition of semen and prepuce secretion and isolate potential pathogenic bacteria of giant panda. [Methods] 13 of prepuce secretions and 12 of semen samples of giant panda were used to determine the bacteria species by 16S rRNA amplicon sequencing technique, bacterial separation and PCR methods. [Results] The results showed that the abundance of Firmicutes was the highest in the samples of prepuce and semen of giant panda at phylum level. Moreover, at the genus level, the bacterial community composition of prepuce was changed in different periods, Corynebacterium and Dolosicoccus were the most abundant microbiome in preputial samples at phase Ⅰ with relative abundances of 15.45% and 12.40%, respectively. Streptococcus and Escherichia were the most abundant microbiome in preputial samples at phase Ⅱ, with relative abundance of 37.94% and 9.68%, respectively. Bacteroides and Prevotella were the most abundant microbiome in seminal samples, with relative abundance of 14.40% and 12.88%, respectively. The results of bacterial diversity showed that the diversity in seminal samples was higher than that in preputial samples; there were no significant difference between preputial samples at stages Ⅰ and stage Ⅱ. Klebsiella pneumonia and other potential pathogenic bacteria were obtained by bacterial isolation and culture. [Conclusion] In this study, we analyzed the bacterial community composition of the prepuce secretions in different periods and semen of male giant pandas, and the dominant microbiome were different. It was hypothesized that potential pathogenic bacteria were in the prepuce and semen of giant pandas, which may pose a threat to the reproductive system health of giant panda, and the pathogenicity needs further research.
Keywords: giant pandaprepucesemen16S rRNA amplicon sequencingmicrobiome
动物生殖系统内存在微生物群落,是动物机体内微生态的组成部分,其中包括共生微生物以及病原微生物[1]。这是在长期进化过程中,通过适应、自然选择,正常菌群在不同种类之间以及正常菌群、宿主和环境之间始终处于动态平衡状态,形成一个相互依存、相互制约的系统[2]。生殖系统内的微生物菌群对宿主的繁殖与生殖系统疾病防御机制有着重要的影响,对机体健康的维持起着重要的作用,生殖系统中的部分细菌能通过分泌抗菌物质、降低生殖道内pH等方法,抑制病原微生物在生殖系统中定殖、生长,从而维系着生殖系统的健康[3-4]。目前,扩增子测序技术作为常用的菌群研究的技术手段,广泛用于生殖系统、消化系统、皮肤等不同部位的微生态调查研究。
大熊猫(Ailuropoda blackoleuca)作为野生动物保护的标志性物种,被认为是中国的国宝,是我国国家一级保护动物,其作为伞护物种保护着同一区域的其他濒危野生动物。2016年,世界自然保护联盟(IUCN)将大熊猫的受威胁程度从濒危变为易危,这是通过几代野生动物保护工作者共同努力的成果,但大熊猫的保护工作不得松懈。由于大熊猫种群面临着传染病和栖息地破碎化的持续威胁[8],维持种群的平稳发展一直是大熊猫保护工作的重中之重,其中繁殖工作是不可忽视的关键环节。泌尿生殖系统的细菌感染和菌群失衡会影响大熊猫生殖健康,严重者可导致流产,是引起大熊猫繁殖障碍的原因之一。因此对于大熊猫生殖系统健康的研究对于大熊猫保护是十分重要的[9]。对于雄性生殖系统的菌群相关调查,常采取精液和包皮分泌物作为样品开展研究。精液中的细菌对精液的质量有着重要的影响[10],已有研究发现人类精液中的细菌是引起雄性动物不育的潜在因素[11],除此之外,包皮中的部分细菌还能引起多种临床疾病,例如尿道炎、前列腺炎、包皮龟头炎、附睾炎等,这些细菌还会随着交配侵入雌性生殖道,造成感染[12]。研究中发现,大肠杆菌(Escherichia coli)、链球菌(Streptococcus)、葡萄球菌(Staphylococcus)、肺炎克雷伯氏菌(Klebsiella pneumoniae)等种属细菌中的机会性致病菌是导致男性生殖系统感染的重要致病菌[13-14]。杨彬等[15]的报道显示,纳米细菌的感染与Ⅲ型前列腺炎的发生可能密切相关;水牛精液的研究中发现,金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌、铜绿假单胞菌(Pseudomonas aeruginosa)能抑制精子的活力[16]。Noelia等[17]的报道中,猪的精液在15-17 ℃的存储温度下,阴沟肠杆菌(Enterobacter cloacae)在一定浓度下会降低精子的存活时间以及受精能力。然而,据我们所知,目前关于雄性大熊猫的生殖系统细菌菌群情况还未见相关的调查和报道,其菌群组成成分、菌群多样性分析、不同时段细菌组成的差异情况、潜在致病菌的调查均不明晰,因此,有必要开展雄性大熊猫生殖系统菌群的调查研究。本研究首次采用16S rRNA扩增子测序技术,同时又采用了培养基分离挑选单一菌落,开展大熊猫生殖系统菌群研究工作,初步探索雄性大熊猫包皮和精液菌群组成情况,以及不同时段、不同部位的细菌组成多样性与主要菌群的差异情况,了解雄性大熊猫生殖系统菌群中可能存在的潜在致病菌,为大熊猫生殖系统健康提供科学依据。
1 材料和方法 1.1 材料 本研究所用的大熊猫样本均来自于成都大熊猫繁育研究基地、未见明显异常的雄性大熊猫个体,均为6-19岁成年个体。采样时使用桂龙?(中国,扬州)一次性使用拭子轻拭雄性大熊猫内冠状沟进行包皮处分泌物样本采集,2019年9月秋季期间,该时期为雌性大熊猫非发情配种时期,共采集了3份大熊猫包皮样本,标记为Ⅰ期包皮样本,将这部分大熊猫包皮样本分别命名为NEP1-NEP3。2020年1月至4月冬季到春季期间,该时期为雌性大熊猫发情配种时期,共采集了10份大熊猫包皮样本,其中有7份样品满足16S rRNA扩增子测序要求,将其标记为Ⅱ期包皮样本,将这部分大熊猫包皮样本分别命名为EP1-EP7。使用无菌采精杯采集大熊猫精液,共收集总体活力在80%以上、均为高质量符合输精要求的精液12份,有5份样品满足16S rRNA扩增子测序要求,将其分别命名为ES1-ES5。
1.2 包皮与精液样本微生物菌群总DNA提取 将本研究中的3份Ⅰ期包皮样本、7份Ⅱ期包皮样本与5份精液样本送往中国深圳华大基因有限公司进行DNA提取和16S rRNA扩增子测序。根据公司的实验流程提取包皮和精液样品中高质量的微生物菌群总基因组DNA,低温保存备用。
1.3 16S rRNA V4高变区扩增 提取得到的总DNA在中国深圳华大基因有限公司进行16S rRNA扩增子测序,检测具体方法按照该公司的操作流程进行。从单个生殖系统微生物组样品中扩增出16S rRNA V4基因,引物序列为:515F:5'-GTGCCAGCMGCCGCGGTAA-3';806R:5'-GGACTACHVGGGTWTCTAAT-3'。取30 ng DNA样品,加入引物混合物和PCR反应预混液,进行PCR扩增。退火温度为56 ℃,聚合酶链式反应循环数为30。
1.4 文库构建及测序 使用Agencourt AMPure XP磁珠对PCR扩增产物进行纯化并溶于Elution Buffer,贴上标签,完成建库。使用Agilent 2100 Bioanalyzer对文库的片段范围及浓度进行检测。检测合格的文库根据插入片段大小,选择HiSeq2500平台进行测序,测序类型为PE250。
1.5 包皮及精液细菌培养 使用索莱宝?(中国,北京)的麦康凯琼脂培养基、伊红美蓝琼脂培养基、SS琼脂培养基、Baird-Parker琼脂培养基对采集到的10份Ⅰ、Ⅱ期包皮样品与11份精液样品进行细菌培养,将不同培养基上生长的不同菌落各挑选一株用索莱宝? (中国,北京)的脑心浸出液液体培养基进行液体增菌。
1.6 PCR扩增鉴定 将增菌培养得到的菌液吸取1.5 mL使用天根? (中国,北京)的细菌DNA提取试剂盒进行DNA提取,以27F和1492R对细菌16S rRNA区域进行PCR扩增,引物序列为:27F:5'-AGAGTTTGAT CCTGGCTCAG-3';1492R:5'-TACGGCTACCTTG TTACGAC-3'。PCR反应体系(25 μL):2×Taq PCR Master Mix 12.5 μL,ddH2O 8.5 μL,上、下游引物各1 μL,模板DNA 2 μL。94 ℃ 5 min;94 ℃ 1 min,54 ℃ 1 min,72 ℃ 1 min,35个循环;72 ℃ 10 min。取PCR产物5 μL用1%琼脂糖凝胶电泳进行检测,PCR产物送往生工生物工程(上海)股份有限公司进行测序,将测序得到的序列输入NCBI数据库用BLASTn进行相似性比较。
1.7 数据的处理和分析 为了获得高质量数据,通过如下的程序过滤原始数据以消除适配器污染和低质量的读数:使用FLASH (fast length adjustment of short reads, v1.2.11)将重合的双端序列合并到标签序列[18]。然后,使用QIIME2 v1.8.0中的DADA2 (Divisive Amplicon Denoising Algorithm)方法去噪,获得变异扩增子序列(amplicon sequence variants,ASVs),其为100%相似的序列,并使用Ribosomal Database Project (RDP)数据库v.2.2,对OTUs代表序列进行分类排序[19]。最后使用R软件(v3.1.1)对各组样品的韦恩图和柱状图进行展示;使用Mother (v.1.31.2)计算Alpha多样性指数,使用R软件(v3.1.1)绘制稀疏曲线(rarefaction cure),判断测序数据量的合理程度,并对3组样品之间与各2组样品之间的Alpha多样性指数分别进行组间Kruskal检验和Wilcoxn秩和检验,获得3组样品间物种多样性的差异;利用Phytools软件和R软件(v3.5.1)根据Weighted Unifrac距离矩阵做UPGMA聚类分析,并用聚类树进行展示;为进一步挖掘3组样品间微生物菌落的差异结构,使用Graphpad 6.0对各组间差异性物种以及Alpha多样性组间差异结果进行分析,选用Kruskal检验和Wilcoxn秩和检验统计方法对3组样品微生物菌落的组成进行统计分析,筛选出3组样品间存在显著差异的菌落。
2 结果和分析 2.1 微生物菌群的OTUs注释结果 将3份Ⅰ期包皮样本、7份Ⅱ期包皮样本与5份精液样本通过HiSeq平台进行测序后,将原始序列读数过滤后进行拼接,分别产生了100528、423293和295788条标签序列,平均每个Ⅰ期包皮样本约33509条标签序列,每个Ⅱ期包皮样本约60470条标签序列,每个精液样本约59158条标签序列。利用RDP Classifier对每个OTUs的代表序列进行物种注释分析,Ⅰ期包皮样本共注释得到522个OTUs,Ⅱ期包皮样本共注释得到1214个OTUs,精液样本共注释得到1261个OTUs;两个不同时段采集的包皮样本与精液样本共有111个OTUs,603个OTUs为Ⅱ期包皮样本独有,293个OTUs为Ⅰ期包皮样本独有,736个OTUs为精液独有(图 1)。
 |
| 图 1 精液与包皮微生物菌群韦恩图 Figure 1 Venn diagram of microbiome in semen and prepuce. |
| 图选项 |
2.2 微生物菌群丰富度和多样性的分析 使用R软件(v3.1.1)绘制稀疏曲线(rarefaction curve),结果显示,当测序深度达到20000 reads时,稀疏曲线出现了平滑现象,OTU的数目接近饱和,表明测序深度已满足后续分析的需求。
使用Mother (v.1.31.2)软件计算获得15个样品的香农指数(Shannon)、辛普森指数(Simpson)、Chao指数(Chao)和ACE指数(ACE)。结果显示,利用香农、辛普森、Chao和ACE四个指数,将Ⅰ期、Ⅱ期包皮样品和精液样品进行差异显著性分析发现,Ⅰ期、Ⅱ期包皮样品在四种指数计算时,皆无显著差异(P > 0.05);精液样品与Ⅰ期包皮样品在香农、Chao和ACE三个指数计算时皆有显著性差异(P < 0.05),精液样品显著高于Ⅰ期包皮样品,利用辛普森指数计算时,无显著性差异(P > 0.05);精液样品与Ⅱ期包皮样品在香农、辛普森、Chao和ACE四个指数计算时,该两组样品皆有显著性差异(P < 0.05),香农、Chao和ACE指数的计算结果中精液样品显著高于Ⅱ期包皮样品,辛普森指数计算结果中精液样品显著低于Ⅱ期包皮样品(图 2,表 1)。
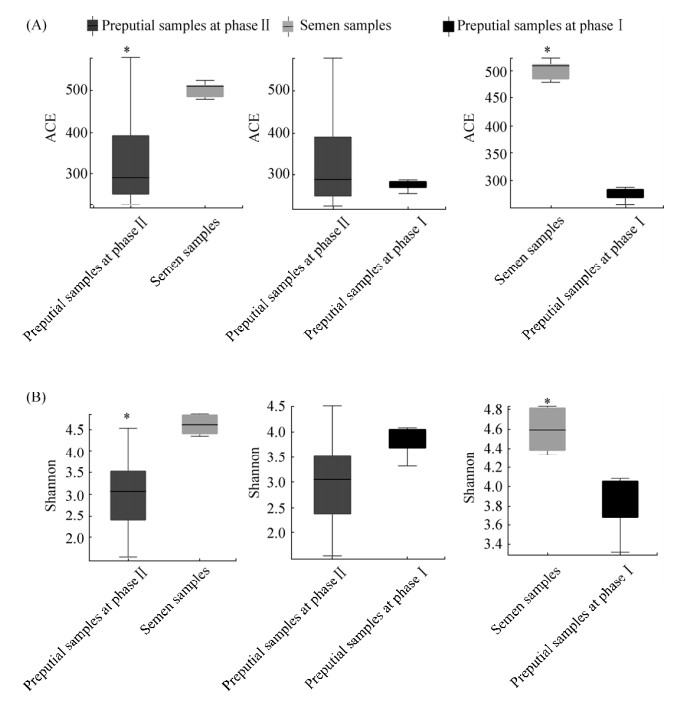 |
| 图 2 三组样本两两间Alpha多样性差异图 Figure 2 Alpha diversity difference map between each two of the three groups. A: the comparison result of ACE index; B: the comparison result of Shannon index. *: 0.01 < P≤0.05; if P > 0.05, not marked. |
| 图选项 |
表 1. 三组样本Alpha多样性结果 Table 1. Alpha diversity results of the three groups
| Groups | Chao index | ACE index | Shannon index | Simpson index |
| Phase Ⅰ prepuce samples | 275.0±17.58b | 275.0±17.58b | 3.816±0.4291b | 0.06077±0.03252ab |
| Phase Ⅱ prepuce samples | 339.1±133.8b | 339.1±133.8b | 2.988±0.9925b | 0.2000±0.1533a |
| Semen samples | 501.0±19.51a | 501.0±19.51a | 4.594±0.2379a | 0.03480±0.01546b |
| “a” and “b” in the table indicate significant difference, significant difference (P < 0.05) is indicated by different letters, and non-significant difference (P > 0.05) is indicated by the same letter. | ||||
表选项
2.3 微生物菌群组成分析 利用RDP Classifier (v2.2)对注释的序列进行分类分析,结果显示,在门水平上,厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)依次为Ⅰ期包皮样本中微生物菌群丰富度高排名前三的细菌种类,分别占序列总数的41.09%-48.13%、20.48%-31.54%、16.64%-23.16%;厚壁菌门、变形菌门、放线菌门依次为Ⅱ期包皮样本中微生物菌群丰富度排名前三的细菌种类,分别占序列总数的40.47%-81.39%、7.07%-46.95%、1.77%-24.78%;厚壁菌门、拟杆菌门(Bacteroidetes)、变形菌门依次为精液样本中微生物菌群丰富度高排名前三的细菌种类,分别占序列总数的37.28%-50.55%、21.41%-46.00%、7.86%-15.98% (图 3-A)。
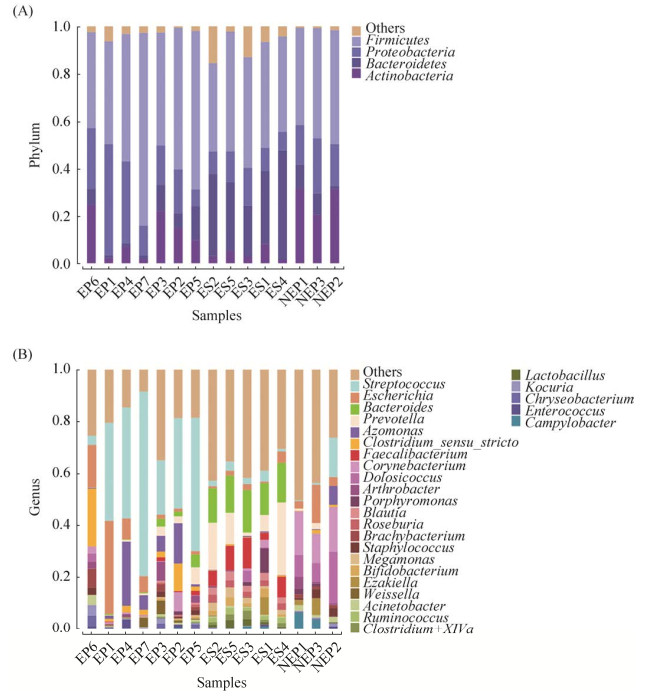 |
| 图 3 各样本细菌菌群组成结果 Figure 3 Results of bacterial community composition of each sample. A: composition of bacterial community of each sample at the phylum level; B: composition of bacterial community of each sample at the genus level. |
| 图选项 |
在属水平上,棒状杆菌属(Corynebacterium)、Dolosicoccus、埃希氏菌属(Escherichia)、链球菌属是Ⅰ期包皮样本中最丰富的微生物菌群,相对丰度分别为11.40%-17.32%、7.16%-19.91%、2.92%-14.81%、0.30%-15.17%。链球菌属、埃希氏菌属、氮单胞菌属(Azomonas)、梭状芽孢杆菌属(Clostridium sensu stricto)是Ⅱ期包皮样本中最丰富的微生物菌群,相对分度分别为3.57%-71.28%、1.31%-35.99%、0.35%-24.76%、1.04%-22.28%。拟杆菌属(Bacteroides)、普雷沃氏菌属(Prevotella)、粪杆菌属(Faecalibacterium)、布劳特氏菌属(Blautia)是精液样本中最丰富的微生物菌群,相对丰度分别为12.20%-16.41%、1.31%-28.05%、2.70%-11.93%、2.13%-3.43% (图 3-B)。
2.4 微生物菌群差异性分析 在门水平上,Ⅰ期包皮样本中放线菌门显著高于精液样本和Ⅱ期包皮样本(P < 0.05);Ⅱ期包皮样本中变形菌门显著高于与精液样本(P < 0.05);精液样本中拟杆菌门显著高于与Ⅰ期包皮样本和Ⅱ期包皮样本(P < 0.05)(图 4-A)。
 |
| 图 4 三组样本间细菌丰度差异显著性分析结果 Figure 4 Comparison of bacterial differences among three groups. A: Comparison of bacterial differences among three groups at the phylum level; B: Comparison of bacterial differences among three groups at the genus level in top 10. The three groups were compared in pairs, which were represented by the two ends of the short term on the groups. ***: P < 0.001; **: 0.001≤P≤0.01;*: 0.01 < P≤0.05; if P > 0.05, not marked. |
| 图选项 |
在属水平上,选取丰度为前10的物种,对每组样品差异检验的显著性进行评估,结果显示,链球菌属、棒状杆菌属、普雷沃氏菌属、拟杆菌属、Dolosicoccus、氮单胞菌属、粪杆菌属、梭状芽孢杆菌属的细菌在这三组样本间存在着差异。其中链球菌属的细菌在Ⅱ期包皮样本中的丰度显著高于Ⅰ期包皮样本和精液样本(P < 0.05);氮单胞菌属和梭状芽孢杆菌属在Ⅱ期包皮样本中的丰度显著高于精液样本(P < 0.05),棒状杆菌属和Dolosicoccus的细菌在Ⅰ期包皮样本中的丰度显著高于精液样本和Ⅱ期包皮样本(P < 0.05);普雷沃氏菌属、拟杆菌属、粪杆菌属的细菌在精液样本中的丰度显著高于Ⅰ期包皮样本和Ⅱ期包皮样本(P < 0.05)(图 4-B)。
2.5 各样本UPGMA聚类树分析 根据Weighted Unifrac距离矩阵作UPGMA聚类分析,并将聚类结果与各样本在门、纲、目、科、属、种水平上的物种相对丰度整合展示,展现各样本细菌物种组成及差异的情况。结果显示,大熊猫精液与包皮样本中菌群共分成2个大支,不同时间采样的包皮样品的菌群组成较为相似,归分在1个大支中,在该支内又分成了2个小支,除去NEP2和EP6样品,其他样品按采样时段分别分划在2个小支中,同一采样时段的包皮样本菌群组成更为相似。精液各样本间菌群组成与包皮样本菌群相比较为相似,单独分划在1个大支中。不同时期包皮菌群组成相似度高于精液微生物组成的相似度(图 5)。
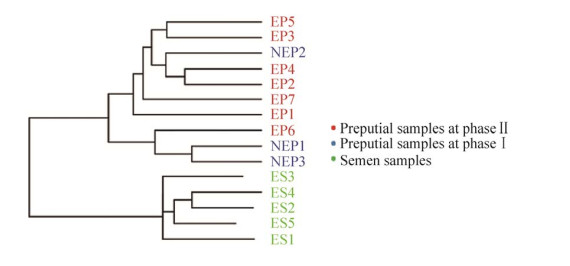 |
| 图 5 各样本UPGMA聚类树 Figure 5 UPGMA clustering tree for each sample. |
| 图选项 |
2.6 潜在致病菌的分离培养 利用选择性培养基对10份2020年1月至4月期间采集的大熊猫包皮样品与11份精液样品中的细菌进行筛选,筛除同一个个体中不同培养基重复筛选的同种细菌后,共得到47株细菌。埃希氏菌属的细菌在包皮分离出的细菌中频率最大,共在9份样品中分离得到(9/10)。精液中,肠球菌属的细菌频率较高,共在7份样品中分离得到(7/11) (表 2)。在本次细菌分离培养结果中,分离到了肺炎克雷伯菌、大肠杆菌、粪肠球菌(Enterococcus faecalis)等细菌。
表 2. 包皮与精液分离细菌分离情况 Table 2. Distribution of bacteria isolated from semen and prepuce
| Genus | Prepuce samples for isolating bacteria | Semen samples for isolating bacteria | |||
| Number of bacterial strains | Percentage/% | Number of bacterial strains | Percentage/% | ||
| Escherichia | 9 | 90.00 | 4 | 36.36 | |
| Enterococcus | 3 | 30.00 | 7 | 63.64 | |
| Staphylococcus | 3 | 30.00 | 3 | 27.27 | |
| Serratia | 3 | 30.00 | 3 | 27.27 | |
| Klebsiella | 3 | 30.00 | 0 | 0.00 | |
| Proteus | 1 | 10.00 | 1 | 9.09 | |
| Enterobacter | 1 | 10.00 | 0 | 0.00 | |
| Shigella | 1 | 10.00 | 0 | 0.00 | |
| Acinetobacter | 1 | 10.00 | 0 | 0.00 | |
| Citrobacter | 1 | 10.00 | 0 | 0.00 | |
| Bacillus | 0 | 0.00 | 2 | 18.18 | |
| Providencia | 0 | 0.00 | 1 | 9.09 | |
表选项
3 讨论 3.1 精液与包皮分泌物微生物菌群组成分析
3.1.1 精液微生物菌群组成分析: 精液中的菌群对精液质量有重要的影响,精液中的某些细菌可能会导致精子的病变,影响精子的质量[16, 20],探查大熊猫精液中菌群的组成对提高大熊猫的繁殖效率有一定的意义。在大熊猫的精液样本中,拟杆菌属与普雷沃氏菌属的细菌为大熊猫精液中的优势菌属,这一结果与Carlota等[21]报道的关于马精液中菌群组成的结果较为相似,该研究采用16S rRNA扩增子测序技术对马精液进行分析,发现Porphyromonadaceae、拟杆菌科(Bacteroidaceae)、Peptoniphilaceae的细菌在马精液中丰度较高。然而该结果与另一项关于马精液菌群的调查结果差异较大,Guimaraes等[22]采用细菌培养方法对马精液菌群调查,研究发现马精液微生物组成种类以棒状杆菌属、肠球菌属、葡萄球菌属为主,这个差异也充分说明了不同检测手段研究菌群组成,结果差异较大。有报道对人类精液微生物菌群组成相关研究发现,在属水平上,精液中最常见的细菌为乳杆菌属(Lactobacillus)的细菌[11],大熊猫精液的菌群组成与人类精液中菌群组成差异较大。在大熊猫精液中存在着较高丰度的拟杆菌属的细菌,拟杆菌属的部分细菌能通过分泌抗菌物质、定殖占据生态位等方法抑制病原菌的入侵,维持宿主的健康[4]。本研究中的精液均为高质量精液,且各精液样本间菌群组成相似,在本研究的精液菌群中的高丰度菌群可能与精液品质相关,具体分析还需要进一步研究。
3.1.2 包皮分泌物微生物菌群组成分析: 包皮中的细菌有可能在采精的过程中对精液带来污染,进而影响精液的质量[23]。除此之外,包皮中的菌群还可能通过交配,给雌性个体生殖道健康带来威胁[24-25]。正常的菌群在机体的免疫系统功能,特别是粘膜免疫功能中,发挥着重要的作用[2]。了解包皮的菌群构成有助于排除其对生殖系统安全的威胁。本研究中,在两个时间段收集大熊猫的包皮分泌物样本,Ⅰ期是雌性大熊猫非发情时间段,Ⅱ期是雌性大熊猫发情时间段,结果显示,同一时期内,各个体之间样品间的优势菌相似,不同时期样品的优势菌属有明显差异。我们推测,这一结果可能是由于在不同时期,大熊猫包皮菌群的变化受雌性大熊猫的影响,在雌性发情期期间受激素的影响发生变化。随着雌性发情期的到来,链球菌属、埃希氏菌属等细菌丰度升高。有研究报道,在大熊猫的阴道中,链球菌属、乳球菌属(Lactococcus)的细菌为大熊猫的阴道优势菌属[26]。在雌性发情期期间的大熊猫包皮样本菌群群落组成与雌性大熊猫阴道内细菌组成更为相近。有报道对人类夫妻生殖系统细菌进行研究,发现男性生殖系统内细菌会对女性生殖道健康有重大影响[24-25]。另一项研究表明,男性精液菌群以乳杆菌属的细菌为主,与女性阴道中微生物组成研究结果相似[3, 27-28]。大熊猫精液中的微生物菌群组成与阴道中微生物菌群的组成有较大差异,反而大熊猫包皮分泌物中优势菌群的组成与阴道菌群的优势菌更为相似,因此还需要对此情况进行更加深入的分析研究。
3.1.3 包皮分泌物微生物菌群组成差异的分析: 有研究表明,雌性大熊猫在发情期间会对与之相处相同环境的雄性大熊猫的行为与激素分泌有一定影响,雄性大熊猫雄性激素水平会在此期间上升[29];另一项研究显示,在人类阴道微生物区系的相关研究中发现,人类随着年龄的变化,激素水平会发生改变,进而影响人类阴道微生物组成[3]。但还需更多深入调查研究以证明两者的相关性。有研究发现随着季节的变化,乳汁中的菌群组成也会发生改变[30],本次实验的包皮样本是在秋季与春季采集,季节的变化也可能是影响大熊猫包皮细菌组成的因素。除此之外,还可能与动物年龄、外界环境等因素有关。在人类包皮微生物组成细菌培养研究中发现,成年男性包皮微生物中,葡萄球菌属与链球菌属的细菌为优势菌[31],青春期男孩包皮检出较多的菌为埃希氏菌属和肠球菌属[32]。这与本研究中大熊猫包皮分泌物的菌群组成差异较大,这可能与物种的差异、检测方法的差异、样品处理方法等因素有关。
3.2 大熊猫包皮分泌物与精液中微生物菌群的多样性比较 本研究对大熊猫精液与包皮中的细菌进行alpha多样性计算发现,精液样品与Ⅰ期包皮样品在香农、Chao和ACE三个指数计算时皆有显著性差异(P < 0.05),说明精液样品与Ⅰ期包皮样品微生物菌群的丰富度与多样性存在一定的差异,精液中微生物菌群的丰富性与多样性显著高于Ⅰ期包皮样品;精液样品与Ⅱ期包皮样品在香农、辛普森、Chao和ACE四个指数计算时,该两组样品皆有显著性差异(P < 0.05),说明精液与Ⅱ期包皮样品微生物菌群的丰富度与多样性存在一定的差异,精液中的微生物菌群的丰富性与多样性显著高于Ⅱ期包皮样品。对大熊猫两个时段间的包皮细菌进行Alpha多样性计算发现,Ⅰ期、Ⅱ期样品在四种指数计算时,皆无明显差异(P > 0.05),说明该两组样品间微生物菌群的丰富度与多样性无明显差异;综合分析3组样品在4个指数中微生物菌群的丰富度与多样性,精液样品高于Ⅰ期包皮样品和Ⅱ期包皮样品,Ⅰ期包皮样品和Ⅱ期包皮样品之间无显著差异。这也体现了雄性大熊猫内生殖器与外生殖器菌群组成多样性的差异,精液在排出的过程中会经过不同的生殖系统区域,有研究发现前列腺按摩液与精液中的菌群组成相似,但也存在着差异[33],所以生殖系统各区域之间的微生物菌群组成可能存在一定的差异,这可能是精液菌群组成多样性高于包皮的原因。
3.3 大熊猫包皮分泌物与精液中存在的潜在致病菌分析 通过细菌选择性培养与16S rRNA扩增子测序发现,在大熊猫的精液与包皮中存在着许多潜在性致病菌,有研究报道粪肠球菌、大肠杆菌、金黄色葡萄球菌等细菌是导致女性需氧性阴道炎的致病菌[3],链球菌属的部分细菌会引起猪的繁殖障碍[34],在对水牛精液的研究中发现,金黄色葡萄球菌、大肠杆菌等能抑制精子的活力[16],在大熊猫的相关报道中,肺炎克雷伯菌是引起大熊猫血尿的致病原[35]。本实验中,16S rRNA扩增子测序的结果中发现,精液与包皮的微生物中存在这部分潜在性致病菌,这对雌性大熊猫的生殖道健康带来了一定的威胁。检出这部分潜在致病菌,大部分为肠道常见细菌,这可能与生殖道口暴露在外部且靠近肛门有关系,其致病性还需进一步研究。
4 结论 在属水平上,大熊猫包皮与精液的优势菌群有差异,不同时期的雄性大熊猫包皮的菌群可能会发生改变。菌群多样性分析结果说明,精液样品高于Ⅰ期包皮样品和Ⅱ期包皮样品,Ⅰ期包皮样品和Ⅱ期包皮样品之间无显著差异。大熊猫包皮与精液中存在潜在性致病菌,这可能对大熊猫的生殖系统健康带来威胁,其致病性有待进一步研究。
References
| [1] | Yan R, Jiang HY, Li LJ. The links among disease, health and human microbiota. Acta Microbiologica Sinica, 2017, 57(6): 793-805. (in Chinese) 严人, 江慧勇, 李兰娟. 人体微生态与健康和疾病. 微生物学报, 2017, 57(6): 793-805. |
| [2] | Zang HJ, Zhang KY. Advances in effects of normal bacteria flora in animal intestinal tract on mucosal immune function. Feed Review, 2007(2): 35-37. (in Chinese) 臧海军, 张克英. 动物肠道正常菌群对黏膜免疫影响的研究进展. 饲料博览, 2007(2): 35-37. DOI:10.3969/j.issn.1001-0084.2007.02.011 |
| [3] | Pekmezovic M, Mogavero S, Naglik JR, Hube B. Host-pathogen interactions during female genital tract infections. Trends in Microbiology, 2019, 27(12): 982-996. DOI:10.1016/j.tim.2019.07.006 |
| [4] | Sun FT, Zhang QS, Zhao JX, Zhang H, Zhai QX, Chen W. A potential species of next-generation probiotics? The dark and light sides of Bacteroides fragilis in health. Food Research International, 2019, 126: 108590. DOI:10.1016/j.foodres.2019.108590 |
| [5] | 张慧. 细菌性阴道病相关菌群功能基因组学研究. 济南大学硕士学位论文, 2018. |
| [6] | Liu WJ, Wang Y, Zhou LH, Fang YY, Xie WL. Analysis of characteristics of intestinal microflora in obese people in Guizhou. Journal of Mountain Agriculture and Biology, 2020, 39(1): 9-19. (in Chinese) 刘文洁, 王洋, 周礼红, 方月月, 解文利. 贵州地区肥胖人群肠道微生物群落特征分析. 山地农业生物学报, 2020, 39(1): 9-19. |
| [7] | Zhao WJ, Xu QH. Microbial diversity on skins in two species of Antarctic fish, Trematomus bernacchii and Notothenia coriiceps. Journal of Dalian Ocean University, 2019, 34(6): 792-797. (in Chinese) 赵文静, 许强华. 伯氏肩孔南极鱼和革首南极鱼皮肤微生物多样性的研究. 大连海洋大学学报, 2019, 34(6): 792-797. |
| [8] | Yue CJ, Deng ZS, Qi DW, Li YL, Bi WL, Ma R, Yang GY, Luo X, Hou R, Liu SR. First detection and molecular identification of Babesia sp. from the giant Panda, Ailuropoda melanoleuca, in China. Parasites & Vectors, 2020, 13(1): 1-8. |
| [9] | Liu Y, Ding N, Li LH, Zhao J, Xia MH, Yuan L, Zhang CL, Liu XF. Analysis of bacteria from vaginal secretions of giant Panda in oestrum. Chinese Journal of Wildlife, 2012, 33(1): 1-2, 31. (in Chinese) 刘燕, 丁楠, 李林海, 赵京, 夏茂华, 原蕾, 张成林, 刘学峰. 发情期大熊猫阴道分泌物细菌分析. 野生动物, 2012, 33(1): 1-2, 31. DOI:10.3969/j.issn.1000-0127.2012.01.001 |
| [10] | Motamedifar M, Malekzadegan Y, Namdari P, Dehghani B, Jahromi BN, Sarvari J. The prevalence of bacteriospermia in infertile men and association with semen quality in southwestern Iran. Infectious Disorders Drug Targets, 2020, 20(2): 198-202. DOI:10.2174/1871526519666181123182116 |
| [11] | Weng SL, Chiu CM, Lin FM, Huang WC, Liang C, Yang T, Yang TL, Liu CY, Wu WY, Chang YA, Chang TH, Huang HD. Bacterial communities in semen from men of infertile couples: metagenomic sequencing reveals relationships of seminal microbiota to semen quality. PLOS ONE, 2014, 9(10): e110152. DOI:10.1371/journal.pone.0110152 |
| [12] | Xiao XM, Li A, Ma XL, Liu C, Li J, Zheng JJ, Yao B. Clinical study of male urogenital infection by simultaneous isothermal amplification assay. The Chinese Journal of Dermatovenereology, 2017, 31(11): 1217-1219. (in Chinese) 肖秀美, 李昂, 马啸龙, 刘宠, 李晶, 郑佳佳, 姚贝. 实时荧光核酸恒温扩增方法检测男性生殖道感染的临床观察. 中国皮肤性病学杂志, 2017, 31(11): 1217-1219. |
| [13] | Chen ZJ. Non-specific male reproductive system infection and nursing care. World Latest Medicine Information, 2018, 18(8): 196-197. (in Chinese) 陈志娟. 非特异性男性生殖系统感染与护理. 世界最新医学信息文摘, 2018, 18(8): 196-197. |
| [14] | Al-Kass Z, Spergser J, Aurich C, Kuhl J, Schmidt K, Morrell JM. Effect of presence or absence of antibiotics and use of modified single layer centrifugation on bacteria in pony stallion semen. Reproduction in Domestic Animals, 2019, 54(2): 342-349. DOI:10.1111/rda.13366 |
| [15] | Yang B, Wang JY, Guo Q, Zhang WJ, Yuan S, Zhang YG. Detection of the nanobacteria in prostate fluid of CPPS. Journal of Shanxi College of Traditional Chinese Medicine, 2019, 20(4): 296-297, 301. (in Chinese) 杨彬, 王靖宇, 郭强, 张文瑾, 袁帅, 张雁钢. 慢性Ⅲ型前列腺炎患者前列腺液中纳米细菌的检测. 山西中医学院学报, 2019, 20(4): 296-297, 301. |
| [16] | Andrabi SMH, Khan LA, Shahab M. Isolation of bacteria in semen and evaluation of antibiotics in extender for cryopreservation of buffalo (Bubalus bubalis) bull spermatozoa. Andrologia, 2016, 48(10): 1166-1174. DOI:10.1111/and.12555 |
| [17] | Prieto-Martínez N, Bussalleu E, Garcia-Bonavila E, Bonet S, Yeste M. Effects of Enterobacter cloacae on boar sperm quality during liquid storage at 17℃. Animal Reproduction Science, 2014, 148(1/2): 72-82. |
| [18] | Mago? T, Salzberg SL. FLASH: fast length adjustment of short reads to improve genome assemblies. Bioinformatics, 2011, 27(21): 2957-2963. DOI:10.1093/bioinformatics/btr507 |
| [19] | Gregory Caporaso J, Kuczynski J, Stombaugh J, Bittinger K, Bushman FD, Costello EK, Fierer N, Pe?a AG, Goodrich JK, Gordon JI, Huttley GA, Kelley ST, Knights D, Koenig JE, Ley RE, Lozupone CA, McDonald D, Muegge BD, Pirrung M, Reeder J, Sevinsky JR, Turnbaugh PJ, Walters WA, Widmann J, Yatsunenko T, Zaneveld J, Knight R. QⅡME allows analysis of high-throughput community sequencing data. Nature Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303 |
| [20] | Diemer, Hu we, Michelmann, Mayer, Schiefer, Weidner. Escherichia coli-induced alterations of human spermatozoa. An electron microscopy analysis. International Journal of Andrology, 2000, 23(3): 178-186. DOI:10.1046/j.1365-2605.2000.00224.x |
| [21] | Qui?ones-Pérez C, Martínez A, Crespo F, Vega-Pla JL. Comparative semen microbiota composition of a stallion in a Taylorella equigenitalis carrier and non-carrier state. Animals, 2020, 10(5): 868. DOI:10.3390/ani10050868 |
| [22] | Guimar?es T, Lopes G, Pinto M, Silva E, Miranda C, Correia MJ, Damásio L, Thompson G, Rocha A. Colloid centrifugation of fresh stallion semen before cryopreservation decreased microorganism load of frozen-thawed semen without affecting seminal kinetics. Theriogenology, 2015, 83(2): 186-191. DOI:10.1016/j.theriogenology.2014.09.003 |
| [23] | Xu GH, Liu XW. Measures on maintain ram semen sterile and sanitary. Modern Journal of Animal Husbandry and Veterinary Medicine, 2013(8): 21-23. (in Chinese) 许桂华, 刘兴伟. 保持公羊精液卫生无菌的措施. 现代畜牧兽医, 2013(8): 21-23. DOI:10.3969/j.issn.1672-9692.2013.08.012 |
| [24] | Vodstrcil LA, Plummer EL, Doyle M, Fairley CK, McGuiness C, Bateson D, Hocking JS, Law MG, Petoumenos K, Donovan B, Chow EPF, Bradshaw CS, Team SR. Treating male partners of women with bacterial vaginosis (StepUp): a protocol for a randomised controlled trial to assess the clinical effectiveness of male partner treatment for reducing the risk of BV recurrence. BMC Infectious Diseases, 2020, 20(1): 834. DOI:10.1186/s12879-020-05563-w |
| [25] | Borovkova N, Korrovits P, Ausmees K, Türk S, J?ers K, Punab M, M?ndar R. Influence of sexual intercourse on genital tract microbiota in infertile couples. Anaerobe, 2011, 17(6): 414-418. DOI:10.1016/j.anaerobe.2011.04.015 |
| [26] | 马晓平. 大熊猫阴道微生物多样性及部分真菌生物学特性研究. 南京农业大学博士学位论文, 2014. |
| [27] | Huang YE, Wang Y, He Y, Ji Y, Wang LP, Sheng HF, Zhang M, Huang QT, Zhang DJ, Wu JJ, Zhong M, Zhou HW. Homogeneity of the vaginal microbiome at the cervix, posterior fornix, and vaginal canal in pregnant Chinese women. Microbial Ecology, 2015, 69(2): 407-414. DOI:10.1007/s00248-014-0487-1 |
| [28] | Kovachev S. Defence factors of vaginal lactobacilli. Critical Reviews in Microbiology, 2018, 44(1): 31-39. DOI:10.1080/1040841X.2017.1306688 |
| [29] | Gocinski BL, Knott KK, Roberts BM, Brown JL, Vance CK, Kouba AJ. Changes in urinary androgen concentration indicate that male giant pandas (Ailuropoda melanoleuca) respond to impending female Oestrus during and outside the typical spring breeding season. Reproduction, Fertility, and Development, 2018, 30(2): 399-408. DOI:10.1071/RD16345 |
| [30] | Nguyen TT, Wu HM, Nishino N. An investigation of seasonal variations in the microbiota of milk, feces, bedding, and airborne dust. Asian-Australasian Journal of Animal Sciences, 2020, 33(11): 1858-1865. DOI:10.5713/ajas.19.0506 |
| [31] | Willeén M, Hoist E, Myhre EB, Olsson AM. The bacterial flora of the genitourinary tract in healthy fertile men. Scandinavian Journal of Urology and Nephrology, 1996, 30(5): 387-393. DOI:10.3109/00365599609181315 |
| [32] | Balci M, Tuncel A, Baran I, Guzel O, Keten T, Aksu N, Atan A. High-risk oncogenic human Papilloma virus infection of the foreskin and microbiology of smegma in prepubertal boys. Urology, 2015, 86(2): 368-372. DOI:10.1016/j.urology.2015.04.034 |
| [33] | 方丹波. Ⅲ型前列腺炎患者精液和前列腺按摩液菌群结构多样性研究. 浙江大学博士学位论文, 2014. |
| [34] | Liu ZC, Aerzgu Li. Streptococcosis of sows with bacterial reproductive disorders. Animal Science and Veterinary Medicine, 2005, 22(8): 32-33. (in Chinese) 刘忠琛, 阿尔孜古丽. 母猪细菌性繁殖障碍病之猪链球菌病. 动物科学与动物医学, 2005, 22(8): 32-33. DOI:10.3969/j.issn.1673-5358.2005.08.010 |
| [35] | Wang CD, Lan JC, Luo L, Yang Z, Zhang ZR. Klebsiella pneumoniae-pathogen of urogenital hematuria of giant Panda. Sichuan Journal of Zoology, 2006, 25(1): 83-85, 202. (in Chinese) 王成东, 兰景超, 罗娌, 杨智, 张再蓉. 大熊猫感染性泌尿生殖道血尿症病原-肺炎克雷伯氏杆菌. 四川动物, 2006, 25(1): 83-85, 202. DOI:10.3969/j.issn.1000-7083.2006.01.018 |
