崔志成, 付亮

 , 赵琦, 周丹丹
, 赵琦, 周丹丹 东北师范大学环境学院, 吉林省水污染控制与资源化工程实验室, 吉林 长春 130117
收稿日期:2020-09-01;修回日期:2020-12-25;网络出版日期:2021-03-22
基金项目:国家自然科学基金(51722803, 51708095);中央高校基本科研业务费专项资金(2412018ZD042, 2412020FZ014)
*通信作者:付亮, Tel: +86-431-89165610;Fax: +86-431-89165621;E-mail: ful988@nenu.edu.cn.
摘要:铁还原菌是一种典型的异化金属还原菌,广泛分布于海洋沉积物、陆地深地层等自然环境,该类细菌可以将铁氧化物中的Fe(Ⅲ)还原为Fe(Ⅱ),在铁、碳的生物地球化学铁循环中发挥重要作用。铁还原菌的末端电子不局限于Fe(Ⅲ),还可以是其他高价金属、有机污染物,可用于土壤、地下水的污染修复和毒性削减。在微生物电化学系统中,铁还原菌氧化有机物产生的电子直接传递给电极,可以产生电能。基于这种独特的胞外电子传递方式,衍生出了微生物燃料电池、微生物电解池、微生物脱盐电池、微生物燃料电池耦合芬顿反应以及光催化微生物燃料电池,常用于微生物发电、生物传感器、生物制氢、定向发酵、海水淡化、生物脱盐和污染物分解矿化。本文从异化铁还原菌的代谢机制、微生态作用、环境修复、水资源再生与能源转化四个方面,综述了铁还原菌的作用原理及国内外研究现状,分析论述了目前亟需解决的关键问题和未来的研究方向,以期为铁还原菌的基础理论研究和应用技术研发提供参考。
关键词:铁还原菌生物修复污水资源化微生物电化学技术电子传递
Iron-reducing bacteria in water regeneration and energy conversion
Zhicheng Cui, Liang Fu

 , Qi Zhao, Dandan Zhou
, Qi Zhao, Dandan Zhou Engineering Laboratory for Water Pollution Control and Resources Recovery of Jilin Province, School of Environment, Northeast Normal University, Changchun 130117, Jilin Province, China
Received: 1 September 2020; Revised: 25 December 2020; Published online: 22 March 2021
*Corresponding author: Liang Fu, Tel: +86-431-89165610; Fax: +86-431-89165621; E-mail: ful988@nenu.edu.cn.
Foundation item: Supported by the National Natural Science Foundation of China (51722803, 51708095) and by the Fundamental Research Funds for the Central Universities (2412018ZD042, 2412020FZ014)
Abstract: Iron-reducing bacteria are typical dissimilatory metal-reducing bacteria that are widespread in nature, including marine sediments and deep formations. These bacteria can reduce the Fe(Ⅲ) of iron oxides to Fe(Ⅱ) and play an important role in the biogeochemical iron cycle of iron and carbon. Aside from Fe(Ⅲ), other high valence state metals and organic pollutants can also serve as the terminal electron acceptors of iron-reducing bacteria; therefore, these bacteria can be utilized for the pollution remediation of soil/groundwater and toxicity reduction. In microbial electrochemical systems, the electrons produced by the oxidation of organic matter by iron-reducing bacteria can be directly transferred to the electrode to generate electricity. Many microbial electrochemical technologies have been developed and are commonly used in wastewater regeneration and energy conversion fields, including microbial fuel cells, microbial electrolysis cells, microbial desalination cells, microbial fuel cells coupled with Fenton processes, and photocatalytic microbial fuel cells, which are utilized for microbial power generation, biosensors, biological hydrogen production, directional fermentation, seawater desalination, pollutant decomposition, and mineralization. Here, we summarize research progress on iron-reducing bacteria, including metabolic mechanisms, micro-ecological functions, environmental remediation, water regeneration, and energy conversion. We highlight outstanding questions in the study of iron-reducing bacteria and point out directions meriting future research. Generally, this review will aid both theoretical and applied studies of iron-reducing bacteria.
Keywords: iron-reducing bacteriabioremediationwastewater renovationmicrobial electrochemical systemelectron transfer
铁(Fe)是地壳中丰度最高的过渡金属元素,地壳中铁的含量约为4.75%,主要以铁氧化物的形式存在。铁还原菌是一种典型的异化金属还原菌,广泛分布于海洋沉积物、陆地深地层等自然环境,该类细菌可以将铁氧化物中的Fe(Ⅲ)还原为Fe(Ⅱ),在铁的生物地球化学铁循环中发挥重要作用。传统观念认为,自然界的铁循环由非生物因素驱动,直到19世纪初人们发现微生物可以通过酶促反应还原Fe(Ⅲ),从此开启了铁还原菌研究的大门[1]。1987年首次分离出具有铁还原能力的纯菌Geobacter metallireducens GS-15,随着微生物铁还原的机理研究不断深入,人们对铁还原菌的微生态作用和应用潜力的认识逐渐清晰[2]。
铁还原菌通过分解有机物产生电子,将电子传递至细胞外,用于固态铁氧化物的还原。除此之外,产生的胞外电子通过细胞色素c、电子中介体和生物纳米导线等方式传递至电子受体[3-6],实现重金属离子还原减毒和有机污染物的分解矿化。因此,铁还原菌在环境修复方面具有广泛应用。铁还原菌产生的胞外电子还可以传递给电极,通过外部闭合回路产生电流。利用铁还原菌这一特性,近年来发展了许多新兴的生物电化学系统,如,微生物燃料电池(MFCs)可以产生电能,微生物电解池(MECs)可以产甲烷或氢气,微生物脱盐电池(MDCs)可用于海水淡化,微生物燃料电池-电芬顿耦合(MFC-Fenton)技术、光催化微生物燃料电池(PMFC)可用于污水处理等。
本文综述了铁还原菌的代谢机制、微生态作用、环境修复中的应用,以及水资源再生与能源转化技术的基本原理及最新研究进展。分析论述了现阶段铁还原菌相关研究方向亟需解决的关键基础科学问题,展望了未来微生物电化学系统在环境污染治理方面研究与应用的发展方向。
1 铁还原菌的代谢机制 1.1 铁还原菌的代谢路径 铁还原菌包括Rhodoferax ferriredueens、Geothrix fermentans、Desulfobulbus propionieus、Shewanella futrefaciens、Geobacter metallireducens等,目前研究最多的是Geobacter和Shewanella,已完成了两种菌的全基因组测序。Geobacter是一种厌氧细菌,可以利用乙酸盐、丙酮酸和H2作为碳源或电子供体进行生长代谢。乙酸或丙酮酸首先生成乙酰辅酶A,随后进入三羧酸循环(tricarboxylic acid cycle,TCA cycle)被完全氧化为CO2,产生的电子传递至醌池,用于物质的还原(图 1-A)[7]。
 |
| 图 1 Geobacter和Shewanella的产能代谢途径 Figure 1 Geobacterand Shewanella productivity metabolic pathways. A: acetate metabolism of Geobacter[11]; B: lactate metabolism of Shewanella, the solid line indicates aerobic metabolism, and the dotted line indicates anaerobic metabolism[12]. CIT: citric acid; ICT: isocitric acid; Mal: malic acid; OAA: oxaloacetic acid; OXO: 2-ketoglutaric acid; PEP: phosphoenolpyruvate; FUM: fumarate ester; SUC: succinic acid; PGA: 3-phosphoglyceric acid; Glu: glutamic acid; Asp: aspartic acid; Gly: glycine; Phe: phenylalanine; C1: one-carbon unit (tetrahydrofolic acid is covalently bonded with one carbon group at N5N10 and is converted into formic acid, formaldehyde, methanol, and another one-carbon unit under redox catalysis); EMP: glycolytic pathway; PPP: pentose phosphate pathway; Ed: Entner-Doudoroff pathway; TCA: tricarboxylic acid cycle. |
| 图选项 |
Shewanella是一种兼性厌氧细菌,可以利用甲酸、乳酸和氨基酸等多种有机酸以及H2作为碳源或电子供体维持自身代谢[8]。在好氧和厌氧条件下,TCA循环均参与了碳代谢,但两者之间又存在明显差别(图 1-B)。好氧条件下,Shewanella主要以好氧呼吸作为细胞的产能代谢过程,乳酸氧化生成丙酮酸,丙酮酸脱羧生成乙酰辅酶A进入TCA循环进行代谢,产生CO2和NADH。厌氧条件下,丙酮酸脱羧产生乙酰辅酶A和甲酸,乙酰辅酶A在磷酸转乙酰酶和乙酸激酶的催化下,经过底物水平磷酸化生成乙酸,同时产生ATP;另一条路径是丝氨酸-异柠檬酸裂解酶途径,丙酮酸产生甲酸,转化为甲醛与甘氨酸缩合形成丝氨酸,丝氨酸通过羟基丙酮酸和甘油酸转化进入磷酸甘油酸代谢中心,经一系列酶解反应转化为草酰乙酸进入TCA循环,转化为谷氨酸,表明TCA路径不完整[9]。近期研究发现,Shewanella以三甲胺N-氧化物作为电子受体时,可通过完整的TCA代谢路径将底物氧化为CO2[9]。尽管如此,底物水平磷酸化生成乙酸仍然是Shewanella厌氧代谢产能的主要途径[10]。
1.2 铁还原菌的电子传递 Shewanella作为一种代表性的铁还原菌,其胞内电子传递链如下:细胞代谢产生的电子进入醌池,内膜的醌氢还原酶CymA将MQH2氧化为MQ同时获得电子,电子传递给周质空间的多种氧化还原酶,如MtrA,经MtrB传递至MtrC和OmcA,最终达到细胞表面,通常MtrA、MtrB、MtrC以MtrCAB复合物的形式存在[13];CymA的电子也可通过MtrDEF路径传递至胞外[13]。此外,位于周质空间的STC也可能参与了电子传递或溶解性高价态金属离子的还原[13]。铁还原菌细胞表面的电子主要通过直接接触、电子穿梭体和导电附属物三种方式传递胞外电子,进而还原高价态金属氧化物(图 2)。位于细胞表面的亚铁血红素细胞色素c蛋白与Fe(Ⅲ)直接接触进行铁还原,或者将电子传递给电子中介体,如核黄素、黄素单核苷酸、黄素二核苷酸等,电子中介体再将Fe(Ⅲ)还原。铁还原菌可以产生纳米导线进行长距离的电子传递,如Geobacter产生10 μm甚至更长的纤毛进行导电[14];而Shewanella通过细胞外膜和周质空间的延展形成纳米导线结构用于电子传递[3-4]。
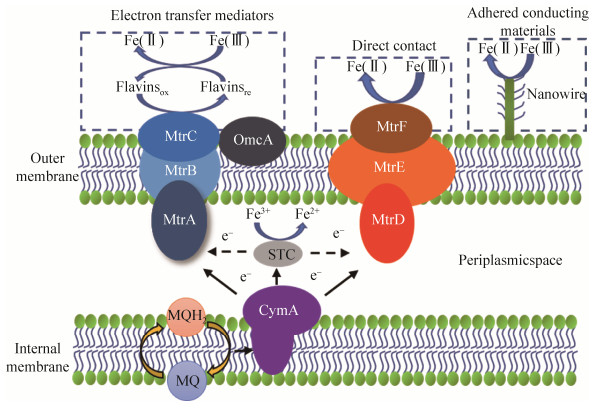 |
| 图 2 铁还原菌的电子传递 Figure 2 Electron transport by iron-reducing bacteria. CymA, MtrA, MtrB, MtrC, OmcA, MtrD, MtrE, MtrFm, and STC are cytochrome proteins. |
| 图选项 |
铁还原菌的胞外电子传递过程可人为强化,添加具有传递电子功能的物质修饰或调控传质界面,建立细菌与电子受体之间的桥梁,从而提高胞外电子传递效率。溶解性的电子中介体如蒽醌、中性红和腐殖酸等物质可促进电子传递,但是这些物质具有一定生物毒性、易流失且价格昂贵,应用方面存在局限。相对而言,碳纳米管、石墨烯和金属氧化物等固态电活性物质,不仅能够提高电子传递效率,而且安全、稳定,优势明显[15]。一些研究表明电活性物质甚至可以代替细胞色素蛋白进行电子传递[16]。Shewanella和Geobacter与铁氧化物通过形成“细菌-铁氧化物-细菌”网络结构促进电子的传递[17]。因此,固态电活性物质在强化铁还原菌胞外电子传递方面具有较好的应用前景。
2 铁还原菌的微生态作用 铁还原菌在自然环境中的微生态作用主要包括三个方面:铁、碳的生物地球化学循环,减缓温室效应,矿物形成与微量元素的迁移转化(图 3)。具有铁还原能力的微生物大部分属于细菌和古菌,而且大多为嗜铁菌属(Siderophilic bacteria),主要分布于一些极端环境中,如深部地层、热泉环境和浅海热液等[18]。铁还原菌利用有机碳作为碳源,在分解矿化有机碳的同时还原高价态的铁元素,从而在碳、铁的生物地球化学循环中发挥重要作用。目前已从环境中分离鉴定出多种铁还原菌,代表性菌株如表 1所示。
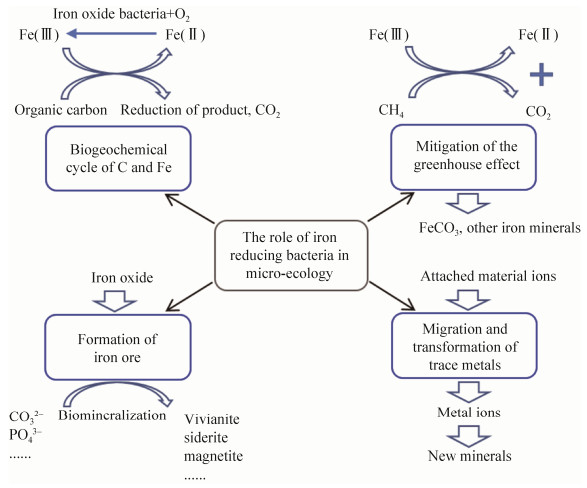 |
| 图 3 铁还原菌在环境中的微生态过程 Figure 3 Microecological processes of iron-reducing bacteria in the environment. |
| 图选项 |
表 1. 环境中常见铁还原微生物的种类 Table 1. Common species of iron-reducing microorganisms in the environment
| Bacteria | Distributional environment | Electron acceptor, metabolic substrates | References |
| Geobacteraceae | Landfills | Fe(Ⅲ), phenol | [19] |
| Peptococcaceae | Gas field/Poland | Fe(Ⅲ), benzene, phenol, benzoic acid | [20] |
| Deltaproteobacteria Geobacter strain TMJ1T | Oil well sediment | Fe(Ⅲ), methylbenzene, phenol | [21] |
| Shewanella decolorationis S12 | Activated sludge of a textile-printing waste-water treatment plant | Fe(Ⅲ), CHCl3 | [22] |
| Betaproteobacteria | Polluted aquifer | Fe(Ⅲ), methylbenzene | [23] |
| Geobacter grbiciae | Freshwater aquatic sediment | Fe(Ⅲ), methylbenzene | [24] |
| Clostridia Desulfitobacterium strain UKTLT | Soil of the original coal gasification field | Fe(Ⅲ), methylbenzene, phenol, p-cresol | [25] |
| Shewanella oneidensis MR-1 | Sediments of Oneida Lake | Fe(Ⅲ), U(Ⅵ), benzene, phenol | [26] |
表选项
2.1 温室气体控制 近期研究发现,铁还原菌具有减缓温室效应的功能。在有机物的分解中,Fe(Ⅲ)是环境中重要的电子受体,较CO2具有更高的氧化还原电位,更优先于其作为电子受体,从而抑制环境中甲烷的生成。
此外,厌氧甲烷氧化古菌(ANME-2d,也被称为Candidatus methanoperedens)还可以将温室气体CH4氧化生成CO2,进而以碳酸盐的形式固定下来,同时利用产生的电子将固态的铁氧化物还原[27]。在海岸沉积物中发现,人为活动引起的水体富营养化导致铁依赖型的厌氧甲烷氧化反应成为主导过程[28],并且ANME-2d可以与典型的异化金属还原菌Shewanella oneidensis协同作用,显著提高铁还原的反应速率[29]。甲烷氧化与铁还原耦合反应的微生物在海洋沉积物、生物圈中广泛存在,对抑制CH4释放、减缓温室效应发挥着重要作用[30-31]。
2.2 矿物形成与微量元素的迁移转化 铁还原菌对铁矿形成和微量金属元素迁移转化具有重要贡献。固态的铁氧化物具有很强的吸附能力,因此,含铁矿物中通常含有多种微量元素,如Cr、Se等。铁还原菌溶解还原铁氧化物时,这些金属元素也随之转化为游离态进入环境,通过吸附或者共沉淀等方式与新的含铁矿物结合,如菱铁矿、蓝铁矿、绿锈等[32]。由此可见,铁还原菌不仅促进了铁元素的自然循环,同时也促进了共存微量元素的迁移转化。
3 铁还原菌在环境修复领域中的应用 铁还原菌分布广泛、适应性强,人们发现可以利用其产生的胞外电子修复环境污染,因此,铁还原菌已成为一类重要的环境功能微生物。铁还原菌在环境污染治理方面,特别是水体、土壤修复领域已被广泛应用。在地表水体、地下水、深层海底、土壤等自然环境中,当氧气、碳源和电子受体匮乏时,铁还原菌对有毒有害有机污染物的降解和重金属离子的转化作用非常显著(图 4)。
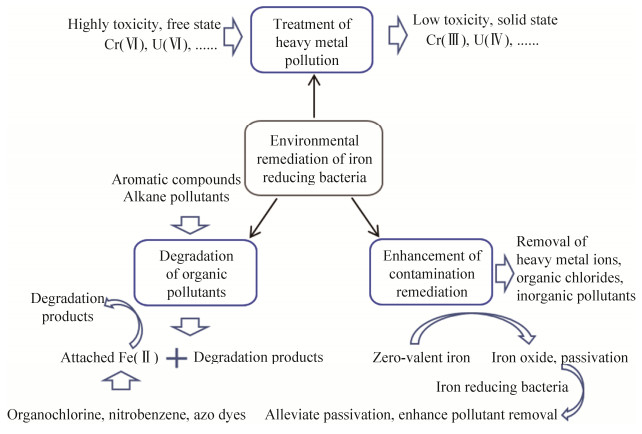 |
| 图 4 铁还原菌环境修复 Figure 4 Environmental remediation of iron-reducing bacteria. |
| 图选项 |
3.1 重金属污染治理 重金属污染严重威胁生态环境和人类健康,世界各国存在着不同程度的重金属污染问题,全世界平均每年排放Hg 1.5×104 t、Cu 3.4×106 t、Pb 5.0×106 t[33]。重金属具有生物毒性大、沿食物链富集和不可降解等特点,对环境产生严重危害。利用微生物的还原、矿化、富集、吸附等作用,可实现重金属减毒或去除[34]。铁还原菌以高价态的重金属离子为电子受体,将其还原为低毒性的稳定化合物,从而达到重金属污染修复的目的。例如,Geobacter还原U(Ⅵ)生成难溶的U(Ⅳ)[35],Shewanella oneidensis MR-1可以还原Mn(Ⅳ)、U(Ⅵ)等重金属离子[36]。此外,铁还原菌还能够将高毒性的Cr(Ⅵ)还原为低毒性的Cr(Ⅲ),还原放射性金属铀和氚的氧化物,以及Cd、Hg、As和Se等其他金属和类金属[36-38]。铁还原菌经过驯化培养可以适应高浓度重金属离子,达到更好的重金属去除效果。Shewanella oneidensis MR-1驯化120 d后,处理浓度高达190 mg/L的含铬废水,80 h后去除率达到了47.70%[39]。值得注意的是,铁还原菌反应生成的低价态离子可以与环境中的CO32-、PO43-、OH-等离子迅速反应生成沉淀,或者通过生物矿化作用在细胞表面附近形成矿物[40]。
3.2 有机污染物降解 铁还原菌在铁还原过程中还可以降解多种具有一定毒性的有机物污染物,如芳香族化合物、烷烃污染物等[41],因此,铁还原菌可用于石油污染修复。石油类污染物通常水溶性差、化学稳定性高和易发生吸附,容易在土壤、含水层和沉积物等环境赋存。在好氧微生物协同作用下,有机物污染区域可形成厌氧环境或局部厌氧微环境,有利于铁还原菌生存和有机物降解,从而发挥污染修复作用。铁还原菌除了通过自身降解有机物之外,其还原生成的Fe(Ⅱ)还可以与矿物形成吸附态的Fe(Ⅱ),如SOFe+、SOFeOH等[42],具有更强的还原能力,降解环境中的有机氯、硝基苯、偶氮染料等有机污染物[42]。
3.3 铁还原菌在水污染治理中的强化作用 生物强化、生物刺激和植物修复是加强城市地表水体修复的有效方法,可去除有机物、氮和磷[43]。目前,微生物修复存在活性维持困难、需要补充乙酸盐等碳源和附加材料具有毒性等问题[44]。铁还原菌可利用不同碳源还原多种电子受体,其适应能力强且在自然环境中分布广泛,不仅可以修复地表水体污染,还可以产生电能。因此,铁还原菌在增强地表水生物修复方面具有广阔的应用前景。
铁还原菌与纳米零价铁(nZVI)技术耦合可用于地下水修复。nZVI颗粒尺寸小、比表面积大和反应活性高,能有效去除地下水中的重金属离子、有机氯化物和无机污染物[45],但是在其颗粒表面易形成包裹态的铁氧化物,造成材料钝化而失效[46]。在nZVI修复地下水的基础上,引入铁还原菌将Fe(Ⅲ)还原,能够有效缓解三价铁氢氧化物和氧化物对nZVI活性的负面影响,产生的吸附态Fe(Ⅱ)还可以参与到其还原反应过程[46]。此外,上述还原过程促使铁氧化物脱落,有利于维持nZVI表面的核-壳结构[47],增强其污染物降解活性。在零价铁降解污染物的体系中,添加铁还原菌可以缓解零价铁钝化,污染物降解效率提高20%-50%[47]。
4 铁还原菌在水资源再生与能源转化中的应用 铁还原菌将呼吸过程中产生的电子传递给固体电极,通过闭合回路产生电流。最具代表性的铁还原菌包括Geobacter和Shewanella两类,均具有优异的产电性能。铁还原菌反应产生电能,根据生物电能的不同利用方式,生物电化学系统(bioelectrochemical system,BES)分为多种,如微生物燃料电池、微生物电解池和微生物脱盐电池等(图 5)。
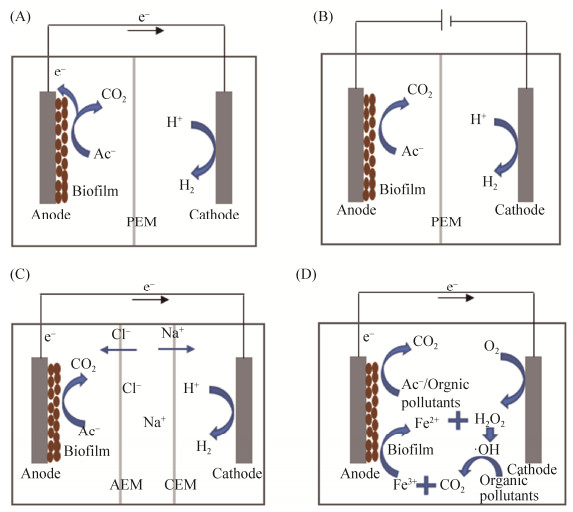 |
| 图 5 生物电化学系统 Figure 5 Bioelectrochemical system. A: microbial fuel cell, MFC; B: microbial electrolysis cells, MEC; C: microbial desalination cells, MDC; D: MFC-Fenton. |
| 图选项 |
4.1 微生物燃料电池 废水处理需要消耗大量的能源,传统生物处理法的能耗约为1500-1700 (kW·h)/t,而废水中所蕴含的能量大约为其能耗的9.3倍[48]。1911年,Potter首次在酵母菌和大肠杆菌的培养液中发现了电流产生的现象,开辟了微生物发电的研究领域[49]。微生物燃料电池(microbial fuel cell,MFC)不仅可以利用微生物分解水中的有机物,同时还能将产生的能量转化成电能。MFC阳极以微生物为催化剂,可以利用多种碳源,不同碳源的阳极电位通常在0.2-0.5 V范围内,而且阳极的生物相容性和导电效果对电极电势均有明显影响。1999年,Kim等首次发现Shewanella putrefaciens在无电子中介体时能够直接将电子传递到电极,显著提升了产电效率[50]。大量研究通过改性阴极-阳极材料、优选分隔膜和优化产电微生物等方法提升MFC的产电功率。
目前,MFC的最高产电功率达到4700- 6400 mW/m2[51-52],与化学电池相比仍然低几个数量级。虽然无法将MFC作为电源直接使用,但是可用于生态环境修复、污染物降解。Pribadi等利用MFC修复富营养化水体,NH4+-N去除率达到96%以上,同时可输出333 mA/m2的电能[53]。例如,利用上流式MFC阳极处理猪粪废水,实现了电池连续产电和COD的去除[54];以乙酸钠作为基质的MFC,可用于氯酚类难降解有机物的去除,去除率达到42%[55]。Fabrice等将藻渣作为MFC的产电基质,其产电能力与乙酸钠接近,功率密度达到1700 mW/m2[56]。MFC阳极的电活性菌能促进有机物氧化;阴极可以富集假单胞菌、芽孢杆菌和不动杆菌等好氧反硝化菌,以硝酸盐和氧气作为电子受体进行脱氮。相较于传统的生物废水处理工艺,利用MFC去除污染物的同时还可以回收部分电能,具有一定的应用价值。
4.2 微生物传感器 MFC产生的微弱电能无法作为电源使用,但是其电信号的变化可以直接反映水处理情况,用于实时在线监测,因此,近年来MFC多作为生物传感器使用,其研究和发展较为迅速。目前,MFC生物传感器已用于BOD、COD、DO的检测和有毒物质对水处理体系的冲击评价。Webster等利用Shewanella oneidensis研发了砷生物传感器,As(Ⅲ)检测限为40 mol/L,线性范围可达100 mol/L[57]。Velasquez-Orta等设计了一种MFC生物传感器,用于在线监测浅井中的粪便和有机污染,并且该系统不受盐度和外电阻影响[58]。此外,MFC生物传感器还可用于监测污水厂出水的NO3-、COD、BOD和挥发性脂肪酸等。Kim等设计构建了BOD生物传感器,用于污水处理系统BOD的原位实时监测,BOD的检测时间仅为45 min,并且检测灵敏度高、稳定性好[59]。
4.3 微生物电解池 微生物电解池(microbial electrolysis cells,MEC)以附着在电极上的电活性微生物为反应主体,通过外部施加电压来克服反应热力学能垒,反应生成H2和CH4等目标产物。MEC能够把多种有机物和实际废水中的混合物定向转化为所需的资源物质。MEC生产H2与其他工艺相比优势明显,与化学法相比操作条件温和、能耗低;与传统生物发酵相比,氢气转化率高、纯度高,避免了乙酸、丁酸等副产物。MEC体系中,乙酸盐转化为H2的电压为0.11 V,不足电解水制氢(1.23- 2.00 V)的1/10[60-61],电能消耗仅为1-3 (kW·h)/m3[62],而传统电解工艺的耗电量高达4.5-5.0 (kW·h)/m3[63]。此外,将MFC或热敏化太阳能电池与MEC结合,耦合体系可进一步降低产氢能耗,并且产氢效率可与传统电解制氢相媲美[63-64]。类似地,MEC产甲烷避免了传统生物厌氧发酵的副产物,甲烷纯度和产量更高。Dykstra等富集得到一种利用H2、CO2的产甲烷菌,利用该种产甲烷菌作为阴极构建MEC体系,该体系的甲烷产量达到(0.586± 0.029) mmol CH4/mg生物量,与直接生物发酵相比提高了3.8倍[65]。
4.4 微生物脱盐电池 微生物脱盐电池(microbial desalination cells,MDC)利用电活性微生物分解有机物,在阴阳极间产生电势,驱动离子定向移动通过离子交换膜,实现生物脱盐。当废水作为有机物来源时,MDC进行脱盐的同时,还可以实现能源生产和废水处理。MDC使用不同的功能膜材料,可进行电渗析、正渗透等反应,可用于盐水淡化、废水资源回收以及产酸产碱。MDC的常见反应器类型有3种(表 2),阴极电子受体可以是O2、铁氰化物和H+,分别发生氧还原、铁氰化物还原以及析氢反应。以乙酸盐作为有机底物、氧分子作为电子受体的MDC体系,可提供电势1.1 V[66],由于电极过电位损失,脱盐可用电势仅为0.5-0.6 V[67],导致实际脱盐速率较低。以H+作为电子受体的MDC体系,可通过外加电压克服反应所需的能垒,从而增加电流密度,加快脱盐速率。电流密度主要影响电解液的离子运动,在MDC中通常选用较小的电阻或者短接的方式增加电流密度,从而提高脱盐速率。此外,电池结构和pH对MDC的脱盐也有较大影响。电池结构大多为阳极室、脱盐室和阴极室的三室结构,在脱盐室内增加膜数量达到五室结构,可进一步提高脱盐效果[66]。随着MDC的运行,阴极室和阳极室溶液的pH发生变化,阳极pH降低导致电微生物活性降低,阴极pH升高导致电池电势下降,pH每升高一个单位电势下降约0.06 V[68]。近期研究发现,采用一种双室管式MDC可以解决OH和H+分别在阴极和阳极室的累积问题,可持续产生电流47 mA,脱盐效率达24.3 mg/h[69]。
表 2. 生物脱盐电池的类型和性能比较 Table 2. Comparison of types and performance of biological desalination cells
| Reactor types | Anolyte | Catholyte | NaCl/(g/L) | Proformance | References | |||||
| NaAc/ (mg/L) | PBS/ (mmol/L) | Electron acceptor | Buffer | COD removal/% | Salinity removal/% | Coulombic efficiency/% | ||||
| 3Cell | 1.60 | 50 | Fe(CN)63- | PBS | 35 | - | 93.0 | - | [71] | |
| 3Cell | 3.00 | 10 | O2 | H2SO4 | 35 | 92 | 94.0 | - | [72] | |
| Stack | 1.64 | 47 | O2 | PBS | 20 | - | 72.1 | 80 | [73] | |
| Stack | 1.00 | 100 | O2 | None | 35 | 91 | 44.0 | 80 | [74] | |
| 3Cell | 1.00-2.00 | 50 | O2 | PBS | 35 | 77-82 | 63.0 | 53-68 | [75] | |
| 3Cell | 2.00 | 50 | H+ | PBS | 10 | 38-54 | 37.0 | 53-68 | [76] | |
| Bipolar | 1.00 | 50 | O2 | None | 10 | - | 86.0 | 97 | [77] | |
表选项
研究者们最新提出了厌氧生物阴极MDC的概念[70],该体系的电子受体十分广泛,包括NO3-、NO2-、SO42-、Fe3+、Mn4+和CO2等,消除了好氧MDC阴极供氧的能源消耗,同时还可以获得一系列生物制品,如甲烷、H2等。某些铁还原微生物具有特殊的电子双向性,即在阳极可以输出电子至电极,在阴极又可以接收电子。例如Geobactor和Shewanella等微生物,在生物阴极反应过程中发挥着非常重要的作用。
4.5 微生物燃料电池耦合芬顿技术 微生物燃料电池耦合芬顿(MFC-Fenton)技术,利用MFC产生的电能驱动阴极还原O2产生H2O2,H2O2与Fe2+发生芬顿反应产生·OH,通过·OH的强氧化性降解污染物,解决了传统电芬顿技术能耗高的问题。Wang等提出了单室无膜的MFC-Fenton体系,阳极微生物利用污染物降解的中间产物产电[78],降低了产电成本同时提高了污染物的矿化效果。本课题组构建了以铁还原菌为主体的MFC-Fenton生物电化学系统(图 5-D),采用兼性厌氧铁还原菌Shewanella将反应生成的Fe3+还原成Fe2+再次进入芬顿反应链,实现了体系内部的铁循环,解决了芬顿反应过程需要不断投加铁盐、产生大量铁泥的问题[79]。该体系中,O2浓度是一个关键的控制条件,O2浓度过高导致微生物发生好氧呼吸,降低了产电功率和库伦效率,产生过多的H2O2还会降低微生物活性;O2不足则无法生成H2O2,影响体系的污染物降解效果。MFC-Fenton作为一种新型的MET技术,对于内分泌干扰物、染料废水、酚类有机物、有机农药和抗生素等大部分难降解有机污染物都表现出很好的处理效果[78-81]。
4.6 微生物燃料电池与光催化燃料电池耦合技术 MFC体系中,微生物可利用的基质大多为乙酸钠、葡萄糖等生物易降解物质,产生的电子可形成电流或用于污染物降解和矿化。实际废水中普遍存在生物抑制性污染物或有毒物质,铁还原菌不仅无法利用这类物质,微生物活性还会受到严重影响,导致产电能力下降、污水处理效率降低。光催化燃料电池(photocatalytic fuel cell,PFC),阳极表面的催化剂接受光照后迅速产生空穴-电子对,强氧化性的空穴在阳极将污染物氧化分解,电子在电势差驱动下传递至阴极。PFC对污染物的降解能力强、适用范围广,但是难以实现污染物的完全矿化,产电效果一般较差。光催化电池与微生物电池耦合(photocatalytic microbial fuel cell,PMFC)在生物抑制性污染物、难降解有毒污染物的处理方面具有显著优势,光催化将大分子的难降解污染物转化为易于生物降解的小分子中间产物,继而被微生物利用。微生物通过降解中间产物降低了其对于活性物种的竞争,同时提高了光催化和生物降解的效率。Zhou等利用多孔泡沫碳电极成功构建了PMFC,电极表面发生光催化反应降解污染物,降解产物被内部微生物进一步分解矿化产生电流[82]。该体系对4-氯酚的矿化效果良好,与单独MFC相比,电流密度提高了50%[82]。光催化材料的激发光大多为紫外光,而紫外光会损害微生物从而影响PMFC体系的稳定性和污染物处理效果。马冬梅通过改良催化剂成功构建了可见光响应的PMFC,该体系的4-氯酚矿化率与MFC和PFC相比,分别提高了1.5倍和1.8倍[83]。不仅如此,PMFC对重金属、染料和抗生素等污染物的处理,均表现出良好的效能[83],在生物抑制性污染物、持久性污染物治理方面具有很好的应用前景。
4.7 微生物电化学技术在污水能源化中的潜在应用 利用电活性微生物构建的各种类型的生物电化学系统,用于产生电能、生成定向产物、脱盐和去除污染物等不同目的,衍生出了多种微生物电化学技术(microbial electrochemical technology,MET)。MET与传统的生物处理技术相比,产生的电流可强化污染物去除效果,运行过程中通过自给部分能量降低了成本,可应用于环境修复及污染治理领域。例如,Lovely等通过施加稳定的阴极电势,将可溶性的U(Ⅵ)富集到电极,将其还原为不可溶的U(Ⅳ),通过电极的移除,即可实现铀污染的去除和物质回收[84]。通过调节外部施加的电位,在阳极和阴极选择氧化还原环境对污染物进行富集和分解转化,可用于水中重金属回收、有机物降解。此外,MET与芬顿、光催化等其他技术结合,构建高级氧化与生物降解近场协同的生物电化学系统,可实现难降解污染物深度处理的同时输出电能,在环境修复、污水能源化方面具有一定的应用前景。尽管目前MET在废水产电、产氢和产甲烷方面仍然难以达到应用水平,随着材料科学的发展与电子传递机制研究的深入,MET体系的性能和技术水平一定会迎来新的变革。
5 展望 铁还原菌在自然界分布广泛,其微生态功能、环境污染修复、水资源再生与能源转化方面仍然面临着一些亟待解决的基础理论和应用技术方面的问题。铁还原菌的上述功能和相关技术应用均依赖于其特殊的胞外电子传递能力,然而复杂环境下铁还原菌导电网络的电子传递机理及作用目前尚不清楚;现有的铁还原菌应用及微生物电化学技术大部分仅限于简化条件的小试规模,而对于复杂的实际环境,多种微生物、多种电子受体共存时,能否保证高效、稳定的污染物去除效果,仍然需要进行大量的实践探索。
铁还原菌与微生物电化学技术结合是一种新型的污染控制-能源转化策略,可根据实际情况选择是否施加一定外部电压,控制体系发生特定反应,如去除某种污染物、生成纯品产物和提高处理能力等。在未来的研究中,需要解决微生物电化学系统快速启动与稳定运行、复杂实际环境条件下电子受体之间的竞争与电子传递机制、离子交换膜等膜污染的控制方法、基因工程强化微生物电化学体系的功能及能量转化效率等问题,通过功能材料设计、微生物电化学体系优化,进一步提升铁还原菌在污染物控制、能源转化方面的效果,推动其应用进程。
References
| [1] | Lovley DR. Dissimilatory Fe(Ⅲ) and Mn(Ⅳ) reduction. Microbiological Reviews, 1991, 55(2): 259-287. DOI:10.1128/mr.55.2.259-287.1991 |
| [2] | Lovley DR, Phillips EJP. Novel mode of microbial energy metabolism: organic carbon oxidation coupled to dissimilatory reduction of iron or manganese. Applied and Environmental Microbiology, 1988, 54(6): 1472-1480. DOI:10.1128/aem.54.6.1472-1480.1988 |
| [3] | Gorby YA, Yanina S, McLean JS, Rosso KM, Moyles D, Dohnalkova A, Beveridge TJ, Chang IS, Kim BH, Kim KS, Culley DE, Reed SB, Romine MF, Saffarini DA, Hill EA, Shi L, Elias DA, Kennedy DW, Pinchuk G, Watanabe K, Ishii S, Logan B, Nealson KH, Fredrickson JK. Electrically conductive bacterial nanowires produced by Shewanella oneidensis strain MR-1 and other microorganisms. Proceedings of the National Acadewy of Sciences of the United States of America, 2006, 103(30): 11358-11363. DOI:10.1073/pnas.0604517103 |
| [4] | Logan BE, Rossi R, Ragab A, Saikaly PE. Electroactive microorganisms in bioelectrochemical systems. Nature Reviews Microbiology, 2019, 17(5): 307-319. DOI:10.1038/s41579-019-0173-x |
| [5] | Kato S, Hashimoto K, Watanabe K. Microbial interspecies electron transfer via electric currents through conductive minerals. Proceedings of the National Acadewy of Sciences of the United States of America, 2012, 109(25): 10042-10046. DOI:10.1073/pnas.1117592109 |
| [6] | Bretschger O, Obraztsova A, Sturm CA, Chang IS, Gorby YA, Reed SB, Culley DE, Reardon CL, Barua S, Romine MF, Zhou JZ, Beliaev AS, Bouhenni R, Saffarini D, Mansfeld F, Kim BH, Fredrickson JK, Nealson KH. Current production and metal oxide reduction by Shewanella oneidensis MR-1 wild type and mutants. Applied and Environmental Microbiology, 2007, 73(21): 7003-7012. DOI:10.1128/AEM.01087-07 |
| [7] | Li DB, Li J, Liu DF, Ma X, Cheng L, Li WW, Qian C, Mu Y, Yu HQ. Potential regulates metabolism and extracellular respiration of electroactive Geobacter biofilm. Biotechnology and Bioengineering, 2019, 116(5): 961-971. DOI:10.1002/bit.26928 |
| [8] | Nealson KH, Scott J. Ecophysiology of the genus Shewanella. The prokaryotes. New York: Springer: 1133-1151. |
| [9] | Tang YJ, Meadows AL, Kirby J, Keasling JD. Anaerobic central metabolic pathways in Shewanella oneidensis MR-1 reinterpreted in the light of isotopic metabolite labeling. Journal of Bacteriology, 2007, 189(3): 894-901. DOI:10.1128/JB.00926-06 |
| [10] | Li HJ, Peng JJ. Recent advances in studies on dissimilatory Fe(Ⅲ)-reducing microorganisms. Acta Ecologica Sinica, 2012, 32(5): 1633-1642. (in Chinese) 黎慧娟, 彭静静. 异化Fe(Ⅲ)还原微生物研究进展. 生态学报, 2012, 32(5): 1633-1642. |
| [11] | Segura D, Mahadevan R, Juarez K, Lovley D. Computational and experimental analysis of redundancy in the central metabolism of Geobacter sulfurreducens. PLoS Computational Biology, 2005, preprint(2008): e36. DOI: 10.1371/journal.pcbi.0040036.eor. |
| [12] | Tang YJ, Hwang JS, Wemmer DE, Keasling JD. Shewanella oneidensis MR-1 fluxome under various oxygen conditions. Applied and Environmental Microbiology, 2007, 73(3): 718-729. DOI:10.1128/AEM.01532-06 |
| [13] | Alves MN, Neto SE, Alves AS, Fonseca BM, Carrêlo A, Pacheco I, Paquete CM, Soares CM, Louro RO. Characterization of the periplasmic redox network that sustains the versatile anaerobic metabolism of Shewanella oneidensis MR-1. Frontiers in Microbiology, 2015, 6: 665. |
| [14] | Reguera G, McCarthy KD, Mehta T, Nicoll JS, Tuominen MT, Lovley DR. Extracellular electron transfer via microbial nanowires. Nature, 2005, 435(7045): 1098-1101. DOI:10.1038/nature03661 |
| [15] | Kato S, Hashimoto K, Watanabe K. Methanogenesis facilitated by electric syntrophy via (semi)conductive iron-oxide minerals. Environmental Microbiology, 2012, 14(7): 1646-1654. DOI:10.1111/j.1462-2920.2011.02611.x |
| [16] | Nakamura R, Kai F, Okamoto A, Newton G, Hashimoto K. Self-constructed electrically conductive bacterial networks. Angewandte Chemie International Edition, 2009, 48(3): 508-511. DOI:10.1002/anie.200804750 |
| [17] | Rotaru AE, Shrestha PM, Liu FH, Markovaite B, Chen SS, Nevin KP, Lovley DR. Direct interspecies electron transfer between Geobacter metallireducens and Methanosarcina barkeri. Applied and Environmental Microbiology, 2014, 80(15): 4599-4605. DOI:10.1128/AEM.00895-14 |
| [18] | Kashefi K. Extending the upper temperature limit for life. Science, 2003, 301(5635): 934. DOI:10.1126/science.1086823 |
| [19] | Botton S, Parson JR. Degradation of BTEX compounds under iron-reducing conditions in contaminated aquifer microcosms. Environmental Toxicology and Chemistry, 2006, 25(10): 2630-2638. DOI:10.1897/06-004R.1 |
| [20] | Abu Laban N, Selesi D, Rattei T, Tischler P, Meckenstock RU. Identification of enzymes involved in anaerobic benzene degradation by a strictly anaerobic iron-reducing enrichment culture. Environmental Microbiology, 2010, 12(10): 2783-2796. |
| [21] | Kumari S, Regar RK, Manickam N. Improved polycyclic aromatic hydrocarbon degradation in a crude oil by individual and a consortium of bacteria. Bioresource Technology, 2018, 254: 174-179. DOI:10.1016/j.biortech.2018.01.075 |
| [22] | Xu MY, Guo J, Cen YH, Zhong XY, Cao W, Sun GP. Shewanella decolorationis sp. nov., a dye-decolorizing bacterium isolated from activated sludge of a waste-water treatment plant. International Journal of Systematic and Evolutionary Microbiology, 2005, 55(1): 363-368. DOI:10.1099/ijs.0.63157-0 |
| [23] | Weelink SAB, Van Doesburg W, Saia FT, Rijpstra WIC, R?ling WFM, Smidt H, Stams AJM. A strictly anaerobic betaproteobacterium Georgfuchsia toluolica gen. nov., sp. nov. degrades aromatic compounds with Fe(Ⅲ), Mn(Ⅳ) or nitrate as an electron acceptor. FEMS Microbiology Ecology, 2009, 70(3): 575-585. DOI:10.1111/j.1574-6941.2009.00778.x |
| [24] | Coates JD, Bhupathiraju VK, Achenbach LA, Mclnerney MJ, Lovley DR. Geobacter Hydrogenophilus, Geobacter chapellei and Geobacter grbiciae, three new, strictly anaerobic, dissimilatory Fe(Ⅲ)-reducers. International Journal of Systematic and Evolutionary Microbiology, 2001, 51(Pt 2): 581-588. |
| [25] | Kunapuli U, Jahn MK, Lueders T, Geyer R, Heipieper HJ, Meckenstock RU. Desulfitobacterium aromaticivorans sp. nov. and Geobacter toluenoxydans sp. nov., iron-reducing bacteria capable of anaerobic degradation of monoaromatic hydrocarbons. International Journal of Systematic and Evolutionary Microbiology, 2010, 60(3): 686-695. DOI:10.1099/ijs.0.003525-0 |
| [26] | Esther J, Sukla LB, Pradhan N, Panda S. Fe (Ⅲ) reduction strategies of dissimilatory iron reducing bacteria. Korean Journal of Chemical Engineering, 2015, 32(1): 1-14. DOI:10.1007/s11814-014-0286-x |
| [27] | Beal EJ, House CH, Orphan VJ. Manganese- and iron-dependent marine methane oxidation. Science, 2009, 325(5937): 184-187. DOI:10.1126/science.1169984 |
| [28] | Egger M, Rasigraf O, Sapart CJ, Jilbert T, Jetten MSM, R?ckmann T, van der Veen C, Band? N, Kartal B, Ettwig KF, Slomp CP. Iron-mediated anaerobic oxidation of methane in brackish coastal sediments. Environmental Science & Technology, 2015, 49(1): 277-283. |
| [29] | Fu L, Li SW, Ding ZW, Ding J, Lu YZ, Zeng RJ. Iron reduction in the DAMO/Shewanella oneidensis MR-1 coculture system and the fate of Fe(Ⅱ). Water Research, 2016, 88: 808-815. DOI:10.1016/j.watres.2015.11.011 |
| [30] | Knittel K, Boetius A. Anaerobic oxidation of methane: progress with an unknown process. Annual Review of Microbiology, 2009, 63: 311-334. DOI:10.1146/annurev.micro.61.080706.093130 |
| [31] | Schout G, Hartog N, Hassanizadeh SM, Griffioen J. Impact of an historic underground gas well blowout on the current methane chemistry in a shallow groundwater system. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(2): 296-301. DOI:10.1073/pnas.1711472115 |
| [32] | Cai C, Leu AO, Xie GJ, Guo JH, Feng YX, Zhao JX, Tyson GW, Yuan ZG, Hu SH. A methanotrophic archaeon couples anaerobic oxidation of methane to Fe(Ⅲ) reduction. The ISME Journal, 2018, 12(8): 1929-1939. DOI:10.1038/s41396-018-0109-x |
| [33] | Zhao Q. Formation mechanism and treatment technology of arsenic pollution in groundwater. Guangdong Chemical Industry, 2018, 45(17): 151-152, 138. (in Chinese) 赵泉. 地下水砷污染形成机制及治理技术. 广东化工, 2018, 45(17): 151-152, 138. DOI:10.3969/j.issn.1007-1865.2018.17.072 |
| [34] | Anderson RT, Vrionis HA, Ortiz-Bernad I, Resch CT, Long PE, Dayvault R, Karp K, Marutzky S, Metzler DR, Peacock A, White DC, Lowe M, Lovley DR. Stimulating the in situ activity of Geobacter species to remove uranium from the groundwater of a uranium-contaminated aquifer. Applied and Environmental Microbiology, 2003, 69(10): 5884-5891. DOI:10.1128/AEM.69.10.5884-5891.2003 |
| [35] | Lovley DR, Roden EE, Phillips EJP, Woodward JC. Enzymatic iron and uranium reduction by sulfate-reducing bacteria. Marine Geology, 1993, 113(1/2): 41-53. |
| [36] | Choppala G, Bolan N, Kunhikrishnan A, Skinner W, Seshadri B. Concomitant reduction and immobilization of chromium in relation to its bioavailability in soils. Environmental Science and Pollution Research, 2015, 22(12): 8969-8978. DOI:10.1007/s11356-013-1653-6 |
| [37] | Chen Y, Wang H, Si YB. Research on the bioaccesibility of HgS by Shewanella oneidensis MR-1. Environmental Science, 2013, 34(11): 4466-4472. (in Chinese) 陈艳, 王卉, 司友斌. Shewanella oneidensis MR-1对硫化汞的生物利用性研究. 环境科学, 2013, 34(11): 4466-4472. |
| [38] | Xiao Y, Xiao CY, Zhao F. Long-term adaptive evolution of Shewanella oneidensis MR-1 for establishment of high concentration Cr(Ⅵ) tolerance. Frontiers of Environmental Science & Engineering, 2019, 14(1): 1-11. |
| [39] | Castro C, Urbieta MS, Plaza Cazón J, Donati ER. Metal biorecovery and bioremediation: whether or not thermophilic are better than mesophilic microorganisms. Bioresource Technology, 2019, 279: 317-326. DOI:10.1016/j.biortech.2019.02.028 |
| [40] | Colwell RR, Walker JD, Cooney JJ. Ecological aspects of microbial degradation of petroleum in the marine environment. CRC Critical Reviews in Microbiology, 1977, 5(4): 423-445. DOI:10.3109/10408417709102813 |
| [41] | da Silva MLB, Johnson RL, Alvarez PJJ. Microbial characterization of groundwater undergoing treatment with a permeable reactive iron barrier. Environmental Engineering Science, 2007, 24(8): 1122-1127. DOI:10.1089/ees.2007.0016 |
| [42] | Nano GV, Strathmann TJ. Ferrous iron sorption by Hydrous metal oxides. Journal of Colloid and Interface Science, 2006, 297(2): 443-454. DOI:10.1016/j.jcis.2005.11.030 |
| [43] | Guo Y, Zeng Z. Progress in bioremediation of organics polluted water. Guangdong Chemical Industry, 2015, 42(14): 151-152. (in Chinese) 郭燕, 曾志. 有机污染水体生物修复技术研究进展. 广东化工, 2015, 42(14): 151-152. DOI:10.3969/j.issn.1007-1865.2015.14.076 |
| [44] | Lü JP, Fu QY, Lu SW, Lu WX. Brief analysis on the application of biological methods in water pollution remediation. Journal of Green Science and Technology, 2016(4): 66-68. (in Chinese) 吕俊鹏, 付秋玥, 鲁斯唯, 陆文霞. 生物方法在水污染修复中的应用研究. 绿色科技, 2016(4): 66-68. DOI:10.3969/j.issn.1674-9944.2016.04.023 |
| [45] | Wang WD, Li S, Lin W, Li YM, Zhang LK, Han JH. Removal of Cr(Ⅵ) from solution by carbon black/zero valence iron composites coupled with metal reducing bacteria. Ecology and Environmental Sciences, 2019, 28(10): 2062-2069. (in Chinese) 王维大, 李硕, 林薇, 李玉梅, 张连科, 韩剑宏. 黑炭/零价铁复合材料耦合金属还原菌对溶液中Cr(Ⅵ)的去除. 生态环境学报, 2019, 28(10): 2062-2069. |
| [46] | Ma LY, He MM, Chen SH. Development and application of nanoscale zero-valent iron and dissimilatory iron rreducing bacteria in environmental remediation. Guangzhou Chemical Industry, 2020, 48(21): 14-16. (in Chinese) 马黎颖, 和明敏, 陈绍华. 异化铁还原菌强化纳米零价铁在环境修复中的应用研究进展. 广州化工, 2020, 48(21): 14-16. DOI:10.3969/j.issn.1001-9677.2020.21.007 |
| [47] | Yang ZL, Wang XL, Li H, Yang J, Zhou LY, Liu YD. Re-activation of aged-ZVI by iron-reducing bacterium Shewanella putrefaciens for enhanced reductive dechlorination of trichloroethylene. Journal of Chemical Technology & Biotechnology, 2017, 92(10): 2642-2649. |
| [48] | Logen BE. 冯玉杰, 王鑫, 等译. Microbial fuel cells. 第1版. 北京: 化学工业出版社, 2009: 4-6. |
| [49] | Potter MC. Electrical effects accompanying the decomposition of organic compounds. Ⅱ.-ionisation of the gases produced during fermentation. Proceedings of the Royal Society of London Series A, Containing Papers of a Mathematical and Physical Character, 1915, 91(632): 465-480. DOI:10.1098/rspa.1915.0038 |
| [50] | Kim BH, Ikeda T, Park HS, Kim HJ, Hyun MS, Kano K, Takagi K, Tatsumi H. Electrochemical activity of an Fe(Ⅲ)-reducing bacterium, Shewanella putrefaciens IR-1, in the presence of alternative electron acceptors. Biotechnology Techniques, 1999, 13(7): 475-478. DOI:10.1023/A:1008993029309 |
| [51] | Yang WL, Logan BE. Immobilization of a metal-nitrogen-carbon catalyst on activated carbon with enhanced cathode performance in microbial fuel cells. ChemSusChem, 2016, 9(16): 2226-2232. DOI:10.1002/cssc.201600573 |
| [52] | Oliot M, Etcheverry L, Mosdale A, Basseguy R, Délia ML, Bergel A. Separator electrode assembly (SEA) with 3-dimensional bioanode and removable air-cathode boosts microbial fuel cell performance. Journal of Power Sources, 2017, 356: 389-399. DOI:10.1016/j.jpowsour.2017.03.016 |
| [53] | Zhang YC, Jiang ZH, Liu Y. Application of electrochemically active bacteria as anodic biocatalyst in microbial fuel cells. Chinese Journal of Analytical Chemistry, 2015, 43(1): 155-163. (in Chinese) 张逸驰, 蒋昭泓, 刘颖. 电化学活性微生物在微生物燃料电池阳极中的应用. 分析化学, 2015, 43(1): 155-163. |
| [54] | Ma DM, Jiang ZH, Lay CH, Zhou DD. Electricity generation from swine wastewater in microbial fuel cell: hydraulic reaction time effect. International Journal of Hydrogen Energy, 2016, 41(46): 21820-21826. DOI:10.1016/j.ijhydene.2016.08.019 |
| [55] | Yu Y, Ndayisenga F, Yu ZS, Zhao MY, Lay CH, Zhou DD. Co-substrate strategy for improved power production and chlorophenol degradation in a microbial fuel cell. International Journal of Hydrogen Energy, 2019, 44(36): 20312-20322. DOI:10.1016/j.ijhydene.2019.05.221 |
| [56] | Ndayisenga F, Yu ZS, Yu Y, Lay CH, Zhou DD. Bioelectricity generation using microalgal biomass as electron donor in a bio-anode microbial fuel cell. Bioresource Technology, 2018, 270: 286-293. DOI:10.1016/j.biortech.2018.09.052 |
| [57] | Webster DP, TerAvest MA, Doud DFR, Chakravorty A, Holmes EC, Radens CM, Sureka S, Gralnick JA, Angenent LT. An arsenic-specific biosensor with genetically engineered Shewanella oneidensis in a bioelectrochemical system. Biosensors and Bioelectronics, 2014, 62: 320-324. DOI:10.1016/j.bios.2014.07.003 |
| [58] | Velasquez-Orta SB, Werner D, Varia JC, Mgana S. Microbial fuel cells for inexpensive continuous in situ monitoring of groundwater quality. Water Research, 2017, 117: 9-17. DOI:10.1016/j.watres.2017.03.040 |
| [59] | Kim BH, Chang IS, Cheol Gil G, Park HS, Kim HJ. Novel BOD (biological oxygen demand) sensor using mediator-less microbial fuel cell. Biotechnology Letters, 2003, 25(7): 541-545. DOI:10.1023/A:1022891231369 |
| [60] | Dewan A, Beyenal H, Lewandowski Z. Scaling up microbial fuel cells. Environmental Science & Technology, 2008, 42(20): 7643-7648. |
| [61] | Kadier A, Simayi Y, Chandrasekhar K, Ismail M, Kalil MS. Hydrogen gas production with an electroformed Ni mesh cathode catalysts in a single-chamber microbial electrolysis cell (MEC). International Journal of Hydrogen Energy, 2015, 40(41): 14095-14103. DOI:10.1016/j.ijhydene.2015.08.095 |
| [62] | Call D, Logan BE. Hydrogen production in a single chamber microbial electrolysis cell lacking a membrane. Environmental Science & Technology, 2008, 42(9): 3401-3406. |
| [63] | Wang B, Gao GD, Li FX, Zhou QX, Song XJ, Zhai HH, Li YN. Advance in application of microbial electrolysis cells. Chemical Industry and Engineering Progress, 2017, 36(3): 1084-1092. (in Chinese) 王博, 高冠道, 李凤祥, 周启星, 宋晓静, 翟欢欢, 李亚宁. 微生物电解池应用研究进展. 化工进展, 2017, 36(3): 1084-1092. |
| [64] | Fu L, You SJ, Yang FL, Gao MM, Fang XH, Zhang GQ. Synthesis of hydrogen peroxide in microbial fuel cell. Journal of Chemical Technology & Biotechnology, 2010, 85(5): 715-719. |
| [65] | Dou ZO, Dykstra CM, Pavlostathis SG. Bioelectrochemically assisted anaerobic digestion system for biogas upgrading and enhanced methane production. Science of the Total Environment, 2018, 633: 1012-1021. DOI:10.1016/j.scitotenv.2018.03.255 |
| [66] | Liu H, Logan BE. Electricity generation using an air-cathode single chamber microbial fuel cell in the presence and absence of a proton exchange membrane. Environmental Science & Technology, 2004, 38(14): 4040-4046. |
| [67] | Kim Y, Logan BE. Microbial desalination cells for energy production and desalination. Desalination, 2013, 308: 122-130. DOI:10.1016/j.desal.2012.07.022 |
| [68] | Tang C, Sun Z, Chen DH, Huang MH, Zheng W, Liao LZ, Cai Q. Simultaneous removal of Rhodamine B and electricity generation in microbial fuel cell with AC/PTFE cathode. Chinese Journal of Environmental Engineering, 2016, 10(11): 6165-6170. (in Chinese) 唐超, 孙哲, 陈东辉, 黄满红, 郑伟, 廖玲芝, 蔡群. AC/PTFE微生物燃料电池阴极去除罗丹明B及同步产电性能. 环境工程学报, 2016, 10(11): 6165-6170. DOI:10.12030/j.cjee.201506048 |
| [69] | Jafary T, Al-Mamun A, Alhimali H, Baawain MS, Rahman S, Tarpeh WA, Dhar BR, Kim BH. Novel two-chamber tubular microbial desalination cell for bioelectricity production, wastewater treatment and desalination with a focus on self-generated pH control. Desalination, 2020, 481: 114358. DOI:10.1016/j.desal.2020.114358 |
| [70] | Perazzoli S, de Santana Neto JP, Soares HM. Anoxic-biocathode microbial desalination cell as a new approach for wastewater remediation and clean water production. Water Science and Technology, 2020, 81(3): 550-563. DOI:10.2166/wst.2020.134 |
| [71] | Cao XX, Huang X, Liang P, Xiao K, Zhou YJ, Zhang XY, Logan BE. A new method for water desalination using microbial desalination cells. Environmental Science & Technology, 2009, 43(18): 7148-7152. |
| [72] | Jacobson KS, Drew DM, He Z. Use of a liter-scale microbial desalination cell as a platform to study bioelectrochemical desalination with salt solution or artificial seawater. Environmental Science & Technology, 2011, 45(10): 4652-4657. |
| [73] | Chen X, Xia X, Liang P, Cao XX, Sun HT, Huang X. Stacked microbial desalination cells to enhance water desalination efficiency. Environmental Science & Technology, 2011, 45(6): 2465-2470. |
| [74] | Kim Y, Logan BE. Series assembly of microbial desalination cells containing stacked electrodialysis cells for partial or complete seawater desalination. Environmental Science & Technology, 2011, 45(13): 5840-5845. |
| [75] | Luo HP, Xu P, Roane TM, Jenkins PE, Ren ZY. Microbial desalination cells for improved performance in wastewater treatment, electricity production, and desalination. Bioresource Technology, 2012, 105: 60-66. DOI:10.1016/j.biortech.2011.11.098 |
| [76] | Qu YP, Feng YJ, Wang X, Liu J, Lv J, He WH, Logan BE. Simultaneous water desalination and electricity generation in a microbial desalination cell with electrolyte recirculation for pH control. Bioresource Technology, 2012, 106: 89-94. DOI:10.1016/j.biortech.2011.11.045 |
| [77] | Chen SS, Liu GL, Zhang RD, Qin BY, Luo Y. Development of the microbial electrolysis desalination and chemical-production cell for desalination as well as acid and alkali productions. Environmental Science & Technology, 2012, 46(4): 2467-2472. |
| [78] | Wang W, Lu YB, Luo HP, Liu GL, Zhang RD, Jin S. A microbial electro-Fenton cell for removing carbamazepine in wastewater with electricity output. Water Research, 2018, 139: 58-65. DOI:10.1016/j.watres.2018.03.066 |
| [79] | Zhao MY, Cui ZC, Fu L, Ndayisenga F, Zhou DD. Shewanella drive Fe(Ⅲ) reduction to promote electro-Fenton reactions and enhance Fe inner-cycle. ACS ES&T Water, 2021, 1(3): 613-620. |
| [80] | Xu N, Zhang YY, Tao HC, Zhou SG, Zeng YQ. Bio-electro-Fenton system for enhanced estrogens degradation. Bioresource Technology, 2013, 138: 136-140. DOI:10.1016/j.biortech.2013.03.157 |
| [81] | Tao HC, Wei XY, Zhang LJ, Lei T, Xu N. Degradation of p-nitrophenol in a BES-Fenton system based on limonite. Journal of Hazardous Materials, 2013, 254/255: 236-241. DOI:10.1016/j.jhazmat.2013.03.061 |
| [82] | Zhou DD, Dong SS, Shi JL, Cui XC, Ki D, Torres CI, Rittmann BE. Intimate coupling of an N-doped TiO2 photocatalyst and anode respiring bacteria for enhancing 4-chlorophenol degradation and current generation. Chemical Engineering Journal, 2017, 317: 882-889. DOI:10.1016/j.cej.2017.02.128 |
| [83] | 马冬梅. 光催化-微生物降解直接耦合燃料电池降解4-氯酚和产电特性研究. 吉林大学硕士学位论文, 2017. |
| [84] | Gregory KB, Lovley DR. Remediation and recovery of uranium from contaminated subsurface environments with electrodes. Environmental Science & Technology, 2005, 39(22): 8943-8947. |
