武利勤1,2, 杨素玲1,2

 , 亓丽梅3, 刘桂君1,2, 顾海科1,2
, 亓丽梅3, 刘桂君1,2, 顾海科1,2 1. 北京市辐射中心射线束技术教育部重点实验室, 北京 100875;
2. 北京师范大学核科学与技术学院, 北京 100875;
3. 北京邮电大学电子工程学院, 北京 100876
收稿日期:2020-08-19;修回日期:2020-12-23;网络出版日期:2021-06-03
基金项目:北京市自然科学基金(6162007);北京市科学技术研究院改革发展培育项目(PY2020JK40)
*通信作者:杨素玲, Tel: +86-10-57910998; E-mail: yangcicely@126.com.
摘要:短梗霉真菌(Aureobasidium spp.)是一种世界性的酵母样真菌,因其产生黑色素而被称为黑酵母。短梗霉的许多菌株都能分泌细胞外脂质liamocins。Liamocins具有表面活性、良好的抗癌和抗菌活性。本文综述了分泌liamocins的短梗霉的多样性及影响其产生liamocins的因素,总结了liamocins生物合成途径的研究进展,并对短梗霉真菌合成liamocins的进一步研究提出了建议。
关键词:短梗霉真菌liamocins抗癌活性抗菌活性生物表面活性剂
Liamocins produced by Aeruobasidium spp.
Wu Liqin1,2, Yang Suling1,2

 , Qi Limei3, Liu Guijun1,2, Gu Haike1,2
, Qi Limei3, Liu Guijun1,2, Gu Haike1,2 1. Key Laboratory of Beam Technology of Ministry of Education, Beijing Radiation Center, Beijing 100875, China;
2. College of Nuclear Science and Technology, Beijing Normal University, Beijing 100875, China;
3. School of Electronic Engineering BUPT, Beijing University of Posts and Telecommunications, Beijing 100876, China
Received: 19 August 2020; Revised: 23 December 2020; Published online: 3 June 2021
*Corresponding author: Suling Yang, Tel: +86-10-57910998; E-mail: yangcicely@126.com.
Foundation item: Supported by the Beijing Municipal Natural Science Foundation of China (6162007) and by the Beijing Academy of Science and Technology-Reform and Development Project (PY2020JK40)
Abstract: Aureobasidium spp. are cosmopolitan yeast-like fungi and popularly known as black yeasts due to their melanin production. Many strains of Aureobasidium spp. are found to secreted extracellular lipids as liamocins. Liamocins are surface active and has promising anticancer and antibacterial activities. This paper reviewed the variety of liamocin-secreting Aureobasidium spp. and the factors that affecting liamocins production. It also summarized the research progress of the biosynthetic pathway of liamocins. Also some further research of liamocins production by Aureobasidium spp. was recommended.
Keywords: Aeruobasidium spp.liamocinsanticancerantibacterialbiosurfactants
出芽短梗霉(Aureobasidium pullulans)是子囊菌中可以分泌黑色素的酵母样真菌,因此也被称为黑酵母,包括A. pullulans var. pullulans、A. pullulans var. melanogenum、A. pullulans var. subplaciale、A. pullulans var. namibiae和A. pullulans var. aubasiandi 5个变种[1]。Gostin?ar等[2]通过基因组测序证实其中4个变种应归属于4个不同的种:A. pullulans,A. melanogenum, A. subglaciale和A. namibiae。短梗霉是一种多形态真菌,具有复杂的生活史,有类酵母细胞(yeast-like cells)、芽生孢子(blastospores)、厚垣孢子(chlamydospores)和菌丝体(mycelia)等几种形态[3]。如发酵时由于氧气的限制和营养的缺乏,短梗霉能够在类酵母和丝状真菌状态之间转换[4-5]。短梗霉作为生防菌可以有效地拮抗植物病原真菌和细菌[6-7]。短梗霉也是一种重要的工业菌株,以能够生产普鲁兰多糖而闻名,同时不同菌株还可以合成聚苹果酸、黑色素、多种生物酶和liamocins (重油)等代谢产物[8-14]。
Liamocins是一种多元醇酯类物质,主要由亲水性的单个多元醇头基,连接一个亲脂性的部分O-乙酰化的3, 5-二羟基癸酸三联体或四联体组成。作为一类新型的胞外真菌糖脂,liamocins与其他胞外真菌糖脂如槐糖脂(SL)、甘露糖赤藓糖醇脂(MEL)和纤维二糖脂(CL)不同,liamocins结构中没有糖基团,它的极性基团是多元醇;并且短梗霉真菌能以葡萄糖等廉价碳源为原料合成liamocins,其他糖脂如槐糖脂则必须添加疏水碳源如植物油才可以大量合成[11, 15]。Liamocins可以特异性地抑制动物和人类的病原菌链球菌,具有抗癌活性和表面活性剂活性,在食品、制药和化妆品工业具有良好的应用前景[11, 16]。本文对短梗霉真菌合成liamocins的研究展开综述。
1 Liamocins的发现和提取方法 1.1 Liamocins的发现 Nagata等[17]发现多株短梗霉真菌(Aureobasidium spp.)发酵葡萄糖不仅能产生聚苹果酸(PMA),而且还可以产生细胞外脂类;并且发现若发酵液中不添加CaCO3,菌株则以产生细胞外脂类为主,这些脂类比水重,所以被称为重油。Kurosawa等[18]分析了重油的化学结构,认为其亲水部分主要是阿拉伯糖醇或甘露糖醇,亲脂性物质为5-羟基脂肪酸,主要为3, 5-二羟基癸酸和5-羟基-2-癸烯酸。Price等[19]利用基质辅助激光解吸/电离飞行时间质谱(MALDI-TOF MS)、质谱(GC/MS)和核磁共振(NMR)等方法解析了重油的结构并命名为liamocins。Liamocins是一种多元醇酯类物质,主要由单个甘露醇头基连接了一个部分O-乙酰化的3, 5-二羟基癸酸三联体(liamocin A1、A2)或四联体(liamocin B1、B2)。Liamocin A1、B1不乙酰化,而liamocin A2、B2包含单个的3′O-乙酰化(图 1)。Liamocins的头基部分因菌株和培养基[20-23]的不同而发生变化,如出芽短梗霉菌株RSU 6 (NRRL 50383)生长在PM培养基中合成甘露醇头基的liamocins,而同一个菌株生长在含有高浓度海盐培养基上则产生甘露醇、阿拉伯糖醇和甘油头基的多种liamocins[20-21]。
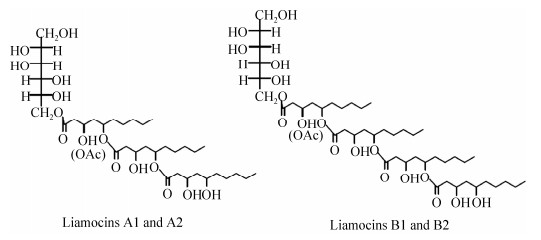 |
| 图 1 出芽短梗霉产生的4种甘露醇头基liamocins A1、A2、B1和B2的结构[19] Figure 1 Structures for mannitol liamocins A1, A2, B1 and B2 produced by Aureobasidium pullulans[19]. |
| 图选项 |
1.2 Liamocins的提取方法 Liamocins常用的一种提取方法是发酵液整体提取,发酵液和提取试剂的比例为1:1到1:2,然后用分液漏斗分离有机相、水相和细胞层。有机相提取溶剂蒸发后获得liamocins[13, 22]。发酵液整体提取的方法简单有效并且获得的liamocins产量最高,但缺点是需要较多的提取试剂,并且提取试剂的挥发也需要较多的时间。另一种获得liamocins的方法是发酵液首先经过离心弃去上清液,将获得细胞和胞外的liamocins一起用提取试剂提取,混合物剧烈混匀后在室温下过夜静置分层,有机相提取试剂蒸发后获得liamocins[13, 24]。
最常用的liamocins提取试剂是2-丁酮(methyl ethyl ketone)[13, 21]。其他试剂尤其是乙酸乙酯(ethyl acetate)也用来提取liamocins[25]。Saur等[26]为了在提取liamocins的同时保持细胞的完整性以获取准确的细胞干重(CDW),他们尝试利用50%乙醇(V/V)和50% NaCl (0.9% W/V)的溶液提取liamocins,发现这种方法在保持细胞的完整性以及liamocins的高效提取方面表现出了最佳性能。
2 liamocins的应用 2.1 Liamocins的表面活性剂活性 Liamocins具有表面活性剂活性。目前使用的合成表面活性剂大都是来源于石油,并且生产过程中会有有毒的副产品被合成[27]。因此表面活性剂工业一直在寻找绿色可持续生产表面活性剂的方法,利用生物表面活性剂替代石油基表面活性剂是一个有希望的方法。Manitchotpisit等[13]发现出芽短梗霉菌株CU43合成的liamocins虽然仅仅部分溶解于水,其饱和水溶液的表面张力为27 mN/m,而水的表面张力为67 mN/m,表明liamocins具有生物表面活性剂的功能,可以被用作增溶剂或乳化剂。Kim等[28-29]和Meneses等[30]也证实liamocins具有生物表面活性剂的作用,具有替代石油基表面活性剂的可能。
2.2 Liamocins的抗癌活性 研究表明liamocins对特定的癌细胞系具有抗增殖效果[13, 31-33]。Isoda等[32]发现liamocins能够抑制人早幼粒细胞白血病细胞HL60细胞生长,诱导其分化成粒细胞。Liamocins抑制人肺癌细胞A549的生长,显著降低细胞内依赖磷脂和Ca2+的蛋白激酶C的活性;并且liamocins对人正常二倍体细胞T1G1没有毒性[33]。
Manitchotpisit等[13]发现来源于菌株NRRL Y-12974的liamocins对非洲绿猴非癌性的肾脏细胞具有细胞毒性,但菌株CU 43合成的liamocins没有细胞毒性。两个菌株产生的liamocins对肺小细胞癌的抑制作用所需的剂量相似,但菌株NRRL Y-12974合成的liamocins对口腔癌细胞的抑制作用所需的剂量仅是菌株CU 43的一半。证明不同菌株合成的liamocins对特定的哺乳动物细胞的作用不同。MALDI-TOF-MS分析2个菌株产生的liamocins表明2个菌株liamocins的主要成分都是A2 (m/z 805.5)和B1 (m/z 949.6),因此不同菌株liamocins细胞毒性的不同与liamocins的主要成分没有直接关系。
同一个研究组在2014年发表的研究结果中进一步证实了不同的出芽短梗霉菌株合成的liamocins具有不同的抗癌活性,不同的是所有测试菌株的liamocins对非癌性非洲绿色猴的肾细胞都没有抑制作用,即没有细胞毒性[31]。Liamocins具有新颖的化学结构,可能拥有特殊的抗癌机制,作为有潜力的抗癌药物具有进一步深入研究的价值[31]。
2.3 Liamocins的抗菌活性 Liamocins的另一个特性是具有抗菌活性。广谱抗菌素的过度使用导致耐药性病原菌持续产生,因此迫切需要新型抗生素特别是对特定病原菌具有抗性的抗生素。liamocins对粪肠球菌(Enterococcus faecalis)、金黃葡萄球菌(Staphylococcus aureus)、发酵乳杆菌(Lactobacillus fermentum)、大肠杆菌(Escherichia coli)和铜绿假单胞菌(Pseudomonas aeruginosa)仅有微弱或没有拮抗活性[20, 31, 34]。但liamocins可以抑制所有测试过的链球菌如无乳链球菌(Streptococcus agalactiae)、乳房链球菌(S. uberis)、变形链球菌(S. mutans)、轻型链球菌(S. mitis)、婴儿链球菌(S. infantarius)、唾液链球菌(S. salivarius)[20, 34]以及猪链球菌(S. suis)[35]。这些链球菌包括动物和人类病原菌[36]。无乳链球菌、乳房链球菌是两种常见的引起奶牛乳腺炎的细菌[37-38]。变形链球菌与龋齿有关[39]。猪链球菌是一种新出现的人畜共患病原体引起猪败血症、肺炎和心内膜炎等疾病[40]。在人类临床医学中,由链球菌可引起多种疾病,包括咽炎、脓疱病、败血症、中毒性休克和坏死性筋膜炎[36]。
链球菌感染通常使用多种抗生素进行治疗,包括红霉素、克林霉素、头孢菌素、万古霉素以及青霉素。链球菌耐药性在临床分离株中屡见不鲜。如美国疾病预防与控制中心公布的引起坏死性筋膜炎的A群链球菌具有威胁等级的红霉素抗性[41]。高达85%的猪链球菌具有抗生素抗性[42]。Liamocins与其他广谱抗菌素相比具有结构上的独特性,与临床使用的重要抗生素产生交叉抗药性的可能性不大;并且使用liamocins拮抗病原菌能够避免干扰有益的正常菌群,和广谱抗生素相比,liamocins在链球菌引起的疾病的预防性应用方面具有无可比拟的优势。
Liamocins的抗菌活性具有热稳定性,经过高温甚至灭菌处理仍保持抗菌活性[20]。荧光分析表明浓度低至250 μg/mL liamocins作用下无乳链球菌质膜完整性迅速降低[34]。Liamocins还可以抑制链球菌形成生物膜。龋齿的形成与口腔中的细菌,特别是变形链球菌和远缘链球菌形成生物膜密切相关。Liamocins有希望发展成为不干扰口腔中正常菌群而降低牙菌斑生物膜和龋齿形成的药物[43]。
3 产liamocins的短梗霉真菌 作为一种普遍存在的腐生菌,短梗霉真菌通常存在于植物的叶际、淡水和海水中,甚至在城市环境条件下的水泥表面[28, 44]。短梗霉能适应极端环境如盐沼和北极的土壤,有极高的耐盐和温度胁迫能力[1, 45],短梗霉也能忍受酸性、碱性和寡营养的条件[21]。但大多数产liamocins的菌株来源于热带和亚热带地区[44]。Manitchotpisit等[44]选取多个基因对53株出芽短梗霉进行分子系统发育分析,将这些菌株分为12个类群。可以产生liamocins的21个菌株分布在7个类群中,而具有明亮黄色、高荧光的liamocins仅仅在热带来源的特定菌株的发酵液中产生,大部分集中在8、9和11三个类群[13]。其中类群8是出芽短梗霉的“彩色变种”(color variants),不仅是分泌liamocins的关键菌株,也可以高产木聚糖酶,目前仅在热带和亚热带分离到[13],类群8的出芽短梗霉次生代谢产物具有重要的生物活性,值得深入研究。Manitchotpisit等[24]分离了36株出芽短梗霉,其中8株分离自冰岛,其余的来自泰国各地。加上以前报道的20株,对56株出芽短梗霉利用ITS和BT2 (β-微管蛋白)基因进行分子系统发育分析,在原来12个类群的基础上,增加到了14个类群。来自冰岛等冷凉气候的出芽短梗霉都分布在新的13类群,来自泰国的菌株分布在其他8个类群,包括新认定的14类群。13类群的出芽短梗霉是较好的聚苹果酸生产者,但liamocins产量较低,印证了分泌liamocins的出芽短梗霉大多是热带来源的观点。Manitchotpisit等[31]从泰国新分离了9株出芽短梗霉,通过分子系统发育分析证实它们分别属于8、9和11类群。9个菌株liamocins和普鲁兰多糖的产量分析表明,尽管大多数8和9类群的菌株可以分泌liamocins,但类群11 liamocins的产量显著的高,达到7.0–8.6 g/L,是他们发现的liamocins产量最高的菌株。并且有意思的是,类群11还可以产生较高产量的普鲁兰,由于普鲁兰多糖是水溶性的多糖类物质,可以和liamocins在最初的提取过程中分离,所以类群11可以用来同时生产liamocins和普鲁兰多糖。
Liu等[46]采集中国海南省红树林植物样品,筛选了200多个酵母样菌株,研究发现菌株23-2、6-1-2、6-1-1、P5、31、9-1和14-2能够产生较多的liamocins,其中P5菌株经鉴定为产黑色素短梗霉(A. melanogenum),可以分泌22.5 g/L的liamocins到发酵液中,这是产黑色素短梗霉可以合成liamocins的首次报道。菌株9-1也属于产黑色素短梗霉,在葡萄糖为碳源时可以产生28.5 g/L liamocins,而以菊粉为碳源时liamocins的产量增加,说明菌株9-1具有代谢廉价碳源菊粉合成liamocins的能力[47]。
来自温带地区的出芽短梗霉也有菌株可以产生liamocins,尽管产量非常低。如Kim等[28]从韩国虎皮百合中分离获得1株产liamocins的出芽短梗霉L3-GPY菌株;Manitchotpisit等[24]也从冰岛获得产liamocins出芽短梗霉,它们的共同点是liamocins产量比较低。
我们从攀枝花芒果中分离获得了3株产黑色素短梗霉(A. melanogenum):A. melanogenum C1、A. melanogenum 142、A. melanogenum 171。初步研究表明,3个菌株都可以分泌较高产量明亮黄色的liamocins,其中C1 liamocins的产量达到11 g/L。
4 影响liamocins合成的因素 4.1 不同培养基对liamocins合成的影响 适合的培养基和培养条件是促进短梗霉合成liamocins的关键。Leathers等[21]比较了文献中常用的4种短梗霉真菌合成liamocins的培养基:A[13]、B[18]、C[48]、D[49](表 1)。这4种培养基都是限氮培养基,短梗霉真菌具有把过多的碳转化成有用的次生代谢产物如普鲁兰多糖、聚苹果酸和liamocins等的潜能。他们发现不同的培养基和菌株影响短梗霉真菌的生长和liamocins的产量。尽管大多数短梗霉真菌在4种培养基中都能生长良好,但Manitchotpisit等[13]改良的用于高产普鲁兰多糖的培养基A更有利于短梗霉真菌的生长。有意思的是分离自陆生植物的菌株NRRL 50381在含有人工海水的培养基C中生长最好,而分离自海洋动物海绵的菌株NRBC 10874在培养基C中生长却不好。Liamocins的产量在0.5–8.0 g/L,不同菌株liamocins产量都是在培养基A中最高,其中菌株NRRL 50384在培养基A中合成的liamocins最高达到8 g/L。
表 1. 4种常用的产liamocins培养基[21] Table 1. Four different culture media used for liamocins production[21]
| Components/(%, W/V) | Medium A | Medium B | Medium C | Medium D |
| Sucrose | 5.000 | |||
| Glucose | 12.000 | 1.000 | 8.000 | |
| Peptone | 0.060 | |||
| Yeast extract | 0.040 | 0.020 | 0.020 | |
| L-asparagine·H2O | 0.050 | |||
| NaNO3 | 0.150 | |||
| KNO3 | 0.100 | |||
| (NH4)2SO4 | 0.020 | |||
| Sea salts | 4.000 | |||
| NaCl | 0.100 | |||
| CaCl2 | 0.015 | |||
| K2HPO4 | 0.500 | 0.005 | 0.050 | 0.700 |
| Na2PO4 | 0.250 | |||
| MgSO4·7H2O | 0.040 | 0.020 | 0.150 | |
| FeCl3·7H2O | 0.015 | |||
| MnSO4·H2O | 0.002 | |||
| ZnSO4·7H2O | 0.002 | |||
| pH | 6.500 | 5.500 | 7.000 | 6.000 |
表选项
不同的培养基和菌株选择也影响到liamocins的质量。短梗霉真菌合成的liamocins常被伴随产生的黑色素所污染,需要花费代价将黑色素除去。研究发现菌株NRRL 50382和NRRL 50384黑色素的分泌在不同的培养基中差异明显,在特定的培养基中黑色素甚至不分泌。用酶处理过的小麦秸秆进行发酵合成的liamocins不产生黑色素,并且liamocins的产量与以蔗糖为碳源的培养基相当[21, 50]。所以合适的培养基是合成高质量的liamocins的必要条件。
不同的培养基和菌株还可以影响短梗霉真菌产生liamocins的类型,但是培养基组成与合成的liamocins类型之间的关系还不明确[21]。如菌株NRRL 50380在培养基A、B和D中培养时合成4种类型的liamocins:liamocin A1、A2、B1、B2,但在不同培养基中不同类型的liamocin相对比例有一定的变化。而在C培养基中则额外产生4种类型的liamocins,这些liamocins结构中多元醇头基部分由阿拉伯糖醇取代了甘露醇。培养液C与其他3种培养液最明显的区别是其含有高浓度的盐。当培养液A中NaCl的浓度增加到4%,则培养液A和C中合成的liamocins没有明显区别[21]。与蔗糖为碳源的培养基不同,出芽短梗霉发酵预先处理的小麦秸秆合成的liamocins一般不乙酰化,即产生的liamocins类型主要是A1、B1[50],这个发现具有重要意义,因为Bischoff等[34]认为不乙酰化的liamocins尤其是B1比乙酰化的B2具有更好的抗菌活性。
4.2 C/N比对liamocins合成的影响 一般认为liamocins的合成与短梗霉真菌合成聚苹果酸和普鲁兰多糖等次级代谢产物相似,高的初始C/N比有利于liamocins的合成。如Manitchotpisit等[13]发现培养4 d后出芽短梗霉细胞生长停滞,6 d后liamocins的产量最大,在细胞生长由于氮源的消耗而停止后,liamocins才能作为次生代谢产物大量合成。
但是Brumano等[51]和Leathers等[21]的实验发现限氮培养基对于liamocins的产生没有促进效果。相反限氮培养基抑制了细胞生长,也阻止了liamocins的合成,反而促进了普鲁兰多糖的产生。Leathers等[52]增加培养液中氮和硫酸镁的浓度,则细胞生长被促进,liamocins的合成是限氮培养基的2倍。同样,Saur等[26]利用发酵罐培养出芽短梗霉,他们也发现氮源的供给加倍可以提高细胞生长,同时促进liamocins的合成:细胞生长大约增长了50%,而liamocins的产量增加了80%。
4.3 pH对liamocin合成的影响 Kurosawa等[18]发现发酵液中添加CaCO3不利于liamocins的合成,而不添加CaCO3发酵液pH随发酵的进程不断降低,出芽短梗霉则以合成liamocins为主;Manitchotpisit等[24]也有相似的研究结果,他们发现培养液添加3% (W/V)的CaCO3聚苹果酸的产量可以增加25%–80%,而普鲁兰多糖和liamocins的合成降低;我们的研究结果显示,产黑色素短梗霉C1培养液中添加CaCO3,其合成的liamocins降低了70%。但尚不清楚CaCO3除了稳定了培养液pH,是不是还参与了聚苹果酸/liamocins的合成代谢。Lee等[53]在多头绒泡菌中利用不同标记碳原子的13C-NMR实验追踪13C的去向,发现碳酸钙在PMLA合成过程中提供碳酸根离子。
Saur等[26]详细研究了出芽短梗霉在摇瓶培养过程中由于酸性物质的产生,发酵液pH在大约12 h开始快速下降,24 h后pH下降到4;然后持续缓慢下降119 h后pH下降到3.3。Liamocins在pH下降后开始合成,产量稳定增加,119 h后达到12 g/L,然后liamocins合成停止黑色素开始合成。他们同时使用发酵罐人工调控发酵液pH考察其对liamocins合成的影响[26]。利用4 mol/L HCl和4 mol/L NaOH控制发酵液pH,若发酵液pH维持在6.5,则一直到140 h无明显的liamocins合成。人工调节pH到5,liamocins的合成被诱导。20 h后再将pH调到3.5,则进一步促进了liamocins的合成。证实了发酵液中添加NaOH调控pH起到了添加CaCO3相似的调控作用;证实了出芽短梗霉合成liamocins分为2个阶段:高pH的细胞生长阶段和pH降低后liamocins的合成阶段。
4.4 碳源对liamocins合成的影响 碳源是liamocins发酵培养基中的关键组分之一,极大地影响liamocins的产量。Liu等[46]发现分离自海南红树林的产黑色素短梗霉P5,120 g/L的葡萄糖加上0.1%的玉米浆是适合liamocins合成的碳源。而同样分离自海南红树林的产黑色素短梗霉9-1,以菊粉为碳源时liamocins的产量最高[47]。周丹凤[54]选择产liamocins较高的菌株ZUST-GS对其发酵培养基进行优化,发现木糖为最佳碳源。Price等[22]研究了多元醇和不同糖作为碳源发酵出芽短梗霉菌株NRRL50380,他们发现蔗糖作为碳源时liamocins的产量最高。Brumano等[51]首次利用搅拌式生物反应器对出芽短梗霉liamocins的生产进行优化,他们发现蔗糖浓度和通气量对liamocins的产生起到关键作用,80 g/L的蔗糖和1.1 vvm的通气量条件下发酵96 h后liamocins的产量达到最大值1.5 g/L。
碳源还可以影响liamocins的结构。Price等[22]研究发现,出芽短梗霉菌株NRRL50380生长在不同的多元醇培养基中,合成的liamocins的头基结构也发生相应的改变,包括合成具有D-半乳糖醇、D-山梨糖醇、D和L-阿拉伯糖醇、D-木糖醇、L-苏糖醇和甘油头基的liamocins。而生长在蔗糖或阿拉伯糖醇发酵培养基上的菌株只合成头基是D-甘露醇或D-阿拉伯糖醇的liamocins。
5 提高liamocins产量的短梗霉真菌的遗传改良 Liamocins良好的生物活性使其具有广阔的应用前景。但是发酵生产liamocins的原料成本高、产量低限制了其商业应用。研究者通过基因工程方法对短梗霉野生型菌株进行了遗传改造以提高liamocins的合成。Guo等[55-56]发现出芽短梗霉拥有高效的同源重组修复机制,基因过表达重组菌株的构建基于这种机制在设计引物时于引物末端加入同源序列,然后将待整合片段经电转导入细胞内,即可在细胞内完成片段连接并整合到设计好的位点。Guo等[57]利用基因同源重组的方法,通过基因过表达或敲除研究编码载脂蛋白(apo)、尿苷二磷酸葡萄糖焦磷酸化酶(UGP)、葡萄糖基转移酶(UGT)和α-磷酸葡萄糖变位酶(PGM)的基因对合成普鲁兰多糖、重油(liamocins)和黑色素的影响。他们发现UGP基因过表达不仅可以促进普鲁兰多糖的合成,而且使重油产量提高146.3%;但是黑色素的合成则相应减少。载脂蛋白apo基因过表达也表现出类似的性质。这些结果说明普鲁兰多糖、重油和黑色素合成途径存在相互影响,即普鲁兰多糖和重油大量合成时,则另一代谢途径被抑制。同样的方法,郭建等[55]在考察载脂蛋白基因apo和gltP对普鲁兰多糖和脂类物质合成的影响时,发现基因apo或gltP的过表达后糖产量分别增加7.78%和15.23%,重油合成分别增加了41.38%和3.5倍。而敲除基因apo或gltP则多糖产量和重油的合成降低。表明apo和gltP基因都能影响普鲁兰多糖和重油的合成,而gltP基因的影响更为关键。
丙酮酸羧化酶(Pyc)通过固定CO2催化丙酮酸转化成草酰乙酸,是胞浆还原性TCA途径中的关键酶。出芽短梗霉P6菌株高产聚苹果酸[58],具有高的Pyc酶活性[59]。Tang等[16]利用P6菌株中获得的Pyc1基因,转化海洋来源产liamocins的产黑色素短梗霉9-1菌株,获得了liamocins产量提高22.4%的Pyc1过表达的转化菌株。郑鹏等[60]在出芽短梗霉P30中过表达Pyc1,得到了类似的结果,liamocins产量提高了17.12%。而过表达其他乙酰-CoA合成相关基因,包括乙酰-CoA合酶编码基因(ACS1)、ATP-依赖性柠檬酸裂解酶编码基因(ACL)和苹果酸酶编码基因(ME),重组菌株liamocins产量都有不同程度的提高,其中过表达ACL liamocins的产量增加了93.74%最为显著,说明ACL为出芽短梗霉P30合成liamocins的关键基因。
Xin等[47]发现分离自红树林的产黑色素短梗霉9-1重油(liamocins)的合成能力较强,并且以菊粉为碳源时菌株9-1重油的产量增加。他们利用来自克鲁维酵母的菊粉外切酶基因转化菌株9-1,获得的重组菌株88不仅菊粉酶活性大幅增加,而且提高了重油的产量。
6 Liamocins的核心生物合成途径、调控、运输和分泌 虽然对短梗霉的多种遗传改良以提高liamocins的产量的研究已经取得了一定的成果,证明了liamocins合成的部分相关基因、关键酶,但我们对于liamocins生物合成途径及代谢的全局性调控仍然知之甚少。解析liamocins的生物合成途径和调控机制以及其运输和分泌机制,是指导高效发酵生产和利用基因工程方法构建高产菌株的关键。Xue等[61]研究分析了真菌与脂类核心生物合成途径、调控、运输和分泌相关的关键酶及其基因。真菌聚酮合成酶(PKSs)由一组酮合成酶(KS)、酰基转移酶(AT)、酰基载体蛋白(ACP)、酮还原酶(KR)、脱水酶(DH)和烯醇还原酶(ER)组成[62]。已经发现一种聚酮合酶(MAS)可以催化分枝杆菌中甲基支链脂肪酸的生物合成[63]。有充分的文献证明,通过磷酸乙烯转移酶(PPTase)的转录后磷酸乙烯基化是PKSs发挥最大酶活性所必需的[64-65]。真菌中的甘露醇代谢是通过甘露醇循环进行的,甘露醇-1-磷酸5-脱氢酶(MPDH)和甘露醇脱氢酶(MtDH)是真菌中甘露醇生物合成的关键酶[66]。此外,酵母中D-阿拉伯糖醇生物合成的关键酶是阿拉伯糖醇脱氢酶(ArDH)[67]。liamocins是一种糖脂,糖脂转移蛋白将糖脂从一个双层膜转移到另一个双层膜[56]。短梗霉中GLTP基因编码的糖脂转移蛋白(Gltp)可能参与了liamocins的转运。此外,在Starmerella bombicola中发现MDR1基因编码的ABC转运蛋白(Mdr1)参与槐脂(也是一种糖脂)的分泌[15]。
基于这些研究结果,Xue等[61]利用裂殖壶菌ATCC 20888的PKS基因(AF378327)、黑曲霉MPDH基因(AAL89587.1)、链格孢菌MtDH基因(AAN28666.1)、黑曲霉ArDH基因(RDH24071.1)、产黑色素短梗霉P5的PPTase基因(KY174985.1)、产黑色素短梗霉CBS 110374的GLTP1基因(KEQ58979.1)和S. bombicola的MDR1基因(HQ6605810)搜索产黑色素短梗霉6-1-2基因组序列,获得了产黑色素短梗霉6-1-2中与liamocins生物合成、调控、运输和分泌相关的基因:PKS1基因、MPDH基因、MtDH基因、ArDH基因、PPTase基因、GLTP1基因和MDR1基因,并且发现EST1基因(编码酯酶)和GAL1基因(编码DNA/RNA结合锌指蛋白,转录激活因子)与PKS1基因位于同一个基因簇中。
这些基因是否真正参与了liamocins的生物合成、调控、运输和分泌?他们利用基因突变和回复突变的方法,证明PKS基因、MPDH基因、MtDH基因、ArDH基因和EST1基因与liamocins核心生物合成密切相关。尤其是PKS基因的缺失、EST1基因的缺失以及MPDH、MtDH、ArDH基因的缺失都能完全阻止liamocins的合成。PPTase基因和GAL1基因缺失突变都不能合成liamocins;而PPTase基因和GAL1基因的回复突变体则完全恢复liamocins的生物合成和分泌。表明HR-PKS的活性受到PPTase的严格控制,PKS1基因的表达受到Ga11的激活,去除GAL1基因也几乎阻断了PKS1基因的表达。失活GLTP基因和MDR1基因liamocins运输和分泌被部分阻断,并且失活GLTP基因比失活MDR1基因能更有效地阻止liamocins的转运和分泌,这表明其他系统可能参与了黑曲霉6-1-2中liamocins的运输和分泌,或者其中一些liamocins可能被动地从酵母样真菌细胞扩散到培养基中。
根据这些研究结果,Xue等[61]推测了liamocins的核心生物合成、调控、运输和分泌途径(图 2)。他们认为HR-PKS负责合成3, 5-二羟基癸酸,对liamocin的产生至关重要。首先,在乙酰辅酶A和丙二酰辅酶A存在下,HR-PKS的所有KS、AT、DH、ER、KR和ACP结构域可能被利用2次以形成己基-S-ACP。然后,结构域ACP、KS、AT和KR被利用两次来合成3, 5-二羟基癸酰基-S-ACP。MPDH和MtDH与甘露醇生物合成有关,ArDH与阿拉伯糖醇生物合成有关。Est1催化3, 5-二羟癸酸与甘露醇或阿拉伯糖醇酯键的形成(liamocins)。PPTase激活了HR-PKS,转录激活因子Ga11促进了PKS1基因和其他基因的表达。糖脂转运蛋白Gltp和ABC转运蛋白Mdr1分别参与产生的liamocins从高尔基体向质膜的转运以及分泌到培养基中。
 |
| 图 2 产黑色素短梗霉6-1-2 liamocins核心生物合成途径、调控、转运和分泌[61] Figure 2 The core synthetic pathway, regulation, transport and secretion of liamocins in A. melanogenum 6-1-2[61]. OAA: oxaloacetate; AKG: α-ketoglutaric acid; PYC: pyruvate carboxylase. |
| 图选项 |
此外,基因突变和回复突变的实验结果表明一个基因的表达或缺失可以使工程菌株上调或下调与liamocins生物合成、调控、运输和分泌相关的其他基因的表达。这表明在短梗霉真菌细胞中存在协调调节机制,尽管具体机制仍不清楚[61]。
7 结语 目前短梗霉真菌合成liamocins的研究主要集中在菌株的分离筛选和liamocins的结构鉴定以及表面活性、抗菌抗癌活性的研究方面,而对发酵培养基和培养条件的优化以及高产菌株的遗传改造研究较少,因此和其他糖脂相比liamocins的产量较低。今后的研究应重点在以下几个方面作深入的研究:优化产liamocins短梗霉真菌的培
养基和培养条件,获得高产liamocins的培养方法;全面阐明liamocins的生物合成途径、调控、转运和分泌机理,获得liamocins合成和调控相关的关键基因,为基因工程技术改造短梗霉的代谢途径提供靶标基因,以获得liamocins高产工程菌株,才有望取得liamocins产量的突破性的进展。
References
| [1] | Zalar P, Gostin?ar C, de Hoog GS, Ur?i? V, Sudhadham M, Gunde-Cimerman N. Redefinition of Aureobasidium pullulans and its varieties. Studies in Mycology, 2008(61): 21-38. |
| [2] | Gostin?ar C, Ohm RA, Kogej T, Sonjak S, Turk M, Zajc J, Zalar P, Grube M, Sun H, Han J, Sharma A, Chiniquy J, Ngan CY, Lipzen A, Barry K, Grigoriev IV, Gunde-Cimerman N. Genome sequencing of four Aureobasidium pullulans varieties: biotechnological potential, stress tolerance, and description of new species. BMC Genomics, 2014(15): 549. |
| [3] | Ronen M, Guterman H, Shabtai Y. Monitoring and control of pullulan production using vision sensor. Journal of Biochemical and Biophysical Methods, 2002, 51(3): 243-249. DOI:10.1016/S0165-022X(01)00182-8 |
| [4] | Schoch CL, Shoemaker RA, Seifert KA, Hambleton S, Spatafora JW, Crous PW. A multigene phylogeny of the dothideomycetes using four nuclear loci. Mycologia, 2006, 98(6): 1041-1052. DOI:10.1080/15572536.2006.11832632 |
| [5] | Shabtai Y, Mukmenev I. Enhanced production of pigment-free pullulan by a morphogenetically arrested Aureobasidium pullulans (ATCC 42023) in a two-stage fermentation with shift from soy bean oil to sucrose. Applied Microbiology and Biotechnology, 1995, 43(4): 595-603. DOI:10.1007/BF00164760 |
| [6] | Johnson KB, Temple TN. Evaluation of strategies for fire blight control in organic pome fruit without antibiotics. Plant Disease, 2013, 97(3): 402-409. DOI:10.1094/PDIS-07-12-0638-RE |
| [7] | de Spadaro D, Droby S. Development of biocontrol products for postharvest diseases of fruit: the importance of elucidating the mechanisms of action of yeast antagonists. Trends in Food Science & Technology, 2016(47): 39-49. |
| [8] | Aung T, Jiang H, Chen CC, Liu GL, Hu Z, Chi ZM, Chi Z. Production, gene cloning, and overexpression of a laccase in the marine-derived yeast Aureobasidium melanogenum strain 11-1 and characterization of the recombinant laccase. Marine Biotechnology, 2019, 21(1): 76-87. DOI:10.1007/s10126-018-9860-2 |
| [9] | Chen CC, Chi Z, Liu GL, Jiang H, Hu Z, Chi ZM. Production, purification, characterization and gene cloning of an esterase produced by Aureobasidium melanogenum HN6.2. Process Biochemistry, 2017(53): 69-79. |
| [10] | Chi ZM, Wang F, Chi Z, Yue LX, Liu GL, Zhang T. Bioproducts from Aureobasidium pullulans, a biotechnologically important yeast. Applied Microbiology and Biotechnology, 2009, 82(5): 793-804. DOI:10.1007/s00253-009-1882-2 |
| [11] | Garay LA, Sitepu IR, Cajka T, Xu J, Teh HE, German JB, Pan ZL, Dungan SR, Block DE, Boundy-Mills KL. Extracellular fungal polyol lipids: a new class of potential high value lipids. Biotechnology Advances, 2018, 36(2): 397-414. DOI:10.1016/j.biotechadv.2018.01.003 |
| [12] | Machaku D, Zhou DF, Lin L, Si ZJ, Liu SW, Wei PL. Fermentative production of liamocin by Aureobasidium pullulans. Journal of Zhejiang University of Science and Technology, 2017, 29(6): 414-418. (in Chinese) Machaku D, 周丹凤, 林琳, 司振军, 刘士旺, 魏培莲. 出芽短梗霉发酵产liamocin的培养条件研究. 浙江科技学院学报, 2017, 29(6): 414-418. DOI:10.3969/j.issn.1671-8798.2017.06.003 |
| [13] | Manitchotpisit P, Price NPJ, Leathers TD, Punnapayak H. Heavy oils produced by Aureobasidium pullulans. Biotechnology Letters, 2011, 33(6): 1151-1157. DOI:10.1007/s10529-011-0548-1 |
| [14] | Manitchotpisit P, Skory CD, Leathers TD, Lotrakul P, Eveleigh DE, Prasongsuk S, Punnapayak H. Α-amylase activity during pullulan production and α-amylase gene analyses of Aureobasidium pullulans. Journal of Industrial Microbiology & Biotechnology, 2011, 38(9): 1211-1218. |
| [15] | van Bogaert INA, Holvoet K, Roelants SLKW, Li B, Lin YC, van de Peer Y, Soetaert W. The biosynthetic gene cluster for sophorolipids: a biotechnological interesting biosurfactant produced by Starmerella bombicola. Molecular Microbiology, 2013, 88(3): 501-509. DOI:10.1111/mmi.12200 |
| [16] | Tang RR, Chi Z, Jiang H, Liu GL, Xue SJ, Hu Z, Chi ZM. Overexpression of a pyruvate carboxylase gene enhances extracellular liamocin and intracellular lipid biosynthesis by Aureobasidium melanogenum M39. Process Biochemistry, 2018(69): 64-74. |
| [17] | Nagata N, Nakahara T, Tabuchi T. Fermentative production of poly(β-L-malic acid), a polyelectrolytic biopolyester, by Aureobasidium sp.. Bioscience, Biotechnology, and Biochemistry, 1993, 57(4): 638-642. DOI:10.1271/bbb.57.638 |
| [18] | Kurosawa T, Sakai K, Nakahara T, Oshima Y, Tabuch T. Extracellular accumulation of the polyol lipids, 3, 5-dihydroxydecanoyl and 5-hydroxy-2-decenoyl esters of arabitol and mannitol by Aureobasidium sp.. Bioscience, Biotechnology, and Biochemistry, 1994, 58(11): 2057-2060. DOI:10.1271/bbb.58.2057 |
| [19] | Price NPJ, Manitchotpisit P, Vermillion KE, Bowman MJ, Leathers TD. Structural characterization of novel extracellular liamocins (mannitol oils) produced by Aureobasidium pullulans strain NRRL 50380. Carbohydrate Research, 2013(370): 24-32. |
| [20] | Bischoff KM, Leathers TD, Price NP, Manitchotpisit P. Novel oils having antibacterial activity. US: International Patent Publication Number WO 2015/142736 A1. 2015. |
| [21] | Leathers TD, Price NPJ, Bischoff KM, Manitchotpisit P, Skory CD. Production of novel types of antibacterial liamocins by diverse strains of Aureobasidium pullulans grown on different culture media. Biotechnology Letters, 2015, 37(10): 2075-2081. DOI:10.1007/s10529-015-1892-3 |
| [22] | Price NP, Bischoff KM, Leathers TD, Cossé AA, Manitchotpisit P. Polyols, not sugars, determine the structural diversity of anti-streptococcal liamocins produced by Aureobasidium pullulans strain NRRL 50380. The Journal of Antibiotics, 2017, 70(2): 136-141. DOI:10.1038/ja.2016.92 |
| [23] | Skory CD. Modification of the mannitol biosynthetic pathway in Aureobasidium pullulans to alter the structure of the polyol lipid liamocin. //2016 Society for Industrial Microbiology and Biotechnology Annual Meeting and Exhibition, P39. |
| [24] | Manitchotpisit P, Skory CD, Peterson SW, Price NPJ, Vermillion KE, Leathers TD. Poly(β-L-malic acid) production by diverse phylogenetic clades of Aureobasidium pullulans. Journal of Industrial Microbiology & Biotechnology, 2012, 39(1): 125-132. |
| [25] | Tabuchi T, Kayano M. New strain and glycolipid produced by the same strain. Japanese: Patent Publication Number JPH04148677(A). 1992. |
| [26] | Saur KM, Brumhard O, Scholz K, Hayen H, Tiso T. A pH shift induces high-titer liamocin production in Aureobasidium pullulans. Applied Microbiology and Biotechnology, 2019, 103(12): 4741-4752. DOI:10.1007/s00253-019-09677-3 |
| [27] | Banat IM, Makkar RS, Cameotra SS. Potential commercial applications of microbial surfactants. Applied Microbiology and Biotechnology, 2000, 53(5): 495-508. DOI:10.1007/s002530051648 |
| [28] | Kim JS, Lee IK, Yun BS. A novel biosurfactant produced by Aureobasidium pullulans L3-GPY from a tiger lily wild flower, Lilium lancifolium Thunb. PLoS ONE, 2015, 10(4): e0122917. DOI:10.1371/journal.pone.0122917 |
| [29] | Kim JS, Lee IK, Yun BS. Pullusurfactans A-E, new biosurfactants produced by Aureobasidium pullulans A11211-4-57 from a fleabane, Erigeron annus (L.) pers. The Journal of Antibiotics, 2018, 71(11): 920-926. DOI:10.1038/s41429-018-0089-0 |
| [30] | Meneses DP, Gudi?a EJ, Fernandes F, Gon?alves LRB, Rodrigues LR, Rodrigues S. The yeast-like fungus Aureobasidium thailandense LB01 produces a new biosurfactant using olive oil mill wastewater as an inducer. Microbiological Research, 2017(204): 40-47. |
| [31] | Manitchotpisit P, Watanapoksin R, Price NPJ, Bischoff KM, Tayeh M, Teeraworawit S, Kriwong S, Leathers TD. Aureobasidium pullulans as a source of liamocins (heavy oils) with anticancer activity. World Journal of Microbiology and Biotechnology, 2014, 30(8): 2199-2204. DOI:10.1007/s11274-014-1639-7 |
| [32] | Isoda H, Kitamoto D, Shinmoto H, Matsumura M, Nakahara T. Microbial extracellular glycolipid induction of differentiation and inhibition of the protein kinase C activity of human promyelocytic leukemia cell line HL60. Bioscience, Biotechnology, and Biochemistry, 1997, 61(4): 609-614. DOI:10.1271/bbb.61.609 |
| [33] | Isoda H, Nakahara T. Antiproliferative effect of polyol lipids, 3, 5-dihydroxydecanoyl and 5-hydroxy-2-decenoyl esters of arabitol and mannitol on lung cancer cell line A549. Journal of Fermentation and Bioengineering, 1997, 84(5): 403-406. DOI:10.1016/S0922-338X(97)81999-X |
| [34] | Bischoff KM, Leathers TD, Price NPJ, Manitchotpisit P. Liamocin oil from Aureobasidium pullulans has antibacterial activity with specificity for species of Streptococcus. The Journal of Antibiotics, 2015, 68(10): 642-645. DOI:10.1038/ja.2015.39 |
| [35] | Bischoff KM, Brockmeier SL, Skory CD, Leathers TD, Price NPJ, Manitchotpisit P, Rich JO. Susceptibility of Streptococcus suis to liamocins from Aureobasidium pullulans. Biocatalysis and Agricultural Biotechnology, 2018(15): 291-294. |
| [36] | Leathers TD, Rich JO, Bischoff KM, Skory CD, Nunnally MS. Inhibition of Streptococcus mutans and S. sobrinus biofilms by liamocins from Aureobasidium pullulans. Biotechnology Reports, 2019(21): e00300. |
| [37] | Keefe GP. Streptococcus agalactiae mastitis: a review. Canadian Veterinary Journal-revue Veterinaire Canadienne, 1997, 38(7): 429-437. |
| [38] | Leigh JA. Streptococcus uberis: a permanent barrier to the control of bovine mastitis?. The Veterinary Journal, 1999, 157(3): 225-238. DOI:10.1053/tvjl.1998.0298 |
| [39] | Hardie JM, Whiley RA. The Genus Streptococcus-Oral in the Prokaryotes: A Handbook on the Biology of Bacteria (eds Dworkin M & Falkow S) 76-107. New York, NY, USA: Springer, 2006. |
| [40] | Lun ZR, Wang QP, Chen XG, Li AX, Zhu XQ. Streptococcus suis: an emerging zoonotic pathogen. The Lancet Infectious Diseases, 2007, 7(3): 201-209. DOI:10.1016/S1473-3099(07)70001-4 |
| [41] | Centers for Disease Control and Prevention (U.S. ). Antibiotic resistance threats in the United States, 2019. Centers for Disease Control and Prevention (U.S. ), 2019. |
| [42] | Varela NP, Gadbois P, Thibault C, Gottschalk M, Dick P, Wilson J. Antimicrobial resistance and prudent drug use for Streptococcus suis. Animal Health Research Reviews, 2013, 14(1): 68-77. DOI:10.1017/S1466252313000029 |
| [43] | Leathers TD, Rich JO, Bischoff KM, Skory CD, Nunnally MS. Inhibition of Streptococcus mutans and S. sobrinus biofilms by liamocins from Aureobasidium pullulans. Biotechnology Reports, 2019(21): e00300. |
| [44] | Manitchotpisit P, Leathers TD, Peterson SW, Kurtzman CP, Li XL, Eveleigh DE, Lotrakul P, Prasongsuk S, Dunlap CA, Vermillion KE, Punnapayak H. Multilocus phylogenetic analyses, pullulan production and xylanase activity of tropical isolates of Aureobasidium pullulans. Mycological Research, 2009, 113(10): 1107-1120. DOI:10.1016/j.mycres.2009.07.008 |
| [45] | Oren A, Gunde-Cimerman N. Fungal life in the dead sea. Biology of marine fungi. Berlin, Heidelberg: Springer Berlin Heidelberg, 2011: 115-132. |
| [46] | Liu YY, Chi Z, Wang ZP, Liu GL, Chi ZM. Heavy oils, principally long-chain n-alkanes secreted by Aureobasidium pullulans var. melanogenum strain P5 isolated from mangrove system. Journal of Industrial Microbiology & Biotechnology, 2014, 41(9): 1329-1337. DOI:10.1007/s10295-014-1484-6 |
| [47] | Xin FH, Zhang Y, Xue SJ, Chi Z, Liu GL, Hu Z, Chi ZM. Heavy oils (mainly alkanes) over-production from inulin by Aureobasidium melanogenum 9-1 and its transformant 88 carrying an inulinase gene. Renewable Energy, 2017(105): 561-568. |
| [48] | Doshida J, Hasegawa H, Onuki H, Shimidzu N. Exophilin A, a new antibiotic from a marine microorganism Exophiala pisciphila. The Journal of Antibiotics, 1996, 49(11): 1105-1109. DOI:10.7164/antibiotics.49.1105 |
| [49] | Wang CL, Li Y, Xin FH, Liu YY, Chi ZM. Evaluation of single cell oil from Aureobasidium pullulans var. melanogenum P10 isolated from mangrove ecosystems for biodiesel production. Process Biochemistry, 2014, 49(5): 725-731. DOI:10.1016/j.procbio.2014.02.017 |
| [50] | Leathers TD, Price NPJ, Manitchotpisit P, Bischoff KM. Production of anti-streptococcal liamocins from agricultural biomass by Aureobasidium pullulans. World Journal of Microbiology and Biotechnology, 2016, 32(199). DOI:10.1007/s11274-016-2158-5 |
| [51] | Brumano LP, Antunes FAF, Souto SG, dos Santos JC, Venus J, Schneider R, da Silva SS. Biosurfactant production by Aureobasidium pullulans in stirred tank bioreactor: new approach to understand the influence of important variables in the process. Bioresource Technology, 2017(243): 264-272. |
| [52] | Leathers TD, Skory CD, Price NPJ, Nunnally MS. Medium optimization for production of anti-streptococcal liamocins by Aureobasidium pullulans. Biocatalysis and Agricultural Biotechnology, 2018(13): 53-57. |
| [53] | Lee BS, Maurer T, Kalbitzer HR, Holler E. β-Poly(l-malate) production by Physarum polycephalum. Applied Microbiology and Biotechnology, 1999, 52(3): 415-420. DOI:10.1007/s002530051540 |
| [54] | 周丹凤. 出芽短梗霉发酵产liamocin的研究. 浙江科技学院硕士学位论文, 2019. |
| [55] | Guo J, Huang SY, Zheng P, Chen YF, Guo XW, Xiao DG. Effect of apolipoprotein genes apo and gltP on pullulan synthesis. Journal of Tianjin University of Science & Technology, 2019, 34(2): 12-18. (in Chinese) 郭建, 黄思瑶, 郑鹏, 陈叶福, 郭学武, 肖冬光. 载脂蛋白基因apo和gltP对普鲁兰多糖合成的影响. 天津科技大学学报, 2019, 34(2): 12-18. |
| [56] | Guo J, Wang YH, Li BZ, Huang SY, Chen YF, Guo XW, Xiao DG. Development of a one-step gene knock-out and knock-in method for metabolic engineering of Aureobasidium pullulans. Journal of Biotechnology, 2017(251): 145-150. |
| [57] | Guo J, Huang SY, Chen YF, Guo XW, Xiao DG. Discovering the role of the apolipoprotein gene and the genes in the putative pullulan biosynthesis pathway on the synthesis of pullulan, heavy oil and melanin in Aureobasidium pullulans. World Journal of Microbiology and Biotechnology, 2017, 34(1): 1-8. |
| [58] | Ma Y, Wang GY, Liu GL, Wang ZP, Chi ZM. Overproduction of poly(β-malic acid) (PMA) from glucose by a novel Aureobasidium sp. P6 strain isolated from mangrove system. Applied Microbiology and Biotechnology, 2013, 97(20): 8931-8939. DOI:10.1007/s00253-013-5150-0 |
| [59] | Zou X, Tu GW, Zan ZQ. Cofactor and CO2 donor regulation involved in reductive routes for polymalic acid production by Aureobasidium pullulans CCTCC M2012223. Bioprocess and Biosystems Engineering, 2014, 37(10): 2131-2136. DOI:10.1007/s00449-014-1182-9 |
| [60] | Zheng P, Zhang MJ, Huang SY, Kang XY, Chen YF. Overexpression of acetyl-CoA synthase and relative enzymes enhanced liamocins synthesis in Aureobasidium pullulans. Food and Fermentation Industries, 2020, 46(9): 25-30. (in Chinese) 郑鹏, 张孟娟, 黄思瑶, 康新玥, 陈叶福. 过表达乙酰- CoA相关基因提高出芽短梗霉liamocins合成能力. 食品与发酵工业, 2020, 46(9): 25-30. |
| [61] | Xue SJ, Chi Z, Liu GL, Gao ZC, Hu Z, Chi ZM. Genetic evidences for the core biosynthesis pathway, regulation, transport and secretion of liamocins in yeast-like fungal cells. Biochemical Journal, 2020, 477(5): 887-903. |
| [62] | Schuemann J, Hertweck C. Biosynthesis of fungal polyketides. Berlin, Heidelberg: Springer Berlin Heidelberg, 2009: 331-351. |
| [63] | Jackson M, Stadthagen G, Gicquel B. Long-chain multiple methyl-branched fatty acid-containing lipids of Mycobacterium tuberculosis: biosynthesis, transport, regulation and biological activities. Tuberculosis, 2007, 87(2): 78-86. DOI:10.1016/j.tube.2006.05.003 |
| [64] | Venkitasubramanian P, Daniels L, Rosazza JPN. Reduction of carboxylic acids by Nocardia aldehyde oxidoreductase requires a phosphopantetheinylated enzyme. Journal of Biological Chemistry, 2007, 282(1): 478-485. DOI:10.1074/jbc.M607980200 |
| [65] | Xue SJ, Chi Z, Zhang Y, Li YF, Liu GL, Jiang H, Hu Z, Chi ZM. Fatty acids from oleaginous yeasts and yeast-like fungi and their potential applications. Critical Reviews in Biotechnology, 2018, 38(7): 1049-1060. DOI:10.1080/07388551.2018.1428167 |
| [66] | Vél?z H, Glassbrook NJ, Daub ME. Mannitol metabolism in the phytopathogenic fungus Alternaria alternata. Fungal Genetics and Biology, 2007, 44(4): 258-268. DOI:10.1016/j.fgb.2006.09.008 |
| [67] | Qi XH, Luo Y, Wang X, Zhu JF, Lin J, Zhang HH, Chen F, Sun WJ. Enhanced D-arabitol production by Zygosaccharomyces rouxii JM-C46:isolation of strains and process of repeated-batch fermentation. Journal of Industrial Microbiology & Biotechnology, 2015, 42(5): 807-812. |
