钟雯, 蒋永光, 石良


中国地质大学环境学院, 生物科学与技术系, 湖北 武汉 430074
收稿日期:2020-03-01;修回日期:2020-04-17;网络出版日期:2020-04-24
基金项目:科技部国家重点研发计划项目(2018YFA0901303);国家自然科学基金项目(91851211,41772363);湖北省****项目和中国地质大学(武汉)中央高校基本科研业务费专项资金
作者简介:石良, 博士, 中国地质大学(武汉)环境学院生物科学与技术系地大****教授, 中国微生物学会地质微生物学专业委员会委员, 中国矿物岩石地球化学学会第九届矿物学专业委员会委员。主要从事微生物胞外电子传递分子机理及其应用的研究, 发现了多个微生物胞外电子传途径, 其成果极大地提升了人们在分子水平上对微生物胞外电子传递过程的认识。先后主持了国家自然科学基金重点项目和面上项目, 以及科技部国家重点研发计划重点专项课题。已在Nature Reviews Microbiology、Nature Communications、Proceedings of the National Academy of Sciences of the United States of America、FEMS Microbiology Reviews、Molecular Microbiology、Applied and Environmental Microbiology、Journal of Bacteriology、Journal of Biological Chemistry、Biochemistry等专业刊物发表科研论文120余篇, 相关工作多次被Nature、Cell、Science等国际顶尖期刊引用.
*通信作者:石良, Tel:+86-27-67883152;E-mail:liang.shi@cug.edu.cn.
摘要:微生物种间直接电子传递是指在厌氧条件下,一种微生物将电子直接传递给另外一种微生物,将两种不同微生物的代谢途径耦合在一起,以达到互养共生的目的。细菌-古菌之间的直接电子传递是其物质转换与能量代谢的新途径和新调控机制,直接参与甲烷的合成以及与硫酸盐还原耦合的厌氧甲烷氧化,在驱动碳和硫的地球化学转化与循环中起着十分重要的作用。目前研究结果认为细菌-古菌之间的直接电子传递主要是由含多个血红素的C型细胞色素介导的,这些细胞色素能形成不间断的胞外电子传递途径,以电子多步跃迁机制在细菌和古菌的细胞质膜之间传递电子。
关键词:细菌古菌种间直接电子传递多个血红素的C型细胞色素
Direct electron transfer between bacteria and archaea
Wen Zhong, Yongguang Jiang, Liang Shi


Department of Biological Sciences and Technology, School of Environmental Studies, China University of Geosciences, Wuhan 430074, Hubei Province, China
Received: 1 March 2020; Revised: 17 April 2020; Published online: 24 April 2020
*Corresponding author: Liang Shi, Tel:+86-27-67883152;E-mail:liang.shi@cug.edu.cn.
Foundation item: Supported by the National Key Research and Development Project of Ministry of Science and Technology of China (2018YFA0901303), by the National Natural Science Foundation of China (91851211, 41772363) and by the One Hundred Talents Program of Hubei Province and the Fundamental Research Funds for the Central Universities, China University of Geosciences-Wuhan
Abstract: Under anoxic condition, a microorganism can transfer electrons directly to another microorganism (i.e., direct interspecies electron transfer or DIET) to couple the metabolic capability of the two microorganisms for their syntrophic growth. DIET between bacteria and archaea is the new way for energy exchange between bacteria and archaea as well as the new mechanisms for regulating their metabolisms. Furthermore, DIET between bacteria and archaea is directly involved in methane formation and the anoxic methane oxidation coupled to sulfate reduction. Thus, DIET between bacteria and archaea plays a crucial role in global biogeochemical transformation and cycling of carbon and sulfur. Finally, all currently available data suggest that multi-heme c-type cytochromes may form continuously extracellular electron transfer pathways to mediate electron transfer between the cytoplasmic membranes of bacteria and archaea via the multi-step hopping mechanism.
Keywords: bacteriaarchaeadirect interspecies electron transfermulti-heme c-type cytochromes
自然界中不同种类的微生物通常生活在一起组成微生物群落。群落里不同种类微生物之间的代谢关系可归纳为以下3种形式:(1)中立关系,群落里各种微生物可不依赖其他种类微生物独立生长,但利用同一底物的不同种类微生物之间可演化为竞争关系;(2)偏利共栖关系,一种微生物依赖另一种微生物为其生长提供必要的代谢支持,如寄生关系;(3)互养共生关系,两种微生物均需要对方为自身的生长提供必要的代谢支持[1]。在厌氧环境中,如地下水、湿地、稻田、湖底及海底,一种微生物可将电子直接传递给另外一种微生物(即微生物种间直接电子传递),将两种不同微生物的代谢途径耦合在一起,以达到互养共生的目的。例如,在稻田土壤中,细菌如地杆菌(Geobacter spp.)和产甲烷古菌(Methanosarcina spp.)可形成依赖直接电子传递的互养共生。在这种共生关系中,地杆菌氧化有机物,并将释放出的电子直接传递给产甲烷古菌,后者再利用接受的电子将二氧化碳(CO2)还原成甲烷(图 1-A)[2-3]。另外,海底沉积物中的厌氧甲烷氧化古菌(Anaerobic methanotrophic archaea or ANME)和硫酸盐还原细菌(Sulfate-reducing bacteria or SRB)也可形成由直接电子传递介导的互养共生。在这种共生关系中,古菌氧化甲烷,然后将释放的电子直接传递给硫酸盐还原细菌,后者再利用接受的电子将硫酸盐还原为硫化氢(图 1-B)[4-5]。细菌-古菌之间的直接电子传递不仅是微生物胞外电子传递的一个重要方式,也是细菌-古菌之间物质转换与能量代谢的新途径和新调控机制。它对于建立细菌-古菌之间的互养共生起着不可替代的作用,也深刻影响着微生物与环境之间的相互作用。以直接电子传递为基础的细菌-古菌的互养共生在微生物驱动碳和硫的地球化学转化与循环中起着十分重要的作用,而且也可以用于污水处理和合成生物燃料[6-10]。
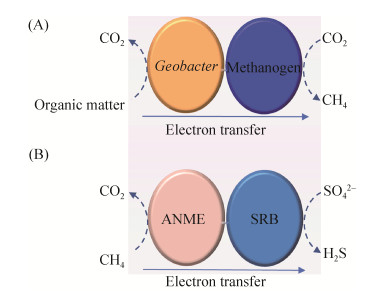 |
| 图 1 细菌-古菌之间的直接电子传递 Figure 1 Direct interspecies electron transfer between bacteria and archaea. A: Direct electron transfer from Geobacter spp. to methanogens. B: Direct electron transfer from anaerobic methanotrophic archaea (ANME) to sulfate-reducing bacteria (SRB). |
| 图选项 |
1 地杆菌到产甲烷古菌的直接电子传递 1.1 地杆菌的胞外电子传递途径 地杆菌是环境中常见的异化铁还原细菌,能够氧化有机物,并利用含三价铁的矿物作为厌氧呼吸的末端电子受体[11]。地杆菌含有跨越整个细胞膜套的胞外电子传递途径,能够将电子由细胞质膜传递到细胞外的含铁矿物。例如,硫还原地杆菌(G. sulfurreducens)的胞外电子传递途径包括位于细胞质膜上的含有多个血红素的C型细胞色素CbcL和ImcH,推测它们能够将质膜中的氢醌氧化为醌,然后将释放出的电子传递给位于周质空间的含有3个血红素的C型细胞色素PpcA和PpcD,这两个蛋白质将电子进一步传递给位于细胞外膜上的,由孔蛋白和含有多个血红素的C型细胞色素组成的复合体。目前已经鉴定的复合体是由孔蛋白OmbB、OmbC和ExtC/GSU2644,周质空间中含多个血红素的C型细胞色素OmaB、OmaC和ExtA/GSU2643,以及外膜表面含多个血红素的C型细胞色素OmcB、OmcC和ExtD/ GSU2642组成。这些复合体的功能是将电子由周质空间跨越外膜传递到细胞表面的含铁矿物(图 2-A)。基于它们的组成成分,这类途径也称为孔蛋白-细胞色素胞外电子传递途径。电子由细胞质膜传递到胞外电子受体的过程也称为微生物的胞外电子传递[6-7, 12]。
 |
| 图 2 硫还原地杆菌的胞外电子传递机制 Figure 2 Extracellular electron transfer mechanism of G. sulfurreducens. A: Extracellular electron transfer pathway; B: PilA nanowire; C: OmcS nanowire[15]. OM: outer membrane; PS: periplasm; CM: cytoplasmic membrane; Q: quinone; QH2: quinol. |
| 图选项 |
1.2 地杆菌的纳米导线 地杆菌的纳米导线能将电子由一个细胞直接传递到邻近的另外一个细胞,也可将电子由微生物细胞表面传递到远离细胞表面的含铁矿物。由于纳米导线能将电子传递出常规的细胞边界,它们极大地延伸了地杆菌的胞外电子传递能力, 使得地杆菌能更好地适应其生存环境[12-13]。早期的研究认为地杆菌纳米导线是锚定在细胞外膜上的菌毛,它由菌毛蛋白PilA组成。类金属型电子传递机制假说认为,PilA紧密重叠的芳香族氨基酸构成芳香化合物-芳香化合物作用链,从而促进电子的离域作用,形成地杆菌纳米导线的导电性。而电子跃迁机制假说则认为,电子可能通过多步跃迁机制在地杆菌纳米导线上的芳香族氨基酸之间传递(图 2-B)。但是,PilA纳米导线的分子结构仍未解析,其导电机理仍需要进一步的实验验证[6-7, 9-10, 12]。最新研究结果表明硫还原地杆菌的纳米导线是由OmcS组成,OmcS是一种含有6个红素的C型细胞色素,这些细胞色素头尾相连形成一条不分叉的蛋白质丝状体,在这个丝状体中,血红素紧密地(3.4–6.1? )排列在一起形成一条长的电子传递链,电子可沿着血红素中的铁原子通过多步跃迁机制由纳米导线的一端传递到另一端(图 2-C)[14-15]。
1.3 地杆菌介导的种间直接电子传递 不同种类地杆菌之间以及地杆菌与其他种类微生物之间可以互养共生。与常见的微生物种间交换水溶性代谢产物介导的互养共生不同,地杆菌采用独特的、以种间直接电子传递为基础的微生物互养共生。金属还原地杆菌(G. metallireducens)和硫还原地杆菌的共生生长是最早报道的以种间直接电子传递为基础的微生物互养共生。在这一互养共生关系中,金属还原地杆菌能够氧化乙醇,但不能还原富马酸,而硫还原地杆菌不能氧化乙醇,但能还原富马酸。因此,金属还原地杆菌需要将氧化乙醇后释放的电子传递给硫还原地杆菌,后者再利用接受的电子还原富马酸。基因敲除结果显示金属还原地杆菌利用PilA和OmcS将电子传递给硫还原地杆菌[16]。不过,近期研究结果显示缺失PilA的金属还原地杆菌仍可以通过C型细胞色素将电子传递给硫还原地杆菌[17]。另外,硫还原地杆菌和厌氧光合细菌绿脓杆菌(Prosthecochloris aestaurii)也可以互养共生,直接电子传递将硫还原地杆菌介导的乙酸氧化和绿脓杆菌介导的CO2还原耦合在一起,研究结果表明硫还原地杆菌的表面细胞色素能够将电子直接传递给绿脓杆菌[18]。
地杆菌纳米导线也可以将电子由金属还原地杆菌传递给产甲烷古菌,如竹节状甲烷鬃毛菌(Methanosaeta harundinacea)和巴氏甲烷八叠球菌(Methanosarcina barkeri)。在这种互养共生关系中,金属还原地杆菌将氧化乙醇释放的电子由地杆菌的PilA和C型细胞色素直接传递给产甲烷古菌,后者利用得到的电子将CO2还原为甲烷(图 1-A)[19-20]。除了地杆菌的PilA和C型细胞色素外,其他导电物质,如磁铁矿、活性碳、生物碳和碳纤维布,也可促进电子由一种地杆菌传递给另外一种地杆菌、产甲烷古菌或其他微生物的过程[19-25]。
环境中的地杆菌、甲烷鬃毛菌和甲烷八叠球菌通常共同生活在一起,组成一个微生物群落,将有机物转化为甲烷。例如,在稻田土壤中这3种微生物通常是优势菌,转录组学结果显示稻田土壤中地杆菌的PilA和OmcS基因以及甲烷鬃毛菌的CO2固定基因均高度表达。由于甲烷鬃毛菌不能利用氢气(H2)作为电子供体,由地杆菌、甲烷鬃毛菌和甲烷八叠球菌组成的微生物群落只能通过直接电子传递的方式共同地将有机物转化为甲烷[2]。此外,在含有地杆菌、甲烷鬃毛菌和甲烷八叠球菌的稻田土壤中加入导电的含铁矿物能够加速甲烷的生成,这主要是因为含铁矿物能够将电子由地杆菌直接传递给产甲烷古菌[3]。除了稻田外,地杆菌-产甲烷古菌的互养共生也存在于河底和海底[26-27]。例如,在海底沉积物中,地杆菌-甲烷八叠球菌的互养共生耦合了乙酸氧化和CO2还原,导电的含铁矿物将电子从地杆菌直接传递给甲烷八叠球菌,这一地杆菌-甲烷八叠球菌的互养共生,不仅使得地杆菌能够生活在富含乙酸和CO2的环境里,而且使共生菌在这样的环境里比其他利用乙酸的产甲烷古菌如甲烷鬃毛菌,更具有竞争优势[26]。目前的假说认为种间直接电子传递能力的演化,赋予了地杆菌在缺少金属矿物的环境中的生存能力[16, 26]。
1.4 产甲烷古菌的胞外电子传递 许多产甲烷古菌,例如巴氏甲烷八叠球菌、马氏甲烷八叠球菌(Methanosarcina mazei)、甲烷嗜热自养杆菌(Methanothermobacter thermautotrophicus)和伏地甲烷球菌(Methanolobus vulcani),均可以还原三价铁矿物,而且三价铁的还原会抑制甲烷的合成[28-31]。对固态含铁矿物的还原表明这些产甲烷古菌均具有胞外电子传递的能力,但是目前对其分子机理的研究才刚刚开始,远不如对地杆菌的了解。另外,乙酸甲烷八叠球菌(Methanosarcina acetivorans)在合成甲烷的过程中也可以氧化甲烷,即痕量甲烷氧化。在这一过程中,甲烷是在没有电子受体的情况下,经由反甲烷生成途径氧化的。在基因组中导入甲基辅酶M还原酶基因后,乙酸甲烷八叠球菌能通过三价铁还原来氧化甲烷[32]。另外,乙酸甲烷八叠球菌拥有成熟的遗传操作系统,因此重组后的乙酸甲烷八叠球菌已经成为研究古菌胞外电子传递分子机理的一个模式菌株。生物化学表征的结果显示位于细胞质膜上的含有7个血红素的C型细胞色素MmcA和异二硫还原酶以及质膜中的甲氧吩嗪均直接或间接地参与了乙酸甲烷八叠球菌还原水溶性三价铁的过程(图 3)[33]。
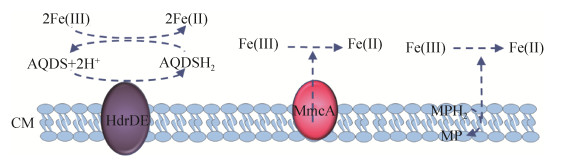 |
| 图 3 乙酸甲烷八叠球菌的胞外电子传递 Figure 3 Extracellular electron transfer of Methanosarcina acetivorans. AQDS: oxidized 9, 10-anthraquinone-2, 6-disulfonate; AQDSH2: reduced 9, 10-anthraquinone-2, 6-disulfonate; HdrDE: heterodisulfide reductase; MmcA: membrane multiheme cytochrome A; MP: oxidized methanophenazine; MPH2: reduced methanophenazine; CM: cytoplasmic membrane. |
| 图选项 |
此外,乙酸甲烷八叠球菌还可以氧化甲醇来还原胞外腐殖质类似物9, 10-蒽醌-2, 6-二磺酸盐,同时也可以合成甲烷。添加甲烷合成抑制剂溴乙烷磺酸盐虽然抑制了其甲烷的合成,但不会抑制其利用9, 10-蒽醌-2, 6-二磺酸盐进行呼吸和生长。转录组分析结果显示在利用9, 10-蒽醌-2, 6-二磺酸盐进行呼吸时,mmcA基因的表达比没有9, 10-蒽醌-2, 6-二磺酸盐时提升了4.5倍。敲除mmcA基因后,乙酸甲烷八叠球菌不能利用9, 10-蒽醌-2, 6-二磺酸盐进行呼吸和生长,但仍能将乙酸和甲醇转化为甲烷[34]。目前所有结果均认为MmcA是三价铁和9, 10-蒽醌-2, 6-二磺酸盐的胞外末端还原酶(图 3)[33-34]。
2 ANME到SRB的直接电子传递 2.1 直接电子传递 ANME在进化上与产甲烷古菌十分接近,它们可将甲烷氧化与硫酸盐、硝酸盐、四价锰及三价铁还原耦合在一起。ANME介导的厌氧甲烷氧化对于调控甲烷向大气中的释放起着举足轻重的作用。据估计,每年有近3亿t甲烷氧化是由ANME通过与硫酸盐还原的耦合催化完成的[6]。目前的实验结果表明ANME能将电子直接传递给SRB。例如,在ANME-1和SRB HotSeep-1及ANME-2和SRB的互养共生体系中没有检测到H2。另外,基因组测序结果显示ANME-1、ANME-2、HotSeep-1和SRB均含有许多含多个血红素的C型细胞色素,HotSeep-1还含有PilA[4-5]。在甲烷氧化的条件下,ANME-1和SRB HotSeep-1的互养共生体系中可以检测到多个C型细胞色素基因的表达以及PilA菌毛[5]。而在同样条件下,互养共生的ANME-2和SRB的细胞质膜及两种细胞之间的间隙中均可以检测到含血红素的蛋白质[4]。总之,已有的研究结果表明ANME氧化甲烷后将释放的电子通过C型细胞色素和菌毛直接传递给SRB,后者再利用这些电子还原硫酸盐[4-5]。
2.2 ANME和SRB的胞外电子传递 除了与SRB互养共生外,ANME也可以通过还原含四价锰或三价铁的矿物来氧化甲烷。在缺少氧气的地球早期环境中,甲烷氧化可能主要是通过还原这些氧化态的矿物[35]。在缺少硫酸盐的条件下,其他水溶性的胞外电子受体,如9, 10-蒽醌- 2, 6-二磺酸盐和柠檬酸铁,也可以支持ANME的甲烷氧化[36]。另外,ANME “Candidatus Methanoperedens ferrireducens”、“CandidatusMethanoperedens manganicus”和“CandidatusMethanoperedens manganireducens”以及一个与“Candidatus Methanoperedens nitroreducens”类似的ANME均可以通过还原含四价锰或三价铁的矿物来氧化甲烷,并且都拥有众多含多个血红素的C型细胞色素[37-39]。因此,与地杆菌类似,ANME也是利用C型细胞色素将电子由细胞内传递到细胞外。目前的研究推测ANME是由异化金属还原古菌演化而来,为了能够生活在富含硫酸盐的环境里,如海底沉积物中,这些具有胞外电子传递能力的金属还原古菌进化为能与SRB互养共生的ANME[36]。
相较于自由生长的SRB,与ANME互养共生的SRB缺少氢化酶和甲酸脱氢酶。因此,互养共生的SRB不能利用H2和甲酸盐,排除了H2和甲酸盐在ANME和SRB之间传递电子的可能。另外,互养共生的SRB比自由生长的SRB拥有更多的含多个血红素的C型细胞色素,部分细胞色素基因也确实能够在甲烷氧化条件下表达。最后,SRB的C型细胞色素基因很可能是通过水平基因转移从地杆菌获得[40]。
综上所述,ANME是利用含多个血红素的C型细胞色素将氧化甲烷释放的电子由其细胞质膜直接传递给SRB细胞表面的同类细胞色素,SRB利用这些细胞色素将电子由细胞外传递到细胞内进行硫酸盐的还原。
3 结论和展望 细菌-古菌之间的直接电子传递常见于稻田、河底和海底等多个水圈环境中。地杆菌-产甲烷古菌之间的直接电子传递促进甲烷的合成,而ANME-SRB之间的直接电子传递则促进甲烷的厌氧氧化和硫酸盐的还原。因此,细菌-古菌之间的直接电子传递对于驱动碳和硫在水圈中的地球化学转换与循环起着十分重要的作用。虽然细菌-古菌之间直接电子传递分子机理的研究才刚刚开始,但是目前的结果显示含多个血红素的C型细胞色素是细菌-古菌之间非常重要的电子导体,这些C型细胞色素很可能相互联结在一起组成不间断的胞外电子传递途径,电子沿着途径中由血红素中的铁原子组成的电子传递链,通过多步跃迁机制,由一种微生物细胞的质膜直接传递到另外一种微生物细胞的质膜,将两种微生物不同的代谢途径有效地耦合在一起。
在过去的6年中,虽然细菌-古菌之间电子直接传递研究取得了令人瞩目的成果,但是许多关键科学问题仍未解决。例如,早期研究结果显示,地杆菌的表面细胞色素以及纳米导线的PilA和OmcS均参与了与产甲烷菌的直接电子传递,但是,地杆菌的哪些氧化还原蛋白直接将电子传递给产甲烷菌的哪些氧化还原蛋白目前仍不清楚。另外,以前关于产甲烷古菌的胞外电子传递的研究侧重于电子由细胞内传递到细胞外的过程,针对电子由细胞外传递到细胞内的过程的研究尚未开展。最后,目前仍缺少ANME-SRB互养共生的模式系统。因此,今后细菌-古菌之间直接电子传递的研究应聚焦于以下3个方向:(1)细菌-古菌界面电子传递的分子机理,(2)电子由产甲烷古菌细胞表面传递到细胞质膜的分子过程,以及(3)构建ANME-SRB互养共生的模式系统。
References
| [1] | Klitgord N, Segre D. Environments that induce synthetic microbial ecosystems. PLoS Computational Biology, 2010, 6(11): e1001002. DOI:10.1371/journal.pcbi.1001002 |
| [2] | Holmes DE, Shrestha PM, Walker DJF, Dang Y, Nevin KP, Woodard TL, Lovley DR. Metatranscriptomic evidence for direct interspecies electron transfer between Geobacter and Methanothrix species in methanogenic rice paddy soils. Applied and Environmental Microbiology, 2017, 83(9): e00223-17. DOI:10.1128/AEM.00223-17 |
| [3] | Kato S, Hashimoto K, Watanabe K. Methanogenesis facilitated by electric syntrophy via (semi)conductive iron-oxide minerals. Environmental Microbiology, 2012, 14(7): 1646-1654. DOI:10.1111/j.1462-2920.2011.02611.x |
| [4] | McGlynn SE, Chadwick GL, Kempes CP, Orphan VJ. Single cell activity reveals direct electron transfer in methanotrophic consortia. Nature, 2015, 526(7574): 531-535. DOI:10.1038/nature15512 |
| [5] | Wegener G, Krukenberg V, Riedel D, Tegetmeyer HE, Boetius A. Intercellular wiring enables electron transfer between methanotrophic archaea and bacteria. Nature, 2015, 526(7574): 587-590. DOI:10.1038/nature15733 |
| [6] | Jiang YG, Shi MM, Shi L. Molecular underpinnings for microbial extracellular electron transfer during biogeochemical cycling of earth elements. Science China Life Sciences, 2019, 62(10): 1275-1286. DOI:10.1007/s11427-018-9464-3 |
| [7] | Shi L, Dong HL, Reguera G, Beyenal H, Lu AH, Liu J, Yu HQ, Fredrickson JK. Extracellular electron transfer mechanisms between microorganisms and minerals. Nature Reviews Microbiology, 2016, 14(10): 651-662. DOI:10.1038/nrmicro.2016.93 |
| [8] | Shi MM, Jiang YG, Shi L. Electromicrobiology and biotechnological applications of the exoelectrogens Geobacter and Shewanella spp. SCIENCE CHINA Life Sciences, 2019, 62(10): 1670-1678. |
| [9] | Lovley DR. Syntrophy goes electric:direct interspecies electron transfer. Annual Review of Microbiology, 2017, 71(1): 643-664. DOI:10.1146/annurev-micro-030117-020420 |
| [10] | Lovley DR. Happy together:microbial communities that hook up to swap electrons. The ISME Journal, 2017, 11(2): 327-336. DOI:10.1038/ismej.2016.136 |
| [11] | Lovley DR, Ueki T, Zhang T, Malvankar NS, Shrestha PM, Flanagan KA, Aklujkar M, Butler JE, Giloteaux L, Rotaru AE, Holmes DE, Franks AE, Orellana R, Risso C, Nevin KP. Geobacter: the microbe electric's physiology, ecology, and practical applications. Advances in Microbial Physiology, 2011, 59: 1-100. DOI:10.1016/B978-0-12-387661-4.00004-5 |
| [12] | Qiu X, Shi L. Electrical interplay between microorganisms and iron-bearing minerals. Acta Chimica Sinica, 2017, 75(6): 583-593. (in Chinese) 邱轩, 石良. 微生物和含铁矿物之间的电子交换. 化学学报, 2017, 75(6): 583-593. |
| [13] | Reguera G, McCarthy KD, Mehta T, Nicoll JS, Tuominen MT, Lovley DR. Extracellular electron transfer via microbial nanowires. Nature, 2005, 435(7045): 1098-1101. DOI:10.1038/nature03661 |
| [14] | Wang FB, Gu YQ, O'Brien JP, Yi SM, Yalcin SE, Srikanth V, Shen C, Vu D, Ing NL, Hochbaum AI, Egelman EH, Malvankar NS. Structure of microbial nanowires reveals stacked hemes that transport electrons over micrometers. Cell, 2019, 177(2): 361-369. DOI:10.1016/j.cell.2019.03.029 |
| [15] | Filman DJ, Marino SF, Ward JE, Yang L, Mester Z, Bullitt E, Lovley DR, Strauss M. Cryo-EM reveals the structural basis of long-range electron transport in a cytochrome-based bacterial nanowire. Communication Biology, 2019, 2: 219. DOI:10.1038/s42003-019-0448-9 |
| [16] | Summers ZM, Fogarty HE, Leang C, Franks AE, Malvankar NS, Lovley DR. Direct exchange of electrons within aggregates of an evolved syntrophic coculture of anaerobic bacteria. Science, 2010, 330(6009): 1413-1415. DOI:10.1126/science.1196526 |
| [17] | Liu X, Zhuo SY, Rensing C, Zhou SG. Syntrophic growth with direct interspecies electron transfer between pili-free Geobacter species. The ISME Journal, 2018, 12(9): 2142-2151. DOI:10.1038/s41396-018-0193-y |
| [18] | Ha PT, Lindemann SR, Shi L, Dohnalkova AC, Fredrickson JK, Madigan MT, Beyenal H. Syntrophic anaerobic photosynthesis via direct interspecies electron transfer. Nature Communications, 2017, 8(1): 13924. DOI:10.1038/ncomms13924 |
| [19] | Rotaru AE, Shrestha PM, Liu FH, Markovaite B, Chen SS, Nevin KP, Lovley DR. Direct interspecies electron transfer between Geobacter metallireducens and Methanosarcina barkeri. Applied and Environmental Microbiology, 2014, 80(15): 4599-4605. DOI:10.1128/AEM.00895-14 |
| [20] | Rotaru AE, Shrestha PM, Liu FH, Shrestha M, Shrestha D, Embree M, Zengler K, Wardman C, Nevin KP, Lovley DR. A new model for electron flow during anaerobic digestion:direct interspecies electron transfer to Methanosaeta for the reduction of carbon dixide to methane. Energy and Environmental Science, 2014, 7(1): 408-415. |
| [21] | Chen SS, Rotaru AE, Liu FH, Philips J, Woodard TL, Nevin KP, Lovley DR. Carbon cloth stimulates direct interspecies electron transfer in syntrophic co-cultures. Bioresource Technology, 2014, 173: 82-86. DOI:10.1016/j.biortech.2014.09.009 |
| [22] | Chen SS, Rotaru AE, Shrestha PM, Malvankar NS, Liu FH, Fan W, Nevin KP, Lovley DR. Promoting interspecies electron transfer with biochar. Scientific Reports, 2014, 4: 5019. |
| [23] | Liu FH, Rotaru AE, Shrestha PM, Malvankar NS, Nevin KP, Lovley DR. Promoting direct interspecies electron transfer with activated carbon. Energy and Environmental Science, 2012, 5(10): 8982-8989. DOI:10.1039/c2ee22459c |
| [24] | Liu FH, Rotaru AE, Shrestha PM, Malvankar NS, Nevin KP, Lovley DR. Magnetite compensates for the lack of a pilin-associated c-type cytochrome in extracellular electron exchange. Environmental Microbiology, 2015, 17(3): 648-655. DOI:10.1111/1462-2920.12485 |
| [25] | Kato S, Hashimoto K, Watanabe K. Microbial interspecies electron transfer via electric currents through conductive minerals. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(25): 10042-10046. DOI:10.1073/pnas.1117592109 |
| [26] | Rotaru AE, Calabrese F, Stryhanyuk H, Musat F, Shrestha PM, Weber HS, Snoeyenbos-West OLO, Hall POJ, Richnow HH, Musat N, Thamdrup B. Conductive particles enable syntrophic acetate oxidation between Geobacter and Methanosarcina from coastal sediments. mBio, 2018, 9(3): e00226-18. DOI:10.1128/mBio.00226-18 |
| [27] | Zheng SL, Zhang HX, Li Y, Zhang H, Wang OM, Zhang J, Liu FH. Co-occurrence of Methanosarcina mazei and Geobacteraceae in an iron (Ⅲ)-reducing enrichment culture. Frontiers in Microbiology, 2015, 6: 941. |
| [28] | Bond DR, Lovley DR. Reduction of Fe(Ⅲ) oxide by methanogens in the presence and absence of extracellular quinones. Environmental Microbiology, 2002, 4(2): 115-124. DOI:10.1046/j.1462-2920.2002.00279.x |
| [29] | Liu D, Dong HL, Bishop ME, Wang HM, Agrawal A, Tritschler S, Eberl DD, Xie SC. Reduction of structural Fe(Ⅲ) in nontronite by methanogen Methanosarcina barkeri. Geochimica et Cosmochimica Acta, 2011, 75(4): 1057-1071. DOI:10.1016/j.gca.2010.11.009 |
| [30] | Zhang J, Dong HL, Liu D, Agrawal A. Microbial reduction of Fe(Ⅲ) in smectitte minerals by thermiphilic methanogen Methanothermobacter thermautotrophicus. Geochimica et Cosmochimica Acta, 2013, 106: 203-315. DOI:10.1016/j.gca.2012.12.031 |
| [31] | Zhang J, Dong HL, Liu D, Fischer TB, Wang S, Huang LQ. Microbial reduction of Fe(Ⅲ) in illite-smectite minerals by methanogen Methanosarcina mazei. Chemical Geology, 2012, 292-293: 35-44. DOI:10.1016/j.chemgeo.2011.11.003 |
| [32] | Soo VWC, McAnulty MJ, Tripathi A, Zhu FY, Zhang LM, Hatzakis E, Smith PB, Agrawal S, Nazem-Bokaee H, Gopalakrishnan S, Salis HM, Ferry JG, Maranas CD, Patterson AD, Wood TK. Reversing methanogenesis to capture methane for liquid biofuel precursors. Microbial Cell Factories, 2016, 15(1): 11. DOI:10.1186/s12934-015-0397-z |
| [33] | Yan Z, Joshi P, Gorski CA, Ferry JG. A biochemical framework for anaerobic oxidation of methane driven by Fe(Ⅲ)-dependent respiration. Nature Communications, 2018, 9(1): 1642. DOI:10.1038/s41467-018-04097-9 |
| [34] | Holmes DE, Ueki T, Tang HY, Zhou JJ, Smith JA, Chaput G, Lovley DR. A membrane-bound cytochrome enables Methanosarcina acetivorans to conserve energy from extracellular electron transfer. mBio, 2019, 10(4): e00789-19. DOI:10.1128/mBio.00789-19 |
| [35] | Beal EJ, House CH, Orphan VJ. Manganese-and iron-dependent marine methane oxidation. Science, 2009, 325(5937): 184-187. DOI:10.1126/science.1169984 |
| [36] | Scheller S, Yu H, Chadwick GL, McGlynn SE, Orphan VJ. Artificial electron acceptors decouple archaeal methane oxidation from sulfate reduction. Science, 2016, 351(6274): 703-707. DOI:10.1126/science.aad7154 |
| [37] | Ettwig KF, Zhu BL, Speth D, Keltjens JT, Jetten MSM, Kartal B. Archaea catalyze iron-dependent anaerobic oxidation of methane. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(45): 12792-12796. DOI:10.1073/pnas.1609534113 |
| [38] | Cai C, Leu AO, Xie GJ, Guo JH, Feng YX, Zhao JX, Tyson GW, Yuan ZG, Hu SH. A methanotrophic archaeon couples anaerobic oxidation of methane to Fe(Ⅲ) reduction. The ISME Journal, 2018, 12(8): 1929-1939. DOI:10.1038/s41396-018-0109-x |
| [39] | Leu AO, Cai C, McIlroy SJ, Southam G, Orphan VJ, Yuan ZG, Hu SH, Tyson GW. Anaerobic methane oxidation coupled to manganese reduction by members of the Methanoperedenaceae. The ISME Journal, 2020, 14(4): 1030-1041. DOI:10.1038/s41396-020-0590-x |
| [40] | Skennerton CT, Chourey K, Iyer R, Hettich RL, Tyson GW, Orphan VJ. Methane-fueled syntrophy through extracellular electron transfer:uncovering the genomic traits conserved within diverse bacterial partners of anaerobic methanotrophic archaea. mBio, 2017, 8(4): e00530-17. DOI:10.1128/mBio.00530-17 |
