张芳, 沈国平, 李永臻, 朱德锐


青海大学医学院基础医学研究中心, 青海 西宁 810016
收稿日期:2019-11-21;修回日期:2020-01-30;网络出版日期:2020-06-16
基金项目:国家自然科学基金(31760034,21967018);青海省重点研发与转化计划(2019SF121);青海省基础应用研究计划(2018ZJ778,2020ZJ767);高原特色盐湖生物资源的集成研发与转化团队计划(2018KYT1)
*通信作者:朱德锐, Tel/Fax:+86-971-6153778;E-mail:zhuderui2005@126.com.
摘要:四氢嘧啶(Ectoine)及其衍生物羟基四氢嘧啶(5-hydroxyectoine,5-HE)是嗜盐微生物胞内合成的一类能够抵抗外界高盐胁迫的相容溶质,具有细胞、细胞膜、蛋白质和核酸的保护作用,可抵抗高盐、高温、冷冻和干燥等极端环境因素的刺激,从而倍受关注。本文对不同类型微生物Ectoine/5-HE(Ects)生物合成代谢、分解代谢以及吸收/转运系统涉及的调控机制进行综述,以期为Ects合成产量的提升与高效积聚策略的优化,提供一定的理论参考依据。
关键词:Ectoine5-hydroxyectoine调节因子转录调控分解代谢转运调节
Metabolic regulation of compatible solutes ectoine and 5-hydroxyectoine
Fang Zhang, Guoping Shen, Yongzhen Li, Derui Zhu


Research Center of Basic Medical Science, Medical College, Qinghai University, Xining 810016, Qinghai Province, China
Received: 21 November 2019; Revised: 30 January 2020; Published online: 16 June 2020
*Corresponding author: Derui Zhu, Tel/Fax: + 86-971-6153778; E-mail: zhuderui2005@126.com.
Foundation item: Supported by the National Natural Science Foundation of China (31760034, 21967018), by the Key Research Foundation of Development and Transformation of Qinghai Province (2019SF121), by the Basic Applied Research Plan of Qinghai Province (2018ZJ778, 2020ZJ767), and by the Team's Research Program of Microbial Resources in Salt-lakes of Qinghai-Tibetan Plateau (2018KYT1)
Abstract: Ectoine and its derivative 5-hydroxyectoine (5-HE) are compatible solutes synthesized intracellularly by halophiles in response to high salinity/osmolarity, heat, freezing, and dryness extremes. They have drawn a lot of attention lately due to their protective effects on maintaining cell survival, membrane integrity, as well as protein and DNA functionality. This article comprehensively reviews the regulatory mechanisms of intracellular biosynthesis and catabolism of ectoine and 5-HE in different types of microorganisms, and summarizes the latest research progress in the regulation of extracellular uptake and transport systems of ectoine and 5-HE. This review may provide a certain theoretical reference for the subsequent optimization of the production and efficient accumulating strategies of ectoine and 5-HE.
Keywords: Ectoine5-hydroxyectoineregulating factortranscriptional regulationcatabolismuptake and transport
四氢嘧啶(l, 4, 5, 6-四氢-2-甲基-4-嘧啶羧酸,Ectoine)及衍生物羟基四氢嘧啶(5-羟基四氢嘧啶,5-hydroxyectoine[5-HE])是典型的相容溶质(Compatible solute)有机化合物,具有亲水性和两性离子特征[1],分子量分别为142.16和158.16。嗜盐或耐盐微生物胞内大量积聚Ects,以此应对高盐或超盐等极端环境的渗透压胁迫[2]。1985年,Ectoine首次从极端嗜盐外硫红螺菌属(Ectothiorhodspira)的光合紫细菌Halochloris中发现[2],次后陆续发现于芽孢杆菌(Bacillus)、链霉菌(Streptomyces)、甲烷菌(Methylomicrobium)、盐单胞菌(Halomonas)以及色盐杆菌(Chromohalobacter)等菌株之中。但因生物合成代谢途径、基因组织多元化以及代谢调控方式的差异,不同菌株的Ectoine积聚量有明显差异。通常,Ectoine高效积聚的模式菌株以盐单胞菌属(Halomonas)和色盐杆菌属(Chromohalobacter)菌株为代表,均隶属于γ-变形菌纲海洋螺菌目盐单胞菌科,如延长盐单胞菌H. elongata DSM2581T与需盐色盐杆菌C. salexigens DSM3043T。诸多研究表明,Ectoine通过协助细胞胞内外的渗透压平衡,提高脂膜表面的水合作用,增强脂膜流态化,从而提高细胞膜承受极端环境的能力。其次,胞内高浓度的Ectoine与蛋白分子相互作用,强化蛋白折叠结构的紧凑性和功能稳定性。相对Ectoine而言,5-HE因多拥有一个羟基(-OH)基团,能够替代性补偿蛋白质的表面失水,其保护作用更加有效。此外,Ectoine还能够防止限制性内切酶的切割作用,从而稳定DNA的分子结构。Ects作为嗜盐微生物重要的次级代谢物,具有细胞、细胞膜、蛋白质和核酸的保护作用,可抵抗冷冻、高温、高盐、高压、干旱和辐射等各种逆境因素的影响[3-6]。目前,Ects已广泛应用于药物制备佐剂、器官移植与保存、皮肤创伤修复以及新型化妆品研发等生物医学领域[4],从而备受关注。
在Ects生物合成途径中,以天冬氨酸半醛为前体底物,依赖于进化高度保守的基因簇操纵子ectABC或ectABCD-ask (ect-operon),其结构基因ectB、ectA和ectC分别编码L-二氨基丁酸转氨酶、L-二氨基丁酸乙酰转移酶和四氢嘧啶合酶,经3步催化合成Ectoine。此外,ectD基因可编码四氢嘧啶羟化酶,将Ectoine转化为5-HE (图 1)。2011年,Schwibbert等[7]首次解析H. elongata DSM2581T的Ectoine分解代谢途径,由doeA、doeB、doeC和doeD 4个基因分别编码四氢嘧啶水解酶(DoeA)、Nα-乙酰基-L-2, 4-二氨基丁酸脱乙酰酶(DoeB)、天冬氨酸-半缩醛脱氢酶(DoeC)和L-2, 4-二氨基丁酸转氨酶(DoeD)联合分解Ectoine (图 1)。通常,胞内的Ects浓度能够随着细菌所处环境的变化而响应变化,如在菌株C. salexigens的细胞静止生长期,Ects积累量最大,Ectoine积累量受到盐度的上调作用而增加,而5-HE积累量受高盐和高温的上调作用而增加[8]。目前,Ects的生物合成途径在基因和酶蛋白水平已进行较为深入的研究,然而在低渗-高渗环境变化下,Ects的诱导启动、转录调控以及吸收转运机制等,尚未系统阐明。近年来,关于Ects的吸收与转运调控研究,在不同菌株之中已发现许多类型的调节因子家族参与其中,如MarR家族(Multiple antibiotic resistance regulator)、OmpR家族(Outer membrane proteins regulation)和TRAP-T家族(Tripartite ATP-independent periplasmic transporter)等。本文系统综述了不同类型的微生物涉及Ects合成代谢(如EctR与CosR因子)、分解代谢(如EhuR因子)以及吸收/转运系统(如TeaABC与ProP)调控机制的最新进展,为后续Ects的生物合成与代谢调控研究提供一定的参考依据。
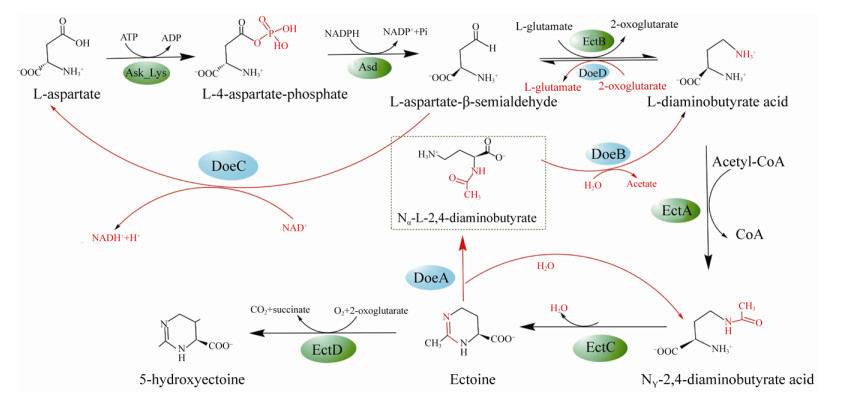 |
| 图 1 Ectoine与5-HE的生物合成和分解代谢途径[7] Figure 1 The biosynthetic and catabolic pathway of ectoine and 5-HE[7] |
| 图选项 |
1 Ects生物合成的分子调控机制 1.1 操纵子ect与渗透压全局调节关联基因 Ects的合成代谢调控,常以进化高度保守的连锁ectABC或ectABCD-ask基因簇操纵子(ect-operon模式)进行。如分析H. elongata菌株的ectABC基因簇,发现在ectA基因上游和ectC基因上游存在两个转录起始位点,参与基因转录,其中ectA由两个控制性启动子组成(δ70和δ38),而ectC存在一个控制性启动子(δ54)[9-12]。然而,不同的微生物ectABC与ectABCD基因簇组织结构差异,如在C. salexigens菌株中,结构基因ectA、ectB与ectC串联形成ectABC操纵子,而ectD则独立存在于启动子之后;又如所有的弧菌属(Vibrio)中,仅ectABC与基因ask形成ectABC-ask操纵子,而缺失ectD基因;又如天蓝色链霉菌(S. coelicolor)则以ectABCD操纵子存在。近年来,通过人为阻断EctD的活性,胞内仍有少许5-HE合成,可能存在其他的未知途径参与合成5-HE[13]。
随着转录组高通量测序技术的广泛应用,研究细胞群体感应、表型变化、代谢功能适应及关键靶向基因差异调控已日趋成熟。Harding等[14]通过转录组和蛋白组预测分析嗜盐菌Halocafeteria seosinensis和Pharyngomonas kirbyi的渗透压适应策略,表明相容溶质5-HE、肌醇(Myo-inositol)和转运蛋白大量合成,以维持渗透压平衡。Carlson等[15]采用葡萄糖或柠檬酸盐培养盐单胞菌H. meridiana,研究高盐和高pH条件下的适应机制。转录组差异分析显示43个Up-regulated基因与酵解途径(酒精/乙醛脱氢酶)、氧化磷酸化和相容溶质Ects生物合成密切相关。Chen等[16]研究盐单胞菌H. beimenensis在高盐状态下转座子诱变的转录组学差异,分析表明直系同源突变基因(nqrA、TrkA[17]、atpC、nadA和gdhB[18])与吸K+排Na+、氧化磷酸化和相容溶质合成等适应策略密切关联,而基因spoT[19]、prkA、mtnN、rsbV、lon、smpB[20]、rfbC、rfbP、tatB[21]、acrR1和lacA[22]与细胞信号传递、群体感应、转录/翻译调控和细胞运动有关。至此,基于转录组学研究不同条件下基因表达差异和基因结构变异,有可能揭示基因间互作网络等信息,亦可能为ect-operon网络调控研究提供新的思考方向。
1.2 甲烷氧化菌与EctR转录调控 Mustakhimov等[23-24]最早从甲烷氧化菌Methylomicrobium alcaliphilum 20Z和Methylophaga thalassica之中发现Ectoine生物合成的转录调控因子EctR,其后发现在Roseobacter、Aliivibrio、Cellvibrio与Alcanivorax等属的细菌中亦广泛存在[25]。EctR蛋白由180个氨基酸组成,分子量20.6 kDa,等电点pI 7.17,隶属MarR家族转录调节因子。EctR蛋白与MarR家族其他成员一样,位于受控基因簇结构的反义链,具有保守的翼状螺旋-转角-螺旋基序,以同型二聚体与DNA结合,但在MarR家族蛋白系统发育树上,EctR呈现单独的进化分支。菌株M. alcaliphilum 20Z和M. thalassica的Ectoine生物合成由操纵子ectABC-ask转录调控,操纵子内有2个间隔紧密的启动子ectAp1和ectAp2,与大肠杆菌σ70启动子同源。EctR可特异性结合启动子ectAp1中的–10 box区域,抑制ectABC-ask操纵子的转录,从而负调控Ectoine的生物合成。在M. alcaliphilum 20Z中,ectABC-ask转录在低盐和高盐度下均可进行[23],而M. thalassica在低盐度下则不能合成Ectoine[24]。
1.3 霍乱弧菌(Vibrio)与CosR转录调控 霍乱弧菌(Vibrio cholerae)是一种水生细菌和人体胃肠道病原体,栖息在人体消化道引发霍乱病。感染期间,V. cholerae通过摄取或合成相容溶质Ectoine,以应对人体消化道环境中盐度和渗透压的变化[26]。Shikuma等[27]通过盐梯度实验进行V. cholerae全局性转录组学分析,发现转录调节因子CosR。CosR隶属MarR型家族转录调节因子,其表达受离子强度(K+和Na+)的影响而被激活。基因cosR定位于V. cholerae染色体Ⅰ上,抑制相容溶质转运体相关的opuD基因和ectABC基因簇的转录表达,从而抑制Ectoine生物合成。此外,CosR还能激活V. cholerae中生物膜形成,并抑制其运动性。
1.4 链霉菌(Streptomyces)与GlnR转录调控 链霉菌属(Streptomyces)具有积聚天然次级代谢物的强大能力,如生物合成抗生素、抗癌药物、免疫抑制剂和驱虫剂等。通常,次级代谢物的生物合成受到复杂的网络调控,许多全局/多效性和通路特异性的调控因子参与其中[28]。早期研究表明,GlnR是氮代谢调控的一个全局性转录调控因子,积聚参与氮代谢相关的基因表达调控,如在天蓝链霉菌(Streptomyces coelicolor)、委内瑞拉链霉菌(S. venezuelae)和人源肺结核杆菌(Mycobacterium tuberculosis)等之中[29]。当氮源缺乏时,GlnR通过抑制Ects的生物合成,以维持胞内谷氨酸代谢池的平衡,减少细菌S. coelicolor对环境氮源的消耗需求。在链霉菌双因子组分系统中,GlnR是典型的应答调节蛋白,属于OmpR家族调节子成员,包括至少15个基因编码的蛋白质(主要是酶),涉及参与氮源摄取、信号传感(amtB-glnK-glnD)、氮源选择性利用(nirB、nasA和ureA)以及Glu/Gln生物合成(glnA、glnII和gdhA)[30]。Shao等[31]研究发现GlnR也是菌株S. coelicolor胞内Ects生物合成操纵子(ectABCD- operon)的转录负性调节因子。在S. coelicolor中,GlnR能够直接结合ect-operon的启动子(?204到?153区域),参与Ects生物合成的负调控。又如在地中海拟无枝酸菌Amycolatopsis mediterranei和阿维链霉菌S. avermitilis中,GlnR也能够直接结合ect-operon的启动子(分别是–45到–3区域和–89到–47区域),从而负调控Ects的生物合成。
1.5 大肠杆菌(Escherichia)与调节因子RpoS 早期研究证实,RpoS是大肠杆菌(E. coli)应激反应(如高渗透压、高盐或低温等)的主要调节因子,参与环境胁迫相关的诸多基因转录调控[32]。Salvador等[33]在需盐色盐杆菌(C. salexigens)也发现RpoS调节因子的存在,参与Ectoine的生物合成调控。在C. salexigens中,RpoS虽不是参与渗透压或高温应急反应的主要调节因子,但可激活ect-operon基因簇的转录,启动Ectoine的生物合成,促进细胞抵抗低盐-高盐渗透压的冲击变化。RpoS不仅参与了低盐度下细胞ectA基因的转录激活,还可能参与翻译后的加工调控,促进Ectoine的生物合成,但在高盐度下ectA基因的诱导表达,受非RpoS因子(ρS)依赖的作用机制介导。此外,Chen等[34]利用系统工程化原理改造大肠杆菌E. coli,对参与L-阿拉伯糖分解代谢的调节基因araC进行人工突变处理,结果显示AraC突变蛋白能特异识别并激活ect操纵子转录,从而促进Ectoine的生物合成。
2 Ects吸收与转运的分子调节机制 2.1 盐单胞菌(Halomonas)与TeaABCD吸收系统 延长盐单胞菌(H. elongate DSM2581T)中存在一种新型的渗透调节摄取与转运系统,称之为TeaABC (Transporter of ectoine accumulation ABC),参与Ectoine的吸收和排泄,甚至调节Ectoine的生物合成[35]。转运系统TeaABC与TRAP-T转运体家族,具有高度的序列和结构相似性,隶属于TRAP-T转运体家族成员,参与渗透压调节。TeaABC是由3个独立的ATP结合胞质转运蛋白构成,包括底物结合蛋白TeaA (38.24 kDa,编码基因1023 bp)、跨膜蛋白TeaC (分子量44.93 kDa,基因1281 bp)和跨膜蛋白TeaB (22.17 kDa,基因603 bp)。转运蛋白体系统TeaABC对Ects分子具有高亲和力(5-HE Kd= 21.7 μmol/L;Ectoine Kd=21.7 μmol/L),不仅能摄取外源Ects进入胞内,还可通过细胞膜排泄内源性Ects至胞外[35]。
此外,Schweikhard等[36]还在H. elongata DSM 2581T中发现第4个TRAP-T转运体蛋白TeaD,具有应激蛋白特性。TeaD蛋白是一种ATP结合蛋白,分子量15.5 kDa,每个单体亚基可结合1个ATP,由4个亚基构成二聚体-二聚体组合复合体,整体形成Rossman样的R/β折叠结构。teaD基因位于teaC基因的下游区域,RT-PCR实验证明基因teaD与teaABC基因簇共转录。若TeaD缺失,则导致转运系统TeaABC增加摄取Ectoine,推断TeaD可能参与TeaABC转运Ectoine的负性调节[35]。
2.2 鲁杰氏菌(Ruegeria)和UehA诱导吸收 Moran等报道[37]海洋细菌Ruegeria (原Silicibacter) pomeroyi DSS-3能够有效摄取外源Ects,作为细胞生存的唯一碳源和氮源营养,而不以Ects作为渗透压保护剂。分析表明DSS-3菌株通过UehABC (Uptake ectoine-hydroxyectoine ABC)转运体系诱导吸收外源性Ects,不是采用常见的渗透压胁迫吸收系统TeaABC进行。UehABC转运体对Ects具有高亲和力和转运活性,Ectoine和5-HE的Kd值分别为1.4±0.1 μmol/L和1.1±0.1 μmol/L,主要由UehA蛋白诱导结合底物Ectoine,并形成UehA-Ectoine复合物。Lecher等[38]已证明UehA是一种Ects特异性底物结合蛋白,分子量为34 kDa,具有两个结构域,结构域Ⅰ包含6个α螺旋,而结构域Ⅱ则包含8个α螺旋和1个β折叠,两个结构域的中心区域由5个反向平行的β-折叠相连接构成。氨基酸相似性分析显示,R. pomeroyi DSS-3的UehA蛋白与盐单胞菌H. elongata的TeaA蛋白氨基酸序列相似度62%;小亚基UehB与TeaB的相似度56%,大亚基UehC与TeaC的相似度74%,由此表明转运体系UehABC和TeaABC可能具有一定的功能关联性和进化同源[39]。
此外,Lecher等[38]深入分析菌株DSS-3的Ects摄取和分解代谢基因簇,发现13个相关基因聚集(uehABC-usp-eutABCDE-asnC-ssd-atf)组成3个功能模块(图 2):(1)第1模块基因簇uehABC编码TRAP转运家族蛋白成员,其中底物结合蛋白(UehA)与Ectoine/5-HE特异性结合形成底物-蛋白复合物;(2)第2个模块基因簇eutABC,3个基因编码5-HE脱羟基生成Ectoine所必需的酶蛋白EutA、EutB和EutD;(3)第3个模块是基因簇eutDE-ssd-atf,编码水解Ectoine外环的氨肽酶(EutD),以及参与中间产物Nα-乙酰基-L-2, 4-二氨基丁酸(Na-ADABA)进一步分解为L-天冬氨酸的酶类(EutE、Ssd和Atf)。
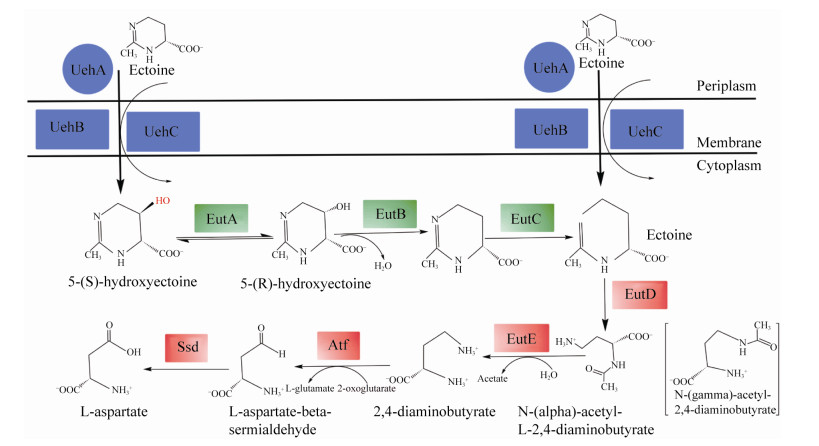 |
| 图 2 鲁杰氏菌Ectoine与5-HE分解代谢途径[56] Figure 2 The catabolic pathway of ectoine and 5-HE in the genus Ruegeria[56]. |
| 图选项 |
2.3 色盐杆菌(Chromohalobacter)与EupR吸收 色盐杆菌C. salexigens是典型的中度嗜盐模式细菌,隶属γ-变形杆菌纲,能够渗透摄取和转运Ectoine,作为碳源营养和渗透压保护剂。Rodríguez-Moya等[40]研究发现C. salexigen胞内摄取Ectoine与EupR蛋白密切相关。EupR蛋白可能归属于细胞膜信号双因子组分,与固氮双因子系统LuxR (NarL/FixJ)的C末端具有类似的蛋白-DNA结合结构域,即为螺旋-转角-螺旋。在低盐度下,EupR能够对胞外Ectoine进行渗透摄取与转运,并作为唯一碳源加以利用,但摄取Ectoine的具体调控机制尚不明确,有待深入研究。同时,发现基因eupR的下游基因编码同源的组氨酸蛋白激酶(Histidine protein kinases,HPK)。典型HPK是一个跨膜受体,由氨基末端的胞外感受区和C末端的胞内信号区域组成,多以二聚体形式存在。HPK可能是EupR的分子传感伴侣,参与感知外部(如离子梯度、膨胀应力与运输)和内部(如细胞质溶质或蛋白质、氧化还原状态)的信息,并进行整合传递。
2.4 大肠杆菌(Escherichia)与ProU/P转运吸收系统 大肠杆菌E. coli的细胞膜上存在转运系统ProU和转运蛋白ProP (图 3),参与Ectoine渗透吸收,前者隶属于ABC转运家族系统(ATP binding cassette),而后者隶属主要易化子超家族MFS (Major facilitator superfamily)的转运蛋白[41]。转运系统ProU是由3个结构基因组成的proVWX操纵子转录表达,并组装形成结合蛋白转运系统,其转录水平受到胞内渗透压升高和胞外谷氨酸钾的诱导[42]。转运系统ProU具有高亲和力特性,其中组分ProV蛋白属于ATP结合盒超家族成员(ATP-binding cassette [ABC] superfamily),参与水解ATP,为底物转运提供能量;组分ProX是周质可溶性底物结合蛋白,参与结合和转运甘氨酸甜菜碱至内膜蛋白ProW[42]。ProP转运蛋白属于次级转运系统,具有低亲和力特性,主要参与Ectoine的摄取和转运。ProP蛋白具有跨膜整合结构域和细胞质C-末端结构域,前者由小周质环和大胞质环组成,而后者相比于其他非渗透压信号(或同源)感应受体,C-末端结构域通常较大[43]。
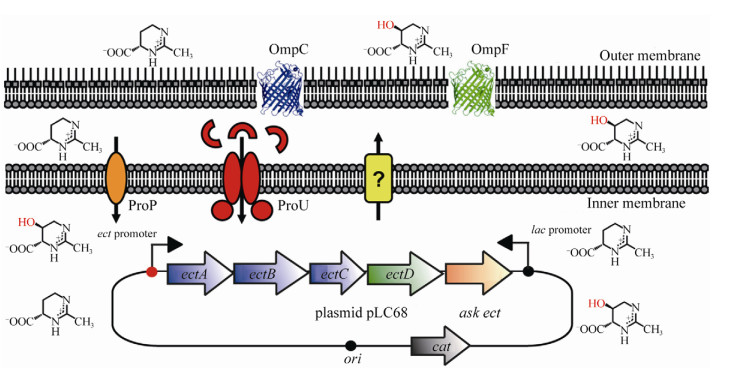 |
| 图 3 转运吸收系统ProU与ProP调控模式[41] Figure 3 Regulation mode of transport absorption system by ProU and ProP[41]. The E. coli cell factory carries a low-copy-number plasmid (pLC68) harboring the ectABCD-ask genes cluster and the lac promoter. ProP and ProU are osmotically inducible transport systems for osmostress protectants. ProP is a member of the MFS family, and ProU is a binding-protein-dependent ABC transporter. The trimeric OmpC and OmpF proteins function as general porins that are inserted into the E. coli outer membrane. |
| 图选项 |
ProP和ProU均可转运各种相容溶质,如渗透保护剂脯氨酸、甘氨酸甜菜碱、γ-丁基甜菜碱和Ectoine等,但二者在渗透压保护剂的转运选择方面存在明显差异。当渗透保护剂浓度低于200 nmol/L时,ProU基因缺陷菌株不能在高渗环境中生存,而ProP基因缺陷株则能适应生存,由此表明E. coli的转运系统ProU主要参与自然状态下(或低浓度Ectoine)的相容溶质渗透和吸收,而转运蛋白ProP可能在高渗情况下发挥其转运功能[43]。当外界渗透压剧增时,外源性Ectoine通过细胞壁上膜孔蛋白(OmpC)扩散进入壁膜周质空间,再由细胞膜上的转运系统ProU和ProP实现胞内Ectoine积累,以响应外界的高渗环境刺激[44]。此外,Choquet等[45]在菊欧文氏杆菌(Erwinia chrysanthemi)中也发现两种渗透转运体:即ABC转运家族系统OusB和MFS转运家族蛋白OusA,均参与Ectoine的渗透吸收。其中,转运系统OusB由3个结构基因(ousV、ousW与ousX)编码表达,其蛋白产物组分(OusVWX)与E. coli的ProU组分(ProVWX)具有高度的序列相似性。
2.5 海球菌(Marinococcus)与EctM渗透吸收 嗜盐海球菌(Marinococcus halophilus)通过从头合成或从胞外摄取Ectoine,以应对渗透压胁迫。Kunte等[46]发现M. halophilus DSM20408T存在相容溶质转运系统EctM,参与外源Ectoine的渗透摄取与转运。蛋白序列相似性显示,EctM隶属于BCCT转运家族成员(Betaine-carnetine-choline transporter)。BCCT家族成员广泛分布于细菌和古生菌两域,常采用H+/Na+驱动力激活,或由Na+同向共转运体系协同参与三甲铵类化合物的吸收与转运,如甘氨酸甜菜碱与肉毒碱等。然而,研究发现EctM是第一个不能转运三甲基铵化合物的BCCT成员,可能仅是一种高度专一性的Ectoine/5-HE转运蛋白。疏水蛋白EctM分子量为58.48 kDa,由525个氨基酸残基组成,其中非极性氨基酸残基约占62.9%,其C末端含有超过50%极性氨基酸(包括7个Glu、2个Asp、3个Lys和7个Asn残基)。EctM转运系统对Ectoine具有高亲和力,Kd = 1.6 μmol/L。当盐度升高时,EctM立即吸收并累积Ectoine至最大浓度,以应对外界环境的渗透压胁迫。
2.6 棒状杆菌(Corynebacterium)与ProP/EctP/ LcoP转运系统 Peter等[47]研究发现谷氨酸棒状杆菌(Corynebacterium glutamicum)中存在两种Ects渗透转运系统:转运蛋白ProP与EctP。转运蛋白ProP是一种次级转运系统,属于主要的易化子超家族MFS成员,具有中等亲和力特性,参与转运脯氨酸(Kd=48 μmol/L)和Ectoine (Kd=132 μmol/L)。ProP可能是通过C末端结构域参与渗透压胁迫感知,但具体机制尚不明确。转运蛋白EctP属于Na+-协同转运超家族SSSS (Sodium-solute symporter superfamily)亚类成员,同时可协助和参与多种相容溶质的跨膜转运,但总体亲和力偏低,其中Ectoine的亲和力最大(Kd=63 μmol/L),可能是Ectoine的最佳渗透调节和转运载体。EctP是一个双功能蛋白质,约12个氨基酸肽段的C末端结构域可以感知环境渗透压的变化,而N末端则负责控制Ectoine转运起始和调节渗透压平衡。EctP对外界渗透压的变化不能立即作出反应,跨膜转运Ects的起始应答时间大约需要10 s。此外,Steger等[48]通过构建C. glutamicum ATCC13032渗透相关基因(betP、putP、proP和ectP)缺失的突变菌株,结果显示甜菜碱和Ectoine仍有较低的摄取率,从而发现一个低通量渗透调节通透酶(LcoP),参与相容溶质的摄取与转运。LocP蛋白共有630个氨基酸残基,属于BCCT家族成员。基因locP的转录与表达严格依赖于外界渗透压的变化。
2.7 枝芽孢杆菌(Virgibacillus)与EctT/OpuC渗透吸收 泛酸枝芽孢杆菌Virgibacillus (原Bacillus) pantothenticus是革兰阳性土壤细菌,通过渗透诱导合成相容溶质脯氨酸和Ectoine (Kd=44 μmol/L),抵御外界高盐或低温环境(15 ℃),但不会生产5-HE[49]。Kuhlmann等[50]证实外源性Ectoine/5-HE能够作为V. pantothenticus的渗透保护剂,发现胞内存在一种相容溶质摄取与转运蛋白EctT。EctT分子量55.1 kDa,由501个氨基酸残基组成,属于BCCT家族成员。EctT可优先摄取Ectoine/ 5-HE,而对脯氨酸和甘氨酸甜菜碱具有较小的摄取活性。基因ectT的转录调控主要由原核SigmaB (σB)启动因子介导,从而促进Ects摄取转运[50]。σB属于杆菌常见的主要应激调节因子,可转录启动细胞抵抗各种极端环境的胁迫,如高盐、低温或乙醇压力等。EctT的氨基酸序列与EctM转运蛋白的氨基酸序列(源自M. halophilus DSM20408T)相似度为49%,与EctP双功能蛋白质的氨基酸序列(来自C. glutamicum)相似度为32%,但EctT的底物谱(Ectoine,甘氨酸甜菜碱和脯氨酸)却最接近于后者EctP[50]。
此外,在枯草芽孢杆菌(B. subtilis)[51]和金黄色葡萄球菌(Staphylococcus aureus)[52]中,还发现一种隶属于ABC转运家族成员的OpuC蛋白,参与摄取外源Ectoine。OpuC蛋白是一个多组分组成的ATP依赖性转运系统,包括底物结合蛋白OpuC、跨膜通道OpuCB/OpuCD以及ATP水解酶OpuA。除了协助Ectoine的跨膜转运,OpuC还能转运其他多种相容溶质,如甜菜碱和胆碱等。
3 Ects分解代谢的分子调控机制 3.1 根瘤菌(Sinorhizobium)分解代谢Ectoine与EhuR调控 Ectoine是苜蓿根瘤菌(Sinorhizobium meliloti)主要的渗透压保护剂,能够被分解利用,而胞内不会维持高浓度的积累量。Jebbar等[53]发现S. meliloti连锁的基因簇ehuABCD-eutABCDE操纵子,参与Ectoine摄取和分解代谢,其中由4个基因(ehuA、ehuB、ehuC和ehuD)编码隶属于ABC转运家族成员的相关蛋白,负责Ectoine的摄入(其中蛋白EhuB结合的Ectoine和5-HE亲和力常数Kd分别1.6 μmol/L和0.5 μmol/L),而eutABCD基因簇编码涉及Ects分解代谢的相关酶类。基因相似性分析显示,eutABCDE操纵子的部分结构基因与doeABCD操纵子(源自H. elongata)的相关基因同源[7],其中eutD与doeA、eutE与doeB同源,eutA并未发现同源基因;基因簇eutBC与基因簇eutDE被3个ORF所隔开,其ORF分别编码同源的转录调节因子DoeX (基因doeX位于doeB与doeC之间)、脱氢酶DoeC和转氨酶DoeD。然而,在菌株S. meliloti中,ehuABCD-eutABCDE操纵子主要由Ectoine诱导表达,而非其他渗透压保护剂。
此外,Jebbar等[53]研究认为ehuABCD- eutABCDE基因簇的转录表达受到底物诱导启动,而不是由渗透压升高激发所致。Yu等[54]研究发现在S. meliloti中存在一种新型的负性调节因子EhuR,参与Ectoine的吸收和分解代谢。EhuR属于MocR (Probable rhizopine catabolism regulator)转录调节因子家族成员,MocR亚家族又隶属GntR (Gluconate regulator)超家族,通常具有螺旋-转角-螺旋(helix-turn-helix, HTH)的DNA结合域和效应物结合域[55]。EhuR分子量为50.2 kDa,由461个氨基酸组成,基因ehuR位于ehuABCD- eutABCDE操纵子的上游区域,与基因簇共转录表达。当胞内Ectoine存在时,EhuR可特异性结合到ehuA启动子的–35区域和ehuR启动子的重叠DNA区域(+1位点),EhuR与ehuA启动子的结合亲和力高于ehuR启动子,从而抑制ehuABCD-eutABCDE操纵子的转录,调节Ectoine的吸收和分解[54]。底物Ectoine与其下游分解产物均可以抑制EhuR的DNA结合活性,但Ectoine自身的抑制作用能够使细胞快速感应,有利于启动Ectoine的吸收过程。
3.2 鲁杰氏菌(Ruegeria)分解代谢Ectoine与EnuR调控 海洋细菌Ruegeria pomeroyi DSS-3中存在多串联的基因簇uehABC-usp-eutABCDE-asnC-ssd- atf,具有Ectoine高亲和力,可被底物诱导,但不能被高盐渗透刺激[38](图 3)。同时,Schulz等[56]发现上述基因簇的上游区域存在一种调节基因enuR。蛋白EnuR隶属MocR亚家族/GntR超家族成员,分子量51.97 kDa,由464个氨基酸残基组成。EnuR蛋白因子具有保守位点Lys302,可共价结合辅基5-磷酸-吡哆醛,参与外源底物5-HE/Ectoine的摄取,并诱导Ects分解代谢基因的表达,实现整个uehABC-usp-eutABCDE操纵子的诱导转录和表达调控[55]。Suvorova[57]等进一步证明,外源Ectoine不仅可作为生长营养源,还能够诱导和强化uehABC-usp-eutABCDE-asnC- ssd-atf操纵子的表达。分析显示,调节基因enuR与操纵子基因簇uehA共转录,该过程由2个完全不同的调控启动子所介导,分别是基因簇上游的底物诱导型启动子和调节基因enuR的上游启动子。然而,基因enuR的启动子属于弱启动子,与Ectoine的存在无直接关系;相反,存在于该基因簇前面的启动子,依赖EnuR诱导分解Ectoine (约36倍)。阻遏蛋白EnuR与Ectoine结合致使构象变化,操纵序列去阻遏作用,结构基因簇开放并表达。由于操纵子的诱导激活和表达,转运系统UehABC介导的Ectoine摄取转运能力亦同步加强,进一步强化操纵子中分解代谢基因簇的表达,直至外源Ectoine被完全消耗殆尽。
4 小结 嗜盐或耐盐微生物胞内合成或摄取积聚相容溶质Ectoine与5-HE,以应对高盐或超盐等极端环境的渗透压胁迫。然而,自然界微生物多样性丰富,因物种分歧进化致使个体的Ects生物合成、分解代谢以及吸收与转运调控模式或参与因子既具共性特征又存在差异性(表 1)。文献综合分析显示一些转录调控因子积极参与Ects生物合成代谢调控,如EctR (Methylomicrobium和Methylophaga)、CosR (Vibrio)、GlnR (Streptomyces)和RpoS (Chromohalobacter)等。具体的调控机制或其他未知的新型调控机制,有待深入研究。现已报道的2个负性调节因子EhuR (Sinorhizobium)和EnuR (Ruegeria),积极参与了胞外Ectoine摄取与分解代谢调控。外源性Ects不仅可作为氮源或碳源供应细胞生长代谢,而且作为相容溶质参与极端环境胁迫保护。至此,Ects生物合成代谢调控势必成为今后的研究热点,尤其涉及正向调控因子重组或构建系统代谢工程菌株,可为高效积聚Ects的策略优化提供新的思考方向。
表 1. Ects生物合成与分解代谢及吸收转运的相关因子 Table 1. Factors related to Ects biosynthesis, catabolism, absorption and transport
| Factor | Strain type | Function | Reference |
| EctR | M. alcaliphilum 20Z, M. thalassica | Inhibits ectABC-ask operon transcription | [23-24] |
| CosR | V. cholerae | Inhibits and regulates ectABC | [27] |
| GlnR | S. coelicolor, A. mediterranei, S. avermitilis | Inhibit the transcription regulation of ectABCD | [30] |
| RpoS | C. salexigens | Promotes ectABC expression | [32] |
| AraC (mutation) | E. coli | Activates ect gene cluster transcription | [34] |
| TeaABCD | H. elongata DSM2581T | Absorption and synthesis of Ects | [35-36] |
| UehA | S. pomeroyi DSS-3 | Induces absorption and synthesis of Ects | [38] |
| EupR | C. salexigens | Osmotic absorption ectoine | [40] |
| ProP | E. coli, C. glutamicum | Osmotic absorption ectoine | [41-42, 47] |
| ProU | E. coli | Osmotic absorption ectoine | [37, 41, 43] |
| OusB | E. chrysanthemi | Osmotic absorption ectoine | [45] |
| OusA | E. chrysanthemi | Osmotic absorption ectoine | [45] |
| EctM | M. halophilus DSM20408 | Osmotic absorption Ects | [46] |
| EctP | C. glutamicum | Osmotic absorption ectoine | [47] |
| LcoP | C. glutamicum | Osmotic absorption ectoine | [48] |
| EctT | V. pantothenticus | Osmotic absorption ectoine | [50] |
| OpuC | B. subtilis, S. aureus | Absorption and synthesis of Ects | [51-52] |
| EhuR | S. meliloti | Absorption synthesis and catabolism of ectoine | [54] |
| EnuR | R. pomeroyi DSS-3 | Absorption synthesis and catabolism of ectoine | [56] |
表选项
此外,涉及Ects吸收与转运的研究报道相对较多,因研究对象的差异,参与的转运系统/家族成员存在菌株选择的偏好,或是几种吸收转运系统的共存协同作用,常见如TRAP-T家族(TeaABCD与UehABC)、ABC转运家族(ProU与OpuC)、MFS超家族(ProP)、BCCT家族(EctM与EctT)和SSSS超家族(EctP)等。综上所述,对不同类型微生物的Ects代谢调控理论研究,众多****已经做了许多广泛和深入的工作,但涉及Ects感应盐环境刺激、Ects生物合成的应答启动、关联基因的网络调控以及多组学共现性分析(转录组、蛋白组与代谢组)方面,尚有待深入研究,尤其是涉及到的新型/未知调节因子的发现与调控机理。
References
| [1] | Zhu DR, Han R, Shen GP, Long QF, Li DD, Liu J, Liu DL. Recombinant co-expression of the Ectoine biosynthesis gene cluster ectABC in Halomonas from Qinghai Lake. Acta Hydrobiologica Sinica, 2015, 39(2): 358-367. (in Chinese) 朱德锐, 韩睿, 沈国平, 龙启福, 李丹丹, 刘建, 刘德立. 青海湖盐单胞菌Ectoine合成基因簇ectABC的重组共表达. 水生生物学报, 2015, 39(2): 358-367. |
| [2] | Galinski EA, Pfeiffer HP, Trüper HG. 1, 4, 5, 6-Tetrahydro- 2-methyl-4-pyrimidinecarboxylic acid: a novel cyclic amino acid from halophilic phototrophic bacteria of the genus Ectothiorhodospira. European Journal of Biochemistry, 1985, 149(1): 135-139. DOI:10.1111/j.1432-1033.1985.tb08903.x |
| [3] | Zhang X, Liu J, Zhu DR. Review on bioengineering and biomedical applications of natural products Ectoine and Hydroxyectoine. Natural Product Research and Development, 2017, 29(5): 882-887. (in Chinese) 张欣, 刘静, 朱德锐. 天然产物Ectoine与Hydroxyectoine的生物工程及医学应用研究进展. 天然产物研究与开发, 2017, 29(5): 882-887. |
| [4] | Ning YK, Wu XJ, Zhang CL, Xu QY, Chen N, Xie XX. Pathway construction and metabolic engineering for fermentative production of ectoine in Escherichia coli. Metabolic Engineering, 2016, 36: 10-18. DOI:10.1016/j.ymben.2016.02.013 |
| [5] | Piubeli F, Salvador M, Argando? a AM, Nieto JJ, Bernal V, Pastor JM, Cánovas M, Vargas C. Insights into metabolic osmoadaptation of the ectoines-producer bacterium Chromohalobacter salexigens through a high-quality genome scale metabolic model. Microbial Cell Factories, 2018, 17(1): 2. DOI:10.1186/s12934-017-0852-0 |
| [6] | Zaccai G, Bagyan I, Combet J, Cuello GJ, Demé B, Fichou Y, Gallat FX, Galvan Josa VM, von Gronau S, Haertlein M, Martel A, Moulin M, Neumann M, Weik M, Oesterhelt D. Neutrons describe ectoine effects on water H-bonding and hydration around a soluble protein and a cell membrane. Scientific Reports, 2016, 6(1): 31434. DOI:10.1038/srep31434 |
| [7] | Schwibbert K, Marin-Sanguino A, Bagyan I, Heidrich G, Lentzen G, Seitz H, Rampp M, Schuster SC, Klenk HP, Pfeiffer F, Oesterhelt D, Kunte HJ. A blueprint of ectoine metabolism from the genome of the industrial producer Halomonas elongata DSM 2581T. Environmental Microbiology, 2011, 13(8): 1973-1994. DOI:10.1111/j.1462-2920.2010.02336.x |
| [8] | Salvador M, Argando? a M, Naranjo E, Piubeli F, Nieto JJ, Csonka LN, Vargas C. Quantitative RNA-seq analysis unveils osmotic and thermal adaptation mechanisms relevant for ectoine production in Chromohalobacter salexigens. Frontiers in Microbiology, 2018, 9: 1845. DOI:10.3389/fmicb.2018.01845 |
| [9] | Czech L, H? ppner A, Kobus S, Seubert A, Riclea R, Dickschat JS, Heider J, Smits SHJ, Bremer E. Illuminating the catalytic core of ectoine synthase through structural and biochemical analysis. Scientific Reports, 2019, 9(1): 364. DOI:10.1038/s41598-018-36247-w |
| [10] | Widderich N, Kobus S, H? ppner A, Riclea R, Seubert A, Dickschat JS, Heider J, Smits SHJ, Bremer E. Biochemistry and crystal structure of ectoine synthase: a metal-containing member of the cupin superfamily. PLoS One, 2016, 11(3): e0151285. DOI:10.1371/journal.pone.0151285 |
| [11] | León MJ, Hoffmann T, Sánchez-Porro C, Heider J, Ventosa A, Bremer E. Compatible solute synthesis and import by the moderate halophile Spiribacter salinus: physiology and genomics. Frontiers in Microbiology, 2018, 9: 108. DOI:10.3389/fmicb.2018.00108 |
| [12] | Richter AA, Mais CN, Czech L, Geyer K, Hoeppner A, Smits SHJ, Erb TJ, Bange G, Bremer E. Biosynthesis of the stress-protectant and chemical chaperon ectoine: biochemistry of the transaminase EctB. Frontiers in Microbiology, 2019, 10: 2811. DOI:10.3389/fmicb.2019.02811 |
| [13] | Czech L, St? veken N, Bremer E. EctD-mediated biotransformation of the chemical chaperone ectoine into hydroxyectoine and its mechanosensitive channel-independent excretion. Microbial Cell Factories, 2016, 15(1): 126. DOI:10.1186/s12934-016-0525-4 |
| [14] | Harding T, Brown MW, Simpson AGB, Roger AJ. Osmoadaptative strategy and its molecular signature in obligately halophilic heterotrophic protists. Genome Biology and Evolution, 2016, 8(7): 2241-2258. DOI:10.1093/gbe/evw152 |
| [15] | Carlson RP, Oshota O, Shipman M, Caserta JA, Hu P, Saunders CW, Xu J, Jay ZJ, Reeder N, Richards A, Pettigrew C, Peyton BM. Integrated molecular, physiological and in silico characterization of two Halomonas isolates from industrial brine. Extremophiles, 2016, 20(3): 261-274. DOI:10.1007/s00792-015-0806-6 |
| [16] | Chen YH, Lu CW, Shyu YT, Lin SS. Revealing the saline adaptation strategies of the halophilic bacterium Halomonas beimenensis through high-throughput omics and transposon mutagenesis approaches. Scientific Reports, 2017, 7(1): 13037. DOI:10.1038/s41598-017-13450-9 |
| [17] | Lehigh KM, West KM, Ginty DD. Retrogradely transported TrkA endosomes signal locally within dendrites to maintain sympathetic neuron synapses. Cell Reports, 2017, 19(1): 86-100. |
| [18] | Belda E, van Heck RGA, José Lopez-Sanchez M, Cruveiller S, Barbe V, Fraser C, Klenk HP, Petersen J, Morgat A, Nikel PI, Vallenet D, Rouy Z, Sekowska A, Martins Dos Santos VAP, de Lorenzo V, Danchin A, Médigue C. The revisited genome of Pseudomonas putida KT2440 enlightens its value as a robust metabolic chassis. Environmental Microbiology, 2016, 18(10): 3403-3424. DOI:10.1111/1462-2920.13230 |
| [19] | Germain E, Guiraud P, Byrne D, Douzi B, Djendli M, Maisonneuve E. YtfK activates the stringent response by triggering the alarmone synthetase SpoT in Escherichia coli. Nature Communications, 2019, 10(1): 5763. DOI:10.1038/s41467-019-13764-4 |
| [20] | Webb HE, Bugarel M, den Bakker HC, Nightingale KK, Granier SA, Scott HM, Loneragan GH. Carbapenem-resistant bacteria recovered from faeces of dairy cattle in the high plains region of the USA. PLoS One, 2016, 11(1): e0147363. DOI:10.1371/journal.pone.0147363 |
| [21] | Fr? bel J, Blümmel AS, Drepper F, Warscheid B, Müller M. Surface-exposed domains of TatB involved in the structural and functional assembly of the Tat translocase in Escherichia coli. Journal of Biological Chemistry, 2019, 294(38): 13902-13914. DOI:10.1074/jbc.RA119.009298 |
| [22] | Wang WW, Liu PF, Lu Q, Ling XF, Zhang JW, Chen MS, Chen H, Chen XM. Potential pathways and genes involved in lac synthesis and secretion in Kerria chinensis (Hemiptera: Kerriidae) based on transcriptomic analyses. Insects, 2019, 10(12): 430. DOI:10.3390/insects10120430 |
| [23] | Mustakhimov Ⅱ, Reshetnikov AS, Glukhov AS, Khmelenina VN, Kalyuzhnaya MG, Trotsenko YA. Identification and characterization of EctR1, a new transcriptional regulator of the ectoine biosynthesis genes in the halotolerant methanotroph Methylomicrobium alcaliphilum 20Z. Journal of Bacteriology, 2010, 192(2): 410-417. DOI:10.1128/JB.00553-09 |
| [24] | Mustakhimov Ⅱ, Reshetnikov AS, Fedorov DN, Khmelenina VN, Trotsenko YA. Role of EctR as transcriptional regulator of ectoine biosynthesis genes in Methylophaga thalassica. Biochemistry (Moscow), 2012, 77(8): 857-863. DOI:10.1134/S0006297912080068 |
| [25] | Czech L, Hermann L, St? veken N, Richter AA, H? ppner A, Smits SHJ, Heider J, Bremer E. Role of the extremolytes ectoine and hydroxyectoine as stress protectants and nutrients: genetics, phylogenomics, biochemistry, and structural analysis. Genes, 2018, 9(4): 177. |
| [26] | Meyer S, Schr? ter MA, Hahn MB, Solomun T, Sturm H, Kunte HJ. Ectoine can enhance structural changes in DNA in vitro. Scientific Reports, 2017, 7(1): 7170. DOI:10.1038/s41598-017-07441-z |
| [27] | Shikuma NJ, Davis KR, Fong JNC, Yildiz FH. The transcriptional regulator, CosR, controls compatible solute biosynthesis and transport, motility and biofilm formation in Vibrio cholerae. Environmental Microbiology, 2013, 15(5): 1387-1399. DOI:10.1111/j.1462-2920.2012.02805.x |
| [28] | Xu L, Ye KX, Dai WH, Sun C, Xu LH, Han BN. Comparative genomic insights into secondary metabolism biosynthetic gene cluster distributions of marine Streptomyces. Marine Drugs, 2019, 17(9): 498. DOI:10.3390/md17090498 |
| [29] | Jiang H, Tian J, Ying B, Wu NF, Xu B. Research progress on GlnR-mediated regulation. Current Biotechnology, 2014, 4(2): 90-95. (in Chinese) 江湖, 田健, 应碧, 伍宁丰, 徐波. GlnR介导的代谢调控研究进展. 生物技术进展, 2014, 4(2): 90-95. DOI:10.3969/j.issn.2095-2341.2014.02.03 |
| [30] | He JM, Zhu H, Zheng GS, Liu PP, Wang J, Zhao GP, Zhu GQ, Jiang WH, Lu YH. Direct involvement of the master nitrogen metabolism regulator GlnR in antibiotic biosynthesis in Streptomyces. Journal of Biological Chemistry, 2016, 291(51): 26443-26454. DOI:10.1074/jbc.M116.762476 |
| [31] | Shao ZH, Deng WX, Li SY, He JM, Ren SX, Huang WR, Lu YH, Zhao GP, Cai ZM, Wang J. GlnR-mediated regulation of ectABCD transcription expands the role of the GlnR regulon to osmotic stress management. Journal of Bacteriology, 2015, 197(19): 3041-3307. DOI:10.1128/JB.00185-15 |
| [32] | Hui S, Silverman JM, Chen SS, Erickson DW, Basan M, Wang JL, Hwa T, Williamson JR. Quantitative proteomic analysis reveals a simple strategy of global resource allocation in bacteria. Molecular Systems Biology, 2015, 11(2): 784. DOI:10.15252/msb.20145697 |
| [33] | Salvador M, Argando? a M, Pastor JM, Bernal V, Cánovas M, Csonka LN, Nieto JJ, Vargas C. Contribution of RpoS to metabolic efficiency and ectoines synthesis during the osmo- and heat-stress response in the halophilic bacterium Chromohalobacter salexigens. Environmental Microbiology Reports, 2015, 7(2): 301-311. DOI:10.1111/1758-2229.12249 |
| [34] | Chen W, Zhang S, Jiang PX, Yao J, He YZ, Chen LC, Gui XW, Dong ZY, Tang SY. Design of an ectoine-responsive AraC mutant and its application in metabolic engineering of ectoine biosynthesis. Metabolic Engineering, 2015, 30: 149-155. DOI:10.1016/j.ymben.2015.05.004 |
| [35] | Grammann K, Volke A, Kunte HJ. New type of osmoregulated solute transporter identified in halophilic members of the bacteria domain: TRAP transporter TeaABC mediates uptake of ectoine and hydroxyectoine in Halomonas elongata DSM 2581T. Journal of Bacteriology, 2002, 184(11): 3078-3085. |
| [36] | Schweikhard ES, Kuhlmann SI, Kunte HJ, Grammann K, Ziegler CM. Structure and function of the universal stress protein TeaD and its role in regulating the ectoine transporter TeaABC of Halomonas elongata DSM 2581T. Biochemistry, 2010, 49(10): 2194-2204. DOI:10.1021/bi9017522 |
| [37] | Moran MA, Buchan A, González JM, Heidelberg JF, Whitman WB, Kiene RP, Henriksen JR, King GM, Belas R, Fuqua C, Brinkac L, Lewis M, Johri S, Weaver B, Pai G, Eisen JA, Rahe E, Sheldon WM, Ye WY, Miller TR, Carlton J, Rasko DA, Paulsen IT, Ren QH, Daugherty SC, Deboy RT, Dodson RJ, Durkin AS, Madupu R, Nelson WC, Sullivan SA, Rosovitz MJ, Haft DH, Selengut J, Ward N. Genome sequence of Silicibacter pomeroyi reveals adaptations to the marine environment. Nature, 2004, 432(7019): 910-913. DOI:10.1038/nature03170 |
| [38] | Lecher J, Pittelkow M, Zobel S, Bursy J, B? nig T, Smits SHJ, Schmitt L, Bremer E. The crystal structure of UehA in complex with ectoine-A comparison with other TRAP-T binding proteins. Journal of Molecular Biology, 2009, 389(1): 58-73. |
| [39] | Kuhlmann SI, Terwisscha van Scheltinga AC, Bienert R, Kunte HJ, Ziegler C. 1.55 ? structure of the ectoine binding protein TeaA of the osmoregulated TRAP-transporter TeaABC from Halomonas elongata. Biochemistry, 2008, 47(36): 9475-9485. DOI:10.1021/bi8006719 |
| [40] | Rodríguez-Moya J, Argando? a M, Reina-Bueno M, Nieto JJ, Iglesias-Guerra F, Jebbar M, Vargas C. Involvement of EupR, a response regulator of the NarL/FixJ family, in the control of the uptake of the compatible solutes ectoines by the halophilic bacterium Chromohalobacter salexigens. BMC Microbiology, 2010, 10(1): 256. DOI:10.1186/1471-2180-10-256 |
| [41] | Czech L, Poehl S, Hub P, St? veken N, Bremer E. Tinkering with osmotically controlled transcription allows enhanced production and excretion of ectoine and hydroxyectoine from a microbial cell factory. Applied & Environmental Microbiology, 2017, 84(2): e01772-17. |
| [42] | Mahmoud RY, Li WQ, Eldomany RA, Emara M, Yu J. The Shigella ProU system is required for osmotic tolerance and virulence. Virulence, 2017, 8(4): 362-374. DOI:10.1080/21505594.2016.1227906 |
| [43] | Culham DE, Shkel IA, Record MT Jr, Wood JM. Correction to "Contributions of coulombic and hofmeister effects to the osmotic activation of Escherichia coli transporter ProP". Biochemistry, 2018, 57(33): 5072. DOI:10.1021/acs.biochem.8b00791 |
| [44] | Cosquer A, Pichereau V, Pocard JA, Minet J, Cormier M, Bernard T. Nanomolar levels of dimethylsulfoniopropionate, dimethylsulfonioacetate, and glycine betaine are sufficient to confer osmoprotection to Escherichia coli. Applied and Environmental Microbiology, 1999, 65(8): 3304-3311. DOI:10.1128/AEM.65.8.3304-3311.1999 |
| [45] | Choquet G, Jehan N, Pissavin C, Blanco C, Jebbar M. OusB, a broad-specificity ABC-Type transporter from Erwinia chrysanthemi, mediates uptake of glycine betaine and choline with a high affinity. Applied and Environmental Microbiology, 2005, 71(7): 3389-3398. DOI:10.1128/AEM.71.7.3389-3398.2005 |
| [46] | Vermeulen V, Kunte HJ. Marinococcus halophilus DSM 20408T encodes two transporters for compatible solutes belonging to the betaine-carnitine-choline transporter family: identification and characterization of ectoine transporter EctM and glycine betaine transporter BetM. Extremophiles, 2004, 8(3): 175-184. DOI:10.1007/s00792-004-0375-6 |
| [47] | Peter H, Weil B, Burkovski A, Kr? mer R, Morbach S. Corynebacterium glutamicum is equipped with four secondary carriers for compatible solutes: identification, sequencing, and characterization of the proline/ectoine uptake system, ProP, and the ectoine/proline/glycine betaine carrier, EctP. Journal of Bacteriology, 1998, 180(22): 6005-6012. DOI:10.1128/JB.180.22.6005-6012.1998 |
| [48] | Steger R, Weinand M, Kr? mer R, Morbach S. LcoP, an osmoregulated betaine/ectoine uptake system from Corynebacterium glutamicum. FEBS Letters, 2004, 573(1/3): 155-160. |
| [49] | Kuhlmann AU, Bursy J, Gimpel S, Hoffmann T, Bremer E. Synthesis of the compatible solute ectoine in Virgibacillus pantothenticus is triggered by high salinity and low growth temperature. Applied and Environmental Microbiology, 2008, 74(14): 4560-4563. DOI:10.1128/AEM.00492-08 |
| [50] | Kuhlmann AU, Hoffmann T, Bursy J, Jebbar M, Bremer E. Ectoine and hydroxyectoine as protectants against osmotic and cold stress: uptake through the sigB-controlled betaine-choline-carnitine transporter-type carrier EctT from Virgibacillus pantothenticus. Journal of Bacteriology, 2011, 193(18): 4699-4708. DOI:10.1128/JB.05270-11 |
| [51] | Wood JM, Bremer E, Csonka LN, Kraemer R, Poolman B, van der Heide T, Smith LT. Osmosensing and osmoregulatory compatible solute accumulation by bacteria. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2001, 130(3): 437-460. |
| [52] | Schuster CF, Bellows LE, Tosi T, Campeotto I, Corrigan RM, Freemont P, Gründling A. The second messenger c-di-AMP inhibits the osmolyte uptake system OpuC in Staphylococcus aureus. Science Signaling, 2016, 9(441): ra81. DOI:10.1126/scisignal.aaf7279 |
| [53] | Jebbar M, Sohn-B? sser L, Bremer E, Bernard T, Blanco C. Ectoine-induced proteins in Sinorhizobium meliloti include an ectoine ABC-type transporter involved in osmoprotection and ectoine catabolism. Journal of Bacteriology, 2005, 187(4): 1293-1304. DOI:10.1128/JB.187.4.1293-1304.2005 |
| [54] | Yu QL, Cai HL, Zhang YF, He YZ, Chen LC, Merritt J, Zhang S, Dong ZY. Negative regulation of ectoine uptake and catabolism in Sinorhizobium meliloti: characterization of the EhuR gene. Journal of Bacteriology, 2017, 199(1): e00119-16. DOI:10.1128/JB.00119-16 |
| [55] | Suvorova IA, Korostelev YD, Gelfand MS. GntR family of bacterial transcription factors and Their DNA Binding Motifs: Structure, Positioning and Co-Evolution. PLoS ONE, 2015, 10(7): e0132618. DOI:10.1371/journal.pone.0132618 |
| [56] | Schulz A, St? veken N, Binzen IM, Hoffmann T, Heider J, Bremer E. Feeding on compatible solutes: a substrate-induced pathway for uptake and catabolism of ectoines and its genetic control by EnuR. Environmental Microbiology, 2017, 19(3): 926-946. DOI:10.1111/1462-2920.13414 |
| [57] | Suvorova IA, Rodionov DA. Comparative genomics of pyridoxal 5'-phosphate-dependent transcription factor regulons in Bacteria. Microbial Genomics, 2016, 2(1): e000047. |
