程万里, 陈珍, 杨雪, 黄典, 张吉斌


华中农业大学农业微生物农药国家工程研究中心, 微生物学国家重点实验室, 生命科学技术学院, 湖北 武汉 430070
收稿日期:2019-10-22;修回日期:2020-01-15;网络出版日期:2020-03-24
基金项目:湖北省技术创新专项重大项目(2017ABA072);中央高校基本科研业务费专项基金(2662016PY110)
*通信作者:张吉斌, Tel:+86-27-87287701;Fax:+86-27-87287254;E-mail:zhangjb@mail.hzau.edu.cn.
摘要:[目的] 南方根结线虫(Meloidogyne incognita)是一种危害严重的土传性植物病原线虫,给农业生产造成了巨大的经济损失,前期研究发现多粘类芽胞杆菌(Panebacillus polymyxa)KM2501-1具有很好的温室防治南方根结线虫效果,且可产生多种挥发性杀线虫活性物质,但对其非挥发性产物是否有杀线虫活性没有研究。本研究拟进一步分离鉴定其产生的杀线虫活性代谢产物,发掘新的杀线虫药物。[方法] 对菌株KM2501-1进行液体发酵并离心收集发酵上清液,通过硅胶柱层析、高效液相色谱分离等方法得到高纯度的杀线虫活性物质,并通过液相色谱质谱联用分析、核磁共振等技术鉴定杀线虫活性物质的结构。[结果] 生物活性检测显示,多粘类芽胞杆菌KM2501-1发酵上清液具有较强的南方根结线虫触杀活性,并能有效抑制南方根结线虫卵孵化,体外杀线虫效率高达87.66%,抑制卵孵化效率达92.26%。结构鉴定结果显示多粘类芽胞杆菌产生的杀线虫活性物质为环二肽类物质cyclo(Pro-Phe),800 mg/L的cyclo(Pro-Phe)杀线虫效率达84.75%。进一步的显微观测结果表明,与对照组相比,活性物质cyclo(Pro-Phe)处理后的根结线虫肠道组织紊乱、结构发生破坏。[结论] 多粘类芽胞杆菌KM2501-1产生的cyclo(Pro-Phe)是一个具有杀线虫新功能的活性物质,其可能通过破坏线虫肠道杀死线虫。
关键词:多粘类芽胞杆菌南方根结线虫杀线虫活性cyclo(Pro-Phe)
Inhibition of Meloidogyne incognita by active compound from Panebacillus polymyxa KM2501-1
Wanli Cheng, Zhen Chen, Xue Yang, Dian Huang, Jibin Zhang


State Key Laboratory of Agricultural Microbiology, National Engineering Research Center of Microbial Pesticides, College of Life Science and Technology, Huazhong Agricultural University, Wuhan 430070, Hubei Province, China
Received: 22 October 2019; Revised: 15 January 2020; Published online: 24 March 2020
*Corresponding author: Jibin Zhang, Tel:+86-27-87287701;Fax:+86-27-87287254;E-mail:zhangjb@mail.hzau.edu.cn.
Foundation item: Supported by the Major Projects of Technological Innovation in Hubei Province, China (2017ABA072) and by the Fundamental Research Funds for the Central Universities, China (2662016PY110)
Abstract: [Objective] Meloidogyne incongnita is a soil transmission plant parasitic nematode that causes serious losses to agricultural production worldwide. Panebacillus polymyxa KM2501-1 inhibits Meloidogyne incongnita in greenhouse experiment, and could produce a variety of nematocidal volatile organic compounds. But whether its non-volatile products have nematocidal activity is still unknown. This study focused on identification of non-volatile nematocidal metabolites from Panebacillus polymyxa KM2501-1. [Methods] Strain KM2501-1 was fermented to collect supernatant. The high purity nematocidal substance was isolated and purified by silica gel column chromatography and high-performance liquid chromatography. The structure of the nematocidal substance was identified by liquid chromatography-mass spectrometry and nuclear magnetic resonance. [Results] The fermentation filtrate of Panebacillus polymyxa KM2501-1 inhibited Meloidogyne incongnita and the egg hatching of Meloidogyne incongnita. The nematocidal efficiency was 87.66% in vitro and the egg hatching inhibitory efficiency was 92.26%. The results of structural identification showed that the nematocidal active substance produced by Panebacillus polymyxa KM2501-1 was cyclo (Pro-Phe). The nematocidal efficiency of 800 mg/L cyclo (Pro-Phe) was up to 84.75% after 96 hours exposure. Microscopic observations show that the intestinal tissue of the Meloidogyne incongnita treated with the cyclo (Pro-Phe) was disordered compared with the control group. [Conclusion] The cyclo (Pro-Phe) produced by Panebacillus polymyxa KM2501-1 is a new nematocidal substance that may inhibit nematodes by destroying the nematode intestinal tract.
Keywords: Panebacillus polymyxaMeloidogyne incognitanematicidal activitycyclo (Pro-Phe)
植物寄生线虫(plant-parasitic nematodes)是一类专性植物寄生病原线虫,对农业经济作物的生产造成巨大的经济损失,每年由植物寄生线虫在世界范围内造成的经济损失约1500亿美元[1]。根结线虫被认为是危害最严重的植物病原线虫[2],能够在包括小麦、番茄、黄瓜、花生等在内的3000多种植物体内寄生。据估算,根结线虫导致我国各类蔬菜每年可减产30%以上,造成的损失超过5亿美元[3]。随着规模化集约农业的快速发展,根结线虫病害频发,严重威胁蔬菜和作物生产,影响农民增收,成为制约我国蔬菜和重要经济作物可持续发展的突出问题。
化学防治是目前应用最为广泛的根结线虫防治方法,但是化学农药的大量使用也带来了环境、安全等多方面的问题,如农药残留、对人畜和自然环境的危害、长期施用作用效果减弱等。特别是2009年哥本哈根会议后,对于低碳环保的倡导,许多高毒性的化学杀线虫剂如溴甲烷、灭线磷等开始被列入淘汰计划甚至禁用[4]。农林业发展迫切需要绿色、环保、具有可持续性的杀线虫剂,近年来,生物防治根结线虫技术由于绿色环保、高效等特点,成为研究的热点,已经有一些微生物及其代谢产物被发现具有较好的线虫防治效果,譬如一些芽胞杆菌可以产生一些次级代谢产物杀死线虫[5],还有其他一些细菌如鼠疫杆菌可以通过产生一些生物膜阻止线虫摄食并杀死线虫[6],但是新的生物杀线虫剂数量少且效果不稳定,无法满足市场需要,急需开发新的生物来源的线虫防治制剂。
多粘类芽胞杆菌是一种常见的土壤细菌,属于植物根际促生菌(plant growth promoting rhizobacteria,PGPR),可以产生一些促进植物生长激素释放或者通过固氮、溶磷和促进钾的吸收起到促进植株生长的作用[7],多粘类芽胞杆菌还可以产生如多粘菌素、杀镰孢菌素等抑制细菌和真菌的抗生素[8-9]。但是关于多粘类芽胞杆菌防治线虫的报道较少,本课题组前期研究发现多粘类芽胞杆菌KM2501-1可以产生抑菌蛋白[10]和一些挥发性杀线虫物质[11],但是对多粘类芽胞杆菌KM2501-1非挥发性杀线虫代谢产物的化学结构及杀虫机理尚未开展研究。本研究通过高效发酵获得多粘类芽胞杆菌KM2501-1非挥发性杀线虫代谢产物,进一步通过硅胶柱层析和高效液相色谱分离纯化目标产物,并利用液相色谱-质谱联用和核磁共振技术对其结构进行解析,以期为进一步挖掘高效的根结线虫防治药物资源提供理论和技术依据。
1 材料和方法 1.1 材料
1.1.1 菌株: 多粘类芽胞杆菌KM2501-1由本课题组利用KMB培养基[12]从江西省湖口县有机复合污染毛茛根际土壤分离得到。菌体发酵采用KMB液体培养基振荡培养(28 ℃,180 r/min) 48 h,8000 r/min离心10 min收集发酵上清液备用。
1.1.2 主要仪器和试剂: 其中核磁共振分析采用德国布鲁克Bruker Avance III 600 MHz高分辨液体核磁共振波谱仪,质谱分析采用美国安捷伦Agilent 6540液质联用系统,高效液相色谱仪采用日本岛津公司LC-20A,色谱半制备柱采用上海月旭科技股份有限公司Welch Ultimate XB-C18 column (10 μm,10×150 mm),色谱分析柱采用美国安捷伦科技公司TC-C18 column (5 μm,4.6 mm×250 mm),乙腈(色谱纯)采购自北京迈瑞达科技有限公司,其余分析级生化试剂均购自国药集团。
1.2 南方根结线虫饲养和二龄幼虫的制备 南方根结线虫由南京农业大学李红梅教授提供。采用常规方法育苗,将萌发的种子种植在营养土中,当番茄苗长出3–4片真叶时将其移入土沙比为1:1的砂壤土花盆中,每盆移栽1株番茄。取制备好的根结线虫二龄幼虫悬浮液,每盆接种约2000头幼虫。在温室内培养,40–55 d后,病株产生大量根结线虫卵块时,拔出番茄植株,用清水洗去根部泥土,用解剖针挑取单个卵囊,放入2 mL装离心管内,加入适量蒸馏水多次洗涤,在20 ℃恒温培养箱中孵化。收集孵化5 d内的二龄期南方根结线虫幼虫备用。
1.3 南方根结线虫离体活性检测 用96孔板进行线虫离体生物活性测定实验,每孔加入120 μL过滤除菌后的样品、2 μL浓度为30 mg/mL的氯霉素和30–40头新鲜的二龄期南方根结线虫;每个样品设置3个重复,菌体发酵上清液采用发酵培养基(KMB培养基)为空白对照,环二肽cyclo (Pro-Phe)纯品采用溶剂无菌水为空白对照,20 ℃温箱培育,一段时间后观察并统计根结线虫死亡率,实验重复3次。
1.4 对南方根结线虫卵囊孵化的抑制实验 用96孔板进行卵囊孵化抑制实验,向96孔板中各加入200 μL不同浓度的多粘类芽胞杆菌KM2501-1发酵上清液、2 μL浓度为30 mg/mL的氯霉素和一个卵囊轻微破损的根结线虫卵块;每个样品设置7个重复,并用KMB培养基作空白对照,将96孔板盖好,并用封口膜密封;将96孔板置于25 ℃温箱培育,在48 h时观察并统计每孔孵化出线虫数。实验重复3次。
1.5 正相硅胶柱层析分离纯化 向菌体KM2501-1发酵上清液加入等体积乙醇混匀后4 ℃静置过夜,离心收集上清液并旋蒸浓缩,对浓缩成分进行硅胶柱层析。共进行3次正相硅胶柱层析,第一次正相硅胶柱层析采用乙酸乙酯、石油醚和甲醇梯度洗脱法,设置3个洗脱梯度,洗脱溶剂配比依次为1:1:0、1:0:1和0:0:1;第二次正相硅胶柱层析采用乙酸乙酯和甲醇作为洗脱体系,设置7个梯度进行洗脱,洗脱溶剂比例依次为1:0、20:1、5:1、1:1、1:5、1:20、0:1;第3次正相硅胶柱层析采用二氯甲烷/甲醇作为洗脱体系,设置6个梯度进行洗脱,洗脱溶剂比例依次为50:1、20:1、5:1、1:1、1:3、1:10。每个比例的洗脱剂冲洗1–2个柱体积。收集各个组分的洗脱液并追踪各组分杀线虫活性,采用杀线虫活性最强的组分进行下一步的分离纯化。
1.6 高效液相色谱分析 半制备高效液相色谱分离以20%乙腈/水溶液(V/V)作为流动相,检测波长为210 nm,进样量100 μL,流速3 mL/min。分析高效液相色谱采用20%乙腈/水溶液(V/V)作为流动相,检测波长为210 nm,进样量为10 μL,流速为1 mL/min。
1.7 液相-质谱联用(LC-MS)检测 将分离纯化的杀线虫活性物质,经分析高效液相色谱验证纯度后,冷冻干燥后用去离子水溶解后过滤除菌,采用Agilent 6540液质联用系统对该活性物质进行液相色谱-飞行时间质谱初步鉴定。LC-MS的参数设置为:正离子源ESI,检测波长210 nm,进样体积2 μL,流速0.3 mL/min,单样品运行时长20 min,载气温度325 ℃,干燥气流4 L/min,毛细管电压4000 V,四级杆通过离子m/z 50–1800。
1.8 核磁共振(NMR)分析 以重甲醇为溶剂溶解冷冻干燥后的杀线虫活性物质纯品,采用德国布鲁克Bruker Avance III 600 MHz高分辨液体核磁共振波谱仪分析活性物质数据,Topspin软件包(Bruker, Rheinstetten,Germany)用于NMR数据采集和处理。
1.9 相关公式 线虫死亡率(%)=死亡线虫数量/线虫总数×100%
1.10 数据统计 采用SPSS 17.0软件进行数据处理和方差分析,结果显示为“平均值±标准差”。并使用独立样本t检验进行实验组和对照组之间的差异显著性分析,显著水平为0.05,**表示实验组与对照组相比P < 0.01,***表示实验组与对照组相比P < 0.001。
2 结果和分析 2.1 多粘类芽胞杆菌KM2501-1体外抑制南方根结线虫活性结果 多粘类芽胞杆菌KM2501-1杀线虫活性检测结果显示,与KMB培养基相比,不同浓度的多粘类芽胞杆菌KM2501-1发酵上清液都有很好的触杀南方根结线虫活性,且随着浓度的升高,杀线虫活性逐渐增强,其中多粘类芽胞杆菌KM2501-1发酵上清原液的杀线虫效果最好,48 h线虫死亡率高达87.66% (图 1-A)。并且不同浓度的多粘类芽胞杆菌KM2501-1发酵上清液对南方根结线虫卵孵化也有很好的抑制效果,其中多粘类芽胞杆菌KM2501-1发酵上清原液和1/4原液的抑制效果最为显著,48 h抑制根结线虫卵孵化效果分别为92.26%和65.01% (图 1-B)。这些结果说明多粘类芽胞杆菌KM2501-1发酵上清液含有高效杀线虫活性物质,值得进一步深入研究其生物活性及化学结构。
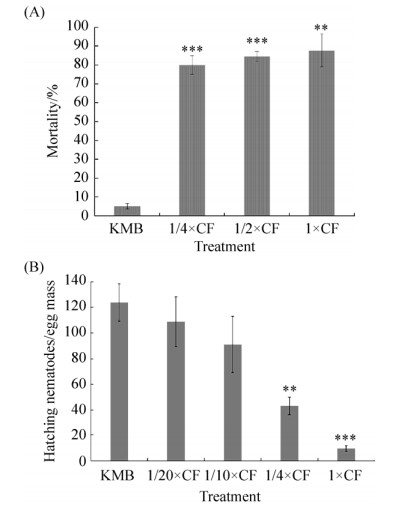 |
| 图 1 不同浓度多粘类芽胞杆菌KM2501-1发酵上清液(Culture filtrate, CF) 48 h触杀南方根结线虫活性(A)和抑制南方根结线虫卵孵化活性(B)结果 Figure 1 The nematicidal activity (A) and inhibitory effects on the egg hatching of M. incognita (B) after 48 h exposure on the culture filtrate of Paenibacillus polymyxa KM2501-1 in different concentrations. |
| 图选项 |
2.2 杀线虫活性物质的分离纯化结果 对多粘类芽胞杆菌KM2501-1发酵上清液中杀线虫活性物质进行分离纯化和杀线虫活性跟踪,经过3次正相硅胶柱层析后,对杀线虫活性最好的组分进行半制备高效液相色谱分析,结果如图 2-A所示,活性物质主要有8个物质峰。
 |
| 图 2 正相硅胶柱层析后杀线虫活性组分(A)及活性组分P7(B)高效液相色谱分析图谱 Figure 2 The high performance liquid chromatography of nematicidal compound after normal phase silica gel column chromatography (A) and nematicidal compound P7 (B). |
| 图选项 |
对P1–P8分别进行半制备柱回收并进行杀线虫活性检测,除P1没有明显杀线虫活性外,其他7个组分都有一定的触杀南方根结线虫活性,其中活性组分P7的杀线虫活性最强,1000 mg/L的P7组分48 h杀线虫效果高达90.48%,因此对活性组分P7进行大量制备,对纯化后的活性物质P7进行高效液相色谱分析,结果如图 2-B所示,活性物质P7的分析图谱除在2 min左右出现一个溶剂峰外,只在8–9 min有一个物质峰,说明P7的纯度较高,可以利用其进行结构鉴定。
2.3 杀线虫活性物质的结构鉴定结果 利用LC-MS技术对纯化后的杀线虫活性物质纯品进行检测分析。图 3-A为杀线虫活性物质P7的一级质谱图,其中质荷比为245.11和267.12的碎片占比例最高,因为使用的是正离子模式,因此在活性物质的碎片上很有可能加上一个H+、Na+或者K+,根据结果推测活性物质[M+H]+(m/z)为245.11,[M+Na]+(m/z)为267.12,所以杀线虫活性物质的分子量为244.11 Da,根据软件预测其分子式为C14H16N2O2。
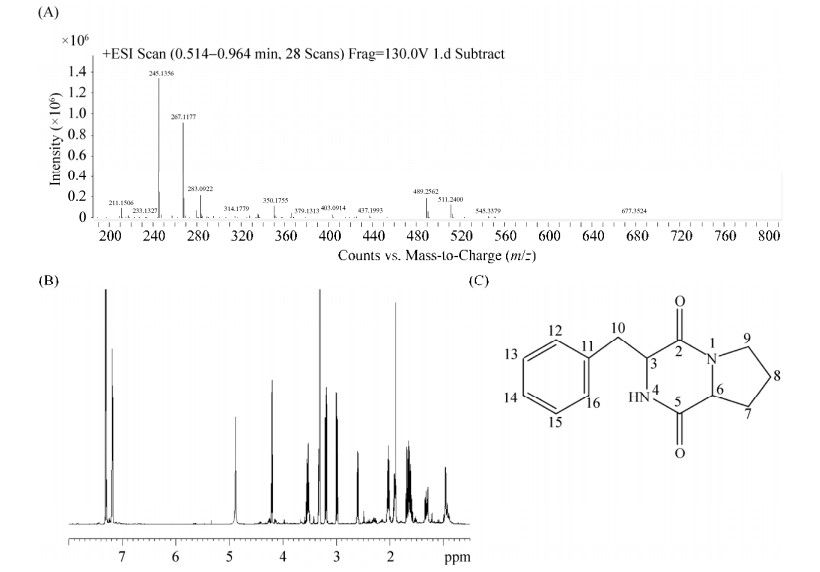 |
| 图 3 杀线虫活性组分P7质谱图谱(A),核磁共振一维谱图(B)及化学结构图(C) Figure 3 The mass spectrogram (A), 1H-NMR (B), and Structure (C) of nematicidal compound P7. |
| 图选项 |
进一步利用核磁共振分析,结合质谱结果探究杀线虫活性物质的化学结构。活性物质核磁共振一维谱如图 3-B所示,有机分子中氢原子化学环境的种类由图谱中特征峰的数目所决定;而不同化学环境氢原子的数目比则根据特征峰的高度比决定。并根据杀线虫活性物质的一维氢谱和碳谱对具体数据进行了初步的解析,具体数据如表 1所示。
表 1. 杀线虫活性物质P7的核磁共振数据 Table 1. The NMR date of nematicidal compound P7
| Atom | 1H | Proton group | Multiplicity | J value | 13C |
| 3 | 4.20 | C3H | t | 4.7 | 60.0 |
| 6 | 2.60 | C6H | dd | 10.8, 6.3 | 59.3 |
| 7 | 2.03 | C7H | m | – | 30.1 |
| 1.67 | C7H′ | m | – | 30.1 | |
| 8 | 1.91 | C8H | m | – | 22.7 |
| 1.62 | C8H′ | m | – | 22.7 | |
| 9 | 3.53 | C9H | m | – | 46.4 |
| 3.31 | C9H′ | m | – | 46.4 | |
| 10 | 3.20 | C10H | dd | 13.7, 4.8 | 41.2 |
| 2.99 | C10H′ | dd | 13.7, 4.7 | 41.2 | |
| 12 | 7.2 | C12H | m | – | 131.5 |
| 13 | 7.31 | C13H | m | – | 129.6 |
| 14 | 7.31 | C14H | m | – | 129.6 |
| 15 | 7.31 | C15H | m | – | 129.6 |
| 16 | 7.2 | C16H | m | – | 131.5 |
表选项
根据该活性物质的质谱、核磁共振分析结果,可以推测菌株KM2501-1中杀线虫活性物质的分子量为244 Da,分子式为C14H16N2O2,化学结构为cyclo (Pro-Phe),该化合物是由脯氨酸和苯丙氨酸环化形成的环二肽,化学结构如图 3-C所示。
2.4 杀线虫活性物质cyclo (Pro-Phe)触杀南方根结线虫活性结果 利用分离纯化得到的杀线虫活性物质cyclo (Pro-Phe)进行杀线虫活性检测,结果如表 2所示,与水处理组相比,不同浓度的cyclo (Pro-Phe)都具有较好的杀线虫活性,且随着处理浓度升高和处理时间增长,其杀线虫效果逐渐增强,其中800 mg/L的cyclo (Pro-Phe)处理96 h后线虫死亡率高达84.75%。
表 2. 环二肽cyclo (Pro-Phe)对根结线虫活性测定 Table 2. Nematicidal activity against Meloidogyne incognita of cyclo (Pro-Phe) in different concentrations
| Concentration/ (mg/L) | Mortality/% | ||
| 48 h | 72 h | 96 h | |
| 0 | 3.33±0.78 | 6.67±1.42 | 6.67±1.42 |
| 200 | 8.82±2.57 | 29.41±5.42 | 41.18±6.14 |
| 800 | 40.68±3.76 | 66.10±5.83 | 84.75±7.35 |
表选项
800 mg/L的杀线虫活性物质cyclo (Pro-Phe)作用于南方根结线虫,24 h后南方根结线虫的活性逐渐减弱,活动幅度变小,肠道开始变模糊(图 4-B),72 h后线虫大量死亡且肠道出现断裂(图 4-C);而对照组无菌水处理的南方根结线虫活性良好,活动幅度大,并且肠道呈现清晰的明暗相间的规则形态(图 4-A)。根据线虫肠道的形态变化,cyclo (Pro-Phe)可能是作用于南方根结线虫的肠道导致线虫的死亡。
 |
| 图 4 无菌水(A)和800 mg/L环二肽cyclo (Pro-Phe)处理南方根结线虫24 h (B)及72 h (C)后线虫的形态变化 Figure 4 Morphological changes of the Meloidogyne incognita treated with (A) ddH2O, or 800 mg/L cyclo (Pro-Phe) after 24 h (B) and 72 h (C). |
| 图选项 |
3 讨论 多粘类芽胞杆菌KM2501-1发酵上清液具有很好的体外抑制南方根结线虫活性和抑制根结线虫卵孵化活性,通过分离纯化和结构鉴定发现其可以产生杀线虫活性物质cyclo (Pro-Phe)。本课题组前期研究发现多粘类芽胞杆菌KM2501-1可以产生2-壬酮等8种挥发性杀线虫活性物质且有很好的根结线虫温室防治效果[11]。多粘类芽胞杆菌KM2501-1可以通过触杀、抑制卵孵化、熏杀、影响线虫趋化性等多模式抑制根结线虫,可以产生cyclo (Pro-Phe)、2-壬酮等9种杀线虫活性物质,还有部分杀线虫活性产物(P6和P8等)的结构尚未解析,因此多粘类芽胞杆菌KM2501-1是一株非常有潜力的生防菌株。且多粘类芽胞杆菌是一类植物根际促生菌,具有促进植物生长的作用,因此多粘类芽胞杆菌KM2501-1具有开发成杀线虫制剂的潜力。
环二肽又称二肽酸酐、2, 5-二酮哌嗪或者2, 5-二氧哌嗪,是由两个氨基酸通过肽键缩合反应环化而成的一类相对简单的化合物,是结构最为简单的一种肽类物质。环二肽是蛋白质及多肽常见的水解产物,广泛存在于自然界中,在动植物、原生动物、真菌及细菌等生物体中都有发现[13]。环二肽类物质具有多种生物活性,一些环二肽具有抑菌效果[14],有些环二肽还可以作为抗癌药物,可以通过促进癌细胞的凋亡来杀死癌细胞[15]。近些年的研究发现有一些微生物产生的环二肽类物质还具有杀线虫活性[16-17]。本研究发现多粘类芽胞杆菌KM2501-1可以代谢产生杀线虫新功能的环二肽cyclo (Pro-Phe),尽管环二肽cyclo (Pro-Phe)已有相关文献报道其结构和部分生物功能,有报道发现cyclo (Pro-Phe)对斑点矢车菊(Spotted knapweed)具有一定的植物毒性[18],同时对大肠杆菌(Escherichia coli)、枯草芽胞杆菌(Bacillus subtilis)和金黄色葡萄球菌(Staphylococcus aureus)显示出抗菌活性[19],创伤弧菌产生的cyclo (Phe-Pro)可以介导NF-κB途径来抑制寄主的先天免疫反应[20],但目前尚未发现其在杀线虫活性方面的报道。因此本研究为首次发现环二肽cyclo (Pro-Phe)具有良好的杀线虫活性,200 mg/L和800 mg/L的cyclo (Pro-Phe)杀线虫效率分别高达41.18%和84.75%,具有防治根结线虫的潜力,进一步扩充了杀线虫药物资源。
本研究发现环二肽cyclo (Pro-Phe)作用后的线虫肠道紊乱,说明其可能通过破坏根结线虫的肠道杀死线虫,是首次报道环二肽类杀线虫活性物质的杀线虫机制,其具体机制和分子机理需要进一步的深入研究。
References
| [1] | Li J, Zou CG, Xu JP, Ji XL, Niu XM, Yang JK, Huang XW, Zhang KQ. Molecular mechanisms of nematode-nematophagous microbe interactions: basis for biological control of plant-parasitic nematodes. Annual Review of Phytopathology, 2015, 53(1): 67-95. DOI:10.1146/annurev-phyto-080614-120336 |
| [2] | Jones JT, Haegeman A, Danchin EGJ, Gaur HS, Helder J, Jones MGK, Kikuchi T, Manzanilla-López R, Palomares-RiusJE, Wesemael WML, Perry RN. Top 10 plant-parasitic nematodes in molecular plant pathology. Molecular Plant Pathology, 2013, 14(9): 946-961. DOI:10.1111/mpp.12057 |
| [3] | 段玉玺. 植物线虫学. 北京: 科学出版社, 2011. |
| [4] | Zhang N. Status and analysis of nematicides registered in China. Pesticide Science and Administration, 2017, 38(7): 23-30. (in Chinese) 张楠. 我国杀线虫剂登记现状及问题分析. 农药科学与管理, 2017, 38(7): 23-30. DOI:10.3969/j.issn.1002-5480.2017.07.004 |
| [5] | Du CY, Cao SY, Shi XY, Nie XT, Zheng JS, Deng Y, Ruan LF, Peng DH, Sun M. Genetic and biochemical characterization of a gene operon for trans-Aconitic acid, a novel nematicide from Bacillus thuringiensis. Journal of Biological Chemistry, 2017, 292(8): 3517-3530. DOI:10.1074/jbc.M116.762666 |
| [6] | Fang HH, Liu L, Zhang YQ, Yang YY, Yan HF, Ding XJ, Han YP, Zhou DS, Yang RF. BfvR, an AraC-family regulator, controls biofilm formation and pH6 antigen production in opposite ways in Yersinia pestis biovar microtus. Frontiers in Cellular and Infection Microbiology, 2018, 8: 347. DOI:10.3389/fcimb.2018.00347 |
| [7] | Grady EN, MacDonald J, Liu LD, Richman A, Yuan ZC. Current knowledge and perspectives of Paenibacillus: a review. Microbial Cell Factories, 2016, 15(1): 203. DOI:10.1186/s12934-016-0603-7 |
| [8] | Shoji JI, Kato T, Hinoo H. The structure of polymyxin T1. Journal of Antibiotics, 1977, 30(12): 1042-1048. DOI:10.7164/antibiotics.30.1042 |
| [9] | Kajimura Y, Kaneda M. Fusaricidin A, a new depsipeptide antibiotic produced by Bacillus polymyxa KT-8: Taxonomy, fermentation, isolation, structure elucidation and biological activity. Journal of Antibiotics, 1996, 49(2): 129-135. |
| [10] | Wang ML, Cheng WL, Yu C, Zhang JB. Screening of bacteria against Mycobacterium smegmatis and preliminary study on its active substance. Chemistry & Bioengineering, 2016(4): 41-45. (in Chinese) 王茂淋, 程万里, 余晨, 张吉斌. 抗耻垢分枝杆菌菌株的筛选及活性物质的初步研究. 化学与生物工程, 2016(4): 41-45. DOI:10.3969/j.issn.1672-5425.2016.04.011 |
| [11] | Cheng WL, Yang JY, Nie QY, Huang D, Yu C, Zheng LY, Cai MM, Thomashow LS, Weller DM, Yu ZN, Zhang JB. Volatile organic compounds from Paenibacillus polymyxa KM2501-1 control Meloidogyne incognita by multiple strategies. Scientific Reports, 2017, 7(1): 16213. DOI:10.1038/s41598-017-16631-8 |
| [12] | Yang JY, Cheng WL, Zeng L, Huang D, Cai MM, Zheng LY, Yu ZN, Zhang JB. Optimization of fermentation culture medium and fermentation conditions of Paenibacillus polymyxa KM2501-1 against phytopathogenic nematodes. Chemistry & Bioengineering, 2018, 35(6): 25-31. (in Chinese) 杨景艳, 程万里, 曾立, 黄典, 蔡珉敏, 郑龙玉, 喻子牛, 张吉斌. 抗植物病原线虫的多粘类芽胞杆菌KM2501-1发酵培养基和发酵条件优化. 化学与生物工程, 2018, 35(6): 25-31. |
| [13] | Brauns SC, Milne PJ, Naudé RJ, van de Venter M. Selected cyclic dipeptides inhibit cancer cell growth and induce apoptosis in HT-29 colon cancer cells. Anticancer Research, 2004, 24(3A): 1713-1720. |
| [14] | Begum AS, Basha SA, Raghavendra G, Kumar MVN, Singh Y, Patil JV, Tanemura Y, Fujimoto Y. Isolation and characterization of antimicrobial cyclic dipeptides from Pseudomonas fluorescens and their efficacy on sorghum grain mold fungi. Chemistry & Biodiversity, 2014, 11(1): 92-100. |
| [15] | Nishanth Kumar S, Dileep C, Mohandas C, Nambisan B, Ca J. Cyclo(D-Tyr-D-Phe): a new antibacterial, anticancer, and antioxidant cyclic dipeptide from Bacillus sp. N strain associated with a rhabditid entomopathogenic nematode. Journal of Peptide Science, 2014, 20(3): 173-185. |
| [16] | Guo J, Jing XP, Peng WL, Nie QY, Zhai YL, Shao ZZ, Zheng LY, Cai MM, Li GY, Zuo HY, Zhang ZT, Wang RR, Huang D, Cheng WL, Yu ZN, Chen LL, Zhang JB. Comparative genomic and functional analyses: unearthing the diversity and specificity of nematicidal factors in Pseudomonas putida strain 1A00316. Scientific Reports, 2016, 6: 29211. DOI:10.1038/srep29211 |
| [17] | Zhai YL, Shao ZZ, Cai MM, Zheng LY, Li GY, Yu ZN, Zhang JB. Cyclo(L-Pro-L-Leu) of Pseudomonas putida MCCC 1A00316 isolated from Antarctic soil: Identification and characterization of activity against Meloidogyne incognita. Molecules, 2019, 24(4): 768. DOI:10.3390/molecules24040768 |
| [18] | Stierle AC, Cardellina JH Ⅱ, Strobel GA. Maculosin, a host-specific phytotoxin for spotted knapweed from Alternaria alternata. Proceedings of the National Academy of Sciences of the United States of America, 1988, 85(21): 8008-8011. DOI:10.1073/pnas.85.21.8008 |
| [19] | Wang GH, Dai SK, Chen MJ, Wu HB, Xie LW, Luo XM, Li X. Two diketopiperazine cyclo(pro-phe) isomers from marine bacteria Bacillus subtilis sp. 13-2. Chemistry of Natural Compounds, 2010, 46(4): 583-585. DOI:10.1007/s10600-010-9680-8 |
| [20] | Kim K, Kim NJ, Kim SY, Kim IH, Kim KS, Lee GR. Cyclo(Phe-Pro) produced by the human pathogen Vibrio vulnificus inhibits host innate immune responses through the NF-κB pathway. Infection and Immunity, 2015, 83(3): 1150-1161. DOI:10.1128/IAI.02878-14 |
