黎秋玲1, 李敏1, 严志宏2, 张庆华1, 陶俊恒1, 李汉广1


1. 江西农业大学, 生物科学与工程学院, 江西农业微生物资源开发与利用工程实验室/江西省菌物资源保护与利用重点实验室, 江西 南昌 330045;
2. 江西中医药大学, 江西 南昌 330004
收稿日期:2019-10-30;修回日期:2020-01-16;网络出版日期:2020-03-26
基金项目:国家自然科学基金项目(21466014);江西省教育厅科学研究项目(GJJ160388);江西省研究生创新专项资金项目(YC2018-S198);江西农业大学博士启动基金(9232305387)
*通信作者:李汉广, E-mail:hanguangli@jxau.edu.cn.
摘要:[目的] 筛选具有较快生长速率及较强产油能力的微藻,探究所获得微藻的生理生化性能及不同培养方式对其生物量、产油能力、碳消耗等生长特性的影响与藻种对pH的适应能力。[方法] 通过磷酸香草醛测定法及尼罗红染色对微藻进行初筛复筛,通过设置光合自养、异养和混养等3种培养方式,并采用气质联用等方法,研究不同培养方式对所获微藻生长特性、所产油脂脂肪酸组成以及碳代谢等方面的影响。[结果] 筛选出两株产油能力较强的藻株H、Z8,其油脂产量分别可达1.14±0.05 g/L和1.33±0.10 g/L,经形态观察和分子生物学鉴定初步表明藻株H属布朗单针藻(Chlorolobion braunii)、藻株Z8属链带藻(Desmodesmus intermedius)。构建了不同培养方式下微藻动力学模型,H、Z8属于生长偶联型。当培养环境的pH处于6.0-9.0,对藻株H、Z8的总脂量与生物量无明显差异(P < 0.05)。[结论] 筛选获得的藻株H、Z8中C16与C18脂肪酸占总脂肪酸的比率能达到90%以上。藻种在混养条件下生物量积累优于异养,但异养条件下更加有利于油脂的积累,且H、Z8均具有较为宽泛的pH适应能力,是具有一定产业化应用潜力的优良产油藻株。
关键词:微藻动力学参数油脂含量脂肪酸测定
Screening of oleaginous microalgae and assessment of its oil producing capability
Qiuling Li1, Min Li1, Zhihong Yan2, Qinghua Zhang1, Junheng Tao1, Hanguang Li1


1. College of Bioscience and Engineering, Jiangxi Agricultural University, Jiangxi Engineering Laboratory for the Development and Utilization of Agricultural Microbial Resources, Jiangxi Key Laboratory for Conservation and Utilization of Fungal Resources, Nanchang 330045, Jiangxi Province, China;
2. Jiangxi University of Traditional Chinese Medicine, Nanchang 330004, Jiangxi Province, China
Received: 30 October 2019; Revised: 16 January 2020; Published online: 26 March 2020
*Corresponding author: Hanguang Li, E-mail:hanguangli@jxau.edu.cn.
Foundation item: Supported by the National Natural Science Foundation of China (21466014), by the Jiangxi Provincial Department of Education Science Research Project (GJJ160388), by the Jiangxi Provincial Graduate Innovation Special Fund Project (YC2018-S198) and by the Jiangxi Agricultural University Doctoral Start Fund (9232305387)
Abstract: [Objective] The purposed of this study is to obtain some microalgae with fast growth and high oil producing ability. In addition, the effects of different culture methods on microalgae growth characteristics such as biomass, oil producing capacity and carbon consumption, and the adaptation of strains to pH were studied. [Methods] The method of phosphoric acid-vanillin reaction and Nile Red staining was used for obtaining some oleaginous microalgae. At the same time, different culture methods such as photoautotrophy, heterotrophy and mixotrophy, were studied by using GC-MS technique. [Results] Two strains of H and Z8, which could produce 1.14±0.05 g/L and 1.33±0.10 g/L total lipid, respectively, were obtained. According to the results of morphological observations and 18S rDNA analysis, strains H and Z8 had the highest homology with Chlorolobion braunii and Desmodesmus intermedius, so the strains were identified as Chlorolobion braunii H and Desmodesmus intermedius Z8. Furthermore, H and Z8 belonged to the growth coupling type based on the results of the kinetic model. There was no significant difference in the total lipid and biomass between H and Z8 when the pH value was between 6.0 and 9.0 (P < 0.05). The percentage of C16 and C18 fatty acids in total fatty acid from the strains H and Z8 was more than 90%. The biomass from mixotrophy was better than heterotrophy, but it was more conducive to lipid accumulation under heterotrophic conditions. Furthermore, the strains of H and Z8 have a wide pH adaptability. [Conclusion] These results indicate that the two strains are excellent potential lipid-producing strains.
Keywords: microalgaekinetic parameterslipid contentfatty acid analysis
随着传统化石燃料的日益枯竭,以及世界经济发展对能源需求的逐年增加,寻找一种可替代化石燃料的新型能源物质是解决世界能源需求的关键所在[1-2]。与化石能源相比,生物柴油作为一种较为成功的可替代传统化石燃料的能源物质,其温室气体排放更少、燃料供应来源更广。因此,寻找分布较广、数量庞大、成本低廉的油脂原料已成为生物柴油产业研究的热点。要想加快发展微藻生物能源技术,获得高油脂含量及生长快速的藻种是目前微藻生物质能源产业化必经途径之一。Taleb等[3]开发了一套新的微藻筛选程序:高效高产光生物反应器的快速预筛选和在平板光生物反应器中的深度筛选,他们通过该筛选方式获得了细胞脆性较高的凯氏小球藻(Parachlorella kessleri UTEX2229)和微拟球藻(Nannochloropsis gaditana CCMP527),以此两株微藻为生产藻株,在光生物反应器中三酰甘油的生产力达到2.7×10–3 kg/(m2·d)和2.3×10–3 kg/(m2·d)。Hugo等[4]利用荧光激活细胞分选(fluorescence activated cell sorting,FACS)法分离出一株富含脂质的绿藻(Tetraselmis sp. CTP4),当以CTP4为生产藻株,通过缺氮两步法进行培养,最终藻株中油脂含量达到33%,其脂肪酸成分中含有少量双键的多不饱和脂肪酸(占总脂肪酸含量的25.67%),这种特点能够满足大多数国家制订的生物柴油标准。Nitta等[5]基于胞内蛋白定位和来自大型种群的细胞间相互作用,利用智能图像激活细胞分选技术(intelligent image-activated cell sorting,IIACS)对低CO2诱导蛋白异常定位的莱茵衣藻突变体进行了分类。该方法能够将直径范围在3–30 μm的各种微藻细胞的胞内化学分布及形态特征进行智能区分,从而提高微藻选育的效率。因此,通过不同筛选方法获得产油性能优良的藻株是克服微藻生物柴油工业化障碍的重要方法。
为丰富产油微藻的藻种资源,本研究通过磷酸香草醛测定法及尼罗红染色方法快速分离筛选得到两株具有较强产油能力的微藻H、Z8,同时构建了两种藻株在不同培养方式的动力学模型,并研究了不同pH调控下的微藻生物量、总脂量、叶绿素含量等方面的变化情况,同时初步探究了其高产油脂的内在生理特性。通过本研究的开展,可为微藻生物柴油的藻种选育及提高其产油性能提供一定的理论及实验参考。
1 材料和方法 1.1 高产油藻株的分离纯化 本实验所用水样采自江西农业大学校园及附近水域以及福建省泰宁县世界地质公园上清溪流域,富集培养后,取100 μL水样涂布于BG-11培养基[6-7]中进行分离。(27±1)℃条件下培养20 d后挑取单藻在固体平板上划线分离,直至水浸片法镜检得到单一藻细胞,纯化后转移至50 mL异养BG-11培养基种进行异养培养。
1.1.1 自养培养: 以10%的接种量将对数生长期的藻液接种于BG-11培养基中,置于光照强度为3600 lux、12 h:12 h光照黑暗循环,于120 r/min、温度(27±1)℃条件下培养。
1.1.2 异养培养: 以10%接种量接种对数生长期的藻液于BG-11异养培养基中(将Na2CO3换成15 g/L葡萄糖,使其作为唯一碳源),于120 r/min、温度(27±1)℃下培养,摇床中避光培养。
1.1.3 混合培养: 以10%的接种量接种对数生长期的藻液于添加15 g/L葡萄糖的BG-11培养基中,其他培养条件与自养相同。
在微藻培养过程中,取稳定期藻液,使用尼罗红染色法进行活体染色,将染色后的藻液用正置荧光显微镜(Nikon ECLIPSE 50i)对藻细胞内部的油脂颗粒进行观察,具体步骤如下:取100 μL稳定期藻液,添加100 μL的尼罗红染料,振荡混匀后于20 ℃黑暗处理3 min,然后用正置荧光显微镜于蓝光激发光下观察细胞内染色油脂形态,初步确定高产油脂藻株。
1.1.4 高脂藻株的复筛: 将初步确定为高产油脂的藻株在200 mL的异养培养基中进一步扩大培养7 d,使用磷酸香草醛比色法对微藻进行复筛[8-9]。取5 mL藻液,于4000 r/min条件下离心10 min,弃去上清液用蒸馏水洗涤1–2次,定容至5 mL。加2 mL 18 mol/L的H2SO4,沸水浴10 min,然后常温水浴5 min。取具塞试管加5 mL的磷酸香草醛溶液,振荡均匀,37 ℃水浴15 min,然后常温水浴10 min,通过观察颜色的深浅变化筛选出高产油性能的藻株。
1.2 分子生物学鉴定[10] 取对数生长期的藻液,离心后将下层藻泥置于另一离心管中,使用新型植物基因组DNA提取试剂盒(北京康为世纪生物科技有限公司)提取微藻的总DNA。藻种采用18S rDNA通用引物(g01:5′-CACCTGGTTGATCCTGCCAG-3′和g07:5′-AGCTTGATCCTTCTGCAGGTTCACCTAC-3′) (Beijing TsingKe Biotech Co.Ltd),PCR反应条件[11]如下:95 ℃预变性5 min;15×[95 ℃变性1 min;65 ℃退火30 s (每循环一次下降1 ℃);72 ℃延伸1 min];20×[95 ℃变性1 min;50 ℃退火30 s;72 ℃延伸1 min];72 ℃延伸10 min;将已获得PCR扩增片段于4 ℃条件下保存备用。用1.0%的琼脂糖凝胶电泳检测扩增产物,将正确大小条带切胶回收并进行测序(由Beijing TsingKe Biotech Co.Ltd完成)。比对得到正确序列后,提交NCBI数据库进行Blast比对分析,鉴定种属信息采用软件MEGA7.0构建进化树进行遗传分析。
1.3 碳源对微藻产油能力的影响 分别将15 g/L的碳源(葡萄糖、糖蜜、糊精、可溶性淀粉、D-麦芽糖、蔗糖、甘油、半乳糖、木糖、甘露醇)作为唯一的碳源加入到BG-11培养基中,接入10%种子液,进行异养培养,培养168 h后测定生物量及总脂量。
1.4 不同pH条件对微藻生长的影响 采用1 mol/L HCl与NaOH将BG11异养培养基的pH分别调至4.0、5.0、6.0、7.0、8.0、9.0、10.0等7个梯度,用0.22 μm滤膜过滤除菌后分装至已灭菌的500 mL三角瓶中,按10%接种量进行接种,(27±1)℃条件下培养168 h,分析不同pH梯度对生物量、总脂量及叶绿素含量的影响。
1.5 富油微藻动力学模型 在微藻生长产油过程中,基质(葡萄糖)的消耗主要可分为3个部分,即:构成藻体主要成分、维持藻体生长代谢以及合成脂类物质。根据细胞生长动力学Logistic模型、通用模型Leudeking-piret及Luedeking-piret修正模型[12-13],对微藻的产油过程中的生物量、总脂量以及总糖消耗的动力学进行分析,模拟培养过程中微藻生长、总脂量以及总糖消耗同时间之间的关系。
1.6 油脂提取方法 采用改良氯仿甲醇提取法[14]:取1 g冷冻干燥的藻粉,加入适量石英砂研磨至细粉,然后加入一定量的低浓度盐酸沸水浴一定时间,室温下用氯仿-甲醇(V/V,2:1)提取1 h,充分浸提2次。离心后取氯仿层(下层)于离心管中将锥形瓶放置60 ℃烘箱中烘干至恒重,称重计算油脂含量(公式1)或总脂量(公式2)。
 | 公式(1) |
 | 公式(2) |
1.8 脂肪酸成分分析 皂化处理:称取10 mg藻油,添加1.5 mL 7.5% (W/V) KOH/CH3OH,于70 ℃热水中水浴4 h。
甲酯化:加入1 mL HCl/CH3OH (1:1,V/V)和1 mL 14% BF3/CH3OH,于70 ℃热水中水浴1.5 h进行甲酯化,冷却至室温,加入0.5 mL 0.9% NaCl溶液和2 mL正己烷,4000 r/min离心5 min,取上层正己烷溶液(用氮气吹干),继续使用2 mL色谱级正己烷重新溶解,0.22 μm有机滤膜过滤,封口待测[16]。
使用Agilent 7890/5975C型气相色谱-质谱联用仪对微藻脂肪酸成分分析,所用色谱柱为30 m× 0.25 mm×0.25 μm毛细管柱(HP-5MS)对照数据库,识别峰,计算峰面积[17]。
2 结果和分析 2.1 产油微藻的形态鉴定 按1.1所示方法对采集到的水样进行分离纯化,最终获得42株藻株,将其转移至异养培养后,通过分析藻株形态、细胞干重及产油能力等,共获得了10株生长较快或油脂含量相对较高的藻株(表 1、图 1),通过藻体外形观察发现藻株的细胞形态主要呈球形、梭形及马蹄形,外表颜色呈浅绿色、绿色,色素体呈杯状或片状等;同时结合《中国淡水藻类-系统、分类及生态》对10株微藻进行初步分类鉴定,发现所获得的微藻主要分布于绿藻门(Chlorophyta)。
表 1. 藻种编号及培养特性 Table 1. The serial number and culture's characteristic of microalgae
| Strains | Species | Size/μm | Biomass/(g/L) | Total lipid/(g/L) | Lipid content/% | Culture characteristics |
| X6/L4 | Chlorella | 13.40±0.73 | 4.91±0.59 | 0.77±0.12 | 15.56±0.59 | Smooth, dark green, easy to dissolve, not easy to settle |
| H | Chlorolobion braunii | 12.27±2.26 | 4.06±0.35 | 1.14±0.05 | 28.78±3.31 | Smooth, dark green, extremely soluble, easy to settle |
| Z8/C/B | Desmodesmus intermedius | 14.99±2.01 | 3.79±0.83 | 1.14±0.53 | 32.83±10.36 | Smooth, dark green, extremely soluble, easy to settle |
| X11/X2 | Chlorella | 4.22±1.43 | 2.22±0.18 | 0.62±0.12 | 27.64±3.22 | Smooth, dark green, extremely soluble, easy to settle |
| Y25 | Kirchneriella | 6.25±1.32 | 1.03±0.08 | 0.25±0.04 | 24.17±2.01 | Smooth, light green, easy to dissolve and settle |
| L8 | Monoraphidium | 14.53±0.93 | 1.96±0.12 | 0.47±0.03 | 24.10±3.01 | Rough, dark green, easy to dissolve and settle |
表选项
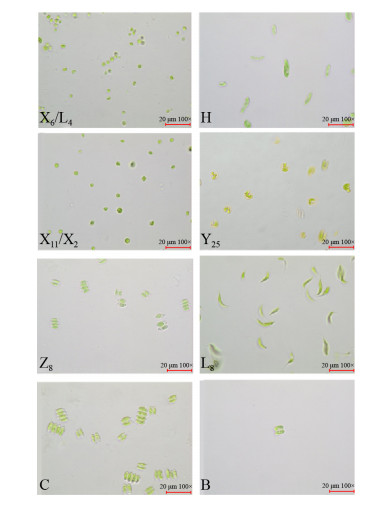 |
| 图 1 部分藻种光学显微镜图片 Figure 1 Several microalgae under light microscope. The letters in the picture are the serial numbers of the strains, indicating different types of microalgae. |
| 图选项 |
从表 1可知,X11、X2、Y25与L8的含油量较高,但是其生物量较低,从而导致它们的总产油量反而不高;X6、L4的含油量相对较低,但是其生物量大,使其总脂量相对提高,但是其产油能力仍无法与H、Z8、C与B相比。从上述可知,产油能力较强的藻种分别是H、Z8、C与B。
尼罗红是一种具有较强荧光特性的疏水性染料,能够与脂类物质结合,在特定波长的激发下发出强烈的橙黄色或红色荧光[18]。将产油能力较强的H、Z8、C与B进行尼罗红染色,从微观结构上观察油脂颗粒。染色后的荧光显微镜图片如图 2所示,H、Z8在蓝光下发出较明亮的黄色荧光,可较为清晰地看到细胞内明亮的油脂颗粒,而与Z8同属的C、B荧光显微镜图片未观察到强烈荧光。综合考虑待定藻株的生物量、总脂量等信息,本研究后续实验将采用藻株H、Z8进行。
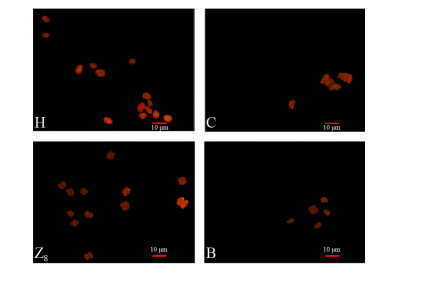 |
| 图 2 微藻尼罗红染色效果 Figure 2 The effect of microalgae's Nile red staining. The letters in the picture are the serial numbers of the strains, indicating different types of microalgae. |
| 图选项 |
2.2 分子生物学鉴定 以藻种DNA为模板,通过扩增、测序得到不同藻种18S rDNA基因序列,然后登陆NCBI数据库与将所得基因序列与已有的同源序列进行BLAST比对,并利用MEGA7.0软件进行多序列同源性比对,同时绘制出系统发育树(图 3)。结果显示H、Z8与布朗单针藻(Chlorolobion braunii)和链带藻(Desmodesmus intermedius)高度相似,H的DNA序列同KT833591.1 Chlorolobion braunii的部分片段相似度高达100%,Z8的DNA序列同KJ616760.1 Desmodesmus intermedius的部分片段相似度高达99.35%,属于栅藻属Scenedesmus的亚属Desmodesmus中的一种。因此,通过18S rDNA分子生物学鉴定可知H和Z8分别属于布朗单针藻(MK920311.1)和链带藻(MN137876.1)。
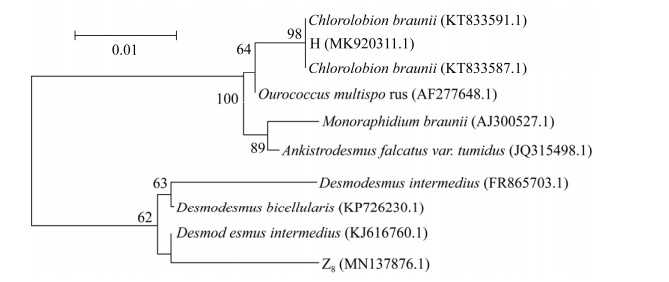 |
| 图 3 基于18S rDNA基因序列构建的系统发育树 Figure 3 Phylogenetic tree constructed for strains based on 18S rDNA gene sequences homology. Evolutionary distances showed in the figure were calculated by MEGA7.0; 0.1 substitution per nucleotide. Numbers in parentheses represent the sequences accession number in GenBank. The number at each branch points is the percentage supported by bootstrap. |
| 图选项 |
2.3 不同碳源对藻株生长的影响研究 在培养基中添加有机碳源,可促进微藻的生长和提高细胞内物质的含量[19]。为研究不同碳源对藻株H、Z8生长的影响,本实验通过改变异养BG-11培养基中碳源类型,探究碳源对藻株H、Z8的生长影响,实验结果如表 2所示。H利用不同碳源生成油脂的产量高低依次是葡萄糖 > 糖蜜 > 糊精 > 可溶性淀粉 > D-麦芽糖 > 蔗糖 > 甘油 > 半乳糖 > 木糖 > 甘露醇。Z8组利用不同碳源合成油脂的产量高低依次是葡萄糖 > 糊精 > 可溶性淀粉 > 蔗糖 > 甘油(其余碳源对Z8的培养与自养培养相比未起到促进作用)。对比两组对碳源的利用情况可知,两株藻异养培养中最佳碳源均是葡萄糖,此时藻株H和Z8的总脂量分别可达1.14±0.05 g/L和1.33±0.10 g/L。因此可以得出,培养液中添加葡萄糖可以提升H、Z8的生长性能。
表 2. 碳源同化结果 Table 2. The results of carbon source assimilation
| Carbon sources | H | Z8 | |||
| Biomass/(g/L) | Total lipid/(g/L) | Biomass/(g/L) | Total lipid/(g/L) | ||
| D-glucose | 4.06±0.35 | 1.14±0.05 | 5.39±0.11 | 1.33±0.10 | |
| Sucrose | 0.82±0.03 | 0.20±0.01 | 1.10±0.10 | 0.16±0.00 | |
| D-(+)-Maltose | 1.36±0.08 | 0.21±0.00 | - | - | |
| Glycerol | 0.80±0.09 | 0.15±0.02 | 0.26±0.02 | 0.08±0.00 | |
| Dextrin | 1.43±0.10 | 0.23±0.00 | 2.71±0.09 | 0.30±0.00 | |
| α-Lactose | 0.69±0.03 | 0.15±0.01 | - | - | |
| D(+)-Xylose | 0.95±0.05 | 0.14±0.00 | - | - | |
| Starch Soluble | 1.53±0.05 | 0.26±0.04 | 2.20±0.07 | 0.20±0.00 | |
| D-Mannitol | 0.74±0.01 | 0.13±0.01 | - | - | |
| Molasses | 2.35±0.09 | 0.48±0.01 | - | - | |
| “-” Indicates that the carbon source has no positive effect on its biomass/total lipid compared with autotroph. | |||||
表选项
2.4 不同pH条件对微藻生长的影响 从图 4、5可知,在本实验所设定的pH范围内,H、Z8的生物量变化趋势变化极小(P > 0.05)。具体而言,总脂量均随着pH的增大先升高再下降,H与Z8的最佳pH分别为7.0和6.0,在此条件下油脂的具体产量分别为0.82 g/L和0.79 g/L。pH的变化对H、Z8中叶绿素a、b有一定的影响,叶绿素的含量变化会影响微藻细胞捕捉和利用光的能力,同时也影响了光能在叶绿体中的分配[20]。在本研究中,叶绿素a含量随着pH的增大,呈现先上升后下降的趋势,与产油变化趋势一致;在pH为7.0时,H、Z8叶绿素a含量达到最大,此时H与Z8的叶绿素a含量分别达到67.11 μg/mL和6.38 μg/mL。叶绿素b含量随着pH的增大先上升后下降,在pH为7.0时,H、Z8叶绿素b含量达到最大34.62 μg/mL和2.28 μg/mL。因此,上述实验数据表明培养基的pH对叶绿素含量的影响较大。
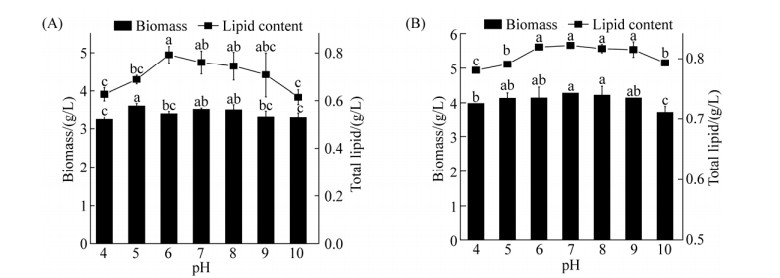 |
| 图 4 不同pH对微藻产油及生物量的影响(A:Z8、B:H) Figure 4 The effect of different pH on lipid content and biomass of microalgae. A: the effect of pH on the biomass and total lipids of Z8. B: the effect of pH on the biomass and total lipids of H. The error bar represents the standard deviation of three parallel samples. And "a, b, c, d, e" in the figure indicates significance. |
| 图选项 |
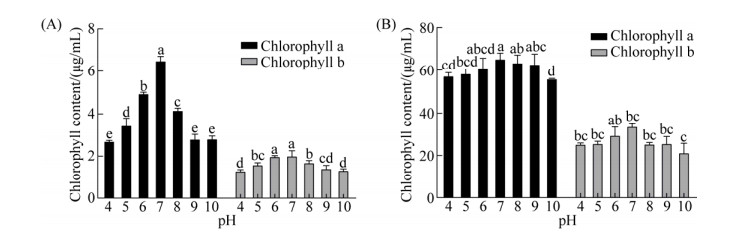 |
| 图 5 不同pH对微藻叶绿素含量的影响(A:Z8、B:H) Figure 5 The effect of different pH on chlorophyll content of microalgae. A: the effect of pH on the chlorophyll content of Z8. B: the effect of pH on the chlorophyll content of H. The error bar represents the standard deviation of three parallel samples. And "a, b, c, d, e" in the figure indicates significance. |
| 图选项 |
2.5 脂肪酸成分分析 作为理想的生物柴油,所含油脂中的脂肪酸需具有较长的碳直链、尽可能少的碳支链,含有较少双键且含有一定的O元素,分子中不含有芳香烃结构[21]。利用GC-MS对藻株H、Z8中的全部脂肪酸成分进行分析,其结果如表 3和图 6所示。
表 3. 两种富油微藻脂肪酸成分 Table 3. Fatty acid composition of two microalgae strains
| Fatty acid composition | Strains | |
| Z8 | H | |
| C16:0 | 29.54±0.40 | 34.10±0.1.27 |
| C18:0 | 3.12±0.01 | - |
| C18:1 | 35.28±0.07 | 36.14±0.49 |
| C18:2 | 14.60±0.57 | 20.36±0.69 |
| C18:3 | 9.30±0.28 | - |
| Others | 8.16±0.08 | 9.40±1.13 |
| “-” Indicates that the fatty acid component doesn’t exist and the fatty acids in the table are relative percentages. | ||
表选项
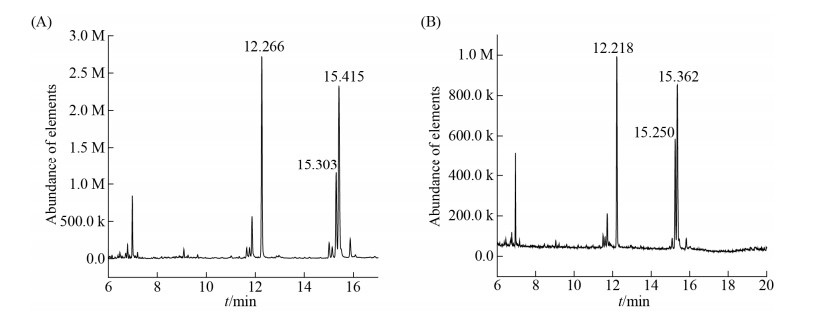 |
| 图 6 微藻脂肪酸成分色谱图(A:Z8;B:H) Figure 6 The fatty acid composition of two microalgae strains. "A" means the fatty acid composition of Z8. "B" means the fatty acid composition of H. The peak at 12.218–12.266 min is C16:0; the peak at 15.250–15.303 min is C18:2; the peak at 15.362–15.415 min is C18:1. |
| 图选项 |
从表 3和图 6可知,H、Z8的C16和C18相对脂肪酸含量占总脂肪酸的比率分别为90.6%和91.84%。从脂肪酸甲酯的总量来看,脂肪酸甲酯含量变化依次为十八碳烯酸甲酯(C18:1)、棕榈酸甲酯(C16:0)及亚油酸甲酯(C18:2),占H和Z8中的全部脂肪酸甲酯的比例分别是36.14%、34.10%、20.36%和35.28%、29.54%、14.60%。
2.6 不同培养方式下微藻生长动力学曲线 为探究H、Z8的最佳培养方式及对应的生长特性,分别对H、Z8进行自养、异养及混养培养。根据实际油脂产量及理论μm、QP max及QS max,分析H和Z8产油过程中的生物量、糖含量及总脂量的变化。
从图 7可知,H、Z8虽然种属不同,但在0– 168 h内不同培养方式下的代谢变化趋势基本保持一致。与异养和混养方式相比,自养方式生长周期较长,在0–168 h内H、Z8生物量和总脂量没有明显增长,在此阶段其生物量和总脂量的变化趋势较平缓。在异养与混养方式下,在0–36 h期间,H、Z8处于延滞期,藻细胞生长缓慢,总脂量没有明显增加,培养体系中的葡萄糖消耗较少;在微藻对数生长期间(36–120 h),体系中的葡萄糖快速下降,总脂量急剧增加(几乎与细胞生长同步);在120–168 h,体系中的葡萄糖浓度趋于0,H、Z8的异养生长进入稳定期,而混养却仍然有小范围增长。在微藻培养过程中,混养培养的H、Z8在生物量上均高于异养培养的微藻,而总脂量异养培养的H、Z8高于混养培养。在整个培养过程中,油脂合成与微藻生长变化趋势一致,异养和混养条件下的生长曲线均呈“S”型特征。表明藻细胞生长与其油脂合成的关系可能属于生长偶联型或生长部分偶联型。
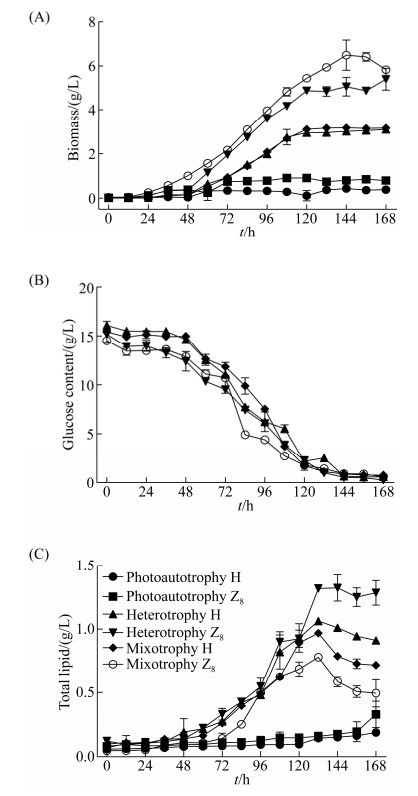 |
| 图 7 不同培养条件下的代谢参数 Figure 7 Biomass, glucose content and lipid content under different culture conditions. A: the growth characteristics of biomass of H and Z8 under the three culture modes of photoautotrophy, heterotrophy and mixotrophy. B: the change of total lipid of H and Z8 under the three culture modes. C: the change of the remaining sugar content of H and Z8 under the three culture modes. The error bar represents the standard deviation of three parallel samples. |
| 图选项 |
2.7 动力学模型拟合求解与检验 通过Logistic、Leudeking-piret及Luedeking- piret修正模型,将图 5中的实验数据进行分析,采用Origin9.0软件对实验数据进行非线性拟合,得出的各参数值、初始值及R2如表 4所示。
表 4. 动力学参数模拟值 Table 4. The value kinetic parameter simulation
| Parameter | Heterotrophy H | HeterotrophyZ8 | Mixotrophy H | Mixotrophy Z8 |
| X0/(g/L) | 0.0100 | 0.0360 | 0.0072 | 0.0964 |
| Xmax/(g/L) | 3.1053 | 5.1691 | 3.2295 | 6.4375 |
| μm/h | 0.0680 | 0.0605 | 0.0709 | 0.0492 |
| R12 | 0.9955 | 0.9954 | 0.9977 | 0.9922 |
| α | 79.5220 | 22.6464 | 111.1910 | 18.2142 |
| β | 1.5832×10–6 | –4.4934×10–6 | –9.9011×10–7 | 1.0980×10–5 |
| P0 | 0.0776 | 0.0045 | 0.0814 | 0.0673 |
| QP max/h | 5.4075 | 1.3701 | 7.8857 | 0.8961 |
| R22 | 0.9558 | 0.9014 | 0.9375 | 0.9610 |
| k1 | 0.0087 | –0.0059 | 8.3251×10–4 | 0.0052 |
| k2 | 4.1442 | 2.6518 | 4.0144 | 2.3248 |
| S0 | 15.4885 | 14.3660 | 15.3392 | 14.0560 |
| QS max/h | 0.2905 | 0.1545 | 0.2847 | 0.1196 |
| R32 | 0.9869 | 0.9795 | 0.9900 | 0.9895 |
表选项
通过表 4可知,利用Logistic方程对实验值进行非线性拟合,能较好地描述各类藻的生长情况,拟合的相关系数R2都在0.90以上。不同培养方式下,H的μmax均比Z8的值更大,说明H在不同培养条件下的生长适应性、生长速度及生长潜力均优于Z8。
如表 4所示,对于所有试验组,α、β均不等于零,但α,β值均较低,甚至为负值,且产物生成相关系数α显著高于非生长相关系数β。另外,根据实验数据可知,微藻生长的稳定期基本没有油脂生成,模型拟合的非零值应该是实验误差和模型本身造成的。H无论在异养还是混养条件下,最大油脂比生成速率QP max的值都比Z8同等情况下更大。
利用Ludedeking-Piret修正方程对实验值进行非线性拟合,能较好地描述各类藻的糖耗情况。H与Z8在不同培养条件下,异养条件下底物比消耗速率QS max略大于混养条件下的值。当经过168 h异养培养时,H与Z8的生物量分别达到3.09 g/L和5.39 g/L,总脂量分别达1.06 g/L和1.32 g/L,生物量分别可达自养培养方式的8.13倍和6.0倍,混合培养的0.97倍和0.83倍,总脂量分别达自养的4.01倍和5.67倍,混合培养的1.63倍和1.10倍。该结果表明,虽然混合培养结合自养与异养的优势,使微藻的生物量在培养过程中占据优势,但在异养方式培养下,更有利于微藻H与Z8进行脂质的合成。
3 讨论 根据现有的研究结果,油脂含量较高的藻种主要分布在绿藻门(Chlorophyta)、硅藻门(Bacillariophyta)和金藻门(Chrysophyta)。为获得产油性能优良的藻种,丰富微藻生物柴油的藻种资源。本研究从所采集的样品中分离纯化出42株微藻藻种,通过多重筛选最终选育出两株油脂含量较高的藻株H和Z8,经显微形态观察与18S rDNA分子生物学鉴定表明,H和Z8分别为布朗单针藻和链带藻。尼罗红染色后可在荧光显微镜下看到明显的亮黄色油滴,证明他们是高脂藻种,且H与Z8油脂含量为25%–40%,远高于原始CTP4藻株油脂含量(10%)。同时通过GC-MS分析发现,H和Z8均具有较高的单不饱和脂肪酸,其中C18:1的含量均占总脂的35%以上,远超过CTP4藻株中的单不饱和脂肪酸(25.67%)在总脂肪酸的比率[4]。本文筛选获得的高产油脂藻株H与Z8的生物量和油脂含量分别为3.79–4.06 g/L和28.78%–32.83%,在产油微藻筛选方面很多科研工作者也作出了大量、高效的工作,如郝宗娣、江丽丽等[10, 22]也筛
选出产油能力较高的微藻,其生物量与油脂含量分别为1.6–2.25 g/L和29.49%–39.7%,本论文首先通过尼罗红染色对收集的样品进行快速筛选,该方法可在短时间内将所获微藻的产油脂情况作出快速判别,然后通过磷酸香草醛测定法将初步确定为高产油脂的藻株作进一步的复筛,最终获得了藻株H与Z8,其生物量与油脂产量与郝宗娣、江丽丽等[10, 22]相比有均较大的提高。添加碳源对微藻细胞的生理和代谢可产生较大影响,能使整个细胞处于比较活跃的生理状态。H与Z8具有较为宽泛的碳源利用能力,此特性对进一步开发微藻H与Z8作为生物柴油生产藻株具有重要意义。环境适应性强是作为高脂微藻的另一重要性能,发酵过程中的pH值对微藻产油有一定的影响,适宜的pH有利于微藻油脂积累。微藻工业化培养过程中所需水量较大,较大的需水量使其与工农生产及日常生活等用水产生竞争关系。本研究中所获得的藻株H、Z8对pH有较为宽泛的适应能力,表明该藻株具有一定的耐酸碱能力,从而降低了微藻培养过程中对水的质量要求,也增加了其利用工农业或生活等废水的可能性。微藻根据自身不同生长属性以及对光源与营养成分的不同需求,可分为光自养、异养和混养三种培养方式[23],在自养条件下微藻的油脂含量一般高于异养与混养,但其生物量往往较高,且生长周期较长[24],因此,与异养、混养条件相比没有时间和成本优势。本研究所获得的藻株H与Z8在异养培养168 h后,生物量与总脂量分别达到3.0–5.0 g/L和1.0–1.5 g/L,其生物量与总脂量分别是同样培养环境下自养培养的6–8倍和4–6倍。另一方面,根据H与Z8在不同培养方式下的细胞生长、油脂生成和底物消耗的变化规律,并采用动力学模型(Logistic、Luedeking Piret以及Luedeking-Piret修正方程)对其进行建模,结果表明微藻H与Z8的油脂合成是生长偶联型,且异养条件下油脂的积累优于混养。Lang等[25]研究发现能适应异养培养的微藻种类较少,且异养模式下会抑制一些光诱导的代谢产物如光合色素等的合成,从而影响微藻品质,但在异养条件下H与Z8都未对产油造成影响,且比较混养与自养,异养培养的产油能力更高。这表明异养条件下H与Z8具有较强的油脂生产潜力。
综上所述,通过尼罗红染色及磷酸香草醛比色法从所采集的样品中分离获得了两株生长速度快、产油能力高的微藻株H和Z8,经显微形态观察与18S rDNA分子生物学鉴定,表明H与Z8分别为布朗单针藻(Chlorolobion braunii)和链带藻(Desmodesmus intermedius),含有较丰富的C16与C18脂肪酸。从Logistic和Ludeking-Piret动力学模型可知H、Z8是生长偶联型,混养条件下有利于微藻生物量的积累,异养条件下能够促进脂类的合成。同时H、Z8具有较为宽泛的pH适应能力。本研究结果对丰富微藻藻种资源及微藻培养偶联环境污染防治的可行性提供了有益的前期探索。
References
| [1] | Sung YJ, Kim JYH, Choi HI, Kwak HS, Sim SJ. Magnetophoretic sorting of microdroplets with different microalgal cell densities for rapid isolation of fast growing strains. Scientific Reports, 2017, 7(1): 10390. DOI:10.1038/s41598-017-10764-6 |
| [2] | Arunachalam Sivagurulingam AP, Sivanandi P, Pandian S, Arumugamurthi SS, Sircar A. Optimization and kinetic studies on biodiesel production from microalgae (Euglena sanguinea) using calcium methoxide as catalyst. Energy Sources, Part A: Recovery, Utilization, and Environmental Effects, 2019, 41(12): 1497-1507. DOI:10.1080/15567036.2018.1549124 |
| [3] | Taleb A, Kandilian R, Touchard R, Montalescot V, Rinaldi T, Taha S, Takache H, Marchal L, Legrand J, Pruvost J. Screening of freshwater and seawater microalgae strains in fully controlled photobioreactors for biodiesel production. Bioresource Technology, 2016, 218: 480-490. DOI:10.1016/j.biortech.2016.06.086 |
| [4] | Pereira H, Gangadhar KN, Schulze PSC, Santos T, de Sousa CB, Schueler LM, Custódio L, Malcata FX, Gouveia L, Varela JCS, Barreira L. Isolation of a euryhaline microalgal strain, Tetraselmis sp. CTP4, as a robust feedstock for biodiesel production. Scientific Reports, 2016, 6: 35663. DOI:10.1038/srep35663 |
| [5] | Nitta N, Sugimura T, Isozaki A, Mikami H, Hiraki K, Sakuma S, Iino T, Arai F, Endo T, Fujiwaki Y, Fukuzawa H, Hase M, Hayakawa T, Hiramatsu K, Hoshino Y, Inaba M, Ito T, Karakawa H, Kasai Y, Koizumi K, Lee S, Lei C, Li M, Maeno T, Matsusaka S, Murakami D, Nakagawa A, Oguchi Y, Oikawa M, Ota T, Shiba K, Shintaku H, Shirasaki Y, Suga K, Suzuki Y, Suzuki N, Tanaka Y, Tezuka H, Toyokawa C, Yalikun Y, Yamada M, Yamagishi M, Yamano T, Yasumoto A, Yatomi Y, Yazawa M, Di Carlo D, Hosokawa Y, Uemura S, Ozeki Y, Goda K. Intelligent image-activated cell sorting. Cell, 2018, 175(1): 266-276.e13. DOI:10.1016/j.cell.2018.08.028 |
| [6] | Li XM, Wang MZ, Liao XH, Chen H, Dai YF, Chen BL. Two stages of N-deficient cultivation enhance the lipid content of microalga Scenedesmus sp. Journal of the American Oil Chemists' Society, 2015, 92(4): 503-512. DOI:10.1007/s11746-015-2613-8 |
| [7] | Chi L, Yao CH, Wang Q, Xue S. Using biogas slurry for cultivation of marine microalga Isochrysis zhangjiangensis. Chinese Journal of Bioprocess Engineering, 2016, 14(1): 49-53, 64. (in Chinese) 迟磊, 姚长洪, 王茜, 薛松. 利用沼液培养海洋微藻湛江等鞭金藻. 生物加工过程, 2016, 14(1): 49-53, 64. DOI:10.3969/j.issn.1672-3678.2016.01.009 |
| [8] | Luo W, Gu QY, Zhong XN, Zhou Y, Yu XB. A rapid analysis method for microalgal lipid determination. Food and Fermentation Industries, 2014, 40(12): 165-168. (in Chinese) 罗玮, 顾秋亚, 钟湘南, 周雅, 余晓斌. 1种快速检测微藻油脂的新方法. 食品与发酵工业, 2014, 40(12): 165-168. |
| [9] | Helal GA, Sarhan MM, Abu Shahla ANK, El-Khair EKA. Effects of Cymbopogon citratus L. essential oil on the growth, lipid content and morphogenesis of Aspergillus niger ML2-strain. Journal of Basic Microbiology, 2006, 46(6): 456-469. DOI:10.1002/jobm.200510106 |
| [10] | Hao ZD, Liu PH, Yang X, Zhang S. Screen and identification of tropical freshwater microalgae for lipid production. Acta Hydrobiologica Sinica, 2013, 37(3): 547-552. (in Chinese) 郝宗娣, 刘平怀, 杨勋, 张森. 热带淡水产油微藻的分离筛选与鉴定. 水生生物学报, 2013, 37(3): 547-552. |
| [11] | Don RH, Cox PT, Wainwright BJ, Baker K, Mattick JS. 'Touchdown' PCR to circumvent spurious priming during gene amplification. Nucleic Acids Research, 1991, 19(14): 4008. DOI:10.1093/nar/19.14.4008 |
| [12] | Zhou YC, He YJ, Li LS, Wang MZ, Chen BL, Zheng X. High cell density fermentation of chlorella based on kinetics model. The Chinese Journal of Process Engineering, 2018, 18(3): 624-631. (in Chinese) 周有彩, 何勇锦, 李林声, 王明兹, 陈必链, 郑行. 基于发酵动力学模型的小球藻高密度发酵培养. 过程工程学报, 2018, 18(3): 624-631. |
| [13] | Phisalaphong M, Srirattana N, Tanthapanichakoon W. Mathematical modeling to investigate temperature effect on kinetic parameters of ethanol fermentation. Biochemical Engineering Journal, 2006, 28(1): 36-43. DOI:10.1016/j.bej.2005.08.039 |
| [14] | 胡文军.产油微藻的筛选、鉴定及其培养条件的研究.江南大学硕士学位论文, 2013. |
| [15] | Zhang X, Zhang YP, Lv PD, Cai ZL, Ouyang F. Determination and comparison of chlorophyll content of several seaweeds// National Biochemical Conference, 2000. (in Chinese) 张栩, 张沂萍, 吕培顶, 蔡昭铃, 欧阳藩.几种海藻叶绿素含量的测定与比较//第九届全国生物化工学术会议论文集.天津: 中国化工学会, 2000. |
| [16] | Wang SK, Hu YR, Wang F, Stiles AR, Liu CZ. Scale-up cultivation of Chlorella ellipsoidea from indoor to outdoor in bubble column bioreactors. Bioresource Technology, 2014, 156: 117-122. DOI:10.1016/j.biortech.2014.01.023 |
| [17] | Wang M, Cheng H, Chen SB, Wen SM, Wu X, Zhang DM, Yuan QP, Cong W. Microalgal cell disruption via extrusion for the production of intracellular valuables. Energy, 2018, 142: 339-345. DOI:10.1016/j.energy.2017.10.061 |
| [18] | Hao CC, Liang CW, Shi L. The use of fluorescent Nile red and BODIPY for lipid measurement in microalgae. Journal of Biology, 2017, 34(1): 70-74. (in Chinese) 郝翠翠, 梁成伟, 石蕾. 尼罗红和BODIPY荧光染料在微藻油脂含量测定中的应用. 生物学杂志, 2017, 34(1): 70-74. |
| [19] | Wang XY, Huang XX. Effect of different carbon sources on growth and biochemical composition of Isochrysis galbana. Journal of Shandong Agricultural University (Natural Science Edition), 2016, 47(4): 506-513. (in Chinese) 王星宇, 黄旭雄. 不同碳源对球等鞭金藻生长和细胞组成的影响. 山东农业大学学报(自然科学版), 2016, 47(4): 506-513. DOI:10.3969/j.issn.1000-2324.2016.04.005 |
| [20] | Zhang XD, Duan ZP. Practice of scientific exploration in high school biology teaching based on STEM concept: effects of low temperature and pH on the chlorophyll a and photosynthetic activity of Microcystis. Bulletin of Biology, 2018, 53(12): 39-41. (in Chinese) 章熙东, 段志鹏. STEM理念下的中学生科学探究实践——低温和pH值对微囊藻叶绿素a及光合活性的影响. 生物学通报, 2018, 53(12): 39-41. DOI:10.3969/j.issn.0006-3193.2018.12.013 |
| [21] | Harrington KJ. Chemical and physical properties of vegetable oil esters and their effect on diesel fuel performance. Biomass, 1986, 9(1): 1-17. DOI:10.1016/0144-4565(86)90008-9 |
| [22] | Jiang LL, Wen XB, Geng YH, Mei H, Li YG. A newly selected lipid-rich microalgae strain and ITS molecular identification. Acta Hydrobiologica Sinica, 2013, 37(4): 606-612. (in Chinese) 江丽丽, 温小斌, 耿亚洪, 梅洪, 李夜光. 一株产油微藻的筛选及分子鉴定. 水生生物学报, 2013, 37(4): 606-612. |
| [23] | Chen CY, Yeh KL, Aisyah R, Lee DJ, Chang JS. Cultivation, photobioreactor design and harvesting of microalgae for biodiesel production: a critical review. Bioresource Technology, 2011, 102(1): 71-81. DOI:10.1016/j.biortech.2010.06.159 |
| [24] | Su H, Lü JP, Liu Q, Xie SL, Feng J. Isolation, identification and lipid analysis of an oil-producing Chlorella strain from soil. Acta Hydrobiologica Sinica, 2018, 42(4): 811-818. (in Chinese) 苏杭, 吕俊平, 刘琪, 谢树莲, 冯佳. 一株高脂土壤小球藻的分离鉴定及脂质分析. 水生生物学报, 2018, 42(4): 811-818. |
| [25] | Lang YY, Liu ZY, Xu M, Xie LY, Li RZ. Effects of glucose on photosynthesis and growth of Chloralla sp. HN08. Acta Microbiologica Sinica, 2017, 57(4): 550-559. (in Chinese) 郎筱宇, 刘志媛, 徐梦, 谢灵玉, 李容珍. 葡萄糖对小球藻(Chloralla sp. HN08)光合作用和生长的影响. 微生物学报, 2017, 57(4): 550-559. |
