唐浩琪1,2, 张娜1,2, 孙波1, 梁玉婷1


1. 中国科学院南京土壤研究所, 土壤与农业可持续发展国家重点实验室, 江苏 南京 210008;
2. 中国科学院大学, 北京 100049
收稿日期:2020-03-31;修回日期:2020-04-30;网络出版日期:2020-05-08
基金项目:国家自然科学基金(41877060)
作者简介:梁玉婷, 博士, 中国科学院南京土壤研究所研究员, 博士生导师。于2004年和2009年获得清华大学学士和博士学位; 2007-2010年美国俄克拉荷马大学访问****、博士后。从事土壤微生物学领域的研究, 近年来在土壤微生物功能演替与稳定机制方面取得了较为系统的创新性研究成果。揭示了我国不同气候带典型农田土壤中微生物群落结构特征及碳氮耦合转化、地力提升功能的演变规律等。近年来在ISME J, mBio, Environ Sci Tech, 《土壤学报》等国内外期刊上发表相关论文50余篇。承担国家自然科学优秀青年基金、江苏省****科学基金等, 担任《土壤学报》、Soil Ecology Letters等编委.
*通信作者:梁玉婷。Tel:+86-25-86881568;Fax:+86-25-86881000;E-mail:ytliang@issas.ac.cn.
摘要:[目的] 进一步揭示AMF和根际细菌群落的跨界网络互作,挖掘与作物氮磷利用显著相关的关键微生物类群,揭示关键类群的生态网络特征。[方法] 利用Illumina测序技术对3种典型农田旱地土壤(黑土、潮土和红壤)中AMF和根际细菌群落结构进行分析;构建互作网络并利用偏冗余分析、相关性分析探究了与氮磷利用相关的潜在关键类群。[结果] 3种土壤中AMF与根际细菌均以正相互作用为主。不同土壤中AMF与根际细菌互作关系差异明显,在红壤中跨界互作最为密切,其中球囊霉属真菌(Glomus)与根际细菌中的放线菌(Actinobacteria)和变形菌(Proteobacteria)之间的交互作用最多。而在黑土中主要体现为根际细菌的界内互作。与氮磷利用率显著相关的关键微生物类群主要属于球囊霉属真菌、放线菌和α变形菌。[结论] 典型旱地土壤中AMF与根际细菌的正相互关系对作物氮磷利用有潜在促进作用,关键类群在有机质和养分贫乏的红壤中可能起到更重要的作用。
关键词:丛枝菌根真菌-细菌网络互作氮磷利用关键微生物类群
Effect of interaction between arbuscular mycorrhizal fungi and rhizosphere bacteria in farmland soils on nutrients utilization
Haoqi Tang1,2, Na Zhang1,2, Bo Sun1, Yuting Liang1


1. State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, Jiangsu Province, China;
2. University of Chinese Academic of Sciences, Beijing 100049, China
Received: 31 March 2020; Revised: 30 April 2020; Published online: 8 May 2020
*Corresponding author: Yuting Liang, Tel: +86-25-86881568; Fax: +86-25-86881000; E-mail: ytliang@issas.ac.cn.
Foundation item: Supported by the National Natural Science Foundation of China (41877060)
Abstract: [Objective] The aim of this study is to explore the cross-kingdom microbial network between AMF and rhizosphere bacterial communities, and disentangle the potential keystones related to nutrient utilization. [Methods] Illumina sequencing and CoNet were used to construct the microbial network, and partial redundancy analysis and correlation analysis was used to explore potential keystones. [Results] Positive associations were dominant between AMF and rhizosphere bacteria in the three soil types. The interactions between AMF and bacterial communities varied in the three soils types. Cross-kingdom interactions were highest in Acrisol, mainly between Glomus and Actinobacteria and Proteobacteria. And in Phaeozem the interactions were mainly intra-kingdom interactions among rhizosphere bacteria. The microbial taxa that significantly correlated with nutrient utilization were species from Glomus, Actinobacteria and Alphaproteobacteria. [Conclusion] The positive interrelationship between AMF and rhizosphere bacteria in typical dryland soil has a potential promotion effect on the utilization of nitrogen and phosphorus. The role of keystones in Acrisol with relatively low organic matters and nutrient may be more important.
Keywords: Arbuscular mycorrhizal fungi-bacteria interactionnitrogen and phosphorus use efficiencykey microbial communities
丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)广泛存在于陆地生态系统中,能与大多数的植物根系形成互惠共生体系(Symbiont)[1]。有研究表明,AMF能改变土壤结构和肥力[2]、提高植物适应性[3]、增强植物对养分和水分的吸收利用[4]等。AMF产生的根外菌丝会直接促进根际细菌在土壤中的扩散,增加根际细菌的定殖数量[5]。根际细菌和AMF之间存在协同或竞争关系[6],从而直接或间接影响宿主植物的生长及其对养分的吸收利用。
根际细菌可以通过改善养分状况、抑制病原菌等途径来促进AMF的生长[7],从而提高AMF与宿主植物共生体系在养分贫瘠情况下的抗逆性。低磷条件下,AMF为根瘤菌(Rhizobium)提供磷和其他营养元素,促进根瘤菌的固氮作用[8],提高氮素利用。AMF与细菌也可以协同促进作物对磷的吸收。根际溶磷菌多粘芽孢杆菌(Bacillus polymyxa)可以作为“菌根辅助剂”促进聚丛球囊霉(Glomus aggregatum)的定殖[9]。Zhang等[10]研究也发现同时接种溶磷菌产碱假单胞菌(Pseudomonas alcaligenes)和丛枝菌根真菌(Rhizophagus irregularis),土壤中酸性磷酸酶的活性更高,证明了二者的协同增效作用。另一方面,在养分限制情况下,AMF与根际细菌之间也会存在竞争作用,如AMF可能通过竞争铵态氮而限制氨氧化细菌的生长,抑制氨氧化过程,降低根际硝态氮含量[11]。由于土壤的氮磷转化过程复杂,AMF-细菌互作和作物氮磷利用的关系还需要进一步深入研究。
AMF与细菌交互作用受多种因素的调控,一方面会受到作物和土壤中其他生物的影响,另一方面,也很大程度受到土壤理化性质或耕作、施肥等人为因素的影响。宿主植物在不同生长期内根际分泌物的变化会改变AMF和根际细菌群落结构及互作关系[6]。土壤有机质、pH和质地也会对微生物之间的交互作用产生显著影响,土壤有机质在2%–15%和pH 5–7时土壤生物间的联系最紧密[12]。我国农田土壤分布广泛、类型多样,不同土壤性质和养分可利用性存在较大差异,会影响土壤微生物多样性和群落结构[13]。目前的研究主要针对接种AMF和特定功能类群(根瘤菌,溶磷细菌等)展开,对于不同土壤类型中AMF与根际细菌群落的分子生态网络及其与农田生态系统氮磷利用效率的关系还不明确。
研究不同土壤中AMF与根际细菌的互作关系,识别关键物种,是未来进一步调控微生物跨界互作,促进作物氮磷利用和抗逆性的基础。分子生态网络分析技术是一种基于高通量测序数据,通过数学模型分析微生物群落间潜在互作关系的方法,目前已经广泛应用于土壤生态系统中[14-15]。本研究选取我国3种典型农田旱地土壤(黑土、潮土和红壤),利用16S rDNA和AMF SSU测序,比较了不同土壤类型中AMF与玉米根际细菌的网络交互作用,并进一步挖掘了促进作物氮磷利用的潜在关键微生物类群。
1 材料和方法 1.1 试验设计 本研究选择了我国3种典型农田土壤类型,黑土、潮土和红壤。分别采自黑龙江省海伦农业生态试验站(126°38′ E,47°26′ N),属于半湿润的寒温带季风气候;河南封丘农业生态试验站(114°24′ E,35°00′ N),属于半干旱、半湿润的暖温带季风气候;和江西省鹰潭农业生态试验站(116°55′ E,28°15′ N),属于中亚热带湿润季风气候。试验田于2005年10月开始设置,为了保证气候条件和作物品种的一致,在各地分层(每层20 cm)采集3种土壤的剖面,运至封丘站按原来的土层顺序填装成1.2 m宽×1.4 m长×1 m深的试验小区,周围用水泥墙与环境隔绝。每年6月初种植1季玉米,品种为郑单958,采用雨养,人工定时除草,设置2个处理:(1)不施肥处理(CK),(2)常规施肥处理(NPK),氮磷钾施肥量分别为150 kg/ha,75 kg/ha和60 kg/ha,肥料分别以尿素、(NH4)2HPO4和KCl的形式投入,种植前施底肥(1/2氮肥、全部磷肥和钾肥),玉米大喇叭口期追施剩余的1/2氮肥。每个处理设置3个重复。本研究试验样品于2016年玉米成熟期采集,植株收获后,用土铲将玉米根部挖出,除去抖落下来的土壤(部分用于理化性质分析),将仍粘附在根表面的土壤视为根际土,在实验室无菌条件下,放入50 mL无菌0.9% NaCl溶液搅动5 min,8000×g离心10 min收集土壤,于–80 ℃保存用于微生物测序分析。
1.2 土壤理化性质测定 在玉米秸秆、籽粒和土壤样品收获后尽快进行基本理化性质测定。土壤pH采用玻璃电极测定,水土比2.5:1;土壤有机质采用重铬酸钾容量法测定;全氮测定采用半微量开式定氮法;硝态氮和铵态氮用2 mol/L KCl溶液浸提,流动分析仪测定;碱解氮测定采用碱解扩散法;全磷采用碳酸钠熔融法,速效磷测定采用Olsen-P法,钼锑抗比色测定;全钾用氢氧化钠熔融法,速效钾用醋酸铵浸提,火焰光度法测定。以上分析测定参照《土壤农业化学分析方法》[16]。
1.3 DNA提取和测序 称取–80 ℃保存的18份根际土壤样品(其中包括3种土壤类型,2种处理,每个处理3个重复)各2 g,采用液氮研磨[17]和MO BIO PowerSoil DNA Isolation Kit的DNA提取试剂盒提取土壤中微生物基因组DNA。提取后的DNA进行1% (W/V)琼脂糖凝胶电泳检测DNA片段大小,采用NanoDrop 2000 (Thermo Fisher Scientific,Waltham,MA,USA)测定DNA的浓度及230 nm、260 nm和280 nm波长的吸光值,样品DNA浓度≥20 ng/μL,OD260/OD280=1.8–2.0,OD260/OD230 > 1.8。
将提取的土壤基因组DNA进行聚合酶链式反应(polymerase chain reaction,PCR),对细菌的16S rDNA基因V4-V5高变区片段[18]和AMF的SSU rDNA基因V4区片段[19]进行扩增。引物序列如下:细菌16S rDNA基因V4-V5区的扩增引物序列为515F (5′-GTGCCAGCMGCCGCGG-3′)和907R (5′-CCGTCAATTCMTTTRAGTTT-3′)。AMF SSU rDNA基因V4区的扩增引物序列为AMV4.5NF (5′-AAGCTCGTAGTTGAATTTCG-3′)和AMDGR (5′-CCCAACTATCCCTATTAATCAT-3′)。
扩增后,取2 μL扩增产物用1% (W/V)琼脂糖凝胶电泳检测基因组DNA完整性(电泳条带清晰可见,无明显降解)。每个DNA样品扩增3管重复,将同一样本的PCR扩增产物均匀混合以消除单次扩增的偏向性,并用PicoGreen进行检测定量。合并后的PCR产物用DNA琼脂糖胶回收试剂盒QIAquick Gel Extraction Kit (QIAGEN Sciences,Germantown,MD,USA)进行纯化,并用PicoGreen重新检测定量。根据MiSeqTM Reagent Kit试剂盒(Illumina,San Diego,CA,USA)操作说明,将经过试剂盒纯化回收后的DNA混合物适当稀释并变性以获得8 pmol/L样本DNA文库,然后与等体积的8 pmol/L PhiX (Illumina,San Diego,CA,USA)混合获得混合样本。取600 μL混合后的文库,300循环(2×150配对末端)向文库末端引入read1、read2和特异性Index标签序列。对原始下机数据进行质控和过滤并通过UCHIME提出嵌合体序列。对97%相似水平的OTU代表序列进行分类学统计。细菌16S比对数据库为Silva (Release128http://www.arb-silva.de);AMF比对数据库为MaarjAM database (http://maarjam.botany.ut.ee)。抽平处理后细菌为59870,AMF为67223。
1.4 数据分析 根据测序得到的细菌和真菌的OTU数据,选择在CK和NPK处理中超过80%的样本中出现、相对丰度大于0.1%的OTU,利用Cytoscape软件中的CoNet插件分别构建黑土、潮土和红壤中微生物生态网络。选择4种相关分析方法构建网络,分别为Pearson correlation、Spearman correlation、Bray-Curtis dissimilarity和Kullback-Leibler dissimilarity,选择相关系数绝对值最高的1000条连线。采用Benjamini-Hochberg方法标准化处理相关系数,即校正原有假设检验得到的显著性P值(P-value)。保留满足P < 0.05的相关OTU构建关联网络。利用NetworkAnalyzer工具,获得网络拓扑性质,包括节点数、连接数、网络密度、聚类系数、网络集中度和相邻节点平均个数等。
氮磷养分表观利用率(apparent recovery efficiency of applied nutrients,RE):RE(%)= (U–U0)/F×100%。其中U为施肥区作物收获时地上部的养分吸收量,U0为未施肥区作物收获期地上部的养分吸收量,F代表化肥的投入量。
本文中处理间数据差异显著性分析采用方差分析法(analysis of variance,ANOVA)和Tukey法。物种丰度与氮磷利用率之间的相关性分析在SPSS 22.0中通过曲线拟合完成。多元统计分析利用R_3.4.1 (http://www.R-project.org/)完成,其中,方差分析、偏冗余分析(partial redundancy analysis,pRDA)使用Vegan软件包完成,残差分析使用extremevalues软件包完成。
2 结果和分析 2.1 AMF与根际细菌交互作用 典型旱地土壤玉米根际细菌群落以变形菌门(Proteobacteria)、放线菌门(Actinobaceria)和酸杆菌门(Acidobacteria)占主导,不同类型土壤中细菌群落组成中差异显著,相比黑土和潮土,红壤中放线菌门(36%)和α变形菌纲(11.15%–15.46%)明显占优势(图 1-A)。属水平上黑土、潮土和红壤中优势菌属分别为Gaiella (5.81%–7.60%)、Gp4 (4.91%–7.38%)和类诺卡式属(Nocardioides,5.01%–5.41%)。3种土壤类型的AMF群落优势菌属均为球囊霉属真菌(Glomus) (图 1-B)。
 |
| 图 1 细菌群落组成(门水平) (A)和AMF群落组成(属水平) (B) Figure 1 Bacterial community composition at phylum level (A) and arbuscular mycorrhizal fungal community composition at genus level (B) derived from Illumina sequencing analysis. CK: non-fertilized; NPK: fertilized. |
| 图选项 |
为了探究AMF与根际细菌群落之间的交互作用,进一步构建了AMF与根际细菌的生态网络(图 2-A,表 1)。不同土壤类型中AMF与细菌互作网络存在显著差异。3种土壤中网络密集程度不同,但其网络交互均以正交互作用为主,黑土、潮土和红壤中正连线分别占据了83.9%、95.8%、78.7%。该结果表明AMF与根际细菌可能以协同作用为主。
 |
| 图 2 AMF与细菌群落的互作网络关系 Figure 2 Interaction networks between arbuscular mycorrhizal fungal and bacterial communities. A1, B1 and C1 represent the AMF and bacterial community network in Phaeozem, Cambisol and Acrisol, respectively. The node represents the OTU and the sizes of node are positively correlated with the OTU abundance. A2, B2 and C2 represent the chordal graph of network in Phaeozem, Cambisol and Acrisol, respectively. The outer length is proportional to number of associations among different groups. |
| 图选项 |
表 1. AMF和细菌群落互作网络的拓扑性质 Table 1. Topological properties of co-occurring networks between arbuscular mycorrhizal fungal and bacterial communities
| Network metrics | Phaeozem | Cambisol | Acrisol |
| Number of nodes | 158 | 147 | 181 |
| Number of edges | 354 | 166 | 230 |
| Number of positive interactions | 297 (83.9%) | 159 (95.8%) | 181 (78.7%) |
| Number of negative interactions | 57 (16.1%) | 7 (4.2%) | 49 (21.3%) |
| Network density | 0.029 | 0.015 | 0.014 |
| Clustering coefficient | 0.290 | 0.241 | 0.254 |
| Network centralization | 0.145 | 0.033 | 0.048 |
| Avg. number of neighbors | 4.481 | 2.259 | 2.541 |
表选项
通过比较互作网络里高交互作用的物种,发现在不同类型土壤中起主要作用的物种各不相同(图 2-B)。黑土微生物网络主要体现在放线菌、变形菌和酸杆菌之间的细菌界内互作,其作用关系占比分别为51.7%、46.3%和21.2%。潮土与黑土类似,放线菌、变形菌和酸杆菌,与其他微生物的关系占比分别为32.5%、32.5%和26.5%。而红壤中与各菌属作用关系密切的主要为球囊霉属真菌、放线菌和变形菌,其占比分别为37.0%、34.8%和32.6%。3种土壤中,AMF与根际细菌的跨界互作在红壤中占比最高,在黑土中最低。
网络节点连接度(degree)表示该节点与多少其余节点相连,连接度越高可能意味着该节点在网络中起着更为重要的作用。结果发现3种土壤中物种连接度差异较大(图 3)。黑土中单个物种的连接度最高为27,其在网络中承担的作用关系强度更大,而红壤中和潮土中最高仅为11和7。不同土壤中连接度最高的物种也不相同,黑土、潮土和红壤中分别为类球囊霉属真菌(Paralomus)、粘球菌(Myxococcales)和球囊霉属真菌。
 |
| 图 3 网络中节点连接度分布的残差图 Figure 3 Residual plots with outliers of degree in interaction networks. |
| 图选项 |
2.2 AMF与细菌交互作用和作物氮磷利用的关系 筛选出细菌和AMF中相对丰度大于0.1%的OTU与氮磷利用率进行线性拟合(表 2,图 4),发现与氮素利用显著相关的有球囊霉属真菌中的OTU446和OTU481,与磷素利用显著相关的包括放线菌中的OTU94、OTU12、OTU863和OTU41,α变形菌中的OTU605和球囊霉属真菌中的OTU446、OTU614和OTU361。这些与氮磷利用显著相关的菌属均属于优势菌群。
表 2. 与氮磷利用显著相关的OTUs Table 2. OTUs that significantly correlated with nitrogen and phosphorus utilization
| Nutrients | OTU ID | Correlations | OTU taxonomic classification | ||||||||
| r2 | P | Superkingdom | Phylum | Class | Order | Family | Genus | ||||
| N | OTU446 | 0.248 | 0.035 | Fungi | Glomeromycota | Glomeromycetes | Glomerales | Glomeraceae | Glomus | ||
| OTU481 | 0.228 | 0.045 | Fungi | Glomeromycota | Glomeromycetes | Glomerales | Glomeraceae | Glomus | |||
| P | OTU94 | 0.331 | 0.012 | Bacteria | Actinobacteria | Actinobacteria | Actinomycetales | Nocardioidaceae | Nocardioides | ||
| OTU605 | 0.235 | 0.042 | Bacteria | Proteobacteria | Alphaproteobacteria | Sphingomonadales | Sphingomonadaceae | Sphingomonas | |||
| OTU863 | 0.321 | 0.014 | Bacteria | Actinobacteria | Actinobacteria | Actinomycetales | Nocardioidaceae | Aeromicrobium | |||
| OTU12 | 0.286 | 0.022 | Bacteria | Actinobacteria | Actinobacteria | Actinomycetales | Nocardioidaceae | Nocardioides | |||
| OTU41 | 0.276 | 0.025 | Bacteria | Actinobacteria | Actinobacteria | Actinomycetales | Microbacteriaceae | Agromyces | |||
| OTU446 | 0.465 | 0.002 | Fungi | Glomeromycota | Glomeromycetes | Glomerales | Glomeraceae | Glomus | |||
| OTU614 | 0.428 | 0.003 | Fungi | Glomeromycota | Glomeromycetes | Glomerales | Glomeraceae | Glomus | |||
| OTU361 | 0.531 | < 0.001 | Fungi | Glomeromycota | Glomeromycetes | Glomerales | Glomeraceae | Glomus | |||
| OTU423 | 0.310 | 0.016 | Fungi | Glomeromycota | Glomeromycetes | Glomerales | Glomeraceae | Glomus | |||
表选项
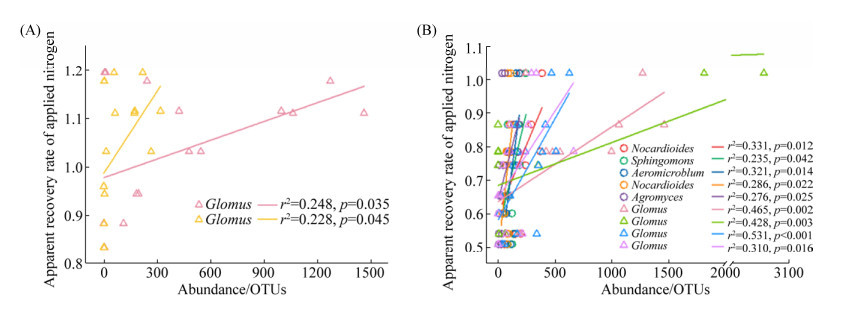 |
| 图 4 AMF与细菌和作物氮(A)、磷(B)表观利用率的关系 Figure 4 The relationships between bacteria, arbuscular mycorrhizal fungi and apparent recovery rate of applied nitrogen (A), and phosphorus (B). |
| 图选项 |
2.3 与氮磷利用相关的关键微生物类群在生态网络中的作用 通过筛选与氮磷利用显著相关的微生物,找出在生态网络中与各菌属的相互作用关系,发现在不同土壤中其互作关系也存在显著差异。与氮素利用显著相关的球囊霉属真菌在红壤中与各菌属联系更多,占比为37.0%,显著高于潮土(15.7%)和黑土(5.1%)。而与磷素显著相关的放线菌则在黑土中与各菌属关系最为密切,连线数占比达到51.7%。球囊霉属真菌在红壤中进入网络的物种数量最多(40),远高于黑土(20)和潮土(19),这可能说明了球囊霉属真菌在红壤中相比黑土和潮土中更为活跃,其交互作用的强度更高(图 5-A)。而放线菌和α变形菌则在黑土中存在着更多的交互作用。放线菌在黑土中进入网络的物种数量为38,最高连接度为16;在红壤中进入网络的物种数量为39,最高连接度为8;在潮土中进入网络的物种数量为24,最高连接度为6 (图 5-B)。α变形菌在黑土、潮土和红壤中进入网络的物种数量分别为17、19、17,最高连接度分别为16、6、7 (图 5-C)。
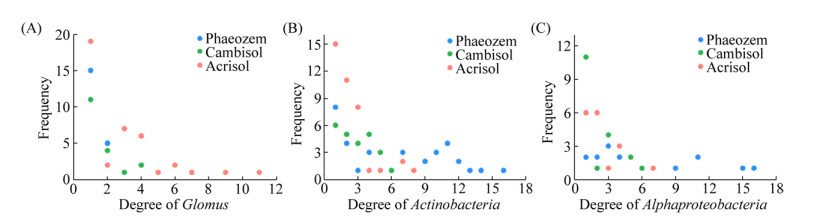 |
| 图 5 球囊霉属(A)、放线菌(B)和α变形菌(C)在网络中节点连接度的频次分布 Figure 5 Frequency distributions of degree of Glomus (A), Actinobacteria (B) and Alphaproteobacteria (C) in networks. |
| 图选项 |
为了探究与氮磷利用显著相关的关键类群在土壤AMF与根际细菌互作网络中的作用,筛选了与这些关键OTU存在交互作用的其他OTU形成了子网络。结果发现黑土中,仅有气氨微菌(Aeromicrobium)与拟杆菌产生了联系(图 6-A);潮土中鞘氨醇单胞菌(Sphingomonas)、气氨微菌(Aeromicrobium)和球囊霉属真菌与其各自同门类物种产生了正相互作用(图 6-B);而红壤的AMF与细菌互作网络中包含的与氮磷利用显著相关的物种最多,包括类诺卡菌(Nocardioides)、鞘氨醇单胞菌(Sphingomonas)、气氨微菌(Aeromicrobium)和球囊霉属真菌,单个物种与其他物种的联系较黑土和潮土中更多(图 6-C)。这说明了球囊霉属真菌可能在红壤中对作物氮磷利用起着更为重要的作用。
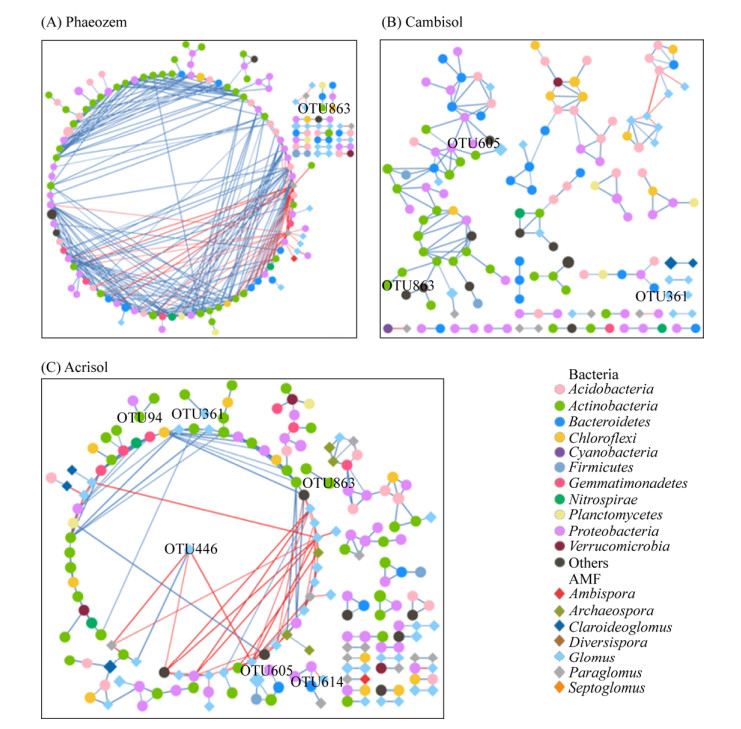 |
| 图 6 与氮磷利用显著相关的关键物种在AMF与细菌互作网络中的作用 Figure 6 The roles in networks of keystones that significantly correlated with nitrogen and phosphorus utilization. Circles represent bacteria and diamonds represent AMF. The sizes of node are positively correlated with OTU abundance. Blue and red lines represent positive and negative interactions, respectively. |
| 图选项 |
3 讨论和结论 根际微生物的活性和相互作用会影响植物的生长和作物氮磷利用[20-21]。本研究基于高通量测序数据和分子生态学网络分析,揭示了根际细菌与AMF群落互作关系,挖掘了典型旱地农田土壤中与氮磷利用相关的关键微生物类群。3种土壤中AMF与根际细菌互作以正相互作用为主(图 2,表 1),与已有研究相似,AMF与细菌之间以协同作用为主[22],这种协同关系可能促进作物对氮磷的吸收和利用。有研究表明同时接种摩西球囊霉(Glomus mosseae)与根际促生菌,如根瘤菌(Bradyrhizobium japonicum)或溶磷细菌(Burkholderia cepacian BAM-6),不但提高了作物的养分吸收利用,也提高了作物的抗逆能力,进而促进宿主植物的生长[22-23]。黑土中根际细菌互作网络最为复杂,而红壤中AMF与细菌群落之间的交互作用比例最高。土壤理化性质会直接影响微生物群落,如细菌生长的pH范围较窄,其群落组成或多样性与土壤pH显著相关[24],红壤属于酸性土壤,根际细菌的组成和多样性不同,其与AMF的交互作用也不同于其他土壤类型;其次,有研究表明土壤养分含量会对AMF与细菌的互作产生一定影响,如低氮处理下,AMF与固氮菌互作会更强烈,促进作物对氮素的利用[25]。根际中AMF的碳源来自于植物,而微生物固氮也是一个耗碳的过程[26]。当植物提供的碳源不足以满足定殖于植物根系的AMF和固氮菌的需求时,二者之间也可能会存在一定的资源竞争[27]。因此AMF与根际细菌之间关系为互利或者竞争可能主要取决于土壤碳、氮磷等养分的来源和需求。红壤相比黑土和潮土,有机质含量低,氮磷等养分贫乏,可能引起AMF与细菌群落之间的竞争,其负连线占比(21.3%)高于黑土和潮土。需要进一步去探究环境条件对AMF与根际细菌互作的影响机制,考虑土壤生态系统营养级和食物链调控对根际微生物跨界作用的潜在影响。
通过筛选与氮磷利用相关的关键微生物类群,发现球囊霉属真菌中多个OTU与氮磷利用率显著正相关,在群落互作中与其他菌属之间也以正交互作用为主(表 1,图 6)。Zhu等[25]发现AMF与固氮菌的分子生态网络模块中核心物种均属于球囊霉属真菌。球囊霉属真菌是AMF中的优势菌属,比其他类群更容易适应环境变化[19]。研究结果表明相比黑土和潮土,关键AMF类群在红壤中更多,其中球囊霉属真菌与其他菌属联系更为紧密。红壤是典型的有机质和磷缺乏的土壤。在低磷条件下,AMF菌丝能扩大根系吸收磷的范围,活化土壤养分,进而增加土壤氮磷等养分向根系的传输,促进宿主植物的氮磷利用[28]。球囊霉属真菌除了具备促进作物氮磷利用的功能外[29],还可以分泌球囊霉素。球囊霉素土壤相关蛋白(Glomalin-related soil protein,GRSP)能提高土壤有机质含量、改善土壤排气和通水等条件,进而提高作物对氮磷养分的利用[30]。其次,在土壤中,GRSP会通过与土壤颗粒的结合能力来促进土壤团聚体的形成,保护土壤有机碳免受微生物分解[31];同时也可以作为土壤活性有机碳来源,为其他微生物补充碳源,刺激功能微生物定殖,从而促进作物氮磷利用[32-33],这种作用可能在红壤中起着更为重要的作用。有研究表明AMF菌丝长度与GRSP含量存在显著相关性[34]。关于球囊霉属真菌及其产生球囊霉素的作用还需要在后期研究中进一步验证。
综上所述,AMF与根际细菌群落互作以协同作用为主,不同土壤中产生主要交互作用关系的物种及其占比各不相同,土壤类型也是影响AMF与根际细菌互作的重要因素。在红壤中AMF与细菌互作中占比最高的类群为球囊霉属真菌,而黑土和潮土中以根际细菌界内互作为主。球囊霉属真菌在有机质和养分贫乏的土壤中,可能在促进作物氮磷利用中起着更重要的作用。AMF和根际细菌群落协同互作,可以给作物提供更多氮磷,促进农业和环境的可持续性发展[35]。因此,未来在利用微生物途径促进作物氮磷利用时,需要有针对性的识别和调控其中关键微生物类群,并考虑调控措施对其群落互作关系及其功能的影响。
References
| [1] | Campos-Soriano L, Segundo BS. New insights into the signaling pathways controlling defense gene expression in rice roots during the arbuscular mycorrhizal symbiosis. Plant Signaling & Behavior, 2011, 6(4): 553-557. |
| [2] | Rillig MC, Mardatin NF, Leifheit EF, Antunes PM. Mycelium of arbuscular mycorrhizal fungi increases soil water repellency and is sufficient to maintain water-stable soil aggregates. Soil Biology and Biochemistry, 2010, 42(7): 1189-1191. DOI:10.1016/j.soilbio.2010.03.027 |
| [3] | Porras-Soriano A, Soriano-Martín ML, Porras-Piedra A, Azcón R. Arbuscular mycorrhizal fungi increased growth, nutrient uptake and tolerance to salinity in olive trees under nursery conditions. Journal of Plant Physiology, 2009, 166(13): 1350-1359. DOI:10.1016/j.jplph.2009.02.010 |
| [4] | Treseder KK. The extent of mycorrhizal colonization of roots and its influence on plant growth and phosphorus content. Plant and Soil, 2013, 371(1/2): 1-13. |
| [5] | Bianciotto V, Bonfante P. Arbuscular mycorrhizal fungi:a specialised niche for rhizospheric and endocellular bacteria. Antonie van Leeuwenhoek, 2002, 81(1/4): 365-371. |
| [6] | Johansson JF, Paul LR, Finlay RD. Microbial interactions in the mycorrhizosphere and their significance for sustainable agriculture. FEMS Microbiology Ecology, 2004, 48(1): 1-13. |
| [7] | de Boer W, Folman LB, Summerbell RC, Boddy L. Living in a fungal world:impact of fungi on soil bacterial niche development. FEMS Microbiology Reviews, 2005, 29(4): 795-811. DOI:10.1016/j.femsre.2004.11.005 |
| [8] | Abd-Alla MH, El-Enany AWE, Nafady NA, Khalaf DM, Morsy FM. Synergistic interaction of Rhizobium leguminosarum bv. viciae and arbuscular mycorrhizal fungi as a plant growth promoting biofertilizers for faba bean (Vicia faba L.) in alkaline soil. Microbiological Research, 2014, 169(1): 49-58. DOI:10.1016/j.micres.2013.07.007 |
| [9] | Larimer AL, Clay K, Bever JD. Synergism and context dependency of interactions between arbuscular mycorrhizal fungi and rhizobia with a prairie legume. Ecology, 2014, 95(4): 1045-1054. |
| [10] | Zhang L, Fan JQ, Ding XD, He XH, Zhang FS, Feng G. Hyphosphere interactions between an arbuscular mycorrhizal fungus and a phosphate solubilizing bacterium promote phytate mineralization in soil. Soil Biology and Biochemistry, 2014, 74: 177-183. DOI:10.1016/j.soilbio.2014.03.004 |
| [11] | Bollmann A, B?r-Gilissen MJ, Laanbroek HJ. Growth at low ammonium concentrations and starvation response as potential factors involved in niche differentiation among ammonia-oxidizing bacteria. Applied and Environmental Microbiology, 2002, 68(10): 4751-4757. DOI:10.1128/AEM.68.10.4751-4757.2002 |
| [12] | Creamer RE, Hannula SE, van Leeuwen JP, Stone D, Rutgers M, Schmelz RM, de Ruiter PC, Hendriksen NB, Bolger T, Bouffaud ML, Buee M, Carvalho F, Costa D, Dirilgen T, Francisco R, Griffiths BS, Griffiths R, Martin F, da Silva PM, Mendes S, Morais PV, Pereira C, Philippot L, Plassart P, Redecker D, R?mbke J, Sousa J P, Wouterse M, Lemanceau P. Ecological network analysis reveals the inter-connection between soil biodiversity and ecosystem function as affected by land use across Europe. Applied Soil Ecology, 2016, 97: 112-124. DOI:10.1016/j.apsoil.2015.08.006 |
| [13] | Zhao MX, Sun B, Wu LW, Gao Q, Wang F, Wen CQ, Wang MM, Liang YT, Hale L, Zhou JZ, Yang YF. Zonal soil type determines soil microbial responses to maize cropping and fertilization. mSystems, 2016, 1(4): e00075-16. |
| [14] | Morri?n E, Hannula SE, Snoek LB, Helmsing NR, Zweers H, de Hollander M, Soto RL, Bouffaud ML, Buée M, Dimmers W, Duyts H, Geisen S, Girlanda M, Griffiths RI, J?rgensen HB, Jensen J, Plassart P, Redecker D, Schmelz RM, Bailey MJ, Bonkowski M, Faber JH, Martin F, Lemanceau P, de Boer W, van Veen JA, van der Putten WH. Soil networks become more connected and take up more carbon as nature restoration progresses. Nature Communications, 2017, 8: 14349. DOI:10.1038/ncomms14349 |
| [15] | Barberán A, Bates ST, Casamayor EO, Fierer N. Using network analysis to explore co-occurrence patterns in soil microbial communities. The ISME Journal, 2012, 6(2): 343-351. DOI:10.1038/ismej.2011.119 |
| [16] | 鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科技出版社, 2000. |
| [17] | Zhou J, Bruns MA, Tiedje JM. DNA recovery from soils of diverse composition. Applied and Environmental Microbiology, 1996, 62(2): 316-322. |
| [18] | Caporaso JG, Lauber CL, Walters WA, Berg-Lyons D, Lozupone CA, Turnbaugh PJ, Fierer N, Knight R. Global patterns of 16S rRNA diversity at a depth of millions of sequences per sample. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(S1): 4516-4522. |
| [19] | Lumini E, Orgiazzi A, Borriello R, Bonfante P, Bianciotto V. Disclosing arbuscular mycorrhizal fungal biodiversity in soil through a land-use gradient using a pyrosequencing approach. Environmental Microbiology, 2010, 12(8): 2165-2179. |
| [20] | Zaidi A, Khan MS, Amil M. Interactive effect of rhizotrophic microorganisms on yield and nutrient uptake of chickpea (Cicer arietinum L.). European Journal of Agronomy, 2003, 19(1): 15-21. DOI:10.1016/S1161-0301(02)00015-1 |
| [21] | Smith SE, Read DJ. Mycorrhizal symbiosis. 3rd ed. San Diego: Academic Press, 2008. |
| [22] | Ding XD, Sui XH, Wang F, Gao JH, He XH, Zhang FS, Yang JC, Feng G. Synergistic interactions between Glomus mosseae and Bradyrhizobium japonicum in enhancing proton release from nodules and hyphae. Mycorrhiza, 2012, 22(1): 51-58. DOI:10.1007/s00572-011-0381-3 |
| [23] | Meng LB, Zhang AY, Wang F, Han XG, Wang DJ, Li SM. Arbuscular mycorrhizal fungi and rhizobium facilitate nitrogen uptake and transfer in soybean/maize intercropping system. Frontiers in Plant Science, 2015, 6: 339. |
| [24] | Rousk J, B??th E, Brookes PC, Lauber CL, Lozupone C, Caporaso JG, Knight R, Fierer N. Soil bacterial and fungal communities across a pH gradient in an arable soil. The ISME Journal, 2010, 4(10): 1340-1351. DOI:10.1038/ismej.2010.58 |
| [25] | Zhu C, Tian GL, Luo GW, Kong YL, Guo JJ, Wang M, Guo SW, Ling N, Shen QR. N-fertilizer-driven association between the arbuscular mycorrhizal fungal community and diazotrophic community impacts wheat yield. Agriculture, Ecosystems & Environment, 2018, 254: 191-201. |
| [26] | Orr CH, Leifert C, Cummings SP, Cooper JM. Impacts of organic and conventional crop management on diversity and activity of free-living nitrogen fixing bacteria and total bacteria are subsidiary to temporal effects. PLoS One, 2012, 7(12): e52891. DOI:10.1371/journal.pone.0052891 |
| [27] | Veresoglou SD, Chen BD, Rillig MC. Arbuscular mycorrhiza and soil nitrogen cycling. Soil Biology and Biochemistry, 2012, 46: 53-62. DOI:10.1016/j.soilbio.2011.11.018 |
| [28] | Barea JM, Toro M, Orozco MO, Campos E, Azcón R. The application of isotopic (32P and 15N) dilution techniques to evaluate the interactive effect of phosphate-solubilizing rhizobacteria, mycorrhizal fungi and Rhizobium to improve the agronomic efficiency of rock phosphate for legume crops. Nutrient Cycling in Agroecosystems, 2002, 65: 35-42. |
| [29] | Behie SW, Bidochka MJ. Nutrient transfer in plant-fungal symbioses. Trends in Plant Science, 2014, 19(11): 734-740. DOI:10.1016/j.tplants.2014.06.007 |
| [30] | Singh PK, Singh M, Tripathi BN. Glomalin:an arbuscular mycorrhizal fungal soil protein. Protoplasma, 2013, 250(3): 663-669. DOI:10.1007/s00709-012-0453-z |
| [31] | Rillig MC. Arbuscular mycorrhizae and terrestrial ecosystem processes. Ecology Letters, 2004, 7(8): 740-754. DOI:10.1111/j.1461-0248.2004.00620.x |
| [32] | Wu QS, Cao MQ, Zou YN, He XH. Direct and indirect effects of glomalin, mycorrhizal hyphae and roots on aggregate stability in rhizosphere of trifoliate orange. Scientific Reports, 2015, 4: 5823. DOI:10.1038/srep05823 |
| [33] | Wu QS, Li Y, Zou YN, He XH. Arbuscular mycorrhiza mediates glomalin-related soil protein production and soil enzyme activities in the rhizosphere of trifoliate orange grown under different P levels. Mycorrhiza, 2015, 25(2): 121-130. DOI:10.1007/s00572-014-0594-3 |
| [34] | Wilson GWT, Rice CW, Rillig MC, Springer A, Hartnett DC. Soil aggregation and carbon sequestration are tightly correlated with the abundance of arbuscular mycorrhizal fungi:results from long-term field experiments. Ecology Letters, 2009, 12(5): 452-461. DOI:10.1111/j.1461-0248.2009.01303.x |
| [35] | Miransari M, Mackenzie AF. Wheat grain nitrogen uptake, as affected by soil total and mineral nitrogen, for the determination of optimum nitrogen fertilizer rates for wheat production. Communications in Soil Science and Plant Analysis, 2010, 41(13): 1644-1653. DOI:10.1080/00103624.2010.485473 |
