贾雨雷1,2, 林标声1,2,3, 廖真1,2, 汪丽芳1,2, 黄在兴1,2, 宋昭昭1,2, 梅兰1,2, 林占熺1,2


1. 福建农林大学生命科学学院, 福建 福州 350002;
2. 国家菌草工程技术研究中心, 福建 福州 350002;
3. 龙岩学院生命科学学院, 福建 龙岩 364012
收稿日期:2019-03-20;修回日期:2019-06-05;网络出版日期:2019-06-13
基金项目:中央引导地方科技发展专项资金(2018L3003);国家林业局林业公益性行业科研专项(201504412);福建农林大学科技创新专项基金(KFA17632A)
*通信作者:林占熺, Tel/Fax:+86-591-83789223;E-mail:lzxjuncao@163.com.
摘要:[目的] 探究不同生境巨菌草内生固氮菌群落组成多样性及其分异规律。[方法] 采用高通量测序固氮酶nifH标靶基因方法,研究了我国6个典型地区的巨菌草内生固氮菌群,包括福建闽侯县、新疆墨玉县、内蒙古阿拉善左旗、青海贵德县、甘肃安定区、海南那大镇,结合地理气候因子统计,分析了固氮菌多样性的环境驱动机制。[结果] 共获得64122条nifH基因的有效序列,640个OTUs,归属于6个门、10个纲、17个目、24个科、33个属和39个种。不同地区巨菌草中优势内生固氮菌群的种类和丰度存在较大的差异。在门水平上,福州闽侯县、甘肃安定区、新疆墨玉县、内蒙古阿拉善左旗和青海贵德县5个地区的优势菌门均为变形菌门,海南那大镇的优势菌门为变形菌门和蓝藻菌门;属水平上,不同地区巨菌草最优势内生固氮菌类群分别为:福州闽侯县(变形菌门中未定属,80.56%);新疆墨玉县(变形菌门中未定属,33.14%);内蒙古阿拉善左旗(变形菌门中未定属,76.23%);甘肃安定区(α-变形菌纲中的未定属,53.78%);海南那大镇(变形菌门中未定属,38.37%);青海贵德县(变形菌门中未定属,46.12%)。Alpha多样性和Beta多样性分析表明,不同地区巨菌草内生固氮菌群落的多样性存在较大的差异,海南那大镇样本中巨菌草各类内生固氮菌群的多样性及丰富度最高,福建闽侯县样本中巨菌草各类内生固氮菌群的多样性及丰富度最低。典范对应分析(CCA)结果表明,年均降雨量和年均气温是影响巨菌草内生固氮菌群变化的主要因素,其次是土壤有机质、土壤全氮和土壤pH。[结论] 不同地区巨菌草内生固氮菌群落的组成及丰度存在着较大的差异,海南那大镇巨菌草内生固氮菌群的种类及相对丰度较高,本研究可为巨菌草内生固氮菌群的资源开发及其固氮微生物肥料的菌种选育和生产应用提供理论支持。
关键词:巨菌草高通量测序内生固氮菌菌群群落多样性
Diversity of endophytic nitrogen-fixing bacteria community in the roots of Pennisetum sp. of typical habitats
Yulei Jia1,2, Biaosheng Lin1,2,3, Zhen Liao1,2, Lifang Wang1,2, Zaixing Huang1,2, Zhaozhao Song1,2, Lan Mei1,2, Zhanxi Lin1,2


1. College of Life Sciences, Fujian Agriculture and Forestry University, Fuzhou 350002, Fujian Province, China;
2. National Engineering Research Center of Juncao, Fuzhou 350002, Fujian Province, China;
3. College of Life Sciences, Longyan University, Longyan 364012, Fujian Province, China
Received: 20 March 2019; Revised: 5 June 2019; Published online: 13 June 2019
*Corresponding author: Lin Zhanxi, Tel/Fax:+86-591-83789223;E-mail:lzxjuncao@163.com.
Foundation item: Supported by the Central Leading Local Science and Technology Development Special Fund Project (2018L3003), by the State Forestry Administration Forestry Public Welfare Industry Research Special Project (201504412) and by the Fujian Agriculture and Forestry University Science and Technology Innovation Special Fund Project (KFA17632A)
Abstract: [Objective] To explore the diversity and differentiation of endophytic nitrogen-fixing bacteria community in Pennisetum sp. in different habitats. [Methods] High-throughput sequencing of nitrogen-fixing enzyme nifH target gene method was used to study the endophytic nitrogen-fixing bacteria in Pennisetum sp. in 6 typical areas of China, including Fujian Minhou County, Xinjiang Moyu County, Inner Mongolia Alashan Zuoqi, Qinghai Guide County, Gansu Anding District, and Hainan Nada Town. The environmental driving mechanism of nitrogen-fixing bacteria diversity was analyzed by combining geographical and climatic factor statistics. [Results] A total of 64122 valid sequences of nifH genes were obtained, 640 OTUs belonging to 6 phyla, 10 classes, 17 orders, 24 families, 33 genera and 39 species. The species and abundance of predominant endophytic nitrogen-fixing bacteria in Pennisetum sp. from different regions were quite different. At the phylum level, Proteobacteria were the dominant bacteria in the five areas of Fuzhou Minhou County, Gansu Anding District, Xinjiang Moyu County, Inner Mongolia Alashan Zuoqi and Qinghai Guide County, whereas Proteobacteria and Cyanobacteria were the dominant phylum in Hainan Nada town. At the genus level, the most dominant endogphytic nitrogen-fixing bacteria groups in Pennisetum sp. in different regions as below:Minhou County of Fuzhou province (undetermined genus of Proteobacteria, 80.56%), Moyu County of Xinjiang province (undetermined genus of Proteobacteria, 33.14%), Alashan Zuoqi of Inner Mongolia (undetermined genus of Proteobacteria, 76.23%), Anding District of Gansu Province (undetermined genus of Alphaproteobacteria, 53.78%), Nada Town of Hainan (undetermined genus of Proteobacteria, 38.79%), Guide County of Qinghai (undetermined genus of Proteobacteria, 46.12%). The analysis of alpha-diversity and beta-diversity showed that the diversity of endophytic nitrogen-fixing bacteria communities in Pennisetum sp. in different regions was different. The diversity and richness of endophytic nitrogen-fixing bacteria in Pennisetum sp. in Nada Town of Hainan Province were the highest, while those in Minhou County of Fujian province were the lowest. The canonical correspondence analysis (CCA) showed that annual average rainfall and annual average temperature were the main factors affecting the change of endophytic nitrogen-fixing bacteria in Pennisetum sp., followed by soil organic matter, soil total nitrogen and soil pH. [Conclusion] The composition and abundance of endophytic nitrogen-fixing bacteria community in Pennisetum sp. in different areas were quite different. The species and relative abundance of endophytic nitrogen-fixing bacteria in Pennisetum sp. in Nada town of Hainan province were relatively high. This research can provide theoretical supports for the development of endophytic nitrogen-fixing bacteria in Pennisetum sp. and the breeding and production of nitrogen-fixing microbial fertilizers.
Keywords: Pennisetum sp.high-throughput sequencingendophytic diazotrophsmicrofloradiversity
巨菌草(Pennisetum sp.)隶属于被子植物门,单子叶植物纲,禾本科,狼尾草属,是典型的C4植物,适宜在热带、亚热带、温带生长[1]。巨菌草是2005–2007年由福建农林大学菌草研究所从非洲引进的品种,根系发达,抗逆性强,产草量高,目前已经在我国福建、浙江、宁夏、新疆、广西、海南等省,以及巴布亚新几内亚、卢旺达、莱索托等国家种植[2]。巨菌草营养价值高,适口性好,用途广泛,既可代替木屑栽培食药用菌,解决菌林矛盾,又可作为动物饲料,在生态治理方面也具有广泛的应用[3–4]。
植物内生固氮菌是指定殖于植物体内与宿主植物进行联合固氮的一类微生物,在固氮、生物防治和促进植物生长等方面具有非常重要的作用[5]。多年来,许多研究者已从甘蔗、水稻、小麦、玉米等禾本科植物中分离到内生固氮菌[6–9]。联合固氮菌除了能为宿主提供氮素以外,还同时具有分泌生长素、溶磷、增强植株抗病性、抗逆境等多方面的促进植物生长的作用[10–13]。植物内生固氮菌的发现和研究揭示了一个新的固氮系统,内生固氮菌的生境特殊性决定了其既有理论研究的广度和深度,又是一个潜能巨大、尚待开发的固氮微生物资源[14–15]。植物内生固氮菌占据着植物组织内有利于营养供应和微环境适宜的生态位[16],能够有效地拮抗病原微生物的生长[17],较根外环境更有利于形成高效固氮体系[18],进而促进作物的生长及产量的提高[19]。所以,固氮资源的发掘和利用在农业生产应用上具有非常重要的意义。目前关于禾本科植物及作物的内生固氮菌国内外已有较多报道,但是关于巨菌草植物内生固氮菌的研究却鲜有报道。
nifH基因是编码固氮酶铁蛋白的基因,是所有固氮微生物含有的最保守的功能基因[20],Young[21]等研究表明,nifH基因系统发育与16S rRNA具有显著的一致性,因此,nifH基因是研究固氮微生物的理想遗传标记[22]。目前,许多研究通过nifH基因的遗传多样性来探究不同植物和生境固氮微生物的群落结构和多样性,并发现在不同植物和自然条件下存在多样性的nifH基因[23–28]。
本团队前期试验研究结果表明,不同生长时期巨菌草根、茎、叶内生固氮菌群组成及丰度存在着较大的差异,其中成熟期根部其联合固氮菌群种类和丰度最高[29]。因此,成熟期根部将是巨菌草最主要的固氮菌群种质资源来源。分子生态学研究表明,传统的分离培养方法鉴定的微生物只占环境生物总数的0.1%–10%,因此通过传统培养方法得到的结果不能真实地反映出植物内生菌的多样性[30–31]。高通量测序技术具有速度快、成本低、覆盖度深、数据量大等特点[32]。因此,本研究通过采用Illumina Miseq第二代测序技术对6个不同生长地区成熟期巨菌草根部内生固氮菌的种类分布及其变化规律进行研究,研究不同生境下巨菌草可能蕴藏的内生固氮菌,以期为巨菌草内生固氮菌群的资源开发及其固氮微生物肥料的菌种选育和生产应用提供理论支持。
1 材料和方法 1.1 样本的采集及处理 2018年9月从福州闽侯县(FJ)、新疆墨玉县(XJ)、内蒙古阿拉善左旗(NM)、甘肃安定区(GS)、海南那大镇(HN)和青海贵德县(QH)6个菌草研究所试验基地采集成熟期巨菌草根样,每个地区分3个样点,每个样点随机选取3株,共采取54个巨菌草根样带回实验室处理。各样本采样地的地理位置和气候信息见表 1所示。
表 1. 各样本采样点地理位置和气候信息 Table 1. Locations and climatic information of sampling points of each sample
| Samples ID | LL | AL/m | RF/mm | T/℃ | Max T/℃ | Min T/℃ | ST/h | pH | OM/(g/kg) | TN/(g/kg) |
| FJ | 25°50?30?N 118°56?45?E | 700 | 1674 | 19.5 | 40.6 | –4 | 1840 | 7.3±0.06 | 12.57±0.86 | 0.62±0.08 |
| XJ | 37°15?27?N 79°36?40?E | 1325 | 35.6 | 11.6 | 42.7 | –23.7 | 2654.6 | 7.1±0.15 | 15.68±1.64 | 0.85±0.04 |
| NM | 39°46?47?N 106°42?53?E | 1054 | 130.54 | 8.3 | 41.7 | –36.4 | 3200 | 7.5±0.22 | 18.59±1.82 | 1.76±0.15 |
| GS | 35°24?26?N 104°56?32?E | 1996 | 390 | 6.3 | 34.3 | –27.1 | 2500.1 | 7.2±0.13 | 25.06±2.35 | 1.32±0.11 |
| HN | 19°31?25?N 109°34?42?E | 168.7 | 1815.6 | 23.2 | 33 | 3.2 | 2250 | 7.2±0.08 | 28.62±1.23 | 1.92±0.16 |
| QH | 35°36?45?N 101°45?50?E | 2720 | 265 | 4.7 | 34.5 | –13.6 | 2798 | 6.7±0.16 | 30.14±2.55 | 2.27±0.05 |
| LL: Latitude and longitude; AL: altitude; T: Average annual temperature; RF: Average annual rainfall; Max T: Annual maximum temperature; Min T: Annual minimum temperature; ST: Average Annual sunshine time; pH: Soil pH; OM: Organic matter; TN: Total nitrogen. | ||||||||||
表选项
1.2 样品的表面消毒 将巨菌草根样用无菌水洗涤样本30 s,接着在70%的乙醇中浸泡2 min,再用2.5% NaClO (含0.1% Tween80)浸泡5 min后转移至70%无菌乙醇浸泡30 s,最后使用无菌水洗涤植物组织3次。取最后一次洗涤液涂布于LB培养基上作为对照,以此检验表面是否彻底消毒。
1.3 基因组DNA的提取、固氮功能基因nifH可变区扩增和高通量测序 使用Magnetic Soil And Stool DNA Kit (天根,中国)试剂盒进行植物基因组总DNA的提取,完成基因组DNA抽提后,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA。以提取的植物基因组DNA为模板,PCR扩增选择长度为450 bp作为固氮功能基因nifH的扩增片段,进行后续高通量测序。引物序列为:nifHF (5?-AAAGGYGGWATCGGY AARTCCACCAC-3?)和nifHR (5?-TTGTTSGCSGC RTACAT-SGCCATCAT-3?)[33]。PCR反应体系(20 μL):5×FastPfu buffer 4 μL,2.5 mmol/L dNTPs 2 μL,Forward primer (5 μmol/L) 0.8 μL,Reverse primer (5 μmol/L) 0.8 μL,FastPfu Polymerase 0.4 μL,S-A 0.2 μL,DNA Template 2 μL,dd H2O 9.8 μL。PCR反应条件为:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,37个循环;72 ℃ 10 min。扩增结果进行2%琼脂糖凝胶电泳,切取目的片段然后用AxyPrep DNA凝胶回收试剂盒切胶回收PCR产物,PCR产物用Quanti-Fluor?-ST蓝色荧光定量系统进行检测定量,随后交由上海美吉生物医药科技有限公司使用Illumina Miseq测序平台进行序列测定。
1.4 生物信息学分析 由Illumina Miseq测序得到的双端序列数据,首先根据PE reads之间的overlap关系,将成对的reads拼接成一条序列,同时对reads的质量和拼接的效果进行质控过滤,根据序列首尾两端的barcode和引物序列区分样品得到有效序列,并校正序列方向,即为优化数据[34]。然后对样本中的有效数据在97%水平上进行OTU聚类分析,基于OTU聚类分析结果,可以对OTU进行多种多样性指数分析,以及测序深度的检测;基于分类学信息,可以在各个分类水平上进行群落结构的统计分析。在上述分析的基础上可以对多样本的群落组成和系统发育信息进行多元分析和差异显著性检验等一系列深入的统计学和可视化分析。高通量测序数据处理与分析由上海美吉生物医药科技有限公司完成。
2 结果和分析 2.1 测序结果的质量分析 本研究通过对6个不同地区巨菌草根样进行Illumina Miseq高通量测序,共获得118965条序列,对原始序列进行质控过滤,优化后共获得64122条有效序列,基于相似性大于97%的原则,将获得的有效序列进行聚类,共获得640个OTUs,归属于6个门、10个纲、17个目、24个科、33个属和39个种。Alpha多样性分析可以反映样品中微生物群落的丰富度和多样性,由表 2中的结果可以看出,各样本内生固氮菌群种类的ACE和Chao指数为HN > XJ > GS > NM > QH > FJ,各样本内生固氮菌群种类的Shannon指数为HN > XJ > QH= GS > NM > FJ,结果表明,HN样本中内生固氮菌群的多样性和丰富度最高,FJ样本中内生固氮菌群的多样性和丰富度最低;各样本nifH基因测序深度指数范围为99.78%–99.87%,表明各样本文库的覆盖率很高,各样本中序列被测出的概率很高,本次测序结果可以反映各样本中微生物的真实情况。
表 2. 典型生境巨菌草根内生固氮菌群落nifH基因多样性 Table 2. NifH gene diversity of endophytic nitrogen-fixing bacteria community in Pennisetum sp. roots in typical habitats
| Sample ID | Shannon | ACE | Chao | Coverage/% |
| FJ | 1.52±0.22 | 101.31±8.72 | 100.50±7.62 | 99.86±0.15 |
| XJ | 3.12±0.54 | 226.27±15.34 | 222.03±14.36 | 99.78±0.35 |
| NM | 2.70±0.17 | 150.13±10.72 | 149.56±11.19 | 99.86±0.26 |
| QH | 2.80±0.28 | 104.60±12.56 | 103.27±10.53 | 99.87±0.59 |
| GS | 2.80±0.35 | 160.44±14.68 | 171.11±12.46 | 99.78±0.23 |
| HN | 3.76±0.26 | 249.01±10.32 | 247.5±10.34 | 99.80±0.46 |
表选项
由图 1-A中构建的稀释性曲线图可知,6组样本的稀释性曲线图均趋向平坦,随着数据量的增加,新的OTU也不会大量出现,说明测序结果合理,能够比较真实地反映6组样本中的微生物多样性。由图 1-B中的NMDS群落多样性分析结果可知,FJ和NM、XJ和QH这两组样本点之间的距离较近,而其他各组样本点之间的距离较远。表明FJ和NM、XJ和QH这两组样本间内生固氮菌群落组成较为相似。而其他各组样本之间内生固氮菌群组成差异较大。
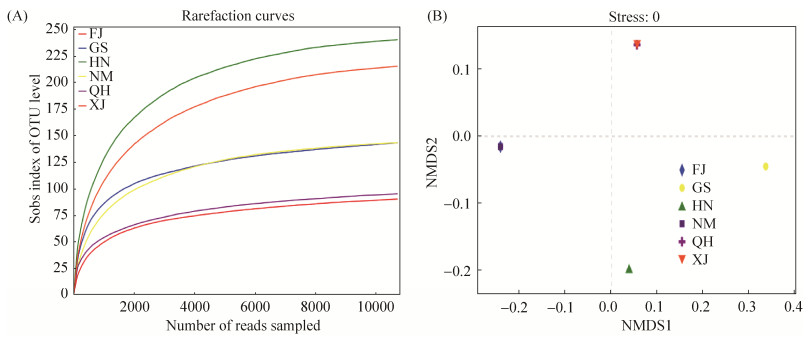 |
| 图 1 典型生境巨菌草根内生固氮菌群落nifH基因多样性 Figure 1 NifH gene diversity of endophytic nitrogen-fixing bacteria community in Pennisetum sp. roots in typical habitats. A: Rarefaction curves; B: NMDS community diversity; FJ: Fujian Minhou County; GS: Gansu Anding District; HN: Hainan Nada Town; NM: Inner Mongolia Alashan Zuoqi; QH: Qinghai Guide County; XJ: Xinjiang Moyu County. |
| 图选项 |
2.2 门水平和属水平上的固氮菌群落结构分析 从图 2-A中门水平上来看,6个不同样本巨菌草的内生固氮菌中有大量的不可分类的门类,其相对丰度为0.66%–10.68%,这表明巨菌草中含有大量发挥固氮活性的固氮菌在目前采用的数据库中未能找到与之相匹配的分类信息;在可定义的门类中,6组样本中所共有的且丰度最高的为变形菌门(Proteobacteria),其相对丰度为87.56%–99.34%;在XJ、NM、HN三个样本中,菌群分布较多、丰富较高的种类还包括蓝藻菌门(Cyanobacteria),其在该3个样品中的相对丰度为0.05%–1.67%;其中,FJ、GS、XJ、NM和QH这5个样本中的优势菌门为变形菌门(Proteobacteria),HN样本中的优势菌门为变形菌门(Proteobacteria)和蓝藻菌门(Cyanobacteria)。不同地区巨菌草样本优势内生固氮菌门组成及其丰度存在差异。
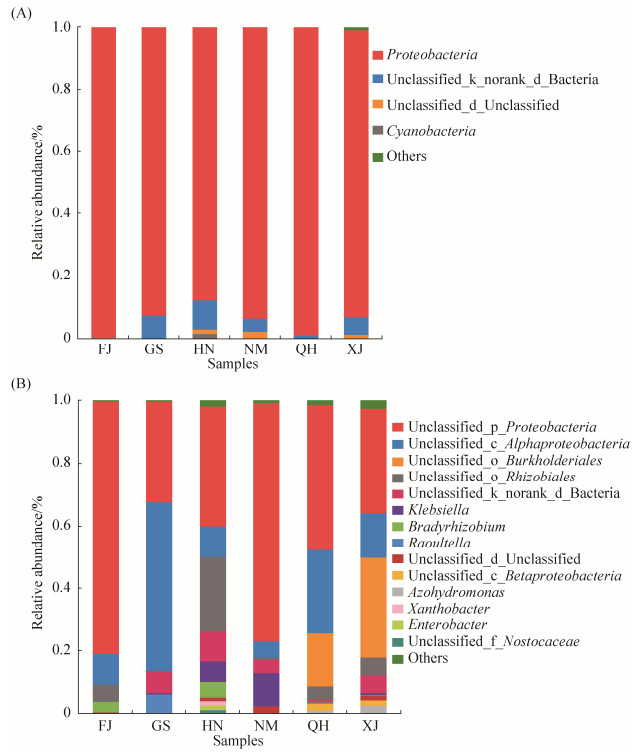 |
| 图 2 典型生境巨菌草根内生固氮菌群落组成 Figure 2 Composition of endophytic nitrogen-fixing bacteria in Pennisetum sp. roots in typical habitats. A: At the phylum level; B: At the genus level. FJ: Fujian Minhou County; GS: Gansu Anding District; HN: Hainan Nada Town; NM: Inner Mongolia Alashan Zuoqi; QH: Qinghai Guide County; XJ: Xinjiang Moyu County. |
| 图选项 |
从图 2-B中属水平来看,不同生境巨菌草内生固氮菌群群落组成及相对丰度存在较大的差异。属水平上,FJ样本中共获得9个属,优势内生固氮菌类群为变形菌门(Proteobacteria)中未定属(80.56%)、α-变形菌纲(Alphaproteobacteria)中的未定属(10.19%)、根瘤菌目(Rhizobiales)中的未定属(5.17%)和慢生根瘤菌属(Bradyrhizobium)(3.17%)。XJ样本中共获得20个属,优势内生固氮菌类群为变形菌门(Proteobacteria)中未定属(33.14%)、伯克氏菌目(Burkholderiales)中的未定属(31.89%)、α-变形菌纲(Alphaproteobacteria)中的未定属(14.34%)、根瘤菌目(Rhizobiales)中的未定属(5.67%)、β-变形菌纲(Betaproteobacteria)中的未定属(1.79%)和Azohydromonas(2.52%)。NM样本中共获得11个属,优势内生固氮菌类群为变形菌门(Proteobacteria)中未定属(76.23%)、克雷伯氏菌属(Klebsiella)(10.77%)和α-变形菌纲(Alphaproteobacteria)中的未定属(5.044%)。GS样本中共获得10个属,优势内生固氮菌类群为α-变形菌纲(Alphaproteobacteria)中的未定属(53.78%)、变形菌门(Proteobacteria)中的未定属(32.24%)和拉乌尔菌属(Raoultella)(6.01%)。HN样本中共获得19个属,优势内生固氮菌类群为变形菌门(Proteobacteria)中未定属(38.37%)、根瘤菌目(Rhizobiales)中的未定属(23.99%)、α-变形菌纲(Alphaproteobacteria)中的未定属(9.71%)、克雷伯氏菌属(Klebsiella)(6.52%)、慢生根瘤菌属(Bradyrhizobium)(5.02%)、黄色杆菌属(Xanthobacter) (1.45%)和肠杆菌属(Enterobacter)(1.41%)。QH样本中共获得15个属,优势内生固氮菌类群为变形菌门(Proteobacteria)中未定属(46.12%)、α-变形菌纲(Alphaproteobacteria)中的未定属(26.87%)、伯克氏菌目(Burkholderiales)中的未定属(17.10%)、根瘤菌目(Rhizobiales)中的未定属(4.01%)和β-变形菌纲(Betaproteobacteria)中的未定属(2.43%)。综上可知,不同地区巨菌草优势内生固氮菌群的种类和丰度存在着较大差异。
2.3 各样本组间的相似性分析 使用R软件,对相对丰度前30位的属进行聚类分析到Heatmap。从图 3-A中可以看出,FJ和NM、QH和XJ这两组样本可以较好地聚类在一起,而其他各组样本之间不能很好地聚类在一起。结果表明不同生境下巨菌草内生固氮菌群结构有一定的差异,在这6个样本中,福州闽侯县和内蒙古阿拉善左旗、青海贵德县和新疆墨玉县之间的巨菌草内生固氮菌群的相似性较高,而其他各组样本之间的相似性较低。从Heatmap图上颜色变化可以看出,6个样本中相对丰度较高的为变形菌门Proteobacteria中的未定属、α-变形菌纲Alphaproteobacteria中的未定属、根瘤菌目Rhizobiales中的未定属。几种主要的内生固氮菌群在H5样本中的丰度及表达量要明显高于XJ、GS、QH、NM和FJ这5个样本。
2.4 环境因子对各样本内生固氮菌群组成的影响分析 对环境因子和固氮菌群落进行CCA相关性分析。从图 3-B结果可以看出,CCA1和CCA2对各样本内生固氮菌属的变化分别解释了24.20%和23.58%,即所有的环境因素对固氮菌属变化共有47.78%的解释度。年均降雨量和年均气温与固氮菌群落的相关性最大,其次是土壤有机质和土壤全氮,土壤pH与固氮菌群落的相关性最小。年均气温、年均降雨量和土壤pH这3个环境因子矢量箭头之间的夹角较小,可能它们之间对固氮菌属的变化具有协同效应。
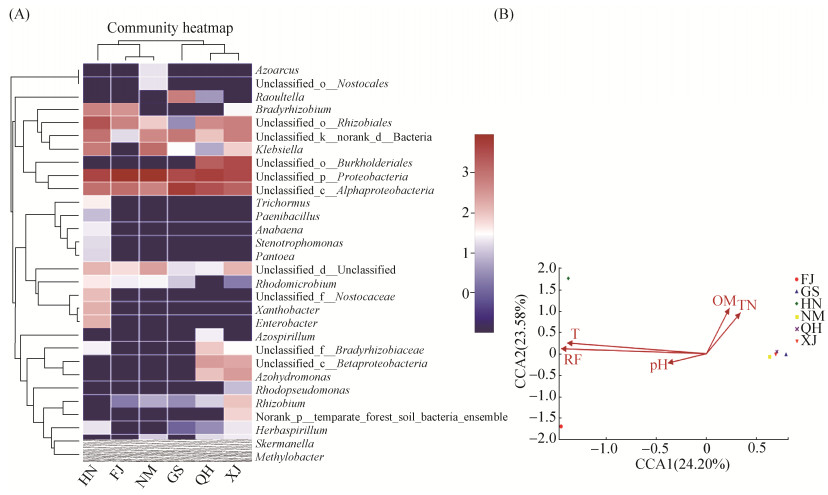 |
| 图 3 典型生境巨菌草根内生固氮菌群落组成分析 Figure 3 Analysis of the composition of endophytic nitrogen-fixing bacteria in Pennisetum sp. roots in typical habitats. A: Heatmap analysis at the genus level; B: Correlation analysis of CCA environmental factors; FJ: Fujian Minhou County; GS: Gansu Anding District; HN: Hainan Nada Town; NM: Inner Mongolia Alashan Zuoqi; QH: Qinghai Guide County; XJ: Xinjiang Moyu County; T: Average annual temperature; RF: Average annual rainfall; pH: Soil pH; OM: Organic matter; TN: Total nitrogen. |
| 图选项 |
3 讨论 本文首次采用高通量测序技术对6个不同地区巨菌草内生固氮菌群落及其多样性进行研究,共获得64122条有效序列,经分析归属于6个门、10个纲、17个目、24个科、33个属和39个种,以变形菌门和蓝藻菌门为优势内生固氮类群。这6个地区巨菌草中所共有的且相对丰度最高的内生固氮菌群为变形菌门(Proteobacteria),其相对丰度为87.56%–99.34%,在巨菌草中占据绝对优势。说明变形菌门不受生境限制,是巨菌草的优势内生固氮菌群。本文的研究结果和林标声等[29]研究结果一致。已有研究报道,变形菌门属于革兰氏阴性菌,为富营养菌,与养分含量呈正相关性[35–36]。变形菌门之所以能够在地理环境迥异的区域生长,可能是因为变形菌门在巨菌草内分布广泛,数量大,环境适应性较强,且不同地区土壤中的养分含量较为充足,适宜变形菌门中固氮菌群的生长。
属水平上,除了福州闽侯县和内蒙古阿拉善左旗、青海贵德县和新疆墨玉县之外,其他各组样本之间内生固氮菌群落组成差异较大,且海南那大镇地区巨菌草内生固氮菌群的多样性及丰富度要明显高于其他5个地区。其中,慢生根瘤菌属(Bradyrhizobium)为福建闽侯县和海南那大镇地区共有的优势内生固氮菌属,克雷伯氏菌属(Klebsiella)为内蒙古阿拉善左旗和海南那大镇地区共有的优势内生固氮菌属,Azohydromonas为新疆墨玉县地区特有的优势内生固氮菌属,拉乌尔菌属(Raoultella)为甘肃安定区特有的优势内生固氮菌属,黄色杆菌属(Xanthobacter)和肠杆菌属(Enterobacter)为海南那大镇地区特有的优势内生固氮菌属。不同地区巨菌草内生固氮菌群的种类及丰度之所以存在较大差异,推测一方面可能与内生固氮菌群的侵染方式和传播途径有关。Kluepfel[37]认为内生菌是通过植物的自然开口和伤口进入植物体的,自然开口包括侧根发生裂隙、气孔、水孔和茎皮孔等,而伤口则是由土壤对根的磨损、动物摄食及收割多年生植物所致。这些途径在近年来关于内生固氮菌如何进入植物的研究中均有发现。已有研究发现,根瘤菌是通过伤口、根毛和完整的表皮进入植物的[38]。固氮醋酸杆菌是从根尖和侧根发生的周围侵染植物的,它还能侵入甘蔗根毛形成侵染线样结构, 只是频率很低[39]。因而,我们推测可能由于不同地区巨菌草宿主本身和不同生境下固氮菌群种类差异的原因,致使不同地区不同种类的固氮菌群侵染进入植物体中的难易程度不同,从而导致不同地区巨菌草中内生固氮类群的组成存在差异。另一方面可能与不同地区的环境因素有关。已有研究表明,在不同自然环境中的nifH基因呈现出多样性和差异性,固氮微生物的群落结构也表现出明显的差异[40]。不同种类的固氮菌都有其适宜生长的环境条件,不同地区地理气候和土壤等环境因素的差异会刺激不同种类固氮菌群的生长,从而导致不同地区巨菌草中的内生固氮菌群组成存在差异。本实验CCA分析结果表明,年均降雨量和年均气温是影响巨菌草内生固氮菌群变化的主要因素,其次是土壤有机质、土壤全氮和土壤pH。Butterwick等[41]研究发现,温度会影响固氮微生物群落结构和多样性。Juraeva等[42]研究发现,土壤全氮含量能够影响固氮菌群的分布。蔡树美等[43]研究发现,固氮菌群落结构与土壤有机质、NH4+-N和有效磷有关。本研究与前人研究结果一致,结果显示固氮菌群结构可由多个环境因素共同影响和控制。本研究中土壤pH与固氮菌群落的相关性较小,这与何冬华等[44]研究发现土壤pH对固氮菌群落也会产生显著影响的结果不一致,造成这种差异的原因可能是由于本研究中不同地区土壤pH较为接近所导致。此外,赵龙飞等[45]研究表明,豆科植物与根瘤菌共生结瘤及根瘤特征,除了与寄主植物的遗传特性、发育时期有关外,还与其所处的生态环境(水分、温度、光照、土壤结构、土壤pH等)有密切的关系。所以,关于其他因素对内生固氮菌群落的影响有待进一步研究验证。
综上所述,不同生长地区巨菌草内生固氮菌群落组成及丰度存在着较大的差异,其中海南那大镇样本中巨菌草内生固氮菌群的种类及相对丰度较高,将是巨菌草内生固氮菌群的主要挖掘资源。本研究的结果对于巨菌草内生固氮菌群资源的开发及其固氮微生物肥料的菌种选育和生产应用提供重要的理论支持。
References
| [1] | Lin XS, Lin H, Lin DM, Luo HL, Hu YP, Lin ZX. Effets of planting density and fertilization on the agronomic traits and production performance of Pennisetum spp. Acta Agrestia Sinica, 2018, 26(6): 1525-1528. (in Chinese) 林兴生, 林辉, 林冬梅, 罗海凌, 胡应平, 林占熺. 种植密度与施肥对巨菌草农艺性状和生产性能的影响. 草地学报, 2018, 26(6): 1525-1528. |
| [2] | Lin XS, Lin ZX, Lin DM, Lin H, Luo HL, Hu YP, Lin CM, Zhu CZ. Effects of different years of planting Pennisetum sp. on the plant-and insect diversity in Pennisetum sp. communities. Chinese Journal of Applied Ecology, 2012, 23(10): 2849-2854. (in Chinese) 林兴生, 林占熺, 林冬梅, 林辉, 罗海凌, 胡应平, 林春梅, 朱朝枝. 不同种植年限的巨菌草对植物和昆虫多样性的影响. 应用生态学报, 2012, 23(10): 2849-2854. |
| [3] | Li ZW. Study on the characteristics of giant grass as energy grass. Agricultural Engineering Technology (New Energy Industry), 2013(6): 12-15. (in Chinese) 李志文. 巨菌草作为能源草的特性研究. 农业工程技术(新能源产业), 2013(6): 12-15. |
| [4] | Chen BC, Lin JR, Luo ZZ, Ye JJ, Jiao WJ. Determination of routine nutritional ingredients and amino acid contents of Jujuncao during different growth stages. Guizhou Agricultural Sciences, 2016, 44(1): 101-103, 109. (in Chinese) 陈碧成, 林洁荣, 罗宗志, 叶健军, 焦文静. 巨菌草不同生长时间的常规营养成分及氨基酸含量测定. 贵州农业科学, 2016, 44(1): 101-103, 109. DOI:10.3969/j.issn.1001-3601.2016.01.027 |
| [5] | Qin LP, Huang SL, Li YR. Research progress in endophytic diazotroph. Chinese Agricultural Science Bulletin, 2005, 21(2): 150-152, 159. (in Chinese) 覃丽萍, 黄思良, 李杨瑞. 植物内生固氮菌的研究进展. 中国农学通报, 2005, 21(2): 150-152, 159. DOI:10.3969/j.issn.1000-6850.2005.02.048 |
| [6] | Meng XF, Long XH, Kang J, Wang XQ, Liu ZP. Isolation and identification of endogenic nitrogen-fixing bacteria in the roots of Jerusalem artichoke (Helianthus tuberosus). Acta Prataculturae Sinica, 2011, 20(6): 157-163. (in Chinese) 孟宪法, 隆小华, 康健, 王雪晴, 刘兆普. 菊芋内生固氮菌分离、鉴定及特性研究. 草业学报, 2011, 20(6): 157-163. |
| [7] | Han M, Luo PY, Xiao YN, Niu XG, Han XR. Isolation of endophytic N2-fixing bacteria of corn rice and their function for promoting growth. Journal of Shenyang Agricultural University, 2010, 41(1): 94-97. (in Chinese) 韩梅, 罗培宇, 肖亦农, 钮旭光, 韩晓日. 玉米内生固氮菌的分离鉴定及其促生长作用研究. 沈阳农业大学学报, 2010, 41(1): 94-97. DOI:10.3969/j.issn.1000-1700.2010.01.021 |
| [8] | Zhao XW, Javed CH, He YM, Zhang ZY, Peng GX, Tan ZY. Diversity of associated nitrogen-fixing bacteria isolated from the pioneer plants-Vetiver zizanioides. Acta Microbiologica Sinica, 2009, 49(11): 1430-1437. (in Chinese) 赵现伟, Javed CH, 何玉梅, 张志英, 彭桂香, 谭志远. 先锋牧草-香根草联合固氮菌多样性. 微生物学报, 2009, 49(11): 1430-1437. DOI:10.3321/j.issn:0001-6209.2009.11.004 |
| [9] | Hu CJ, Shi GY, Zeng Q, Cen ZL, Song J, Yang LT, Li YR. The diversity of culturable endogenous nitrogen-fixing bacteria of sugarcane in two different soil conditions. Soils and Fertilizers Sciences in China, 2017(2): 141-148. (in Chinese) 胡春锦, 史国英, 曾泉, 岑贞陆, 宋娟, 杨丽涛, 李杨瑞. 两种不同土壤条件下可培养甘蔗内生固氮菌的多样性. 中国土壤与肥料, 2017(2): 141-148. |
| [10] | Xi LQ, Yao T, Yang JJ, Han WX, Zhang DG. Porperty of associative nitrogen-fixing bacteria producing IAA and its promoting growth of oat. Grassland and Turf, 2005(4): 25-29. (in Chinese) 席琳乔, 姚拓, 杨俊基, 韩文星, 张德罡. 联合固氮菌株分泌能力及其对燕麦的促生效应测定. 草原与草坪, 2005(4): 25-29. DOI:10.3969/j.issn.1009-5500.2005.04.005 |
| [11] | Zhang GX, Mao Q, He ZY, Tan ZY. Detection of nitrogenase activity and phosphorus dissolving ability of endophytic isolates from Oryza rufipogon in Lingshui. Chinese Journal of Applied and Environmental Biology, 2006, 12(4): 457-460. (in Chinese) 张国霞, 茅庆, 何忠义, 谭志远. 陵水普通野生稻(Oryza rufipogon)内生菌的固氮及溶磷特性. 应用与环境生物学报, 2006, 12(4): 457-460. DOI:10.3321/j.issn:1006-687X.2006.04.003 |
| [12] | Bertrand H, Plassard C, Pinochet X, Touraine B, Normand P, Cleyet-Marel JC. Stimulation of the ionic transport system in Brassica napus by a plant growth-promoting rhizobacterium (Achromobacter sp.). Canadian Journal of Microbiology, 2000, 46(3): 229-236. DOI:10.1139/w99-137 |
| [13] | Hu CJ, Lin L, Shi GY, Wang Q, Wang QS, Li YR. Screening and identification of associative nitrogen fixation bacteria in rhizosphere of sugarcane in Guangxi. Acta Ecologica Sinica, 2012, 32(15): 4745-4752. (in Chinese) 胡春锦, 林丽, 史国英, 汪茜, 王钱崧, 李杨瑞. 广西甘蔗根际高效联合固氮菌的筛选及鉴定. 生态学报, 2012, 32(15): 4745-4752. |
| [14] | D?bereiner J, Reis VM, Paula MA, Olivares F. Endophytic diazotrophs in sugar cane, cereals and tuber plants//Palacios R, Mora J, Newton WE. New Horizons in Nitrogen Fixation. Dordrecht: Springer, 1993: 671-676. |
| [15] | Luo N, Xiao HL, Lu S, Zhao HP, Luo Q. The isolation of pepper endogenous nitrogen-fixing bacteria identification and diversity analysis. Crops, 2014(6): 52-56. (in Chinese) 罗娜, 肖海兰, 鲁颂, 赵慧萍, 罗琼. 辣椒内生固氮菌的分离鉴定与多样性分析. 作物杂志, 2014(6): 52-56. |
| [16] | Huang SF, Gao C, Liu LH, Tan ZY, Peng GX. Research methods and trend of phylogenetic evolution of endophytic diazotrophs. Microbiology China, 2018, 45(1): 181-190. (in Chinese) 黄淑芬, 郜晨, 刘丽辉, 谭志远, 彭桂香. 植物内生固氮菌系统发育进化新进展. 微生物学通报, 2018, 45(1): 181-190. |
| [17] | Sturz AV, Christie BR, Nowak J. Bacterial endophytes:potential role in developing sustainable systems of crop production. Critical Reviews in Plant Sciences, 2000, 19(1): 1-30. DOI:10.1080/07352680091139169 |
| [18] | Yuan HJ, Yan H, Yang F, Peng GX, Tan ZY. Molecular characterization and phylogenetic analysis of endophytic nitrogenfixing bacteria in Oryza australiensis. Chinese Journal of Applied & Environmental Biology, 2014, 20(4): 571-577. (in Chinese) 原红娟, 严慧, 杨芳, 彭桂香, 谭志远. 澳洲野生稻(Oryza australiensis)内生固氮菌的分子鉴定及发育分析. 应用与环境生物学报, 2014, 20(4): 571-577. |
| [19] | Gupta G, Panwar J, Jha PN. Natural occurrence of Pseudomonas aeruginosa, a dominant cultivable diazotrophic endophytic bacterium colonizing Pennisetum glaucum (L.) R. Br. Applied Soil Ecology, 2013, 64: 252-261. DOI:10.1016/j.apsoil.2012.12.016 |
| [20] | Li JH, Yuan D, Lu JM, Yang LT, Li YR, Xing YX. Effects of nitrogen fertilizer on the expression of nifH gene of endophytic azotobacter in sugarcane leaves. Biotechnology Bulletin, 2017, 33(7): 100-106. (in Chinese) 李佳慧, 袁丹, 陆建明, 杨丽涛, 李杨瑞, 邢永秀. 氮肥对甘蔗叶片内生固氮菌nifH基因表达的影响. 生物技术通报, 2017, 33(7): 100-106. |
| [21] | Yong JPW. Phylogenetic classification of nitrogen-fixing organisms//Stacey G, Burris RH, Evans HJ. Biological Nitrogen Fixation. New York: Chapman and Hall, 1992: 43-48. |
| [22] | Zhang MM, Liu Y, Sheng R, Qin HL, Wu YZ, Wei WX. Effects of rice straw returning on the community structure and diversity of nitrogen-fixing gene (nifH) in paddy soil. Chinese Journal of Applied Ecology, 2013, 24(8): 2339-2344. (in Chinese) 张苗苗, 刘毅, 盛荣, 秦红灵, 伍延正, 魏文学. 稻草还田对水稻土固氮基因(nifH)组成结构和多样性的影响. 应用生态学报, 2013, 24(8): 2339-2344. |
| [23] | Ueda T, Suga Y, Yahiro N, Matsuguchi T. Remarkable N2-fixing bacterial diversity detected in rice roots by molecular evolutionary analysis of nifH gene sequences. Journal of Bacteriology, 1995, 177(5): 1414-1417. DOI:10.1128/JB.177.5.1414-1417.1995 |
| [24] | Wu SJ, Wang LX, Liu Y, Yan FK, Ding MM, Li XX, Liang WY. Cloning of nifH from N. flagelliforme and its differential expression pattern under drought stress. Acta Agriculturae Boreali-occidentalis Sinica, 2017, 26(11): 1639-1647. (in Chinese) 吴诗杰, 王玲霞, 刘阳, 严奉坤, 丁苗苗, 李晓旭, 梁文裕. 发菜固氮酶nifH基因克隆及其干旱胁迫下的差异表达. 西北农业学报, 2017, 26(11): 1639-1647. DOI:10.7606/j.issn.1004-1389.2017.11.010 |
| [25] | Wendu RL, Li G, Yang DL, Zhang JN, Yi J. NifH gene diversity and community structure of soil nitrogen-fixing bacteria in Hulunbeier grassland, Inner Mongolia. Chinese Journal of Ecology, 2011, 30(4): 790-797. (in Chinese) 文都日乐, 李刚, 杨殿林, 张静妮, 易津. 呼伦贝尔草原土壤固氮微生物nifH基因多样性与群落结构. 生态学杂志, 2011, 30(4): 790-797. |
| [26] | dos Santos PC, Dean DR. Co-ordination and fine-tuning of nitrogen fixation in Azotobacter vinelandii. Molecular Microbiology, 2011, 79(5): 1132-1135. DOI:10.1111/j.1365-2958.2011.07541.x |
| [27] | Zehr JP, Mellon MT, Zani S. New nitrogen-fixing microorganisms detected in oligotrophic oceans by amplification of nitrogenase (nifH) genes. Applied and Environmental Microbiology, 1998, 64(9): 3444-3450. DOI:10.1128/AEM.64.9.3444-3450.1998 |
| [28] | MacGregor BJ, van Mooy B, Baker BJ, Mellon M, Moisander PH, Paerl HW, Zehr J, Hollander D, Stahl DA. Microbiological, molecular biological and stable isotopic evidence for nitrogen fixation in the open waters of Lake Michigan. Environmental Microbiology, 2001, 3(3): 205-219. DOI:10.1046/j.1462-2920.2001.00180.x |
| [29] | Lin BS, Fan JL, Song ZZ, Zhang LL, Zhang YL, Lin ZX. Endophytic diazotrophs composition of Pennisetum sp. at different growth stages. Microbiology China, 2018, 45(7): 1479-1490. (in Chinese) 林标声, 范锦琳, 宋昭昭, 张丽丽, 张煜隆, 林占熺. 巨菌草不同生长时期的内生固氮菌群组成分析. 微生物学通报, 2018, 45(7): 1479-1490. |
| [30] | Tholozan JL, Cappelier JM, Tissier JP, Delattre G, Federighi M. Physiological characterization of viable-but-nonculturable Campylobacter jejuni cells. Applied and Environmental Microbiology, 1999, 65(3): 1110-1116. DOI:10.1128/AEM.65.3.1110-1116.1999 |
| [31] | Amann RI, Ludwig W, Schleifer KH. Phylogenetic identification and in situ detection of individual microbial cells without cultivation. Microbiological Reviews, 1995, 59(1): 143-169. DOI:10.1128/MMBR.59.1.143-169.1995 |
| [32] | Feng J, Zhao XW. High-throughput sequencing technology and its application in plant research. Liaoning Forestry Science and Technology, 2012(4): 29-33, 37. (in Chinese) 冯健, 赵雪崴. 高通量测序技术及其在植物研究中的应用. 辽宁林业科技, 2012(4): 29-33, 37. DOI:10.3969/j.issn.1001-1714.2012.04.011 |
| [33] | R?sch C, Mergel A, Bothe H. Biodiversity of denitrifying and dinitrogen-fixing bacteria in an acid forest soil. Applied and Environmental Microbiology, 2002, 68(8): 3818-3829. DOI:10.1128/AEM.68.8.3818-3829.2002 |
| [34] | Fang Y, Wang F, Jia XB, Lin CQ, Zhang H, Chen LJ, Chen JC. Effect of green manure and reduced chemical fertilizer load on the community of soil nitrogen-fixing bacteria. Journal of Agro-Environment Science, 2018, 37(9): 1933-1941. (in Chinese) 方宇, 王飞, 贾宪波, 林陈强, 张慧, 陈龙军, 陈济琛. 绿肥配施减量化肥对土壤固氮菌群落的影响. 农业环境科学学报, 2018, 37(9): 1933-1941. |
| [35] | Wang HY, Xu MG, Zhou BK, Ma X, Duan YH. Response and driving factors of bacterial and fungal community to long-term fertilization in black soil. Scientia Agricultura Sinica, 2018, 51(5): 914-925. (in Chinese) 王慧颖, 徐明岗, 周宝库, 马想, 段英华. 黑土细菌及真菌群落对长期施肥响应的差异及其驱动因素. 中国农业科学, 2018, 51(5): 914-925. |
| [36] | Fierer N, Bradford MA, Jackson RB. Toward an ecological classification of soil bacteria. Ecology, 2007, 88(6): 1354-1364. DOI:10.1890/05-1839 |
| [37] | Kluepfel DA. The behavior and tracking of bacteria in the rhizosphere. Annual Review of Phytopathology, 1993, 31: 441-472. DOI:10.1146/annurev.py.31.090193.002301 |
| [38] | Sprent JI, de Faria SM. Mechanisms of infection of plants by nitrogen fixing organisms. Plant and Soil, 1988, 110(2): 157-165. DOI:10.1007/BF02226795 |
| [39] | Reis VM, Olivares FL, de Oliveira ALM, dos Reis Junior FB, Baldani JI, D?bereiner J. Technical approaches to inoculate micropropagated sugar cane plants were Acetobacter diazotrophicus. Plant and Soil, 1998, 206(2): 205-211. DOI:10.1023/A:1004436611397 |
| [40] | Zehr JP, Jenkins BD, Short SM, Steward GF. Nitrogenase gene diversity and microbial community structure:a cross-system comparison. Environmental Microbiology, 2003, 5(7): 539-554. DOI:10.1046/j.1462-2920.2003.00451.x |
| [41] | Butterwick C, Heaney SI, Talling JF. Diversity in the influence of temperature on the growth rates of freshwater algae, and its ecological relevance. Freshwater Biology, 2005, 50(2): 291-300. |
| [42] | Juraeva D, George E, Davranov K, Ruppel S. Detection and quantification of the nifH gene in shoot and root of cucumber plants. Canadian Journal of Microbiology, 2006, 52(8): 731-739. DOI:10.1139/w06-025 |
| [43] | Cai SM, Xu SX, Zhang HL, Zhang DS, Lv WG, Gu FJ, Zhu HT. Canonical correspondence analysis of relationship between characteristics of nitrogen-fixing microbes community and environmental factors in mudflat soil. Soils, 2017, 49(6): 1159-1165. (in Chinese) 蔡树美, 徐四新, 张翰林, 张德闪, 吕卫光, 顾富家, 诸海焘. 滩涂土壤固氮菌群落与环境因子的典范对应分析. 土壤, 2017, 49(6): 1159-1165. |
| [44] | He DH, Shen QL, Xu QF, Chen JH, Cheng M, Mao XW, Li YC. Evolvement of structure and abundance of soil nitrogen-fixing bacterial community in Phyllostachys edulis plantations with age of time. Acta Pedologica Sinica, 2015, 52(4): 934-942. (in Chinese) 何冬华, 沈秋兰, 徐秋芳, 陈俊辉, 程敏, 毛新伟, 李永春. 不同年限毛竹林土壤固氮菌群落结构和丰度的演变. 土壤学报, 2015, 52(4): 934-942. |
| [45] | Zhao LF, Deng ZS, Yang WQ, Wei GH. Investigation of leguminous plants and rhizobial resources in some regions of northwest China. Agricultural Research in the Arid Areas, 2009, 27(6): 33-39. (in Chinese) 赵龙飞, 邓振山, 杨文权, 韦革宏. 我国西北部分地区豆科植物根瘤菌资源调查研究. 干旱地区农业研究, 2009, 27(6): 33-39. |
