杨东明, 杨利峰

 , 赵德明, 周向梅
, 赵德明, 周向梅 中国农业大学动物医学院, 北京 100193
收稿日期:2018-05-23;修回日期:2018-07-14;网络出版日期:2018-07-25
基金项目:十三五国家重点研发计划(2017YFC1200500)
作者简介:杨利峰,博士,中共党员,中国农业大学副教授,博导兼硕导。主要从事兽医病理学的教学与研究工作,研究方向为传染性海绵状脑病致病的分子机制及诊断方法。现任中国畜牧兽医学会兽医病理学分会第九届理事会副理事长兼秘书长、中国药学会毒性病理专业委员会委员、中国兽医协会标准化技术委员会委员、中国兽医协会实验动物兽医分会委员,担任《实验动物科学》第七届编委,Cellular and Molecular Life Sciences、Oncotarget、Neurobiology of Diseases、Scientific Reports等杂志评审专家,《中国实验动物学报》、《中国比较医学杂志》和《实验动物科学》特约审稿人。作为项目主持人,已承担国家及省部级科研课题18项,在国内外知名期刊上发表学术论文150余篇,其中SCI收录期刊论文82篇,以第一作者及通信作者在Aging Cell、Neurotherapeutics、Molecular Neurobiology、Ageing Research Reviews等国际重要SCI收录期刊发表论文39篇,出版教材、著(译)作15部,累计900余万字
*通信作者:杨利峰, Tel/Fax:+86-10-62732987, E-mail:yanglf@cau.cn
摘要:人体内肠道菌群数量庞大,参与机体物质与能量代谢,对机体的生理活动具有重要调节作用。近年来,众多研究表明,肠道菌群稳态在维持大脑和神经系统的正常功能中发挥着重要作用,肠道菌群失调与帕金森病(Parkinson's disease,PD)等神经疾病的发作密切相关。目前,针对PD发病机制与肠道菌群失调的研究成果丰富,表明肠道菌群在PD发病中起着重要的诱导作用。本文梳理了肠道菌群紊乱与PD发生的相关国内外文献,通过深入分析PD患者肠道菌群的变化特征,讨论了PD与肠道菌群变化间的关系;同时,探讨了粪便移植技术在PD治疗中的应用,旨在为有效预防与治疗PD提供可靠的理论依据。
关键词: 肠道菌群 帕金森 路易小体 肠内分泌细胞 粪便移植
Correlation of gut microbiota with Parkinson's disease
Dongming Yang, Lifeng Yang

 , Deming Zhao, Xiangmei Zhou
, Deming Zhao, Xiangmei Zhou College of Veterinary Medicine, China Agricultural University, Beijing 100193, China
Received 23 May 2018; Revised 14 July 2018; Published online 25 July 2018
*Corresponding author: Yang Lifeng, Tel/Fax:+86-10-62732987, E-mail:yanglf@cau.cn
Supported by the National Key Research and Development Program of China (2017YFC1200500)
Abstract: The large number of gut microbiota (GM) in human body, participating in the material metabolize and energy cycles, regulates the physiological activities of the body. In recent years, many studies demonstrate that the stable state of GM plays an essential role in maintaining the normal function of the brain and nervous system. GM disorder is closely related to some neurological diseases like Parkinson's disease (PD). At present, there are abundant research results on relationship between the pathogenesis of PD and the dysregulation of GM, indicating that GM brings a vital induction effect to the pathogenesis of PD. After reviewing the literature on the correlation of GM with PD and analyzing the change of GM in PD patients, we discuss the relationship between the occurrence of PD and the change of GM. Moreover, we also address the application of faecal transplants treatment in PD treatment in order to provide a reliable theoretical basis for the potential prevention and treatment of PD by regulating GM.
Keywords: gut microbiota Parkinson's disease lewy body enteroendocrine cell faecal transplant
帕金森疾病(Parkinson’s disease,PD),是一种多发于中老年人的神经退行性疾病,严重危害人体健康。PD的主要临床特征是神经系统出现路易小体病变,并且患者常表现出明显的肠道功能障碍[1]。近年来研究发现,肠道菌群失调可引起肠道多种炎症反应,通过肠脑轴(gut microbiota-brain axis,GMBA),使机体神经系统产生路易小体病变[2]。因此有****认为肠道是PD早期发病的场所,肠道菌群失调是PD发生的潜在因素[3]。本文着眼于肠道菌群失调与PD发生的相关性,梳理已有丰富研究成果,讨论肠道菌群紊乱与PD的作用机制,探讨基于菌群基础的PD治疗技术,旨在为进一步预防与治疗PD提供科学依据。
1 肠道菌群 肠道菌群(gut microbiota,GM)在人体内有着十分重要的作用,被研究者称为“遗忘的器官”。其主要由后壁菌、拟杆菌、放线菌、变性杆菌4个门类组成,数量约有100万亿,约为人体内所有细胞总数的10倍。不仅如此,这些GM的所有基因组约有300万个,约为人体基因组的150倍。其中,约三分之一的菌群具有稳定性,这些菌群普遍存在于人体中,三分之二的菌群具有个体差异性,在不同人体内,种类和含量具有明显差异[4]。目前,人体内约50%-60%的菌群尚未明确分型;更重要的是,菌群在体内的代谢产物对机体的能量与物质代谢具有十分重要的影响[5-6]。因此,近年来肠道菌群是众多****关注的热点。目前,已有众多研究表明,帕金森病、肥胖、Ⅱ型糖尿病、肠应激综合征和动脉粥样硬化等疾病与肠道菌群的失调密切相关[7]。并且,随着研究的深入,研究者还发现了肠道菌群和大脑的双边通路,称为“肠脑轴”,而这一通路已被证实可以影响大脑等神经系统的功能,从而解释了肠道菌群会影响神经系统的正常功能[8-10]。
2 帕金森病 PD的主要临床特征是:肌肉强直、震颤麻痹、运动障碍、体态平衡障碍及语言表达障碍;典型的病理变化是:黑质纹状体变性、减少、缺失,神经元α突触核蛋白过表达、沉积以及路易小体的形成[11-14],目前,PD的发病原因和机制尚不明确,但在PD发病早期,患者常伴有明显的肠道症状,如肠道蠕动减慢,便秘等[15-16],严重影响患者的生活健康。
α突触核蛋白是广泛分布在神经系统的神经元蛋白,其大小为19 kDa,由140个氨基酸残基组成;虽然α突触核蛋白的生理功能尚未完全研究清楚,但****推断其可能对神经突触具有保护功能;与黑质纹状体多巴胺合成相关[17]。并且,还与细胞抗氧化和热应激反应相关[18]。
3 帕金森病与肠道菌群相关性研究现状 关于PD与GM相关性的研究,历史久远。1980年PD标志物首次在肠道中被发现,自此GM逐渐成为探索PD发作机制的重要研究思路。至1990年,Braak研究团队首次提出关于PD与肠道相关性的重要假说,并通过临床试验验证该假说,使得PD与GM相关性研究真正成为PD发生机制研究的主要方向。进入21世纪,众多研究者不仅相继验证了Braak的经典假说,而且还进一步研究PD发作所引起的菌群与机体代谢变化。
3.1 帕金森病起源于肠道 在PD与GM相关性的众多研究中,最经典的研究成果属于Braak团队的研究,其一方面推测了PD病在肠道中的发生过程,另一方面通过临床试验验证该假说并总结了PD的病程分期。
3.1.1 相关假说起源: 1980年,PD病人胃肠道中首次发现了路易氏小体,并将其作为PD发生的重要标志物被报道[19],提示相关****PD发病起因源于胃肠道。针对该研究成果,Braak研究团队进一步进行了深入研究,并在其相关研究基础上提出了关于PD产生机理的重要假说。认为,胃肠道的固有神经与外周神经、迷走神经背侧核(dorsal motor nucleus of the vagus,DMV),以及肠道神经系统(enteric nervous system,ENS)均在PD发生早期受到未知病原不同程度的侵害。甚至,这一变化要早于黑质纹状体功能异常[20-21]。并且,Braak还指出PD病原为一种嗜神经的病原,这种病原最先引起肠道病变,破坏ENS并使其产生路易小体病变,接着沉积的路易小体通过迷走神经到达DMV,并最终到达黑质纹状体并进行沉积,从而引起PD的临床症状[22-23]。基于Braak的推论,肠道中出现路易小体病变的现象基本得到解释:肠道首先受到PD病原的侵袭,继而引发PD的后续相关反应,虽然其推论仅停留在假设层面,但该推论直接表明肠道在PD的发生中起到至关重要的作用。
Braak提出关于PD发病机制相关推论后,该推论得到了相关研究者的关注,为了进一步验证推论的正确性,其研究团队进行了尸体解剖实验。团队系统地研究了5位患者(中枢神经系统有明显路易小体病变)与相同人数的健康对照组的胃、肠粘膜层、肌层神经丛,发现这5位患者的肠粘膜层、肌层以及DMV中均沉积了α-突触核蛋白,其中有3位患者最终诊断为帕金森疾病,且黑质纹状体内沉积了大量的α-突触核蛋白。虽然,其余2人没有表现出PD明显的临床症状,但两者的胃肠与DMV均发现了沉积的α-突触核蛋白,甚至其中1人的黑质纹状体内已经开始出现路易小体病变。这些现象不仅表明胃肠道是最早出现路易小体病变的部位之一,且胃肠内的神经丛也是最先受到病原侵害的部位之一,在尚未出现明显的PD症状之前,肠道中就已经存在典型病变,从这一临床解剖的实验成果,证明了Braak关于PD与肠道相关性的推断。
基于先前大量研究基础,Braak还推测了肠神经在PD发生中的作用,同时划分了PD的发生及临床表现时期。在PD的发病早期,胃肠道神经丛会参与其中;帕金森病的标志物(路易小体)不止出现在疾病末期,在没有PD临床症状的人群中,胃肠道和其他部位的神经丛内也可能出现PD典型的病理变化,即α-突触核蛋白的沉积。据此,PD的发展阶段可以大概分为3个时期:病原最初侵犯多个不同部位的神经系统;接着继续侵害胃肠道内神经丛;最后到达中枢神经。这样就形成了一个从肠道到中枢神经系统的循环链,从而PD病原可以通过肠上皮到达肠道神经丛并沉积α-突触核蛋白产生路易小体病变。不仅如此,沉积的α-突触核蛋白可以通过该循环到达中枢神经系统,从而破坏神经系统的正常功能。与之相对应的临床症状则可分为六期:前一、二期为运动症状前期,病人临床表现为便秘和嗅觉减退,这时路易小体可能出现在嗅球和DMV,随后到达脑干并继续沉积;第三期时,路易小体到达黑质内且病人出现了典型的运动障碍症状;最后三期中,路易小体到达纹状体和大脑皮层中,病人开始出现认知功能下降和严重的肢体运动障碍[24-25]。
3.1.2 临床验证假说: Braak的推论中,ENS是最初受损部位,其受损后进一步传递病原使得其他神经系统产生路易小体病变,并最终导致大脑病变。因此,ENS是PD研究的热点,大多研究均想从ENS中找到PD发生的内在机理。Svensson和Liu在长达30年的研究中均发现:切除腹部迷走神经(不切除胃迷走神经的传出神经)显著降低病人罹患PD疾病的概率。由此表明,切除迷走神经不仅会降低患PD的风险,而且也提示其在PD病原转移中发挥了重要作用,间接支持了Braak关于PD发病机制的假说[26]。Stokholm等从39例PD病人(均为前期)的不同肠道组织的石蜡切片中发现,22例病人的肠道神经丛存在磷酸化的α-突触核蛋白沉积物,这些临床观察与活体组织实验均支持Braak的假设[27]。Pouclet从9例患者中发现4例患者的结肠粘膜下层中沉积着路易小体,且其中3例可以直接在粘膜中检测到沉积的α-突触核蛋白,而对照组(10例)中均未检测到病变的α-突触核蛋白[28-29]。目前,虽然所遇到的技术瓶颈是如何从正常的α-突触核蛋白中找到异常的α-突触核蛋白(错误折叠、沉积或纤维化),但现有的研究均表明异常的α-突触核蛋白都是最先从肠道中开始积聚。Pan的研究表明,鱼藤酮灌胃小鼠后,诱导其产生PD样的神经病变,结果发现典型的PD病变最早出现在小鼠的肠道ENS中,且最后仅出现在黑质纹状体内[30],通过进一步研究,Pan还发现这一诱导结果可以被迷走神经切除术或半迷走神经切除术阻碍。不仅如此,鱼藤酮可以使肠神经释放α-突触核蛋白,而这些释放的α-突触核蛋白被突触前神经元摄取并以逆行的方式转运到DMV[31]。之后,Holmqvist的实验进一步支持了这一现象,具体操作是:将单体或低聚α-突触核蛋白注入大鼠肠壁后,α-突触核蛋白从肠道向脑干主动转运,这一现象与Braak推断肠神经是最早沉积路易氏小体的部位相吻合[32]。
3.2 肠道菌群是帕金森病的潜在致病因素 基于PD与GM相关性的众多研究成果,以及患者常伴有明显的消化道症状,所以患者GM的组成分析成为PD发病机制研究的重点。近年来,大量的研究结果表明,肠道菌群紊乱是PD的潜在致病因素。Forsyth与Keshavarizian等的研究表明,PD可能是由紊乱的GM而并非由传统认知中的病原体或环境毒素,通过损伤肠道神经丛造成的[33-34]。肠道菌群及其代谢物通过增加肠道的通透性与细菌易位,激发肠道局部及系统性炎症与氧化应激反应,使得肠道中产生了路易小体病变。此外,菌群的部分代谢产物(脂多糖等)可以破坏血脑屏障,促发黑质神经的炎症与损伤[35]。Devos等从PD患者结肠活组织中检测到促炎因子如TNF-α、IFN-γ、IL-6等表达水平的升高,以及小胶质细胞的活化证明了肠道菌群是PD的潜在致病因素[36]。此外,宏基因组的研究表明,Helicobacter pylori是与PD发生联系最为紧密的菌群。基于大多数PD患者的研究结果表明,PD患者不仅H. Pylori的感染率很高,而且他们均有运动和左旋多巴(治疗PD的特效药物)吸收障碍的现象[37],不仅如此,患者小肠内菌群发生显著失调并有菌群过度繁殖的现象,且这一现象也会引起患者运动功能障碍[38]。Scheperjans的最近研究发现,患者粪便中Prevotellaceae菌科显著减少,Lactobacilliceae菌科显著增加,且Prevotellaceae菌科的菌群可能与肠道内黏蛋白生物合成有关,而黏蛋白的变化又可以改变患者肠道的渗透性,所以使外界病原更容易进入肠粘膜下神经丛,且这两种菌群的共同变化又影响患者体内生长素水平,生长素的作用是保护和维持黑质纹状体的正常功能,其含量改变可进一步影响黑质纹状体的功能,从而改变患者的神经功能[39-40]。并且,研究还发现,Enterobacteriaceae菌科的丰度与PD的严重程度与步态障碍有直接的正相关关系[39]。在Keshavarzian的研究中,PD患者表现为肠粘膜渗透性增加,大肠内毒素全身性中毒,并且患者粪便中Blautia、Coprococcus、Roseburia以及属于Faecalibacterium菌门的未知菌属菌群明显减少,患者肠粘膜中的Ralstonia菌属明显增加。这些菌群大多为抗炎、产丁酸盐(短链脂肪酸的一种)的菌群,其变化会引起短链脂肪酸(short chain fatty,SCFAs)的代谢水平发生变化从而改变肠道的渗透性[41]。基于基因水平分析患者代谢状况的研究表明,患者脂多糖生物合成和代谢水平发生了明显失调,SCFAs代谢水平及硫胺素和叶酸体内合成水平显著下调[41]。并且,通过干预PD患者的肠道菌群发现,人为移植的菌群会通过GMBA来调控多巴胺合成酶的作用,使得多巴胺在大脑中合成增加,并且促进肠道中如Bacillus spp.等合成多巴胺的菌群明显增加[42]。之后,随着研究的深入,Unger发现PD患者不仅肠道菌群的组成发生了明显变化,而且粪便中的SCFAs混合物也明显下降,包括醋酸盐、丙酸盐和丁酸盐,而这些SCFAs混合物的减少会引起肠ENS功能异常以及GM失调[43-44]。Sampson通过转基因大鼠(α-突触核蛋白过表达)与无菌小鼠对比实验,证明PD病人肠道菌群的分泌物SCFAs可以激活胶质细胞,加重PD的病程,加剧患者的运动功能障碍,并且移植PD患者的肠道菌群可以使无菌小鼠出现PD症状[45]。由此,PD病原可能是通过改变肠道菌群的组成,使得宿主肠道菌群组成紊乱,诱发肠道炎症级联反应从而导致或加重PD,使肠道和大脑中产生了α-突触核蛋白沉积的典型病变,且肠道中增加的促炎菌群通过调节脂多糖代谢,使机体氧化应激反应明显加剧,从而加重了疾病的进程。
4 帕金森病与肠道菌群相关性研究的现状思考 自Braak提出关于PD与肠道相关性的假说以来,该假说一直成为该研究方向的重要理论支持,虽然该假说仍然存有争论,但与该假说相关的研究却一直走向深入,使得PD在胃肠道的发病过程的假设也逐步清晰。现有众多研究发现,肠道菌群失调可能引发PD在肠道中发病,失调的菌群主要通过自身易位与改变肠道内环境,从而引发肠道局部炎症反应,产生路易小体病变,进一步通过自身代谢产物(脂多糖、SCFAs等)调节机体代谢,并通过神经系统传递到大脑中,引发大脑黑质神经炎症与损伤,产生PD临床症状。从此类众多研究中可以推断,PD的发病机制或是由肠道菌群诱导产生,并通过诱导肠道炎症与氧化应激反应引起α-突触核蛋白的错误折叠或聚集,并通过神经细胞进行传递、转移,使得多巴胺神经缺失,最终造成多巴胺含量的减少。虽然,目前该推断尚未最终被验证,但是通过以上几个角度对该相关性进行分析,可以最终推断确定PD发生与肠道菌群紊乱具有一定相关性(图 1)。
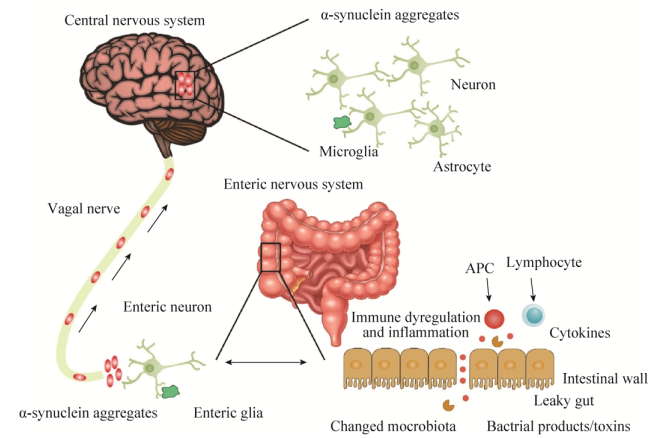 |
| 图 1 现有研究推测PD发生的机制 Figure 1 The existing studies on the mechanism of PD. |
| 图选项 |
5 基于粪便移植疗法的PD治疗技术 粪便移植(fecal microbiota transplant,FMT)或粪便菌群疗法是指收集健康人群的粪便然后移植到肠道功能紊乱病人的胃肠道内,其目的是对患者肠道内的菌群进行重建。其过程包括筛选病原,随后纯化、过滤,再悬浮粪便样品,并最终通过鼻胃管、灌肠等方法灌注到患者的消化道中[46]。对PD患者而言,其遭受了严重的肠道功能障碍,如长期便秘,直肠运动障碍等[47],研究发现FMT不仅可有效减缓并治疗PD患者的胃肠功能紊乱的临床症状,还可以改善肠道功能失调的症状。已有研究结果表明,FMT治疗PD患者肠道功能障碍的特点是:可以直接与迷走神经发生作用,改变患者的激素代谢水平,引起免疫反应,并刺激神经产生相应的代谢物。PD患者大多都存在肠道功能障碍等症状,而现有的研究也正努力探索肠道菌群和PD病原之间的潜在关系[48]。自主神经系统和大脑边缘系统对肠道健康和机体的行为有重要作用,自主神经系统连接肠道和大脑,从肠道神经丛到大脑边缘系统,包括大脑海马体、杏仁核和边缘皮质[49-50]。其中,边缘皮质控制机体运动,所以在自主神经系统中更为重要,并在PD病人中常常受到严重的损伤,其所属的迷走神经作为GMBA中主要的通路负责传递信号。研究表明,小鼠接种PD患者的粪便后,不仅运动功能明显受到损伤,而且肠道中的Lachnospiraceae和Ruminococceae菌科也明显下降,且这一变化与原粪便捐献患者的菌群变化相一致[51]。目前粪便移植疗法用于治疗多种疾病(PD、阿尔兹海默、多发性硬化、肌张力障碍综合征等)的肠道功能障碍(便秘、肠道运动障碍、结肠溃疡等),现在该疗法对于神经系统尤其是迷走神经的刺激作用已经得到了证明,最新的研究也发现FMT对于没有肠道功能障碍症状的上述疾病也有缓解作用[52-53]。未来,FMT疗法与自主神经系统关系的研究可能会为PD病原和GM相关性的研究提供更多思路和启示;并且相比较其他化学药物治疗(左旋多巴等),FMT疗法不仅副作用小,且或许能从根源上改善PD病症。
6 讨论 综上所述,目前可以确定的是,PD患者的肠道菌群紊乱会通过多种途径加重大脑的路易小体病变,加剧PD病程;但目前尚未确定的是,PD与GM紊乱的因果关系;值得庆幸的是,大量研究结论均表明,肠道菌群或通过炎症反应与氧化应激作用,使得肠道及神经系统出现路易小体病变,并最终破坏黑质纹状体的正常功能。在未来,凭借诸如粪便移植等先进临床靶向诊疗手段,着手解决肠道神经丛的生物标志物,发现肠道在PD中的易损部位,并找到最先出现路易小体病变的部位,相信PD与肠道菌群相关性的问题会迎刃而解,而PD的发病机制也将最终得以解决。
References
| [1] | Visanji NP, Brooks PL, Hazrati LN, Lang AE. The prion hypothesis in Parkinson's disease: Braak to the future. Acta Neuropathologica Communications, 2013, 1: 2. DOI:10.1186/2051-5960-1-2 |
| [2] | Vizcarra JA, Wilson-Perez HE, Espay AJ. The power in numbers: gut microbiota in Parkinson's disease. Movement Disorders, 2015, 30(3): 296-298. DOI:10.1002/mds.26116 |
| [3] | Klingelhoefer L, Reichmann H. Pathogenesis of Parkinson's disease—the gut-brain axis and environmental factors. Nature Reviews Neurology, 2015, 11(11): 625-636. DOI:10.1038/nrneurol.2015.197 |
| [4] | Franzosa EA, Huang K, Meadow JF, Gevers D, Lemon KP, Bohannan BJM, Huttenhower C. Identifying personal microbiomes using metagenomic codes. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(22): E2930-E2938. DOI:10.1073/pnas.1423854112 |
| [5] | Walker AW, Duncan SH, Louis P, Flint HJ. Phylogeny, culturing, and metagenomics of the human gut microbiota. Trends in Microbiology, 2014, 22(5): 267-274. DOI:10.1016/j.tim.2014.03.001 |
| [6] | Browne HP, Forster SC, Anonye BO, Kumar N, Neville BA, Stares MD, Goulding D, Lawley TD. Culturing of 'unculturable' human microbiota reveals novel taxa and extensive sporulation. Nature, 2016, 533(7604): 543-546. DOI:10.1038/nature17645 |
| [7] | de Vos WM, de Vos EAJ. Role of the intestinal microbiome in health and disease: from correlation to causation. Nutrition Reviews, 2012, 70(S1): S45-S56. |
| [8] | Forsythe P, Kunze WA. Voices from within: gut microbes and the CNS. Cellular and Molecular Life Sciences, 2013, 70(1): 55-69. |
| [9] | Cryan JF, Dinan TG. Mind-altering microorganisms: the impact of the gut microbiota on brain and behaviour. Nature Reviews Neuroscience, 2012, 13(10): 701-712. DOI:10.1038/nrn3346 |
| [10] | Bercik P, Denou E, Collins J, Jackson W, Lu J, Jury J, Deng YK, Blennerhassett P, Macri J, McCoy KD, Verdu EF, Collins SM. The intestinal microbiota affect central levels of brain-derived neurotropic factor and behavior in mice. Gastroenterology, 2011, 141(2): 599-609. DOI:10.1053/j.gastro.2011.04.052 |
| [11] | Jost WH. Gastrointestinal dysfunction in Parkinson's Disease. Journal of the Neurological Sciences, 2010, 289(1/2): 69-73. |
| [12] | Abbott RD, Petrovitch H, White LR, Masaki KH, Tanner CM, Curb JD, Grandinetti A, Blanchette PL, Popper JS, Ross GW. Frequency of bowel movements and the future risk of Parkinson's disease. Neurology, 2001, 57(3): 456-462. DOI:10.1212/WNL.57.3.456 |
| [13] | Abbott RD, Ross GW, White LR, Sanderson WT, Burchfiel CM, Kashon M, Sharp DS, Masaki KH, Curb JD, Petrovitch H. Environmental, life-style, and physical precursors of clinical Parkinson's disease: recent findings from the Honolulu-Asia Aging Study. Journal of Neurology, 2003, 250(S3): iii30-iii39. |
| [14] | Haehner A, Boesveldt S, Berendse HW, Mackay-Sim A, Fleischmann J, Silburn PA, Johnston AN, Mellick GD, Herting B, Reichmann H, Hummel T. Prevalence of smell loss in Parkinson's disease—a multicenter study. Parkinsonism & Related Disorders, 2009, 15(7): 490-494. |
| [15] | Erro R, Brigo F, Tamburin S, Zamboni M, Antonini A, Tinazzi M. Nutritional habits, risk, and progression of Parkinson disease. Journal of Neurology, 2018, 265(1): 12-23. DOI:10.1007/s00415-017-8639-0 |
| [16] | Quigley EM. Gastrointestinal dysfunction in Parkinson's disease//Seminars in Neurology, 1996. |
| [17] | Sidhu A, Wersinger C, Vernier P. α-Synuclein regulation of the dopaminergic transporter: a possible role in the pathogenesis of Parkinson's disease. FEBS Letters, 2004, 565(1/3): 1-5. |
| [18] | Lee VMY, Trojanowski JQ. Mechanisms of Parkinson's disease linked to pathological α-synuclein: new targets for drug discovery. Neuron, 2006, 52(1): 33-38. DOI:10.1016/j.neuron.2006.09.026 |
| [19] | Edwards LL, Quigley EM, Pfeiffer RF. Gastrointestinal dysfunction in Parkinson's disease: frequency and pathophysiology. Neurology, 1992, 42(4): 726-732. DOI:10.1212/WNL.42.4.726 |
| [20] | Lee HJ, Suk JE, Bae EJ, Lee JH, Paik SR, Lee SJ. Assembly-dependent endocytosis and clearance of extracellular a-synuclein. The International Journal of Biochemistry & Cell Biology, 2008, 40(9): 1835-1849. |
| [21] | Lee HJ, Patel S, Lee SJ. Intravesicular localization and exocytosis of α-synuclein and its aggregates. Journal of Neuroscience, 2005, 25(25): 6016-6024. DOI:10.1523/JNEUROSCI.0692-05.2005 |
| [22] | Shimozawa A, Ono M, Takahara D, Tarutani A, Imura S, Masuda-Suzukake M, Higuchi M, Yanai K, Hisanaga SI, Hasegawa M. Propagation of pathological α-synuclein in marmoset brain. Acta Neuropathologica Communications, 2017, 5: 12. DOI:10.1186/s40478-017-0413-0 |
| [23] | Ulusoy A, Rusconi R, Pérez-Revuelta BI, Musgrove RE, Helwig M, Winzen-Reichert B, Di Monte DA. Caudo-rostral brain spreading of α-synuclein through vagal connections. EMBO Molecular Medicine, 2013, 5(7): 1119-1127. DOI:10.1002/emmm.201302475 |
| [24] | Braak H, Rüb U, Gai WP, Del Tredici K. Idiopathic Parkinson's disease: possible routes by which vulnerable neuronal types may be subject to neuroinvasion by an unknown pathogen. Journal of Neural Transmission (Vienna), 2003, 110(5): 517-536. DOI:10.1007/s00702-002-0808-2 |
| [25] | Braak H, de Vos RAI, Bohl J, del Tredici K. Gastric α-synuclein immunoreactive inclusions in Meissner's and Auerbach's plexuses in cases staged for Parkinson's disease-related brain pathology. Neuroscience Letters, 2006, 396(1): 67-72. DOI:10.1016/j.neulet.2005.11.012 |
| [26] | Svensson E, Horváth-Puhó E, Thomsen RW, Djurhuus JC, Pedersen L, Borghammer P, S rensen HT. Vagotomy and subsequent risk of Parkinson's disease. Annals of Neurology, 2015, 78(4): 522-529. DOI:10.1002/ana.v78.4 |
| [27] | Shannon KM, Keshavarzian A, Dodiya HB, Jakate S, Kordower JH. Is alpha-synuclein in the colon a biomarker for premotor Parkinson's disease? Evidence from 3 cases. Movement Disorders, 2012, 27(6): 716-719. DOI:10.1002/mds.v27.6 |
| [28] | Borghammer P. How does parkinson's disease begin? Perspectives on neuroanatomical pathways, prions, and histology. Movement Disorders, 2018, 33(1): 48-57. DOI:10.1002/mds.27138 |
| [29] | Corbille AG, Letournel F, Kordower JH, Lee J, Shanes E, Neunlist M, Munoz DG, Derkinderen P, Beach TG. Evaluation of alpha-synuclein immunohistochemical methods for the detection of Lewy-type synucleinopathy in gastrointestinal biopsies. Acta Neuropathologica Communications, 2016, 4: 35. DOI:10.1186/s40478-016-0305-8 |
| [30] | Pan-Montojo F, Anichtchik O, Dening Y, Knels L, Pursche S, Jung R, Jackson S, Gille G, Spillantini MG, Reichmann H, Funk RHW. Progression of Parkinson's disease pathology is reproduced by intragastric administration of rotenone in mice. PLoS One, 2010, 5(1): e8762. DOI:10.1371/journal.pone.0008762 |
| [31] | Fasano A, Visanji NP, Liu LWC, Lang AE, Pfeiffer RF. Gastrointestinal dysfunction in Parkinson's disease. The Lancet Neurology, 2015, 14(6): 625-639. DOI:10.1016/S1474-4422(15)00007-1 |
| [32] | Holmqvist S, Chutna O, Bousset L, Aldrin-Kirk P, Li W, Bj?rklund T, Wang ZY, Roybon L, Melki R, Li JY. Direct evidence of Parkinson pathology spread from the gastrointestinal tract to the brain in rats. Acta Neuropathologica, 2014, 128(6): 805-820. DOI:10.1007/s00401-014-1343-6 |
| [33] | Forsyth CB, Shannon KM, Kordower JH, Voigt RM, Shaikh M, Jaglin JA, Estes JD, Dodiya HB, Keshavarzian A. Increased intestinal permeability correlates with sigmoid mucosa alpha-synuclein staining and endotoxin exposure markers in early Parkinson's disease. PLoS One, 2011, 6(12): e28032. DOI:10.1371/journal.pone.0028032 |
| [34] | Keshavarzian A, Green SJ, Engen PA, Voigt RM, Naqib A, Forsyth CB, Mutlu E, Shannon KM. Colonic bacterial composition in Parkinson's disease. Movement Disorders, 2015, 30(10): 1351-1360. DOI:10.1002/mds.26307 |
| [35] | Chen WC, Quigley EM. Probiotics, prebiotics & synbiotics in small intestinal bacterial overgrowth: opening up a new therapeutic horizon!. Indian Journal of Medical Research, 2014, 140(5): 582-584. |
| [36] | Devos D, Lebouvier T, Lardeux B, Biraud M, Rouaud T, Pouclet H, Coron E, Bruley Des Varannes S, Naveilhan P, Nguyen JM, Neunlist M, Derkinderen P. Colonic inflammation in Parkinson's disease. Neurobiology of Disease, 2013, 50: 42-48. DOI:10.1016/j.nbd.2012.09.007 |
| [37] | Mridula KR, Borgohain R, Chandrasekhar Reddy V, Bandaru VCS, Suryaprabha T. Association of Helicobacter pylori with Parkinson's Disease. Journal of Clinical Neurology, 2017, 13(2): 181-186. DOI:10.3988/jcn.2017.13.2.181 |
| [38] | Fasano A, Bove F, Gabrielli M, Petracca M, Zocco MA, Ragazzoni E, Barbaro F, Piano C, Fortuna S, Tortora A, Di Giacopo R, Campanale M, Gigante G, Lauritano EC, Navarra P, Marconi S, Gasbarrini A, Bentivoglio AR. The role of small intestinal bacterial overgrowth in Parkinson's disease. Movement Disorders, 2013, 28(9): 1241-1249. DOI:10.1002/mds.v28.9 |
| [39] | Scheperjans F, Aho V, Pereira PAB, Koskinen K, Paulin L, Pekkonen E, Haapaniemi E, Kaakkola S, Eerola-Rautio J, Pohja M, Kinnunen E, Murros K, Auvinen P. Gut microbiota are related to Parkinson's disease and clinical phenotype. Movement Disorders, 2015, 30(3): 350-358. DOI:10.1002/mds.26069 |
| [40] | Forsyth CB, Shannon KM, Kordower JH, Voigt RM, Shaikh M, Jaglin JA, Estes JD, Dodiya HB, Keshavarzian A. Increased intestinal permeability correlates with sigmoid mucosa alpha-synuclein staining and endotoxin exposure markers in early Parkinson's disease. PLoS One, 2011, 6(12): e28032. DOI:10.1371/journal.pone.0028032 |
| [41] | Brown CT, Davisrichardson AG, Giongo A, Gano KA, Crabb DB, Mukherjee N, Casella G, Drew JC, Ilonen J, Knip M, Hy?ty H, Veijola R, Simell T, Simell O, Neu J, Wasserfall CH, Schatz D, Atkinson MA, Triplett EW. Gut microbiome metagenomics analysis suggests a functional model for the development of autoimmunity for type 1 diabetes. PLoS One, 2011, 6(10): e25792. DOI:10.1371/journal.pone.0025792 |
| [42] | Galán JE, Collmer A. Type Ⅲ secretion machines: bacterial devices for protein delivery into host cells. Science, 1999, 284(5418): 1322-1328. DOI:10.1126/science.284.5418.1322 |
| [43] | Unger MM, M?ller JC, Mankel K, Eggert KM, Bohne K, Bodden M, Stiasny-Kolster K, Kann PH, Mayer G, Tebbe JJ, Oertel WH. Postprandial ghrelin response is reduced in patients with Parkinson's disease and idiopathic REM sleep behaviour disorder: a peripheral biomarker for early Parkinson's disease?. Journal of Neurology, 2011, 258(6): 982-990. DOI:10.1007/s00415-010-5864-1 |
| [44] | Unger MM, Spiegel J, Dillmann KU, Grundmann D, Philippeit H, Bürmann J, Fa bender K, Schwiertz A, Sch fer KH. Short chain fatty acids and gut microbiota differ between patients with Parkinson's disease and age-matched controls. Parkinsonism & Related Disorders, 2016, 32: 66-72. |
| [45] | Sampson TR, Debelius JW, Thron T, Janssen S, Shastri GG, Ilhan ZE, Challis C, Schretter CE, Rocha S, Gradinaru V, Chesselet MF, Keshavarzian A, Shannon KM, Krajmalnik-Brown R, Wittung-Stafshede P, Knight R, Mazmanian SK. Gut microbiota regulate motor deficits and neuroinflammation in a model of Parkinson's Disease. Cell, 2016, 167(6): 1469-1480. DOI:10.1016/j.cell.2016.11.018 |
| [46] | Aas J, Gessert CE, Bakken JS. Recurrent Clostridium difficile colitis: case series involving 18 patients treated with donor stool administered via a nasogastric tube. Clinical Infectious Diseases, 2003, 36(5): 580-585. DOI:10.1086/cid.2003.36.issue-5 |
| [47] | Lesser GT. Frequency of bowel movements and future risk of Parkinson's disease. Neurology, 2002, 58(5): 838. |
| [48] | Panchal P, Budree S, Scheeler A, Medina G, Seng M, Wong WF, Eliott R, Mitchell T, Kassam Z, Allegretti JR, Osman M. Scaling safe access to fecal microbiota transplantation: past, present, and future. Current Gastroenterology Reports, 2018, 20(4): 14. DOI:10.1007/s11894-018-0619-8 |
| [49] | Borody TJ, Khoruts A. Fecal microbiota transplantation and emerging applications. Nature Reviews Gastroenterology & Hepatology, 2011, 9(2): 88-96. |
| [50] | Unger MM, M?ller JC, Mankel K, Eggert KM, Bohne K, Bodden M, Stiasny-Kolster K, Kann PH, Mayer G, Tebbe JJ, Oertel WH. Postprandial ghrelin response is reduced in patients with Parkinson's disease and idiopathic REM sleep behaviour disorder: a peripheral biomarker for early Parkinson's disease?. Journal of Neurology, 2011, 258(6): 982-990. DOI:10.1007/s00415-010-5864-1 |
| [51] | Andrews ZB, Erion D, Beiler R, Liu ZW, Abizaid A, Zigman J, Elsworth JD, Savitt JM, DiMarchi R, Tsch?p M, Roth RH, Gao XB, Horvath TL. Ghrelin promotes and protects nigrostriatal dopamine function via a UCP2-dependent mitochondrial mechanism. Journal of Neuroscience, 2009, 29(45): 14057-14065. DOI:10.1523/JNEUROSCI.3890-09.2009 |
| [52] | De Vos WM, De Vos EAJ. Role of the intestinal microbiome in health and disease: from correlation to causation. Nutrition Reviews, 2012, 70(S1): S45-S56. |
| [53] | Parashar A, Udayabanu M. Gut microbiota: implications in Parkinson's disease. Parkinsonism & Related Disorders, 2017, 38: 1-7. |
