王杨#, 陈菲#, 谢明杰


辽宁师范大学生命科学学院, 辽宁省生物技术与分子药物研发重点实验室, 辽宁 大连 116081
收稿日期:2017-12-30;修回日期:2018-03-25;网络出版日期:2018-06-15
基金项目:辽宁省大学生创新创业训练计划(201710165000223);辽宁省自然科学基金(201602462);辽宁省教育厅科学研究一般项目(L201683675)
*通信作者:谢明杰, Tel:+86-411-85827068, E-mail:xmj1222@sina.com
#并列第一作者
摘要:[目的]研究紫草素抑制白色念珠菌的作用机制。[方法]通过微量稀释法测定紫草素对白色念珠菌的最低抑菌浓度(MIC)和最低杀菌浓度(MFC);紫外分光光度法测定紫草素对白色念珠菌细胞膜渗透性的影响;扫描电镜观察紫草素对菌体形态的影响;激光共聚焦显微镜测定紫草素对白色念珠菌细胞内钙离子浓度的影响;卵黄平板培养基法检测紫草素对白色念珠菌的细胞膜磷脂酶活性的影响;RT-PCR检测紫草素对白色念珠菌PLB1和PLB2基因表达量的影响。[结果]紫草素对白色念珠菌有较强的抑制作用,其对白色念珠菌的MIC和MFC分别为16μg/mL和32μg/mL。紫草素能破坏白色念珠菌细胞膜的完整性,使细胞膜的通透性增加,导致细胞内DNA和RNA等大分子物质的泄漏和细胞内钙离子的流失。其中MIC的紫草素作用菌体16 h后,上清液中的DNA和RNA等大分子含量与对照组相比增加了117.32%(P < 0.01);细胞内的[Ca2+]降低了72.02%(P < 0.01)。扫描电镜结果也证明了紫草素对白色念珠菌细胞膜的破坏作用。紫草素也能抑制白色念珠菌分泌磷脂酶,且呈浓度剂量依赖。其中,与对照组相比,MIC的紫草素能使白色念珠菌分泌磷脂酶的量下降56.3%(P < 0.01)。RT-PCR结果显示,紫草素能抑制编码磷脂酶B的基因PLB1和PLB2的表达量,其中1/2 MIC的紫草素作用白色念珠菌16 h后,与对照组相比,PLB1和PLB2基因的相对表达量分别降低了56.4%和61.4%(P < 0.01)。[结论]紫草素对白色念珠菌有较强的抑杀作用,其作用机制是通过破坏白色念珠菌细胞膜的完整性,增加菌体细胞膜的通透性,导致细胞内DNA和RNA等大分子的泄漏和细胞内[Ca2+]的流失,最终引起菌体的死亡。而紫草素对白色念珠菌磷脂酶分泌的抑制作用,致使其不能及时维护和修复由紫草素造成的细胞膜的破坏和损伤,也是导致菌体死亡的原因。
关键词: 紫草素 白色念珠菌 细胞膜 磷脂酶
Inhibitory mechanism of alkannin on Candida albicans
Yang Wang#, Fei Chen#, Mingjie Xie


Key Laboratory of Biotechnology and Molecular Drug Development in Liaoning Province, College of Life Sciences, Liaoning Normal University, Dalian 116081, Liaoning Province, China
Received 30 December 2017; Revised 25 March 2018; Published online 15 June 2018
*Corresponding author: Mingjie Xie, Tel: +86-411-85827068; E-mail: xmj1222@sina.com
Supported by the Liaoning College Students' Innovation and Entrepreneurship Training Program (201710165000223), by the Liaoning Natural Science Foundation Project (201602462) and by the Liaoning Provincial Department of Education General Scientific Research Project (L201683675)
#These authors contributed equally to this work
Abstract: [Objective]This study aims to explore the inhibitory effect of alkannin on Candida albicans and the mechanism.[Methods]The minimal inhibitory concentration and minimal fungicidal concentration of alkannin on C. albicans were measured by microdilution method. The effect of alkannin on the membrane permeability of C. albicans was determined by ultraviolet spectrophotometry. The effect of alkannin on the morphology of C. albicans was observed by scanning electron microscope and the effect of alkannin on intracellular calcium?ion?concentration of C. albicans was determined by laser scanning confocal microscope. The effect of alkannin on membrane phospholipid enzyme activity of C. albicans was determined by egg-yolk agar plate medium method. The effect of alkannin on amount?of?gene?expression of PLB1 and PLB2 was determined by RT-PCR.[Results]Alkannin had potent inhibitory effect on C. albicans, the minimal inhibitory concentration and minimal fungicidal concentration of alkannin on C. albicans were 16 μg/mL and 32 μg/mL respectively. Alkannin could damage the cytomembrane integrity of C. albicans and increased the permeability of cytomembrane, leading to the leakage of macromolecular substances such as DNA and RNA in cells and the loss of intracellular calcium ions. The concentration of macromolecular substances such as DNA and RNA in the supernatant increased by 117.32% (P < 0.01) after alkannin acted on C. albicans for 16 h and the intracellular[Ca2+] decreased by 72.02% (P < 0.01). The scanning result of electron microscopy also proved the destructive?effect of alkannin on C. albicans cytomembrane. Alkannin could inhibit secretion of phospholipase by C. albicans and showed the dose-dependence. Alkannin in minimal inhibitory concentration decreased phospholipase secretion of C. albicans by 56.3% (P < 0.01) compared with the control group. RT-PCR results demonstrated that alkannin could inhibit the expression of PLB1 and PLB2, which were a pair of gene encoding phospholipase B. After alkannin in 1/2 minimal inhibitory concentration acted on C. albicans for 16 h, the expression of PLB1 and PLB2 decreased by 56.4% and 61.4% respectively (P < 0.01) compared with the control group.[Conclusion]Alkannin had a strong inhibitory effect on C. albicans by damaging cytomembrane integrity of C. albicans and increasing the permeability, leading to leak of intracellular macromolecule such as DNA and RNA and loss of[Ca2+], eventually causing cell death. The inhibition of alkannin on phospholipase secretion of C. albicans prevented cells from maintaining and repairing the damage of cytomembrane caused by alkannin, was also one of reasons of cell death.
Keywords: alkannin Candida albicans cytomembrane phospholipase
白色念珠菌(Candida albicans)是临床上最常见的条件致病真菌。一般存在于人体的皮肤、粘膜、阴道等部位。当机体免疫机能降低或其寄居部位微生态环境失调,白色念珠菌就会大量繁殖,引起皮肤、粘膜或内脏感染[1-4]。目前临床上用于治疗白色念珠菌的药物以唑类和多烯类抗生素为主,但由于这些药物均存在一定的毒性,且长期使用后致使白色念珠菌耐药性不断增强,因此目前由白色念珠菌引起的疾病已成为临床上急需解决的问题[5]。紫草是由中国药典收录的中草药,常用于治疗急、慢性肝炎和肝硬化等。紫草素(alkannin)是从紫草中提取的萘醌类化合物,已有的研究结果显示,紫草素具有多种药理作用,如抗肿瘤、抗菌和抗炎等作用[6-8]。目前关于紫草素的抗肿瘤作用研究较多,研究结果显示紫草素类化合物所发挥的抗肿瘤作用,是通过影响肿瘤细胞的代谢、增殖、分化、信号传递和基因表达等来阻碍肿瘤细胞的生长[9-10]。但有关紫草素对真菌的抑制作用目前尚未见相关报道。因此本文以白色念珠菌为实验材料,研究了紫草素对真菌的抑制作用及其机制,旨在为开发抗真菌感染药物提供理论依据。
1 材料和方法 1.1 材料
1.1.1 菌种: 白色念珠菌(Candida albicans ATCC10231),购自中国医学菌种保藏中心。
1.1.2 培养基与试剂: 沙堡葡萄糖琼脂固体培养基(SDA)、RPM-1640液体培养基和酵母浸出粉胨葡萄糖培养基(YEPD);蛋黄培养基;紫草素标准品购于成都曼斯特股份有限公司。
1.1.3 主要实验仪器设备: 酶标仪(Thermo MULTISKAN ASCENT);PCR仪(英国TTECHNE-512型);实时荧光定量PCR仪(日本TAKARATP800);电泳凝胶定量分析系统(Bio-Rad公司,Version 3.1);扫描电镜(KYKY-1000B);激光共聚焦显微镜(Zeizz LSM 710,German)。
1.2 紫草素对白色念珠菌的抑制作用测定 将200 μL培养至对数期的白色念珠菌的菌悬液(106 CFU/mL)分别加入96孔板中,再加入20 μL不同浓度的紫草素药液,使其终浓度分别为64、32、16、8、4 μg/mL,37℃培养24 h后于595 nm处测定吸光值。以不加药物组为空白对照。实验重复3次,取平均值。其中,紫草素对白色念珠菌的最低抑菌浓度(MIC)值为菌体的OD值下降80%以上的最低药物浓度。从大于MIC的各孔中分别取10 μL菌悬液涂布于SDA固体培养基上,37℃培养48 h后观察菌体生长情况,最低杀菌浓度(MFC)为平板上没有菌体生长的最低药物浓度。
1.3 紫草素对白色念珠菌细胞膜渗透性的影响 将培养至对数期的菌悬液按2%接种量接种于20 mL RPM-1640液体培养基中,以150 r/min、30℃恒温培养16 h后,离心弃上清液,用PBS洗涤菌体2次,制成适当浓度的白色念珠菌菌悬液,分别向其中加入浓度为MIC和2MIC的紫草素继续培养12 h,每隔2 h分别取样液4 mL,4000 r/min离心10 min弃沉淀,用紫外分光光度计于260 nm下测定上清液中DNA和RNA等大分子物质的变化。以不加药为空白对照组,实验重复3次,取平均值。
1.4 紫草素对白色念珠菌形态的影响 将培养至对数期的白色念珠菌菌悬液(107 CFU/mL)接种于含紫草素终浓度为MIC的YEPD液体培养基中,150 r/min、30℃振荡培养。于6 h和16 h分别取1 mL菌悬液,3000 r/min离心5 min后弃上清。再加入0.5 mL PBS缓冲液和0.5 mL 2.5%的戊二醛,4℃冰箱固定过夜。次日用PBS缓冲液冲洗2次,50%、80%、100%乙醇依次脱水1次,每次15 min,100%乙醇浸没的电镜样品置4℃冰箱中降温10 min后,放入真空干燥器中干燥40 min。待干燥后的样品温度升至室温后取出,喷金镀膜,使用扫描电镜观察照相,以不加药组为空白对照,实验重复3次。
1.5 紫草素对白色念珠菌细胞内钙离子浓度的影响 将2 mL RPM-1640培养基及300 μL培养至对数期的菌悬液(106 CFU/mL)分别加入6孔板中,每孔内分别放一片无菌盖玻片,37℃培养4 h后,以加入300 μL浓度为MIC的紫草素的孔为实验组,加入300 μL去离子水的孔为空白对照组,37℃下继续培养16 h。然后吸出每孔中的液体,用PBS缓冲液洗涤2次。阴干后于避光环境下向每孔中加入1 mL 5 μmol/L的钙离子荧光探针(Fluo-3AM),于37℃培养箱中孵育45 min进行探针装载。吸出剩余的荧光探针染液并用PBS缓冲液冲洗,置于37℃培养箱中继续孵育15 min,以确保Fluo-3 AM完全转变为Fluo-3。取出盖玻片,用10 μL抗荧光淬灭剂进行封片后,利用激光共聚焦显微镜检测荧光强度,并按照公式(1)计算钙离子浓度([Ca2+])变化百分率。实验重复3次。
 | 公式(1) |
1.6 紫草素对白色念珠菌分泌胞外磷脂酶(phosphlipase,PL)的影响 制备10 μL含紫草素终浓度为1/2 MIC和MIC的菌悬液(106 CFU/mL)并用移液枪接种于卵黄培养基上,以加等量PBS的菌悬液为空白对照,于37℃下培养48 h。待培养结束后,用刻度尺分别测量平板上的菌落直径和沉淀圈直径,每组实验重复3次,取平均值。磷脂酶的活性用PZ值表示,PZ值按下列公式计算。PZ值=菌落直径/总直径。总直径=菌落直径+菌落周围沉淀圈的直径。PZ=1,表示无磷脂酶活性;PZ值< 1,表示有磷脂酶活性,且PZ值越大,磷脂酶的活性越弱。
1.7 紫草素对白色念珠菌PLB1和PLB2相对表达量的影响
1.7.1 白色念珠菌PLB1和PLB2基因的检测: 提取模板DNA,根据GenBank中已发布的白色念珠菌的基因序列,利用Primer 5.0软件及参考文献设计磷脂酶相关基因PLB1和PLB2的上下游引物,琼脂糖凝胶电泳检测PCR扩增产物(表 1)。PCR扩增条件为94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 45 s,30个循环;72℃ 10 min。
表 1. PCR引物 Table 1. Primer sequences used for PCR amplification
| Primer name | Primer sequences (5′→3′) | Size/bp |
| PLB1-F | TGTGGTCAGATGTAACGAGTGC | 299 |
| PLB1-R | AGACAACACCGCTTCGTTGA | |
| PLB2-F | TGGAACCAGGCTTGATGATG | 305 |
| PLB2-R | TCTGACCGTCTTCACCTCCA |
表选项
1.7.2 紫草素对白色念珠菌PLB1和PLB2相对表达量的影响: 将培养至对数期的菌悬液接种到含紫草素终浓度分别为1/8 MIC、1/4 MIC和1/2 MIC的RPM-1640培养基中,30℃、150 r/min培养16 h后,采用Trizol法提取RNA,用微量核酸测量仪进行RNA浓度的定量。采用2步法反转合成模板cDNA,根据设计合成RT-PCR引物进行扩增(表 2)。以18S rRNA为内参基因,以不加药物组为空白对照。待反应结束后分析RT-PCR的扩增曲线和融解曲线,并计算PLB1和PLB2基因的相对表达量。
表 2. RT-PCR引物 Table 2. Primer sequences used for RT-PCR amplification
| Primer name | Primer sequences (5′→3′) | Size/bp |
| PLB1-F | GCAATGTTGACTGGAGCAGGT | 125 |
| PLB1-R | AACCACGATCCACCTGATAACC | |
| PLB2-F | GCTTCCATTGATCCACCGTAA | 135 |
| PLB2-R | GCAATGCCATCTCCTTGTGA |
表选项
1.8 统计学方法 采用SPSS 17.0及Curve Expert 1.3统计软件进行分析,数值用均数±标准差(x±s)表示。予以卡方检验和t检验。以P < 0.05为具有统计学意义。
2 结果和分析 2.1 紫草素对白色念珠菌的抑制作用 实验结果显示,紫草素对白色念珠菌有显著的抑制和杀灭作用,且呈浓度剂量依赖。其抑杀白色念珠菌的MIC和MFC分别为16 μg/mL和32 μg/mL。
2.2 紫草素对白色念珠菌细胞膜渗透性的影响 实验结果显示(图 1),紫草素能导致细胞内DNA和RNA等大分子物质的泄漏,其中MIC的紫草素作用菌体12 h后,上清液中的DNA和RNA等大分子含量与对照组相比增加了117.32% (P < 0.01),表明紫草素可破坏白色念珠菌细胞膜的完整性,使细胞膜的通透性大大增加。
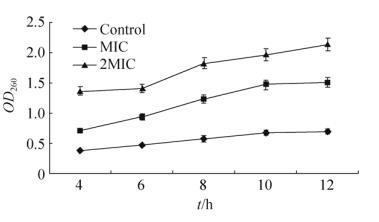 |
| 图 1 紫草素作用白色念珠菌后大分子物质的变化 Figure 1 Effect of alkannin on macromolecules against Candida albicans. |
| 图选项 |
2.3 紫草素对白色念珠菌细胞形态的影响 扫描电镜结果显示(图 2),MIC紫草素作用白色念珠菌后,其细胞形态发生了明显的改变。其中对照组的白色念珠菌(图 2-A),形态规则、外观饱满、表面光滑致密、折光性好。而加药处理6 h后(图 2-B),细胞表面开始变得粗糙,扭曲变形。当药物作用菌体16 h后(图 2-C),大部分菌体严重皱缩、干瘪、扭曲变形,菌体表面凹凸不平,形成囊泡状或不规则的突起结构。
 |
| 图 2 紫草素作用后白色念珠菌形态变化的扫描电镜结果 Figure 2 Scanning electron microscopy results of morphological changes of Candida albicans after alkannin effected. |
| 图选项 |
2.4 紫草素对白色念珠菌钙离子通透性的影响 利用钙离子荧光探针Fluo-3 AM检测细胞内[Ca2+]变化的原理,是Fluo-3 AM进入菌体细胞后,能在细胞内水解酶的作用下水解成Fluo-3,Fluo-3与细胞内钙离子的结合物能在激发光下产生特异的荧光。荧光强度可反映细胞内的[Ca2+],荧光强度越弱,表示细胞内[Ca2+]流失的越多,细胞膜的损伤越严重。激光共聚焦显微镜结果显示(图 3),紫草素能显著降低白色念珠菌细胞内的[Ca2+],与对照组相比,MIC的紫草素能使白色念珠菌细胞内的[Ca2+]降低72.02% (P < 0.01)。表明紫草素能够破坏白色念珠菌细胞膜的完整性使细胞膜的通透性大大增加。
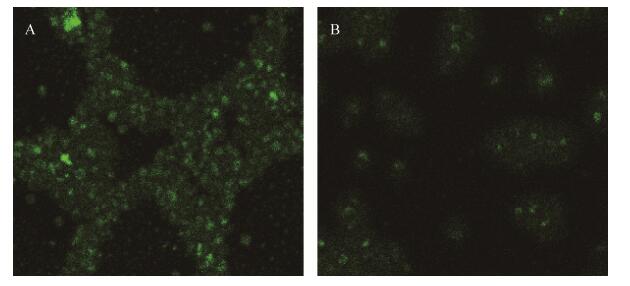 |
| 图 3 紫草素作用白色念珠菌后的荧光强度变化 Figure 3 Fluorescence intensity of Candida albicans after alkannin effected. A: blank control group; B: test group. |
| 图选项 |
2.5 紫草素对白色念珠菌分泌的胞外磷脂酶的影响 采用卵黄培养基平板法检测磷脂酶的原理,是菌体分泌到细胞外的磷脂酶能将培养基中所含的磷脂分解成脂肪酸,脂肪酸与培养基中的钙反应能形成脂肪酸钙沉淀圈。因此根据形成的沉淀圈的大小,即可判断菌体分泌磷脂酶的活性。本实验结果显示(表 3),不同浓度的紫草素均可抑制白色念珠菌分泌磷脂酶,且呈浓度剂量依赖。其中,与对照组相比,MIC的紫草素能使白色念珠菌分泌磷脂酶的量下降56.3% (P < 0.01)。
表 3. 紫草素对白色念珠菌细胞分泌磷脂酶的影响 Table 3. The result of alkannin effected cell membrane phospholipase of Candida albicans
| c(Alkannin)/(μg/mL) | Colony diameter/ mm | Total diameter/mm | PZ |
| Control | 12.0 | 38.0 | 0.32 |
| 1/2MIC | 12.0 | 32.0 | 0.38* |
| MIC | 12.0 | 24.0 | 0.50* |
| *P < 0.01, compared with the control group. | |||
表选项
2.6 紫草素对白色念珠菌PLB1和PLB2基因相对表达量的影响 PCR结果显示,白色念珠菌中存在编码磷脂酶B的相关基因PLB1和PLB2基因(图 4)。RT-PCR结果显示(图 5),紫草素可降低PLB1和PLB2基因的相对表达量,且呈浓度剂量依赖。其中1/2MIC的紫草素作用白色念珠菌16 h后,与对照组相比,PLB1和PLB2基因的相对表达量分别降低了56.4%和61.4% (P < 0.01)。
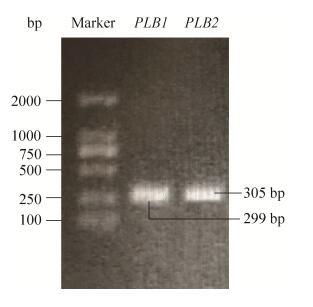 |
| 图 4 白色念珠菌的PLB1和PLB2 PCR扩增结果 Figure 4 Candida albicans PLB1 and PLB2 PCR amplification results. |
| 图选项 |
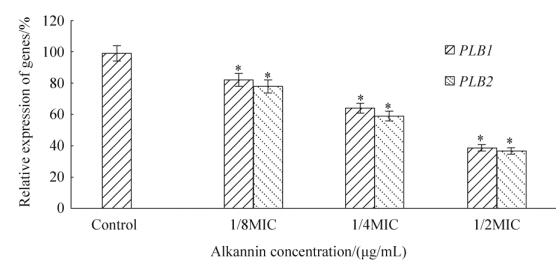 |
| 图 5 紫草素对白色念珠菌细胞膜相关基因表达的影响 Figure 5 Effect of alkannin on Candida albicans cell membrane related gene expression. *P < 0.01, compared with the blank control group. |
| 图选项 |
3 讨论 近年来,由念珠菌导致的真菌感染的发生率逐年上升,占所有真菌感染的73.4%,已成为临床上十分棘手的问题[11-13]。由于目前用于抗真菌感染的药物,普遍存在抗菌谱窄、不良反应强、生物利用度差和易产生耐药性等缺点,因此寻找高效、安全无毒和不易产生耐药性的抗真菌药物成为解决难以治疗的真菌感染的有效途径之一[14-15]。本研究结果显示,紫草素对白色念珠菌有显著的抑制和杀灭作用,其抑杀白色念珠菌的MIC和MFC分别为16 μg/mL和32 μg/mL。
目前临床上应用的抗真菌药物的作用机制不同,有的是抑制真菌细胞壁的合成,如卡泊芬净等;有的是阻止细胞膜的合成,如两性霉素B等;有的是干扰真菌核酸的合成,如灰黄霉素等[16-17]。细胞膜是保证细胞完成各种生理功能的重要屏障结构,可为细胞的生长代谢提供相对稳定的内环境。如果真菌细胞膜受到破坏和损伤,则会影响菌体正常的生长繁殖,当损伤严重时则会导致菌体死亡。本研究结果显示,紫草素对白色念珠菌的抑制作用机制是通过破坏菌体细胞膜的完整性,使细胞膜的通透性大大增加,导致细胞内DNA和RNA等大分子的泄漏和细胞内[Ca2+]的流失,最终引起菌体死亡。扫描电镜结果也证明了紫草素对白色念珠菌细胞膜的破坏作用。
磷脂酶是生物体内负责磷脂代谢和生物合成的一类酶,广泛存在于生物体内,其作用是维护和修复细胞膜的结构,参与细胞内的代谢和信号传导的调节等。目前已经证实磷脂酶在念珠菌对宿主细胞的穿入、损伤和溶解中发挥作用,是白色念珠菌致病的重要毒力因子之一。根据磷脂酶水解磷脂的特异性脂键的不同,可将其分为A、B、C和D等类型。研究发现,白色念珠菌的磷脂酶主要是磷脂酶B,其具有水解酶和溶血磷脂酶-转酰基酶的活性。可通过分解宿主细胞膜中的磷脂,破坏宿主细胞膜的完整性或通透性,来增强白色念珠菌的侵袭力[18-19]。目前在白色念珠菌上已分离到编码磷脂酶B的基因PLB1和PLB2 [20-22]。本研究结果显示,紫草素可以明显抑制白色念珠菌分泌磷脂酶的活性,与对照组相比,MIC的紫草素能使白色念珠菌分泌磷脂酶的量下降56.3% (P < 0.01)。RT-PCR结果显示,紫草素能够抑制PLB1和PLB2基因的相对表达量,其中1/2 MIC的紫草素作用白色念珠菌16 h后,与对照组相比,PLB1和PLB2基因的相对表达量分别降低了56.4%和61.4% (P < 0.01)。该结果除了表明紫草素能够通过抑制磷脂酶的分泌、降低白色念珠菌的感染毒力和致病性外,由于磷脂酶与维护和修复细胞膜的结构有关,还可以推测,紫草素对白色念珠菌的抑杀作用,与磷脂酶分泌量的减少、致使白色念珠菌不能及时维护和修复由紫草素造成的细胞膜的破坏和损伤有关。
综上所述,紫草素对白色念珠菌有较强的抑杀作用,其作用机制是通过破坏白色念珠菌细胞膜的完整性,增加菌体细胞膜的通透性,导致细胞内DNA和RNA等大分子的泄漏和细胞内[Ca2+]的流失,最终引起菌体的死亡。而紫草素对白色念珠菌磷脂酶分泌的抑制作用,致使其不能及时维护和修复由紫草素造成的细胞膜的破坏和损伤,也可能是导致菌体死亡的原因。
References
| [1] | Peleg AY, Hogan DA, Mylonakis E. Medically important bacterial-fungal interactions. Nature Reviews Microbiology, 2010, 8(5): 340-349. DOI:10.1038/nrmicro2313 |
| [2] | Pfaller MA, Diekema DJ. Epidemiology of invasive mycoses in North America. Critical Reviews in Microbiology, 2010, 36(1): 1-53. DOI:10.3109/10408410903241444 |
| [3] | Turner SA, Butler G. The Candida pathogenic species complex. Cold Spring Harbor Perspectives in Medicine, 2014, 4(9): a019778. DOI:10.1101/cshperspect.a019778 |
| [4] | Papon N, Courdavault V, Clastre M, Bennett RJ. Emerging and emerged pathogenic Candida species:beyond the Candida albicans paradigm. PLoS Pathogens, 2013, 9(9): e1003550. DOI:10.1371/journal.ppat.1003550 |
| [5] | Shapiro RS, Robbins N, Cowen LE. Regulatory circuitry governing fungal development, drug resistance, and disease. Microbiology and Molecular Biology Reviews, 2011, 75(2): 213-267. DOI:10.1128/MMBR.00045-10 |
| [6] | Zhai TY, Hei ZY, Ma Q, Liang HB, Xu Y, Zhang YC, Jin LY, Han C, Wang JD. Shikonin induces apoptosis and G0/G1 phase arrest of gallbladder cancer cells via the JNK signaling pathway. Oncology Reports, 2017, 38(6): 3473-3480. |
| [7] | Liu XC, Sun GY. Shikonin enhances Adriamycin antitumor effects by inhibiting efflux pumps in A549 cells. Oncology Letters, 2017, 14(4): 4270-4276. DOI:10.3892/ol.2017.6702 |
| [8] | Chen X, Oppenheim J, Howard OMZ. Shikonin, a component of antiinflammatory Chinese herbal medicine, selectively blocks chemokine binding to CC chemokine receptor-1. International Immunopharmacology, 2001, 1(2): 229-236. DOI:10.1016/S1567-5769(00)00033-3 |
| [9] | Li MY, Mi CL, Wang KS, Wang Z, Zuo HX, Piao LX, Xu GH, Li XZ, Ma J, Jin XJ. Shikonin suppresses proliferation and induces cell cycle arrest through the inhibition of hypoxia-inducible factor-1α signaling. Chemico-Biological Interactions, 2017, 274: 58-67. DOI:10.1016/j.cbi.2017.06.029 |
| [10] | Li Y, Lu HL, Gu YC, Ning ZQ, Cao TH, Chen C, Hu CR, Tao M. Enhancement of NK cells proliferation and function by Shikonin. Immunopharmacology and Immunotoxicology, 2017, 39(3): 124-130. DOI:10.1080/08923973.2017.1299174 |
| [11] | Tan PL, Wang ZJ, Zhao JF. Resistance of Candida albicans isolates against fluconazole and the resistance correlation with CAP1 gene. Chinese Journal of Zoonoses, 2015, 31(4): 325-329. (in Chinese) 谈潘莉, 汪浙炯, 赵金方. 白假丝酵母菌临床菌株对氟康唑耐药性及其与CAP1基因相关性研究. 中国人兽共患病学报, 2015, 31(4): 325-329. DOI:10.3969/cjz.j.issn.1002-2694.2015.04.007 |
| [12] | Chin VK, Lee TY, Rusliza B, Chong PP. Dissecting Candida albicans infection from the perspective of C. albicans virulence and omics approaches on host-pathogen interaction:a review. International Journal of Molecular Sciences, 2016, 17(10): 1643. DOI:10.3390/ijms17101643 |
| [13] | Calderone R, Sun N, Gay-Andrieu F, Groutas W, Weerawarna P, Prasad S, Alex D, Li DM. Antifungal drug discovery:the processand outcomes. Future Microbiology, 2014, 9(6): 791-805. DOI:10.2217/fmb.14.32 |
| [14] | Xie JL, Polvi EJ, Shekhar-Guturja T, Cowen LE. Elucidating drug resistance in human fungal pathogens. Future Microbiol, 2014, 9(4): 523-42. DOI:10.2217/fmb.14.18 |
| [15] | Sorgo AG, Heilmann CJ, Dekker HL, Bekker M, Brul S, de Koster CG, de Koning LJ, Klis FM. Effects of fluconazole on the secretome, the wall proteome, and wall integrity of the clinical fungus Candida albicans. Eukaryote Cell, 2011, 10(8): 1071-1081. DOI:10.1128/EC.05011-11 |
| [16] | Pfaller MA, Diekema DJ, Messer SA, Hollis RJ, Jones RN. In vitro activities of caspofungin compared with those of fluconazole and itraconazole against 3, 959 clinical isolates of Candida spp., including 157 fluconazole-resistant isolates. Antimicrobial Agents and Chemotherapy, 2003, 47(3): 1068-1071. DOI:10.1128/AAC.47.3.1068-1071.2003 |
| [17] | Dutcher JD. The discovery and development of amphotericin B. Diseases of the Chest, 1968, 54(S1): 296-298. |
| [18] | Ibrahim AS, Mirbod F, Filler SG, Banno Y, Cole GT, Kitajima Y, Edwards JE Jr, Nozawa Y, Ghannoum MA. Evidence implicating phospholipase as a virulence factor of Candida albicans. Infection and Immunity, 1995, 63(5): 1993-1998. |
| [19] | Ghannoum MA. Potential role of phospholipases in virulence and fungal pathogenesis. Clinical Microbiology Reviews, 2000, 13(1): 122-143. DOI:10.1128/CMR.13.1.122-143.2000 |
| [20] | Theiss S, Ganchimeg Ishdorj, Audrey Brenot, Marianne Kretschmar, Lan CY, Thomas Nichterlein, J?rg Hacker, Santosh Nigam, Nina Agabian, Gerwald A. K?hler. Inactivation of the phospholipase B gene PLB5 in wild-type Candida albicans reduces cell-associated phospholipase A2 activity and attenuates virulence. International Journal of Medical Microbioloy, 2005, 296(6): 405-420. |
| [21] | Leidich SD, Ibrahim AS, Fu Y, Koul A, Jessup C, Vitullo J, Fonzi W, Mirbod F, Nakashima S, Nozawa Y, Ghannoum MA. Cloning and disruption of caPLB1, a phospholipase B Gene involved in the pathogenicity of Candida albicans. Journal of Biological Chemistry, 1998, 273(40): 26708-26086. |
| [22] | Naglik J, Albrecht A, Bader O, Hube B. Candida albicans proteinases and host/pathogen interactions. Cellular Microbiology, 2004, 6(10): 915-926. DOI:10.1111/cmi.2004.6.issue-10 |
