高晓威, 唐晓峰, 唐兵


武汉大学生命科学学院微生物学系, 湖北 武汉 430072
收稿日期:2017-05-14;修回日期:2017-06-29;网络出版日期:2017-07-05
基金项目:国家自然科学基金(31570062)
作者简介:唐兵,1989及1992年先后在武汉大学生物系微生物学专业获得学士及硕士学位,1995年在中国科学院微生物研究所酶室获得生物化学专业博士学位,2000-2002年在日本国立食品研究所酶室进行博士后研究。现任武汉大学生命科学学院教授、博士生导师。主要从事极端微生物适应机理及酶结构与功能方面的研究,重点研究嗜热及嗜盐微生物蛋白酶适应极端条件的分子机制。作为主持人先后获6项国家自然科学基金面上项目资助。在包括Applied and Environmental Microbiology、Journal of Bacteriology、Molecular Microbiology及Journal of Biological Chemistry等重要学术杂志上发表研究论文30余篇
*通信作者:唐兵, Tel:+86-27-68753583, E-mail:tangb@whu.edu.cn
摘要:蛋白酶和肽酶在超嗜热古菌的营养代谢、蛋白质转换与加工以及蛋白质质量控制等重要生物学过程中发挥关键作用。超嗜热古菌蛋白酶和肽酶具有优良的热稳定性和高温活性,是研究蛋白质耐热分子机制和酶行使功能上限温度等科学问题的理想材料,同时也具有重要的工业应用价值。本文对超嗜热古菌的ATP非依赖型蛋白酶和肽酶的种类、功能、催化特性、热稳定机制以及应用前景进行综述与分析。
关键词: 超嗜热古菌 蛋白酶 肽酶 温度适应 热稳定性
ATP-independent proteases and peptidases from hyperthermophilic archaea
Xiaowei Gao, Xiao-Feng Tang, Bing Tang


Department of Microbiology, College of Life Sciences, Wuhan University, Wuhan 430072, Hubei Province, China
Received 14 May 2017; Revised 29 June 2017; Published online 5 July 2017
*Corresponding author: Bing Tang, Tel: +86-27-68753583; E-mail: tangb@whu.edu.cn
Supported by the National Natural Science Foundation of China (31570062)
Abstract: Proteases and peptidases play important roles in nutrient metabolism, protein turnover and processing, and protein quality control in hyperthermophilic archaea. Due to their high stability and activity at high temperatures, proteases and peptidases from hyperthermophilic archaea are especially valuable to study mechanisms that stabilize protein structure and function at the maximum temperature capable of supporting life, and have great potential in industrial application. This review summarizes types, functions, catalytic properties, thermostabilizing mechanisms, and application potential of ATP-independent proteases and peptidases from hyperthermophilic archaea.
Key words: hyperthermophilic archaea protease peptidase temperature adaptation thermostability
超嗜热微生物(hyperthermophiles)的最适生长温度等于或高于80 ℃,大多数属于古菌,在生命进化树中接近根部,这暗示它们与地球早期生命形式密切相关[1]。随着各种超嗜热古菌陆续被发现,人们对生命形式所能承受的温度上限的认识不断被更新,目前已知的超嗜热古菌(hyperthermophilic archaea)的最高生长温度已超过120 ℃[2]。对这类生物的研究不仅丰富了人们对生物多样性及适应机理的认识,也有助于人类探索生命起源与进化历程。同时,超嗜热古菌对高温环境的适应能力取决于其细胞结构及生物分子对高温的耐受性,超嗜热古菌酶已成为研究蛋白质耐热分子机制和酶行使功能上限温度等科学问题的理想材料。另外,超嗜热古菌酶通常对变性剂和有机溶剂等具有很强抗性,有广泛的工业用途,而且其独特的耐热分子机制还能为人们构建新型生物催化剂提供新的理论依据和设计思路[3]。蛋白酶和肽酶广泛存在于包括超嗜热古菌在内的各种生物中,它们分别作用于蛋白质和分子量较小的肽类物质,而且不同类型的蛋白酶或肽酶在定位与分布、催化特性及结构特征等方面显示出丰富的多样性,在细胞的许多生命活动中发挥重要作用。2002年,Ward等[4]对当时已知的超嗜热微生物蛋白酶进行了归纳综述,其中来自超嗜热古菌的ATP非依赖型(ATP-independent)蛋白酶和肽酶有20种。近年来,特别是随着基因组数据的日益丰富,越来越多的超嗜热古菌ATP非依赖型蛋白酶和肽酶被发掘,对它们的研究和认识得到进一步拓展和深化,本文将对这类酶的研究进展进行介绍。
1 种类与功能 迄今已报道的超嗜热古菌的ATP非依赖型蛋白酶和肽酶至少达到48种,主要来源于Pyrococcus、Thermococcus、Sulfolobus和Aeropyrum这几个属的古菌,大部分属于丝氨酸蛋白酶和金属蛋白酶,少部分为半胱氨酸蛋白酶和天冬氨酸蛋白酶(表 1)。蛋白酶和肽酶在超嗜热古菌的营养代谢、蛋白质加工转换和蛋白质质量控制等重要生物学过程中发挥关键作用。
表 1. 超嗜热古菌的已知ATP非依赖型蛋白酶和肽酶的基本性质 Table 1. Properties of known ATP-independent proteases and peptidases from hyperthermophilic archaea
| Organism (optimal growth temperature) | Enzyme | Typea | Topt/ ℃ | pHopt | MW/kDa | PDB | Locationb | Reference |
| Aeropyrum pernix (95 ℃) | Pernisine | S | 90 | 8.0-9.0 | 34 | E | [40] | |
| Aeropyrolysin | M | 110 | 6.0-8.0 | 52 | E | [4] | ||
| Pernilase | S | 90 | 9.0 | 50 | I | [4] | ||
| Acylaminoacyl peptidase (ApAAP) | S | 90 | 63(2-mer) | 1VE6 | I | [23] | ||
| Desulfurococcus mucosus (85 ℃) | Archaelysin | S | 90-95 | 7.2 | 52 | E | [4] | |
| Desulfurococcus kamchatkensis (85 ℃) | TET aminopeptidase (APDkam589) | M | 43(12-mer) | 4WWV | I | [28] | ||
| Methanococcus jannaschii (85 ℃) | Barophilic protease | S | 116 | 7.5-7.8 | 29 | I | [15] | |
| Pyrobaculum aerophilum (100 ℃) | Aerolysin | S | 43 | E | [4] | |||
| Pyrococcus abyssi (96 ℃) | PPA protease | S | 95 | 9.0 | 60(multimer) | E | [4] | |
| Pyrococcus furiosus (100 ℃) | Carboxypeptidase (PfuCP) | M | 90-100 | 6.2-6.6 | 59(2-mer) | 1KA4 | I | [4] |
| Deblocking aminopeptidase (DAP) | M | 39(12-mer) | I | [4] | ||||
| Methionine aminopeptidase (MAP) | M | ~90 | 7.0-8.0 | 33 | 1XGM | I | [4] | |
| Lysine aminopeptidase (KAP) | M | 100 | 8.0 | 38(4-mer) | I | [41] | ||
| Protease Ⅰ (PfpI) | C | 105 | 7.0 | 19(6-mer) | I | [4] | ||
| Pyrolysin | S | 115 | 6.5-10.5 | 138 | E, MA | [33] | ||
| Prolyl oligopeptidase (POP) | S | 85-90 | 7.0-8.0 | 70 | I | [42] | ||
| Alkaline serine protease (PfuS) | S | 85-95 | 6.0-8.0 | 43 | E | [43] | ||
| Pyrrolidone carboxyl peptidase (PCP) | C | ~90 | 6.0-9.0 | 23(4-mer) | 1IOI | I | [4] | |
| Proline dipeptidase (Prolidase) | M | 100 | 7.0 | 39(2-mer) | 1PV9 | I | [4] | |
| TET aminopeptidase | M | 38(12-mer) | 4X8I | I | [44] | |||
| Pyrococcus horikoshii (98 ℃) | TET aminopeptidase (PhTET1) | M | 95 | 7.5 | 37(12/24-mer) | 2CF4 | I | [4] |
| TET aminopeptidase (PhTET2) | M | 100 | 7.0-7.5 | 42(2/12-mer) | 1XFO | I | [12] | |
| TET aminopeptidase (PhTET3) | M | 100 | 7.0-7.5 | 41(12-mer) | 2VPU | I | [12] | |
| Acylaminoacyl peptidase (PhAAP*) | S | 90 | 7.5 | 72 | I | [45] | ||
| Acylaminoacyl peptidase (PhAAP) | S | 70 | 6.0-7.5 | 73(6-mer) | 4HXE | I | [8] | |
| PfpI-homolog (PH1704) | C | 80 | 8.0 | 18(6/12-mer) | 1G2I | I | [22] | |
| Staphylothermus marinus (92 ℃) | STABLE protease | S | 90 | 9.0 | 150 | E, MA | [29] | |
| Sulfolobus solfataricus (87 ℃) | Cysteine protease | C | 70 | 7.5 | 11 | I | [45] | |
| Aminopeptidase | M | 75 | 6.8 | 80(4-mer) | I | [4] | ||
| Carboxypeptidase | M | 85 | 5.5-7.0 | 42(4-mer) | I | [4] | ||
| Proteinase Ⅰ | S | > 90 | 6.5-8.0 | 54(2-mer) | I | [4] | ||
| Thermopsin (SsMTP) | A | 70-90 | 2.0 | 120 | E, MA | [16] | ||
| Thermopsin (SsMTP-1) | A | 70 | 2.0 | 75 | E, MA | [17] | ||
| Metalloprotease | M | 55-65 | 7.0 | 55(2-mer) | I | [46] | ||
| Type Ⅳ prepilin peptidase (PibD) | A | 27 | MP | [10] | ||||
| Thermococcus kodakarensis (85 ℃) | Tk-subtilisin | S | 90 | 9.5 | 35 | 2E1P | E | [47] |
| Tk-SP | S | ~100 | 7.0-11.5 | 44 | 3AFG | E | [48] | |
| Thiol protease | C | 110 | 7.0 | 44 | E | [4] | ||
| Signal peptide peptidase (SppATk) | S | 80 | 10.0 | 36 | MP | [11] | ||
| Protease HybD (TK2066) | A | 16 | 1CFZ | I | [13] | |||
| Protease HycI (TK2004) | A | 17 | I | [13] | ||||
| Zinc-dependent protease | M | 55 | 8.0 | 28 | I | [49] | ||
| Thermococcus litoralis (85 ℃) | Pyrrolidone carboxyl peptidase (PCP) | C | 70-75 | 24(4-mer) | 1A2Z | I | [7] | |
| Thermococcus onnurineus (80 ℃) | Aminopeptidase P | M | ≥100 | 5.0-7.0 | 40 | I | [50] | |
| Prolyl oligopeptidase | S | 80 | 7.0-7.5 | 70 | I | [51] | ||
| Carboxypeptidase | M | 70-80 | 6.5 | 61(2-mer) | I | [52] | ||
| Methionine aminopeptidase | M | 80-90 | 7.0 | 33 | I | [6] | ||
| Deblocking aminopeptidase | M | 90-100 | 7.5 | 38 | I | [9] | ||
| aS: serine protease; M: metalloprotease; C: cysteine protease; A: aspartic protease. bE: extracellular protease; Ⅰ: intracellular protease; MP: membrane protease; MA: membrane-associated protease. | ||||||||
表选项
大多数异养型超嗜热古菌可利用蛋白类底物进行生长。以化能异养型Pyrococcus furiosus为例,该菌能够以蛋白和肽类物质作为唯一的碳源、氮源和能源,只有当肽类物质存在时糖类物质才能作为碳源和能源支持该菌生长,而且肽类物质不能被20种氨基酸的混合物替换[5],这可能与该菌缺乏某种(些)氨基酸的转运系统有关,因此蛋白酶和肽酶对P. furiosus的营养代谢至关重要。P. furiosus的基因组编码的30余种ATP非依赖型蛋白酶和肽酶中有11种得到研究(表 1)。该菌的胞外蛋白酶(如Pyrolysin)可将环境中分子量较大的蛋白底物降解成分子量较小的肽类物质以便于细胞摄取,胞内的蛋白酶(PfpI)、羧肽酶(PfuCP)、氨肽酶(TET和KAP)、寡肽酶(POP)和二肽酶(Prolidase)等可将进入到细胞内的肽类物质进一步降解供细胞利用。
超嗜热古菌的蛋白降解体系不仅用于降解外源蛋白底物,还以不同方式作用于细胞自身的蛋白质或肽类。一些氨肽酶对蛋白质或寡肽的N端进行特异性加工,例如甲硫氨酸氨肽酶(MAP)负责去除新合成多肽链N端的甲硫氨酸残基[6];吡咯烷酮羧肽酶(PCP)切除蛋白质N端的焦谷氨酸残基[7];酰基氨肽酶(APP)和去封闭氨肽酶(DAP)切除寡肽的N端酰基化氨基酸残基[8-9]。位于细胞膜上的信号肽酶(PibD)和信号肽肽酶(SppATk)则分别切割和降解分泌蛋白的信号肽[10-11]。除了对蛋白质底物进行加工,ATP非依赖型蛋白酶和肽酶还是超嗜热古菌的蛋白质质量控制体系的重要组成部分。例如,Pyrococcus horikoshii的ATP依赖型蛋白酶体将错误折叠或变性蛋白质降解为肽类物质,而ATP非依赖型TET氨肽酶则将这些肽类物质进一步降解[12]。
值得提及的是,目前对超嗜热古菌蛋白酶和肽酶的生理功能的分析主要根据酶的生化性质进行推测,而且很多酶的生理功能仍不确定,这一方面是由于超嗜热古菌的培养条件苛刻,另一方面是由于超嗜热古菌的遗传操作体系的建立相对滞后。最近,Kanai等[13]通过基因敲除的方法证明Thermococcus kodakarensis的2种胞内蛋白酶(HybD和HycI)分别专一性地对2种镍铁氢化酶的C端进行加工切除,使氢化酶得以成熟。随着各种超嗜热古菌(特别是硫化叶菌目Sulfolobales和热球菌目Thermococcales)的遗传操作体系不断建立和完善[14],有关超嗜热古菌蛋白酶生理功能的研究将有望获得新进展。
2 催化特性 超嗜热古菌蛋白酶和肽酶普遍具有优良的高温活性,最适反应温度通常高于90 ℃,有些酶的最适反应温度甚至超过100 ℃ (表 1),这使得它们能够在超嗜热古菌所生存的高温条件下充分行使功能。与此同时,这些酶在中温条件(如室温)下活性低甚至没有活性。某些超嗜热古菌所生存的环境为多重极端环境,这些古菌的蛋白酶和肽酶也具有相应的适应能力。例如,深海超嗜热古菌Methanococcus jannaschii的一种蛋白酶的最适反应温度为116 ℃,当压力增加到500大气压时酶活性提高至少1倍以上[15];生活在高温和酸性环境中的Sulfolobus solfataricus的胞外蛋白酶Thermopsin不仅高温活性好,其最适反应pH也达到2左右[16-17]。
在超嗜热古菌中,大多数已知胞内蛋白酶和肽酶以多聚体形式发挥功能(表 1)。来源于P. horikoshii的胞内蛋白酶PH1704形成同源六聚体环形结构,活性中心位于环形结构内侧,这使得该酶能有效降解变性伸展的蛋白质或肽类物质,而具有高级结构的蛋白则由于空间位阻效应不能被该酶降解,从而避免胞内功能蛋白受到损伤[18]。在P. horikoshii细胞中还存在3种TET氨肽酶,它们的底物专一性存在差异,但都以多聚体形式发挥功能。TET1可形成四面体(十二聚体)和八面体(二十四聚体)这两种有活性的形式,前者可能负责将来源于蛋白酶体的降解产物(6-20个残基的肽)进一步降解,后者则可能参与降解来源于胞外的肽类营养物质(2-6个残基)[19];TET2可形成有活性的二聚体和十二聚体,而后者倾向作用于分子量较大的肽类物质[20];TET3也形成十二聚体,但与TET1和TET2相比,该酶具有更高的底物专一性,是一种赖氨酰氨肽酶[12]。有意思的是,TET2和TET3还能够形成异源十二聚体,该异源多聚体比两种酶各自形成的同源多聚体具有更高的催化活性[21]。由此可见,超嗜热古菌蛋白酶和肽酶的寡聚化不仅可以防止细胞功能蛋白质受到损伤,还对酶的催化活性具有调节作用。
一些超嗜热古菌蛋白酶和肽酶在催化活性方面表现出一定的灵活性。例如,P. horikoshii的胞内蛋白酶PH1704既具有氨肽酶活性,也具有内肽酶活性[22]。来自Aeropyrum pernix的酰基氨肽酶ApAAP同时具有肽酶和酯酶活性,将该酶的保守氨基酸残基Arg526突变为Val后显著提高其酯酶活性,将其突变为Glu后则基本消除肽酶活性而酯酶活性仅下降2倍,这暗示肽酶和酯酶具有共同的进化祖先,而Arg526有可能是这些酶分子趋异进化的一个标记点[23]。从进化角度考虑,超嗜热古菌最接近于地球早期生命形式,它们的蛋白酶和肽酶中有可能残存着水解性酶类在进化过程中的分子“遗迹”,使得它们在催化活性方面具有一定的可塑性,发掘这些分子“遗迹”(位点)将有利于我们采用突变手段对酶的催化活性进行重塑。
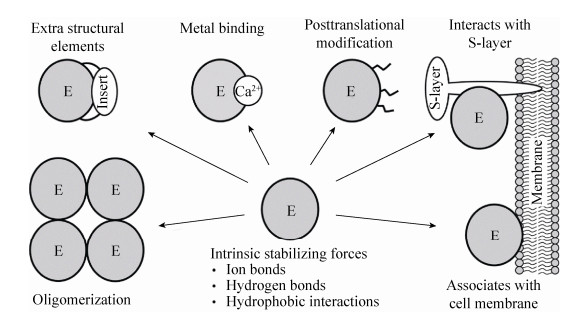
3 热稳定机制 由于超嗜热古菌突出的高温适应能力,它们产生的各种酶被广泛用于研究蛋白质的高温耐受性。研究者主要采用结构比较和突变分析等手段解析超嗜热古菌蛋白酶的耐热分子机制,并发现这些酶采用多种方式维持酶分子在高温条件下的结构稳定性(图 1),以保证它们在高温条件下充分行使功能。
 |
| 图 1 超嗜热古菌蛋白酶热稳定机制示意图 Figure 1 Thermostabilization mechanisms of proteases from hyperthermophilic archaea. |
| 图选项 |
许多超嗜热古菌蛋白酶和肽酶通过增加离子键和氢键数量、优化疏水相互作用、加强分子内结构域之间相互作用和结合金属离子等方式提高热稳定性。例如,Ogasahara等[24]发现P. furiosus的甲硫氨酸氨肽酶(PfMAP)比来自大肠杆菌的同源酶含有更多的离子键和离子网络,提高离子强度或降低pH可以破坏PfMAP分子中的有利静电相互作用而导致酶稳定性下降,说明离子键在维持该酶高温稳定性方面发挥重要所用。A. pernix的酰基氨肽酶ApAAP晶体结构得到解析,结果显示该酶由N端的β-螺旋桨结构域和C端的催化结构域构成,2个结构域之间通过29个氢键和离子键以及额外的疏水相互作用使酶分子整体结构得到稳定;β-螺旋桨结构域含有7个分别由β-折叠片层构成的“浆叶”,相邻“浆叶”之间形成了12个离子键,这对该酶热稳定性具有重要贡献[25]。Tk-subtilisin是T. kodakarensis的一种胞外蛋白酶,该酶在分子结构上的一个突出特点是含有7个Ca2+结合位点(Ca1-Ca7),其中Ca2-Ca5影响酶分子的折叠,而Ca1、Ca6及Ca7则对该酶的高温稳定性具有重要影响[26]。
对于以多聚体形式发挥作用的嗜热古菌蛋白酶和肽酶而言,亚基之间的稳定相互作用是它们在高温条件下正常行使功能的前提。Thermococcus litoralis的吡咯烷酮羧肽酶(PCP)以四聚体形式发挥功能,亚基之间形成的疏水相互作用和二硫键提高了该酶的热稳定性[27]。P. horikoshii的TET氨肽酶(PhTET2) 可形成二聚体或十二聚体,亚基之间形成的离子键是该酶高热稳定性的重要因素[20]。Desulfurococcus kamchatkensis的TET氨肽酶APDkam589也形成十二聚体,但亚基之间离子键的数量明显少于PhTET2,而且热稳定性相对于后者较低,这暗示亚基之间的静电相互作用是提高TET氨肽酶多聚体在高温条件下稳定性的主要作用力[28]。
与细胞特定组分相结合也是超嗜热古菌蛋白酶提高自身的热稳定性的一种方式。例如Staphylothermus marinus的胞外蛋白酶STABLE与该菌的S层相结合,这种结合形式的STABLE在温度超过125 ℃时才开始变性失活,而游离形式的STABLE在温度高于95 ℃时便迅速变性失活;STABLE与S层蛋白形成的复合物在中性pH条件下十分稳定,而在酸性和SDS存在条件下可相互分离,说明两者以非共价方式结合,但它们之间的相互作用机制目前尚不清楚[29]。通常情况下,蛋白质一级结构在130 ℃左右失去稳定性而导致多肽链骨架自发水解,与S层蛋白结合的STABLE甚至在135 ℃处理10 min后仍然能检测到残余酶活性[29],这意味着两者形成的复合物的热稳定性已接近蛋白质的高温耐受极限,这也使得人们对生命所能承受的温度上限的分子机制有了新的认识。
超嗜热古菌蛋白酶还利用额外的结构元件或结构域来提高酶分子整体结构的热稳定性。本实验室研究表明,来自P. furiosus的胞外蛋白酶Pyrolysin的成熟酶由催化功能区和C端延伸区构成,其催化功能区还含有4个额外的插入序列(IS147、IS29、IS27和IS8),C端延伸区和IS147分别含有对酶热稳定性具有重要贡献的Ca2+结合位点,而IS27和IS8参与形成的离子键增强了Pyrolysin的热稳定性[30-32]。另外,对Pyrolysin的C端延伸区Ca2+结合位点和IS29中的带电荷氨基酸残基进行突变并消除不利静电相互作用后,该酶在95 ℃的半衰期由12 h提高到36 h[32]。这进一步说明有利的静电相互作用是增强超嗜热古菌蛋白酶热稳定性的重要分子机制,同时也提示我们超嗜热古菌蛋白质的热稳定性仍然具有提升空间。
与其他类型酶不同,蛋白酶水解多肽链这一特有属性会引起酶分子间相互攻击发生自降解,从而导致蛋白酶不可逆失活,这也是影响这类酶稳定性的一个重要因素。超嗜热古菌蛋白酶也具有对抗这种不可逆失活的机制。如前所述,很多超嗜热古菌蛋白酶形成多聚体,这种有序聚集可以避免酶活性中心随机攻击酶分子多肽链。另外,将蛋白酶分子以某种形式固定化也可以减少分子间相互作用的机会而限制自降解的发生。例如S. marinus的胞外蛋白酶STABLE与S层蛋白相结合[29],S. solfataricus的胞外蛋白酶SsMTP则利用C末端的跨膜区锚定在细胞膜表面[16]。P. furiosus的胞外蛋白酶Pyrolysin也存在于该菌的胞外被膜,但目前尚不清楚该酶与何种被膜组分以何种方式结合[33]。本实验室最近发现,虽然可溶形式的Pyrolysin在有NaCl存在条件下会发生自降解(2个自降解位点分别位于插入序列IS29和IS8中),但自降解片段仍然非共价结合在一起形成有活性的“缺刻型(Nicked)”酶,而且这种“缺刻型”酶在95 ℃的半衰期还能达到6 h[32]。显然,形成相对稳定的“缺刻型”酶提高了Pyrolysin对不可逆失活的抗性,并且延长了该酶在高温条件下发挥催化功能的持续时间。
除了上述热稳定机制外,其他因素也可能与超嗜热古菌蛋白酶和肽酶的热稳定性相关。有证据显示,由P. furiosus胞外被膜分离的Pyrolysin被糖基化[33],S. marinus的胞外蛋白酶STABLE也具有潜在的糖基化位点[29]。我们发现在大肠杆菌中表达的非糖基化重组Pyrolysin的热稳定性低于天然的糖基化酶,暗示糖基化修饰与该酶的热稳定性相关[30]。另外,超嗜热古菌细胞内还存在对蛋白质具有稳定作用的小分子相溶溶质及分子伴侣等物质,它们对胞内蛋白酶和肽酶稳定性的影响值得进一步研究。
4 应用 与常温条件下进行的催化反应相比,在高温条件下进行的反应具有反应速率加快、底物及产物溶解度提高和微生物污染减少等优点。超嗜热古菌蛋白酶具有优良的热稳定性和高温活性,并且对有机溶剂、变性剂和去污剂等有很强的耐受性,因此具有重要的应用价值。来源于P. furiosus的几种蛋白酶和肽酶已由TaKaRa公司开发并作为分子生物学试剂投入商业化应用,例如:具有广泛的底物特异性的胞外蛋白酶PfuS被用于蛋白质序列测定前将蛋白底物片段化;去封闭氨肽酶(DAP)、甲硫氨酸氨肽酶(MAP)和吡咯烷酮羧肽酶(PCP)则被用于对蛋白质N端进行加工和去封闭化。
在常温条件下,一些蛋白底物空间结构较为稳定而难以被蛋白酶降解。在高温条件下,蛋白质易发生变性,其空间结构被破坏导致多肽链松弛伸展,因此更容易受到蛋白酶的攻击,超嗜热古菌蛋白酶在这种情况下充分显示出独特的优势。例如朊病毒对一般蛋白酶具有抗性,但在高温条件下其结构发生变化而对蛋白酶敏感。研究表明,来自P. furiosus的Pyrolysin、A. pernix的Pernisine及T. kodakarensis的Tk-SP和Tk-subtilisin这4种蛋白酶均能在高温条件下(92-100 ℃)将朊病毒完全降解[34-37],这说明超嗜热古菌蛋白酶在医疗领域具有巨大的应用潜力。还有证据显示,超嗜热古菌Thermococcus sp. VC1[38]和D. kamchatkensis[39]能够降解角蛋白,它们产生的角蛋白酶在羽毛和毛发等废弃物处理和资源再利用方面具有潜在应用价值。
相对于常温生物的酶而言,超嗜热古菌蛋白酶和肽酶在应用方面的劣势在于它们的中、低温活性低,这在很大程度上限制了这类酶的应用范围,而且在大规模工业生产中酶催化反应所需温度过高可能带来能耗过大的问题。采用定点突变或定向进化对超嗜热古菌蛋白酶进行改造来提高它们的中、低温活性有望解决这一问题。特别是越来越多的嗜热古菌蛋白酶和肽酶的晶体结构获得解析(表 1),这为人工设计、改造这类酶奠定了坚实的基础。
5 展望 随着各种超嗜热古菌不断被发掘及基因组数据的日益丰富,更多的超嗜热古菌蛋白酶和肽酶的性质将得到表征,发现并阐明这类酶新的催化特性及耐热分子机制今后仍然是研究重点,基于X晶体衍射和冷冻电镜等的结构生物学研究技术将在其中发挥重要作用。对超嗜热古菌蛋白酶和肽酶催化特性和耐热分子机制的深入研究不仅将深化生命形式对高温环境适应机理的认识,也将促进新型蛋白酶制剂的开发和应用。采用理性设计和定向进化等手段对超嗜热古菌蛋白酶和肽酶进行修饰和改造,可以有效克服这类酶低温活性低的局限性,拓展它们的应用范围。值得注意的是,尽管来源于超嗜热古菌的蛋白酶和肽酶已经具有突出的高温耐受性,现有证据表明少数几个氨基酸残基的改变就能进一步显著提高这类酶的热稳定性,这为今后深入探究蛋白质乃至生命形式所能承受的温度上限这一重要科学问题提供了新线索。虽然目前有关超嗜热古菌蛋白酶和肽酶的生理功能的研究相对滞后,但日渐完善的超嗜热古菌遗传操作系统将极大地推进该领域的研究,这将不断深化人们对超嗜热古菌及其蛋白酶和肽酶在极端高温这一特殊生境的物质循环中所发挥作用的认识。
References
| [1] | Stetter KO. A brief history of the discovery of hyperthermophilic life. Biochemical Society Transactions, 2013, 41(1): 416-420. DOI:10.1042/BST20120284 |
| [2] | Kashefi K, Lovley DR. Extending the upper temperature limit for life. Science, 2003, 301(5635): 934. DOI:10.1126/science.1086823 |
| [3] | Elleuche S, Sch?fers C, Blank S, Schr?der C, Antranikian G. Exploration of extremophiles for high temperature biotechnological processes. Current Opinion in Microbiology, 2015, 25: 113-119. DOI:10.1016/j.mib.2015.05.011 |
| [4] | Ward DE, Shockley KR, Chang LS, Levy RD, Michel JK, Conners SB, Kelly RM. Proteolysis in hyperthermophilic microorganisms. Archaea, 2002, 1(1): 63-74. DOI:10.1155/2002/503191 |
| [5] | Snowden LJ, Blumentals Ⅱ, Kelly RM. Regulation of proteolytic activity in the hyperthermophile Pyrococcus furiosus. Applied and Environmental Microbiology, 1992, 58(4): 1134-1141. |
| [6] | Lee HS, Kim YJ, Bae SS, Jeon JH, Lim JK, Jeong BC, Kang SG, Lee JH. Cloning, expression, and characterization of a methionyl aminopeptidase from a hyperthermophilic archaeon Thermococcus sp. NA1. Marine Biotechnology, 2006, 8(4): 425-432. DOI:10.1007/s10126-005-6124-8 |
| [7] | Singleton MR, Taylor SJC, Parrat JS, Littlechild JA. Cloning, expression, and characterization of pyrrolidone carboxyl peptidase from the archaeon Thermococcus litoralis. Extremophiles, 2000, 4(5): 297-303. DOI:10.1007/s007920070017 |
| [8] | Szeltner Z, Kiss AL, Domokos K, Harmat V, Náray-Szabó G, Polgár L. Characterization of a novel acylaminoacyl peptidase with hexameric structure and endopeptidase activity. Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, 2009, 1794(8): 1204-1210. DOI:10.1016/j.bbapap.2009.03.004 |
| [9] | Lee HS, Cho Y, Kim YJ, Nam K, Lee JH, Kang SG. Biochemical characterization of deblocking aminopeptidase from hyperthermophilic archaeon Thermococcus onnurineus NA1. Journal of Bioscience and Bioengineering, 2007, 104(3): 188-194. DOI:10.1263/jbb.104.188 |
| [10] | Szabó Z, Albers SV, Driessen AJM. Active-site residues in the type Ⅳ prepilin peptidase homologue PibD from the archaeon Sulfolobus solfataricus. Journal of Bacteriology, 2006, 188(4): 1437-1443. DOI:10.1128/JB.188.4.1437-1443.2006 |
| [11] | Matsumi R, Atomi H, Imanaka T. Biochemical properties of a putative signal peptide peptidase from the hyperthermophilic archaeon Thermococcus kodakaraensis KOD1. Journal of Bacteriology, 2005, 187(20): 7072-7080. DOI:10.1128/JB.187.20.7072-7080.2005 |
| [12] | Durá MA, Rosenbaum E, Larabi A, Gabel F, Vellieux FMD, Franzetti B. The structural and biochemical characterizations of a novel TET peptidase complex from Pyrococcus horikoshii reveal an integrated peptide degradation system in hyperthermophilic archaea. Molecular Microbiology, 2009, 72(1): 26-40. DOI:10.1111/mmi.2009.72.issue-1 |
| [13] | Kanai T, Yasukochi A, Simons JR, Scott JW, Fukuda W, Imanaka T, Atomi H. Genetic analyses of the functions of[NiFe]-hydrogenase maturation endopeptidases in the hyperthermophilic archaeon Thermococcus kodakarensis. Extremophiles, 2017, 21(1): 27-39. DOI:10.1007/s00792-016-0875-1 |
| [14] | Leigh JA, Albers SV, Atomi H, Allers T. Model organisms for genetics in the domain Archaea:methanogens, halophiles, Thermococcales and Sulfolobales. FEMS Microbiology Reviews, 2011, 35(4): 577-608. DOI:10.1111/j.1574-6976.2011.00265.x |
| [15] | Michels PC, Clark DS. Pressure-enhanced activity and stability of a hyperthermophilic protease from a deep-sea methanogen. Applied and Environmental Microbiology, 1997, 63(10): 3985-3991. |
| [16] | Cannio R, Catara G, Fiume I, Balestrieri M, Rossi M, Palmieri G. Identification of a cell-bound extracellular protease overproduced by Sulfolobus solfataricus in peptide-rich media. Protein & Peptide Letters, 2010, 17(1): 78-85. |
| [17] | Gogliettino M, Riccio A, Cocca E, Rossi M, Palmieri G, Balestrieri M. A new pepstatin-insensitive thermopsin-like protease overproduced in peptide-rich cultures of Sulfolobus solfataricus. International Journal of Molecular Sciences, 2014, 15(2): 3204-3219. DOI:10.3390/ijms15023204 |
| [18] | Du XL, Choi IG, Kim R, Wang WR, Jancarik J, Yokota H, Kim SH. Crystal structure of an intracellular protease from Pyrococcus horikoshii at 2-? resolution. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(26): 14079-14084. DOI:10.1073/pnas.260503597 |
| [19] | Schoehn G, Vellieux FMD, Durá MA, Receveur-Bréchot V, Fabry CMS, Ruigrok RWH, Ebel C, Roussel A, Franzetti B. An archaeal peptidase assembles into two different quaternary structures:a tetrahedron and a giant octahedron. The Journal of Biological Chemistry, 2006, 281(47): 36327-36337. DOI:10.1074/jbc.M604417200 |
| [20] | Appolaire A, Rosenbaum E, Durá MA, Colombo M, Marty V, Savoye MN, Godfroy A, Schoehn G, Girard E, Gabel F, Franzetti B. Pyrococcus horikoshii TET2 peptidase assembling process and associated functional regulation. The Journal of Biological Chemistry, 2013, 288(31): 22542-22554. DOI:10.1074/jbc.M113.450189 |
| [21] | Appolaire A, Durá MA, Ferruit M, Andrieu JP, Godfroy A, Gribaldo S, Franzetti B. The TET2 and TET3 aminopeptidases from Pyrococcus horikoshii form a hetero-subunit peptidasome with enhanced peptide destruction properties. Molecular Microbiology, 2014, 94(4): 803-814. DOI:10.1111/mmi.2014.94.issue-4 |
| [22] | Zhan DL, Bai AX, Yu L, Han WW, Feng Y. Characterization of the PH1704 protease from Pyrococcus horikoshii OT3 and the critical functions of Tyr120. PLoS One, 2014, 9(9): e103902. DOI:10.1371/journal.pone.0103902 |
| [23] | Wang QY, Yang GY, Liu YL, Feng Y. Discrimination of esterase and peptidase activities of acylaminoacyl peptidase from hyperthermophilic Aeropyrum pernix K1 by a single mutation. The Journal of Biological Chemistry, 2006, 281(27): 18618-18625. DOI:10.1074/jbc.M601015200 |
| [24] | Ogasahara K, Lapshina EA, Sakai M, Izu Y, Tsunasawa S, Kato I, Yutani K. Electrostatic stabilization in methionine aminopeptidase from hyperthermophile Pyrococcus furiosus. Biochemistry, 1998, 37(17): 5939-5946. DOI:10.1021/bi973172q |
| [25] | Bartlam M, Wang GG, Yang HT, Gao RJ, Zhao XD, Xie GQ, Cao SG, Feng Y, Rao ZH. Crystal structure of an acylpeptide hydrolase/esterase from Aeropyrum pernix K1. Structure, 2004, 12(8): 1481-1488. DOI:10.1016/j.str.2004.05.019 |
| [26] | Uehara R, Takeuchi Y, Tanaka SI, Takano K, Koga Y, Kanaya S. Requirement of Ca2+ ions for the hyperthermostability of Tk-subtilisin from Thermococcus kodakarensis. Biochemistry, 2012, 51(26): 5369-5378. DOI:10.1021/bi300427u |
| [27] | Singleton MR, Isupov MN, Littlechild JA. X-ray structure of pyrrolidone carboxyl peptidase from the hyperthermophilic archaeon Thermococcus litoralis. Structure, 1999, 7(3): 237-244. DOI:10.1016/S0969-2126(99)80034-3 |
| [28] | Petrova TE, Slutskaya ES, Boyko KM, Sokolova OS, Rakitina TV, Korzhenevskiy DA, Gorbacheva MA, Bezsudnova EY, Popov VO. Structure of the dodecamer of the aminopeptidase APDkam598 from the archaeon Desulfurococcus kamchatkensis. Acta Crystallographica Section F:Structural Biology Communications, 2015, 71(3): 277-285. DOI:10.1107/S2053230X15000783 |
| [29] | Mayr J, Lupas A, Kellermann J, Eckerskorn C, Baumeister W, Peters J. A hyperthermostable protease of the subtilisin family bound to the surface layer of the archaeon Staphylothermus marinus. Current Biology, 1996, 6(6): 739-49. DOI:10.1016/S0960-9822(09)00455-2 |
| [30] | Dai Z, Fu HT, Zhang YF, Zeng J, Tang B, Tang XF. Insights into the maturation of hyperthermophilic pyrolysin and the roles of its N-terminal propeptide and long C-terminal extension. Applied and Environmental Microbiology, 2012, 78(12): 4233-4241. DOI:10.1128/AEM.00548-12 |
| [31] | Zeng J, Gao XW, Dai Z, Tang B, Tang XF. Effects of metal ions on stability and activity of hyperthermophilic pyrolysin and further stabilization of this enzyme by modification of a Ca2+-binding site. Applied and Environmental Microbiology, 2014, 80(9): 2763-2772. DOI:10.1128/AEM.00006-14 |
| [32] | Gao XW, Zeng J, Yi HW, Zhang F, Tang B, Tang XF. Four inserts within the catalytic domain confer extra stability and activity to hyperthermostable pyrolysin from Pyrococcus furiosus. Applied and Environmental Microbiology, 2017, 83(5): e03228-16. |
| [33] | Voorhorst WGB, Eggen RIL, Geerling ACM, Platteeuw C, Siezen RJ, de Vos WM. Isolation and characterization of the hyperthermostable serine protease, pyrolysin, and its gene from the hyperthermophilic archaeon Pyrococcus furiosus. The Journal of Biological Chemistry, 1996, 271(34): 20426-20431. DOI:10.1074/jbc.271.34.20426 |
| [34] | McLeod AH, Murdoch H, Dickinson J, Dennis MJ, Hall GA, Buswell CM, Carr J, Taylor DM, Sutton JM, Raven ND. Proteolytic inactivation of the bovine spongiform encephalopathy agent. Biochemical and Biophysical Research Communications, 2004, 317(4): 1165-1170. DOI:10.1016/j.bbrc.2004.03.168 |
| [35] | ?najder M, Vilfan T, ?ernilec M, Popovi? R, Popovi? M, Juntes P, ?erbec V?, Ulrih NP. Enzymatic degradation of PrPSc by a protease secreted from Aeropyrum pernix K1. PLoS One, 2012, 7(6): e39548. DOI:10.1371/journal.pone.0039548 |
| [36] | Hirata A, Hori Y, Koga Y, Okada J, Sakudo A, Ikuta K, Kanaya S, Takano K. Enzymatic activity of a subtilisin homolog, Tk-SP, from Thermococcus kodakarensis in detergents and its ability to degrade the abnormal prion protein. BMC Biotechnology, 2013, 13(1): 19. DOI:10.1186/1472-6750-13-19 |
| [37] | Koga Y, Tanaka SI, Sakudo A, Tobiume M, Aranishi M, Hirata A, Takano K, Ikuta K, Kanaya S. Proteolysis of abnormal prion protein with a thermostable protease from Thermococcus kodakarensis KOD1. Applied Microbiology and Biotechnology, 2014, 98(5): 2113-2120. DOI:10.1007/s00253-013-5091-7 |
| [38] | Tsiroulnikov K, Rezai H, Bonch-Osmolovskaya E, Nedkov P, Gousterova A, Cueff V, Godfroy A, Barbier G, Métro F, Chobert JM, Clayette P, Dormont D, Grosclaude J, Haertlé T. Hydrolysis of the amyloid prion protein and nonpathogenic meat and bone meal by anaerobic thermophilic prokaryotes and Streptomyces subspecies. Journal of Agricultural and Food Chemistry, 2004, 52(20): 6353-6360. DOI:10.1021/jf0493324 |
| [39] | Kublanov IV, Bidjieva SK, Mardanov AV, Bonch-Osmolovskaya EA. Desulfurococcus kamchatkensis sp. nov., a novel hyperthermophilic protein-degrading archaeon isolated from a Kamchatka hot spring. International Journal of Systematic and Evolutionary Microbiology, 2009, 59(Pt 7): 1743-1747. |
| [40] | Catara G, Ruggiero G, La Cara F, Digilio FA, Capasso A, Rossi M. A novel extracellular subtilisin-like protease from the hyperthermophile Aeropyrum pernix K1:biochemical properties, cloning, and expression. Extremophiles, 2003, 7(5): 391-399. DOI:10.1007/s00792-003-0337-4 |
| [41] | Story SV, Shah C, Jenney Jr FE, Adams MWW. Characterization of a novel zinc-containing, lysine-specific aminopeptidase from the hyperthermophilic archaeon Pyrococcus furiosus. Journal of Bacteriology, 2005, 187(6): 2077-2083. DOI:10.1128/JB.187.6.2077-2083.2005 |
| [42] | Juhász T, Szeltner Z, Polgár L. Properties of the prolyl oligopeptidase homologue from Pyrococcus furiosus. FEBS Letters, 2006, 580(14): 3493-3497. DOI:10.1016/j.febslet.2006.05.022 |
| [43] | Takakura H, Morishita M, Shimojo T, Asada K, Kato I. Thermostable protease. United States:US6358726B1. 2002-03-19. |
| [44] | Colombo M, Girard E, Franzetti B. Tuned by metals:the TET peptidase activity is controlled by 3 metal binding sites. Scientific Reports, 2016, 6: 20876. DOI:10.1038/srep20876 |
| [45] | Ishikawa K, Ishida H, Koyama Y, Kawarabayasi Y, Kawahara JI, Matsui E, Matsui I. Acylamino acid-releasing enzyme from the thermophilic archaeon Pyrococcus horikoshii. The Journal of Biological Chemistry, 1998, 273(28): 17726-17731. DOI:10.1074/jbc.273.28.17726 |
| [46] | Guagliardi A, Cerchia L, Rossi M. An intracellular protease of the crenarchaeon Sulfolobus solfataricus, which has sequence similarity to eukaryotic peptidases of the CD clan. Biochemical Journal, 2002, 368(1): 357-363. DOI:10.1042/bj20021017 |
| [47] | Hu YM, Peng N, Han WY, Mei YX, Chen ZJ, Feng X, Liang YX, She QX. An archaeal protein evolutionarily conserved in prokaryotes is a zinc-dependent metalloprotease. Bioscience Reports, 2012, 32(6): 609-618. DOI:10.1042/BSR20120074 |
| [48] | Pulido MA, Saito K, Tanaka SI, Koga Y, Morikawa M, Takano K, Kanaya S. Ca2+-dependent maturation of subtilisin from a hyperthermophilic archaeon, Thermococcus kodakaraensis:the propeptide is a potent inhibitor of the mature domain but is not required for its folding. Applied and Environmental Microbiology, 2006, 72(6): 4154-4162. DOI:10.1128/AEM.02696-05 |
| [49] | Foophow T, Tanaka S, Koga Y, Takano K, Kanaya S. Subtilisin-like serine protease from hyperthermophilic archaeon Thermococcus kodakaraensis with N-and C-terminal propeptides. Protein Engineering Design and Selection, 2010, 23(5): 347-355. DOI:10.1093/protein/gzp092 |
| [50] | Jia BL, Li ZQ, Liu JL, Sun Y, Jia XM, Xuan YH, Zhang JY, Jeon CO. A zinc-dependent protease AMZ-tk from a thermophilic archaeon is a new member of the archaemetzincin protein family. Frontiers in Microbiology, 2015, 6: 1380. |
| [51] | Lee HS, Kim YJ, Bae SS, Jeon JH, Lim JK, Jeong BC, Kang SG, Lee JH. Cloning, expression, and characterization of aminopeptidase P from the hyperthermophilic archaeon Thermococcus sp. strain NA1. Applied and Environmental Microbiology, 2006, 72(3): 1886-1890. DOI:10.1128/AEM.72.3.1886-1890.2006 |
| [52] | Lee HS, Kim YJ, Cho Y, Kim SJ, Lee JH, Kang SG. Characterization of prolyl oligopeptidase from hyperthermophilic archaeon Thermococcus sp. NA1. Journal of Bioscience and Bioengineering, 2007, 103(3): 221-228. DOI:10.1263/jbb.103.221 |
| [53] | Lee HS, Kim YJ, Bae SS, Jeon JH, Lim JK, Kang SG, Lee JH. Overexpression and characterization of a carboxypeptidase from the hyperthermophilic archaeon Thermococcus sp. NA1. Bioscience, Biotechnology, and Biochemistry, 2006, 70(5): 1140-1147. DOI:10.1271/bbb.70.1140 |
