张春兰1, 徐济责2, 柿岛真1, 李玉1


1.吉林农业大学食药用菌教育部工程研究中心, 吉林 长春 130118;
2.吉林农业科技学院生物工程学院, 吉林 吉林 130200
收稿日期:2016-07-20;修回日期:2016-09-13;网络出版日期:2016-09-23
基金项目:国家“973项目”(2014CB138305);公益性行业(农业)科研专项经费(201503137)
*通信作者:李玉, E-mail:966yuli@126.com
摘要: [目的]确定有害疣孢霉的传播途径,明确双孢蘑菇受有害疣孢霉侵染后发病症状和微观形态变化,以及有害疣孢霉的核相。[方法]将有害疣孢霉喷施于培养料及覆土材料的不同深度,观察记录双孢蘑菇的发病情况;将有害疣孢霉接种于不同生长阶段的双孢蘑菇子实体,观察记录其发病情况;使用光学显微镜及扫描电镜观察双孢蘑菇子实体受有害疣孢霉侵染前后的形态变化;通过DAPI(4',6-二脒基-2-苯基吲哚)染色的方法对有害疣孢霉核相进行观察。[结果]将有害疣孢霉接种于培养料及覆土层的不同深度得到双孢蘑菇发病率如下:覆土层表面>覆土层中间>覆土与培养料交界处>培养料中间层;有害疣孢霉可以侵染双孢蘑菇的任意阶段,将其接种于原基直径小于3 mm子实体表面时,得到不能正常分化的“马勃状”组织;对有害疣孢霉的侵染过程进行观察得到:其孢子可粘附于双孢蘑菇表面,并萌发长出芽管,接种处双孢蘑菇表面产生褐色病斑,双孢蘑菇菌丝体发生质壁分离,最后菌丝体膨大,细胞壁变薄甚至溢裂,菌丝体内部中空;有害疣孢霉产生两种类型的分生孢子,Ⅰ类无隔膜含1个细胞核;Ⅱ类具1隔膜含2个细胞核,2个细胞核被隔膜分开;细胞核的第1次有丝分裂发生于分生孢子母细胞中;厚垣孢子由上下2个细胞构成,上胞中含有2个细胞核。下胞含1-2个细胞核。有害疣孢霉的厚垣孢子萌发可产生1-2个芽管,芽管中细胞核的数目不断变化,一般0-2个细胞核。[结论]双孢蘑菇受其侵染后发生显著的细胞学变化;我们对有害疣孢霉做遗传分析时,进行单孢分离需挑取无隔膜的分生孢子为实验材料进行遗传分析。
关键词: 有害疣孢霉 形态学 细胞核
The development of Agaricus bisporus wet bubble disease and the nuclear phase of pathogen
Chunlan Zhang1, Jize Xu2, Makoto Kakishima1, Yu Li1


1.Engineering Research Center of Chinese Ministry of Education for Edible and Medicinal Fungi, Jilin Agriculture University, Changchun 130118, Jilin Province, China;
2.Bioegineering Institute, Jilin Agriculture Science and Technology College, Jilin 130200, Jilin Province, China
Received 20 July 2016; Revised 13 September 2016; Published online 23 September 2016
*Corresponding author: Yu Li, E-mail:966yuli@126.com
Supported by the National Basic Research Program of China (2014CB138305) and by the Special Fund for Agro-scientific Research in the Public Interest (201503137)
Abstract: [Objective]We studied the dynamic nuclear behavior of Hypomyces perniciosus on axenic culture and its disease progression after infection on different growth stages of Agaricus bisporus.[Methods]Infection process was initiated by inoculating different stages of A. bisporus fruit body, and different depths of compost and casing soil with H. perniciosus. Disease progression was studied by observing symptoms on the fruit body using light microscopy and scanning electron microscopy. The nuclear behavior of H. perniciosus was determined by observation using fluorescence light microscopy after binding of DNA specific fluorochrome dye (DAPI:4, 6-Diamidino-2-phenylindole dihydrochloride) to the nuclei.[Results]Inoculating H. perniciosus on different depths of compost and casing soil resulted in different disease rate as follows:on the surface of casing soil>in the center of casing soil>between the casing soil and the compost>in the center of compost. H. perniciosus can infect any stage of fruit body development, when young primordial (up to 3 mm) was infected, large, irregular and tumorous fungal masses were formed. H. perniciosus directly penetrated A. bisporus without the formation of appressorium-like structures. The germination of the conidia led to a necrotic brown lesion symptom on A. bisporus at the beginning stages of disease development. The mycelium of A. bisporus plasmolysed, hydropically degenerated, cytoplasmolysed, emptied of mycelium cytosol and eventual death as the disease advanced. H. perniciosus produced two types of conidia. Group Ⅰ conidia had no septa, colorless and smooth containing one nucleus. Group Ⅱ didymoconidium had septa, containing two nuclei, separated by septa. The first round of mitosis occurred in conidia with no nucleus in the germinal tube. Another kind of asexual spore for thicker cell wall wart convex chlamydospore, chlamydospore had two cells. The upper cell had two nuclear while the basal cell had one or two nuclear, when germinated, it produced one or two germinal tubes. The number of nuclear in the germinal tube was irregular, usually contained 0 to 2 nuclear.[Conclusion]H. perniciosus can infect any part of the A. bisporus fruit body and can cause tremendous cytology changed. If we perform single spore isolation to do genetic analysis, one must isolate conidia with no septa.
Key words: Hypomyces perniciosus morphology nuclei
双孢蘑菇褐腐病,又叫湿泡病、疣孢霉病。该病害的病原物为有害疣孢霉Hypomyces perniciosus Magnus Delacr。有害疣孢霉的分生孢子、厚垣孢子及菌丝体均具致病作用[1]。菇床中通常可观察到两种不同形状罹病的双孢蘑菇子实体。一种为具菌盖菌柄及子实层的病菇,另一种为无菌盖菌柄及子实层不能产生担孢子的似马勃状的病菇[2]。Lambert研究表明,双孢蘑菇菇蕾形成期被侵染,产生畸形的蘑菇组织,称为“硬皮马勃状团块”,在子实体生长末期被侵染,子实体外观相对正常,主要体现在菌柄加粗,形成大脚菇[3]。但其没有明确的阐明所谓的菇蕾形成期,子实体生长末期的子实体大小及形态特征。目前我国双孢蘑菇栽培仍以传统栽培模式主,培养料发酵处理一般只经过1次发酵或简易二次发酵导致发酵不彻底,病原菌活体仍存在于其中。使用这样的培养料后双孢蘑菇是否会发生疣孢霉病?覆土层的不同深度含有有害疣孢霉的孢子会对双孢蘑菇产生怎样的影响,目前仍无明确报道。鉴于此本研究对不同大小的双孢蘑菇子实体接种有害疣孢霉,观察记录双孢蘑菇的发病情况;在覆土材料及培养料的不同部位接种有害疣孢霉,观察双孢蘑菇的发病情况;同时为明确有害疣孢霉的侵染过程,本研究在离体条件下,使用光学显微镜及扫描电镜观察双孢蘑菇子实体阶段 (菌盖直径4–6 cm) 受有害疣孢霉侵染后形态变化。
关于有害疣孢霉菌孢子的核相,仅查阅到其厚垣孢子的下胞含1个细胞核的报道,未见其上胞细胞核数目的报道[4]。真菌细胞的核相是许多真菌分类的重要依据,其核相变化也是真菌遗传变异的基础。本研究采用DAPI (4′, 6–二脒基–2–苯基吲哚) 荧光染色方法,对有害疣孢霉孢子进行显微观察,并对其孢子萌发过程中的核相变化进行观察,以确定细胞核数目变化的原因,旨为有害疣孢霉的遗传学研究工作提供参考依据。
1 材料和方法 1.1 材料
1.1.1 菌种来源: 有害疣孢霉分离于罹病的双孢蘑菇As2796子实体中,采集地为武汉新州区。双孢蘑菇使用美国Sylvan A15菌株。供试的双孢蘑菇及有害疣孢霉菌株均采用组织分离的方法,经纯培养后获得纯种。菌种均保存于吉林农业大学菌种保藏中心。有害疣孢霉菌种编号为CCMJ1131,双孢蘑菇菌种编号为CCMJ1139。:
1.1.2 PDA培养基 (g/L): 马铃薯200,葡萄糖20,琼脂15,加蒸馏水定容至1 L。: 1.2 双孢蘑菇栽培条件 双孢蘑菇培养料配方及环境控制条件如下:二次发酵麦草鸡粪培养料,小麦,石膏,鸡粪,配比按10.0:6.0:0.5 (W/W),含水量64%–66%;按麦粒种占1%比例播种,层播的方式播种。采用袋式栽培 (菌袋直径30 cm,长度50 cm),培养料厚度15 cm。播种后菇房环境控制如下:温度23–24 ℃,相对湿度90%–95%。待菌丝爬满培养料后进行覆土,覆土材料使用草炭土,覆土层厚3–4 cm。待菌丝爬至2/3覆土层时,改变菇房环境条件。降低温度至16.5–17.5 ℃,相对湿度88%–92%,加大通风[5]。
1.3 培养料及覆土层不同部位接种有害疣孢霉 配制孢子浓度为1×105个/mL的有害疣孢霉菌悬液。在草炭土及培养料的不同深度接种有害疣孢霉菌悬液,具体接种部位如图 1所示。每个处理接种50 mL,将菌悬液均匀喷施于同一平面。播种时在培养料的中间层及最上层喷施有害疣孢霉的菌悬液。覆土后,于草炭土的中间层及表面喷施相同体积及浓度的有害疣孢霉菌悬液。以不施用有害疣孢霉菌悬液为对照组。每个处理5个重复。观察记录不同处理下双孢蘑菇菌丝的生长状况及原基开始形成后双孢蘑菇的发病情况。
 |
| 图 1. 培养料及覆土层不同深度接种有害疣孢霉菌示意图 Figure 1. Illustration of inoculation of Hypomyces perniciosus on the different depth of compost and casing soil. 1: surface of casing soil; 2: center of casing soil; 3: below the casing soil under the compost; 4: center of the compost. |
| 图选项 |
1.4 子实体不同阶段接种有害疣孢霉 待双孢蘑菇爬满覆土菌丝开始扭结形成原基时,对不同生长阶段双孢蘑菇子实体接种。按子实体大小共划分为5个生长阶段。分别为 (1) 原基大小1–3 mm;(2) 原基大小3–6 mm;(3) 原基大小6–10 mm;(4) 菌盖直径1–2 cm;(5) 菌盖直径大于2 cm。具体接种方法如下:配制有害疣孢霉孢子悬液,浓度1×104个/mL,移液枪吸取5 μL菌悬液接种于上述不同生长阶段的子实体表面,每生长阶段的双孢蘑菇,设置20个重复,菇房环境条件设置如下:温度17–18 ℃,湿度:88%–92%,每天观察记录双孢蘑菇的发病情况,并对其进行显微镜观察。
1.5 离体条件下接种病原菌后发病症状观察 配制有害疣孢霉菌悬液,孢子浓度5×104个/mL。离体接种方法:摘取成熟的双孢蘑菇子实体 (菌盖直径为3–4 cm),将其置于灭菌的平皿中,平皿底部铺有灭菌滤纸。共3组试验,分别为在双孢蘑菇子实体的菌盖、菌柄、菌褶滴加5 μL孢子悬液。每处理10个重复。将平皿置于25 ℃,相对湿度85%–90%的培养箱中黑暗培养。每隔12 h,取不同接种部位组织制片,于光学显微镜及扫描电镜下观察[6]。
1.6 有害疣孢霉的核相观察
1.6.1 有害疣孢霉无性孢子的核相: 活化纯培养有害疣孢霉菌,挑取尖端菌丝体接种于PDA培养基中,采用插片培养法,25 ℃暗培养。以菌丝刚生长到盖玻片上为宜。在载玻片上加入5 μL,10 μg/mL DAPI染液,将长有有害疣孢霉的盖玻片轻轻盖在染液上,静置1–5 min,用镊子轻轻将盖玻片压下,使菌丝和染液充分接触。制片后在光学显微镜及激光共聚焦显微镜 (型号:LSM 710/780 ZISS,Germany) 下观察。并记录100个分生孢子,厚垣孢子中细胞核的数目。:
1.6.2 有害疣孢霉分生孢子萌发时核相变化观察: 取生长于PDA培养基中5 d的有害疣孢霉,无菌水冲洗下孢子后,用10层纱布过滤。显微镜检确定孢子浓度为1×105个/mL。取5 mL菌悬液于灭菌的培养皿中,封盖,以上操作均在超净工作台中完成,5次重复。25 ℃黑暗条件下培养。在培养2、4、6、8、10、12 h后分别取5 μL菌悬液于载玻片中央,加入浓度为10 μg/mL的DAPI进行核相观察,方法同1.6.1。:
1.6.3 诱导有害疣孢霉厚垣孢子萌发及其萌发过程中核相变化: 取新采摘的双孢蘑菇子实体,用灭菌的解剖刀将其分割成小块组织 (边长约2 cm),用接种针沾取长在PDA平板上的有害疣孢霉的孢子,将孢子涂抹于蘑菇组织块的表面。将处理后的双孢蘑菇组织置于灭菌的培养皿中,以上操作均在超净工作台中完成,10次重复。25 ℃,相对湿度85%暗培养。每隔6 h,取小块蘑菇组织于光学显微镜下检查厚垣孢子萌发情况。待确定厚垣孢子萌发后,取接种部位的蘑菇组织 (边长约0.3 cm,厚度低于1 mm) 进行制片观察,制片过程如下:将蘑菇组织置于载玻片中央,加入10倍体积的浓度为10 μg/mL的DAPI染料,染色1–5 min。在光学显微镜和激光共聚焦显微镜下进行观察,观察记录100个厚垣孢子的芽管萌发位置,个数及细胞核数目。: 2 结果和分析 2.1 培养料及覆土层不同深度接种有害疣孢霉后双孢蘑菇的发病情况 降温处理后20 d,草炭土表面及中间层接种有害疣孢霉的处理组现马勃状病组织,无健康的双孢蘑菇子实体 (图 2-A,图 2-B)。且草炭土表层接种有害疣孢霉的菇包数量明显多于草炭土中间层接种有害疣孢霉的菇包数量。培养料表层与培养料中间层接种有害疣孢霉的处理组,于草炭土表层形成健康的双孢蘑菇子实体,但在培养料表层接种有害疣孢霉的处理组在覆土层边缘现发病的马勃状菇包 (图 2-C)。
 |
| 图 2. 在培养料及覆土层的不同深度接种有害疣孢霉后双孢蘑菇的发病情况 Figure 2. Inoculated Hypomyces perniciosus on the different depth of casing soil and compost. A: inoculated H. perniciosus on the surface of the casing soil; B: inoculated H. perniciosus in the center of the casing soil; C: inoculated H. perniciosus below the casing soil above the compost; D: inoculated H. perniciosus in the center of the compost. |
| 图选项 |
2.2 子实体不同阶段接种有害疣孢霉后双孢蘑菇子实体的发病情况 在原基直径小于3 mm (图 3-A) 时接种有害疣孢霉菌的双孢蘑菇7 d后,发育无菌柄、菌盖及子实层的的马勃状组织 (图 3-B)。双孢蘑菇子实体直径大于3 mm (图 3-C) 的处理组,接种有害疣孢霉7 d后,均产生分化出正常子实层的子实体,但其仍表现明显的病症,其发病症状具体如下:接种有害疣孢霉后2 d,接种处黄褐色病斑 (图 3-E),4 d斑点继续扩大,表面长出有害疣孢霉菌丝体 (图 3-F),9 d感病的双孢蘑菇表面产生褐色液滴,子实体几乎全部变黄褐色,部分子实体菌柄及菌盖表面皲裂图 3-G。显微观察健康的双孢蘑菇子实体不同阶段组织形态,发现原基直径小于3 mm时,双孢蘑菇没有子实层的分化,此时子实体内部菌丝交织排列 (图 4-A,图 4-E);而子实体直径介于3–6 mm时,以开始子实层分化,现栅栏组织 (图 4-B,图 4-F);大于6 mm时可见明显的菌褶及子实层 (图 4-C,图 4-D、图 4-G,图 4-H)。
 |
| 图 3. 活体条件下不同生长阶段的双孢蘑菇子实体接种有害疣孢霉后发病情况 Figure 3. In vivo inoculation of Hypomycese perniciosus on the surface of Agaricus bisporus at different stages of fruit body development. A: fruit body of A. bisporus 3 mm; B: puffball like tissue of A. bisporus; C: fruit body of A. bisporus 5 mm; D: inoculatedH. perniciosus on the surface of 5 mm diameter fruit body 7 days; E: inoculatedH. perniciosus on the surface of 1 cm diameter fruit body 2 days; F: inoculatedH. perniciosus on the surface of 1 cm diameter fruit body 4 days; G: inoculatedH. perniciosus on the surface of 1 cm diameter fruit body 9 days. |
| 图选项 |
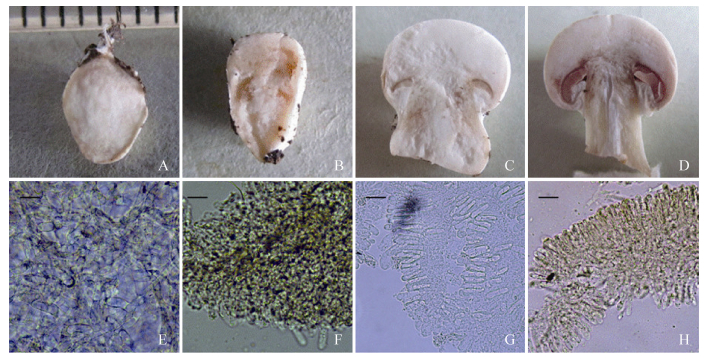 |
| 图 4. 不同时期的双孢蘑菇子实体形态 Figure 4. Different stages of Agaricus bisporus fruit body. A: primordium 3 mm in size; B: primordium 5 mm in size; C: fruit body with a cap size of 1 cm; D: fruit body with a cap size of 2.5 cm; E: micro-morphology of primordium 3 mm in size; F: micro-morphology of primordium 5 mm in size; G: hymenium of fruit body with a cap size of 1 cm; H: hymenium of fruit body with a cap size of 2.5 cm. Bars=20 μm. |
| 图选项 |
2.3 离体条件下双孢蘑菇子实体发病症状及微观形态观察 双孢蘑菇的菌柄、菌盖、菌褶接种有害疣孢霉后均可发病。光学显微镜下健康的的双孢蘑菇菌盖内部菌丝体饱满,呈不规则排列,腊肠状 (图 5-A)。扫描电镜观察健康的双孢蘑菇菌盖表面,双孢蘑菇菌丝体不规则排列,部分菌盖表面覆盖黏性物质。双孢蘑菇子实体内部菌丝饱满,菌丝内壁网状结构,且细胞器清晰可见 (图 6-A)。接种有害疣孢霉12 h,可见有害疣孢霉孢子粘附于子实体表面 (图 6-B),子实体未见明显异常,显微镜下观察其菌丝体形态正常。接种有害疣孢霉24 h后,显微镜下观察接种部位子实体形态,发现部分有害疣孢霉的厚垣孢子已萌发 (图 5-B,图 6-C)。接种处双孢蘑菇菌丝体未见明显异常。接种有害疣孢霉2 d,接种处子实体表面形成黑色病斑。光学显微镜下观察发现,接种处双孢蘑菇菌丝体褐变,发生质壁分离且有黑色素产生。接种后的第3 d,双孢蘑菇子实体表面有褐色液滴溢出,现有害疣孢霉的菌落 (图 6-D,图 7-B),剖开子实体,其外边缘呈黄褐色 (图 7-D)。显微镜下观察到受侵染处双孢蘑菇菌丝体膨大,细胞壁变薄部分瓦解,细胞结构模糊,子实体内现大量的有害疣孢霉菌丝体 (图 5-D,图 6-F),但未观察到有害疣孢霉的孢子产生。接种后第4天有害疣孢霉菌落进一步扩展。显微镜下可观察到有害疣孢霉在双孢蘑菇子实体表面产生大量分生孢子和厚垣孢子 (图 5-E,图 6-E,图 7-C),子实体内部仍无有害疣孢霉的孢子产生。
 |
| 图 5. 光学显微镜下观察有害疣孢霉侵染双孢蘑菇的形态变化 Figure 5. Observed diseased symptom changed of Agaricus bisporus fruit body by light microscope. A: center part of cap mycelium; B: chlamydospore germinated after 36 h; C: mycelium of H. perniciosus grown on PDA. D: H. perniciosus invaded into fruit body of A. bisporus; E: H. perniciosus covered the surface of A. bisporus gill. mh: mycelium of H. perniciosus. Bars=10 μm. |
| 图选项 |
 |
| 图 6. 受侵染的双孢蘑菇菌柄扫描电镜图谱 Figure 6. SEM photographs of Hypomyces perniciosus invading Agaricus bisporus. A: center of healthy A. bisporus; B: clamydospore ofH. perniciosus adhered on the surface ofA. bisporus 12 h after inoculation of H. perniciosus; C: clamydospore of H. perniciosus germinated 24 h after inoculated H. perniciosus; D: lots of H. pernisiosus covered A. bisporus fruit body; E: H. perniciosus hypha infection of A. bisporus gills 4 d after inoculation; F: 4 days after inoculation, center of A. bisporus is filled withH. perniciosus and the mycelium of A. bisporus with hydropic degeneration. h: clamydospore ofH. perniciosus; a: mycelium of A. bisporus; mh: mycelium of H. perniciosus. |
| 图选项 |
 |
| 图 7. 双孢蘑菇子实体受侵染后症状 Figure 7. Symptoms of wet bubble diseased on Agaricus bisporus fruit body. A: diseased symptom of A. bisporus on the cultural bed; B: 3 days after Inoculation of H. perniciosus on the surface of A. bisporus; C: 4 days after inoculation of H. perniciosus on the surface of A. bisporus; D: center of A. bisporus fruit body 3 days after inoculation of H. perniciosus. |
| 图选项 |
2.4 有害疣孢霉的核相
2.4.1 分生孢子及厚垣孢子的核相: 有害疣孢霉产生两种类型的分生孢子,Ⅰ类数量占78%,Ⅱ类数量占22%。Ⅰ类分生孢子无隔膜,无色透明,光滑,含1个细胞核 (图 8-A)。Ⅱ类分生孢子无色透明,光滑,具1隔膜,含2个细胞核,且2个细胞核被隔膜分开 (图 8-B,图 8-C)。厚垣孢子双胞,上下2个细胞构成,上胞较大黄褐色具疣凸,细胞中含有2个细胞核 (图 8-D,图 8-F)。下胞无色透明,光滑,含1–2个细胞核 (图 8-E,图 8-F)。:
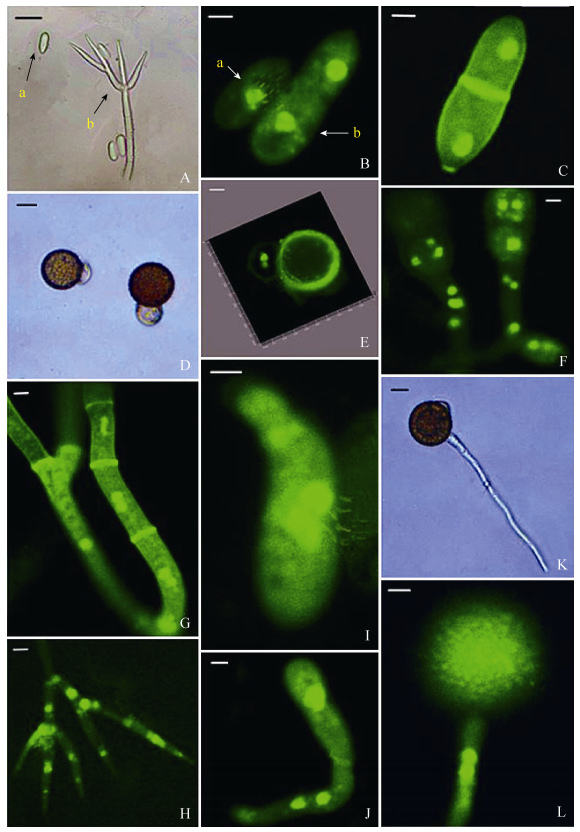 |
| 图 8. 有害疣孢霉的核相 Figure 8. Nuclei of Hypomyces perniciosus. A: conidia and conidiophore. a: conidia; b: conidiophore. Bars= 10 μm. B: conidia. a: conidia without septa; b: conidia with septa. Bars=1 μm. C: conidia with septa. Bars=1 μm. D–F: chlamydospore. Bars=5 μm. G: mycelium. Bars=1 μm. H: conidiophore. Bars=5 μm. I: conidia germinated in one germinal tube, mitosis of the nucleus in conidia. Bars=1 μm. J: conidia without septa germinated in one tube, mitosis of the nucleus in the germinal tube. Bars=1 μm. K: chlamydospore germinated in one germinal tube from the apical cell. Bars=10 μm. L: chlamydospore germinated in one germinal tube from the apical cell, two nucleus in the germinal tube. Bars=10 μm. |
| 图选项 |
2.4.2 分生孢子及厚垣孢子萌发过程中核相变化: 有害疣孢霉的分生孢子极易萌发,在蒸馏水中,25 ℃,黑暗培养4 h即可萌发,萌发出的芽管位于分生孢子母细胞顶端 (图 8-I)。无论Ⅰ类分生孢子或Ⅱ类分生孢子,细胞核的第1次有丝分裂均发生于分生孢子母细胞中,分生孢子母细胞中1个细胞核分裂成2个细胞核,芽管与孢子间形成1隔膜,此时芽管中无细胞核 (图 8-I);6 h后1个细胞核进入芽管,另1个仍保留在分生孢子中,芽管里1个细胞核继续分裂产生2个细胞核 (图 8-J),一般此后细胞核不再进行分裂,即芽管内最多有2个细胞核,随后芽管伸长并会产生隔膜;厚垣孢子相对分生孢子不易萌发,此试验条件下24 h可萌发。有害疣孢霉厚垣孢子的上胞和下胞均可产生芽管,且产生的方向不定。上胞及下胞可产生1–2个芽管 (图 8-K),下胞易破裂,下胞破裂的厚垣孢子其上胞仍可萌发长出芽管。萌发的厚垣孢子芽管里含0–2个细胞核 (图 8-L)。: 3 讨论 在培养料及覆土层的不同深度接种有害疣孢霉后,双孢蘑菇发病率不同。在覆土层喷施有害疣孢霉后发病较为明显。分析可能由于培养料中
较覆土层含有更多的能够抑制有害疣孢霉孢子萌发或菌丝生长的拮抗微生物。双孢蘑菇的培养料里含有大量的放线菌,这些放线菌可以产生抗生素,抑制一些霉菌的生长及孢子萌发,同时有害疣孢霉对双孢蘑菇的营养菌丝体阶段无致病力[7]。双孢蘑菇在培养料中生长时是营养菌丝体阶段,在这可能也是影响在双孢蘑菇培养料中间层喷施有害疣孢霉后双孢蘑菇不发病的一个原因。而双孢蘑菇菌丝扭结及原基形成均发生覆土层中,有害疣孢霉对双孢蘑菇子实体有较强致病力[8],因此在覆土层喷施有害疣孢霉后,现大量的双孢蘑菇病组织。整体试验结果:双孢蘑菇的发病率覆土层表面 > 覆土层中间 > 覆土与培养料交界处 > 培养料中间层。可以看出与空气接触面积越大,发病率越高。可能有害疣孢霉的孢子在氧气浓度低条件下,萌发受到抑制。导致覆土层表面含有有害疣孢霉,双孢蘑菇发病最为严重。
双孢蘑菇子实体不同生长阶段接种有害疣孢霉后,双孢蘑菇分化出形态特征不同的病菇。在原基直径小于3 mm时候接种,罹病的双孢蘑菇子实体不能正常分化形成菌柄、菌盖及子实层;原基直径大于3 mm的子实体接种后的,罹病的双孢蘑菇可分化出菌柄、菌盖及子实层。显微镜下观察健康的不同发育阶段的双孢蘑菇子实体形态,发现原基直径小于3 mm时,双孢蘑菇无子实层的分化,整个原基内的菌丝体不规则排列;而直径大于3 mm的原基以完成子实层的分化。通过此试验确定菇床中受侵染的双孢蘑菇之所以会出现病菇和菇包的不同形状病组织是因为其受侵染的阶段不同导致的。而在原基直径小于3 mm时受有害疣孢霉侵染后双孢蘑菇子实体不能正常的分化,其作用机理目前仍不明确。关于真菌与寄生真菌之间的相互作用目前研究较为薄弱,明确他们之间的互作机制有助于更好的预防和控制病害的发生。
本研究通过光学显微镜及扫描电镜对有害疣孢霉侵染对双孢蘑菇的过程进行观察,接种有害疣孢霉致使双孢蘑菇子实体发生巨大的形态学及细胞学变化。由于双孢蘑菇表面分布着大量的黏性物质为多糖类[9],致使有害疣孢霉的孢子极易粘附于其表面,并萌发长出芽管,本实验进一步证实有害疣孢霉可产生毒性物质,致双孢蘑菇菌丝体产生黑色素,发生质壁分离,发病后期双孢蘑菇菌丝体积细胞器被降解;有害疣孢霉的致病物质有待进一步研究,分析可能为一些水解酶类。
有害疣孢霉菌丝体产生两类分生孢子,Ⅰ类分生孢子单胞,含1个细胞核;Ⅱ类分生孢子双胞具一隔膜,含2个细胞核。这一结果与大多数植物病原真菌的分生孢子的细胞核行为相同,如:张敬泽等报道了无核柿炭疽病菌单胞的分生孢子含1个细胞核[10];有害疣孢霉的分生孢子及厚垣孢子萌发过程中的核相变化表明,由于细胞核在不断地进行分裂,其芽管和菌丝细胞中细胞核的数目将会不断地发生变化。即使是成熟的菌丝细胞内的大多数细胞核也会进行有丝分裂。因此,有害疣孢霉芽管和菌丝细胞是多核的,细胞核数目在0–2个。有害疣孢霉的厚垣孢子的上胞和下胞均可产生芽管,且产生的方向不定。Holland等 (1990) 使用透射电镜观察到有害疣孢霉厚垣孢子的下胞含1个细胞核,但未报道上胞细胞核的数目,及萌发后芽管中细胞核的核相变化[11]。本研究确定有害疣孢霉的厚垣孢子上胞含2个细胞核,下胞含有1–2个细胞核。对有害疣孢霉做遗传分析时 (如:对有害疣孢霉的全基因组测序,采用ISSR和ALFP等方法判定其亲缘关系及遗传多样性),需挑取无隔膜的分生孢子为实验材料。
参考文献
| [1] | Umar MH, Geels FP, Van Griensven LJLD. Pathology and pathogenesis of Mycogone perniciosa infection of Agaricus bisporus.Mushroom Science, 2000, 15: 561–567. |
| [2] | Fletcher JT, Hims MJ, Hall RJ. The control of bubble diseases and cobweb disease of mushrooms with prochloraz.Plant Pathology, 1983, 32(2): 123–131DOI:10.1111/ppa.1983.32.issue-2. |
| [3] | Lambert EB. Studies on the relation of temperature to the growth, parasitism, thermal death points, and control of Mycogone perniciosa.Phytopathology, 1930, 20(1): 75–83. |
| [4] | Holland DM, Parker ML, Cooke RC, Evans GH. Germination of bicellular conidia of Mycogone perniciosa, the wet bubble pathogen of the cultivated mushroom.Transactions of the British Mycological Society, 1985, 85(4): 730–735DOI:10.1016/S0007-1536(85)80272-2. |
| [5] | Eastwood DC, Herman B, Noble R, Dobrovin-Pennington A, Sreenivasaprasad S, Burton KS. Environmental regulation of reproductive phase change in Agaricus bisporus by 1-octen-3-ol, temperature and CO2.Fungal Genetics and Biology, 2013, 55: 54–66DOI:10.1016/j.fgb.2013.01.001. |
| [6] | 方中达. 植病研究方法.第3版.北京: 中国农业出版社, 1998. |
| [7] | Han YS, Shin KC, Kim DS. Some biological studies on Mycogone perniciosa Magn. Causing wet bubble in ultivated mushroom, Agaricus bisporus (Lange) sing (Ⅰ) antagonistic relationships between M. perniciosa and microfloral organisms in the casing soil (Ⅱ) lnteractions between M. perniciosa and A. bisporus.The Korean Journal of Mycology, 1974, 2(1): 7–14. |
| [8] | Holland DM, Cooke RC. Nutrient depletion and sporulation in the wet bubble pathogen Mycogone perniciosa.Mycological Research, 1991, 95(3): 364–369DOI:10.1016/S0953-7562(09)81249-5. |
| [9] | Michalenko GO, Hohl HR, Rast D. Chemistry and architecture of the mycelial wall of Agaricus bisporus.Journal of General Microbiology, 1976, 92(2): 251–262DOI:10.1099/00221287-92-2-251. |
| [10] | Zhang JZ, Xu T, He LP. Anthracnose pathogen on Diospyros kaki cv. Wuheshi and its nuclear behavior in process of appressorium formation.Mycosystema, 2005, 24(3): 446–456(in Chinese).张敬泽, 徐同, 何黎平. 浙江无核柿炭疽病菌鉴定及附着胞形成过程中的核相变化.菌物学报, 2005, 24(3): 446–456. |
| [11] | Holland DM, Cooke RC. Activation of dormant conidia of the wet bubble pathogen Mycogone perniciosa by basidiomycotina.Mycological Research, 1990, 94(6): 789–792DOI:10.1016/S0953-7562(09)81379-8. |
