张鹏, 底亚涵, 周景文, 堵国成, 陈坚, 史仲平


工业生物技术教育部重点实验室, 江南大学生物工程学院, 江苏 无锡 214122
收稿日期:2015-12-17;修回日期:2016-02-04;网络出版日期:2016-05-09
基金项目:国家“973项目”(2012CB720802);国家自然科学基金重点项目(31130043)
*通信作者:史仲平,Tel:+86-510-85918312;Fax:+86-510-85918309;E-mail:zpshi@jiangnan.edu.cn
摘要: [目的]为了研究泛素化对组氨酸转运及调控的影响。[方法]应用泛素化位点预测及定点突变等技术手段,Hip1p的3个潜在的泛素化位点K30、K42和K52被突变。这些突变的Hip1p被克隆到泛素化检测质粒中,检测泛素化位点突变对Hip1p的泛素化水平的影响。同时这些突变对细胞生长及组氨酸利用的影响也进一步做了检测。[结果]Hip1p的3个赖氨酸位点K30、K42和K52突变能有效降低其泛素化水平。同时,双重突变对其泛素化水平有明显的协同作用,并进一步影响了细胞生长和组氨酸利用。[结论]泛素化水平调控能有效调节组氨酸代谢,引起细胞对组氨酸利用的改变,为进一步研究氨基酸转运蛋白的调控机制提供了重要的依据。
关键词: 氨基酸 荧光双分子互补技术 氮代谢 基因突变
Ubiquitination regulation of histidine transporter Hip1p on histidine utilization in Saccharomyces cerevisiae
Zhang Peng, Di Yahan, Zhou Jingwen, Du Guocheng, Chen Jian, Shi Zhongping


Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu Province, China
Received 17 December 2015; Revised 04 February 2016; Published online 09 May 2016
*Corresponding author: Tel:+86-510-85918312;Fax:+86-510-85918309;E-mail:zpshi@jiangnan.edu.cn
Supported by the Major Project of China National Programs for Fundamental Research and Development (2012CB720802) and by the Key Project of Chinese National Natural Science Foundation (31130043)
Abstract: [Objective] In order to demonstrate the ubiquitination regulation mechanism of histidine transporters. [Methods] By both ubiquitination sites prediction and site-directed mutagenesis, 3 potential ubiquitination sites, K30, K42 and K42 of Hip1p were mutated. These Hip1p mutants were cloned into the ubiquitination detection plasmid for measuring its ubiquitination level change. Effects of these mutants on both cell growth and histidine utilization were measured. [Results] By comparing the relative fluorescence of Hip1p and its mutants, ubiquitination sites mutation reduced the ubiquitination levels of Hip1p. Furthermore, double mutation of ubiquitination sites showed a synergy effect on reducing ubiquitination level. The ubiquitination sites mutants also influenced cell growth and enhance histidine utilization when histidine was used as the sole nitrogen source. [Conclusion] The ubiquitination levels could regulate the histidine metabolism and change the pattern for histidine metabolism, and provide clues for further investigation of regulation mechanisms involved in the amino acids transporter proteins.
Key words: amino acid bimolecular fluorescence complementation nitrogen metabolism gene mutagenesis
酿酒酵母细胞对胞外氨基酸的利用主要是通过多种多样的氨基酸转运蛋白来实现的。不同的氨基酸转运蛋白表达受到不同的代谢调控[1]。这些过程包括通用氨基酸调控(GAAC)、非折叠蛋白应答(UPR)、SPS(Ssy1-Ptr3-Ssy5)信号途径和氮代谢阻遏调控(NCR)[2-3]。在不同的氮源条件下,细胞通过调节转运蛋白来实现胞外氨基酸物质的运输。细胞膜上的氨基酸转运蛋白的下游调控主要依赖泛素-蛋白酶解途径[4]。这一调控途径又受到TORC1 (Target of rapamycin complex 1)的调控。TORC1通过负调控的磷酸激酶Npr1p,泛素化连接酶Rsp5p调控这一过程,实现细胞对营养物质的正常利用[5-7]。在氮源贫瘠的环境中,TORC1路径受到阻断,氨基酸转运蛋白被Npr1p磷酸化激酶磷酸化,进而激活氨基酸转运蛋白的转运功能。当有丰富的氮源存在时,TORC1途径被激活,Npr1p磷酸化激酶活性受到抑制,氨基酸转运蛋白被泛素化连接酶Rsp5p和相关的结合蛋白多重泛素化,并随后被转运到液泡中进行降解[8]。
酵母中组氨酸的转运主要涉及到2类转运蛋白,一类是通用氨基酸转运蛋白Gap1p,另一类是特异性的组氨酸转运蛋白。Hip1p是1种特异性转运组氨酸的膜蛋白,组氨酸对于菌体的合成代谢具有重要作用[9]。HIP1基因敲除后酵母能在高于细胞正常需求50倍约30 mmol/L的组氨酸为唯一氮源的条件下生长,在敲除菌种重新表达HIP1基因能够使酵母在正常水平的组氨酸需求下生长[10]。
荧光双分子互补技术的泛素化检测主要基于荧光双分子互补技术构建了1个泛素化检测载体,1个启动子表达的泛素分子末端带有荧光蛋白的氨基端的一部分,另一个启动子表达检测基因和荧光蛋白的羧基端融合表达。如果待研究蛋白与泛素分子间存在相互作用,目的蛋白与泛素分子的结合将使荧光分子的羧基端、氨基端重新结合成一个完整的荧光蛋白,因而在酶标仪下定量检测荧光蛋白的荧光强度,从而检测蛋白分子的泛素化变化。
泛素化对氨基酸转运蛋白的膜定位、降解过程中发挥了重要的作用。本文使用在线软件UbPred对Hip1p潜在的泛素化位点进行预测[10-11]. 并进一步通过定点突变的方法对Hip1p的泛素化调控机制进行了研究。揭示泛素化位点突变对Hip1p泛素化及细胞对组氨酸的利用的影响。为进一步深入研究泛素化修饰对酿酒酵母氮源代谢调控提供可靠的理论基础及依据。
1 材料和方法 1.1 材料 1.1.1?菌株和质粒:酿酒酵母菌株Saccharomyces cerevisiae CEN.PK2-1D-Δubi4(MATα ura3-52;trp1-289;leu2-3,112;his3Δ1;MAL2-8C;SUC2)[12] 为本研究室保藏。泛素化检测载体pUbDetec16为本研究室构建[13]。大肠杆菌Escherichia coli JM109用于质粒载体构建。
1.1.2?培养基与培养条件:YNB基础培养基:1.74 g/L无氨基酵母氮源,20 g/L 葡萄糖,5 g/L硫酸氨。YNB完全培养基:YNB培养基中添加50 μg/mL组氨酸、50 μg/mL色氨酸、50 μg/mL亮氨酸、50 μg/mL尿嘧啶。YNB-Leu-Ura双重氨基酸缺陷型培养基:YNB基础培养基中添加50 μg/mL组氨酸和50 μg/mL色氨酸。YPD培养基:20 g/L葡萄糖,20 g/L蛋白胨,10 g/L酵母粉。LB培养基:10 g/L 胰蛋白胨,5 g/L 酵母粉,10 g/L 氯化钠,定容后调节pH至7.0。固体培养基LB培养基中额外加入20 g/L 琼脂粉。大肠杆菌JM109培养条件:从LB平板上挑取单菌落至20 mL LB培养基的摇瓶中,200 r/min、37 ℃培养16-24 h。酿酒酵母 CEN.P K2-1D-Δubi4感受态制备培养条件:挑取单菌落接种于20 mL YPD培养基中,200 r/min于30 ℃培养12-16 h,离心收集细胞制备感受态。泛素化检测实验培养条件:从平板上接种少量细胞于20 mL YNB-Leu-Ura培养基中,200 r/min于30 ℃培养至对数中期,离心转接到20 mL YNB添加混合氨基酸的培养基中培养90 min。
1.1.3?主要试剂和仪器:大肠杆菌感受态制备试剂盒和质粒提取试剂盒购于上海生工有限公司;胶回收试剂盒购于Fermentas公司;限制性内切酶、连接酶和DNA聚合酶等购买于大连宝生物有限公司。DNA测序送样于上海生工有限公司。
1.2 HIP1泛素化检测质粒构建及酵母转化 从NCBI上查找酿酒酵母S228C的HIP1基因(GenBank Reference Sequence: NC_001139.9)序列,设计引物HIP1-F(EcoRⅠ)和HIP1-R(SmaⅠ)从酿酒酵母基因组上扩增HIP1基因。PCR扩增产物经过纯化后,用限制性内切酶EcoRⅠ和SmaⅠ进行双酶切,并与pUbDetec16载体进行过夜酶连,之后将酶连产物加入JM109感受态中进行热击转化,通过菌落PCR验证阳性转化子,送上海生工测序,构建重组质粒pUbDetec16-HIP1。将测序正确重组质粒利用醋酸锂转化法转化酿酒酵母CEN.PK2-1D-Δubi4感受态中[14],取适量菌体涂布在YNB-Leu-Ura固体平板上,30 ℃培养3-4 d,挑选单菌落进行菌落PCR验证筛选阳性转化子。
1.3 Hip1p蛋白泛素化位点预测及定点突变 使用在线泛素化位点预测软件UbPred (http://www.ubpred.org/)对Hip1p的泛素化位点进行预测,结果显示Hip1p的第30、42和50位的赖氨酸位点具有较高的置信度。我们使用表 1中的突变引物以pUbDetec16-HIP1为模板进行PCR扩增,将扩增产物用限制性内切酶Dpn Ⅰ在37 ℃消化1 h,转化大肠杆菌JM109感受态,挑取单菌落送生工测序,获取正确的突变质粒。
表 1. HIP1基因突变引物 Table 1. Primers used for the site directed mutagenesis of HIP1
| Primer name | Primer sequence (5′→3′) |
| HIP1-F | CCGGAATTCATGCCTAGAAACCCATTGAAAAAGG |
| HIP1-R | TCCCCCGGGACACCAGAAATGTAAAAATCTTGTT |
| HIP1K30R-F | CCAGCCTTCGAGAATGAAAGAGAATCTACTACATTTGTT |
| HIP1K30R-R | AACAAATGTAGTAGATTCTCTTTCATTCTCGAAGGCTGG |
| HIP1K42R-F | GTTACCGAACTAACTTCCAGAACCGATTCTGCATTTCCA |
| HIP1K42R-R | TGGAAATGCAGAATCGGTTCTGGAAGTTAGTTCGGTAAC |
| HIP1K52R-F | GCATTTCCATTAAGTAGCAGGGATTCACCTGGCATAAAC |
| HIP1K52R-R | GTTTATGCCAGGTGAATCCCTGCTACTTAATGGAAATGC |
| Underlined letters represent the restriction enzyme cutting sites. | |
表选项
1.4 重组质粒泛素化水平的荧光检测 将含有Hip1p泛素化位点突变质粒的酿酒酵母CEN.PK2-1D-Δubi4接种到液体YNB培养基中30 ℃、200 r/min过夜培养至对数中期,8000 r/min5 min离心去上清。用无菌水洗涤2次细胞,转移菌体到添加终浓度为0.25%酪蛋白水解物的YNB基础培养基中,30 ℃、200 r/min培养90 min。使用分光光度计测定OD600,并取200 μL于96孔全黑酶标板,在发射光/激发光=485/524 nm条件下检测荧光强度。按照公式(1)计算各突变体相对于Hip1p转运蛋白的相对荧光强度变化(RC)。
 | 公式(1) |
1.5 组氨酸转运蛋白Hip1p泛素化位点突变对酿酒酵母组氨酸利用的影响 将含有Hip1p泛素化位点突变质粒的酿酒酵母CEN.PK2-1D-Δubi4接种到液体YNB培养基中30 ℃、200 r/min过夜培养至对数中期。于8000 r/min、5 min离心去上清。用无菌水洗2次,按5%的接种量转接到YNB基础培养基(不含硫酸铵)并添加终浓度为5 mmol/L的组氨酸培养基中,于30 ℃、200 r/min培养48 h。检测酿酒酵母Hip1p突变对组氨酸利用的影响。
1.6 组氨酸的高效液相色谱(HPLC)检测 组氨酸的测定使用安捷伦1260 HPLC检测系统,色谱柱为购于thermo公司的ODS2-C18柱。色谱条件按照文献[15]中描述的方法进行。
1.7 突变菌株遗传稳定性检测 接种Hip1p突变菌株到10 mL YPD培养基中,30 ℃、200 r/min 培养48 h。将菌液稀释106倍,取150 μL涂布在YPD固体培养基上,30 ℃、培养2 d。用牙签或枪头挑取100个单菌落转接到YNB-Leu-Ura固体培养基上,30 ℃、培养2 d,统计YNB-Leu-Ura固体培养基上的菌落生长数,计算突变菌株的遗传稳定性。重复操作3次。
2 结果和分析 2.1 Hip1p泛素化位点预测及突变 使用在线泛素化位点预测软件UbPred对酿酒酵母组氨酸转运蛋白Hip1p的泛素化位点进行预测,预测得到3个置信度比较高的赖氨酸位点K30、K42和K52,并通过基于PCR扩增的突变技术成功对Hip1p的泛素化位点进行了突变(图 1)。并将Hip1p、Hip1pK30R、Hip1pK42R、Hip1pK52R、Hip1pK30,42R、Hip1pK30,52R、Hip1pK42,52R和Hip1pK30,42,52R连接到pUbDtect16质粒。
 |
| 图 1. Hip1p泛素化位点预测及突变 Figure 1. Prediction of ubiquitination sites of Hip1p and mutagenesis. A: prediction of high confidence ubiquitination sites of Hip1p. B: types of seven Hip1p mutants. |
| 图选项 |
2.2 Hip1p突变菌株的遗传稳定性检测 为了验证Hip1p质粒的遗传稳定性,将酵母菌株在营养丰富的YPD培养基中培养48 h,由表 2可知,在YNB-Leu-Ura固体培养基上,所有菌株平均遗传稳定性均大于为99.7%,说明这些突变菌株在YPD中培养48 h,其遗传稳定性良好。
表 2. Hip1p突变株的遗传稳定性 Table 2. Genetic stability of Hip1p mutants
| Strains | Average genetic stability/% |
| pUbDtect16 | 100.0 |
| Hip1p | 100.0 |
| Hip1pK30R | 100.0 |
| Hip1pK42R | 99.7 |
| Hip1pK52R | 100.0 |
| Hip1pK30,42R | 100.0 |
| Hip1pK30,52R | 99.7 |
| Hip1pK42,52R | 100.0 |
| Hip1pK30,42,52R | 99.7 |
表选项
2.3 Hip1p蛋白泛素化位点定点突变对其泛素化水平的影响 将Hip1p野生型及其突变菌株在YNB基础培养基中培养至对数生长期,添加终浓度为0.25%酪蛋白水解物后继续培养90 min诱导蛋白的泛素化。相对于Hip1p蛋白,将Hip1p的第30、42及52位泛素化位点的赖氨酸突变为精氨酸后,Hip1p的泛素化水平受到明显的下调影响(图 2)。单个泛素化位点突变的突变体Hip1pK30R、Hip1pK42R及Hip1pK52R泛素化检测荧光强度分别下降4.2%、7.9%和7.4%。2个泛素化位点突变的突变体Hip1pK30,42R、Hip1pK30,52R及Hip1pK42,52R泛素化检测荧光强度分别下降22.2%、18.1%和28.9%。三重泛素化位点突变的突变体Hip1pK30,42,52R的泛素化检测荧光强度下降了27.2%。以上结果表明3个赖氨酸位点对Hip1p的泛素化水平有明显的影响,且具有明显的协同作用。
 |
| 图 2. 转运蛋白Hip1p突变体荧光强度的变化 Figure 2. The change of relative fluorescence of Hip1p mutants |
| 图选项 |
2.4 Hip1p泛素化位点突变对组氨基酸利用的影响 Hip1p泛素化位点突变对其泛素化水平有明显的改变。为了进一步验证Hip1p泛素化水平改变对酿酒酵母利用组氨酸过程的影响,我们将转化Hip1p质粒的酵母菌株在YNB基本培养基(不添加硫酸铵)中添加终浓度为5 mmol/L组氨酸培养基中培养48 h,检测Hip1p泛素化位点突变对细胞生长及组氨酸利用情况。由图 3可知,过量表达Hip1p能有效提升酵母在组氨酸为唯一氮源条件下的生长。相对于野生型的Hip1p蛋白,过量表达泛素化位点突变的Hip1p蛋白能有效提升酵母细胞生长和对组氨酸的利用。过量表达Hip1pK42,52R提升了酵母11%的组氨酸利用。相对于单个泛素化位点突变,2个泛素化位点的突变能有效提升酵母对组氨酸的利用,但是Hip1p的三重位点突变并未对组氨酸利用有明显的提升效果。
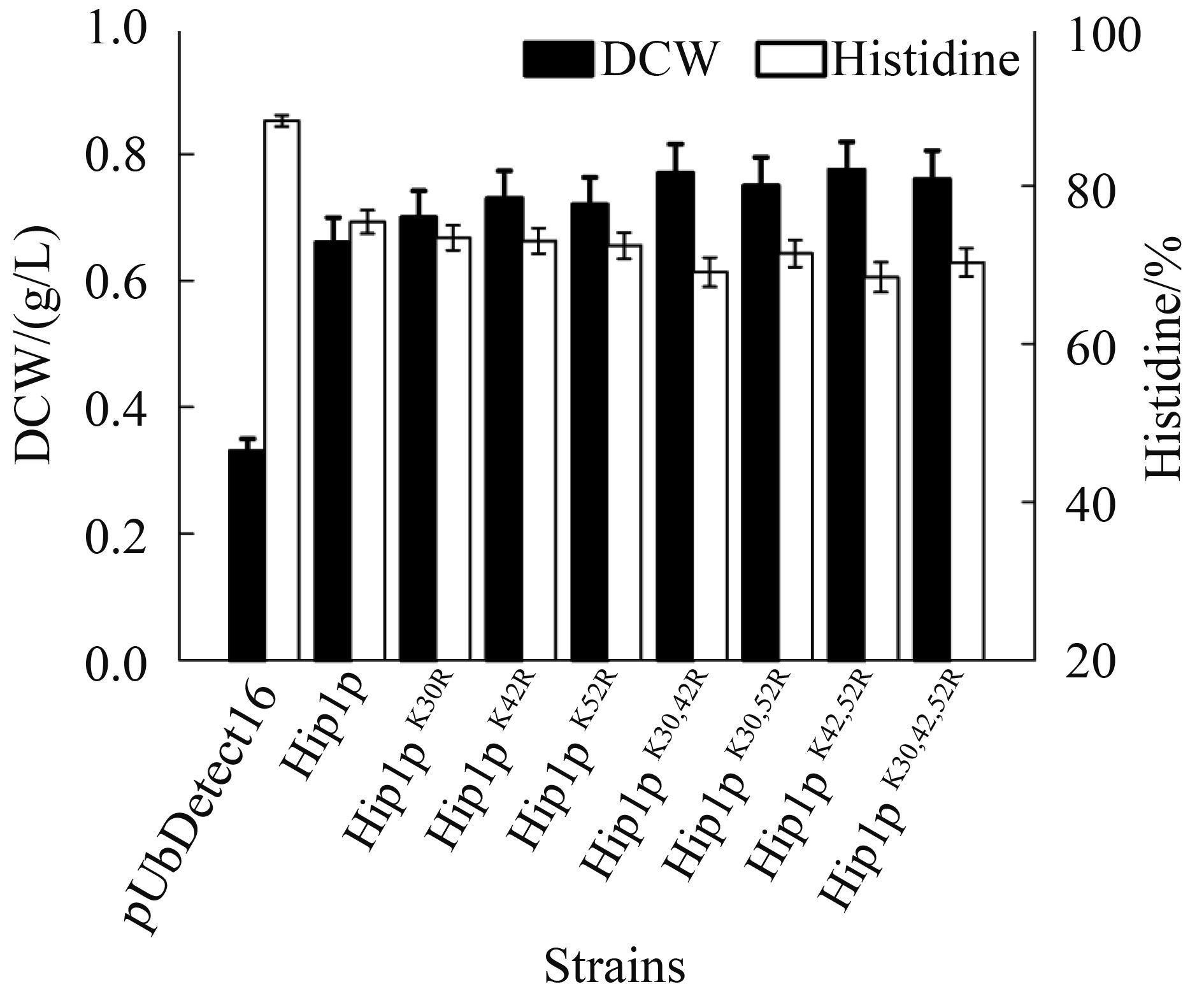 |
| 图 3. 转运蛋白Hip1p对组氨酸利用的影响 Figure 3. The influence of Hip1p mutants on histidine utilization |
| 图选项 |
3 讨论 酿酒酵母转运蛋白对细胞的营养物质摄取及细胞生长发育有着重要的影响。本文通过对组氨酸转运蛋白Hip1p的泛素化进行研究,探讨泛素化水平改变对酿酒酵母组氨酸利用的影响。通过对Hip1p的泛素化位点预测和定点突变等手段,在酿酒酵母CEN.PK2-1D-Δubi4中构建重组的Hip1p泛素化检测体系。结果表明,泛素化位点预测与改造能有效改变组氨酸转运蛋白的泛素化水平,并影响酵母细胞在组氨酸为单一氮源条件下的生长和对组氨酸的利用。泛素化修饰作为细胞内翻译后修饰的重要调控手段,在细胞代谢、营养物质转运及蛋白合成降解调控中发挥重要的作用[16]。大量的氨基酸转运蛋白存在泛素化修饰现象,而这些泛素化调控过程和转运蛋白潜在的泛素化位点密切相关[12]。目前常用的蛋白泛素化位点的鉴别方法,主要是利用泛素化抗体或泛素化结合蛋白,再采用质谱技术和定点突变技术鉴别和验证蛋白的泛素化位点[17]。
研究表明,通用氮源转运蛋白Gap1p存在2个泛素化位点K9和K16在调控Gap1p的泛素化过程中发挥不同的功能[18]。基于荧光双分子互补技术的泛素化质粒检测系统能有效识别膜蛋白泛素化改变,并在Gap1p蛋白中得到验证[13]。吕永坤等对酵母氮代谢调控相关蛋白的泛素化调控过程进行了研究[12]。本文对特异性组氨酸转运蛋白Hip1p泛素化位点的调控研究发现,Hip1p泛素化位点存在一定的协同作用,且这些协同作用可能受到蛋白结构和泛素化位点细胞定位等因素的影响,导致三重突变并未比二重突变表现出明显的泛素化水平改变。泛素化水平降低能延长Hip1p在胞内的存留时间,增强其对组氨酸的转运,从而促进组氨酸代谢过程。对组氨酸特异性转运蛋白Hip1p的泛素化研究,为研究泛素化调控与氮源利用水平提供了直接的证据。这一结果也表明,泛素化位点对Hip1p的泛素化水平调控是一种简单并且效果显著的调控手段。泛素化水平调控研究对于理解真核生物细胞代谢调节过程及关键酶与转运蛋白的代谢工程研究具有重要的指导意义。
参考文献
| [1] | Zaman S, Lippman SI, Zhao X, Broach JR. How Saccharomyces responds to nutrients.Annual Review of Genetics, 2008, 42(1): 27–81DOI:10.1146/annurev.genet.41.110306.130206. |
| [2] | Ljungdahl PO, Daignan-Fornier B. Regulation of amino acid, nucleotide, and phosphate metabolism in Saccharomyces cerevisiae.Genetics, 2012, 190(3): 885–929DOI:10.1534/genetics.111.133306. |
| [3] | Godard P, Urrestarazu A, Vissers S, Kontos K, Bontempi G, van Helden J, André B. Effect of 21 different nitrogen sources on global gene expression in the yeast Saccharomyces cerevisiae.Molecular and Cellular Biology, 2007, 27(8): 3065–3086DOI:10.1128/MCB.01084-06. |
| [4] | Shin CS, Kim SY, Huh WK. TORC1 controls degradation of the transcription factor Stp1, a key effector of the SPS amino-acid-sensing pathway in Saccharomyces cerevisiae.Journal of Cell Science, 2009, 122(12): 2089–2099DOI:10.1242/jcs.047191. |
| [5] | MacGurn JA, Hsu PC, Smolka MB, Emr SD. TORC1 regulates endocytosis via Npr1-mediated phosphoinhibition of a ubiquitin ligase adaptor.Cell, 2011, 147(5): 1104–1117DOI:10.1016/j.cell.2011.09.054. |
| [6] | Lin CH, MacGurn JA, Chu T, Stefan CJ, Emr SD. Arrestin-related ubiquitin-ligase adaptors regulate endocytosis and protein turnover at the cell surface.Cell, 2008, 135(4): 714–725DOI:10.1016/j.cell.2008.09.025. |
| [7] | Polo S, Di Fiore PP. Finding the right partner: science or ART?.Cell, 2008, 135(4): 590–592DOI:10.1016/j.cell.2008.10.032. |
| [8] | Boeckstaens M, Llinares E, van Vooren P, Marini AM. The TORC1 effector kinase Npr1 fine tunes the inherent activity of the Mep2 ammonium transport protein.Nature Communications, 2014, 5: 3101. |
| [9] | Farcasanu IC, Mizunuma M, Hirata D, Miyakawa T. Involvement of histidine permease (Hip1p) in manganese transport in Saccharomyces cerevisiae.Molecular and General Genetics, 1998, 259(5): 541–548DOI:10.1007/s004380050846. |
| [10] | Menant A, Barbey R, Thomas D. Substrate-mediated remodeling of methionine transport by multiple ubiquitin-dependent mechanisms in yeast cells.The EMBO Journal, 2006, 25(19): 4436–4447DOI:10.1038/sj.emboj.7601330. |
| [11] | Ljungdahl PO. Amino-acid-induced signalling via the SPS-sensing pathway in yeast.Biochemical Society Transactions, 2009, 37(1): 242–247DOI:10.1042/BST0370242. |
| [12] | Lv YK, Zhou JW, Liu L. Ubiquitination detection of NCR related permeases and regulators.Journal of Food Science and Biotechnology, 2014, 33(6): 576–582(in Chinese).吕永坤, 周景文, 刘龙. 氮代谢调控相关蛋白质泛素化修饰筛选.食品与生物技术学报, 2014, 33(6): 576–582. |
| [13] | Lv YK, Zhao XR, Liu L, Du GC, Zhou JW, Chen J. A simple procedure for protein ubiquitination detection in Saccharomyces cerevisiae: Gap1p as an example.Journal of Microbiology Methods, 2013, 94(1): 25–29DOI:10.1016/j.mimet.2013.04.004. |
| [14] | Radivojac P, Vacic V, Haynes C, Cocklin RR, Mohan A, Heyen JW, Goebl MG, Iakoucheva LM. Identification, analysis, and prediction of protein ubiquitination sites.Proteins: Structure Function and Bioinformatics, 2010, 78(2): 365–380DOI:10.1002/prot.v78:2. |
| [15] | Zhao XR, Zou HJ, Fu JW, Zhou JW, Du GC, Chen J. Metabolic engineering of the regulators in nitrogen catabolite repression to reduce the production of ethyl carbamate in a model rice wine system.Applied and Environmental Microbiology, 2014, 80(1): 392–398DOI:10.1128/AEM.03055-13. |
| [16] | Kirkpatrick DS, Hathaway NA, Hanna J, Elsasser S, Rush J, Finley D, King RW, Gygi SP. Quantitative analysis of in vitro ubiquitinated cyclin B1 reveals complex chain topology.Nature Cell Biology, 2006, 8(7): 700–710DOI:10.1038/ncb1436. |
| [17] | Kim W, Bennett EJ, Huttlin EL, Guo AL, Li J, Possemato A, Sowa ME, Rad R, Rush J, Comb MJ, Harper JW, Gygi SP. Systematic and quantitative assessment of the ubiquitin-modified proteome.Molecular Cell, 2011, 44(2): 325–340DOI:10.1016/j.molcel.2011.08.025. |
| [18] | Risinger AL, Kaiser CA. Different ubiquitin signals act at the Golgi and plasma membrane to direct GAP1 trafficking.Molecular Biology of the Cell, 2008, 19(7): 2962–2972DOI:10.1091/mbc.E07-06-0627. |
