 , 廖晓勇1,2
, 廖晓勇1,2
 , 赵一澍1,2, 王亮2, 龚雪刚2, 张玉秀3, 马旭2,3
, 赵一澍1,2, 王亮2, 龚雪刚2, 张玉秀3, 马旭2,31. 南昌大学资源环境与化工学院, 南昌 330031;
2. 中国科学院地理科学与资源研究所, 北京 100101;
3. 中国矿业大学(北京), 化学与环境工程学院, 北京 100083
收稿日期: 2021-01-03; 修回日期: 2021-02-24; 录用日期: 2021-02-24
基金项目: 国家重点研发计划(No.2017YFD0800900);国家科技基础性工作专项(No.2015FY111300)
作者简介: 杨宝林(1995—), 男, E-mail: tunanyang@163.com
通讯作者(责任作者): 廖晓勇, E-mail: liaoxy@igsnrr.ac.cn
廖晓勇, 研究员, 博士生导师, 主要从事城市工业场地和污染农田土壤的风险评估, 修复技术和装备研发, 是我国较早从事污染土壤修复技术研究和工程示范的****之一.在国内外环境领域重要学术刊物发表学术期刊论文120余篇, 其中SCI收录论文46篇(第一作者或通讯作者28篇), 英译著3篇; 申请国家发明专利26项, 其中16项已经授权; 授予软件著作权2项.主持或参与40余项污染场地修复领域的重要课题, 现主持国家重点研发计划, 中科院重点部署项目, 北京市科技计划重大项目和国家自然科学基金项目等课题
摘要:蜈蚣草能够超累积土壤中的砷,对土壤环境中的多环芳烃也具有较好的耐受能力,是修复砷和多环芳烃复合污染的理想修复手段之一.为探究在苯并(a)芘和砷(As)单独污染和复合污染条件下的蜈蚣草对两种污染物的吸收转运,通过水培模拟实验揭示蜈蚣草体内砷与苯并(a)芘的交互作用,同时采用双光子激光共聚焦扫描显微技术检测观察苯并(a)芘在蜈蚣草中的赋存和分布.结果表明,添加苯并(a)芘使得蜈蚣草各部分总砷含量均下降.其中,叶、茎、根分别下降149.4、78.59、47.05 mg·kg-1(以DW计)(p < 0.05),叶部下降幅度最大,达到47.3%,根部及茎部含量分别下降了40.9%和38.2%(p < 0.05).同时苯并(a)芘的添加也改变了砷在蜈蚣草体内的赋存形态,根部与叶部三价砷的比例分别下降了3.87%、4.20%(p < 0.05),而茎部两种砷形态比例无显著变化.砷的添加促进了蜈蚣草各部分对苯并(a)芘的积累,每株根部、茎部和叶部的累积量分别增加了4680、109.26和226.61 ng(p < 0.05),说明苯并(a)芘和砷在蜈蚣草植株中交互作用显著,砷的添加不会改变苯并(a)芘的赋存位点,但会增强蜈蚣草对于苯并(a)芘吸收,而苯并(a)芘的添加则会抑制砷的吸收,苯并(a)芘首先由蜈蚣草根部表皮细胞吸收,通过茎部的U型维管束及茎部外缘细胞转运到叶部,赋存于叶部的表皮细胞、叶脉组织及气孔细胞当中.
关键词:苯并(a)芘砷复合污染蜈蚣草相互作用
Occurrence and transportation characteristics of benzo(a)pyrene and arsenate and their interaction in Pteris vittata L.
YANG Baolin1,2
 , LIAO Xiaoyong1,2
, LIAO Xiaoyong1,2
 , ZHAO Yishu1,2, WANG Liang2, GONG Xuegang2, ZHANG Yuxiu3, MA Xu2,3
, ZHAO Yishu1,2, WANG Liang2, GONG Xuegang2, ZHANG Yuxiu3, MA Xu2,31. School of Environmental and Chemical Engineering, Nanchang University, Nanchang 330031;
2. Institute of Geographic Sciences and Natural Resources Research, Beijing 100101;
3. Department of Environmental and Biological Engineering, China University of Mining and Technology(Beijing), Beijing 100083
Received 3 January 2021; received in revised from 24 February 2021; accepted 24 February 2021
Abstract: Pteris vittata L. can accumulate arsenic in soil and also have good tolerance to PAHs in soil. It is one of the ideal remediation methods for arsenic and PAHS combined pollution. To explore the mechanism of Pteris vittata L. absorb two pollutants and transport under the condition of the benzo (a) pyrene and arsenic (As) pollution alone and composite pollution, and also to reveals the interaction between arsenic and benzene(a) pyrene in the body of the Pteris vittata L. by hydroponic simulation, using two-photon laser scanning confocal microscopy to observe the benzo (a) pyrene in the occurrence and distribution of the centipede grass. The results showed that the addition of benzo (a) pyrene reduced the total arsenic content in all parts of Pteris vittata L.. Among all parts of Pteris vittata L., leaf, stem and root decrease 149.4、78.59、47.05 mg·kg-1 respectively, the leaf decreased the most, reaching 47.3%, and the root and stem content decreased by 40.9% and 38.2% respectively. At the same time, the addition of benzoyl (a) pyrene also changed the occurrence form of arsenic in Pteris vittata L.. The proportion of trivalent arsenic between root and leaf decreased by 3.87% and 4.20% respectively, while the proportion about two forms of arsenic in stem doesn't change significantly. The addition of arsenic can promote the accumulation of benzoyl (a) pyrene in each part of Pteris vittata L.. The accumulation of root, stem and leaf increased by 4680 ng, 109.26 ng and 226.61 ng per plant, respectively. The results showed that the significant interaction between benzo (a) pyrene and arsenic in Pteris vittata L., the addition of arsenic will not change the occurrence site of benzo (a) pyrene, but it will enhance the absorption of Benzo (a) pyrene by Pteris vittata L., on the contrary, the addition of Benzo (a) pyrene will inhibit the absorption of arsenic, the benzo (a) pyrene was first absorbed by the epidermal cells of the root part of scolopendrium, and transported to the leaf through the U shaped vascular bundle and the outer cells of the stem, and occurred in the epidermal cells, vein tissues and stomatal cells of the leaf part.
Keywords: Benzo (a) pyrenearseniccombined pollutionPteris vittata L.interaction
1 引言(Introduction)砷(As)和多环芳烃(PAHs)被列为我国优先控制污染物, 这两种高毒性物质均具有致癌性、致畸性、致突变性, 常共于焦化厂、采矿区、冶炼厂等工业场地及城市居住区域, 严重危害了生态环境及人体健康(Kay et al., 2008; Bisone et al., 2013; Islam et al., 2019).砷与PAHs的共存可引起协同毒性反应, 反应后其毒性远高于单一污染(Li et al., 2010; Chigbo et al., 2013).苯并(α)芘(Benzo[a]pyrene, BaP)是PAHs中强致癌单体, 长期暴露于苯并(a)芘环境中会大幅度增加肺癌等疾病的患病概率(Petit et al., 2019).
此外, 砷也会增强苯并(a)芘代谢物对DNA的损伤作用, 显著增加了健康风险.Sun等(2014)对工业场地调查发现, 冶炼类和煤矿类场地砷和PAHs的复合污染情况严重, 土壤中砷和PAHs的含量分别可高达251 mg·kg-1及4329 μg·kg-1.砷和PAHs复合污染不仅对场地周边环境和居民产生危害, 还限制了场地本身的安全再利用, 因此对其进行污染治理具有重大意义.
植物修复是一种高效、环保且具有经济效益的砷污染土壤修复方法, 其对砷污染修复的可行性已得到充分证明(Yan et al., 2019).此外, 植物修复对PAHs污染也具有一定的治理效果(Kenday et al., 2019).土壤中的PAHs主要通过被动运输和主动运输被植物根系吸收, 进而在植物体内被转运、累积和代谢(Zhan et al., 2015; Houshani et al., 2019).蜈蚣草作为砷超累积植物(陈同斌等, 2010), 可处于砷含量较高的环境中(1500 mg·kg-1土壤)不被损伤且具有高量积累砷的能力(13800 mg·kg-1干重)(Lu et al., 2018).环境介质中的五价砷被蜈蚣草根部吸收后由维管束组织运输到地上部分, 在植物体内发生生物化学还原反应, 主要转化为三价砷赋存于植物叶片中(Liao et al., 2016).同时本课题组之前的研究证明蜈蚣草对砷和PAHs复合污染也具有较好的耐受能力, 其对砷和PAHs的最高耐受量分别可达1276 mg·kg-1和1.48 mg·kg-1 (Lu et al., 2014).因此, 蜈蚣草可作为砷和多环芳烃复合污染的理想修复手段之一.
多环芳烃与重金属共存可能引起复杂的相互作用, 从而增加土壤污染的复杂性, 影响植物修复过程(Ding et al., 2017; Nasreen et al., 2017).已有研究表明, 多环芳烃的存在会影响植物对重金属的吸收.Wang等(2012)指出芘和菲的添加降低了东南景天对镉的吸收和积累效率; Zhang等(2009)也表明在芘污染下, 玉米对镉的吸收作用受到了抑制.此外, 多环芳烃还被报道可以降低重金属的毒性作用, 从而促进植物对重金属的吸收和积累(Lu et al., 2014; Jeelani et al., 2017).另一方面, 重金属对植物吸收和修复多环芳烃也有显著影响.Liao等(2016)指出不同形态的砷对蜈蚣草吸收菲均有抑制作用; Chigbo等(2013)在铜-芘联合胁迫下也获得了类似的抑制作用.然而, 在某些情况下, 添加重金属可以促进植物对PAHs的吸收(Sun et al., 2011).重金属毒性对植物修复PAHs的影响以及PAHs对植物提取金属的影响效应仍尚未清晰.
目前针对植物修复砷和PAHs复合污染的研究较少, 特别是对高环PAHs复合污染的研究更是鲜有报道.本研究以高环PAHs苯并(a)芘和砷为目标污染物, 探究砷-苯并(a)芘复合污染物在蜈蚣草植株体内的吸收赋存规律及其相互作用的影响, 同时通过双光子激光共焦扫描显微镜(TPCLSM)观察苯并(a)芘在蜈蚣草组织细胞中的分布及贮存信号, 揭示其在植株内的转运规律, 进一步解释PAHs和砷在蜈蚣草中的生物化学行为和交互机制, 为植物修复砷与多环芳烃复合污染提供参考.
2 材料与方法(Materials and methods)2.1 实验方案本研究主要通过水培试验研究砷与苯并(a)芘在蜈蚣草中的交互作用, 首先将室外采集的蜈蚣草孢子均匀地撒在培养基质中(花卉土∶蛭石=1∶1), 添加适当水分, 且盖上薄膜保持湿润, 维持25 ℃的昼间温度, 20 ℃的夜间温度, 65%的湿度条件进行培育.当孢子发育到合适时机(有数片幼羽叶长出时), 分苗移栽到1/5强度霍格兰德营养液(pH=6.0)中进行培养, 5个月后, 选取健康且相似的蜈蚣草幼苗备用.
实验包括4个处理, 空白对照、苯并(a)芘、砷、苯并(a)芘加砷, 每个处理设置3个重复.用10 mg·L-1砷酸钠配置实验所需五价砷, 将苯并(a)芘溶解于丙酮中, 进一步添加到常用的100%强度的霍格兰德水培营养液中, 使营养液中苯并(a)芘浓度为2 mg·L-1.然后以3 d为一个周期更换一次营养液, 4个周期后将全部蜈蚣草收获.收获后清水洗净, 晾干, 将叶、茎、根各部分分开.另选取其中部分蜈蚣草于烘箱105 ℃杀青30 min, 然后于65 ℃烘干24 h, 用于测定总砷含量.再将剩余部分蜈蚣草冷冻干燥24 h, 将干物质称重, 冰浴条件下研磨, 磨碎后于-80 ℃冷藏保存, 用于砷形态和苯并(a)芘的测定.
2.2 砷的测定将烘干的蜈蚣草样品用HNO3-HClO4(US EPA 3050B 1996)消煮, 消煮后稀释、定容, 再用原子荧光光度计(AFS-9130)测定总砷含量, 用(GBW-07603)中规定标准物质进行质量控制.
将冷藏保存的蜈蚣草, 用体积比1∶1的甲醇水溶液超声提取3次, 每次30 min, 中间隔15 min振荡1次, 然后将提取液离心去除植物碎屑, 旋转蒸发去除提取液中甲醇, 最后稀释、定容, 应用双道原子荧光光度计(AFS-LC-9130)测定砷形态(Sun et al., 2011).
2.3 苯并(a)芘的测定将冷藏保存的蜈蚣草, 用体积比1∶1的丙酮和二氯甲烷混合溶液超声提取3次, 每次30 min, 依旧隔15 min振荡1次, 然后通过离心去除提取液中植物碎屑, 取上层清液旋转蒸发浓缩至0.5 mL, 转移到硅胶层析柱中净化, 并进一步用正己烷和二氯甲烷混合液淋洗, 然后旋转蒸发浓缩至约1 mL, 加7~8 mL正己烷, 再次旋蒸浓缩至约0.5 mL, 加适量内标物、定容至1 mL, 最后用气相色谱-质谱仪(GC-MS Agilent6890)测定苯并(a)芘含量(n=4, RSD < 10.5), 回收率为92%~98%.
2.4 双光子激光共焦扫描显微镜(TPCLSM)观测苯并(a)芘信号将准备好的蜈蚣草样品用蒸馏水洗净, 制作植物活体组织切片, 用中性树胶封片, 然后应用双光子激光共焦扫描显微镜(Carl Zeiss LSM 780)进行植物体组织细胞观测.其中物镜为W plan-Apochromat 20×/1.0 DIC(UV) VIS-IR M2775 mm, 并设置激发波、发射波、检测波波长分别为710、740、371~495 nm, 定义绿色为植物自身荧光信号, 红色为苯并(a)芘伪彩色信号.
2.5 数据与图像处理数据采用SPSS 21.0(SPSS Inc., Chicago)软件进行方差分析与显著性分析, 均值差的显著性水平为0.05;并用origin2018软件绘制相应图表.
根富集系数(RCF)、转运系数(TF)和蜈蚣草i部位污染物累积量(Q)计算公式分别见式(1)~(3)。
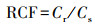 | (1) |
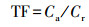 | (2) |
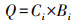 | (3) |
3 结果(Results)3.1 砷与苯并(a)芘作用下蜈蚣草各部位生物量变化表 1为添加苯并(a)芘和砷处理下, 蜈蚣草根部、茎部、叶部生物量统计汇总, 可以发现, 蜈蚣草各部位生物量大小排序为根部>叶部>茎部(p<0.05), 且在添加砷以及苯并(a)芘处理后也并没有改变这一生长状况;从4个不同处理来看, 添加砷和苯并(a)芘的处理并没有显著影响蜈蚣草叶部和茎部的生物量, 但是显著促进了根部的生长, 且无论是单独砷、单独苯并(a)芘亦或是复合处理, 均达到了相近的作用效果, 其中以单独砷和苯并(a)芘的处理中蜈蚣草根部生物量最大, 为2.51 g, 相比对照提高了6.36%, 这说明一定程度上砷和苯并(a)芘的添加可以促进蜈蚣草根系的生长.
表 1(Table 1)
| 表 1 蜈蚣草各部位生物量变化 Table 1 The change of biomass about different part of P. vitatta L. | ||||||||||||||||||||||||
表 1 蜈蚣草各部位生物量变化 Table 1 The change of biomass about different part of P. vitatta L.
| ||||||||||||||||||||||||
3.2 蜈蚣草中砷与苯并(a)芘的含量根据表 2统计数据可知, 单独砷处理下, 蜈蚣草对砷具有较高的吸收能力, 植株各部分砷含量呈叶部>茎部>根部.其中, 叶部砷含量高达315.2 mg·kg-1, 为茎部和根部砷含量的1.5~2.7倍.添加苯并(a)芘后, 蜈蚣草各部位总砷含量均有下降, 其中叶部总砷含量下降幅度最大, 达47.3%, 含量减少了149.4 mg·kg-1.茎部和根部次之, 总砷含量分别下降了78.6 mg·kg-1(38.0%)和47.1 mg·kg-1(41.0%).在单独苯并(a)芘处理下, 蜈蚣草各部对其吸能力大小为根部>茎部>叶部. 根部对苯并(a)芘的吸收量(以DW计)高达5895.3 μg·kg-1, 而叶部和茎部的苯并(a)芘含量远低于根部, 仅为根部的3.3%~5.9%.砷的添加显著促进蜈蚣草各部对苯丙(a) 芘的吸收, 与单独苯并(a)芘处理相比, 添加砷处理后, 蜈蚣草根部苯并(a)芘的含量增加了1882.8 μg·kg-1, 提高了31.9%, 同时茎部和叶部苯并(a)芘的含量也分别提高了113.4 μg·kg-1(32.3%)和111.3 μg·kg-1(57.9%).
表 2(Table 2)
| 表 2 蜈蚣草各部分总砷和苯并(a)芘的含量变化 Table 2 The change of concentrations about total arsenic and benzo(a)pyrene in different part of P. vitatta L. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2 蜈蚣草各部分总砷和苯并(a)芘的含量变化 Table 2 The change of concentrations about total arsenic and benzo(a)pyrene in different part of P. vitatta L.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.3 蜈蚣草中砷与苯并(a)芘累积量砷和苯并(a)芘的交互作用显著影响了蜈蚣草对两种复合污染物的累积量, 由图 1a可知, 蜈蚣草对砷的累积量呈现出叶部>根部>茎部的规律, 其与蜈蚣草各部砷含量的大小顺序略有差别, 这主要是由于生物量的不同造成的.其中, 蜈蚣草叶部对砷的累积量可达677.25 μg·株-1, 为茎部和根部砷累积量的2.3~3.2倍.苯并(a)芘对蜈蚣草各部累积砷的抑制作用较为明显.与单独砷处理相比, 苯并(a)芘的添加导致蜈蚣草植株叶部砷累积量下降了336.36 μg·株-1, 降幅达49.7%.茎部与根部砷累积量分别下降了85.46 μg·株-1(40.2%)、119.24 μg·株-1(41.2%).
蜈蚣草植株各部分对于苯并(a)芘的贮存能力不同, 由图 1b可知, 蜈蚣草中苯并(a)芘的积量呈现出根部>叶部>茎部的规律, 其中, 根部对苯并(a)芘累积量可达14.78 μg·株-1, 而叶部与茎部苯并(a)芘累积量分别为395.42 ng·株-1及355.19 ng·株-1 (DW), 仅为根部苯并(a)芘累积量的2.4%~2.7%.砷对蜈蚣草累积苯并(a)芘具有显著的促进作用.与单独苯并(a)芘处理相比, 添加砷处理后蜈蚣草各部分苯并(a)芘累积量均有不同程度升高.其中, 根部苯并(a)芘的累积量的增量最大, 为4.68 μg·株-1(31.6%), 叶部苯并(a)芘累积量增量次之, 为226.61 ng·株-1(57.3%), 茎部苯并(a)芘累积量也增加了10.26 ng·株-1(30.8%).
图 1(Fig. 1)
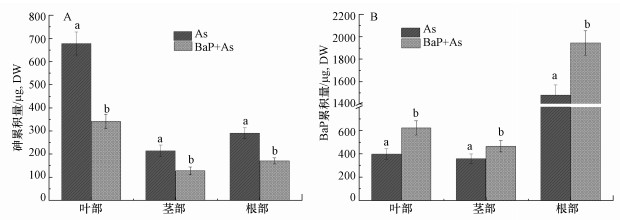 |
| 图 1 蜈蚣草各部分砷和苯并(a)芘累积量的交互影响 (不同字母表示同部位不同处理差异性显著, p<0.05) Fig. 1The effect of intereaction about accumulation between arsenic and benzo(a)pyrene in P. vitatta L. |
3.4 苯并(a)芘对蜈蚣草中砷的赋存形态的影响砷在蜈蚣草体内以三价砷和五价砷的形态赋存, 植株各部分三价砷和五价砷的含量与比例分布情况见图 2.结果表明, 无论在单一砷污染或在砷和苯并(a)芘复合污染的条件下, 蜈蚣草体内各部分三价砷的含量均高于五价砷的含量.其中, 单一砷处理条件下蜈蚣草叶部三价砷的含量最高(161.41 mg·kg-1), 显著高于叶部五价砷(102.72 mg·kg-1)含量, 是根部三价砷(52.57 mg·kg-1)的3.07倍.添加苯并(a)芘处理后, 蜈蚣草各部分中三价砷和五价砷含量均降低.其中, 根部三价砷的下降幅度最大(53%), 茎部五价砷的含量降幅最大(50.1%).此外, 苯并(a)芘的添加也导致蜈蚣草各部三价砷和五价砷所占的比例发生改变.茎部三价砷占比有轻微上升, 差异不显著, 而根部和叶部三价砷占比分别下降了3.87%和4.20%(P<0.05), 五价砷的占比相应升高, 推测苯并(a)芘的添加抑制了蜈蚣草根部和叶部中五价砷的还原反应.
图 2(Fig. 2)
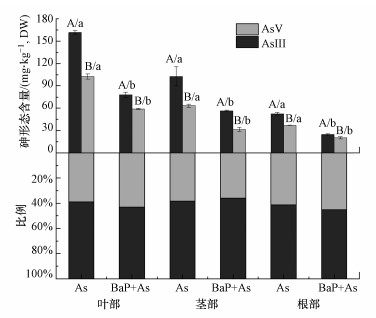 |
| 图 2 蜈蚣草中各部分苯并(a)芘对砷形态的影响 (大写字母为同部位同处理不同砷形态差异性比较, 小写字母为同部位同种砷形态不同处理差异性比较) Fig. 2Effects of benzo (a) pyrene on arsenic morphology in different part of P. vitatta L. |
3.5 苯并(a)芘信号在蜈蚣草组织中的分布采用双光子激光共聚焦显微镜在两种不同处理条件下(苯并(a)芘处理, 砷加苯并(a)芘处理)观察到的蜈蚣草内苯并(a)芘的赋存信号如图 3所示. 在单独苯并(a)芘处理的蜈蚣草根尖部位, 苯并(a)芘主要附着于根部的表皮细胞中, 其在表皮细胞中的含量较高.此外, 在根部内部细胞中也可观察到相对较弱的苯并(a)芘的赋存信号(图 3 A-根尖). 值得注意的是, 苯并(a)芘在根部的信号与茎部叶部相比为强烈, 这与苯并(a)芘在根部的赋存含量高的结果相吻合.在蜈蚣草茎部, 苯并(a)芘赋存于U型维管束的内皮层细胞、木质部细胞的细胞膜以及茎部外缘表皮细胞的细胞膜中(图 3 A-茎部横切面), 木质部细胞的细胞膜中苯并(a)芘赋存信号较强.在叶部, 苯并(a)芘主要赋存于上下表皮细胞、叶脉组织和气孔细胞当中(图 3 A-叶部横切面、图 3 A-叶部表皮), 叶脉及气孔细胞中的苯并(a)芘信号均强于上下表皮细胞. 对比图 3中A、B两种处理的苯并(a)芘的赋存信号可知, 砷的添加并不会影响苯并(a)芘在蜈蚣草植株各部分的赋存位置, 而只会影响苯并(a)芘在不同部位的信号强度或赋存含量.添加了砷处理后, 苯并(a)芘在蜈蚣草各部分的赋存信号与单独苯并(a)芘处理相比均明显增强.其中, 根部表皮细胞的苯并(a)芘赋存信号变化尤为明显(图 3B-根尖).
图 3(Fig. 3)
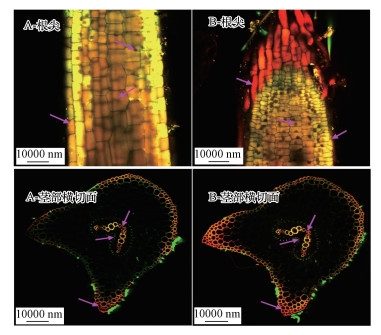 |
| 图 3 蜈蚣草根部、茎部横切面苯并(a)芘信号的微观分布 (A、B分别代表苯并(a)芘、苯并(a)芘与砷两种不同处理, 其中红色(部分深红似黑色)为苯并(a)芘荧光信号, 绿色为植物荧光信号, 紫色箭头指向苯并(a)芘信号赋存位置) Fig. 3The microscopic distribution of BaP signal in Pteris vittata of root and transverse section of stem |
图 4(Fig. 4)
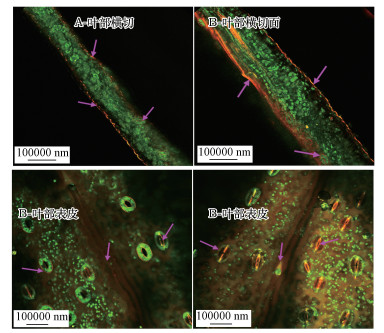 |
| 图 4 蜈蚣草叶部横切面和叶部表皮苯并(a)芘信号的微观分布 (A、B分别代表苯并(a)芘、苯并(a)芘与砷两种不同处理, 其中红色(部分深红似黑色)为苯并(a)芘荧光信号, 绿色为植物荧光信号, 紫色箭头指向苯并(a)芘信号赋存位置) Fig. 4The microscopic distribution of BaP signal in Pteris vittata of the epidermis of leaf |
4 讨论(Discussion)4.1 苯并(a)芘在蜈蚣草体内的吸收及转运规律应用双光子激光共聚焦显微镜技术观察蜈蚣草植株中苯并(a)芘的赋存情况, 推测蜈蚣草吸收和转运苯并(a)芘的途径: 苯并(a)芘首先由蜈蚣草根部表皮细胞吸收, 随后在蒸腾作用下向蜈蚣草地上部分进行转运.大部分的苯并(a)芘是通过茎部的U型维管束转运到蜈蚣草的叶部, 另一部分则通过茎部外缘细胞向叶部进行转运.转运到叶部中的苯并(a)芘最终通过叶脉网络运输到叶部表皮细胞、叶脉组织及气孔细胞中.这与芘和菲在蜈蚣草内的转运情况具有较强的一致性(张玉秀等, 2015; Liao et al., 2016).植物根系对PAHs的吸收包括两个步骤: 首先在外部环境和植物根部之间平衡PAHs含量, 然后将其吸附到亲脂性根固体中, 如细胞膜、细胞壁及细胞脂质体(Subashchandrabose et al., 2015).在植物中, PAHs的吸收和积累主要取决于生物利用度, 由PAHs的理化性质决定, 如亲脂性、辛醇水分配系数(logKow)等.苯并(a)芘具有低水溶性、高疏水性, 加之细胞膜磷脂双分子层结构内部的亲脂性高于外部, 导致苯并(a)芘易在膜结构的内部聚集, 苯并(a)芘的独特特性也增强了细胞膜对其的吸附能力(Haritash et al., 2009; Subashchandrabose et al., 2015).此外, 植物体对PAHs的吸收也与植物自身的结构功能息息相关.研究表明植物叶部可通过表面蜡质从沉积在叶上富含PAHs的固体颗粒物中吸收少量的PAHs(Gao et al., 2009).蜈蚣草的叶面具有粗糙、毛状等特征, 且具有较大的叶面暴露面积, 从而增强了其赋存和累积高分子量PAHs的能力(Lu et al., 2014).
蜈蚣草根部对苯并(a)芘的富集能力较强, 其根部富集系数(RCF苯并(a)芘)高达2.95.焦海华等(2019)指出油麦菜根部对苯并(a)芘的吸收量最高, 是其他15种PAHs吸收量的4.5~45.8倍. Sivaram等(2019)也得出玉米根系中苯并(a)芘的粘附量远高于芘.这主要是由于PAHs亲脂性的差异造成的, 研究表明, 亲脂性有机污染物特别是亲脂性高的化合物具有较高的根系吸收潜力(Tao et al., 2009).苯并(a)芘为高环PAHs, 具有高亲脂性, 易在根部细胞膜内聚集, 进而导致植株对其的根部吸收含量较高.然而, 蜈蚣草对苯并(a)芘的转运能力较差, 其转运系数(TF苯并(a)芘)仅为0.045.Simonich等(1995)指出部分PAHs到达根部表皮后很难进入内部的木质部, 从而减弱其从根部向茎叶部的运输能力, 这与我们观察到的苯并(a)芘主要附着于根部的表皮细胞中相一致.此外, 植物中PAHs向顶端转运主要依赖于蒸腾作用, 其转运能力主要取决于水溶性, 从根部到地上部分的蒸腾流浓度因子随logKow的增加而降低(Gao et al., 2009; Kang et al., 2010).苯并(a)芘水溶性极低, 较难随着水蒸气向植株叶部转运, 故蜈蚣草根部茎部及叶部的含量远低于根部.Houshani等(2019)也指出随着PAHs的亲脂性增加, 植株对PAHs的根部富集能力越强, 而PAHs从植株根部到叶部的转运能力下降.
4.2 砷与苯并(a)芘在蜈蚣草体内赋存及交互影响苯并(a)芘对蜈蚣草各部分吸收赋存砷具有显著的抑制作用.添加苯并(a)芘处理后, 植株体内各部分砷含量均明显下降, 且植株体内砷形态的赋存情况也发生了改变.推测苯并(a)芘对蜈蚣草吸收转运砷的抑制效应有以下3个原因: ①苯并(a)芘可以改变植物对砷的吸附或改变砷的溶解度.研究表明植物根系能够分泌出可与重金属络合从而增加其生物可利用性的有机化合物(Liao et al., 2016).而PAHs能够改变根系分泌有机化合物的组分和含量, 进而抑制植物对重金属的吸收转运(Almeida et al., 2008).②苯并(a)芘可能与细胞膜上的砷转运蛋白或与砷还原酶相结合, 影响砷的正常运输与转化.植物中的谷胱甘肽(GSH)和植物螯合肽(PC)等蛋白质物质对植物体内砷的还原和转运具有显著的影响(Sakai et al., 2010; Zhao et al., 2010; Sun et al., 2018).而PAHs会优先进入细胞的磷脂双层疏水区与包含GSH、PC类的蛋白质发生交互反应, 损害细胞膜的重要功能, 从而抑制砷的还原与转运(Qu et al., 2007), 本课题组之前的研究就提到过菲及其降解产物可通过与五价砷竞争GSH, 从而抑制蜈蚣草中五价砷的还原和转运(Sun et al., 2011).③苯并(a)芘可能与砷共同竞争由植株根部向地上部分转运的通道.植物根部中不同形态的砷均是通过木质部及韧皮部向植物顶部进行转运(Zhao et al., 2009; Carey et al., 2010).本研究中, 苯并(a)芘亦是主要通过U型维管束的内皮层细胞及木质部等进行向植株顶部转运, 与砷竞争了由根部向地上部分转运的通道, 故导致砷在蜈蚣草内转运能力降低, 植株地上部分砷含量减少.
砷能够显著促进蜈蚣草各部分对苯并(a)芘的吸收及累积.加砷处理后, 蜈蚣草各部苯并(a)芘含量均增加, 苯并(a)芘的根部富集系数(RCF)由2.95增加至3.89, 但其转运系数(TF)只提高0.003.砷的添加对苯并(a)芘由根部向地上部分转运能力的促进效果不明显, 但显著增强了植株根部对苯并(a)芘的富集能力.推测砷促进蜈蚣草吸收苯并(a)芘的原因有以下3点: ①砷的添加改变了蜈蚣草的根部结构, 从而影响其根部对苯并(a)芘的吸收及降解过程.研究表明, 砷的添加可增加蜈蚣草根部羧基碳的比例, 进而改变植株根部碳基团的化学结构(廖晓勇等, 2016).此外, Sun等(2011)也指出砷可能改变蜈蚣草根部的细胞通透性或根构型, 从而影响蜈蚣草根部对PAHs的吸附.②添加的As5+与BaP之间形成了阳离子-π键体系相互作用, 增加了苯并(a)芘的自由溶解浓度, 从而增加了蜈蚣草对苯并(a)芘的吸收.某些阳离子与芳香族有机化合物之间可形成非共价结合的阳离子-π键体系, 通过阳离子-π键相互作用可改促进PAHs被生物体吸收(Chen et al., 1997; Qu et al., 2007).Tao等(2015)指出添加的Cu2+与PAHs之间形成了阳离子-π键体系, 增加了PAHs的自由溶解浓度, 从而增大了蓝藻对其的吸收量, 且蓝藻对不同PAHs单体吸收增量的顺序为苯并(a)芘>芘>菲.③砷改变了蜈蚣草根系分泌的溶解性有机物(DOM)的性质, 从而影响其对苯并(a)芘的吸收量.研究表明植物分泌的DOM通常与PAHs等疏水性有机物有较高的结合力, 可增强PAHs的溶解性及扩散传质能力进而易于被生物体吸收(Philipp et al., 2007).此外, 这种促进作用会随着疏水性有机污染物(HOCs)的疏水性及DOM的芳香性的增加而增大(Johnson, 1996).Tao等(2015)研究证实Cu2+、Ag+的添加引起了DOM的芳香性增加, 促进了PAHs的溶解和转运, 且Cu2+、Ag+对植株摄取PAHs的促进作用超过其本身对植株的毒性作用, 从而增强了蓝藻对PAHs的摄取.
值得注意的是, 添加了砷处理后并没有改变苯并(a)芘在蜈蚣草体内的转运途径及赋存位点, 仅影响了苯并(a)芘在植株各部分内的赋存含量及信号强度(图 3), 这可能是由于PAHs和砷在植株内的的转运受不同转运体调控造成的(Liao et al., 2016).
5 结论(Conclusions)1) 蜈蚣草各部位生物量大小为根部>叶部>茎部, 而一定量的砷或苯并(a)芘可显著提升蜈蚣草根部生物量, 促进蜈蚣草根部生长, 但对茎部及叶部生物量无显著影响。
2) 砷的添加没有改变苯并(a)芘在蜈蚣草体内的转运途径及赋存位点, 但增强了蜈蚣草各部分对苯并(a)芘的吸收与累积, 加砷处理后苯并(a)芘在蜈蚣草各部的赋存信号增强.
3) 苯并(a)芘的添加会抑制蜈蚣草各部对砷的吸收及转运, 同时也会影响砷在蜈蚣草体内的赋存形态, 单一砷处理情况下, 蜈蚣草各部均为三价砷浓度高于五价砷, 加苯并(a)芘处理后, 植株各部不同形态砷含量均下降, 根部和叶部五价砷所占比例会升高, 茎部两种形态砷所占比例无显著变化.
4) 通过双光子激光共聚焦显微镜技术得出在蜈蚣草中苯并(a)芘的转运规律: 苯并(a)芘首先由蜈蚣草根部表皮细胞吸收, 由根部转运到地上部分; 大部分的苯并(a)芘是通过茎部的U型维管束运输到蜈蚣草的叶部, 另一部分由茎部外缘细胞向上转运; 在叶部苯并(a)芘通过叶脉网络转运到叶部的表皮细胞、叶脉组织及气孔细胞当中.
参考文献
| Almeida C M R, Mucha A P, Delgado M F C, et al. 2008. Can PAHs influence Cu accumulation by salt marsh plants?[J]. Marine Environmental Research, 66(3): 311-318. DOI:10.1016/j.marenvres.2008.04.005 |
| Bisone S, Mercier G, Blais J F, et al. 2013. Decontamination of metals and polycyclic aromatic hydrocarbons from slag-polluted soil[J]. Environmental Technology, 34(18): 2633-2648. DOI:10.1080/09593330.2013.781231 |
| Carey A M, Scheckel K G, Lombi E, et al. 2010. Grain unloading of arsenic species in rice[J]. Plant Physiology, 152(1): 309-319. |
| Chen G D, Ma S G, Cooks R G, et al. 1997. Electron affinities and C60 anion clusters of certain bowl-shaped polycyclic aromatic hydrocarbons[J]. Journal of Mass Spectrometry, 32(12): 1305-1309. DOI:10.1002/(SICI)1096-9888(199712)32:12<1305::AID-JMS590>3.0.CO;2-W |
| Chigbo C, Batty L, Bartlett R. 2013. Interactions of copper and pyrene on phytoremediation potential of Brassica juncea in copper-pyrene co-contaminated soil[J]. Chemosphere, 90(10): 2542-2548. DOI:10.1016/j.chemosphere.2012.11.007 |
| 陈同斌, 李海翔, 雷梅, 等. 2010. 植物修复过程中蜈蚣草对土壤养分的吸收动态: 5年田间定位试验[J]. 环境科学学报, 30(2): 402-408. |
| Ding Y, Huang H F, Zhang Y, et al. 2017. Polycyclic aromatic hydrocarbons in agricultural soils from Northwest Fujian, Southeast China: Spatial distribution, source apportionment, and toxicity evaluation[J]. Journal of Geochemical Exploration, 195: 121-129. |
| Gao Y Z, Zeng Y C, Qing S, et al. 2009. Fractionation of polycyclic aromatic hydrocarbon residues in soils[J]. Journal of Hazardous Materials, 172(2): 897-903. |
| Haritash A K, Kaushik C P. 2009. Biodegradation aspects of Polycyclic Aromatic Hydrocarbons (PAHs): A review[J]. Journal of Hazardous Materials, 169(1): 1-15. |
| Houshani M, Saalehi Lisar S Y, Movafeghi A, et al. 2019. Growth and antioxidant system responses of maize (Zea mays L.) seedling to different concentration of pyrene in a controlled environment[J]. Acta Agriculturae Slovenica, 113(1): 29-39. DOI:10.14720/aas.2019.113.1.03 |
| Islam M N, Jo Y T, Jeong Y J, et al. 2019. Remediation approach for organic compounds and arsenic co-contaminated soil using the pressurized hot water extraction process[J]. Environmental Technology, 40(1): 125-131. DOI:10.1080/09593330.2017.1380713 |
| Johnson W P, Logan B E. 1996. Enhanced transport of bacteria in porous media by sediment-phase and aqueous-phase natural organic matter[J]. Water Research, 30(4): 923-931. DOI:10.1016/0043-1354(95)00225-1 |
| Jeelani N, Yang W, Xu L Q, et al. 2017. Phytoremediation potential of Acorus calamus in soils co-contaminated with cadmium and polycyclic aromatic hydrocarbons[J]. Scientific Reports, 7(1): 8028. DOI:10.1038/s41598-017-07831-3 |
| 焦海华, 郭佳佳, 张婧旻, 等. 2019. 种植油麦菜评价多环芳烃污染土壤的农用风险[J]. 环境科学, 40(5): 2460-2470. |
| Kang F X, Chen D S, Gao Y Z, et al. 2010. Distribution of polycyclic aromatic hydrocarbons in subcellular root tissues of ryegrass (Lolium multiflorumLam.)[J]. Bmc Plant Biology, 10(1): 210. DOI:10.1186/1471-2229-10-210 |
| Kay R T, Arnold T L, Cannon W F, et al. 2008. Concentrations of polycyclic aromatic hydrocarbons and inorganic constituents in ambient surface soils, Chicago, Illinois: 2001-2002[J]. Soil and Sediment Contamination: An International Journal, 17(3): 221-236. DOI:10.1080/15320380802006939 |
| Li Q, Lauer F T, Liu K J, et al. 2010. Low-dose synergistic immunosuppression of T-dependent antibody responses by polycyclic aromatic hydrocarbons and arsenic in C57BL/6J murine spleen cells[J]. Toxicology and Applied Pharmacology, 245(3): 334-351. |
| Liao X Y, Ma X, Yan X L, et al. 2016. Transportation and localization of phenanthrene and its interaction with different species of arsenic in Pteris vittata L[J]. Chemosphere, 153: 307-314. DOI:10.1016/j.chemosphere.2016.03.071 |
| Lu M, Zhang Z Z, Wang J X, et al. 2014. Interaction of heavy metals and pyrene on their fates in soil and tall fescue (Festuca arundinacea)[J]. Environmental Science & Technology, 48(2): 1158-1165. |
| 廖晓勇, 龚雪刚, 阎秀兰, 等. 2016. 砷-菲对蜈蚣草根部不同碳基团的影响[J]. 环境科学, 37(12): 4841-4847. |
| Petit P, Ma?tre A, Persoons R, et al. 2019. Lung cancer risk assessment for workers exposed to polycyclic aromatic hydrocarbons in various industries[J]. Environment International, 124: 109-120. DOI:10.1016/j.envint.2018.12.058 |
| Philipp M, Margit F M, Peter C S, et al. 2007. Enhanced diffusion of polycyclic aromatic hydrocarbons in artificial and natural aqueous solutions[J]. Environmental Science & Technology, 41(17): 6148-6155. |
| Qu X L, Wang X R, Zhu D Q. 2007. The partitioning of PAHs to egg phospholipids facilitated by copper and proton binding via cation-pi interactions[J]. Environmental Science & Technology, 41(24): 8321-8327. |
| Sivaram A K, Logeshwaran P, Lockington R, et al. 2019. Phytoremediation efficacy assessment of polycyclic aromatic hydrocarbons contaminated soils using garden pea (Pisum sativum) and earthworms (Eisenia fetida)[J]. Chemosphere, 229: 227-235. DOI:10.1016/j.chemosphere.2019.05.005 |
| Simonich S L, SHites R A. 1995. Organic pollutant accumulation in vegetation[J]. Environmental Science & Technology, 29(12): 2905-2914. |
| Sun L, Zhu G H, Liao X Y. 2018. Enhanced arsenic uptake and polycyclic aromatic hydrocarbon (PAH)-dissipation using Pteris vittata L. and a PAH-degrading bacterium[J]. The Science of the Total Environment, 624: 683-690. DOI:10.1016/j.scitotenv.2017.12.169 |
| Sun L, Liao X Y, Yan X L, et al. 2014. Evaluation of heavy metal and polycyclic aromatic hydrocarbons accumulation in plants from typical industrial sites: potential candidate in phytoremediation for co-contamination[J]. Environmental Science and Pollution Research International, 21(21): 12494-12504. DOI:10.1007/s11356-014-3171-6 |
| Sakai Y, Watanabe T, Wasaki J, et al. 2010. Influence of arsenic stress on synthesis and localization of low-molecular-weight thiols in Pteris vittata[J]. Environmental Pollution, 158(12): 3663-3669. DOI:10.1016/j.envpol.2010.07.043 |
| Subashchandrabose S R, Megharaj M, Venkateswarlu K, et al. 2015. Interaction effects of polycyclic aromatic hydrocarbons and heavy metals on a soil microalga, Chlorococcum sp. MM11[J]. Environmental Science and Pollution Research, 22(12): 8876-8889. DOI:10.1007/s11356-013-1679-9 |
| Sun L, Yan X L, Liao X Y, et al. 2011. Interactions of arsenic and phenanthrene on their uptake and antioxidative response in Pteris vittata L[J]. Environmental Pollution, 159(12): 3398-3405. DOI:10.1016/j.envpol.2011.08.045 |
| Sun Y B, Zhou Q X, Xu Y M, et al. 2011. Phytoremediation for co-contaminated soils of benzo[a]pyrene (B[a]P) and heavy metals using ornamental plant Tagetes patula[J]. Journal of Hazardous Materials, 186(2/3): 2075-2082 |
| Tao Y Q, Xue B, Yang Z, et al. 2015. Effects of metals on the uptake of polycyclic aromatic hydrocarbons by the cyanobacterium Microcystis aeruginosa[J]. Chemosphere, 119: 719-726. DOI:10.1016/j.chemosphere.2014.08.013 |
| Tao Y Q, Zhang S Z, Zhu Y G, et al. 2009. Uptake and acropetal translocation of polycyclic aromatic hydrocarbons by wheat (Triticum aestivum L.) grown in field-contaminated soil[J]. Environmental Science & Technology, 43(10): 3556-3560. |
| Wang K, Zhu Z Q, Huang H G, et al. 2012. Interactive effects of Cd and PAHs on contaminants removal from co-contaminated soil planted with hyperaccumulator plant Sedum alfredii[J]. Journal of Soils and Sediments, 12(4): 556-564. DOI:10.1007/s11368-012-0471-7 |
| Yan H L, Gao Y W, Wu L L, et al. 2019. Potential use of the Pteris vittata arsenic hyperaccumulation-regulation network for phytoremediation[J]. Journal of Hazardous Materials, 368: 386-396. DOI:10.1016/j.jhazmat.2019.01.072 |
| Zhan X H, Yi X, Yue L, et al. 2015. Cytoplasmic pH-Stat during phenanthrene uptake by wheat roots: A mechanistic consideration[J]. Environmental Science & Technology, 49(10): 6037-6044. |
| Zhao F J, Ma J F, Meharg A A, et al. 2009. Arsenic uptake and metabolism in plants[J]. New Phytologist, 181(4): 777-794. DOI:10.1111/j.1469-8137.2008.02716.x |
| Zhao F J, McGrathAndrew S P, Meharg A. 2010. Arsenic as a food chain contaminant: Mechanisms of plant uptake and metabolism and mitigation strategies[J]. Annual Review of Plant Biology, 61: 535-559. DOI:10.1146/annurev-arplant-042809-112152 |
| 张玉秀, 马旭, 廖晓勇, 等. 2015. 蜈蚣草中芘与砷的赋存特征及其相互作用[J]. 环境科学, 36(12): 4623-4629. |
