 , 彭健伟2, 文怡心1, 林立斌2, 彭志华2, 黄璜1
, 彭健伟2, 文怡心1, 林立斌2, 彭志华2, 黄璜1

1. 中山大学环境科学与工程学院, 广东省环境污染控制与修复技术重点实验室, 广州 510006;
2. 佛山水业三水供水有限公司, 佛山 528100
收稿日期: 2020-08-07; 修回日期: 2020-11-10; 录用日期: 2020-11-10
基金项目: 广东省基础与应用基础研究基金(No.2020A1515011047);广州市科技计划项目(No.201904010125)
作者简介: 李忠禹(1997-), 男, E-mail: lizhy297@mail2.sysu.edu.cn
通讯作者(责任作者): 黄璜, E-mail: huang46@mail.sysu.edu.cn
摘要:消毒副产物生成潜能测试常用于表征水中消毒副产物的前体物含量.不同于三氯甲烷等含碳消毒副产物,二卤代乙腈(DHANs)与二卤代乙酰胺(DHAcAms)等含氮消毒副产物在氯消毒的余氯存在下易分解,并且在氯胺消毒过程中可由氯胺提供氮源生成,因此常用于含碳消毒副产物的生成潜能测试方法(如Krasner提出的测试法)可能无法有效揭示DHANs与DHAcAms的前体物水平.本研究以三氯甲烷和氯醛两种含碳消毒副产物为对比,考察DHANs与DHAcAms在饮用水氯消毒与氯胺消毒过程中不同投氯量与反应时间下的生成量,识别最大生成量对应的消毒条件,以便更好地评估水样中DHANs与DHAcAms的前体物浓度.同时,对消毒过程中生成的这些挥发性消毒副产物进行毒性评价.结果显示,两个水样氯消毒的DHANs与DHAcAms生成量分别为6.19~40.08、1.34~15.75 nmol·mg-1(mg-1以TOC计);氯胺消毒的DHANs与DHAcAms生成量分别为2.63~21.46、18.43~49.99 nmol·mg-1.Krasner测试法条件下的DHANs与DHAcAms生成量均最低.在投氯量为TOC+8×NH3-N、反应时间为24 h的氯消毒条件下,氯胺投加量20×TOC、反应时间为3 d的氯胺消毒条件下,两个水样具有最高水平的DHANs与DHAcAms生成量,并且消毒副产物毒性也高于Krasner法测试条件下的毒性水平.因此,氯消毒采用投氯量TOC+8×NH3-N、反应时间24 h,氯胺消毒采用投加量20×TOC、反应时间3 d的生成潜能测试条件可能更好地揭示水中DHANs和DHAcAms的前体物浓度水平.
关键词:生成潜能前体物卤乙腈卤乙酰胺氯消毒氯胺消毒
Formation potential and estimated toxicity of nitrogenous and carbonaceous disinfection byproducts in drinking water
LI Zhongyu1
 , PENG Jianwei2, WEN Yixin1, LIN Libin2, PENG Zhihua2, HUANG Huang1
, PENG Jianwei2, WEN Yixin1, LIN Libin2, PENG Zhihua2, HUANG Huang1

1. School of Environmental Science and Engineering, Guangdong Provincial Key Laboratory of Environmental Pollution Control and Remediation Technology, Sun Yat-Sen University, Guangzhou 510006;
2. Foshan Sanshui Water Supply Co. Ltd., Foshan 528100
Received 7 August 2020; received in revised from 10 November 2020; accepted 10 November 2020
Abstract: The disinfection by-product (DBP) formation potential test is commonly used to evaluate the precursor concentrations of disinfection by-products in drinking water. Different from carbonaceous DBPs such as trichloromethane, nitrogenous DBPs such as dihaloacetonitriles (DHANs) and dihaloacetamides (DHAcAms) decompose rapidly in the presence of residual chlorine during chlorination, and can be produced using nitrogen in chloramines during chloramination. Therefore, the commonly used potential test methods for carbonaceous DBPs (such as the test method proposed by Krasner) may not effectively assess the precursor concentrations of DHANs and DHAcAms. This study investigated the concentrations and toxicities of the volatile DBPs, including DHANs, DHAcAms, trichloromethane and chloral hydrate, formed during chlorination and chloramination of drinking water at different disinfectant doses and contact times, and identified the disinfection conditions at which the maximum DHAN and DHAcAm yields were obtained. The identified conditions therefore could be used to assess the precursor concentrations of DHANs and DHAcAms. The yields of DHANs and DHAcAms were 6.19~40.08 and 1.34~15.75 nmol·mg-1 TOC, respectively, during chlorination of two water samples and were 2.63~21.46 and 18.43~49.99 nmol·mg-1TOC, respectively, during chloramiantion. The yields of DHANs and DHAcAms were the lowest under the conditions of the formation potential test method proposed by Krasner. The yields of DHANs and DHAcAms were highest at chlorine dose of TOC+8×NH3-N after 24 h of reaction time during chlorination, and at monochloramine dose of 20×TOC after 3 d of reaction time during chloramination. The estimated toxicity of the DBPs formed under these two conditions were higher than that under the conditions of Krasner test method. Therefore, using the chlorination with a dose of TOC+8×NH3-N and a reaction time of 24 h, and the chloramination condition of a dose of 20×TOC and a reaction time of 3 d might preferably reveal the precursor concentrations of DHANs and DHAcAms in drinking water.
Keywords: formation potentialprecursorhaloacetonitrileshaloacetamideschlorinationchloramination
1 引言(Introduction)消毒能有效保障饮用水的生物安全性, 但常用的氯与氯胺消毒剂会与水中有机物生成具有三致作用的消毒副产物(DBPs).三氯甲烷(TCM)、氯醛(CH)等含碳消毒副产物已被列入许多国家与地区的饮用水水质标准或规范中.近年来, 卤乙腈、卤乙酰胺等含氮消毒副产物由于具有更高的毒性开始受到广泛关注.其中, 二卤代的副产物二卤乙腈(DHANs)与二卤乙酰胺(DHAcAms)在饮用水中被普遍检出(Huang et al., 2012; 2016;2017).
在消毒过程中, 与氯或氯胺反应生成DBPs的有机物称为前体物.去除前体物是控制DBPs的重要手段.因此, 准确测量有机前体物浓度对于评估和改进消毒方式及控制DBPs的生成非常重要(Do et al., 2015).实验室中通常采用DBPs生成潜能(Formation potential, FP)测试来表征水中DBPs的前体物含量.TCM等含碳DBPs(C-DBPs)的FP测试通常通过控制一定的pH和温度, 在高消毒剂投加量与长时间接触的条件下使水中有机物与消毒剂完全反应生成DBPs, 使得DBPs生成量最大(Bougeard et al., 2010).Krasner等提出的FP测试方法近年来被广泛使用, 其氯消毒FP测试以Cl2 = 3 × TOC + 8 ×NH3-N +10(以质量浓度计量)为投氯量反应24 h, 氯胺消毒FP测试以Cl2= 3 × TOC(以质量浓度计量)为投氯量反应3 d(Krasner et al., 2007; Chu et al., 2010; Huang et al., 2012; 2016).但DHANs与DHAcAms易水解, 且游离氯促进其分解(Yu et al., 2015; 邵开利等, 2019).因此, 常用氯消毒FP测试的高余氯可能促进DHANs与DHAcAms的分解, 导致其生成浓度降低, 影响前体物浓度的准确评估.在氯胺消毒过程中, DHANs与DHAcAms等含氮DBPs(N-DBPs)可由氯胺供氮生成(Huang et al., 2012), 常用氯胺消毒FP测试的反应剂量可能不足以表征这部分前体物.
因此, 本研究主要针对DHANs与DHAcAms这两类高毒性N-DBPs, 以TCM与CH这两类常规氯代C-DBPs为比对, 考察其在饮用水氯消毒与氯胺消毒过程中不同投氯量与反应时间下生成量的变化规律, 识别最大生成量对应的消毒条件, 以便更好地评估水样中DHANs与DHAcAms的前体物浓度.同时对消毒过程中生成的DBPs毒性进行评价.
2 试验材料与方法(Materials and methods)2.1 水样实验所用水样取自广东省佛山市两个水厂的进水, 其水源地分别为北江和西江, 是佛山等珠三角城市众多水厂的重要水源, 具有代表性.取样当天无降水.水样经孔径为0.45 μm的水系滤膜过滤后4 ℃遮光贮藏, 用于消毒实验, 并在24 h内测定水质基本参数.
2.2 消毒条件以Krasner等(2007)提出的FP测试方法的条件为基础.鉴于游离氯促进DHANs、DHAcAms的分解, 通过减少氯投加量与接触时间考察减弱氯接触剂量是否在氯消毒过程中生成更高浓度的DHANs、DHAcAms.因此, 氯投量选取TOC+8×NH3-N(I)、2×TOC+8×NH3-N(II)、3×TOC+8×NH3-N(III)、3×TOC+8×NH3-N+5(IV)、3×TOC+8×NH3-N+10(V)(以质量浓度计量);接触时间选取4、6、10、24 h.鉴于氯胺可提供氮源生成DHANs、DHAcAms, 通过增加氯胺投量与接触时间考察增加氯胺接触剂量是否在氯胺消毒过程中生成更高浓度的DHANs、DHAcAms.因此, 氯胺投量选取3×TOC(i)、10×TOC(ii)、20×TOC(iii)(以质量浓度计量);接触时间选取3、5、7 d.每个消毒条件均设置两组平行样.
2.3 分析方法水样的TOC浓度测定采用TOC测定仪.NH4+-N、NO2--N、NO3--N利用氨氮浓度测定仪(HANNA HI96700)、亚硝酸盐氮浓度测定仪(HANNA HI96707)和硝酸盐氮浓度测定仪(HANNA HI96728).总有机氮(TON)通过电渗析法去除无机氮后测定总氮获得(Zhu et al., 2015), 溴离子浓度采用离子色谱仪.2种实际水样水质参数如表 1所示.
表 1(Table 1)
| 表 1 实验水样的基本水质参数 Table 1 Water qualities of the water samples | |||||||||||||||||||||||||||
表 1 实验水样的基本水质参数 Table 1 Water qualities of the water samples
| |||||||||||||||||||||||||||
TCM、CH和DHANs[包括二氯乙腈(DCAN)、溴氯乙腈(BCAN)和二溴乙腈(DBAN)]采用GC/ECD法测定, 采用DB-5色谱柱, 其测定程序:35 ℃保持9 min;以2 ℃·min-1的速度升至40 ℃, 保持1 min;以20 ℃·min-1的速度升至160 ℃, 保持5 min.检测器ECD温度为290 ℃, 吹扫平均流速为18.7 cm·s-1.DHAcAms[包括二氯乙酰胺(DCAcAm)、溴氯乙酰胺(BCAcAm)和二溴乙酰胺(DBAcAm)]也采用GC/ECD法测定, 采用DB-1701色谱柱, 其测定程序:35 ℃保持3 min;以20 ℃·min-1的速度升至220 ℃保持1.5 min.检测器ECD温度为290 ℃, 吹扫平均流速为18.7 cm·s-1.各DBP的检测限为0.04~0.22 μg·L-1 (Huang et al., 2017).
2.4 挥发性DBPs的毒性评价参考前人研究(Plewa et al., 2002; 2008; Muellner et al., 2007; Jeong et al., 2015; Chuang et al., 2017), 以消毒试验中生成的DBPs物质的量的浓度与各DBPs的半数致死浓度LC50(使中国仓鼠卵巢(CHO)细胞生长减少50%所需的DBPs浓度)的比值来评价每种DBP的细胞毒性, 并认为该比值可作加和, 以评估水样在不同消毒条件下生成的DBPs的毒性.DBPs的LC50值如表 2所示(Muellner et al., 2007; Plewa et al., 2008; 2009; Jeong et al., 2015).
表 2(Table 2)
| 表 2 DBPs的LC50值 Table 2 LC50 values of the DBPs ? | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2 DBPs的LC50值 Table 2 LC50 values of the DBPs ?
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3 结果与讨论(Results and discussion)3.1 氯消毒中DBPs的浓度变化在两个水样的氯消毒过程中, TCM、CH这两类C-DBPs与3种DHANs、3种DHAcAms这两类N-DBPs均被测出, 且DCAN、DCAcAm分别为主要的DHANs、DHAcAms种类.C-DBPs的生成量远高于N-DBPs的生成量.图 1中数据为两组平行样的均值, 水样A中TCM、CH、DHANs、DHAcAms的误差范围分别为4.31~32.26、0.15~10.07、0.22~2.14、0.01~3.94 nmol·mg-1(mg以TOC计, 全文同).水样B中TCM、CH、DHANs、DHAcAms的误差范围分别为0.68~12.52、0.15~8.68、0.04~1.71、0~0.48 nmol·mg-1.如图 1a、1b所示, 在Krasner测试法的氯消毒条件下(投氯量Ⅴ, 反应时间24 h), 两个水样的TCM的浓度分别为219.56、351.69 nmol·mg-1(26.21、41.98 μg·mg-1), CH的浓度分别为91.66、113.21 nmol·mg-1(13.51、16.69 μg·mg-1).随着投氯量或反应时间的减少, TCM和CH这两类C-DBPs的生成浓度基本逐渐下降.这表明对于TCM和CH这两类C-DBPs, Krasner法的高消毒剂接触剂量能够反映出较高的前体物浓度水平.
图 1(Fig. 1)
 |
| 图 1 氯消毒条件下两个水样的C-DBPs (a, b)和N-DBPs (c, d) 生成浓度随投氯量和反应时间的变化 Fig. 1The formation of C-DBPs (a, b) and N-DBPs (c, d) versus chlorine dose and reaction time during chlorination of two water samples |
图 1c、1d为两个水样DHANs和DHAcAms生成浓度随投氯量和反应时间的变化.在Krasner测试法的氯消毒条件下, DHANs的浓度分别为8.96、6.19 nmol·mg-1(1.22、0.74 μg·mg-1), DHAcAms的浓度分别为4.03、2.20 nmol·mg-1(0.55、0.30 μg·mg-1).减少投氯量或反应时间, 两个水样的DHANs和DHAcAms生成量升高, 其中每种二氯代、溴氯代、二溴代DBPs生成量均升高.在较低投氯量(I、II)的条件下, 随着反应时间的增加DHANs和DHAcAms的生成量逐渐增加, 而在较高投氯量(III~V)情况下, 生成量随着时间的增加先增加后降低或逐渐降低.两个水样的DHANs和DHAcAms生成量均在低投氯量(I, TOC+8×NH3-N), 长反应时间(24 h)条件下最高, 其中DHANs生成量分别达到40.08、36.95 nmol·mg-1(4.94、4.27 μg·mg-1), 分别是Krasner测试条件所得数据的4.47倍、5.97倍;DHAcAms浓度分别达到15.75、6.33 nmol·mg-1(2.20、0.85 μg·mg-1), 分别为Krasner测试条件所得数据的3.91倍、2.88倍.在该低投氯量、长反应时间条件下两水样中基本无余氯, 但Krasner法实验条件下存在大量余氯.余氯会促进DHANs和DHAcAms的分解, 且其分解速率随余氯量的增大而增大(Yu et al., 2015; Huang et al., 2016; 邵开利等, 2019).在Krasner法的高的氯消毒剂接触剂量条件下, 生成的DHANs和DHAcAms可能在余氯的存在下经过长时间的分解, 从而出现浓度的显著下降, 反而不能反映出水样中前体物的浓度水平.对于易分解的DHANs和DHAcAms类N-DBPs, 在FP测试中降低投氯量(TOC+8×NH3-N)可能可以更好地揭示水中其前体物浓度水平.
3.2 氯胺消毒中DBPs的浓度变化氯胺消毒过程中, 水样A的TCM、CH、3种DHANs和3种DHAcAms均被测出, 水样B除DBAcAm外其余上述DBPs均被测出, 且DHANs、DHAcAms中浓度最高的分别为DCAN、DCAcAm.同样条件下N-DBPs尤其是DHAcAms的生成量远高于C-DBPs的生成量.图 2中数据为两组平行样的均值, 水样A中TCM、CH、DHANs、DHAcAms的误差范围分别为0.27~1.89、0~1.05、0.11~0.81、0.46~10.18 nmol·mg-1.水样B中TCM、CH、DHANs、DHAcAms的误差范围分别为0.03~5.91、0~1.93、0.02~0.51、0~1.38 nmol·mg-1.如图 2a、2b所示, 在氯胺消毒的Krasner测试法条件下(投氯量i, 反应时间3 d), 两个水样的TCM的浓度分别为2.91、6.78 nmol·mg-1(0.35、0.81 μg·mg-1), CH的浓度分别为0.78、0.63 nmol·mg-1(0.11、0.09 μg·mg-1), 当增加氯胺的投加量, TCM和CH均具有更高的生成量.这表明增加氯胺投加量, 可使水样中的C-DBPs前体物与氯胺发生更充分的反应, 揭示出更高的生成潜能.
图 2(Fig. 2)
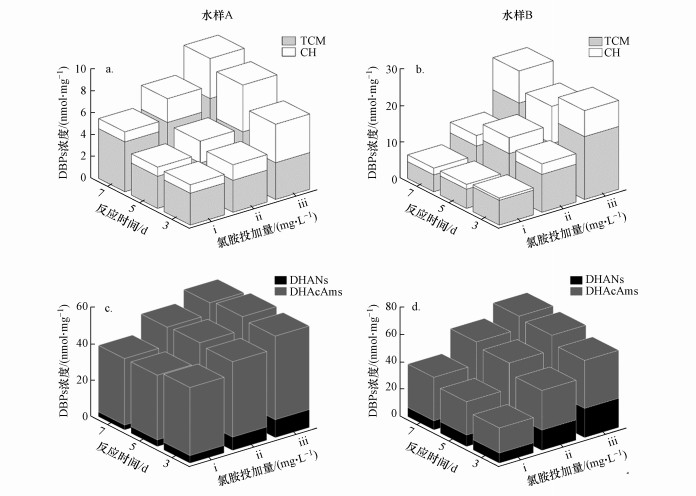 |
| 图 2 氯胺消毒条件下两个水样C-DBPs (a, b)和N-DBPs (c, d) 浓度随氯胺投加量和反应时间的变化 Fig. 2The formation of C-DBPs (a, b) and N-DBPs (c, d) versus monochloramine dose and reaction time during chloramination of two water samples |
图 2c、2d为两个水样氯胺消毒下DHANs和DHAcAms生成浓度随投氯量和反应时间的变化.在氯胺消毒的Krasner测试法条件下, 两个水样中DHANs的浓度分别为4.16、7.43 nmol·mg-1(0.51、0.85 μg·mg-1), DHAcAms的浓度分别为37.50、18.43 nmol·mg-1(5.00、2.40 μg·mg-1).随着接触时间的增加, DHANs(主要是DCAN)的生成量出现下降, 而DHAcAms生成量升高.这可能与DHANs、DHAcAms的水解有关, 且DHANs水解会生成相应的DHAcAms(Huang et al., 2019), 从而出现DHANs浓度下降、DHAcAms浓度升高.这表明在氯胺消毒过程中, 前体物与氯胺在3 d内可能已经完成了大部分的DHANs与DHAcAms生成反应.随着氯胺投加量的增加, 两个水样的DHANs和DHAcAms生成量逐渐增加.这可能由于随着氯胺投加量的增加, 不仅水中含氮前体物充分反应, 非含氮前体物也由氯胺贡献氮源生成N-DBPs(Huang et al., 2012), 因此生成更多的N-DBPs.此外, 氯胺不同于游离氯, 不会明显促进DHANs和DHAcAms的分解, 这两类N-DBPs在氯胺存在条件下的分解速率较慢(Yu et al., 2015;邵开利等, 2019), 因此高氯胺投加量下这两类N-DBPs的浓度仍保持在高水平.在高投氯量(iii, 20×TOC)、3 d反应时间条件下, 两个水样的DHANs生成量分别为9.86、21.46 nmol·mg-1(1.26、2.40 μg·mg-1), DHAcAms的浓度分别为46.04、35.20 nmol·mg-1(6.04、4.57 μg·mg-1), 与Krasner测试条件所得数据相比均有较为明显的增加.因此, 对于氯胺消毒的FP测试, 增大投氯量(20×TOC)可能揭示出水中更多的DHANs与DHAcAms前体物.
3.3 挥发性DBPs的毒性评价将两个水样氯消毒与氯胺消毒生成的以上挥发性DBPs进行毒性评价, 结果如图 3所示.在氯消毒过程中, 两个水样生成的DBPs毒性随投氯量、接触时间的变化规律与N-DBPs的生成量变化规律一致.这主要是由于DHANs贡献了主要的毒性.因此, N-DBPs生成量最大的氯消毒条件, 即低投氯量(I, TOC+8×NH3-N)、反应24 h的条件, 也揭示出两个水样生成的DBPs的最高毒性水平, 分别为Krasner测试法条件下生成DBPs毒性的2.38、3.12倍.在氯胺消毒过程中, 生成的DBPs毒性随着氯胺投量的增加而增加, DHANs和DHAcAms是主要的毒性来源, CH和TCM的毒性与之相比少了接近3个数量级, 几乎可忽略不计.高氯胺投加量(iii, 20×TOC)、3 d反应时间下, 两个水样生成的DBPs毒性分别为1.34×10-3、9.64×10-4, 高于Krasner测试法条件下的DBPs毒性(7.18×10-4、4.60×10-4).
图 3(Fig. 3)
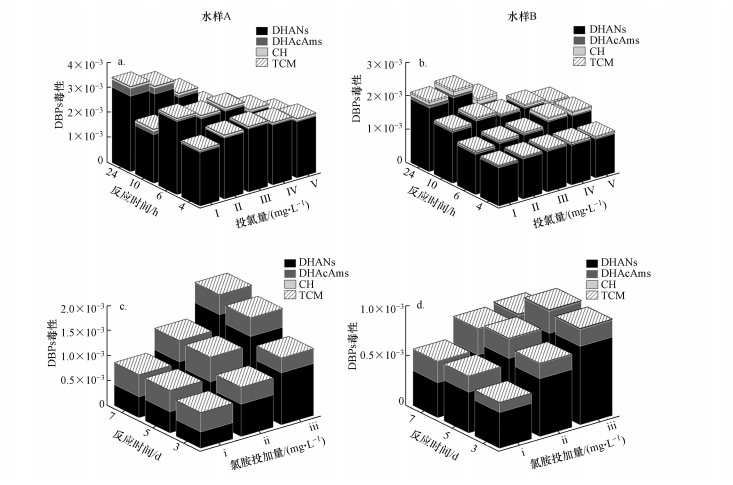 |
| 图 3 两个水样氯消毒(a, b) 与氯胺消毒(c, d) 过程中DBPs的毒性随投氯量和反应时间的变化 Fig. 3Estimated cytotoxicity of the measured DBPs versus disinfectant dose and contact time during chlorination (a, b) and chloramination (c, d) of two water samples |
以水样A为例, 分析氯消毒与氯胺消毒过程中生成的DBPs的浓度分布及其毒性分布, 如图 4所示.水样A氯消毒后, 4类DBPs的生成量大小规律:TCM>CH>DHANs>DHAcAms.TCM是主要的DBPs(占比超过50%), DHANs和DHAcAms的生成量基本仅占总DBPs浓度的20%以下, 且随着投氯量和反应时间的增加逐渐减少.但DHANs和DHAcAms对毒性的贡献却处于主导地位, 其中DHANs的毒性占比最高, 基本超过80%.这些DBPs的毒性大小规律:DHANs>DHAcAms>CH>TCM.这表明水样在氯消毒中生成的N-DBPs浓度虽然不高, 但却具有高毒性(Muellner et al., 2007; Ding et al., 2018).在水样A氯胺消毒中, DHANs和DHAcAms的生成量占总DBPs浓度的80%以上, 毒性占比则接近100%.其中, DHAcAms占总DBPs浓度的70%以上, 但仅占总DBPs毒性的50%以下, 且占比均随投氯量的增加而减小;相反, DHANs在DBPs中的浓度与毒性占比均随氯胺投量的增大而增大.这表明增加氯胺投量对DHANs生成的增加强于对DHAcAms生成的增加.毒性分析结果强调了在氯胺消毒中, N-DBPs是需要重点关注的DBPs.
图 4(Fig. 4)
 |
| 图 4 水样A氯消毒(a, c) 与氯胺消毒(b, d) 生成的DBPs的浓度分布及毒性分布 (每组氯消毒投氯量数据从左到右分别对应4、6、10、24 h反应时间的占比;每组氯胺消毒氯胺投加量数据从左往右分别对应3、5、7 d反应时间的占比) Fig. 4Distributions of the concentration and toxicity of the DBPs formed during chlorination (a, c) and chloramination (b, d) of water sample A (The columns for each chlorine dose corresponding to 4, 6, 10, 24 h reaction time, left to right; The columns for each monochlorine dose corresponding to 3, 5, 7 d reaction time, left to right) |
4 结论(Conclusions)1) 氯消毒过程中, 两个水样DHANs、DHAcAms生成量分别为6.19~40.08 nmol·mg-1(0.74~4.94 μg·mg-1)、1.34~15.75 nmol·mg-1(0.20~2.20 μg·mg-1).Krasner生成潜能测试法条件下(投氯量3 × TOC + 8 ×NH3-N +10, 反应时间24 h)的DHANs和DHAcAms生成量最低, 降低投氯量至TOC+8×NH3-N生成最高浓度的DHANs和DHAcAms, 可能可以更好地揭示水样氯消毒的DHANs和DHAcAms前体物浓度水平.
2) 氯胺消毒过程中, 两个水样DHANs、DHAcAms生成量分别为2.63~21.46 nmol·mg-1(0.37~2.40 μg·mg-1)、18.43~49.99 nmol·mg-1(2.40~6.59 μg·mg-1).DHANs和DHAcAms生成量在Krasner生成潜能测试法条件下(投氯量3 × TOC, 反应时间3 d)最低, 并且随氯胺投加量的增加而增加.增大投氯量至20×TOC生成最高浓度的DHANs和DHAcAms, 揭示出水中更多的氯胺消毒DHANs与DHAcAms前体物.
3) 氯消毒过程中, DHANs和DHAcAms生成量低于TCM、CH, 但毒性远高于TCM、CH, 因此低投氯量TOC+8×NH3-N、反应时间24 h下生成的DBPs毒性处于最高水平;氯胺消毒过程中, DHANs和DHAcAms生成量与毒性均远高于TCM、CH, 在高投氯量20 × TOC条件下的DBPs毒性高于Krasner法测试条件下的毒性.
参考文献
| Bougeard C M M, Goslan E H, Jefferson B, et al. 2010. Comparison of the disinfection by-product formation potential of treated waters exposed to chlorine and monochloramine[J]. Water Research, 44(3): 729-740. DOI:10.1016/j.watres.2009.10.008 |
| Chu W H, Gao N Y, Deng Y, et al. 2010. Precursors of dichloroacetamide, an emerging nitrogenous DBP formed during chlorination or chloramination[J]. Environmental Science & Technology, 44(10): 3908-12. |
| Chuang Y H, Mitch W A. 2017. Effect of ozonation and biological activated carbon treatment of wastewater effluents on formation of N-nitrosamines and halogenated disinfection byproducts[J]. Environmental Science &Technology, 51(4): 2329-2338. |
| Ding S K, Chu W H, Bond T, et al. 2018. Formation and estimated toxicity of trihalomethanes, haloacetonitriles, and haloacetamides from the chlor(am) ination of acetaminophen[J]. Journal of Hazardous Materials, 341: 112-119. DOI:10.1016/j.jhazmat.2017.07.049 |
| Do T D, Chimka J R, Fairey J L. 2015. Improved (and singular) disinfectant protocol for indirectly assessing organic precursor concentrations of trihalomethanes and dihaloacetonitriles[J]. Environmental Science & Technology, 49(16): 9858. |
| Huang H, Chen B Y, Zhu Z R. 2016. Formation and speciation of haloacetamides and haloacetonitriles for chlorination, chloramination, and chlorination followed by chloramination[J]. Chemosphere, 166: 126-134. |
| Huang H, Shao K L, Duan S Y, et al. 2019. Effect of copper corrosion products on the formation and speciation of haloacetamides and haloacetonitriles during chlorination[J]. Separation and Purification Technology, 211: 467-473. DOI:10.1016/j.seppur.2018.10.025 |
| Huang H, Wu Q Y, Hu H Y, et al. 2012. Dichloroacetonitrile and dichloroacetamide can form independently during chlorination and chloramination of drinking waters, model organic matters and wastewater effluents[J]. Environmental Science and Technology, 46(19): 10624-10631. DOI:10.1021/es3025808 |
| Huang H, Wu Q Y, Tang X, et al. 2016. Formation of haloacetonitriles and haloacetamides and their precursors during chlorination of secondary effluent[J]. Chemosphere, 144: 297-303. DOI:10.1016/j.chemosphere.2015.08.082 |
| Huang H, Zhu H H, Gan W H, et al. 2017. Occurrence of nitrogenous and carbonaceous disinfection byproducts in drinking water distributed in Shenzhen, China[J]. Chemosphere, 188: 257-264. DOI:10.1016/j.chemosphere.2017.08.172 |
| Jeong C H, Postigo C, Richardson S D, et al. 2015. Occurrence and comparative toxicity of haloacetaldehyde disinfection byproducts in drinking water[J]. Environmental Science Technology, 49(23): 13749-13759. DOI:10.1021/es506358x |
| Krasner S W, Sclimenti M J, Mitch W, et al. 2007. Using formation potential tests to elucidate the reactivity of DBP precursors with chlorine versus with chloramines[J]. In: Proceedings of the American Water Works Association Water Quality Technology Conference, Charlotte, North Carolina, US, November 4-8 |
| Muellner M G, Wagner E D, McCalla K, et al. 2007. Haloacetonitriles vs. regulated haloacetic acids: Are nitrogen-containing DBPs more toxic?[J]. Environmental Science Technology, 41(2): 645-651. DOI:10.1021/es0617441 |
| Plewa M J, Kargalioglu Y, Vankerk D, et al. 2009. Mammalian cell cytotoxicity and genotoxicity analysis of drinking water disinfection by-products[J]. Environmental and Molecular Mutagenesis, 40(2): 134-142. |
| Plewa M J, Muellner M G, Richardson S D, et al. 2008. Occurrence, synthesis, and mammalian cell cytotoxicity and genotoxicity of haloacetamides: An emerging class of nitrogenous drinking water disinfection byproducts[J]. Environmental Science Technology, 42(3): 955-961. DOI:10.1021/es071754h |
| Plewa M J, Wagner E D. 2009. Mammalian cell cytotoxicity and genotoxicity of disinfection by-products[J]. Water Research Foundation: Denver, CO, 134. |
| 邵开利, 郭亭验, 黄璜. 2019. 含氮消毒副产物卤乙酰胺的水解特性[J]. 环境科学研究, 32(5): 881-887. |
| Yu Y, Reckhow D A. 2015. Kinetic analysis of haloacetonitrile stability in drinking waters[J]. Environmental Science &Technology, 49(18): 11028-11036. |
| Zhu A, Chen B, Zhang L, et al. 2015. Improved analysis of dissolvedorganic nitrogen in water via electrodialysis pretreatment[J]. Analytical Chemistry, 87: 2353-2359. DOI:10.1021/ac504224r |
