 , 许海1,2
, 许海1,2
 , 朱广伟1, 朱梦圆1, 赵锋1,3
, 朱广伟1, 朱梦圆1, 赵锋1,31. 中国科学院南京地理与湖泊研究所, 湖泊与环境国家重点实验室, 南京 210008;
2. 中国科学院大学, 北京 100049;
3. 江南大学环境与土木工程学院, 无锡 214122
收稿日期: 2020-10-21; 修回日期: 2021-01-06; 录用日期: 2021-01-06
基金项目: 国家自然科学基金(No.41830757,41573076,41671494)
作者简介: 康丽娟(1997—), 女, E-mail: kanglijuan18@mails.ucas.ac.cn
通讯作者(责任作者): 许海, E-mail: hxu@niglas.ac.cn
摘要:河流反硝化作用是水体氮素去除的重要途径,对流域氮负荷削减具有重要意义.为探究河网区河道的反硝化脱氮能力及其主要控制因子,本研究调查了太湖14条主要环湖河道的水质和沉积物特征,通过泥浆培养实验,利用氮氩比的方法和膜接口质谱仪分析技术,测定了14条环湖河道的沉积物反硝化潜力.结果表明,太湖环湖河道的反硝化潜力为-9.93~35.71 μmol·L-1·d-1,均值为(20.79±14.79)μmol·L-1·d-1,南部河道的反硝化潜力显著低于北部河道,负值代表沉积物的吸附或固氮行为.水柱中的硝态氮浓度、溶解氧、溶解性有机碳(DOC)和沉积物中的碳含量均会对沉积物反硝化潜力产生影响.相关分析结果表明,硝态氮浓度对河道反硝化作用的影响有限,反硝化作用对硝态氮底物的响应遵从米氏动力学模型(R2=0.77)的规律.而在太湖氮负荷严重的西部和北部河道区,水体中的DOC是反硝化潜力的主要限制因素.改善氮的去除环境对促进水体氮去除过程和区域氮管理具有重要意义,在氮负荷严重的流域河道,水体的DOC应该得到更多的关注.
关键词:河道氮负荷米氏动力学模型耦合硝化反硝化作用太湖
Sediment denitrification potential and its influencing factors in the main rivers of Lake Taihu
KANG Lijuan1,2
 , XU Hai1,2
, XU Hai1,2
 , ZHU Guangwei1, ZHU Mengyuan1, ZHAO Feng1,3
, ZHU Guangwei1, ZHU Mengyuan1, ZHAO Feng1,31. State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008;
2. University of Chinese Academy of Sciences, Beijing 100049;
3. School of Environment and Civil Engineering, Jiangnan University, Wuxi 214122
Received 21 October 2020; received in revised from 6 January 2021; accepted 6 January 2021
Abstract: River denitrification is an important mechanism for nitrogen removal from water bodies, and as such may be a significant way to reduce nitrogen load in river basins. In order to estimate the rates and determine factors controlling denitrification in the river channels connecting to the lake, we investigated water quality and sediment characteristics of the 14 dominant channels discharging to Taihu Lake, and calculated the denitrification potential of sediments in 14 channels by mud incubation experiments, using the N2: Ar ratio method and membrane inlet mass spectrometry (MIMS). The results show that the denitrification potential of sediments in 14 channels ranged from -9.93 to 35.71 μmol·L-1·d-1, with a mean value of (20.79±14.79) μmol·L-1·d-1. The denitrification potential of southern river channels was significantly lower than the counterpart of the northern river channel, and even yielded negative value, indicative of net nitrogen fixation. The concentrations of water column nitrate nitrogen and sediment dissolved oxygen, dissolved organic carbon, and carbon content in sediments all impacted denitrification potential of sediments. Correlation analysis results of denitrification potential and these environmental factors showed that not all river channel denitrification rates are controlled by nitrate concentration, which follows the law of Mie kinetic model (R2=0.77). In the western and northern river regions which showed high nitrogen loads, DOC in water column was the main limiting factor for denitrification potential. Improving denitrification potential is critical for promoting the nitrogen removal process of water bodies and regional nitrogen management. The results indicate that in water bodies showing high nitrogen loading, DOC content should receive close attention.
Keywords: river channelsnitrogen loadingMichaelis-Menten kinetic modelcoupled nitrification-denitrificationTaihu Lake
1 引言(Introduction)河道是流域和湖泊之间的主要物质输移通道(Harrison et al., 2009;Li et al., 2018), 流域产生的污染物经过河网的截流、净化和传输作用进入下游的湖泊(毛战坡等, 2006), 因此, 入湖河道既是湖泊水体污染物的主要来源, 也是污染物自净的重要场所(张波等, 2012).河道对污染物质的截留能力直接影响到下游水域水质(查慧铭等, 2018), 对流域营养负荷排放管理和湖泊富营养化治理具有重要意义(Zhang et al., 2019).
随着我国工农业的快速发展, 大量的人为活性氮通过沟渠汇入河流, 河流的外源氮输入常常会成为下游湖泊氮污染的主要来源.以太湖为例, 每年通过河道进入太湖的氮负荷占入湖总负荷的70%以上(Yi et al., 2017), 河道输入是造成太湖污染负荷重的主要原因(朱广伟, 2009;王倩等, 2017).过量的氮是造成湖泊水体富营养化(Xu et al., 2010)、有害藻类水华频繁暴发和水生生物多样性降低的关键原因, 因此, 近几十年来关于地表水环境中活性氮去除过程的相关研究也受到国内外****的广泛关注.
由微生物驱动的反硝化过程将水体中的硝态氮还原成氮气返回大气, 可以减少氮素向下游的输送, 降低下游湖泊或河流水域的富营养化风险(Seitzinger et al., 2006), 是水生生态系统中氮素去除的主要方式和氮循环的关键过程(席北斗等, 2009).研究表明, 每年淡水系统(地下水、湖泊和河流)反硝化脱氮量约占全球脱氮总量的20%(Seitzinger et al., 2006), 河流系统是反硝化作用发生的热点区域, 输入的溶解无机氮(DIN)约有15%~33%在此被反硝化去除(Wollheim et al., 2008).
温度、pH、溶解氧(DO)、有机碳的可用性和硝态氮供应等环境因素均会对反硝化微生物的分布和脱氮速率产生影响(Korom, 1992; Lan et al., 2015).不同区域的水体由于污染水平和污染类型不同, 反硝化作用的主导控制因子也不同.在对有关河流反硝化影响因素的研究过程中, 硝态氮浓度一直被认为是影响反硝化速率的首要因素(Pi?a-Ochoa et al., 2006; Li et al., 2013; Zhao et al., 2015).例如, 张波等(2012)通过对太湖流域北部部分河流反硝化作用的研究, 发现沉积物的反硝化速率与上覆水的硝态氮浓度呈显著正相关;赵永强等通过对太湖入湖河流殷村港和河南埂沉积物反硝化作用的研究, 建立起了以硝态氮浓度和水温为主要变量的反硝化脱氮模型(Zhao et al., 2015).但也有较多的研究表明, 在硝态氮底物充足的条件下, 反硝化速率还会在较大程度上受到碳源的限制(Knowles, 1982; Korom, 1992).太湖流域河流众多, 其生态类型和水质状况差异较大(陈小锋等, 2012), 水体反硝化作用也会受氮素污染程度、沉积物性质等因素影响而差异显著.因此, 针对太湖环湖河道沉积物反硝化潜力及其控制因素有必要进一步开展研究.
基于此, 本研究通过调查太湖14条主要环湖河道的现场水质理化参数, 并采集相应的沉积物样品, 通过泥浆培养实验测定14条河流的反硝化潜力, 以阐明太湖环湖河流的水体反硝化潜力大小, 以及其在空间上是否存在一定的差异, 并厘清环太湖河流反硝化潜力的主要控制因子.本研究对于深入理解河流氮素的滞留机制和评估太湖环湖河道氮素的去除能力具有重要意义, 可为流域氮素精确管理和湖泊水质富营养化管理目标提供数据支撑.
2 研究方法(Research methods)2.1 研究区域概况太湖是我国第三大淡水湖, 地处长江三角洲平原的核心地区, 面积为2338 km2, 平均水深为1.9 m, 河网密布, 水系发达, 出入湖河道超过200条(朱金格等, 2018), 地表径流和降水过程是主要水分的补给来源.该流域不仅是我国重要的水稻种植区, 土地耕种密集, 人口众多, 而且城镇化、工业化水平高(Yi et al., 2017), 经济发达.伴随着流域内工农业的快速发展, 大量的污水和氮负荷也通过河网不断流入太湖(Li et al., 2013).研究表明, 太湖全年氮素河流输入总量约为7.00×104 t, 其中, 大量污染物是由河流从流域进入湖体的(陈小锋等, 2012);尤其是太湖西部, 不少入湖河流水体全年总氮监测值均劣于Ⅴ类水指标, 水体的富营养化主要问题为总氮含量超标;湖西的太滆运河、漕桥河、殷村港、陈东港4条河流的多年平均总氮入湖污染物量占江苏省河流入湖总氮的近50%(马倩等, 2014).过量的有机氮输入使太湖富营养化等级逐年上升(秦伯强等, 2007), 氮污染严重, 蓝藻水华现象发生频繁, 经过多年治理, 湖泊富营养化问题依然严峻.
2.2 样品采集与分析本文选择太湖周边的14条环湖河流, 于2019年11月采集各条河流中表层水与沉积物样品.14条河流自太湖东北顺时针依次为望虞河、胥江、瓜泾、太浦河、大钱港、长兜港、长兴港、合溪新港、乌溪港、陈东港、沙塘港、殷村港、漕桥河和太滆运河(图 1).其中, 大钱港、长兜港、长兴港和合溪新港4条河流在浙江省湖州市境内, 其余10条河流均位于江苏省境内.
图 1(Fig. 1)
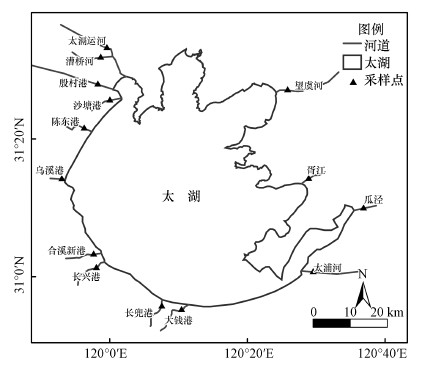 |
| 图 1 采样点位空间分布图 Fig. 1Spatial distribution of the study sites |
所有采样点均位于河流距湖口约1 km的距离内, 利用便携式多参数水质分析仪(Yellow Springs Instruments, USA)现场测定水面表层的水温(WT)、溶解氧(DO)和pH.在每个点位现场采集表层50 cm水样100 mL, 立即通过0.45 μm孔径的玻璃纤维滤膜(Whatman GF/F), 并立即收集经滤膜过滤后的水样冷藏带回实验室, 用于测定溶解性总氮(DTN)、硝态氮(NO3--N)、亚硝态氮(NO2--N)、氨氮(NH4+-N)和溶解性总碳(DOC), 其中, NO3--N、NO2--N、NH4+-N采用流动分析仪(Skalar Sanplus, 荷兰)测定, DOC采用TOC分析仪测定.此外, 每个点另外收集表层水样500 mL, 并立即冷藏带回实验室, 部分水样用于总氮(TN)测定(硫酸钾-紫外分光光度法), 部分水样用于泥浆实验培养.用抓斗沉积物采样器采集每个样点表层5 cm内的原位沉积物, 沿河流断面采集3次, 将3次采集的样品充分混合, 分别保存质量约100 g的沉积物于两个自封袋中, 带回实验室, 一份称重后冻干, 测定含水率, 然后研磨粉碎用于分析沉积物中的总碳(STC)和总氮(STN), 另一份用于实验培养.其中, STN采用凯氏定氮法测定, STC采用重铬酸钾氧化法测定.
2.3 泥浆培养法测定反硝化潜力泥浆培养实验:取各样点沉积物样品和原位水样以干重1∶5的比例置于250 mL血清瓶中, 充分搅拌混合均匀制成泥浆(Hou et al., 2015; Jiang et al., 2020).添加KNO3溶液使水体中的NO3--N增加2 mg·L-1, 用高纯氦气吹扫5 min赶出泥浆中的氧气与氮气, 晃动血清瓶以使泥浆充分均匀, 然后用蠕动泵将其密闭分装至6个12 mL的Labco培养瓶(H=100 mm, φ=10 mm)中.分装时将蠕动泵出口端橡皮管伸入培养瓶的底部, 排走瓶内空气, 瓶子快满时缓慢抽出橡皮管, 在瓶口留下凸液面水珠并立刻旋紧瓶盖, 以免出现气泡.分装后的培养瓶分为两组, 第1组用注射器立即加入0.1 mL饱和质量分数为50%的ZnCl2溶液以终止微生物反应并马上密封保存, 第2组垂直置于20 ℃的水中恒温培养24 h后取出, 用相同方式加入ZnCl2溶液后密封保存待测.
样品中溶解性氮气根据N2∶Ar比法采用膜进样质谱仪(Membrane Introduction Mass Spectrometry, MIMS)测定.氮氩比的方法由Kana等(1994)提出:由于水环境中N2主要受生物过程(主要是反硝化)和水气平衡过程影响, 不易被微生物所直接利用, 而Ar在水环境中的溶解度比较稳定, 主要受到温度、盐度条件控制.因此, 可以通过N2和Ar比值变化来测定给定时间内氮气的增量△[N2](mol·L-1), 计算公式为(Jiang et al., 2020):
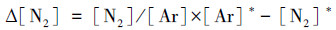 | (1) |
2.4 统计分析与计算利用Kolmogorov-Smirnov和Levene检验对所获取的数据进行正态分布和方差齐性检验, 数据间的显著性差异通过单因素方差分析(one-way ANOVA)的方法分析.对于不符合正态分布和方差齐性的数据, 使用Wilcoxon秩和检验的方法进行非参数比较.所有样本的相关性通过Pearson相关分析进行检验.为了更好地表征反硝化过程与环境因子之间的关系, 采用相关分析的方法探究净N2通量与各环境因素的关系, 选用的可能影响反硝化脱氮潜力的环境因子包括DO、NO3--N、NH4+-N、DOC、STN和STC(徐徽等, 2009; Li et al., 2013; Zhao et al., 2015).
3 结果(Results)3.1 环湖河道水体和沉积物理化特征在对14条河道的调查过程中发现(表 1), 河道的平均水温为(15.95±0.67) ℃, 水体DO浓度为5.47~9.89 mg·L-1, 胥江的DO最低, 为5.47 mg·L-1, 槽桥港的DO最高, 为9.89 mg·L-1;瓜泾、太浦河、大钱港和长兜港的DO也均大于9 mg·L-1.14条河道的TN和NO3--N浓度存在较大的差异, 硝态氮浓度与总氮分布规律类似, 胥江的TN浓度最高, 达4.88 mg·L-1;太浦河和大钱港的TN浓度分别为0.89 mg·L-1和0.95 mg·L-1, NO3--N浓度则均不超过0.10 mg·L-1;此外, NO3--N浓度较低的还有长兜港、长兴港和合溪新港.河道水体中的DOC除望虞河较低以外, 其余普遍较高, 均值为(3.50±0.71) mg·L-1.STC的差异相对较大, 含量最高的是长兜港(2.08%), 最低的是合溪新港(0.47%).STN含量为0.10%~0.26%.
表 1(Table 1)
| 表 1 采样点水柱和沉积物的理化参数 Table 1 The physical and chemical parameters of sites in water and sediment | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 采样点水柱和沉积物的理化参数 Table 1 The physical and chemical parameters of sites in water and sediment
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.2 环湖河道反硝化潜力泥浆培养实验结果表明, 不同河道的反硝化潜力呈现出一定的差异性(图 2).14条河道的沉积物反硝化潜力平均值为(20.79±14.79) μmol·L-1·d-1, 最高值出现在胥江, 为35.71 μmol·L-1·d-1;太浦河、大钱港、长兜港和长兴港4条位于南部的河道的反硝化潜力明显较低, 最低值出现在太浦河, 为-9.93 μmol·L-1·d-1, 表出现固氮的现象.将太浦河、大钱港、长兜港和长兴港最南部的4条河流划分为一组(南部河道), 剩下的10条河道划分为一组(北部河道).方差分析结果表明, 南部河道的平均反硝化速率明显低于北部河道(p=0.01), 即南部河道和北部河道的反硝化潜力在空间位置上表现出较大的差异.但两组河道除NO3--N外, 在DOC和DO等环境因子上均没有表现出明显差异.
图 2(Fig. 2)
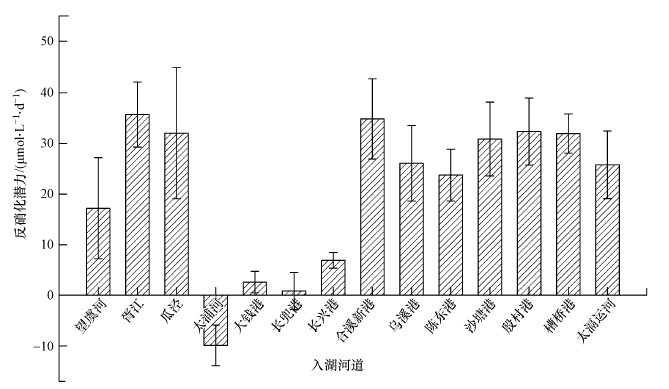 |
| 图 2 环湖河道的反硝化潜力 Fig. 2Histogram of denitrification potential of the rivers to Taihu Lake |
表 2(Table 2)
| 表 2 太湖环湖河道反硝化潜力与环境因子间的相关分析 Table 2 Pearson correlation coefficient between denitrification potential and the environmental factors in Taihu Lake | ||||||||||||||||||||||||||||
表 2 太湖环湖河道反硝化潜力与环境因子间的相关分析 Table 2 Pearson correlation coefficient between denitrification potential and the environmental factors in Taihu Lake
| ||||||||||||||||||||||||||||
3.3 反硝化潜力与环境因素的关系相关分析结果表明, DO与反硝化潜力间存在显著的负相关性(r=-0.57, p < 0.05), 而NO3--N与反硝化潜力间存在显著的正相关性(r=0.58, p < 0.05).同时, 考虑到水体硝态氮作为反硝化底物可能造成较大的组间差异, 本研究对北部河道进行单独相关分析, 发现北部河道反硝化潜力的主要影响因素是水体中的DOC(r=0.76, p < 0.01)和STN(r=-0.69, p < 0.05).值得注意的是, 水体的DOC与沉积物的STC间(r=-0.27, p=0.38)均没有显著的相关关系, 表明在河流生态系统中, 由于水流较快, 水体与沉积物的性质并不同步.
4 太湖环湖河道反硝化潜力特征(Characteristics of denitrification potential in the rivers around Lake Taihu)4.1 太湖环湖河道反硝化潜力的空间差异过多的氮素进入生物圈, 会引起河流与湖泊富营养化、有毒有害藻类暴发和生物多样性降低等问题(Xu et al., 2010; Zhong et al., 2010), 进而影响人们取水用水安全.而由流域河网环境、水体类型(Mulholland et al., 2008)引起的河流硝态氮浓度的不同, 也会造成不同流域区系反硝化速率间的较大差异(燕姝雯等, 2011; Paerl et al., 2016).从本文调查结果也可看出, 太湖主要环湖河道在水质特征上也有较大差异, 西北的陈东港、沙塘港、殷村港、太滆运河是太湖重要的污染物输入来源, 总氮浓度整体较高;望虞河作为“引江济太”调水工程的主要线路, 是长江水源与太湖水的连接通道, 同时也是洪水期流域水外排的重要河道(马倩等, 2014).位于南边的太浦河、长兜港是太湖出湖水量最大的两条河, 总氮浓度明显较低.
太湖环湖河道的反硝化潜力为-9.93~35.71 μmol·L-1·d-1, 最高值出现在胥江, 为35.71 μmol·L-1·d-1.从水质数据可以看出, 胥江不仅具有较高浓度的硝态氮, 而且水体溶解氧较低, 以厌氧细菌为主的反硝化微生物可以在该条件下较好生存(Ghafari et al., 2008; Wang et al., 2016; Kreiling et al., 2019), 相关分析结果中也显示出DO与反硝化速率有显著的负相关性(r= -0.57, p < 0.05).
4.2 硝态氮浓度对太湖环湖河道反硝化速率的影响硝态氮(NO3--N)作为反硝化过程的底物, 一直被认为是自然环境中反硝化速率的首要影响因子.较多的研究已证实沉积物反硝化速率与上覆水中NO3--N浓度呈正相关关系(Pi?a-Ochoa et al., 2006; Li et al., 2013; Zhao et al., 2015), 在一定的范围内, NO3--N浓度越高, 反硝化脱氮速率越高(Hansen et al., 2018);河流等淡水系统中沉积物的反硝化速率对硝态氮底物有很强的响应(Seitzinger, 1988), 地表水中反硝化作用发生的热点区域也主要集中在硝态氮含量高的地区(燕姝雯等, 2011);缺乏硝态氮不仅会降低反硝化速率, 在硝态氮较低的地方, 反硝化细菌的生长率也较低(Findlay et al., 2011).但由于反硝化是利用微生物的呼吸代谢的酶促反应, 反硝化速率对底物浓度的正向响应是有限的, 应更多的遵循米氏方程(Michaelis-Menten kinetics)的规律, 在河流、河口、海湾等生态系统的沉积物反硝化研究中均发现有此规律(Shan et al., 2018).即在低的底物浓度下, 反应速率随着底物的增加有较好的增加趋势, 而当底物继续增加时, 反应速率逐渐趋向于平缓;在高的底物浓度下, 酶被底物饱和, 反应速率逐渐不再增加.
在相关分析的结果中, 反硝化潜力与水中原位的NO3--N浓度呈显著相关性(r=0.57, p=0.03), 而这种相关性在氮污染严重的北部河道中不显著(r=-0.04, p>0.1).本文利用Michelis-Menten动力学模型拟合了河道沉积物反硝化潜力与原位上覆水NO3--N浓度间的关系(图 3), 得到河道沉积物反硝化动力学参数方程为:y=42.72x/(0.72+x) (R2=0.77).其中, 合溪新港的藻类生物量较多(叶绿素值为39.60 μg·L-1), 将其视为异常值处理.方程中, 反硝化潜力的最大反应速率(Vm)为42.72 μmol·L-1·d-1, 也叫作微生物作用的饱和速率, 即当上覆水有充分的硝态氮供应时, 沉积物的反硝化潜力最大值为42.72 μmol·L-1·d-1, 该值主要受到参与反应的酶活性及参与反应的微生物数量限制.半饱和常数(Km)为0.72, 考虑到实验中外加的2 mg·L-1硝态氮, 即当水体中氮浓度较高时(约为2.7 mg·L-1), 硝态氮浓度不再是反硝化潜力的主要影响因素.
图 3(Fig. 3)
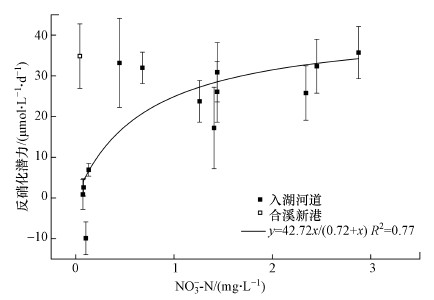 |
| 图 3 河道反硝化潜力与水体硝态氮之间的米氏方程拟合 Fig. 3Michaelis-Menten kinetics of the denitrification potential and nitrate in in river channels |
沉积物进行反硝化作用时, 硝态氮主要有两种来源途径:一是直接来自于水柱的扩散, 二是沉积物中的氨氮通过硝化作用生成(Li et al., 2013), 分别成为非耦合反硝化过程(Dw)和耦合反硝化过程(Dn).因为水与沉积物间是一个物质相对交换的环境, 影响Dw和Dn在总反硝化速率中比重的主要因素是DO在沉积物中的侵蚀深度(Evrard et al., 2013).本研究中, 水体与沉积物中STN和STC并不表现出显著的相关性, 而反硝化潜力与水体性质具有更强的相关性, 而与沉积物未表现出任何相关性, 因此, 该区非耦合反硝化可能是沉积物反硝化作用的主要方式.
4.3 有机碳是高氮河道区反硝化速率的主要限制因素有机碳在水体反硝化过程氮素去除中不仅作为电子供体来源, 同时也是反硝化细菌生长代谢的能量源(杨珊等, 2014).在工业废水和污水的处理中, 也常常通过外加碳源来调节水体中的碳氮比例, 从而促进反硝化作用速率(Her et al., 1995).在自然河流中, 含有硝态氮和不稳定有机碳的河流沉积物中反硝化细菌更加活跃(Seitzinger, 1988).
本文的相关分析结果中, 尽管14条河道的反硝化潜力与水体DOC并未表现出显著的相关性, 北部河道的反硝化潜力却与DOC显著相关(r=0.76, p<0.01).在对北部河道的反硝化潜力与水体中DOC进行单独回归分析时发现(图 4), 反硝化潜力与DOC间存在较为显著的线性关系y=5.36x+10.47(R2=0.53), 也就是说对于高氮负荷的河道, 反硝化速率与水中DOC浓度的关系更为紧密.相对应的, 河道的反硝化潜力与沉积物总碳(STC)表现出统计上的负相关关系, 这可能是与沉积物中微生物的作用或数目有关, 反硝化微生物在利用完沉积物中可利用的碳后, 从水体中摄取DOC继续作用.Hansen等(2018)的研究也表明, 有机碳供应不足会影响农业河流和与氮排放有关河流的反硝化速率.而南部河道受到硝态氮底物的限制, DOC的限制作用不明显.
图 4(Fig. 4)
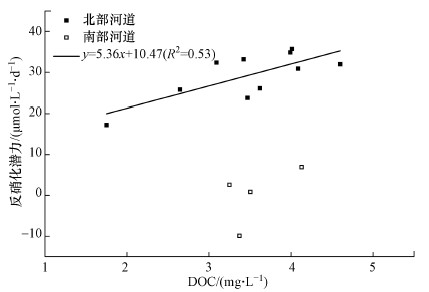 |
| 图 4 北部河道反硝化潜力与水体DOC间的回归关系 Fig. 4Regression between denitrification potential of northern rivers and dissolved organic carbon in north rivers |
5 太湖河道反硝化潜力对氮管理的启示(Illuminate of denitrification potential in Taihu river to nitrogen management)在水生生态系统中, 氮循环过程对于初级生产力具有重要的作用, 反硝化过程作为最直接的脱氮过程, 对氮的迁移转化与收支平衡具有重要的意义(钟继承等, 2009).平原河网区人口密集, 水系发达, 是反硝化脱氮的热点区域.但河网环境复杂, 不同的土地利用、人类活动方式都会造成污染物输入间的差异.
缓解湖泊氮污染和防控蓝藻暴发除了需要控制养分的排放外, 还应该致力于改善氮的去除环境(Jiang et al., 2020).传统观点一致认为硝态氮底物是反硝化脱氮的主要影响因素, 较多****已指出硝态氮及温度在河道反硝化过程中的重要作用(Li et al., 2013; Zhao et al., 2015), 但在氮污染负荷严重的地区, 除硝态氮以外的其它因素需要被更多的关注, 水体中氮素达到最低才是氮管理的目的.室内实验结果较为系统地揭示了太湖环湖河道反硝化潜力的空间差异;通过对北部河道和水体DOC的单独回归分析表明, 在氮素污染严重的河道中, 反硝化潜力受到水中DOC的限制作用.因此, 在对太湖流域及其类似氮污染严重地区进行氮素循环的研究时, 应当充分考虑水体有机碳的存在.对于一些氮浓度较高的河道, 如胥江、殷村港、太滆运河, 可以考虑在岸边增加水生植被的覆盖率以增加水体的有机质含量促进反硝化过程的发生.由于本研究观测的是河道的反硝化潜力而不是原位的反硝化速率, 对评估河道对氮的去除量方面尚有不足, 同时还需要对河道氮负荷在季节上的变化及反硝化速率对温度变化的响应做进一步研究.
6 结论(Conclusions)本文通过对太湖环湖河道反硝化潜力的研究结果表明, 河道沉积物的反硝化潜力受到水体硝态氮浓度影响并遵循米氏方程的规律.在氮污染严重的条件下, 水体有机碳含量成为反硝化潜力的主要限制因子.除了实行严格的氮排放控制外, 改善氮的去除环境及促进反硝化作用的最大发生是氮污染负荷严重地区的重要目标.对太湖入湖河道进行分区管理, 在氮负荷严重区要注重污水排放中的氮碳比率, 针对性地利用河道自身自净能力降低入湖负荷.本研究结果对太湖河网区的氮素管理和减轻流域氮负荷过重问题有重要参考价值.
致谢:叶小锐、郭宇龙、胡春华、张成英、邹伟在样品采集和处理分析中给予了很大帮助, 在此表示感谢!
参考文献
| 陈能汪, 吴杰忠, 段恒轶, 等. 2010. N2: Ar法直接测定水体反硝化产物溶解N2[J]. 环境科学学报, 30(12): 2479-2483. |
| 陈小锋, 揣小明, 曾巾, 等. 2012. 太湖氮素出入湖通量与自净能力研究[J]. 环境科学, 33(7): 2309-2314. |
| Evrard V, Glud R N, Cook P L, et al. 2013. The kinetics of denitrification in permeable sediments[J]. Biogeochemistry, 113(1): 563-572. |
| Findlay S, Mulholland P J, Hamilton S K, et al. 2011. Cross-stream comparison of substrate-specific denitrification potential[J]. Biogeochemistry, 104(1/3): 381-392. DOI:10.1007/s10533-010-9512-8 |
| Ghafari S, Hasan M, Aroua M K, et al. 2008. Bio-electrochemical removal of nitrate from water and wastewater-A review[J]. Bioresource Technology, 99(10): 3965-3974. DOI:10.1016/j.biortech.2007.05.026 |
| Hansen A T, Dolph C L, Foufoulageorgiou E, et al. 2018. Contribution of wetlands to nitrate removal at the watershed scale[J]. Nature Geoscience, 11(2): 127-132. DOI:10.1038/s41561-017-0056-6 |
| Harrison J A, Maranger R, Alexander R B, et al. 2009. The regional and global significance of nitrogen removal in lakes and reservoirs[J]. Biogeochemistry, 93(1): 143-157. |
| Her J, Huang J. 1995. Influences of carbon source and C/N ratio on nitrate/nitrite denitrification and carbon breakthrough[J]. Bioresource Technology, 54(1): 45-51. DOI:10.1016/0960-8524(95)00113-1 |
| Jiang X, Gao G, Zhang L, et al. 2020. Denitrification and dissimilatory nitrate reduction to ammonium in freshwater lakes of the Eastern Plain, China: Influences of organic carbon and algal bloom[J]. Science of the Total Environment, 710: 136303. DOI:10.1016/j.scitotenv.2019.136303 |
| Kana T M, Darkangelo C, Hunt M D, et al. 1994. Membrane Inlet Mass Spectrometer for rapid high-precision determination of N2, O2, and Ar in environmental water samples[J]. Analytical Chemistry, 66(23): 4166-4170. DOI:10.1021/ac00095a009 |
| Kreiling R M, Richardson W B, Bartsch L A, et al. 2019. Denitrification in the river network of a mixed land use watershed: unpacking the complexities[J]. Biogeochemistry, 143(3): 327-346. DOI:10.1007/s10533-019-00565-6 |
| Knowles R. 1982. Denitrification[J]. Microbiological Reviews, 46(1): 43-70. DOI:10.1128/MR.46.1.43-70.1982 |
| Lan T, Han Y, Cai Z, et al. 2015. Denitrification and its product composition in typical Chinese paddy soils[J]. Biology and Fertility of Soils, 51(1): 89-98. DOI:10.1007/s00374-014-0953-4 |
| 李卫芬, 郑佳佳, 张小平, 等. 2014. 反硝化酶及其环境影响因子的研究进展[J]. 水生生物学报, 38(1): 166-170. |
| Li W, Zhai L, Lei Q, et al. 2018. Influences of agricultural land use composition and distribution on nitrogen export from a subtropical watershed in China[J]. Science of the Total Environment, 642: 21-32. DOI:10.1016/j.scitotenv.2018.06.048 |
| Li X, Xia Y, Li Y, et al. 2013. Sediment denitrification in waterways in a rice-paddy-dominated watershed in eastern China[J]. Journal of Soils and Sediments, 13(4): 783-792. DOI:10.1007/s11368-013-0651-0 |
| 马倩, 田威, 吴朝明. 2014. 望虞河引长江水入太湖水体的总磷、总氮分析[J]. 湖泊科学, 26(2): 207-212. |
| 毛战坡, 单保庆, 彭文启, 等. 2006. 氮素在河流生态系统中的滞留研究进展[J]. 长江流域资源与环境, 15(4): 480-484. DOI:10.3969/j.issn.1004-8227.2006.04.013 |
| Mulholland P J, Helton A M, Poole G C, et al. 2008. Stream denitrification across biomes and its response to anthropogenic nitrate loading[J]. Nature, 452(7184): 202-205. DOI:10.1038/nature06686 |
| Hou L, Yin G, Liu M, et al. 2015. Effects of sulfamethazine on denitrification and the associated N2O release in estuarine and coastal sediments[J]. Environmental Science & Technology, 49(1): 326-333. |
| Paerl H W, Scott J T, Mccarthy M J, et al. 2016. It takes two to tango: when and where dual nutrient (N & P) reductions are needed to protect lakes and downstream ecosystems[J]. Environmental Science & Technology, 50(20): 10805-10813. |
| Pi?a-Ochoa E, álvarez-Cobelas M. 2006. Denitrification in aquatic environments: a cross-system analysis[J]. Biogeochemistry, 81(1): 111-130. DOI:10.1007/s10533-006-9033-7 |
| 秦伯强, 王小冬, 汤祥明, 等. 2007. 太湖富营养化与蓝藻水华引起的饮用水危机-原因与对策[J]. 地球科学进展, 22(9): 896-906. DOI:10.3321/j.issn:1001-8166.2007.09.003 |
| Seitzinger S P, Harrison J A, Bohlke J K, et al. 2006. Denitrification across landscapes and waterscapes: a synthesis[J]. Ecological Applications, 16(6): 2064-2090. DOI:10.1890/1051-0761(2006)016[2064:DALAWA]2.0.CO;2 |
| Seitzinger S P. 1988. Denitrification in freshwater and coastal marine ecosystems: Ecological and geochemical significance[J]. Limnology and Oceanography, 33(4): 702-724. |
| Shan J, Yang P, Shang X, et al. 2018. Anaerobic ammonium oxidation and denitrification in a paddy soil as affected by temperature, pH, organic carbon, and substrates[J]. Biology and Fertility of Soils, 54(3): 341-348. DOI:10.1007/s00374-018-1263-z |
| Wang J, Chu L. 2016. Biological nitrate removal from water and wastewater by solid-phase denitrification process[J]. Biotechnology Advances, 34(6): 1103-1112. DOI:10.1016/j.biotechadv.2016.07.001 |
| 王倩, 吴亚东, 丁庆玲, 等. 2017. 西太湖入湖河流水系污染时空分异特征及解析[J]. 中国环境科学, 37(7): 2699-2707. DOI:10.3969/j.issn.1000-6923.2017.07.035 |
| 王书伟, 颜晓元, 单军, 等. 2018. 利用膜进样质谱法测定不同氮肥用量下反硝化氮素损失[J]. 土壤, 50(4): 664-673. |
| Weiss R F. 1970. The solubility of nitrogen, oxygen and argon in water and seawater[J]. Deep Sea Research and Oceanographic Abstracts, 17(4): 721-735. DOI:10.1016/0011-7471(70)90037-9 |
| Wollheim W M, Peterson B J, Thomas S M, et al. 2008. Dynamics of N removal over annual time periods in a suburban river network[J]. Journal of Geophysical Research, 113(G3): G03038. |
| 席北斗, 于会彬, 马文超, 等. 2009. 湖岸缓冲带反硝化作用的研究进展[J]. 环境工程学报, 3(10): 3-8. |
| Xu H, Paerl H W, Qin B, et al. 2010. Nitrogen and phosphorus inputs control phytoplankton growth in eutrophic Lake Taihu, China[J]. Limnology and Oceanography, 55(1): 420-432. DOI:10.4319/lo.2010.55.1.0420 |
| 徐徽, 张路, 商景阁, 等. 2009. 太湖梅梁湾水土界面反硝化和厌氧氨氧化[J]. 湖泊科学, 21(6): 775-781. |
| 杨珊, 石纹豪, 王晗, 等. 2014. 外加碳源影响水体异养反硝化脱氮的研究进展[J]. 环境科学与技术, (8): 54-58. |
| 燕姝雯, 余辉, 张璐璐, 等. 2011. 2009年环太湖入出湖河流水量及污染负荷通量[J]. 湖泊科学, 23(6): 855-862. |
| Yi Q, Chen Q, Hu L, et al. 2017. Tracking nitrogen sources, transformation, and transport at a basin scale with complex plain river networks[J]. Environmental Science & Technology, 51(10): 5396-5403. |
| 查慧铭, 朱梦圆, 朱广伟, 等. 2018. 太湖出入湖河道与湖体水质季节差异分析[J]. 环境科学, 39(3): 1102-1112. |
| 张波, 杜应旸, 陈宇炜, 等. 2012. 太湖流域典型河流沉积物的反硝化作用[J]. 环境科学学报, 32(8): 1866-1873. |
| Zhang W, Li H, Kendall A D, et al. 2019. Nitrogen transport and retention in a headwater catchment with dense distributions of lowland ponds[J]. Science of the Total Environment, 683: 37-48. |
| Zhao Y, Xia Y, Ti C, et al. 2015. Nitrogen removal capacity of the river network in a high nitrogen loading region[J]. Environmental Science & Technology, 49(3): 1427-1435. |
| Zhong J, Fan C, Liu G, et al. 2010. Seasonal variation of potential denitrification rates of surface sediment from Meiliang Bay, Taihu Lake, China[J]. Journal of Environmental Sciences, 22(7): 961-967. |
| 钟继承, 刘国锋, 范成新, 等. 2009. 湖泊底泥疏浚环境效应: Ⅲ. 对沉积物反硝化作用的影响[J]. 湖泊科学, 21(4): 465-473. |
| 朱广伟. 2009. 太湖水质的时空分异特征及其与水华的关系[J]. 长江流域资源与环境, 18(5): 439-445. |
| 朱金格, 刘鑫, 邓建才, 等. 2018. 太湖西部环湖河道污染物输移速率变化特征[J]. 湖泊科学, 30(6): 1509-1517. |
