 , 杨琛1,2
, 杨琛1,2
 , 宋之怡3,4, 何春凤1, 何俊衡1, 黄伟林1,3, 党志1,2
, 宋之怡3,4, 何春凤1, 何俊衡1, 黄伟林1,3, 党志1,21. 华南理工大学环境与能源学院, 广州 510006;
2. 工业聚集区污染控制与生态修复教育部重点实验室, 广州 510006;
3. 美国罗格斯大学环境科学系, 新泽西州 08901;
4. 广东省生态环境与土壤研究所, 广州 510650
收稿日期: 2021-01-07; 修回日期: 2021-03-01; 录用日期: 2021-03-01
基金项目: 国家自然科学基金(No.41773107);广东省基础与应用基础研究基金项目(No.2020A1515011560);广州市科技计划项目(No.202002030297)
作者简介: 周季妮(1996—), 女, E-mail: Jinizhou@126.com
通讯作者(责任作者): 杨琛, E-mail: cyanggz@scut.edu.cn
摘要:为阐明抗生素与重金属复合污染对水稻根系的影响机制,考察了四环素(TC)与镉(Cd)单一和复合污染条件下,水培分蘖期水稻根系生长、污染物积累和根系分泌物的变化特征.结果表明:TC与Cd单一处理时,根部生物量和叶绿素含量下降,表现出毒害作用,低剂量的TC与Cd共同作用能够缓解其毒性效应;TC与Cd单一/复合污染均使根的伸长和植株蒸腾量表现出低促高抑现象.水稻根系对TC和Cd的吸收积累呈现出显著的剂量效应,且两者共存会改变污染物的生物可利用性及在根系的亲和力,从而协同促进TC和Cd在水稻根系的吸收积累,但更多的TC会与Cd络合导致根系Cd吸收减少.TC与Cd单一污染可显著抑制根系分泌物的分泌,复合污染条件下,对根系分泌物的影响随浓度升高存在差异:低浓度时能在一定程度上缓解TC/Cd对光合作用的抑制作用,且伴随蒸腾作用的增加,水稻根系分泌物增多;而高浓度时根系细胞完整性可能受损,进而抑制根系分泌物的分泌.进一步分析发现,高浓度时,根系分泌物中氨基酸及衍生物类、有机酸类和糖醇类物质的分泌显著增加,可能是因为TC与Cd的络合作用使Cd的生物可利用性降低,缓解了高Cd胁迫对水稻的毒性,促进分泌有机酸类、氨基酸及衍生物类和糖醇类物质,增强自我防护作用.本研究结果可为保障水稻安全生产,建立有效控制抗生素-重金属类复合污染的根际调控措施提供参考数据.
关键词:四环素镉水稻根系积累根系分泌物
Influences of tetracycline and cadmium on rice roots: Growth and root exudates
ZHOU Jini1
 , YANG Chen1,2
, YANG Chen1,2
 , SONG Zhiyi3,4, HE Chunfeng1, HE Junheng1, HUANG Weilin1,3, DANG Zhi1,2
, SONG Zhiyi3,4, HE Chunfeng1, HE Junheng1, HUANG Weilin1,3, DANG Zhi1,21. School of Environment and Energy, South China University of Technology, Guangzhou 510006;
2. Key Laboratory of Pollution Control and Ecosystem Restoration in Industry Clusters, Ministry of Education, Guangzhou 510006;
3. Department of Environmental Sciences, Rutgers University, The State University of New Jersey, New Brunswick, NJ 08901;
4. Guangdong Institute of Ecological Environment and Soil, Guangzhou 510650
Received 7 January 2021; received in revised from 1 March 2021; accepted 1 March 2021
Abstract: Hydroponic culture experiments were conducted to find out the changes of rice root morphological characteristics and root exudates after single and combined pollutants treatments of tetracycline (TC) and cadmium (Cd). Pollutants accumulation in rice roots at tillering stage has been studied, so as to elucidate the mechanism of antibiotic and heavy metal combined pollution on rice root system. In single pollutant treatment of TC or Cd, both root biomass and chlorophyll content decreased, which indicated adverse effects on rice growth. However, antagonism effect was observed at low dose TC and Cd combined pollutants treatment. The root elongation and transpiration rate of rice plants showed promotion in low concentration exposure of single or combined pollutants treatments while high concentration exposure environment limited various physiological indexes. The accumulation of TC or Cd in rice root showed observable increase with the increase of the concentration of TC and Cd. Moreover, the coexistence of TC and Cd could increase the bioavailability and affinity of both pollutants, which results in synergistically promotion of pollutants accumulation in rice root. However, high TC concentration might led to Cd accumulation reduction in rice root because of complexation enhancement. The secretion of rice root exudates was significantly inhibited under single pollutant treatment of TC or Cd, but the combined pollution treatment showed different effects. In combined TC and Cd at low concentration treatment, with the remission of toxicity, the increased rice root exudates may result from increased photosynthesis rate and transpiration rate. But, the integrity of rice root cells was damaged under high concentration treatment, which inhibited the secretion of root exudates. Further analysis showed that the secretion of amino acids and derivatives, organic acids and sugar alcohols in root exudates increased significantly under high concentration combined pollutant treatment. The complexation of TC and Cd decreased the bioavailability of Cd, and alleviated the toxicity of Cd under high concentration treatment on rice, which increased the secretion of organic acids, amino acids and derivatives and sugar alcohols for detoxication. The results of this study can provide reference data for ensuring the safe production of rice and establishing effective rhizosphere regulation measurement for the control of antibiotic-heavy metal combined pollution.
Keywords: tetracyclinecadmiumriceroot growthaccumulationroot exudates
1 引言(Introduction)近年来, 随着畜禽养殖业和饲料工业的规模化发展, 养殖废物大量肥料化施用(Peng et al., 2019; Kabelitz et al., 2020), 加之污水灌溉(Negreanu et al., 2012; Mehmood et al., 2019), 导致农田土壤普遍存在重金属和抗生素复合污染.我国多个地区施放畜禽粪便和有机肥的农业土壤中存在μg·kg-1~mg·kg-1级水平的抗生素积累(Pan et al., 2011; Hou et al., 2015; Fang et al., 2015), 而残留于土壤中的四环素类抗生素具有较高的水溶性和较长的半衰期, 使其相对持久地滞留于土壤环境中(Hou et al., 2015; Albero et al., 2018), 并影响蔬菜和粮食作物的生长(Liu et al., 2018; 迟荪琳等, 2018).2014年《全国土壤污染状况调查公报》显示, 我国农用地土壤镉(Cd)的点位超标率为7.0%, 位居污染物首位.Cd作为生物体的非必需元素, 具有较强的流动性和潜在生物毒性(Li et al., 2017), 因其易被水稻等作物吸收和积累(Chiao et al., 2019; Gray et al., 2020)而倍受关注.重金属可以与抗生素发生络合作用(Tong et al., 2015), 对植物产生协同、加和、拮抗等复杂的作用, 改变两种污染物在根际微生态系统中的环境行为, 并直接影响作物或植物的生长、新陈代谢、生理和衰老(马莎, 2013).有研究表明, 四环素(TC)对小白菜的生长发育具有明显的抑制作用, Cd与TC复合污染可导致危害加剧, 表现出显著的协同效应(马莎, 2013);Lu等(2016)发现铜(Cu)与TC的相互作用会显著抑制水葫芦的养分吸收及生长;而Sayen等(2019)证实Cu的存在有利于抗生素以两性离子或者Cu-TC络合物形式在芦苇中的吸收积累.
水稻作为我国主要的粮食作物(Hu et al., 2016), 分蘖期营养生长迅速, 根系对环境响应更敏感(马场赳, 1976).植物根系是吸收矿质养分和水分的重要器官, 也是最先感知土壤逆境胁迫的部位, 其根系生长及根际微生态的相应改变是植物应激保护及生理响应的直接表现.植物可通过细胞及根系分泌物来改变根际土壤pH值、氧化还原条件和微生物群落等(Hu et al., 2018), 或通过螯合作用和还原作用, 改变根际养分及有害物质的溶解度和移动性(Chen et al., 2016), 进而调节植物对这些物质的吸收和利用来维持植物的稳态(Ghori et al., 2019).植物根系分泌物的组成及含量的变化趋势直接或间接响应植物新陈代谢及生长发育作用(Lapie et al., 2019).研究发现, 水稻细胞和根系分泌物中的低分子量有机酸是根际效应的重要还原剂(Yao et al., 2018), 苹果酸、柠檬酸和色氨酸能够减轻Cd对水稻根系发育的抑制作用, 并能通过螯合金属离子有效抑制Cd在水稻各器官的转移, 显著降低稻米中Cd含量(张烁, 2018; 李化欣, 2018).微囊藻毒素能导致水稻根系分泌出更多的酒石酸、苹果酸、溶解性有机碳(DOC)和碳水化合物(Cao et al., 2018).目前, 相关研究侧重于抗生素或重金属单一污染对植物养分吸收及其生长的影响, 而关于抗生素-重金属复合污染对植物根系影响的研究鲜有报道.
为了科学认识抗生素和重金属共存对植物根系的影响机制, 本研究以水稻为对象, 采用水培试验考察TC与Cd单一和复合污染对分蘖期水稻根系生长的影响, 包括水稻根系生长、污染物积累和根系分泌物及相关生理作用的变化特征, 以期为保障水稻安全生产, 建立有效控制抗生素-重金属类复合污染的根际调控措施提供参考数据.
2 材料与方法(Materials and methods)2.1 实验材料2.1.1 水稻供试常规稻“黄华占”, 属中等耐Cd品种(杨明等, 2017), 由华南农业大学选育, 纯度不低于99.0%, 发芽率不低于85%.
2.1.2 化学试剂四环素(TC), 化学式为C22H24N2O8·HCl, 纯度≥99.0%, 购自Adamas-bata公司, 2~8 ℃保存;CdCl2, 纯度99.99%, K2SO4、KH2PO4、NaCl、H3BO3、Fe(u)-EDTA及其他试剂均为分析纯, 购自阿拉丁试剂有限公司;甲醇、乙腈为色谱纯, 购自上海安普科学仪器有限公司;盐酸、硝酸、高氯酸、氢氧化钠为分析纯, 购自广州化学试剂厂.
2.2 植物培养水培营养液配方(Huang et al., 2019)如表 1所示, 营养液pH值用适量HCl和NaOH溶液调节至5.5~6.5.选取饱满一致的种子进行翻晒、浸种, 30%的H2O2溶液浸泡30 min消毒, 超纯水洗净、育苗.在湿润培养皿中恒温培养(28 ℃, 黑暗)催芽, 出芽后, 转移至一定浓度营养液中培养(28 ℃, 黑暗12 h, 光照12 h)至三叶一心, 其营养液从1/8浓度依次增大至全营养液浓度.选取健壮、长势一致的幼苗, 移栽至装有全营养液的水培箱(锡箔纸避光)进行培养至分蘖期, 营养液每5 d更换一次.胁迫处理28 d后取样分析, Cd浓度设置为0、1、10和45 μmol·L-1, TC浓度设置为0、5、10和25 μmol·L-1, 设置3个重复, 处理期间每天观察水稻生长情况.
表 1(Table 1)
| 表 1 Kimura B(木村)营养液配方 Table 1 The Kimura B nutrient solution formula | ||||||||||||||||||||||||||||||||||
表 1 Kimura B(木村)营养液配方 Table 1 The Kimura B nutrient solution formula
| ||||||||||||||||||||||||||||||||||
2.3 营养液中Cd与TC的形态分析利用化学平衡软件Visual MINTEQ 3.1计算营养液中Cd与TC的形态(Gustafsson, 2012; 顾雪元等, 2018; 欧阳卓智, 2020).
2.4 测定项目与方法2.4.1 水稻生长生理指标测定叶绿素含量通过叶绿素测定仪(型号:SPAD-502 Plus)进行测量, 取第2片叶子的平均值;蒸腾量采用称重法测定.水稻收获后经自来水冲洗根部以释放根际溶液, 超纯水洗净, 滤纸吸干, 测量各处理水稻根伸长量(根伸长量为最长根的根尖到根茎之间的距离), 称取根部鲜重, 经冷冻干燥48 h后称取干重, 粉碎机粉碎至粉末后密封保存.统计叶绿素含量、蒸腾量、根伸长量和根部生物量等.
2.4.2 水稻根部污染物积累指标测定Cd测定方法如下(卢毅欣等, 2019):水稻根部样品利用石墨炉消解仪(型号:DS-360L)进行湿式消解, 容量瓶定容, 过0.22 μm水系滤膜, 待火焰原子吸收分光光度计(型号:PinAAcle900T)测定Cd浓度.
TC的提取及分析流程为(Zhang et al., 2019):将水稻根部样品加入到提取缓冲溶液中, 涡旋振荡30 min, 离心后提取上清液, 重复3次, 合并上清液, 45 ℃真空旋转蒸发浓缩.HLB萃取净化小柱预先用6 mL甲醇活化, 6 mL超纯水过柱, 样品过柱后, 用6 mL超纯水冲洗, 低真空下小柱干燥10 min;用6 mL甲醇洗脱TC, 过0.22 μm有机系滤膜, 待高效液相色谱仪(HPLC, 安捷伦1260)测定.
提取缓冲溶液为含有20% 0.01 mol·L-1草酸甲醇的丙酮溶液和0.1 mol·L-1 Na2EDTA-Mellvaine缓冲液的等体积溶液(V/V=50% ∶ 50%).
HPLC测定参数:色谱柱为Luna, C18(2)型色谱柱(250 mm×4.6 mm, 5 μm);流动相为乙腈和0.01 mol·L-1的草酸水溶液(V/V=20% ∶ 80%);检测器为紫外检测器;检测波长为360 nm;流速为1 mL·min-1;进样量为50 μL;出峰时间为8.1 min.
2.4.3 水稻根系分泌物的收集测定收获的水稻根系经自来水、超纯水洗净, 用0.2 mmol·L-1 CaCl2溶液浸泡2 h以维持根细胞的渗透环境(Oburger et al., 2018), 超纯水洗净, 用海绵固定置于装有超纯水的三角瓶(黑袋包裹避光)中, 培养24 h收集根系分泌物, 加入micropur抑菌剂, 多样品平行蒸发定量浓缩仪(型号:Syncore Analyst)浓缩, 过0.22 μm水系滤膜后储存于-20 ℃冰箱, 待超高分辨四极杆组合静电场轨道阱液质联用仪(HRAM LC-MS/MS, 型号:Q Exactives)测定成分.
2.5 数据处理运用Excel 2010和IBM SPSS Statistics 23计算各指标平均值及标准误差, 并进行单因素ANOVA方差齐性检验和LSD-T2多重比较差异性显著性分析(p < 0.05);运用Thermo Scientific Xcalibur进行HRAM LC-MS/MS数据采集和处理;并采用Origin 9.1绘制数据图.
3 结果与讨论(Results and discussion)3.1 营养液中Cd和TC形态的分布由于TC具有一定的络合能力, 与Cd共存可能发生络合反应, 形成络合物, 进而影响二者的生物可利用性.使用Visual MINTEQ 3.1对水培营养液中不同浓度配比TC与Cd的形态分布进行了计算, 结果如表 2所示.TC与Cd单一/复合污染条件下, TC主要以H2TC形态(97.6%~98.7%)较稳定存在, 这与相关研究结果一致(Zhao et al., 2013);高浓度Cd(10.0和45.0 μmol·L-1)存在时, 约0.03%~0.18%的TC以CdTC形态存在.单一Cd(1.0、10.0和45.0 μmol·L-1)处理浓度增大, 营养液中游离Cd2+含量显著增加, 分别占89.1%、95.0%和98.2%;但TC的加入减少了游离Cd2+的比例, 有少部分的Cd(0.03%~0.16%)与TC形成CdTC复合物, 其含量随TC(5.0、10.0和25.0 μmol·L-1)处理浓度的增大而有所增加.有研究表明(Sayen et al., 2019), 恩诺沙星(Enro)与Cu共存时形成的Cu-Enro复合物, 降低了芦苇对Cu的吸收.因此, 高浓度TC存在更有利于CdTC复合物的形成, 降低Cd的生物可利用性, 导致水稻根系对Cd的吸收有所减少(图 1b).
表 2(Table 2)
| 表 2 营养液中Cd与TC形态的分布(pH=5.50) Table 2 Distribution of speciation of Cd and TC in nutrient solution(pH=5.50) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2 营养液中Cd与TC形态的分布(pH=5.50) Table 2 Distribution of speciation of Cd and TC in nutrient solution(pH=5.50)
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
图 1(Fig. 1)
 |
| 图 1 TC与Cd单一/复合污染下的水稻根系TC积累量(a)和Cd积累量(b) Fig. 1TC (a) and Cd (b) accumulation in rice roots under single and combined treatment of TC and Cd |
3.2 水稻根系污染物积累3.2.1 对TC的积累TC与Cd单一/复合污染下水稻根系TC的积累情况如图 1a所示.水稻根部TC含量随TC处理浓度的增加而显著增加, 呈现明显剂量效应(p < 0.01), 单一TC处理浓度为5.0、10.0和25.0 μmol·L-1时, 水稻根部TC的积累量分别为90.69、188.47和545.99 mg·kg-1.相比于单一TC污染, Cd的存在可协同促进水稻根部对TC(5.0、10.0和25.0 μmol·L-1)的积累, 且积累量随着Cd(1.0、10.0和45.0 μmol·L-1)浓度的增大而显著大幅增加, 可能是由于Cd的加入通过表面桥接机制促进了TC在根系表面的吸附, 进而促进其积累(Figueroa et al., 2004).高浓度Cd(45.0 μmol·L-1)促进水稻根系对TC的吸收更为显著, 相比于单一TC(5.0、10.0和25.0 μmol·L-1)处理分别增加了146.10%、162.73%和58.32%, 水稻由于自身的防护机制, 根系细胞壁的增厚及木质化能够防止有害物质进入细胞内, 表现出一定的耐受能力(Cheng et al., 2014; Han et al., 2019);而随着TC/Cd投加量增加, 形成的协同联合毒性可能损坏水稻根细胞的完整性, 增大质膜透性使得更多的TC及其配合物透过根细胞膜进入细胞, 增大水稻根系中TC的积累(Dalcorso et al., 2010; Rizwan et al., 2017).这与Cd和磺胺二甲基嘧啶(SMT)复合污染对白菜根系吸收SMT稍有差异, Cd(1、5和10 mg·kg-1)的存在显著增加了白菜根系对SMT(1 mg·kg-1)的吸收, 但减小了高浓度STM(10 mg·kg-1)在根系的积累(卢毅欣等, 2019; Zhou et al., 2021).这可能与TC(亲水性)/SMT(疏水性)两者极性的不同、抗生素与Cd金属络合作用及其联合毒性有关.
3.2.2 对Cd的积累TC与Cd单一/复合污染下水稻根系Cd的积累情况如图 1b所示.水稻根部Cd的含量随着Cd处理浓度的增加而显著增加, 呈现明显剂量效应(p < 0.01).复合污染条件下, 与根部对TC的吸收情况不同的是, 加入TC后水稻根部Cd的积累量显著增加, 但高浓度TC(10.0和25.0 μmol·L-1)的处理出现下降的趋势, 与相关研究结果类似(卢毅欣等, 2019; Zhou et al., 2021), 水稻根部Cd(5 mg·L-1)的含量随SMT(0.5、2和10 mg·L-1)投加量的增大而先增加后减少.这意味着TC与Cd的复合污染能够在一定程度上促进Cd在水稻根部的积累, 低剂量TC(5.0 μmol·L-1)的促进作用更明显, 相比于单一Cd(1.0、10.0和45.0 μmol·L-1)污染, 可分别增加17.66%、38.32%和14.94%.这可能与TC和Cd不同浓度配比的络合作用强弱及Cd的生物可利用性有关, TC的加入会减少游离Cd2+含量(表 2), 进而降低Cd的生物可利用性.Tong等(2015)研究表明, TC与Cd之间存在络合作用, 且表现出轻微的协同毒性.低剂量TC的加入可能作为碳源, 为水稻及根际微生物的生长提供营养, 促进根系生长(图 2), 增加水稻根系对Cd的亲和力而增大其积累;但更多TC的存在会增强TC-Cd络合作用, 从而降低Cd的生物可利用性, 且可能与Cd竞争根系表面结合位点, 增大气孔阻力, 导致根系对Cd的吸收减少(Zhang et al., 2012; 卢毅欣等, 2019).
图 2(Fig. 2)
 |
| 图 2 TC与Cd单一/复合污染下的水稻根部生物量(a)及根伸长量(b) Fig. 2Root biomass (a) and root elongation (b) of rice under single and combined treatment of TC and Cd |
为进一步探究TC和Cd复合污染增强Cd/TC在水稻根部积累的作用是否与两者的交互作用有关, 本研究对TC与Cd单一/复合污染影响Cd或TC在水稻根部的积累进行双因素方差分析, 结果如表 3所示.复合污染下, Cd-TC的交互作用对Cd在水稻根部的积累有显著(p < 0.05)影响, 而对TC在根部的积累影响不显著.
表 3(Table 3)
| 表 3 TC与Cd浓度及交互作用对水稻根部吸收Cd/TC的双因素方差分析 Table 3 Two-way ANOVA for Cd, TC and their interactions on Cd or TC accumulation in rice root | ||||||||||||||||||||||||||||||||||||||||||
表 3 TC与Cd浓度及交互作用对水稻根部吸收Cd/TC的双因素方差分析 Table 3 Two-way ANOVA for Cd, TC and their interactions on Cd or TC accumulation in rice root
| ||||||||||||||||||||||||||||||||||||||||||
3.3 水稻根系生长根系是植物吸收养分和水分的主要器官, 也是最先感知逆境胁迫的部位, 植物根伸长的相应改变是其应激保护的生理响应, 根部生物量能直观反映植物是否受毒害作用.研究发现, TC与Cd单一/复合污染条件下均能影响水稻根系的生长(图 2), 低浓度复合污染可促进水稻根系的生长, 而高浓度复合污染会产生抑制作用.
3.3.1 TC与Cd单一污染的影响单一TC或者Cd污染对水稻根部生物量和根伸长量的影响分别呈现出逐渐减少和先增加后减少的变化趋势(图 2a和图 2b), 表现出毒害作用, 抑制水稻根系的生长.TC对水稻根部生物量的抑制作用更明显, 当TC浓度达到10.0 μmol·L-1时, 水稻根部生物量显著减少, 相对于空白对照减少了18.04%;当浓度达到25.0 μmol·L-1时, 水稻根部生物量极显著地减少, 仅为空白对照组根部生物量的69.69%.低浓度TC/Cd处理的水稻根伸长量均较空白对照有所增加, 在10.0 μmol·L-1 Cd和5.0 μmol·L-1 TC条件下达到最大伸长量, 分别相对于对照增加了15.14%和15.47%.可能是低剂量毒物引起水稻根系的刺激反应, “过度补偿”促进根的伸长, 即“毒物兴奋效应”(Stebbing, 1982).有研究表明, 植物在低浓度Cd胁迫下, 可通过协调营养代谢补充抗氧化机制以保护其生长(Gill et al., 2012).随毒物剂量升高, 其毒性效应使水稻生长受到抑制, 导致根伸长量减小;而高浓度Cd胁迫的水稻根伸长量与空白对照相比差异不明显, 可能是因为水稻具有较高的Cd金属耐受能力和自我防护机制(Jwa et al., 2006).这与相关研究结果类似, 低浓度Cd可促进金银花和玫瑰花根系的生长, 而在土壤Cd浓度较高时产生抑制作用(Liu et al., 2008);低浓度抗生素对花生、水稻根系的生长有促进作用, 而高浓度的抗生素则对根系活力有明显的限制作用, 会破坏作物的生理结构而明显抑制其生长(顾国平等, 2016; Devireddy et al., 2017; Riaz et al., 2017; Liu et al., 2018).
3.3.2 TC与Cd复合污染的影响TC与Cd的复合污染对水稻根系生长的影响表现出低浓度协同促进和高浓度协同抑制作用(图 2a和图 2b).相比于低浓度Cd(1.0 μmol·L-1)单一污染, 随着加入TC(5.0、10.0和25.0 μmol·L-1)浓度的增大, 水稻根部生物量和根伸长量均呈现出先增加后减少的趋势.当高浓度Cd(10.0和45.0 μmol·L-1)存在时, TC与Cd的协同毒性作用导致水稻根部生物量显著减小, 也抑制了水稻根的伸长;45.0 μmol·L-1 Cd+10.0 μmol·L-1 TC和45.0 μmol·L-1 Cd+25.0 μmol·L-1 TC处理显著抑制水稻根的伸长, 根伸长量相比于空白对照分别减少了18.15%和21.65%.TC与Cd之间的弱络合和较轻微的协同联合毒性(Tong et al., 2015), 导致水稻根伸长量在低浓度复合污染下有所增加而高浓度产生抑制作用, 这可能是因为水稻根系对于较低剂量毒物的应激反应(Lu et al., 2016), 增强了水稻的营养吸收而缓解TC/Cd对水稻根系生长的抑制作用.随TC/Cd处理浓度的增加, 其剂量效应使得更多的毒物及配合毒物透过根细胞膜进入根部细胞, 协同联合毒性增强, 显著抑制了水稻根系生长, 降低了水稻根伸长量和根部生物量(Kuang et al., 2016; Zhou et al., 2021).
3.4 水稻生理作用叶绿素含量是反映植物叶片生长生理情况的一个重要指标, 也可以一定程度地反映水稻光合作用能力.TC与Cd单一污染均使水稻叶片叶绿素含量逐渐下降, 其中, TC的影响较明显(图 3a), 表明水稻叶片受TC/Cd毒害作用不尽相同.随TC处理浓度逐渐升高, 水稻叶片叶绿素含量相对于空白对照不断降低, 下降幅度最大达23.32%;而Cd单一污染条件下, 水稻叶片叶绿素含量差异并不显著.这可能是由于TC的亲水性使其更容易被水稻吸收并通过木质部向上运输至叶片(图 4a和图 4b).研究表明(Rydzyński et al., 2019), 四环素类抗生素能够抑制叶绿体合成酶的活性, 刺激过氧化氢的生成, 导致叶绿体功能受损、气孔减少从而显著影响光合作用, 而Cd可通过取代镁元素抑制叶绿素的合成来抑制水稻的光合作用.对比TC单一污染, Cd(1.0、10.0 μmol·L-1)的加入能够在一定程度上减缓水稻叶片叶绿素含量的降低, 但Cd浓度增大至45.0 μmol·L-1时, 水稻叶片叶绿素含量再次呈现下降趋势, 表明TC与Cd低浓度复合污染能够在一定程度上缓解TC对水稻叶片的毒害作用, 使水稻叶绿素含量有所增加.这可能是因为TC与Cd共存时产生的络合作用及Cd离子与TC在水稻根系表面的桥连机制(Figueroa et al., 2004; Tong et al., 2015), 将TC更多地赋集在根系, 抑制其向叶片运输(图 4a), 但两者高浓度联合毒性会抑制水稻生长, 进而抑制水稻光合作用.
图 3(Fig. 3)
 |
| 图 3 TC与Cd单一/复合污染下的水稻叶片叶绿素含量(a) 及植株蒸腾量(b) Fig. 3Leaf chlorophyll content (a) and plant transpiration (b) of rice under single and combined treatment of TC and Cd |
图 4(Fig. 4)
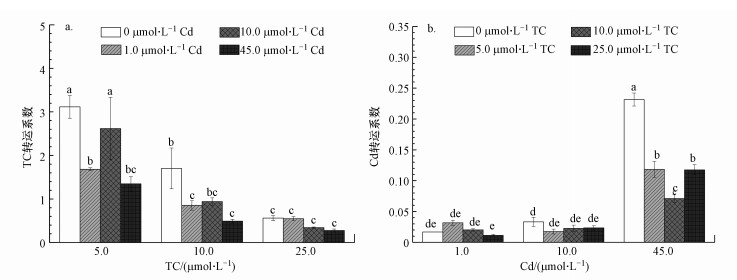 |
| 图 4 TC与Cd单一/复合污染下的水稻TC (a)和Cd (b) 的转运系数 Fig. 4Transport coefficient of TC (a) and Cd (b) in rice under single and combined treatment of TC and Cd |
水稻植株蒸腾量能反映植物的生长代谢作用.TC与Cd单一污染均使水稻植株蒸腾量呈现出先增加后减少的变化趋势(图 3b).水稻植株蒸腾量在1.0 μmol·L-1 Cd胁迫下相比于空白对照增加了46.21%;但随Cd处理浓度升高, 水稻植株蒸腾量相对于空白对照不断降低, 下降幅度最大达31.79%.水稻植株蒸腾量的增加可能是由于水稻在低剂量毒物下的“毒物兴奋效应”(Stebbing, 1982);而随毒物剂量的升高, 水稻自身调节机制能通过抑制蒸腾作用诱导保水活性而提高耐受性(Takahashi et al., 2017).TC(5.0、10.0和25.0 μmol·L-1)单一污染条件下, 水稻植株蒸腾量均相比于空白对照有所增加, 分别增加了58.53%、11.55%和14.72%, 可能是因为TC胁迫能够为植物生长提供碳源而促进其生长代谢, 但随剂量的增大, 水稻的自身调节作用使植株蒸腾量出现下降趋势.TC与Cd复合污染条件下, 随着TC(5.0、10.0和25.0 μmol·L-1)处理浓度的升高, 水稻植株蒸腾量相对于较低Cd(1.0 μmol·L-1)单一污染不断降低, 下降幅度最大达32.63%;而相对于较高Cd(10.0 μmol·L-1)单一污染不断增加, 分别增加了13.80%、12.34%和26.17%;但相比于高浓度Cd(45.0 μmol·L-1)单一污染呈现先增加后减少的趋势. 水稻植株蒸腾量在TC与Cd复合污染下的差异可能与污染物络合作用强弱及植物防御机制有关(Tong et al., 2015; Takahashi et al., 2017; Naeem et al., 2018).低剂量复合污染下, 水稻对蒸腾作用有所限制, 提高保水活性并增强耐受能力;随着毒物剂量的升高, TC与Cd的络合作用可降低Cd的生物有效性(表 2), 减缓Cd对水稻蒸腾作用的限制, 导致植株蒸腾量有所增加;当达到一定剂量后, TC与Cd的联合毒性可对水稻产生毒害作用, 抑制水稻生长而降低植株蒸腾量.
3.5 水稻根系分泌物TC与Cd单一/复合污染下水稻根系分泌物的总有机碳含量如图 5所示.TC与Cd单一污染均可抑制水稻根系分泌物的分泌, 并呈现明显的剂量效应, 其中, Cd的作用更为显著.复合污染条件下, 根系分泌物的变化略为复杂.对比Cd单一污染, 随着TC(5.0、10.0和25.0 μmol·L-1)的加入, 水稻植株蒸腾量相对于较低单一Cd(1.0 μmol·L-1)污染不断降低, 分别减少了1.41%、4.07%和12.69%;而相对于较高Cd(10.0 μmol·L-1)污染不断增加, 分别增加了36.63%、48.16%和48.73%;但当Cd处理浓度为45.0 μmol·L-1时, TC的加入抑制了水稻根系分泌物的分泌, 这与TC和Cd复合污染下水稻植株蒸腾量的变化趋势基本一致(图 3b).这可能与TC和Cd共存对水稻光合作用、蒸腾代谢作用及根膜通透性、细胞完整性造成影响有关.有研究表明(Haichar et al., 2014), 植物光合作用产物会转移至地下部, 以根系分泌物的形式排出, 其中约5%~25%的光合固定碳通过根系分泌物转移到根际.TC与Cd低浓度复合污染能够缓解TC/Cd对水稻光合作用的抑制且促进蒸腾(图 3), 提高水分利用率(Nwugo et al., 2008), 使更多的根系分泌物释放到根际环境中;但高浓度复合污染可能导致根系细胞完整性受损(Scandalios, 2005), 从而抑制根系分泌物的分泌.有研究表明, 植物根系在根际会不断释放出分泌物, 其成分、数量和含量受到植物种类、环境条件等多种因素的影响, 其分泌量可能与根膜通透性、细胞完整性有关(Javed et al., 2017).
图 5(Fig. 5)
 |
| 图 5 TC与Cd单一/复合污染下的水稻根系分泌物的总有机碳含量 Fig. 5Total organic carbon content of rice root exudates under single and combined treatment of TC and Cd |
为进一步明确TC与Cd复合污染对水稻根系分泌物的影响, 利用HRAM LC-MS/MS半定量测定水稻根系分泌物种类和含量, 结果表明, 根系分泌物中有机酸类、植物激素及核酸类、氨基酸及衍生物类和糖醇类物质含量在TC与Cd单一/复合污染下存在明显差异(表 4).水稻根系分泌物的种类在TC与Cd的单一污染下有所减少.空白对照水稻根系分泌物的126个物质中主要为有机酸类、植物激素及核酸类和氨基酸及衍生物类, 3类物质占比超过70.00%, 而糖醇类物质仅占0.50%.植物防御逆境胁迫过程中, 根系分泌物中的有机酸类、糖醇类和氨基酸类物质具有重要作用.糖醇是植物生理中的重要物质之一, 其参与保护了植物渗透压和氧化应激作用(Singh et al., 2015).Fu等(2018)证实了Cd胁迫下水稻根系分泌有机酸的增加是其根系应对环境胁迫的主动反应而非细胞完整性受损, 有机酸含多个活性基团, 能有效地螯合Cd而降低其生物有效性和毒性作用(Nigam et al., 2001), 缓解水稻的质膜损伤(Zhang et al., 2019);而氨基酸可以抑制植物的氧化损伤(Fu et al., 2018).Cd单一污染下, 根系分泌物中有机酸类、植物激素及核酸类、氨基酸及衍生物类和糖醇类物质含量在Cd(10.0 μmol·L-1)处理时有所增加;并随着Cd(45.0 μmol·L-1)浓度的增大而有所减少.在TC(10.0 μmol·L-1)单一胁迫下, 根系分泌物中有机酸类和糖醇类物质含量相比于空白对照有所增加, 而植物激素及核酸类和氨基酸及衍生物类物质含量有所减少;且随着TC(25.0 μmol·L-1)处理浓度的增大, 氨基酸及衍生物类含量有所增加而其他3类物质含量呈现下降的趋势.即Cd污染胁迫可能刺激水稻根系分泌物中有机酸类、氨基酸及衍生物类和糖醇类物质的分泌来保护植物渗透压和氧化损伤;而根系分泌物中有机酸类和糖醇类物质含量的增加应对TC的污染胁迫.但随着Cd/TC浓度的升高, 剂量效应使水稻根系积累污染物增加(图 1), 过量的活性氧与脂质和蛋白质反应导致酶失活和膜损伤, 导致根系细胞完整性受损(Scandalios, 2005)而抑制根系分泌物的分泌, 进而减小参与植物防御作用的成分含量.复合污染条件下, 根系分泌物各类物质的含量变化略为复杂.TC与Cd的复合污染对根系分泌物中植物激素及核酸类物质含量的影响表现出低浓度(10.0 μmol·L-1 TC+10.0 μmol·L-1 Cd)拮抗抑制和高浓度(25.0 μmol·L-1 TC+45.0 μmol·L-1 Cd)协同抑制作用, 这可能与TC与Cd低浓度复合污染能够在一定程度上缓解TC对水稻叶片的毒害作用而增强光合作用(图 3a)及促进生长代谢(图 3b)有关.而高浓度复合污染(25.0 μmol·L-1 TC+45.0 μmol·L-1 Cd)对根系分泌物中氨基酸及衍生物类、有机酸类和糖醇类物质含量的影响表现为拮抗作用, 其含量相比于单一Cd(45.0 μmol·L-1)污染胁迫显著增加.这可能是因为高剂量的TC与Cd络合能降低Cd的生物可利用性(表 2)(卢毅欣等, 2019), 缓解高浓度Cd胁迫对水稻的毒性作用, 进而增加有机酸类、氨基酸及衍生物类和糖醇类物质的分泌来增强自身防护作用(Nigam et al., 2001; Singh et al., 2015; Fu et al., 2018; ;Zhang et al., 2019).
表 4(Table 4)
| 表 4 TC与Cd单一/复合污染下水稻根系分泌物的种类和含量 Table 4 Species and contents of rice root exudates under single and combined treatment of TC and Cd | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 4 TC与Cd单一/复合污染下水稻根系分泌物的种类和含量 Table 4 Species and contents of rice root exudates under single and combined treatment of TC and Cd
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
4 结论(Conclusions)1) 水稻根系对TC与Cd的吸收积累呈现出显著的剂量效应, 且复合污染起协同作用.
2) TC与Cd单一污染可抑制水稻根系生物量和叶片叶绿素含量, 由于“毒物兴奋效应”, 低剂量单一污染可促进水稻根的伸长和蒸腾作用, 而在高剂量下表现出抑制.低剂量的TC与Cd复合污染能够缓解其毒性.
3) TC与Cd的单一污染能显著抑制水稻根系分泌物的分泌, 呈现剂量效应, Cd的影响更为明显;TC与Cd低浓度复合污染对水稻光合作用的缓解及伴随着蒸腾作用的提升, 能促进水稻根系分泌物的分泌, 但高浓度复合污染胁迫则可能使根系细胞完整性受损, 从而抑制根系分泌物的分泌.根系分泌物中参与植物防御作用的成分变化规律有所不同;TC与Cd单一污染时, 水稻根系分泌物中有机酸类、氨基酸及衍生物类和糖醇类物质含量升高, 激活植物的自我防护作用, 但导致植物激素及核酸类物质含量降低.高浓度复合污染(25.0 μmol·L-1 TC+45.0 μmol·L-1 Cd)对根系分泌物中氨基酸及衍生物类、有机酸类和糖醇类物质含量的影响表现为拮抗作用, 其含量相比于Cd(45.0 μmol·L-1)单一污染胁迫显著增加, 有利于缓解Cd高浓度胁迫对水稻的毒性作用, 增强自我防护作用.
参考文献
| Albero B, Tadeo J L, Escario M, et al. 2018. Persistence and availability of veterinary antibiotics in soil and soil-manure systems[J]. Science of the Total Environment, 643: 1562-1570. DOI:10.1016/j.scitotenv.2018.06.314 |
| Cao Q, Rediske R R, Yao L, et al. 2018. Effect of microcystins on root growth, oxidative response, and exudation of rice (Oryza sativa)[J]. Ecotoxicology and Environmental Safety, 149: 143-149. DOI:10.1016/j.ecoenv.2017.11.020 |
| Chen J, Shafi M, Wang Y, et al. 2016. Organic acid compounds in root exudation of Moso Bamboo (Phyllostachys pubescens) and its bioactivity as affected by heavy metals[J]. Environmental Science and Pollution Research, 23(20): 20977-20984. DOI:10.1007/s11356-016-7323-8 |
| Cheng H, Jiang Z Y, Liu Y, et al. 2014. Metal (Pb, Zn and Cu) uptake and tolerance by mangroves in relation to root anatomy and lignification/suberization[J]. Tree Physiology, 34(6): 646-656. DOI:10.1093/treephys/tpu042 |
| Chiao W, Syu C, Chen B, et al. 2019. Cadmium in rice grains from a field trial in relation to model parameters of Cd-toxicity and-absorption in rice seedlings[J]. Ecotoxicology and Environmental Safety, 169: 837-847. DOI:10.1016/j.ecoenv.2018.11.061 |
| 迟荪琳, 王卫中, 徐卫红, 等. 2018. 四环素类抗生素对不同蔬菜生长的影响及其富集转运特征[J]. 环境科学, 39(2): 935-943. |
| Dalcorso G, Farinati S, Furini A. 2010. Regulatory networks of cadmium stress in plants[J]. Plant Signal Behav, 5(6): 663-667. DOI:10.4161/psb.5.6.11425 |
| Devireddy A R, Inupakutika M A, Willmon D, et al. 2017. Veterinary antibiotics influence trigonelline biosynthesis and plant growth in Arachis hypogaea L[J]. Acta agriculturae Scandinavica.Section B, Soil and Plant Science, 67(3): 245-251. |
| Fang H, Wang H, Cai L, et al. 2015. Prevalence of antibiotic resistance genes and bacterial pathogens in long-term manured greenhouse soils as revealed by metagenomic survey[J]. Environmental Science & Technology, 49(2): 1095-1104. |
| Figueroa R A, Leonard A, Mackay A A. 2004. Modeling tetracycline antibiotic sorption to clays[J]. Environmental Science & Technology, 38(2): 476-483. |
| Fu H, Yu H, Li T, et al. 2018. Influence of cadmium stress on root exudates of high cadmium accumulating rice line (Oryza sativa L.)[J]. Ecotoxicology and Environmental Safety, 150: 168-175. DOI:10.1016/j.ecoenv.2017.12.014 |
| 顾国平, 章明奎. 2016. 兽药土霉素对水稻幼苗根系及部分生理特性的影响[J]. 浙江农业学报, 28(2): 190-194. DOI:10.3969/j.issn.1004-1524.2016.02.02 |
| 顾雪元, 艾弗逊, 张云燕. 2018. Visual MINTEQ软件在环境化学教学中的应用[J]. 实验室研究与探索, 37(11): 165-167, 176. DOI:10.3969/j.issn.1006-7167.2018.11.042 |
| Ghori N H, Ghori T, Hayat M Q, et al. 2019. Heavy metal stress and responses in plants[J]. International Journal of Environmental Science and Technology, 16(3): 1807-1828. DOI:10.1007/s13762-019-02215-8 |
| Gill S S, Khan N A, Tuteja N. 2012. Cadmium at high dose perturbs growth, photosynthesis and nitrogen metabolism while at low dose it up regulates sulfur assimilation and antioxidant machinery in garden cress (Lepidium sativum L.)[J]. Plant Science, 182: 112-120. DOI:10.1016/j.plantsci.2011.04.018 |
| Gray C W, Wise B E. 2020. Mitigating cadmium accumulation in spinach and onions by the application of silicon fertilizer to soil[J]. Soil and Sediment Contamination: An International Journal, 29(5): 532-544. DOI:10.1080/15320383.2020.1747980 |
| Gustafsson J P. 2012. Visual MINTEQ 3.0 user guide[Z]. Dep. of Land & Water Resour. eng |
| Haichar F E Z, Santaella C, Heulin T, et al. 2014. Root exudates mediated interactions belowground[J]. Soil Biology and Biochemistry, 77: 69-80. DOI:10.1016/j.soilbio.2014.06.017 |
| Han T, Liang Y, Wu Z, et al. 2019. Effects of tetracycline on growth, oxidative stress response, and metabolite pattern of ryegrass[J]. Journal of Hazardous Materials, 380: 120885. DOI:10.1016/j.jhazmat.2019.120885 |
| Hou J, Wan W, Mao D, et al. 2015. Occurrence and distribution of sulfonamides, tetracyclines, quinolones, macrolides, and nitrofurans in livestock manure and amended soils of Northern China[J]. Environmental Science and Pollution Research, 22(6): 4545-4554. DOI:10.1007/s11356-014-3632-y |
| Hu L, Robert C A M, Cadot S, et al. 2018. Root exudate metabolites drive plant-soil feedbacks on growth and defense by shaping the rhizosphere microbiota[J]. Nature Communications, 9(1). DOI:10.1038/s41467-018-05122-7 |
| Hu Y, Cheng H, Tao S. 2016. The challenges and solutions for cadmium-contaminated rice in China: A critical review[J]. Environment International, 92-93: 515-532. DOI:10.1016/j.envint.2016.04.042 |
| Huang Y, Chen H, Reinfelder J R, et al. 2019. A transcriptomic (RNA-seq) analysis of genes responsive to both cadmium and arsenic stress in rice root[J]. Science of the Total Environment, 666: 445-460. DOI:10.1016/j.scitotenv.2019.02.281 |
| Javed M T, Akram M S, Tanwir K, et al. 2017. Cadmium spiked soil modulates root organic acids exudation and ionic contents of two differentially Cd tolerant maize (Zea mays L.) cultivars[J]. Ecotoxicology and Environmental Safety, 141: 216-225. DOI:10.1016/j.ecoenv.2017.03.027 |
| Jwa N, Agrawal G K, Tamogami S, et al. 2006. Role of defense/stress-related marker genes, proteins and secondary metabolites in defining rice self-defense mechanisms[J]. Plant Physiology and Biochemistry, 44(5/6): 261-273. |
| Kabelitz T, Ammon C, Funk R, et al. 2020. Functional relationship of particulate matter(PM) emissions, animal species, and moisture content during manure application[J]. Environment International, 143: 105577. DOI:10.1016/j.envint.2020.105577 |
| Kuang X, Gu J, Tie B, et al. 2016. Interactive effects of cadmium and Microcystis aeruginosa (cyanobacterium) on the growth, antioxidative responses and accumulation of cadmium and microcystins in rice seedlings[J]. Ecotoxicology, 25(8): 1588-1599. DOI:10.1007/s10646-016-1714-y |
| Lapie C, Leglize P, Paris C, et al. 2019. Profiling of main metabolites in root exudates and mucilage collected from maize submitted to cadmium stress[J]. Environmental Science and Pollution Research, 26(17): 17520-17534. DOI:10.1007/s11356-019-05168-0 |
| Li H, Luo N, Li Y W, et al. 2017. Cadmium in rice: Transport mechanisms, influencing factors, and minimizing measures[J]. Environmental Pollution, 224: 622-630. DOI:10.1016/j.envpol.2017.01.087 |
| Liu J, Zhou Q, Sun T, et al. 2008. Identification and chemical enhancement of two ornamental plants for phytoremediation[J]. Bulletin of Environmental Contamination and Toxicology, 80(3): 260-265. DOI:10.1007/s00128-008-9357-1 |
| Liu X, Lv Y, Xu K, et al. 2018. Response of ginger growth to a tetracycline-contaminated environment and residues of antibiotic and antibiotic resistance genes[J]. Chemosphere, 201: 137-143. DOI:10.1016/j.chemosphere.2018.02.178 |
| Lu X, Gao Y, Luo J, et al. 2016. Interactive effects of tetracyclines and copper on plant growth and nutrient uptake by eichhornia crassipes[J]. Clean-Soil Air Water, 44(1): 96-104. DOI:10.1002/clen.201400662 |
| 李化欣. 2018. 色氨酸对水稻镉离子吸收转运特性的影响[D]. 哈尔滨: 东北农业大学 |
| 卢毅欣, 杨琛, 李华峰, 等. 2019. 磺胺二甲嘧啶与镉单一和复合污染对生菜生长的影响[J]. 生态环境学报, 28(1): 160-169. |
| 马场赳. 1976. 水稻的生理[M]. 上海: 上海人民出版社. |
| 马莎. 2013. 四环素和重金属(Cu2+、Cd2+)单一及复合污染对小白菜的毒性效应研究[D]. 成都: 四川农业大学 |
| Mehmood A, Aslam Mirza M, Aziz Choudhary M, et al. 2019. Spatial distribution of heavy metals in crops in a wastewater irrigated zone and health risk assessment[J]. Environmental Research, 168: 382-388. DOI:10.1016/j.envres.2018.09.020 |
| Naeem A, Saifullah, Zia-Ur-Rehman M, et al. 2018. Silicon nutrition lowers cadmium content of wheat cultivars by regulating transpiration rate and activity of antioxidant enzymes[J]. Environmental pollution, 242(Pt A): 126-135. |
| Negreanu Y, Pasternak Z, Jurkevitch E, et al. 2012. Impact of treated wastewater irrigation on antibiotic resistance in agricultural soils[J]. Environmental Science & Technology, 46(9): 4800-4808. |
| Nigam R, Srivastava S, Prakash S, et al. 2001. Cadmium mobilisation and plant availability-the impact of organic acids commonly exuded from roots[J]. Plant and Soil, 230(1): 107-113. DOI:10.1023/A:1004865811529 |
| Nwugo C C, Huerta A J. 2008. Effects of silicon nutrition on cadmium uptake, growth and photosynthesis of rice plants exposed to low-level cadmium[J]. Plant and Soil, 311(1/2): 73-86. DOI:10.1007/s11104-008-9659-4 |
| 欧阳卓智. 2020. 复合污染下金属离子对抗生素氧化及光降解的影响机制[D]. 广州: 华南理工大学 |
| Oburger E, Jones D L. 2018. Sampling root exudates-Mission impossible?[J]. Rhizosphere, 6: 116-133. DOI:10.1016/j.rhisph.2018.06.004 |
| Pan X, Qiang Z, Ben W, et al. 2011. Residual veterinary antibiotics in swine manure from concentrated animal feeding operations in Shandong Province, China[J]. Chemosphere, 84(5): 695-700. DOI:10.1016/j.chemosphere.2011.03.022 |
| Peng H, Chen Y, Weng L, et al. 2019. Comparisons of heavy metal input inventory in agricultural soils in North and South China: A review[J]. Science of the Total Environment, 660: 776-786. DOI:10.1016/j.scitotenv.2019.01.066 |
| Riaz L, Mahmood T, Coyne M S, et al. 2017. Physiological and antioxidant response of wheat (Triticum aestivum) seedlings to fluoroquinolone antibiotics[J]. Chemosphere, 177: 250-257. DOI:10.1016/j.chemosphere.2017.03.033 |
| Rizwan M, Ali S, Adrees M, et al. 2017. A critical review on effects, tolerance mechanisms and management of cadmium in vegetables[J]. Chemosphere, 182: 90-105. DOI:10.1016/j.chemosphere.2017.05.013 |
| Rydzyński D, Piotrowicz-Cie?lak A I, Grajek H, et al. 2019. Chlorophyll degradation by tetracycline and cadmium in spinach (Spinacia oleracea L.) leaves[J]. International Journal of Environmental Science and Technology, 16(10): 6301-6314. DOI:10.1007/s13762-018-2142-8 |
| Sayen S, Rocha C, Silva C, et al. 2019. Enrofloxacin and copper plant uptake by Phragmites australis from a liquid digestate: Single versus combined application[J]. Science of the Total Environment, 664: 188-202. DOI:10.1016/j.scitotenv.2019.01.134 |
| Scandalios J G. 2005. Oxidative stress: molecular perception and transduction of signals triggering antioxidant gene defenses[J]. Brazilian Journal of Medical And Biological Research, 38(7): 995-1014. DOI:10.1590/S0100-879X2005000700003 |
| Singh M, Kumar J, Singh S, et al. 2015. Roles of osmoprotectants in improving salinity and drought tolerance in plants: A review[J]. Reviews in Environmental Science and Bio/Technology, 14(3): 407-426. DOI:10.1007/s11157-015-9372-8 |
| Stebbing A R D. 1982. Hormesis-the stimulation of growth by low levels of inhibitors[J]. Science of the Total Environment, 22(3): 213-234. DOI:10.1016/0048-9697(82)90066-3 |
| Takahashi N, Sunohara Y, Fujiwara M, et al. 2017. Improved tolerance to transplanting injury and chilling stress in rice seedlings treated with orysastrobin[J]. Plant Physiology and Biochemistry, 113: 161-167. DOI:10.1016/j.plaphy.2017.02.004 |
| Tong F, Zhao Y, Gu X, et al. 2015. Joint toxicity of tetracycline with copper(Ⅱ) and cadmium(Ⅱ) to Vibrio fischeri: effect of complexation reaction[J]. Ecotoxicology, 24(2): 346-355. DOI:10.1007/s10646-014-1383-7 |
| 杨明, 陈璐, 徐庆国, 等. 2017. 镉胁迫对不同水稻品种种子萌发和幼苗生长的影响[J]. 作物研究, 31(6): 659-663. |
| Yao Y, Zhang F, Wang M, et al. 2018. Thallium-induced oxalate secretion from rice (Oryza sativa L.) root contributes to the reduction of Tl(Ⅲ) to Tl(Ⅰ)[J]. Environmental and Experimental Botany, 155: 387-393. DOI:10.1016/j.envexpbot.2018.07.028 |
| Zhang X, Chen J, Liu X, et al. 2019. The relief effects of organic acids on Scirpus triqueter L.under pyrene-lead stress[J]. Environmental Science and Pollution Research, 26(16): 15828-15837. DOI:10.1007/s11356-019-04976-8 |
| Zhang Y, Cai X, Lang X, et al. 2012. Insights into aquatic toxicities of the antibiotics oxytetracycline and ciprofloxacin in the presence of metal: Complexation versus mixture[J]. Environmental Pollution, 166: 48-56. DOI:10.1016/j.envpol.2012.03.009 |
| Zhang Z, Ouyang Z, Yang J, et al. 2019. High mineral adsorption of glyphosate versus diethyl phthalate and tetracycline, during visible light photodegradation with goethite and oxalate[J]. Environmental Chemistry Letters, 17(3): 1421-1428. DOI:10.1007/s10311-019-00877-x |
| Zhao Y, Tan Y, Guo Y, et al. 2013. Interactions of tetracycline with Cd(Ⅱ), Cu(Ⅱ) and Pb(Ⅱ) and their cosorption behavior in soils[J]. Environmental Pollution, 180: 206-213. DOI:10.1016/j.envpol.2013.05.043 |
| Zhou C, Ma Q, Li S, et al. 2021. Toxicological effects of single and joint sulfamethazine and cadmium stress in soil on pakchoi (Brassica chinensis L.)[J]. Chemosphere, 263: 128296. DOI:10.1016/j.chemosphere.2020.128296 |
| 张烁. 2018. 苹果酸对水稻镉离子吸收转运特性的影响[D]. 哈尔滨: 东北农业大学 |
