
 , 雷建森, 王洋, 余豆, 董为, 张小芳, 郭凤麒, 张馨丹, 闫广轩
, 雷建森, 王洋, 余豆, 董为, 张小芳, 郭凤麒, 张馨丹, 闫广轩河南师范大学环境学院, 黄淮水环境与污染防治教育部重点实验室, 河南省环境污染控制重点实验室, 新乡 453007
收稿日期: 2020-06-24; 修回日期: 2020-07-15; 录用日期: 2020-07-15
基金项目: 国家自然科学基金(No.41805123,41807327)
作者简介: 姜继韶(1985—), 男, 讲师, E-mail: jiangjishao@163.com
通讯作者(责任作者): 姜继韶, E-mail: jiangjishao@163.com
摘要:鉴于氮肥增效剂在农田中的保氮经验,研究其对堆肥中氮素的保持具有重要意义.因此,本研究以氮肥增效剂-双氰胺(Dicyandiamide,DCD)为添加剂,脱水污泥为堆肥原料,进行了20 d的堆肥试验,探讨DCD对堆肥过程中氮素转化和酶活性变化及其细菌群落演变的影响.结果表明,DCD的添加降低了堆肥高温期的温度,延长了高温期的持续天数;DCD组显著降低了高温期NH4-N的含量和整个时期NO3-N的含量.堆肥结束时,总氮含量与对照相比提高了14.8%.此外,DCD的添加抑制了高温期纤维素分解酶和蛋白酶的活性,抑制了整个过程的硝酸还原酶的活性,而且高温期时,DCD组中厚壁菌门和绿弯菌门的丰度显著低于对照.冗余分析表明,NH4-N、pH和温度主要影响高温期时酶的活性,NO3-N和总氮主要影响稳定期时酶的活性.综上所述,DCD通过降低高温期的微生物丰度和相关酶活性,减缓了高温期的氨化作用和后期的硝化作用,减少了氮素损失,是一种可行的污泥堆肥添加剂.
关键词:氮肥增效剂双氰胺氮素转化酶活性细菌群落
Effects of dicyandiamide on enzyme activity and the structure of bacterial community during sewage sludge composting
JIANG Jishao

 , LEI Jiansen, WANG Yang, YU Dou, DONG Wei, ZHANG Xiaofang, GUO Fengqi, ZHANG Xindan, YAN Guangxuan
, LEI Jiansen, WANG Yang, YU Dou, DONG Wei, ZHANG Xiaofang, GUO Fengqi, ZHANG Xindan, YAN GuangxuanSchool of Environment, Henan Normal University, Key Laboratory for Yellow River and Huai River Water Environmental and Pollution Control, Ministry of Education, Henan Key Laboratory for Environmental Pollution Control, Xinxiang 453007
Received 24 June 2020; received in revised from 15 July 2020; accepted 15 July 2020
Abstract: Considering nitrogen fertilizer synergist for reducing nitrogen loss in farmland, it is of great significance to explore the nitrogen conservation during composting process. Therefore, a 20 d composting experiments of sewage sludge, including control and dicyandiamide (DCD) addition, were established to investigate the influences of DCD on nitrogen conversion, enzyme activity and the succession of bacterial community during composting process. The results show that DCD decreased the temperature and prolonged the duration of the thermophilic stage. The DCD treatment significantly decreased the NH4-N content during thermophilic stage and NO3-N content during the whole composting process. At the end of composting, the total nitrogen content increased by 14.8% compared to the control. In addition, the addition of DCD inhibited the activity of cellulase and protease, and decreased the abundances of Firmicutes and Chloroflexi during thermophilic stage relative to control. The activity of nitrate reductase during the whole composting process was also inhibited due to the DCD addition. Redundancy analysis results showed that NH4-N, pH and temperature significantly affected the enzyme activity during the thermophilic stage, while NO3-N and total nitrogen mainly affected the enzyme activity during maturation stage. In conclusion, DCD could slow down ammonification during thermophilic stage and nitrification during the cooling and maturation stages, and reduce nitrogen loss through decreasing microbial abundance and related enzyme activities during thermophilic stage. Thus, DCD is a feasible additive for the sewage sludge composting.
Keywords: nitrogen fertilizer synergistdicyandiamidenitrogen transformationenzyme activitybacterial community
1 引言(Introduction)好氧堆肥是固体有机废弃物资源化利用的有效方式, 是在微生物作用下, 把有机固体废弃物降解并转化为类腐殖质肥料的过程(Bernal et al., 2009; Bello et al., 2020).在生物转化过程中, 微生物分泌的各种酶类起着重要作用, 按堆肥阶段划分可分为两类:一类为前期有机物矿化分解起主要作用的酶, 如纤维素分解酶(Cellulase, CL)、蛋白酶(Protease, PT)、脲酶和蔗糖酶等;另一类是后期腐殖化进程中起主要作用的酶, 如硝酸还原酶(Nitrate reductase, NR)、脱氢酶和过氧化氢酶等(连鹏等, 2018; 张勇等, 2019).因此研究堆肥过程中酶活性的变化可以推断堆肥所处的阶段及其矿质化和腐殖化的程度, 为缩短堆肥化进程和保持营养元素提供理论依据和技术支撑.
硝化抑制剂(Nitrification inhibitor, NI)是常用的氮肥增效剂, 被广泛应用到农田中, 用来提高氮素的利用效率和减少氧化亚氮的排放(Akiyama et al., 2010; Lam et al., 2016).NI主要通过抑制土壤中氨氧化细菌的生长与活性来抑制硝化反应过程, 延缓土壤中铵盐向亚硝酸盐的转化, 从而减少土壤中氮素流失(Lam et al., 2016).堆肥中氮素的循环过程同农田土壤中一样, 因此借用农田中经验, 硝化抑制剂应用到堆肥过程中应该也能起到同样的效果.鉴于此, 很多****研究了硝化抑制剂对堆肥过程的影响, 主要集中在两个方面:一是氮素物质的转化, 包括氨气和氧化亚氮的排放(Jiang et al., 2016; 齐鲁等, 2017);二是对堆肥过程中氮转化功能基因的影响(Zhang et al., 2016).此外, 研究表明NI显著抑制了堆肥过程中有机物质的降解(齐鲁等, 2017; Jiang et al., 2018).如Jiang等(2018)发现在污泥堆肥中, 对照、NI与物料混合均匀和NI覆盖于物料表面3个处理的一级动力学降解常数分别为0.132、0.074和0.130 d-1, 添加NI均大于未添加处理.对堆肥有机质降解的抑制很有可能是抑制了相关微生物的生长和活性, 而酶类又是由微生物分泌而得.然而, 硝化抑制剂的加入对堆肥过程中微生物演变和相关酶活性的影响, 却缺少相应的研究.
因此, 本文主要研究硝化抑制剂对污泥堆肥过程中纤维素分解酶、蛋白酶和硝酸还原酶活性的影响及其对细菌群落的演变, 同时探明堆肥过程中环境因子、细菌群落组成与相关酶活性之间的关系, 找出影响酶活性的关键环境因子和细菌群落组分, 为有效处理有机固体废弃物和保持堆肥中氮素留存提供一定的理论基础和技术支持.
2 材料和方法(Materials and methods)2.1 堆肥原料和添加剂本实验堆肥原料为脱水污泥和木材废料, 新鲜的脱水污泥取自新乡市小尚庄污水处理厂, 木材废料取自实木家具加工厂.污泥和木材废料的主要理化性质如下:有机质含量分别为41.8%和97.2%;pH分别为7.12和7.52;含水率分别为81.0%和8.38%;C/N分别为15.6和74.7.木材废料破碎为粒径1~2 cm的碎片, 用来调节堆肥的含水率和C/N, 并对堆体起到一定的蓬松作用, 达到通气的效果.使用的硝化抑制剂为双氰胺(化学纯)(dicyandiamide, DCD), 购买于中国无锡亚泰联合化工有限公司.
2.2 实验方案实验共2个处理:处理一为对照(CK):取3.6 kg新鲜污泥和0.9 kg木材废料以4 ∶ 1的比例混合均匀, 放置到堆肥反应器中;处理二为添加DCD处理(DCD组):DCD添加量参考Jiang等(2018)的研究, 在CK的基础上, 在起始阶段加入物料干重0.5%的DCD, 并与物料混合均匀进行堆置.由于本实验堆体较小, 因此反应器放置到水浴槽中进行加热保温, 以减少堆体温度的快速损失.水浴温度一般比2个堆体堆温最低者低1~2 ℃, 起到保温效果的同时, 能够真实反映堆体中微生物累积热量的情况.实验过程中, 通风量和通风频率控制如下:堆体温度50 ℃以上时, 通风量为400 mL·min-1, 通风频率为开1 h, 关0.5 h;堆体温度50 ℃以下时, 通风量为200 mL·min-1, 通风频率为开1 h, 关0.5 h.其他反应器细节及其过程控制见文献(Jiang et al., 2019a; 2019b).
堆肥实验周期为20 d, 分别在0、4、8、12、16和20 d, 翻动堆体混合均匀后取样.样品分为3份, 一份80 ℃烘干磨碎, 用于总有机碳和总氮含量的测定;一份在冰箱中4 ℃保存, 用于无机氮和酶活性的测定, 其中酶活性仅测定0、4、12和20 d的堆肥样品;另一份在-80 ℃条件下冰冻保存, 后送于上海美吉生物医药科技有限公司, 进行细菌群落组成的测定.
2.3 测定项目和方法无机氮的测定:按堆肥鲜样:去离子水为1 ∶ 10的体积比振荡, 离心, 过滤后, 用全自动间断化学分析仪(Clever Chem 380, 德国) 进行铵态氮(NH4-N)、亚硝态氮(NO2-N)和硝态氮含量(NO3-N)的测定.总有机碳(TOC)和总氮(TN)使用元素分析仪(Elemental Vario EL, 德国) 进行测定.
堆肥样品酶活性参考《土壤酶及其研究方法》测定(关松荫, 1986):纤维素分解酶活性采用蒽酮比色法测定, 通过纤维素分解酶催化纤维素降解产生的还原糖的含量确定酶活性;蛋白酶采取可见分光光度法测定, 以将酪蛋白水解释放的酪氨酸的量表示;硝酸还原酶用可见分光光度法测定, 以将N3O-N催化释放的N2O的量表示.
堆肥样品中细菌群落16S rDNA的高通量测序交由上海美吉生物医药科技有限公司完成.其通用引物序列为338F (5′-ACTCCTACGGGAGGCAGCAG-3′)和806R (5′-GGACTACHVGGGTWTCTAAT-3′), 利用Usearch (vsesion 7.0) 软件, 对所得序列进行聚类分析, 并将相似性大于97%的序列定义为一个操作分类单元(OTU), 得到OTU表, 并进行生物信息统计分析.并随后使用美吉在线平台i- (http://www.i-sanger.com/) 进行细菌微生物群落多样性分析, 主要参数包括Chao、Ace、Shannon、Simpson和Coverage等(Jiang et al., 2019a).
2.4 数据处理和分析用Microsoft Excel 2019进行试验数据的基础分析, 采用Sigmaplot 14.0进行图形的制作, 并使用Canoco 5.0对相关理化指标、微生物群落和酶活性指标之间的关系做冗余分析(Redundancy analyses, RDA).
3 结果和讨论(Results and discussion)3.1 温度(Temperature)、pH和TOC的变化图 1a反映了堆体温度随着堆肥时间的变化, 总体上经历了高温期(0~8 d)、降温期(8~16 d)和腐熟期(16~20 d)3个阶段, 堆肥开始时, 有机物大量分解释放出大量热量, 堆体持续升温, CK和DCD组均于第2 d进入高温期(> 50 ℃), 且2 d时温度达到最高, 分别为58.1 ℃和56.5 ℃, 高温期分别持续了5和6 d, 满足了粪便无害化卫生标准(Bernal et al., 2009).且CK和DCD组高温期平均温度分别为55.4 ℃和53.8 ℃.高温期后, 随着堆体的碳源与氮源的持续消耗, 易分解的有机物已被充分利用, 难分解有机物质降解缓慢, 产生热量开始减少, 温度持续下降, 直到第17 d时与室温持平, 进入腐熟阶段.从整个堆肥过程中可以看出, 添加DCD抑制了有机物质的降解速率, 因此降低了堆肥高温期的温度, 延长了高温期的持续天数.齐鲁等(2017)研究也发现另外一种NI, 3, 4-二甲基吡唑磷酸盐(DMPP) 同样抑制了污泥堆肥过程中温度的上升, 其主要原因可能是脱水污泥中大量的硝化相关微生物的生产和活性被DMPP所抑制, 导致堆体温度的降低.
图 1(Fig. 1)
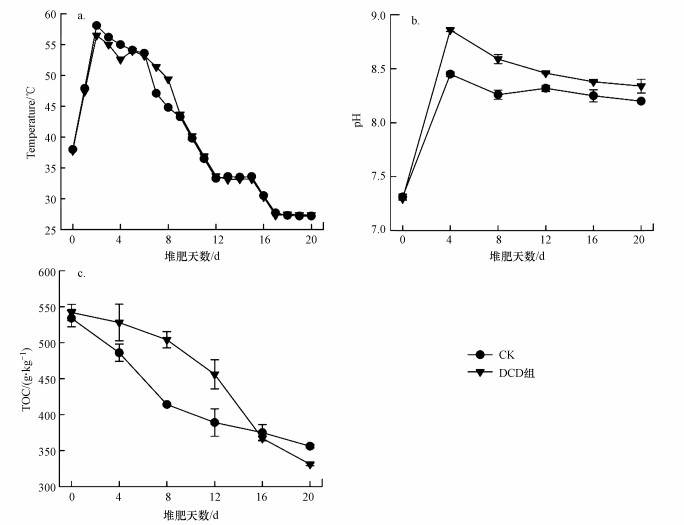 |
| 图 1 堆肥过程中温度(a)、pH (b)和TOC (c) 的变化 Fig. 1Changes of temperature (a), pH (b) and TOC (c) during composting |
堆肥过程中pH呈现出先升高后降低的趋势(图 1b).前期的增加是因为有机氮的氨化作用产生大量的NH4-N (Bernal et al., 2009; Guo et al., 2020), 而后期的降低可能是由于NH4-N的硝化且产生大量的H+造成的(Ning et al., 2019).在整个堆肥过程中, DCD组的pH均大于CK, 尤其在第4 d时, CK和DCD组pH分别为8.45和8.86, 差异较为明显.其原因可能是添加的DCD抑制了堆体中NH4-N的硝化作用, 使大量的NH4-N存于堆体中, 从而导致pH的升高(Jiang et al., 2019a).
图 1c可以看出, 整体上CK与DCD组TOC都呈稳定下降趋势, 说明碳源不断被微生物分解利用转化, DCD组TOC降解于0~12 d较慢, 12~20 d加快, CK却相反, 0~12 d快速分解, 12~20 d趋于平缓, 堆肥结束时两组总有机碳含量分别为356 g·kg-1和331 g·kg-1, 与堆肥初期TOC含量相比同比下降了33.3%和38.9%.0~12 d DCD的添加影响硝化细菌的同时也对其他有机质降解相关的微生物活性产生了影响, 抑制或延缓了其分解速率(齐鲁等, 2017).而随着堆肥的进行, DCD自身会逐渐降解, 在12~20 d其抑制作用可能已有所减弱或是消除, 因此未降解的有机物质继续降解, TOC在此期间下降较快.
3.2 NH4-N、NO2-N、NO3-N和TN的变化图 2a显示了堆肥过程中NH4-N的含量变化, 随着堆肥的进行, 有机氮的氨化使得NH4-N含量急剧增加, CK和DCD组NH4-N含量都于8 d时达到最大值, 分别为935.1和759.8 mg·kg-1, 之后开始逐渐下降.至堆肥结束, CK和DCD组NH4-N含量分别为200.3和398.5 mg·kg-1, 均小于400 mg·kg-1, 满足了腐熟的要求(Bernal et al., 2009).然而, 在堆肥前期, 0~8 d时DCD组NH4-N含量明显低于CK, 12~20 d时DCD组的NH4-N含量明显高于CK, 与已有研究结果不一致.如Jiang等(2018)研究表明DCD的添加抑制了硝化作用, 从而使得整个堆肥过程中NH4-N含量增加.而本研究出现的结果可能是由于堆肥前期DCD对微生物活性的抑制, 使得有机氮的氨化作用受到影响, 生成的NH4-N相对较少, 而后期由于DCD自身含量的减少, 对氨化作用的抑制作用减弱或是消除, 使得NH4-N的含量又有所升高(图 2a).
图 2(Fig. 2)
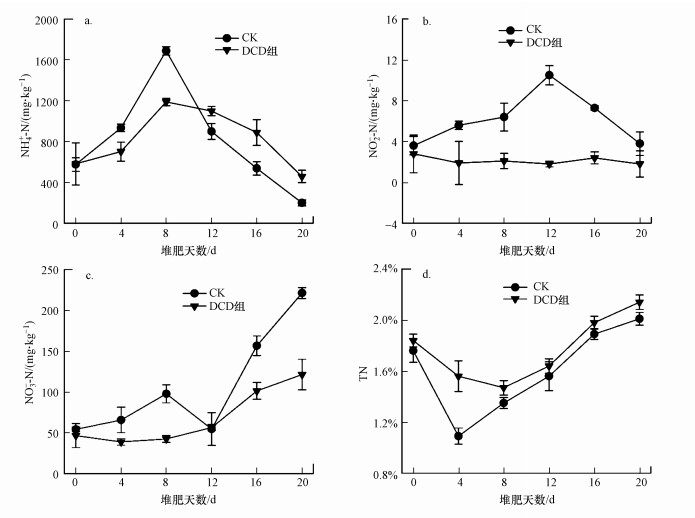 |
| 图 2 堆肥过程中NH4-N (a)、NO2-N (b)、NO3-N (c)和TN (d) 的变化 Fig. 2Changes of NH4-N (a), NO2-N (b), NO3-N (c), and TN (d) during composting |
图 2b显示了堆肥过程中NO2-N的含量变化, 作为硝化和反硝化作用的中间产物, N2O-N在堆体中的存留时间较短, 因此其含量明显低于NH4-N和NO3-N, 在两个处理的整个堆肥过程中, 其变化范围仅为1.5~10.5 mg·kg-1.在DCD组中, 由于DCD抑制了硝化作用, DCD组N2O-N含量更低, 一直维持在3.0 mg·kg-1左右.CK的N2O-N含量呈现0~12 d增加, 12~20 d快递下降的趋势.前期N2O-N含量的增加可能是NH4-N经硝化作用转化生成N2O-N;而后期的快速下降是因为后期生成的N2O-N快速转化为NO3-N或N2O (Wang et al., 2016b; Lv et al., 2019).
图 2c显示了堆肥过程中NO3-N的含量变化, 由于堆肥前期温度较高, 抑制了硝化作用, 因此两个处理的NO3-N含量都较低, 12~20 d时温度适于硝化作用的进行, NO3-N的含量开始上升.至堆肥结束时, CK和DCD组含量分别为221.3和156.5 mg·kg-1, 分别为初期的3.1和2.4倍.且整个过程中由于DCD对硝化作用的抑制作用, DCD组NO3-N平均含量(80.3 mg·kg-1)明显低于CK(108.4 mg·kg-1), 与已有研究相似(陈耀宁等, 2016).
由图 2d得出, CK和DCD组的TN含量都呈先下降后上升的趋势, 堆肥前期由于微生物的反应, 堆体不断分解释放出NH3, TN含量不断下降, 堆肥中期由于有机碳化合物的强降解, TN出现富集效应, TN含量上升(Li et al., 2012).堆肥结束时CK和DCD组TN含量分别比初期提高了14.2%和16.3%;与CK相比, TN含量增加了14.8%.DCD组0~8 d由于抑制了氨化作用, 使得高温期的NH4-N含量减少(图 2a), 因此减少了NH3的排放;而DCD组抑制了后期NH4-N的硝化作用, 使得后期NH4-N含量明显高于CK, 从而有效减少了由于硝化和反硝化引起的氮素损失, 保存了氮源(齐鲁等, 2017).
3.3 纤维素分解酶、蛋白酶和硝酸还原酶的活性变化堆肥过程中, 微生物利用蛋白酶可将混合物中的蛋白质转化为氨基酸(李淑娴等, 2015), 纤维素分解酶可将纤维素分解为葡萄糖, 纤维二糖等物质(马闯等, 2019), 为后续微生物的生长提供氮源和碳源.反硝化作用是堆肥氮素损失的重要途径, 而硝酸还原酶作为反硝化的关键酶又起着重要作用(Zenga et al., 2017; Lv et al., 2019).
图 3a和3b表明, 在整个堆肥进程中纤维素分解酶和蛋白酶的酶活性变化趋势基本相同.CK中, 蛋白酶和纤维素分解酶的酶活性在0~4 d内快速上升, 第4 d达到峰值, 分别为23.5 mg·d-1·g-1和189.4 mg·d-1·g-1, 此后酶活性持续下降.DCD组蛋白酶和纤维素分解酶的酶活性在0~12 d内持续上升, 第12 d达到峰值, 分别为17.8 mg·d-1·g-1和175.5 mg·d-1·g-1, 此后酶活性持续下降.说明DCD的添加明显抑制了高温期时蛋白酶和纤维素分解酶的活性, 这也解释了DCD组在高温期温度下降(图 1a)、TOC分解速率慢(图 1c)和NH4-N含量低(图 2a)的原因.高温期后, DCD自身分解作用导致DCD含量减少, 从而对氨化、硝化细菌的作用减弱, 使得蛋白酶和纤维素分解酶的酶活性又高于CK.
图 3(Fig. 3)
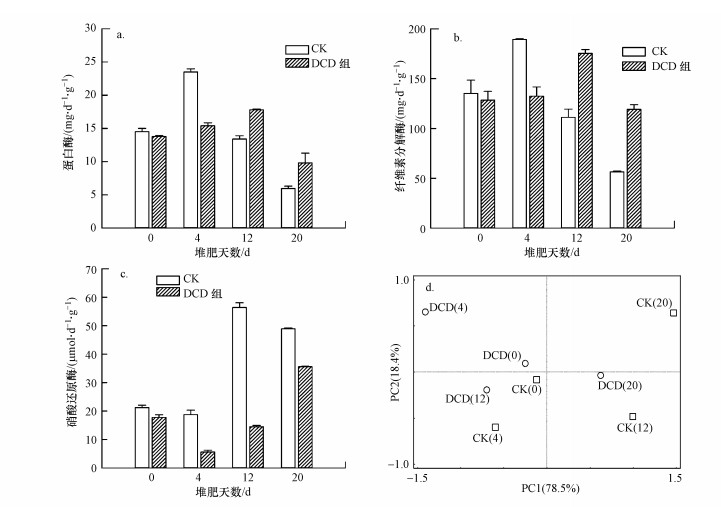 |
| 图 3 堆肥过程中蛋白酶(a)、纤维素分解酶(b)和硝酸还原酶(c) 变化及其酶活性的PCA分析(d) Fig. 3Changes of protease (a), cellulase (b), and nitrate reductase (c) during the composting and the PCA of enzymatic activity (d) |
研究表明, 硝酸还原酶主要在缺氧或是绝对厌氧的环境条件下起主要作用(Zenga et al., 2017).本研究中, 0~4 d内氧气充足, 硝酸还原酶活性有所下降, 随着有机物质的快速分解, 消耗了堆体中大量的氧气, 形成了厌氧环境, 使得硝酸还原酶活性在此后(12和20 d)不断升高(图 3c).至堆肥结束, CK和DCD组硝酸还原酶活性分别为48.9和35.6 μmol·d-1·g-1.同时, 添加DCD组在整个堆肥过程中, 由于受到DCD的抑制作用, 其硝化和反硝化作用相对较弱, 导致其硝酸还原酶活性低于CK.
PCA分析表明, 堆肥初期(0 d)和稳定期(20 d)CK和DCD组样品间距较小, 说明在这两个时期3种酶的活性差异较小, 而在高温期(4 d)和降温期(12 d)时CK和DCD组样品间距较大, 说明在这2个时期时3种酶的活性差异较大(图 3d).
3.4 细菌群落丰度和组分的变化表 1可以看出, 4个样品16S rDNA文库的覆盖率(Coverage)均大于0.99, 说明此次高通量测序结果能够充分反映堆肥中细菌微生物的真实情况.在微生物多样性分析中, Chao指数和Ace指数用来反映微生物的丰度大小, 其值越大代表微生物的丰度越大.Shannon指数和Simpson指数反映微生物的多样性, Shannon指数越大表示微生物多样性越高, 而Simpson指数越大则表示微生物多样性越低(刘洋等, 2016).高温期时, DCD组的Chao指数和Ace指数均小于CK, Shannon指数略高于CK, Simpson指数略小于CK.稳定期时, DCD组的Chao指数、Ace指数和Shannon指数均大于CK, Simpson指数小于CK.结果表明, DCD的添加抑制了高温期时微生物的丰度, 略微增加了微生物的多样性;而稳定期时, DCD抑制剂的抑制作用变弱或是消除, 堆体的微生物丰度和多样性都高于CK.
表 1(Table 1)
| 表 1 细菌多样性指数 Table 1 Richness and diversity of bacterial community during two sampling stages | ||||||||||||||||||||||||||||||||||||||||||
表 1 细菌多样性指数 Table 1 Richness and diversity of bacterial community during two sampling stages
| ||||||||||||||||||||||||||||||||||||||||||
由门水平下的细菌群落组成的变化可以看出(图 4a), 高温期堆体中的细菌菌群主要有厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、Patescibacteria菌门和绿弯菌门(Chloroflexi), 占微生物总数的比例分别为46.9%~52.7%、19.1%~19.7%、13.4%~14.8%、5.6%~8.6%和4.8%~5.6%, 5类细菌菌门共占微生物总数的94.8%~96.4%.而稳定期堆体中的主要菌群仅为厚壁菌门、放线菌门和变形菌门, 占微生物总数的99%, Patescibacteria菌门和绿弯菌门在稳定期丰度仅为2%左右.在4个堆肥样品中, 厚壁菌门、放线菌门和变形菌门3个菌门为堆肥的优势菌门, 与以往Partanen等(2010)在污泥以及Wang等(2016a)在家禽尸体堆肥中的研究结果一致.
图 4(Fig. 4)
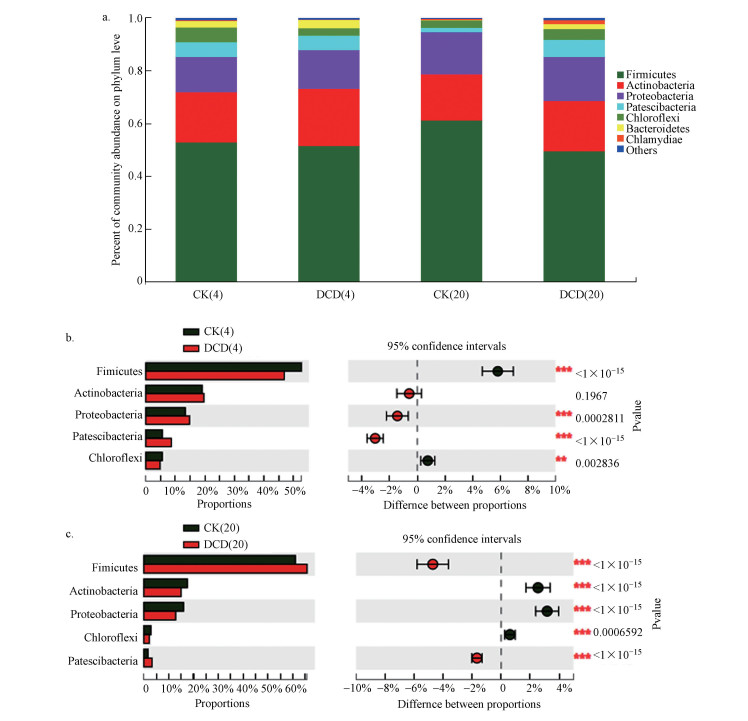 |
| 图 4 细菌群落的基本信息 (a.门水平下的细菌群落组成, b.5种优势菌门在高温期的差异性分析, c.5种优势菌门在稳定期的差异性分析) Fig. 4Basic information on the bacteria communities during composting (a.Phylum-level composition of the bacteria communities, b.the top five phylum variation during thermophilic stage, c.and the top five phylum variation during maturation stage) |
5种优势菌门在高温期和稳定期的差异性分析表明(图 4b、4c), 在高温期, DCD组中厚壁菌门和绿弯菌门的丰度显著低于CK(p < 0.001), 而变形菌门和Patescibacteria菌门的丰度显著高于CK(p < 0.001).厚壁菌门是分解环境中纤维素、半纤维素和木质素的主要微生物菌群(Sangeeta et al., 2013), 变形菌门是堆肥过程中有机物质分解的主要菌门(Awasthi et al., 2017).然而由于厚壁菌门的丰度(60%左右)远大于变形菌门的丰度(15%左右), 因此DCD组在高温期TOC的分解受到一定的抑制(图 1a).到堆肥稳定期, DCD组厚壁菌门和绿弯菌门的丰度显著高于CK, 而其他3个菌门的丰度则小于CK, 说明后期DCD的自身分解, 对微生物的抑制作用减弱, 分解有机物质的主要菌群丰度又开始增加, 这也说明DCD仅仅是一种抑制剂, 而不是杀菌剂(Luo et al., 2013).此外, 添加DCD显著增加高温期变形菌门的丰度(p < 0.001), 而变形菌门具有氮素固定的功能, 与堆肥中氮素的转化密切相关(Xi et al., 2016), 这也解释了文章之前所述关于DCD减少堆肥过程中氮素损失的结果.
3.5 细菌群落与理化指标和酶活性的关系堆肥过程中有机物质的分解都是在微生物分泌胞外酶的作用下进行, 堆肥过程中微生物的演变与酶活的变化密切相关(Mandpe et al., 2019), 而堆肥过程中其他理化指标的变化对微生物群落的演变也有一定的影响(Mao et al., 2019), 并最终影响酶的分泌及其活性.RDA分析了微生物群落、理化指标和酶活性的相关关系, 结果表明, 选择的5个细菌菌门和7个环境变量共同解释了酶活性90.2%的变异(图 5).而且高温期两个样品之间的距离明显大于稳定期两个样品之间的距离, 说明酶活性在高温期变化比较强烈, 与PCA结果分析一致(图 3d).环境指标中, NH4-N、NO3-N和温度显著影响酶活性的变异, 其次为pH、TN和TOC.细菌菌门中, 变形菌门主要影响了酶活性的变化, 其他菌门影响较小.
图 5(Fig. 5)
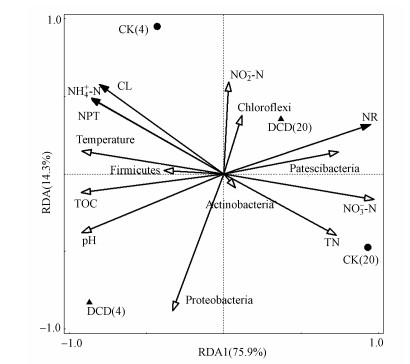 |
| 图 5 堆肥酶活性、理化性质和细菌门水平下的冗余分析 Fig. 5The RDA of compost enzyme activity, physicochemical indexes and bacterial phyla |
样品点、环境因子在RDA图形中的象限分布能够得出影响高温期和腐熟期酶活性的主要环境指标.高温期的两个样品主要分布在整个象限图形的左边(以竖直中间轴为参照), 有机物质分解的主要酶类NPT和CL也在此区域, 而且此时酶活性较高, 因此此时期有机碳氮快速分解, 从而使得此时温度和pH比较高.由此可以说明, NH4-N、pH和温度显著影响高温期酶的活性.而稳定期的2个样品分布在整个象限图形的右边, 这个时期酶活性的变化主要受到NO3-N和TN的影响.Mao等(2018)研究发现温度和水溶性有机碳主要在堆肥高温期影响微生物群落变化, 而在稳定期的主要影响因素是电导率和TN, 与本研究的结果基本一致.
4 结论(Conclusions)DCD的添加抑制了高温期有机碳的降解, 使得高温期温度低于对照;而且还抑制了高温期的氨化作用和后期的硝化作用, 使得总氮含量与对照相比增加了14.8%.此外, 高温期纤维素酶和蛋白酶的活性及其细菌的丰度也受到DCD的抑制, 到堆肥后期酶活性和微生物丰度才高于对照.RDA分析表明, 环境因子中NH4-N、NO3-N和温度主要影响酶活性的变异, 而细菌中影响酶活性变异的主要菌门是变形菌门.本实验借鉴农田中氮肥增效剂的保氮经验, 从酶活性和微生物方面初步探讨了DCD添加对堆肥中氮素保持的机理, 为降低堆肥氮素损失和提高堆肥品质提供一定的理论基础和技术支持.
参考文献
| Akiyama H, Yan X, Yagi K. 2010. Evaluation of effectiveness of enhanced-efficiency fertilizers as mitigation options for N2O and NO emissions from agricultural soils: meta-analysis[J]. Global Change Biology, 16(6): 1837-1846. |
| Awasthi M K, Zhang Z, Wang Q, et al. 2017. New insight with the effects of biochar amendment on bacterial diversity as indicators of biomarkers support the thermophilic phase during sewage sludge composting[J]. Bioresource Technology, 238: 589-601. DOI:10.1016/j.biortech.2017.04.100 |
| Bello A, Han Y, Zhu H, et al. 2020. Microbial community composition, co-occurrence network pattern and nitrogen transformation genera response to biochar addition in cattle manure-maize straw composting[J]. The Science of the Total Environment, 721: 137759-137759. DOI:10.1016/j.scitotenv.2020.137759 |
| Bernal M P, Alburquerque J A, Moral R. 2009. Composting of animal manures and chemical criteria for compost maturity assessment. A review[J]. Bioresource Technology, 100(22): 5444-5453. DOI:10.1016/j.biortech.2008.11.027 |
| 陈耀宁, 黄爱知, 黎媛萍, 等. 2016. 硝化抑制剂对农业废物好氧堆肥理化性质及反硝化功能基因的影响[J]. 环境工程学报, 10(8): 4451-4456. |
| 关松荫. 1986. 土壤酶及其研究法[M]. 北京: 农业出版社. |
| Guo H, Gu J, Wang X, et al. 2020. Microbial driven reduction of N2O and NH3 emissions during composting: Effects of bamboo charcoal and bamboo vinegar[J]. Journal of Hazardous Materials, 390: 121292. DOI:10.1016/j.jhazmat.2019.121292 |
| Jiang J, Kang K, Wang C, et al. 2018. Evaluation of total greenhouse gas emissions during sewage sludge composting by the different dicyandiamide added forms: Mixing, surface broadcasting, and their combination[J]. Waste Management, 81: 94-103. DOI:10.1016/j.wasman.2018.10.003 |
| Jiang J, Pan Y, Yang X, et al. 2019a. Beneficial influences of pelelith and dicyandiamide on gaseous emissions and the fungal community during sewage sludge composting[J]. Environmental Science and Pollution Researchnviron, 26: 8928-8938. DOI:10.1007/s11356-019-04404-x |
| Jiang J, Wang Y, Liu J, et al. 2019b. Exploring the mechanisms of organic matter degradation and methane emission during sewage sludge composting with added vesuvianite: Insights into the prediction of microbial metabolic function and enzymatic activity[J]. Bioresource Technology, 286: 121397. DOI:10.1016/j.biortech.2019.121397 |
| Jiang T, Ma X, Tang Q, et al. 2016. Combined use of nitrification inhibitor and struvite crystallization to reduce the NH3 and N2O emissions during composting[J]. Bioresource technology, 217: 210-218. DOI:10.1016/j.biortech.2016.01.089 |
| Lam S K, Suter H, Mosier A R, et al. 2016. Using nitrification inhibitors to mitigate agricultural N2O emission: a double-edged sword?[J]. Global change biology, 23(2): 485-489. |
| Li R, Wang J, Zhang Z, et al. 2012. Nutrient transformations during composting of pig manure with bentonite[J]. Bioresource Technology, 121: 362-368. DOI:10.1016/j.biortech.2012.06.065 |
| 李淑娴, 姚玉峰. 2015. 细菌体内的蛋白质降解[J]. 微生物学报, 55(5): 521-528. |
| 连鹏, 范周周, 郭东矗, 等. 2018. 城市污泥与园林废弃物混合堆肥施用对林地土壤微生物量碳、氮及酶活性的影响[J]. 环境科学学报, 38(7): 2842-2848. |
| Liu N, Hou T, Yin H, et al. 2019. Effects of amoxicillin on nitrogen transformation and bacterial community succession during aerobic composting[J]. Journal of Hazardous Materials, 362: 258-265. DOI:10.1016/j.jhazmat.2018.09.028 |
| 刘洋, 曾全超, 黄懿梅, 等. 2016. 基于454高通量测序的黄土高原不同乔木林土壤细菌群落特征[J]. 中国环境科学, 36(11): 3487-3494. |
| Luo Y, Li G, Luo W, et al. 2013. Effect of phosphogypsum and dicyandiamide as additives on NH3, N2O and CH4 emissions during composting[J]. Journal of Environmental Sciences, 25(7): 1338-1345. DOI:10.1016/S1001-0742(12)60126-0 |
| Lv B, Zhang D, Chen Q, et al. 2019. Effects of earthworms on nitrogen transformation and the correspond genes (amoA and nirS) in vermicomposting of sewage sludge and rice straw[J]. Bioresource Technology, 287: 121428. DOI:10.1016/j.biortech.2019.121428 |
| 马闯, 扈斌, 刘福勇, 等. 2019. 有机废弃物好氧堆肥过程中微生物及酶活性变化状况综述[J]. 环境工程, 37(9): 159-164+187. |
| Mandpe A, Paliya S, Kumar S, et al. 2019. Fly ash as an additive for enhancing microbial and enzymatic activities in in-vessel composting of organic wastes[J]. Bioresource Technology, 293: 122047. DOI:10.1016/j.biortech.2019.122047 |
| Mao H, Lv Z, Sun H, et al. 2018. Improvement of biochar and bacterial powder addition on gaseous emission and bacterial community in pig manure compost[J]. Bioresource Technology, 258: 195-202. DOI:10.1016/j.biortech.2018.02.082 |
| Mao H, Zhang H, Fu Q, et al. 2019. Effects of four additives in pig manure composting on greenhouse gas emission reduction and bacterial community change[J]. Bioresource Technology, 292: 121896. DOI:10.1016/j.biortech.2019.121896 |
| Partanen P, Hultman J, Paulin L, et al. 2010. Bacterial diversity at different stages of the composting process[J]. Bmc Microbiology, 10(1): 1-11. DOI:10.1186/1471-2180-10-1 |
| 齐鲁, 张俊亚, 郑嘉熹, 等. 2017. 沸石粉和硝化抑制剂投加对污泥堆肥过程中氮素保存和温室气体排放的影响[J]. 环境科学学报, 38(6): 2131-2139. |
| Sangeeta P, Surender S, Ajar Nath Y, et al. 2013. Phylogenetic diversity and characterization of novel and efficient cellulase producing bacterial isolates from various extreme environments[J]. Bioscience Biotechnology & Biochemistry, 77(7): 1474-1480. |
| Wang J, Du X, Zhang Y, et al. 2016a. Effect of substrate on identification of microbial communities in poultry carcass composting and microorganisms associated with poultry carcass decomposition[J]. Journal of Agricultural & Food Chemistry, 64(36): 6838-6847. |
| Wang Q, Wang Z, Awasthi M K, et al. 2016b. Evaluation of medical stone amendment for the reduction of nitrogen loss and bioavailability of heavy metals during pig manure composting[J]. Bioresource Technology, 220: 297-304. DOI:10.1016/j.biortech.2016.08.081 |
| Xi B, Zhao X, He X, et al. 2016. Successions and diversity of humic-reducing microorganisms and their association with physical-chemical parameters during composting[J]. Bioresource Technolog, 219: 204-211. DOI:10.1016/j.biortech.2016.07.120 |
| Zenga G, Zhanga L, Donga H, et al. 2017. Pathway and mechanism of nitrogen transformation during composting: Functional enzymes and genes under different concentrations of PVP-AgNPs[J]. Bioresource Technolog, 253(3): 112-120. |
| Zhang J, Sui Q, Li K, et al. 2016. Influence of natural zeolite and nitrification inhibitor on organics degradation and nitrogen transformation during sludge composting[J]. Environmental Science and Pollution Research, 23(2): 1324-1334. DOI:10.1007/s11356-015-5326-5 |
| 张勇, 陈宇鹏, 权秋梅, 等. 2019. 畜禽粪添加对菌糠堆肥过程中酶活性的影响[J]. 地球环境学报, 10(4): 406-418. |
