 , 刘盛余1
, 刘盛余1
 , 杨杰1, 能子礼超2, 杨淑清1
, 杨杰1, 能子礼超2, 杨淑清11. 成都信息工程大学资源环境学院, 成都 610225;
2. 西昌学院资源与环境学院, 西昌 615013
收稿日期: 2020-12-14; 修回日期: 2021-03-16; 录用日期: 2021-03-16
基金项目: 四川省科技厅重点研发项目(No.2020YFS0342);成都信息工程大学人才启动基金(No.KYTZ202014);国家自然科学基金面上项目(No.21676032);四川省教育厅创新团队项目(No.14TD0020)
作者简介: 曹静(1997-), 女, E-mail: 1482075357@qq.com
通讯作者(责任作者): 刘盛余, E-mail: shengyuliu_cuit@sina.com
摘要:燃煤工业是我国人为汞排放的主要来源,寻求合理有效的途径来控制汞排放至关重要.本文将氧化性强的过渡金属锰离子引入Mn/γ-Fe2O3晶格中,制备出锰铁复合磁性材料(Fe3-xMnx)1-δO4,以其来模拟Hg0在燃煤废气中的吸附过程,并通过比表面积和孔隙率、X衍射分析、SEM、磁性分析、氧化还原等材料表征方法研究(Fe3-xMnx)1-δO4的吸附性能,同时重点研究(Fe3-xMnx)1-δO4在不同掺杂量、温度、空速等操作条件下对Hg0的吸附能力.结果显示,制备所得的(Fe3-xMnx)1-δO4的比表面积均在120 m2·g-1以上,较大的比表面积和孔体积可以为Hg0的吸附反应提供更多的活性区域,促进反应进行.SEM表征也显示(Fe3-xMnx)1-δO4的微观特征呈现球状颗粒物,拥有较大的表面积,能够提供更多的吸附活性位.在磁性铁氧化物中引入过渡金属锰,其对汞的氧化能力明显增强;在100~200℃的反应温度窗口,此时温度大小与(Fe3-xMnx)1-δO4对汞的吸附能力成正比,达到200℃时,500 min内平均穿透率可达到9%;空速对(Fe3-xMnx)1-δO4吸附汞的能力影响较小.
关键词:Fe2O3锰离子零价汞脱汞燃煤废气
Study on the preparation of manganese-Fe composite magnetic materials and their capability for gaseous elemental mercury capture
CAO Jing1
 , LIU Shengyu1
, LIU Shengyu1
 , YANG Jie1, NENGZI Lichao2, YANG Shuqing1
, YANG Jie1, NENGZI Lichao2, YANG Shuqing11. College of Resources and Environment, Chengdu University of Information Technology, Chengdu 610225;
2. Academy of Resources and Environmental Sciences, Xichang University, Xichang 615013
Received 14 December 2020; received in revised from 16 March 2021; accepted 16 March 2021
Abstract: In China, coal-fired power plants is the main stationary sources of atmospheric Hg emissions. Thus, it is vital to find a reasonable and effective way to control Hg emissions. In this work, the ferromanganese composite magnetic material (Fe3-xMnx)1-δO4 was prepared with Mn/γ-Fe2O3 and strong oxidized transition metal manganese ions. It has been applied to adsorb the Hg0 from simulated coal-fired flue gas. Various characterization methods including specific surface area test, X-ray diffraction (XRD), scanning electron microscopy (SEM), magnetic analysis was employed for the characterization of the composite materials. It also focuses on the adsorption capacity of (Fe3-xMnx)1-δO4 to Hg0 under operating conditions such as doping quantity, different temperature and space velocity. It has been found that the the specific surface area of prepared (Fe3-xMnx)1-δO4 is more than 120 m2·g-1.The larger specific surface area and pore volume can provide more active areas for the adsorption reaction of Hg0 and promote the reaction. SEM characterization also showed the microscopic characteristics of (Fe3-xMnx)1-δO4 are spherical particles with large surface area and can provide more adsorption active sites. The removal efficiency of the mercury could be enhanced when the transition metal manganese was doped on the magnetic iron oxide. In the reaction temperature window of 100~200 ℃, the temperature is the same as (Fe3-xMnx)1-δO4 is directly proportional to the adsorption capacity of mercury. When it reaches 200 ℃, the average penetration rate can reach 9% within 500 minutes, and the space velocity has little effect on the energy of mercury adsorption by (Fe3-xMnx)1-δO4.
Keywords: Fe2O3manganese ionszero-valent mercuryde-mercurycoal-fired flue gas
1 引言(Introduction)汞是一种全球性污染物, 对人类和自然环境构成了严重威胁(刘晓星等, 2017;Chen et al., 2018;吾竺娟等, 2020), 而煤炭是世界上最大的人造汞排放源(吾竺娟等, 2020).当前, 许多从事大气污染控制研究的科研人员不断寻求合理有效的途径来控制和引导燃煤汞排放(Bin et al., 2019).目前, 燃煤行业控制汞污染的方法主要有两种(车凯等, 2018), 分别为选择性催化还原技术(SCR)+烟气脱硫技术(FGD)协同控制和活性炭(PAC)控制技术(周强等, 2018), 但这两种方法在我国的实行运用均受到一定的限制.这是因为这种两种技术未能完全将汞及其化合物从烟气中捕集下来进行集中控制, 而是将气态的零价汞氧化成毒性更大的氯化汞, 这些氯化汞分散在飞灰、脱硫液及脱硫石膏中, 有可能产生二次污染, 从而增加中国居民的汞暴露风险.
煤中几乎所有的汞都是以Hg0的形式进入废气, 在冷却过程中, 部分Hg0与其他燃烧产物发生化学变化转化为Hg2+和Hgp(吴小琴等, 2018).Hg0吸附技术是目前减少燃煤Hg污染阶段需要研究的重要组成部分.钙官能团具有较高的Hg2+吸附率, 易于获得且价格便宜, 但对Hg0的吸附率较低, 因此, 研究人员通常对其改性以提高汞吸附率, 但同时也增加了成本(任建莉等, 2006;Zhang et al., 2017;Yang et al., 2019;Wojciechowska et al., 2019).活性炭对Hg0的吸附在国内外得到了广泛应用, 主要是因为活性炭具有较大的比表面积、发达的孔结构, 更利于对NOx、SO2和Hg0进行吸附, 但活性炭的运行成本较高, 从而限制了其大规模应用(罗锦英等, 2009;Shen et al., 2017;Ma et al., 2019;刘含笑等, 2019;安东海等, 2019;Wang et al., 2019).而且我国煤炭的含硫量高, 导致烟气中二氧化硫浓度较高, 这就需要选择既高效又耐受性好的吸附剂.
Fe、Co、Ni及其氧化物为主要的磁性纳米粒子, 但因含有Co、Ni等毒素元素, 进而限制了其在生物化学领域中的使用.氧化铁是重要的磁性材料, 具有很好的生物相容性, 在很多领域扮演着重要的角色(孙涛等, 2010;戚政武等, 2016;孙青柯等, 2017;Shen et al., 2018;Zhang et al., 2018;李向阳等, 2019;Wang et al., 2019).铁基尖晶石的物理化学性质直接受到掺杂金属种类、位置和性质的影响, 而将过渡金属如Ni、Cu、Mn、Co和V等掺杂进尖晶石结构中能够显著改变其氧还原能力(谢武明等, 2020).其中, 二氧化锰是一种优良的汞氧化催化剂(张安超等, 2015;Zhou et al., 2019), 当铁基尖晶石结构中的Fe2+和Mn2+等低价金属发生氧化后, 同时引入阳离子空位继而维持尖晶石结构.
陈力等(2019)研究了锰负载对磁性铁氧化物吸附Hg0的影响, 通过制备Mn/γ-Fe2O3吸附剂并在模拟烟气条件下设计实验以探究该吸附剂对Hg0的吸附性能, 结果表明, 在模拟烟气条件下Mn/γ-Fe2O3吸附剂对Hg0有较为优异的吸附性能.γ-Fe2O3为面心立方结构, 每个晶胞中有32个O2-和24个铁离子, 二价氧离子在晶胞中的积累会产生64位的四面体间隔和32位的八面体间隔.在γ-Fe2O3八面体中, Fe3+和Fe2+呈无序排列, 电子可在其中迅速迁移.γ-Fe2O3中的铁离子能够被其它阳离子替换, 发生类质同像置换, 离子半径范围在高自旋铁离子半径±18%内的金属阳离子可被掺杂进其晶格中, 其物理化学性质也将受到掺杂离子种类的影响.
基于此, 本文拟通过将氧化性强的过渡金属锰离子引入到Mn/γ-Fe2O3晶格中, 制备出锰铁复合磁性材料(Fe3-xMnx)1-δO4, 以提高其氧化还原能力及对二氧化硫的耐受性, 并探究锰掺杂进γ-Fe2O3材料中对汞吸附效果的影响.同时, 采用比表面积和孔隙率、X衍射分析、SEM、磁性分析、氧化还原等材料表征方法研究(Fe3-xMnx)1-δO4的吸附性能, 重点探究(Fe3-xMnx)1-δO4在不同工况条件下(掺杂量、温度、空速等)对零价汞的吸附能力.
2 实验部分(Experiment)2.1 吸附剂制备及表征采用共沉淀法制备(Fe3-xMnx)1-δO4吸附剂(Hsi et al., 2011;陈力等, 2019周普阳等, 2020), 具体操作为:将硫酸亚铁(FeSO4·7H2O)、三氯化铁(FeCl3·6H2O)、硫酸锰(MnSO4)溶于去离子水(总离子浓度约为0.3 mol·L-1), 并将此混合溶液迅速加入到氢氧化钠溶液(NaOH) (1.2 mol·L-1), 得到黑色胶体溶液(反应过程见式(1));接着在搅拌器中于800 r·min-1下搅拌2 h, 过滤并用蒸馏水冲洗3次以去除所有杂质离子;然后将它们在105 ℃的真空烘箱中放置10 h, 燃烧并干燥样品中的黑色固体沉淀物, 并在550个大气压气氛下煅烧样品3 h, 以获得(Fe3-xMnx)1-δO4.冷却至室温后, 将其研磨并过筛, 使用粒径为0.25~0.38 mm的吸收样品.
 | (1) |
程序升温脱附在化学吸附仪上完成, 每次实验前均先将样品用He在300 ℃下吹扫60 min, 冷却至50 ℃后, 将He切换成10% NH3/He(流量为15 mL·min-1);60 min后, 再将10% NH3/He切换成He(流量30 mL·min-1)吹扫60 min;最后在He气氛下将样品程序升温至600 ℃, 升温速率为10 ℃·min-l. 扫面电镜分析(SEM)所用仪器为德国蔡司Ultra 55扫描电子显微镜, 将样品进行预处理后直接放入仪器中进行表征, 该表征方法用于表征(Fe3-xMnx)1-δO4吸附剂的微观形貌特征(陈力等, 2019).
2.2 实验装置及方法图 1为模拟汞在煤燃烧的固定床上传输的实验装置(陈力等, 2019).该设备主要包括模拟煤燃烧排气部件、透汞软管、气体混合器、固定催化剂、气体回路系统、吹扫气体清洁剂、汞气体分析仪等.汞蒸气由可透过汞的软管(美国VICI Metronics)产生, 该管封装在U形石英管中.在开始实验之前, 先用N2将反应器中的空气置换出来, 然后模拟燃煤烟气.模拟燃煤烟气部分主要由N2和其他气体组成, 一种用作补充气体, 另一种用作透汞载气.管道主要由PTFE制成, 以减少冷凝损失和管道中汞蒸气的吸附. 整个管道系统使用电热带和导热材料来保持恒定的温度.吸附床使用带有内置筛板的石英管作为固定床炉, 内径为10 mm, 长度为200 mm, 大都均匀地分布在内部.实验中使用的(Fe3-xMnx)1-δO4量为100 mg, 废气被酸性高锰酸钾溶液吸收后释放到大气中.汞控制方法使用EPA推荐的安大略方法(陈力等, 2019).
图 1(Fig. 1)
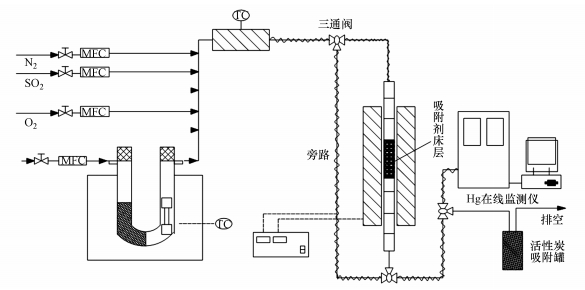 |
| 图 1 脱汞实验装置系统示意图 Fig. 1Schematic diagram of mercury removal experimental device |
本文采用汞穿透率作为评价指标, 计算公式见式(3).穿透率越高则表面吸附剂的汞吸附效果越差.吸附剂的吸附效率η1和单位质量吸附剂的Hg吸附量q的计算见式(2)和(4).
 | (2) |
 | (3) |
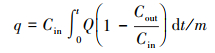 | (4) |
3 结果与讨论(Results and discussion)3.1 吸附材料的表征3.1.1 (Fe3-xMnx)1-δO4的孔结构特性汞气体与吸附剂材料之间的接触面积导致气体与固体之间的反应速率不同, 而内外扩散、吸附速率的快慢则是由吸附剂的孔数量和孔分布决定的.这些因素在微观层面上对汞在吸附材料表面的反应速率扮演着重要的角色.本文对样品(Fe3-xMnx)1-δO4的N2吸附和脱附进行了测试, 以研究Mn的影响.
由表 1可知, Mn掺杂进入后, (Fe3-xMnx)1-δO4的比表面积和累积孔容都有不同幅度的提高, 当Mn掺杂量x=0.75时, 比表面积和孔容分别为179.11 m2·g-1和0.096 cm3·g-1.在Hg吸附反应中, 气相中的Hg首先被吸附到材料表面的活性区域, 成为吸附态过渡产物, 之后该产物进一步发生反应.可以看出, 较大的比表面积和孔体积可以为Hg0的吸附反应提供更多的活性区域, 促进反应进行.(Fe3-xMnx)1-δO4的N2吸附-脱附曲线见图 2, 根据IUPAC分类方法, 这些曲线都是带有H3磁滞回线的V形曲线. 该材料在低压和相对压力结束时与N2的相互作用较弱, 如果相对压力为0, 则(Fe2.5Mn0.5)1-δO4的吸附剂体积仍达到10 cm3·g-1, 说明其中微孔较多.当相对压力超过0.6时, 吸附体积急剧增加并且表面材料包含大量的中孔.(Fe2.5Mn0.5)1-δO4滞后环闭点在0.8, 表明其孔径大的孔结构比例越大.
表 1(Table 1)
| 表 1 不同Mn掺杂量(Fe3-xMnx)1-δO4的孔结构特性 Table 1 Pore structure characteristics Mn different doping amounts (Fe3-xMnx)1-δO4 | ||||||||||||||||
表 1 不同Mn掺杂量(Fe3-xMnx)1-δO4的孔结构特性 Table 1 Pore structure characteristics Mn different doping amounts (Fe3-xMnx)1-δO4
| ||||||||||||||||
图 2(Fig. 2)
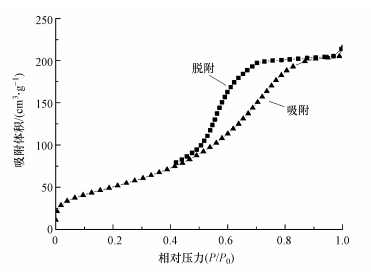 |
| 图 2 (Fe2.5Mn0.5)1-δO4的N2吸附-脱附曲线 Fig. 2N2 adsorption/desorption isotherms of (Fe2.5Mn0.5)1-δO4 |
3.1.2 SEM表征对制备的(Fe3-xMnx)1-δO4吸附剂进行SEM分析, 结果见图 3.由图可知, Mn掺杂制备的(Fe3-xMnx)1-δO4与γ-Fe2O3呈现出不同的微观形貌, γ-Fe2O3材料表面形状不一, 无序的碎片和块状颗粒显示出较差的均匀性, 并且颗粒之间的相互作用明显相关.而在(Fe2.5Mn0.5)1-δO4图中没有看到明显的片状颗粒, 外观主要显示为球形, 形成致密、堆积和聚集的颗粒, 并且颗粒的结构显示出很大的不均一性.与γ-Fe2O3相比, (Fe2.5Mn0.5)1-δO4的黏连现象较轻, 颗粒物相对独立.反应发生时, 气相中的汞会首先扩散到吸附剂表面, 吸附活化后进行反应, 因此, 反应物在材料孔道内的扩散情况将会影响其吸附性能.综上所述, 相对于块状及片状颗粒, 独立的球状颗粒能够保证孔道之间的连通性, 减少气体在吸附剂中的扩散阻力, 加速传质过程, 同时球状颗粒物拥有较大的表面积, 能够提供更多的吸附活性位.
图 3(Fig. 3)
 |
| 图 3 γ-Fe2O3 (a)和(Fe2.5Mn0.5)1-δO4 (b) 的表面形貌照片 Fig. 3Photographs of the surface morphology of γ-Fe2O3(a) and (Fe2.5Mn0.5)1-δO4(b) |
3.1.3 XRD表征粉末X-射线衍射在日本理学D/max-2200/PC衍射仪上完成, 扫描速度为7°·min-1, 扫描范围为10°~80°, Cu Kα靶, 管电压为35 kV, 管电流为30 mA.图 4为Mn掺杂所得(Fe2.5Mn0.5)1-δO4和γ-Fe2O3的XRD谱图.与JCPDS39-1346标准光谱相比, 非常符合标准光谱的是, 在2θ=30.2°、35.6°、43.3°、53.7°、57.3°和62.9°处两种吸附剂均具有明显的γ-Fe2O3晶格分布峰, 并且还表明(Fe2.5Mn0.5)1-δO4中掺杂的Mn是主要成分, 对相晶格影响不大, Mn氧化物的结晶度低.这可能是因为Mn以无定形式分散在(Fe2.5Mn0.5)1-δO4晶相内部, 与材料中的铁交互作用, 形成固溶体.观察图 4中(Fe2.5Mn0.5)1-δO4可知, 掺杂锰使得γ-Fe2O3的晶粒直径减小, 晶粒被细化.
图 4(Fig. 4)
 |
| 图 4 γ-Fe2O3和(Fe2.5Mn0.5)1-δO4的XRD谱图 Fig. 4XRD spectrum of γ-Fe2O3 and (Fe2.5Mn0.5)1-δO4 |
3.1.4 磁性分析图 5为(Fe2.75Mn0.25)1-δO4、(Fe2.5Mn0.5)1-δO4、(Fe2.25Mn0.75)1-δO4的磁滞回线, 图中显示没有明显的磁滞回线, 没有矫顽力, 也没有磁滞现象, 表明(Fe3-xMnx)1-δO4这类材料为超顺磁性体材料.(Fe2.75Mn0.25)1-δO4吸附剂时比饱和磁化强度σs=56.2 emu·g-1, 剩磁σr=1.16 emu·g-1, 矫顽力Hc=39.12 Oe;(Fe2.5Mn0.5)1-δO4吸附剂的σs=47.8 emu·g-1, σr=1.22 emu·g-1, Hc=38.22 Oe;(Fe2.75Mn0.25)1-δO4吸附剂的σs=42.2 emu·g-1, σr=1.37 emu·g-1, Hc=39.32 Oe.有一定的剩磁和矫顽力表明(Fe3-xMnx)1-δO4发生小部分团聚, 但很小, 所制备的(Fe3-xMnx)1-δO4在使用中没有磁聚的现象.实验表明, 普通磁体可以从10 g粉煤灰中分离出1 g 15%的15%-Mn/γ-Fe2O3.从图中还可知, 随着锰掺杂量的增加, (Fe3-xMnx)1-δO4的比饱和磁场强度有所降低, 但磁场强度均在40 emu·g-1以上, 能够达到磁分离的要求.
图 5(Fig. 5)
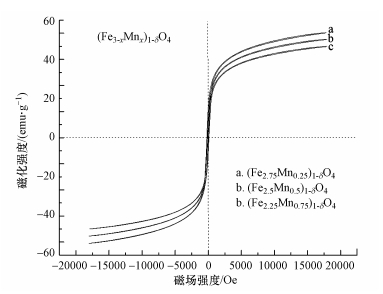 |
| 图 5 (Fe2.75Mn0.25)1-δO4、(Fe2.5Mn0.5)1-δO4及(Fe2.25Mn0.75)1-δO4的磁性特征 Fig. 5Magnetic characteristics of (Fe2.75Mn0.25)1-δO4, (Fe2.5Mn0.5)1-δO4 and (Fe2.25Mn0.75)1-δO4 |
3.1.5 H2-TPR采用H2-TPR的方法来探究吸附剂(Fe3-xMnx)1-δO4的氧化能力, 结果如图 6所示.对于单组分锰氧化物MnOx, 在370 ℃和520 ℃处出现的两个还原峰分别对应Mn4+向Mn3+的转化和Mn3+向Mn2+的转变;γ-Fe2O3的曲线中出现两个还原峰, 317 ℃处对应的是γ-Fe2O3被还原成Fe3O4, 高温段出现较宽的峰对应的是Fe3O4被还原成Fe0.随着锰的掺杂, 不同锰掺杂量的(Fe3-xMnx)1-δO4的还原峰都向低温区间偏移, 说明形成的(Fe3-xMnx)1-δO4中, 铁和锰之间并不是相互独立的, 存在着交互作用, 正是这种交互作用增强了(Fe3-xMnx)1-δO4的氧化能力.锰含量提高至x=0.5时, (Fe2.5Mn0.5)1-δO4的还原峰开始分裂, 在300~400 ℃出现还原峰, 说明锰铁之间存在强烈的交互作用, 锰的掺入对(Fe2.5Mn0.5)1-δO4的氧化能力影响较大, 并且在低温区形成较大的还原峰面积, 消耗的H2增加, 说明锰铁复合氧化物的氧化能力增强.当锰含量提高至x=0.75时, 还原峰的位置近似锰氧化物, 推测可能由于过多的锰含量抑制了锰铁复合间的交互作用, 使其更易形成独立的单组分锰的金属氧化物所致.
通过掺杂过渡金属元素锰, 能够提升(Fe3-xMnx)1-δO4吸附剂的氧化能力, 推测可能是由于金属氧化物之间的复合能够降低(Fe3-xMnx)1-δO4吸附剂表面价态高的锰发生还原反应的活化能, 克服能量壁垒, 宏观上表现出TPR的还原峰向低温区间偏移.
图 6(Fig. 6)
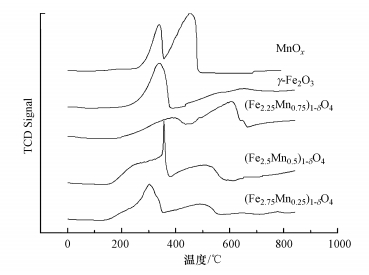 |
| 图 6 (Fe3-xMnx)1-δO4的H2-TPR曲线 Fig. 6H2-TPR curve of (Fe3-xMnx)1-δO4 |
3.2 掺杂量对零价汞在吸附剂表面吸附的影响图 7为N2+6%O2气体组分下, 反应温度200 ℃下不同锰掺杂量的(Fe3-xMnx)1-δO4对零价汞的吸附性能.从图中可以看出, 随着Mn掺入, 形成的锰铁复合金属氧化物对零价汞的吸附性能明显提升.当x=0.25时, (Fe2.75Mn0.25)1-δO4初始穿透率在21%左右, 提升Mn的掺杂量, 穿透率降低至18%并且在很长时间都维系着一个较低的穿透水平.Mn掺杂量增加, 可导致(Fe3-xMnx)1-δO4的比表面积和孔体积增大, 提供更多的反应活性位及通道, 增加了与汞接触的几率, 使其拥有较强的吸附能力.但Mn掺杂过量, 则会产生负效应, 破坏材料本身的结构, 减弱活性物质掺入所带来的正效应.
图 7(Fig. 7)
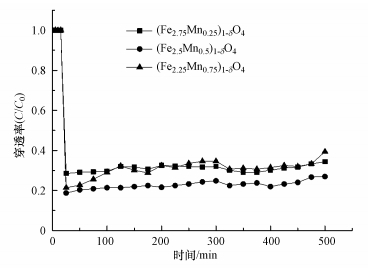 |
| 图 7 不同Mn掺杂量下(Fe3-xMnx)1-δO4吸附汞的穿透曲线 Fig. 7Penetration curve of mercury adsorption on (Fe2.5Mn0.5)1-δO4 under different Mn loading |
3.3 温度对零价汞在吸附剂表面吸附的影响图 8所示为在N2+6%O2气体组分下, 以(Fe2.5Mn0.5)1-δO4为吸附剂, 反应温度分别为100、150、200、250、300 ℃时汞的吸附实验.从图中可以看出, 反应温度对(Fe2.5Mn0.5)1-δO4吸附汞性能影响显著, 100 ℃时, 吸附剂的穿透率在20%, 温度升至150 ℃时, 穿透率下降至17%, 200 ℃时, 穿透率达到9%.可见在100~200 ℃的温度窗口, 温度的提高有利于汞的吸附.这是因为温度升高可增强吸附材料中分子的活化, 使得吸附过程中的化学活化能用于产生更多的分子.在此阶段, (Fe2.5Mn0.5)1-δO4对Hg0的吸附主要为化学吸附.同时, 根据碰撞理论, 分子运动的速度会随着温度的升高而增加.温度升高, 汞分子与(Fe2.5Mn0.5)1-δO4表面的有效碰撞增多, 反应速率提高, 最终导致穿透率降低.温度超过200 ℃后, 穿透率不断增加, 反应温度在300 ℃时, 穿透率超过了50%.其原因是高温下不利于吸附剂对零价汞的物理吸附, 会阻碍零价汞成为吸附态过渡产物, 影响之后该产物进一步发生反应, 即零价汞的氧化;此外, 在高温条件下表面生成的氧化汞也会发生脱附.实验结果表明, 在100~200 ℃的反应温度窗口, 温度高低与(Fe3-xMnx)1-δO4对汞的吸附能力成正比, 达到200℃时, 500 min内平均穿透率可达到9%.
图 8(Fig. 8)
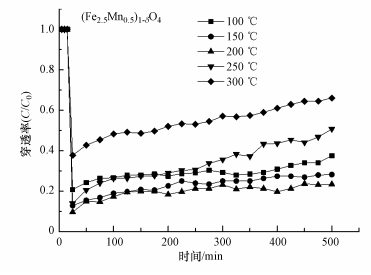 |
| 图 8 不同温度下(Fe2.5Mn0.5)1-δO4吸附汞的穿透曲线 Fig. 8Penetration curve of mercury adsorption on (Fe2.5Mn0.5)1-δO4 at different temperature |
3.4 空速对零价汞在吸附剂表面吸附的影响在N2+6%O2气体组分下, 考察了不同空速对(Fe3-xMnx)1-δO4脱汞效率的影响, 结果见图 9.采用带有控制体积流速的装置, 将相应风速调整为12000、24000、36000、48000 h-1, 并满足大多数空塔的设计要求, 吸附床层温度为200 ℃, 初始汞浓度为80 μg·m-3.由图 9可知, 在相同使用(Fe3-xMnx)1-δO4的情况下, 空速为12000 h-1和24000 h-1时, 其初始穿透率分别为11%和12%, 进一步增加空速至36000、48000 h-1, 穿透率在初始阶段变化幅度很小, 这说明空速对(Fe3-xMnx)1-δO4的脱汞效率有一定影响.碰撞理论认为吸附反应需要分子间发生有效碰撞才能进行, 空速的增加意味着每单位时间反应分子数的减少, 降低了碰撞机率, 从而导致反应速率增加和更高的渗透率, 但穿透率随空速增加下降幅度并不大.实验结果表明, 空气流速对(Fe3-xMnx)1-δO4上汞迁移的影响相对较小, 即对于气态零价汞在(Fe3-xMnx)1-δO4上的吸附过程来说, 影响吸附效果的重要步骤不是外部扩散过程.
图 9(Fig. 9)
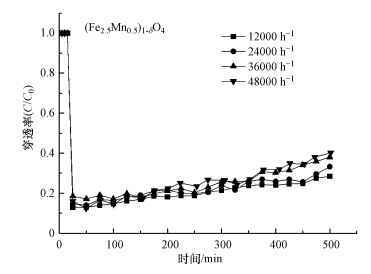 |
| 图 9 不同空速下(Fe2.5Mn0.5)1-δO4吸附汞的穿透曲线 Fig. 9Penetration curve of mercury adsorption on (Fe2.5Mn0.5)1-δO4 under different space velocity |
3.5 脱汞机制的初步推测对于锰铁复合磁性材料脱汞机理, 陈佳敏等(2020)基于密度泛函理论对Hg在Mn掺杂的具有Feoct2-终端的Fe3O4(1 1 1)表面上的吸附情况进行了机理研究, 通过对结构优化后得到的各稳定构型的Mulliken电荷数、吸附能、键长、键布居数及吸附后部分态密度图中的s、p、d轨道进行结合分析后得出以下结论:通过考察Hg0在不同Mn掺杂位置上的吸附效果发现, 随着Mn掺杂量增多, 吸附效果增强, 该结果符合实验结论;Hg0在具有Feoct2-终端的Mn/Fe3O4(1 1 1)表面上的吸附不仅有物理吸附还有一定程度的化学吸附, 而在吸附时, Hg更倾向于Mn-Hg反应.Yang等(2018)研究了碳纳米纤维(CNF)负载磁性铁锰二元氧化物(Fe3-xMnxO4)对烟气汞的脱除, 结果显示, 随着Fe3O4尖晶石结构中Mn含量的增加, Fe3-xMnxO4/CNF对Hg0的去除性能明显提高, 反应过程遵循Mars-Maessen机理.综上推测, Hg0在(Fe3-xMnx)1-δO4表面上的吸附不仅有物理吸附还有一定程度的化学吸附.
4 结论(Conclusions)1) 在磁性铁氧化物中引入过渡金属锰, 可明显增强材料对汞的氧化能力, 过渡金属锰与汞之间的相互间作用是材料具备较好氧化能力的重要原因.(Fe3-xMnx)1-δO4的理化性质和脱汞能力与Mn的掺杂量和温度密切相关, 随着掺杂量的增加, 吸附剂的比表面积和孔体积增加, 并且孔径减小.
2) 当反应温度为100~200 ℃时, (Fe3-xMnx)1-δO4对Hg的吸附能力随温度的升高而增强, 超过200 ℃后, (Fe3-xMnx)1-δO4的吸附性能减弱, 在100~200 ℃的温度窗口内, 其对汞的吸附性能最优, 空速对这一材料吸附汞的能力影响较小.
参考文献
| 安东海, 程星星, 周滨选, 等. 2019. 准东煤基粉状活性焦对烟气中汞的吸附及再生性能研究[J]. 煤炭学报, 44(6): 1891-1898. |
| Bin H, Yang Y, Cai L, et al. 2019. Enhancing mercury removal across air pollution control devices for coal-fired power plants by desulfurization wastewater evaporation[J]. Environmental Technology, 40: 154-162. DOI:10.1080/09593330.2017.1380716 |
| 陈力, 刘盛余, 吕维阳, 等. 2019. 锰负载对磁性铁氧化物吸附Hg0的影响[J]. 环境工程, 37(9): 131-137. |
| Chen D Y, Zhao S J, Qu Z, et al. 2018. Cu-BTC as a novel material for elemental mercury removal from sintering Gas[J]. Fuel, 217: 297-305. DOI:10.1016/j.fuel.2017.12.086 |
| 车凯, 李振海, 韩忠阁, 等. 2018. 燃煤电厂汞脱除特性及迁移规律[J]. 洁净煤技术, 24(2): 114-118. |
| 陈佳敏. 2020. 燃煤烟气汞在Mn/Fe3O4(1 1 1)表面吸附的密度泛函理论研究[D]. 南京: 南京师范大学 |
| Chen L, Liang S, Liu M D, et al. 2019. Trans-provincial health impacts of atmospheric mercury emissions in China[J]. Nature Communications, 10: 1484. DOI:10.1038/s41467-019-09080-6 |
| Hsi H C, Tsai C Y, Kuo T H, et al. 2011. Development of low-concentration mercury adsorbents from biohydrogen-generation agricultural residues using sulfur impregnation[J]. Bioresource Technology, 102(16): 7470-7477. DOI:10.1016/j.biortech.2011.05.036 |
| 罗锦英. 2009. 改性活性炭对烟气中气态汞的吸附研究[D]. 厦门: 厦门大学 |
| 刘晓星. 2017. 开展汞排放清单研究切实有效防控汞污染[N]. 中国环境报, 05-03(5) |
| 李向阳. 2019. MnOx-CeOx改性活性炭用于模拟烟气中元素汞脱除[D]. 大连: 大连理工大学 |
| 刘含笑, 陈招妹, 王伟忠, 等. 2019. 燃煤电厂烟气Hg排放特征及其吸附脱除技术研究进展[J]. 环境工程, 37(8): 128-133. |
| Ma J, Mei D, Tian X, et al. 2019. Fate of mercury in volatiles and char during in situ gasification chemical-looping combustion of coal[J]. Environmental Science & Technology, 53: 137887-7892. |
| 戚政武, 杨宁祥, 王磊, 等. 2016. 纳米四氧化三铁黑磁粉的优点和应用前景[J]. 特种设备安全技术, (5): 43-44. |
| 任建莉, 周劲松, 骆仲泱, 等. 2006. 钙基类吸附剂脱除烟气中气态汞的试验研究[J]. 燃料化学学报, 34(5): 557-561. DOI:10.3969/j.issn.0253-2409.2006.05.009 |
| Shen B X, Zhu S W, Zhang X, et al. 2018. Simultaneous removal of NO and HgO using Fe and Co co-doped Mn-Ce/TiO2 catalysts[J]. Fuel, 224: 241-249. DOI:10.1016/j.fuel.2018.03.080 |
| Shen B, Tian L, Li F, et al. 2017. Elemental mercury removal by the modified bio-char from waste tea[J]. Fuel, 187: 189-196. DOI:10.1016/j.fuel.2016.09.059 |
| 孙青柯, 黄亚继, 王靓, 等. 2017. 磁性Fe3O4-Ag复合纳米颗粒吸附剂脱汞性能实验研究[J]. 化工进展, 36(3): 1101-1106. |
| 孙涛, 王光辉, 陆安慧, 等. 2010. 磁性氧化铁纳米颗粒的研究进展[J]. 化工进展, (7): 1241-1250. |
| 吾竺娟, 魏文栋, 孟靖, 等. 2020. 煤电大气汞驱动因素, 排放预测和减排策略研究: 以辽宁省为例[J]. 中国环境管理, 12(2): 95-104. |
| 吴小琴, 王金星. 2018. 燃煤电厂汞的迁移转化特性的分析[J]. 广东化工, 45(14): 85-87. DOI:10.3969/j.issn.1007-1865.2018.14.037 |
| Wang Y, Han X, Liu Y X, et al. 2019. Removal of gaseous elemental mercury by hydrogen chloride non-thermal plasma modified biochar[J]. Environmental Science & Technology, 53: 10387-10397. |
| Wojciechowska K M, Krol M, Bajda T, et al. 2019. Sorption of heavy metal cations on mesoporous ZSM-5 and mordenite zeolites[J]. Materials, 12(19): 3271. DOI:10.3390/ma12193271 |
| 谢武明, 毕小林, 黄子峻, 等. 2020. 纳米活性氧化铝负载磁性纳米零价铁对不同重金属的吸附机理[J]. 环境科学学报, 40(8): 2732-2740. |
| Yang J P, Zhu W B, Zhang S, et al. 2019. Role of flue gas components in Hg 0 oxidation over La0.8 Ce0.2MnO3 perovskite catalyst in coal combustion flue gas[J]. Chemical Engineering Journal, 360: 1656-1666. DOI:10.1016/j.cej.2018.10.218 |
| Yang J, Zhao Y, Liang S, et al. 2018. Magnetic iron-manganese binary oxide supported on carbon nanofiber (Fe3-xMnxO4/CNF) for efficient removal of Hg0 from coal combustion flue gas[J]. Chemical Engineering Journal, 334: 216-224. DOI:10.1016/j.cej.2017.10.004 |
| 周普阳, 张新民, 张安超, 等. 2020. Ag-AgIO3改性BiOI光催化剂湿法脱除气态单质汞[J]. 中国环境科学, 40(11): 4703-4711. DOI:10.3969/j.issn.1000-6923.2020.11.008 |
| Zhao Y, Hao R L, Guo Q, et al. 2014. A novel pre-oxidation method for elemental mercury removal utilizing a complex vaporized absorbent[J]. Journal of Hazardous Materials, 280: 118-126. DOI:10.1016/j.jhazmat.2014.07.061 |
| Zhang S B, Zhao Y C, Yang J P, et al. 2018. Fe-modified MnOx/TiO2 as the SCR catalyst for simultaneous removal of NO and mercury from coal combustion flue gas[J]. Chemical Engineering Journal, 348: 618-629. DOI:10.1016/j.cej.2018.05.037 |
| 周强, 段钰锋, 卢平. 2018. 燃煤电厂吸附剂喷射脱汞技术的研究进展[J]. 化工进展, 37(11): 345-352. |
| Zhou Q, Tao X, Lei Y, et al. 2019. Effect of molybdenum incorporation on the activity of magnetic Fe-Mn sorbent for the capture of elemental mercury[J]. Energy & Fuels, 33: 2390-2398. |
| Zhang Y, Zhang Z, Liu Z, et al. 2017. Study on the mercury captured by mechanochemical and bromide surface modification of coal fly ash[J]. Fuel, 200: 427-434. DOI:10.1016/j.fuel.2017.03.095 |
| 张安超, 张洪良, 宋军, 等. 2015. Mn-Co/MCM-41吸附剂表征及脱除烟气中单质汞研究[J]. 中国环境科学, 35(5): 1319-1327. DOI:10.3969/j.issn.1000-6923.2015.05.005 |
