 , 梁晓怿
, 梁晓怿
 , 乔文明
, 乔文明华东理工大学, 化学工程联合国家重点实验室, 特种功能高分子材料及相关技术教育部重点实验室, 上海 200237
收稿日期: 2020-12-20; 修回日期: 2021-02-10; 录用日期: 2021-02-10
基金项目: 国家自然科学基金(No.21177038)
作者简介: 吉龙彪(1996-), 男, E-mail: jlb180800@foxmail.com
通讯作者(责任作者): 梁晓怿, E-mail: xyliang@ecust.edu.cn
摘要:利用分子模拟软件构建狭缝孔模型,通过调节官能团的种类、含量及湿度,了解在不同情况下活性炭吸附二氯甲烷时应选择的结构.结果表明,在1.0 nm的孔中加入适当数量的羰基、羟基或羧基,在低压下都有利于二氯甲烷的吸附,其中,羧基的吸附效果最好.在二氯甲烷分压为1 Pa条件下,孔径为1.0 nm、羧基含量为6.25%的活性炭和孔径为1.0 nm、羰基含量为3.13%的活性炭,其二氯甲烷的吸附量受湿度的影响较小,而其他吸附剂的吸附量都随湿度的增加而降低.
关键词:二氯甲烷活性炭官能团吸附分子模拟
Molecular simulation of the influences of functional groups and humidity on the adsorption of dichloromethane on activated carbon
JI Longbiao
 , LIANG Xiaoyi
, LIANG Xiaoyi
 , QIAO Wenming
, QIAO WenmingState Key Laboratory of Chemical Engineering, Key Laboratory of Special Functional Polymer Materials and Related Technologies, East China University of Science and Technology, Shanghai 200237
Received 20 December 2020; received in revised from 10 February 2021; accepted 10 February 2021
Abstract: The simulation software, Materials Studio, has been applied to construct a slit-shaped pore model to select the proper structure by adjusting the type, content, and humidity of functional groups for activated carbon that can adsorb dichloromethane. The results show that the absorbability of dichloromethane is modified by adding an appropriate amount of carbonyl, hydroxyl, or carboxyl groups to 1.0 nm pore under low pressure, and adding carboxyl groups has the best result. The adsorption capacity of dichloromethane is less affected by humidity when carboxyl content is 6.25% and carbonyl content is 3.13% (at 1 Pa partial pressure of dichloromethane and activated carbon with 1.0 nm pore), while the adsorption capacity of other adsorbents decreases with an increase in humidity.
Keywords: dichloromethaneactivated carbonfunctional groupsadsorptionmolecular simulation
1 引言(Introduction)二氯甲烷作为一种甲烷氯化物, 被广泛用于金属清洗、脱漆剂、粘合剂、发泡剂和农药等方面(Huang et al., 2014).目前涉及制备二氯甲烷的工艺主要包括天然气氯化工艺、氯甲烷氯化工艺.若将二氯甲烷排入大气中, 会破坏臭氧层, 危害生态环境, 因此, 必须要严格控制二氯甲烷的排放, 重视对二氯甲烷的处理(Dobrzyńska et al., 2010).常用的处理二氯甲烷的方法主要包括焚烧法、金属催化法、吸附法、电化学法、光催化法、生物滴滤法等(Henry et al., 2002;Huang et al., 2013;Yu et al., 2014;Cao et al., 2016;Almomani et al., 2020).其中, 焚烧法成本较高, 且容易产生如光气、二噁英等有害副产物(Buekens et al., 1998), 金属催化法中催化剂容易因焦结、氯化等原因而失活(Han et al., 2016), 而吸附法因为具有成本低、方便设计、操作简单等优势而被广泛使用(Dai et al., 2018).
活性炭作为一种常见的吸附剂, 具有良好的吸附能力, 可以有效地吸附二氯甲烷.Hsu等(2014)采用麻风树种作为原料, 以NaOH作为活化剂通过化学活化成功制备活性炭, 并通过吸附二氯甲烷等多种含氯挥发性有机物以测试其吸附性能.Lemus等(2012)的实验表明, 商业活性炭可以高效地吸附气流中的二氯甲烷, 并能在温和条件下实现吸附剂的再生.
活性炭的自身结构会影响其对二氯甲烷的吸附.对于活性炭孔结构的影响, 实验表明, 增加微孔数量有利于提高二氯甲烷的吸附容量(Tsai et al., 2008;李香燕等, 2014).而有关表面官能团对吸附影响的研究并不多, Lemus等(2012)研究表明, 二氯甲烷的吸附量受官能团的影响, 其中, 羰基、羧酸酐等作为氢键受体基团对吸附有利, 而羟基、羧基等作为氢键供体基团则不利于吸附, 但并未涉及官能团含量对二氯甲烷吸附的影响.
高湿度条件也会影响活性炭对二氯甲烷的吸附.例如, 周剑锋等(2013)的实验表明, 当二氯甲烷气体中水分含量过多时, 吸附会受到干扰, 而使用吸水饱和炭甚至不会发生吸附.另外, 二氯甲烷具有较强的挥发性, 其在低浓度下容易挥发到大气中造成危害, 因此, 有必要研究在低浓度下活性炭对二氯甲烷的吸附情况.
分子模拟提供了一种能对上述问题进行研究的方法.通过分子模拟, 可以控制二氯甲烷的分压和表面官能团的种类和数量, 从微观层面对吸附现象进行解释(Chen et al., 2010).本研究使用Materials Studio软件(Liang et al., 2017), 建立活性炭狭缝孔模型, 对二氯甲烷分子进行吸附, 研究官能团和湿度对活性炭吸附二氯甲烷的影响, 从而了解在不同情况下吸附二氯甲烷时应选择的活性炭结构.
2 实验方法(Experimental method)2.1 建立模型利用Materials Studio软件进行模型的建立和运算.实验中使用的活性炭孔模型是狭缝孔模型(Davies et al., 1999).建立模型后, 要先使用Forcite模块对模型进行优化, 然后用Sorption等模块进行实验计算.
建立的活性炭狭缝孔模型如图 1所示, 片层平面尺寸为1.968 nm×1.968 nm, 模型的孔径分别为1.0、1.5、2.0 nm.对于包含官能团的狭缝孔模型, 在孔壁的两侧上分别负载含羰基、羟基和羧基的官能团, 在孔壁一侧所负载的官能团数量分别为2、4、8、16个, 即植入官能团的摩尔比例分别为1.56%、3.13%、6.25%、12.50%.用None w代表不同孔径的不含官能团的狭缝孔模型, w代表孔径.例如, None w10表示该不含官能团的狭缝孔孔径为1.0 nm的模型.含有羟基、羰基、羧基官能团的孔模型分别用OH x-w、C=O x-w和COOH x-w表示, 其中, x代表在孔壁一侧所负载的官能团数量, w代表孔径.例如, OH x4-w10表示含有羟基的狭缝孔孔径为1.0 nm的模型, 植入官能团的摩尔比例为3.13%.
图 1(Fig. 1)
 |
| 图 1 不含官能团的狭缝孔模型 Fig. 1Slit-shaped pore model without functional groups |
2.2 确定参数计算时使用Metropolis蒙特卡洛模拟方法, 力场为Compass立场, 设定的温度为298 K, 测定含有不同官能团的狭缝孔在不同压力、不同孔径下吸附二氯甲烷的吸附等温线.考虑到吸附法的吸附能力的限制, 用吸附法吸附吸附质的浓度并不高(Dai et al., 2018), 而且在行业应用中也很少用到高于1 kPa的分压(Borkar et al., 2010), 因此, 将压力范围设在1×10-7~1 kPa, 对数取点.用Atom based法计算范德华力, Ewald & Group求和法计算静电作用力.为确保吸附过程达到平衡, 设定的平衡步为2×107步, 模拟的计算步为2×107步.
3 结果与讨论(Results and discussion)3.1 官能团对二氯甲烷吸附的影响图 2是二氯甲烷分子在1.0 nm的孔径下, 不含官能团的狭缝孔及官能团分别为羰基、羧基、羟基, 摩尔含量分别为3.13%(图 2a)和6.25%(图 2b)的狭缝孔中的吸附等温线.从图 2可以看出, 当压力超过某一数值时二氯甲烷分子开始被吸附, 且在刚开始吸附时吸附容量快速上升, 随后吸附曲线趋于平缓, 吸附量接近饱和.另外, 在狭缝孔中添加官能团可以降低开始吸附二氯甲烷分子的压力.为了方便阐述, 将吸附剂开始吸附一个二氯甲烷分子的压力, 即二氯甲烷的吸附容量达到0.50 mmol·cm-3时所对应的压力, 称为起始吸附压力(池君杰等, 2015).
图 2(Fig. 2)
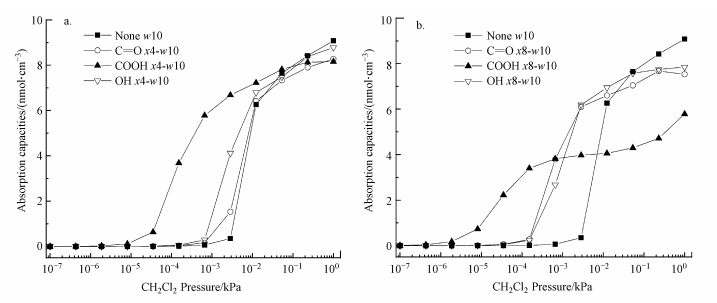 |
| 图 2 二氯甲烷在官能团摩尔含量分别为3.13% (a)和6.25% (b) 的1.0 nm孔中各吸附剂的吸附等温线 Fig. 2Dichloromethane adsorption isotherms in 1.0 nm slit-shaped pore with the molar content of functional groups which are 3.13%(a) and 6.25%(b) |
对比图 2a和图 2b还可以得出, 在狭缝孔中添加官能团的数量不同也会影响其起始吸附压力.图 3给出了二氯甲烷在1.0 nm孔中随官能团数量不同起始吸附压力的变化.从图 3可以看出, 对于没有添加官能团的1.0 nm孔, 其起始吸附压力为3.077 Pa.当孔中官能团的摩尔含量为1.56%时, 起始吸附压力开始降低, OH x2-w10、C=O x2-w10和COOH x2-w10的起始吸附压力分别为2.811、2.122和1.044 Pa.当孔中官能团的摩尔含量为3.13%时, 起始吸附压力进一步降低, OH x4-w10、C=O x4-w10和COOH x4-w10的起始吸附压力分别为0.775、1.188和0.028 Pa.当孔中官能团的摩尔含量为6.25%时, 含有3种不同官能团的起始吸附压力都降至最低值, OH x8-w10、C=O x8-w10和COOH x8-w10的起始吸附压力分别为0.205、0.183和0.005 Pa.而当孔中官能团的摩尔含量提高至12.50%时, OH x16-w10和C=O x16-w10的起始吸附压力明显升高.而对于COOH x16-w10, 其起始吸附压力并未在图中显示, 这是因为过多的羧基占据在孔内, 使得孔中能吸附二氯甲烷的空间大幅减小, 从而丧失了吸附能力.从图 2b可以发现, 在0.05~1 kPa的分压下, 吸附剂的吸附量遵循None>OH>C=O>COOH的规律, 而在图 2a中却没有这样的规律.这说明孔内的官能团数量过多除了会增加起始吸附压力外, 还会降低在较高压力下二氯甲烷的吸附量.
图 3(Fig. 3)
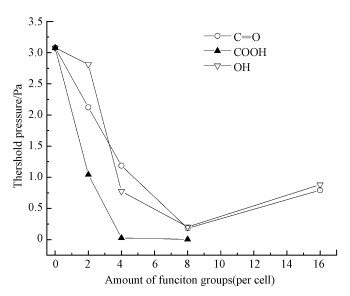 |
| 图 3 二氯甲烷在不同官能团数量的1.0 nm孔中的起始吸附压力 Fig. 3Threshold pressure of dichloromethane in 1.0 nm slit-shaped pore with carbonyl, hydroxyl, and carboxyl groups in different amounts |
为了进一步解释官能团对二氯甲烷吸附的影响, 计算了二氯甲烷在1.0 nm孔的各种吸附剂中的单分子非键能、单分子范德华力和单分子静电力, 结果如表 1所示.非键能是指范德华力、静电力和氢键相互作用对相互作用能的总贡献, 而单分子非键能只包括吸附质与吸附剂间的相互作用, 不包括吸附质之间的相互作用.
表 1(Table 1)
| 表 1 二氯甲烷在孔径为1.0 nm的各种吸附剂中的单分子非键能、单分子范德华力和单分子静电力 Table 1 Non-bond energy, van der Waals energy, and electrostatic energy of dichloromethane monomolecular in different absorbents with 1.0 nm pore | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 二氯甲烷在孔径为1.0 nm的各种吸附剂中的单分子非键能、单分子范德华力和单分子静电力 Table 1 Non-bond energy, van der Waals energy, and electrostatic energy of dichloromethane monomolecular in different absorbents with 1.0 nm pore
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
由表 1可知, 在官能团种类不变的情况下, 改变负载官能团的数量, 除COOH x16-w10以外, 二氯甲烷单分子非键能的变化规律与图 3中起始吸附压力的变化规律相同, 这说明单分子非键能是影响起始吸附压力变化的重要因素.在官能团摩尔含量分别为1.56%、3.13%和6.25%的吸附剂中, 含羧基的吸附剂单分子非键能都高于含羰基或羟基的吸附剂, 因此, 含羧基的吸附剂的起始吸附压力最低.其中, 摩尔含量为6.25%的吸附剂的单分子非键能都高于其他摩尔含量的吸附剂, 因此, 在低浓度下适当添加一定含量的羟基、羧基和羰基都有助于降低起始吸附压力, 且含羧基的吸附剂的吸附效果最好, 这与Lemus等(2012)所得的结论不一致.
对于静电力, 由于羰基本身不带电荷, 含羰基的吸附剂的单分子静电力与None w10相比没有明显变化.而羧基和羟基虽然都带电荷, 但羧基比羰基多包含一个氧原子, 所以前者的静电力大于后者.其中, COOH x16-w10的静电力为正值, 这说明二氯甲烷与吸附剂之间产生的是排斥作用而非吸附作用, 这与在图 3中未能显示其起始吸附压力的结果相呼应.
对于吸附过程中是否存在氢键相互作用, 因为非键能是指范德华力、静电力和氢键相互作用三者之和, 而从表 1可以发现对于每种吸附剂, 其单分子非键能的数值约等于单分子范德华力和静电力之和, 氢键相互作用的数值可以忽略不计, 这说明在吸附剂吸附单分子二氯甲烷的过程中未发生氢键的相互作用.
通过模拟软件计算不仅能得到吸附1个二氯甲烷分子下单分子非键能、单分子范德华力和单分子静电力, 还可以得到吸附单个二氯甲烷分子时使其能量最低的吸附位.从狭缝孔模型的正视角度观察, 可以把二氯甲烷的2个氯原子相连构成的直线与狭缝孔孔壁所在平面的位置关系分为平行、垂直、斜交3种.图 4a和4b分别代表处于平行位置关系的两种不同情况, 图 4c表示处于垂直位置关系的情况.
图 4(Fig. 4)
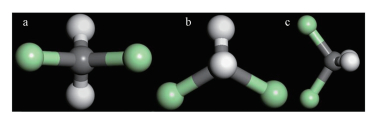 |
| 图 4 单个二氯甲烷分子在吸附剂中的构型示意图 (a.平行位置关系1, b.平行位置关系2, c.垂直位置关系) Fig. 4Schematic diagram of the configuration of a single dichloromethane molecule in the adsorbent |
表 2给出了在孔径为1.0 nm、添加了官能团的狭缝孔中单个二氯甲烷分子与吸附平面的位置关系.另外, 因为对于1.0 nm且不含官能团的孔和1.5 nm的各种孔, 二氯甲烷的两个氯原子的连线与吸附平面的位置关系都是平行关系, 所以二氯甲烷分子在狭缝孔中的吸附位一般是如图 4a或4b所示.根据表 2可知, 吸附剂COOH x4-w10、OH x8-w10和OH x16-w10在二氯甲烷分子的吸附位方面与其他吸附剂不同.
表 2(Table 2)
| 表 2 在1.0 nm孔中二氯甲烷分子与吸附平面的位置关系 Table 2 Positional relationship between a single dichloromethane molecule and adsorption plane in 1.0 nm pore | ||||||||||||||||||||||||
表 2 在1.0 nm孔中二氯甲烷分子与吸附平面的位置关系 Table 2 Positional relationship between a single dichloromethane molecule and adsorption plane in 1.0 nm pore
| ||||||||||||||||||||||||
图 5给出了在COOH x4-w10和OH x8-w10中吸附单个二氯甲烷分子的能量最低吸附位.如图 5a所示, 在吸附剂COOH x4-w10中, 优化后的狭缝孔具有上下对称性, 二氯甲烷分子处于垂直状态下, 其两个氯原子分别与孔壁一侧的羧基保持适当的距离, 使其构型比处于平行状态下更稳定.对于吸附剂OH x8-w10和OH x16-w10, 可能是因为优化后狭缝孔的孔壁上同一相对位置的羟基, 其氧原子的朝向不一致, 并由于狭缝孔的孔径较小使得二氯甲烷分子受到孔壁两侧相对位置不同的羟基的影响, 从而处于斜交状态下.
图 5(Fig. 5)
 |
| 图 5 二氯甲烷在COOH x4-w10 (a)和OH x8-w10 (b) 中吸附的能量最低构型 Fig. 5Energetically favorable configuration of dichloromethane adsorption in COOH x4-w10 (a) and OH x8-w10(b) |
为了能在给定的二氯甲烷分压范围内寻找吸附效果最好的吸附剂, 将该压力范围在孔径为1.5 nm和2.0 nm的各种吸附剂中的吸附量与其在孔径为1.0 nm吸附剂中的吸附量进行比较.在确定含羧基的吸附剂吸附效果最好的前提下, 图 6给出了二氯甲烷在不同孔径、含不同数量羧基的孔中的吸附量.
图 6(Fig. 6)
 |
| 图 6 二氯甲烷在不同孔径、含不同数量羧基的孔中的吸附等温线 Fig. 6Dichloromethane adsorption isotherms at 298 K in different pores with carboxyl groups |
从图 6可以得到, 当二氯甲烷的分压为2×10-6~10-4 kPa时, 在1.0 nm孔中, 羧基含量为6.25%的吸附剂COOH x8-w10的吸附效果最佳.当二氯甲烷的分压在10-4~10-1 kPa范围内, 在1.0 nm孔中, 羧基含量为3.13%的吸附剂COOH x4-w10的吸附效果最佳.当二氯甲烷的分压在1 kPa时, 在1.5 nm孔中, 羧基含量为6.25%的吸附剂COOH x8-w15的吸附效果最佳.
3.2 湿度对二氯甲烷吸附的影响选取了5种不同的吸附剂并分别在相对湿度为10%、50%、80%、100%的条件下进行重复试验.图 7给出了这些吸附剂在温度为298 K、不同湿度条件下的起始吸附压力和二氯甲烷分压为1 Pa下的吸附容量.从图 7a可以看出, 随着湿度的增加, 吸附剂COOH x4-w10和OH x8-w10的起始吸附压力逐渐升高, 吸附剂COOH x8-w10和OH x4-w10的起始吸附压力在湿度分别达到80%和50%后开始升高, 在此之前几乎不变, 吸附剂C=O x4-w10的起始吸附压力没有明显变化.从图 7b可以看出, 吸附剂COOH x4-w10和OH x8-w10的吸附量随湿度增加不断减少.吸附剂OH x4-w10的吸附量刚开始没有变化, 到湿度达到50%后开始减少.除湿度为0的情况外, 吸附剂C=O x4-w10的吸附量随湿度增加保持不变, 但湿度大于0时的吸附量相比湿度为0时有所减少.而吸附剂COOH x8-w10的吸附量随湿度增加没有明显变化.
图 7(Fig. 7)
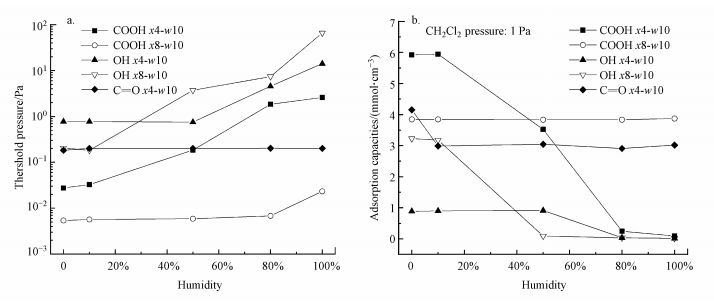 |
| 图 7 二氯甲烷在不同孔中随湿度变化的起始吸附压力(a)和二氯甲烷分压在1 Pa时的吸附容量(b) Fig. 7Threshold pressure of dichloromethane in different pores with humidity(a) and Adsorption capacity at 1 Pa in dichloromethane partial pressure(b) |
综上所述, COOH x8-w10和C=O x4-w10可以有效减轻在吸附二氯甲烷气体时受水蒸汽的影响.对于吸附剂C=O x4-w10, 其无论在何种湿度下对水蒸汽的吸附量都很少.对于吸附剂COOH x8-w10, 虽然其在高湿度、低二氯甲烷分压下会吸附水蒸汽, 但随着二氯甲烷分压逐渐升高, 当二氯甲烷的吸附量开始快速上升时, 水蒸汽的吸附量同时降低, 狭缝孔中的水分子逐渐被二氯甲烷分子替代.同样含有羧基官能团的吸附剂COOH x4-w10的吸附效果却远不如吸附剂COOH x8-w10, 这可能是因为水分子的存在阻碍了狭缝孔内的二氯甲烷分子形成垂直状态的能量最优吸附位所致.
4 结论(Conclusions)使用分子模拟软件构建吸附模型并进行运算, 了解官能团种类和含量对二氯甲烷吸附的影响, 并从中选取一部分吸附剂, 考察其受湿度的影响.结果表明, 在低浓度下, 对于羰基、羟基和羧基, 在活性炭中加入适当含量的官能团都有利于二氯甲烷的吸附.若加入官能团的含量不变, 含羧基的吸附剂的吸附效果优于含羟基或羰基的吸附剂.当二氯甲烷分压在2×10-6~10-4 kPa范围内, 孔径为1.0 nm、羧基含量为6.25%的活性炭的吸附效果最佳;当二氯甲烷分压在10-4~10-1 kPa范围内, 孔径为1.0 nm、羧基含量为3.13%的活性炭的吸附效果最佳.当二氯甲烷分压在1 Pa下, 孔径为1.0 nm、羧基含量为6.25%的活性炭和孔径为1.0 nm、羰基含量为3.13%的活性炭在吸附二氯甲烷时受湿度的影响较小.
参考文献
| Almomani F, Rene E R, María C, et al. 2020. Treatment of waste gas contaminated with dichloromethane using photocatalytic oxidation, biodegradation and their combinations[J]. Journal of Hazardous Materials, 405: 123735. |
| Borkar C, Tomar D, Gumma S. 2010. Adsorption of dichloromethane on activated carbon[J]. Journal of Chemical & Engineering Data, 55(4): 1640-1644. |
| Buekens A, Huang H. 1998. Comparative evaluation of techniques for controlling the formation and emission of chlorinated dioxins/furans in municipal waste incineration[J]. Journal of Hazardous Materials, 62: 1-33. DOI:10.1016/S0304-3894(98)00153-8 |
| Cao S, Wang H Q, Yu F X, et al. 2016. Catalyst performance and mechanism of catalytic combustion of dichloromethane (CH2Cl2) over Ce doped TiO2[J]. Journal of Colloid & Interface science, 463: 233-241. |
| Chen J J, Ren J L, Zhong Y J, et al. 2010. Application development of molecular simulation in gas-solid adsorption mechanism[J]. Light Industry Machinery, 28(6): 5-9. |
| 池君杰, 梁晓怿, 余青霓, 等. 2015. 分子模拟研究活性炭表面官能团对丙酮吸附的影响[J]. 航天医学与医学工程, 28(4): 284-287. |
| Dai C H, Zhou Y Y, Peng H, et al. 2018. Current progress in remediation of chlorinated volatile organic compounds: A review[J]. Journal of Industrial and Engineering Chemistry, 62: 106-119. DOI:10.1016/j.jiec.2017.12.049 |
| Davies G M, Seaton N A, Vassiliadis V S. 1999. Calculation of pore size distributions of activated carbons from adsorption isotherms[J]. Langmuir, 15(23): 8235-8245. DOI:10.1021/la9902643 |
| Dobrzyńska E, Po?niak M, Szewczyńska M, et al. 2010. Chlorinated volatile organic compounds-Old, However, actual analytical and toxicological problem[J]. Critical Reviews in Analytical Chemistry, 40(1): 41-57. DOI:10.1080/10408340903547054 |
| Han Y, Liu C, Horita J, et al. 2016. Trichloroethene hydrodechlorination by Pd-Fe bimetallic nanoparticles: Solute-induced catalyst deactivation analyzed by carbon isotope fractionation[J]. Applied Catalysis B: Environmental, 188: 77-86. DOI:10.1016/j.apcatb.2016.01.047 |
| Henry S M, Hardcastle C H, Warner S D. 2002. Chlorinated solvent and DNAPL remediation: An overview of physical, chemical, and biological processes[C]. American Chemical Society, 37: 1-20 |
| Hsu S H, Huang C S, Chung T W, et al. 2014. Adsorption of chlorinated volatile organic compounds using activated carbon made from Jatropha curcas seeds[J]. Journal of the Taiwan Institute of Chemical Engineers, 45: 2526-2530. DOI:10.1016/j.jtice.2014.05.028 |
| Huang B B, Lei C, Wei C H, et al. 2014. Chlorinated volatile organic compounds (Cl-VOCs) in environment-sources, potential human health impacts, and current remediation technologies[J]. Environment International, 71: 118-138. DOI:10.1016/j.envint.2014.06.013 |
| Huang C C, Lo S L, Lien H L. 2013. Synergistic effect of zero-valent copper nanoparticles on dichloromethane degradation by vitamin B12 under reducing condition[J]. Chemical Engineering Journal, 219(3): 311-318. |
| Lemus J, Martin-Martinez M, Palomar J, et al. 2012. Removal of chlorinated organic volatile compounds by gas phase adsorption with activated carbon[J]. Chemical Engineering Journal, 211-212(47): 246-254. |
| 李香燕, 赵轩, 刘晓光, 等. 2014. 二次活化活性炭纤维吸附回收二氯甲烷[J]. 环境工程学报, 8(5): 2035-2039. |
| Liang X Y, Chi J J, Yang Z. 2018. The influence of the functional group on activated carbon for acetone adsorption property by molecular simulation study[J]. Microporous and Mesoporous Materials, 262: 77-88. DOI:10.1016/j.micromeso.2017.06.009 |
| Tsai J H, Chiang H M, Huang G Y, et al. 2008. Adsorption characteristics of acetone, chloroform and acetonitrile on sludge-derived adsorbent, commercial granular activated carbon and activated carbon fibers[J]. Journal of Hazardous Materials, 154: 1183-1191. DOI:10.1016/j.jhazmat.2007.11.065 |
| Yu J, Liu W, Cheng Z W, et al. 2014. Dichloromethane removal and microbial variations in a combination of UV pretreatment and biotrickling filtration[J]. Journal of Hazardous Materials, 268: 14-22. DOI:10.1016/j.jhazmat.2013.12.068 |
| 周剑峰, 吴祖成. 2013. 不同条件对活性炭吸附挥发性有机物的影响[J]. 浙江大学学报(理学版), (2): 83-88. |
