
 , 王邦彦, 刘然彬, 江瀚
, 王邦彦, 刘然彬, 江瀚北京建筑大学城市雨水系统与水环境省部共建教育部重点实验室, 中-荷污水处理技术研发中心, 北京 100044
收稿日期: 2021-03-21; 修回日期: 2021-04-02; 录用日期: 2021-04-02
基金项目: 国家自然科学基金(No.51878022);北京"未来城市设计高精尖中心"项目(2021)
作者简介: 郝晓地(1960-), 男, 教授(博士), E-mail: haoxiaodi@bucea.edu.cn
通讯作者(责任作者): 郝晓地
摘要:碳中和目前已成为国际共识,亦是我国政府的政治承诺.实现碳中和目标无疑需要人为努力,但自然界还存在着一些仍未完全被认知但又不可小觑的碳排放源.例如,地表水体中在常规水底沉积物厌氧产甲烷(CH4)现象之外还存在着一种非常规CH4释放现象(甲烷悖论),且这种非常规CH4释放量在某些地区甚至超过化石燃料使用、汽车尾气排放、管道泄漏等温室气体排放量总和.如果这种现象变得普遍,则有可能形成在21世纪中叶虽可实现碳中和目标,但在世纪末却难以完成控温 < 2℃的尴尬局面.因此,有必要了解甲烷悖论现象及过程机制,高度警惕甲烷悖论现象下的CH4超量释放现象,而不仅仅是以完成碳中和作为唯一目标.基于碳中和目的,首先简述水体底泥常规甲烷生成途径,并由此引出水体甲烷超量释放现象,即甲烷悖论.其次,综述现有甲烷悖论过程机理研究,揭示表层有氧水体过量释放甲烷现象的实质.最后,分析调控甲烷悖论有可能适用的技术策略.
关键词:碳中和甲烷悖论甲烷有氧代谢富营养贫营养藻类代谢物产甲烷
Carbon neutrality vs excess methane release from water environments/the methane paradox
HAO Xiaodi

 , WANG Bangyan, LIU Ranbin, JIANG Han
, WANG Bangyan, LIU Ranbin, JIANG HanSino-Dutch R&D Centre for Future Wastewater Treatment Technologies, Key Laboratory of Urban Stormwater System and Water Environment(Ministry of Education), Beijing University of Civil Engineering and Architecture, Beijing 100044
Received 21 March 2021; received in revised from 2 April 2021; accepted 2 April 2021
Abstract: Carbon neutrality has become an international consensus and also a political commitment of the China's government.Achieving the goal of carbon neutrality undoubtedly requires our human efforts, but there are also other carbon emission sources in the nature, which have not been fully recognized and however cannot be underestimated.For example, there is the unconventional CH4 release phenomena (the methane paradox) in surface waters besides the conventional phenomena of anaerobic methane production (CH4) in water sediments, and moreover the unconventional CH4 release amount in some areas even exceeds the sum of greenhouse gas emissions from fossil fuel, automobile exhaust and pipeline leakage.If the phenomena become common, an embarrassing situation would emerged that the goal of carbon neutrality would even be achieved in the middle of this century but the controlled temperature below 2 ℃ by the end of this century would hardly be completed.For this reason, it is necessary to understand the phenomena of the methane paradox and the associated process mechanisms of highly alerting the over-released CH4 under the methane paradox, not only for paying attention to carbon neutrality as the only goal.Based on the purpose of carbon neutrality, the conventional methanogenic pathway from water sediments is briefly described, and the phenomena of excessive methane release from surface waters (the methane paradox) is introduced.Then, the mechanisms of the methane paradox are reviewed to reveal the essence of excessive methane production in surface aerobic waters.Finally, the possible technical strategies for controlling the methane paradox are analyzed.
Keywords: carbon neutralitymethane paradoxaerobic metabolism of methaneeutrophicationoligotrophicmethane production by phytoplankton metabolite
1 引言(Introduction)全球气候变暖导致的自然灾害等现象令人担忧.为避免灾难性后果发生, 《巴黎协定》签署、生效, 旨在将全球平均气温上升幅度于21世纪末控制在较“工业革命”前2 ℃以内, 最好能控制在1.5 ℃以内(Conference of the Parties, 2015).温室气体是导致全球变暖的罪魁祸首, 广义温室气体是指任何会吸收和释放红外线辐射并存在于大气中的气体, 包括水蒸气(产生约2/3的温室效应)、臭氧(O3)、二氧化碳(CO2)、甲烷(CH4)、氮氧化物(NxO)、氢氟碳化合物(HFCs)、全氟碳化物(PFCs)及六氟化硫(SF6)等(李金惠等, 2018).因水蒸气及臭氧的时空分布变化较大, 所以在进行温室气体减量措施规划时, 一般都不将这两种气体纳入考虑(United Nations, 1998).
《京都议定书》所规定控制的6种温室气体的温室效应依以上顺序能力逐渐变强, 如CH4、NxO与SF6百年以内的全球增温潜势(GWP)分别为CO2的25、296和31298倍(Stocker et al., 2013;Wang et al., 2013).就排放量而言, CO2位居首位, 约占温室效应的1/4;CH4排放量虽不及CO2, 但其25倍于CO2的GWP也不免令人关注.
CH4排放除与人类活动(如养牛、化粪池、下水道、污水处理、天然气泄漏等)相关外, 自然源排放亦不可小觑, 特别是从天然水体中排放的CH4因人类活动干扰而日趋增加.当水体“甲烷悖论”被人类察觉并逐渐认识后, 人们发现大量CH4不是从水体底部淤泥厌氧产生, 而是在水体表层好氧环境中直接出现(Günthel et al., 2019).这就超出了人为控制CH4产生的数量与难度, 为本世纪末控温 < 2 ℃带来潜在隐患, 尽管我们有可能按时完成碳中和目标.
为此, 有必要关注水体CH4排放, 对其在水体中生成路径、生成量等研究成果予以综述.特别要阐述水体甲烷悖论中CH4释放现象及其机理, 以揭示和评估其对于碳中和及控温可能产生的负面影响.与此同时, 期望从文献综述中获得一些可能的调控策略, 以尽可能减少甲烷悖论现象下CH4产生量.
2 水环境中甲烷产生(Methane production in water environment)2.1 常规甲烷产生途径自然水体, 包括海洋、湖泊、河流、湿地等, 普遍具有较强的CH4释放现象, 且已经被大量研究证实(Parkes et al., 2012;Saunois et al., 2016;Vizza et al., 2017).CH4常规产生途径仅限于厌氧环境下(氧化还原电位ORP≤-350 mV), 是在氧气和无机氧化剂(NO3-Fe3+SO42-等)耗尽环境中作为电子给予体而形成的被氧化产物(程国玲等, 2013).自然水体中的底部有机沉积物为CH4产生创造了良好的条件, 厌氧沉积物中富含大量产乙酸菌和产甲烷菌等微生物, 通过水解、发酵、产甲烷等一系列代谢过程产生CH4.在这些微生物代谢过程中产甲烷菌产CH4是终点, 这一步骤中产甲烷菌通过异养与自养两种途径生成CH4(Ferry, 2010).
不同自然水体沉积物中CH4生成途径存在较大差异, 在海洋沉积物中大部分CH4是通过产甲烷菌进行CO2还原和甲基基质歧化反应所产生(Formolo, 2010), 因此, 在缺氧的近岸海区底层沉积物中有着较强的CH4生产能力(Naqvi et al., 2010).当硫酸盐存在时, 硫酸盐还原菌(SRB)消耗CH4的速率要普遍高于产甲烷菌产CH4的速率(Treude et al., 2003), 因此, 尽管海洋面积辽阔, 但其释放进入大气的CH4量相对较少, 约80%由底层沉积物产生的CH4已经被沉积物或水体中硫酸盐所消耗(Reeburgh, 2007;Knittel et al., 2009).在淡水生态系统中, 植物和藻类被证实在沉积物产CH4途径中起关键作用;植物残体、根系分泌物及微生物代谢产物成为湿地、湖泊等地表水体的重要碳源来源;水生植物和藻类能够共同固定生态系统中80%以上的碳(CO2), 通过自身光合作用与共生微生物协同作用可将CO2转化为水体中溶解性有机碳(DOC)(Clark et al., 2008).DOC一方面可以通过生物化学过程直接成为产甲烷菌所需碳源, 另一方面其好氧(当存在时)分解至无机碳(DIC:CO2)过程中需要消耗大量氧气, 这也为产甲烷菌提供了良好的厌氧环境(Keller, 2011).
即使在同一类水环境中CH4生成途径也存在一定差异.King等(1982)对美国缅因州Lowes Cove湿地沉积物产CH4途径进行了分析, 结果显示, 乙酸对产CH4贡献率仅占0.5%~5.5%;Oremland等(1982)在旧金山河口湿地检测中发现, 确实仅有1%的CH4产生于乙酸.然而, 也有****在有机质相对丰富的加利福尼亚Cape Hatteras滨海湿地检测中发现, 乙酸对产CH4贡献率达25%~50%(Blair et al., 1992);在英国Arne Peninsula盐沼湿地甚至发现99%的CH4来源于乙酸发酵(Parkes et al., 2012).显然, 自然环境中环境因子存在着差异, 不同的影响因子可以改变产CH4途径并导致不同产CH4量贡献率, 结果出现CH4产生和释放存在高度时空变异性(Purdy et al., 2002).
2.2 甲烷过量释放现象大量研究人员对自然水体产生的CH4量进行长期观测发现, 人类活动可以直接导致自然水体中CH4释放量大幅增长, 且其增长量甚至已经超过传统认知中的排放量, 例如, 甚至已高过化石燃料使用、汽车尾气排放、管道泄漏等温室气体排放量(Fernandez et al., 2019;Beaulieu et al., 2019).有人对美国五大湖之一伊利湖(Lake Erie)进行了观测, 发现46年间CH4排放量增加了10倍(4.6 mg·m-2·d-1), 已经远远超过美国俄亥俄州与密歇根州大多数天然气配送系统或垃圾填埋场所产生的CH4总量.如果将其CH4排放量折算为CO2当量为209775 t·a-1, 相当于 > 10万辆汽车行驶1年的总碳排量, 或25万t·a-1燃煤量(Fernandez et al., 2019).
由于人类活动中大量有机质和营养盐经陆地、河流输入至海洋, 使海洋微生物受到巨大影响, 这其中就包括CH4生成量(Vizza et al., 2017;Xiao et al., 2017).原本仅占全球海洋很小部分的河口与近岸海域, 如今CH4排放量已占到海洋CH4总排放量的75%(Bange et al., 1994;Reeburgh, 2007).进言之, 这些有机物质和营养盐进入地表水体后也产生了水体富营养化现象, 致藻类大量繁殖, 水生物种群、数量发生变化, 最终破坏水体生态平衡.有研究表明, 微囊藻水华的聚集和破碎对浮游细菌群落产生了影响, 具体表现为军团菌目(Micrococcineae)和微球菌目(Legionellales)丰度增加对水体碳代谢具有重要影响(Li et al., 2011).此外, 有人建立了计算CH4产生与水体富营养化程度关系的数学模型, 假设富营养化程度(总磷, TP)增加3倍, 扩散通量(Diffusive flux, 由于水环境中CH4过饱和, 驱动其从水体释放至大气的通量)则会从当前水平(28×106 t·a-1)增加至45×106 t·a-1, 即增加60%;气泡通量(Ebullitive fluxes, 未溶解于水环境中的CH4形成气泡上浮至大气)和总CH4排放量(扩散+气泡)将增加近1倍.按照这个模型计算, 若全球湖泊富营养化程度增加1.5倍, 全球湖泊CH4总排放量将上升至141×106 t·a-1, 将会超过目前全球最大CH4排放源—湿地排放量(139×106 t ·a-1)(Beaulieu et al., 2019).根据对未来内陆水域营养盐负荷的估算, 到21世纪末因水体富营养化现象导致的CH4排放量将净增30%~90%, 与水体富营养化现象类似, 已有大量研究证实, 温度同样是CH4排放量增加的重要因子(Duc et al., 2010;Fuchs et al., 2016).温度升高有利于微生物代谢作用(DelSontro et al., 2016), 同时, 气泡通量比扩散通量对升温更为敏感(Wik et al., 2011).如果将水体富营养化与升温这两种因素相结合, 其结果显然将绝不是简单的叠加.有人基于对中尺度浅水湖泊研究第一次证明了温度与富营养化之间的协同作用, 实验数据见表 1, 结果显示, 对CH4释放(特别是气泡通量)而言, 协同效应确实远远超过两个单变量作用之总和(Davidson et al., 2018).
表 1(Table 1)
| 表 1 水体富营养化与温度对湖泊CH4释放量的协同影响 Table 1 Synergy between eutrophication and warming on methane emissions | ||||||||||||||||||||||||||||||||
表 1 水体富营养化与温度对湖泊CH4释放量的协同影响 Table 1 Synergy between eutrophication and warming on methane emissions
| ||||||||||||||||||||||||||||||||
3 甲烷悖论与机理(Methane paradox and mechanisms)3.1 好氧水体甲烷释放现象自然水体中CH4过量释放现象已经被普遍观测到, 仅靠常规底泥有机物厌氧消化途径显然难以自圆其说.按常规途径, 无论是海洋还是地表水体似乎应在底部沉积物处方能监测到最高CH4浓度.然而, 实际情况并非如此, 在很多海洋表层和近表层含氧水体中发现CH4常常是过饱和的(Reeburgh, 2007;Karl et al., 2008).大量证据表明, 这些海域中CH4大都来自于含氧的原位水体, 形成向大气净释放CH4现象(Lamontagne et al., 1971;Scranton et al., 1977).有人对瑞士哈尔维尔湖(Lake Hallwil)进行监测时亦发现, 在距湖面最近、溶解氧(DO)含量最高的变温层中CH4浓度要比其之下的温跃层高出近100倍.根据变温层产CH4分馏因子(αapp=1.045)与沉积物相应因子(αapp=1.056~1.060)对比得知, 每年约有(26±14) t·a-1 CH4来源于湖水表层未知路径(Matthew et al., 2014).同时, 采用同位素对比法发现, 表层水相中被氧化的碳源与CH4中碳同位素值差异较小(-39.4‰~-45.1‰), 而与沉积物中碳源相差相对较大(-65‰), 说明在湖表层有氧区域确实存在着某种还不为人知的其它CH4生成途径(Hartmann et al., 2020).
尽管如此, 仍然有人称有氧区域CH4来源于沉积物横向和垂直运输, 并以他人对气泡中CH4含量检测不精确及同位素差异源于近岸沉积物横向运输为理由予以反驳(Peeters et al., 2019).对此, 有人又对德国东北部Stechlin湖进行了检测, 特别是对东北湖区和南部湖区横向和垂直输送进行了检测(Günthel et al., 2019), 结果见表 2.这项研究同时还检测到两处含氧水相上层CH4浓度急增现象(水深6 m处, CH4浓度为1400 nmol·L-1;水深 > 10 m处, CH4浓度 < 200 nmol·L-1).在此之后, 他们采用经验模型(平均准确度91.4%)结合卫星数据对全球湖泊(≥0.01 km)进行了评估, 结果显示, 全球湖泊中约有66%的CH4均源于好氧环境(Günthel et al., 2019).
表 2(Table 2)
| 表 2 Stechlin湖有氧环境CH4释放情况(Günthel et al., 2019) Table 2 Methane emission from Lake Stechlin in aerobic environment | ||||||||||||||||
表 2 Stechlin湖有氧环境CH4释放情况(Günthel et al., 2019) Table 2 Methane emission from Lake Stechlin in aerobic environment
| ||||||||||||||||
3.2 甲烷悖论与机理有悖于传统观念中厌氧底泥释放, 这种在好氧环境下CH4过量释放的现象被学界称之为“甲烷悖论”.海洋环境中藻类被认为是CH4直接释放源已有近40年研究历史(Scranton et al., 1977), 以藻类代谢物二甲基磺酰丙酸盐(DMSP)及其降解产物甲硫醇、二甲基硫醚(DMS)、二甲基亚砜(DMSO)等作为底物, 在有氧环境下可以产生CH4的“假说”已被证实.有人通过热力学计算表明, 在好氧条件下微生物为产生能量, 以甲硫醇作为直接前体代谢可以产生CH4(Damm et al., 2010).为了研究DMS与产CH4代谢途径之间的关系, 有人对DMS释放主要来源—颗石藻(Emiliania huxleyi)等3种浮游生物进行了详细研究, 通过13C标记实验可以清楚地确定碳酸氢盐是颗石藻产CH4的主要无机碳前体(Lenhart et al., 2016), 并且在其所有生长阶段均有CH4产生(Langer et al., 2013).如图 1所示, DMSP首先降解为DMS, 随后被氧化为DMSO;在两种代谢途径下以非血红素铁(Ⅳ)为催化剂均证明存在CH4释放现象(Althoff et al., 2014), 并且各个化合物之间产CH4率受环境影响是可变的.因此, DMSP连续降解是好氧CH4形成的一种可能途径.
图 1(Fig. 1)
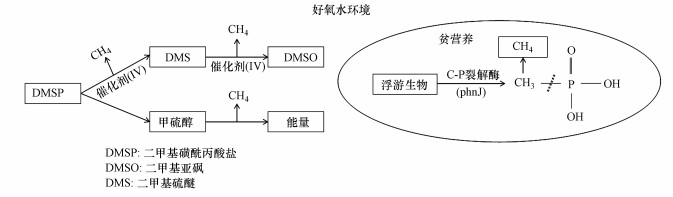 |
| 图 1 甲烷悖论机理归纳 Fig. 1Summary of the mechanisms for the methane paradox |
甲烷悖论现象并不仅仅局限于海洋之中, 一项最新研究称, 一种微生物酶可让甲基磷酸脂(MPn)在脱去磷酸酯分子过程中生成CH4, 这为解释地表水体甲烷悖论现象提供了可能(Liu et al., 2018).一些研究者对有氧产CH4环境进行了宏基因组分析, 如图 1所示, 很多含有C-P裂解酶(phnJ)基因的浮游生物(如蓝藻、原绿藻、假单胞菌等), 在缺磷条件下对有机磷化合物(如MPn)进行代谢也可以产生CH4(Yao et al., 2016;Wang et al., 2017;Khatun et al., 2020).有人根据MPn代谢路径对德国Matano湖宏基因组分析显示, 代谢途径中所有基因(如phnDEC、phnM等)都被包括在内, 但在水深 > 10 m以下深度却离奇消失;在培养的4个菌株中未提供MPn时, 所有菌株均未产生CH4;当添加MPn的同时添加同等浓度磷酸盐可使其中3个菌株CH4产生量减少40%~60%, 而另外一个菌株CH4产量则完全被抑制(Yao et al., 2016).同理, 有人也对美国黄石公园内湖进行了研究, 将甲酸、乙酸、MPn等进行了13C标记, 结果表明, 仅MPn能产生CH4;此外, 他们还观测到假单胞菌在富氧层中异常丰富, 构成整个微生物群落的10.6%, 而在10 m水深处仅为0.26%, 20 m处继续下降为0.04%(Wang et al., 2017).也有人对日本9个深淡水湖进行了调查, 使用16S rRNA和CARD-FISH方法还证明了CH4浓度与聚球菌(Synechococcus)细胞密度之间存在重要相关性(Khatun et al., 2020).
4 碳中和VS甲烷悖论(Carbon neutrality vs methane paradox)水体甲烷悖论现象已被证实, 所涉及的机理如上所述已有初步揭示并形成一定理论.可以预计, 随科学技术深入发展, 解释甲烷悖论的详细机理会逐步完全明了.然而, 甲烷悖论导致的可观CH4释放量已成为不争的事实.无形中, 这对我们正在努力的2060年碳中和目标带来不小压力, 人为碳减排还需进一步加大力度, 仅仅满足碳中和目标还是远远不够的.
当然, 如果对甲烷悖论研究不断深入, 对隐含机理能够详尽揭示, 或许有可能根据机理研究出一些调控措施, 以缓解自然水体CH4超量释放现象, 减少碳中和目标实现的压力.近年来, 人们针对地表水体富营养化现象采取了一系列措施, 水华或赤潮现象已得到明显改善, 这对调控地表水体中CH4释放量应该具有积极的效果, 因为甲烷悖论机理其中一种就是藻类作祟.
甲烷悖论机理显然是多渠道的, 富营养化导致的藻类繁殖可致CH4好氧释放(Scranton et al., 1977), 而缺乏营养(P)的环境亦能出现CH4好氧释放现象, 如有机磷化合物(MPn)代谢(Yao et al., 2016), 这就使得仅仅针对水体的富营养化现象来调控水体CH4超量释放还远远不够.有研究证明, 沿海工业与农业污水排放会刺激河口与近岸海域微生物分解MPn, 进而加速CH4释放(Valle et al., 2014).
显然, 水体富营养与贫营养都会出现甲烷悖论现象, 只有维持水体营养水平在一种健康状态才有可能减少甲烷悖论下CH4超量排放现象.为此, 一方面需要加大对甲烷悖论现象机理的深入研究, 以制定调控技术措施;另一方面需在水生态健康维护方面继续进行卓有成效的实际工作.只有这样才能最大限度地减少CH4超量释放现象, 为碳中和目标解忧.
5 结论(Conclusions)1) 碳中和是今后30年全社会共同努力奋斗的目标.然而, 人为努力之外还存在着一些不可小觑的“自然”排放源, 如水体甲烷悖论下超常规CH4释放现象.CH4超量排放量甚至高过某些地区化石燃料使用、汽车尾气排放、管道泄漏、森林砍伐等温室气体排放总量之和.如果对这一“异常”现象不加以重视, 即使若干年后我们实现了碳中和, 可能也难完成本世纪末全球控温 < 2 ℃的目标.因此, 向着碳中和前行的同时, 我们还必须了解甲烷悖论及可能对碳中和产生的负面影响.
2) 甲烷悖论指的是水底沉积物厌氧产甲烷(常规)之外的好氧表层水产甲烷现象, 且这种非常规(异常)产甲烷量往往高于常规产甲烷量.研究表明, 甲烷悖论现象存在多种有氧环境产甲烷途径, 目前研究已确定的主要有两种:①藻类代谢物产甲烷;②甲基磷酸脂(MPn)脱磷酸酯产甲烷.前者可能因水体富营养化藻类大量繁殖引起, 后者则发生于贫营养(缺无机磷)水体.可见, 只有维持水体营养水平达到一种健康、平衡状态方有可能减少甲烷悖论下CH4超量排放现象.为此, 一方面需要加大对甲烷悖论现象机理的深入研究, 以制定相应调控技术措施;另一方面需在水生态健康维护方面继续进行卓有成效的实际工作.只有这样才能最大限度减少CH4超量释放现象, 以保证在实现碳中和的同时也达到21世纪末全球控温 < 2 ℃的目标.
参考文献
| Althoff F, Benzing K, Comba P, et al. 2014. Abiotic methanogenesis from organosulphur compounds under ambient conditions[J]. Nat Commun, 5(10): 1038. |
| Bange H W, Bartell U H, Rapsomanikis S, et al. 1994. Methane in the Baltic and North Seas and a reassessment of the marine emissions of methane[J]. Glob Biogeochem Cycle, 8: 465-480. DOI:10.1029/94GB02181 |
| Beaulieu J J, DelSontro T, Downing J A. 2019. Eutrophication will increase methane emissions from lakes and impoundments during the 21st century[J]. Nature Communications, 10(1). DOI:10.1038/s41467-019-09100-5 |
| Blair N E, Carter W D. 1992. The carbon isotope biogeochemistry of acetate from a methanogenic marine sediment[J]. Pergamon, 56(3): 1247-1258. |
| 程国玲, 李巧燕, 李永峰. 2013. 产甲烷菌细菌学原理与应用[M]. 哈尔滨: 哈尔滨工业大学出版社. |
| Clark J M, Lane S N, Chapman P J, et al. 2008. Link between DOC in near surface peat and stream water in an upland catchment[J]. The Science of the Total Environment, 404(2/3): 308-315. |
| Damm E, Helmke E, Thoms S, et al. 2010. Methane production in aerobic oligotrophic surface water in the central Arctic Ocean[J]. Biogeosciences, 7: 1099-1108. DOI:10.5194/bg-7-1099-2010 |
| Davidson T A, Audet J, Jeppesen E, et al. 2018. Synergy between nutrients and warming enhances methane ebullition from experimental lakes[J]. Nature Climate Change, 8(2): 156-160. DOI:10.1038/s41558-017-0063-z |
| Duc N T, Crill P, Bastviken D, et al. 2010. Implications of temperature and sediment characteristics on methane formation and oxidation in lake sediments[J]. Biogeochemistry, 100: 185-196. DOI:10.1007/s10533-010-9415-8 |
| DelSontro T, Boutet L, St-Pierre A, et al. 2016. Methane ebullition and diffusion from northern ponds and lakes regulated by the interaction between temperature and system productivity[J]. Limnology and Oceanography, 61(S1): 62-77. DOI:10.1002/lno.10335 |
| Fernandez J M, Townsend-Small A, Zastepa A, et al. 2019. Large increases in emissions of methane and nitrous oxide from eutrophication in Lake Erie[J]. Nature Communications, 10(1): 1375. DOI:10.1038/s41467-019-09100-5 |
| Ferry J G. 2010. How to make a living by exhaling methane[J]. Annual Review of Microbiology, 64(1): 453-473. DOI:10.1146/annurev.micro.112408.134051 |
| Formolo M. 2010. The microbial production of methane and other volatile hydrocarbons[J]. Handbook of Hydrocarbon and Lipid Microbiology: 113-126. |
| Fuchs A, Lyautey E, Montuelle B, et al. 2016. Effects of increasing temperatures on methane concentrations and methanogenesis during experimental incubation of sediments from oligotrophic and mesotrophic lakes[J]. Geophysical Research: Bio-geosciences, 121(5): 1394-1406. |
| Günthel M, Donis D, Kirillin G, et al. 2019. Contribution of oxic methane production to surface methane emission in lakes and its global importance[J]. Nat Commun, 10: 5497. DOI:10.1038/s41467-019-13320-0 |
| Hartmann J, Günthel M, Klintzsch T, et al. 2020. High spatiotemporal dynamics of methane production and emission in oxic surface water[J]. Environmental Science Technology, 54: 1451-1463. DOI:10.1021/acs.est.9b03182 |
| Karl D M, Beversdorf L, Bj?rkman K M, et al. 2008. Aerobic production of methane in the sea[J]. Nature Geoscience, 1: 473-478. DOI:10.1038/ngeo234 |
| Keller J K. 2011. Wetlands and the global carbon cycle: What might the simulated past tell us about the future?[J]. New Phytologist, 192(4): 789-792. DOI:10.1111/j.1469-8137.2011.03954.x |
| King G M, Klug M J, Lovley D R. 1983. Metabolism of acetate, methanol, and methylated amines in intertidal sediments of lowes cove, maine[J]. Applied and Environmental Microbiology, 45(6): 1848-1853. DOI:10.1128/AEM.45.6.1848-1853.1983 |
| Khatun S, Iwata T, Kojima H, et al. 2020. Linking stoichiometric organic carbon-nitrogen relationships to planktonic cyanobacteria and subsurface methane maximum in deep freshwater lakes[J]. Water, 12(2): 402. DOI:10.3390/w12020402 |
| Knittel K, Boetius A. 2009. Anaerobic oxidation of methane: Progress with an unknown process[J]. Annual Review of Microbiology, 63: 311-334. DOI:10.1146/annurev.micro.61.080706.093130 |
| Lamontagne R A, Swinnerton J W, Linnenbom V J. 1971. Nonequilibrium of carbon monoxide and methane at the air-sea interface[J]. Journal of Geophysics Research, 76: 5117-5121. DOI:10.1029/JC076i021p05117 |
| Langer G, Oetjen K, Brenneis T. 2013. Coccolithophores do not increase particulate carbon production under nutrient limitation: A case study using Emiliania huxleyi[J]. Journal of Experimental Marine Biology and Ecology, 443: 155-161. DOI:10.1016/j.jembe.2013.02.040 |
| Lenhart K, Klintzsch T, Langer G, et al. 2016. vidence for methane production by the marine algae Emiliania huxleyi[J]. Biogeosciences, 13: 3163-3174. DOI:10.5194/bg-13-3163-2016 |
| 李金惠, 贾少华, 谭全银. 2018. 环境外交基础与实践[M]. 北京: 中国环境出版集团, 163. |
| Liu Y F, Liu W H, Wu X P. 2018. Global Technology Reference[EB/OL]. 2018-1-30. http://news.sciencenet.cn/sbhtmlnews/2018/1/331836.shtm?id=331836 |
| Li H B, Xing P, Chen M J, et al. 2011. Short-term bacterial community composition dynamics in response to accumulation and breakdown of Microcystis blooms[J]. Water research, 45(4): 1702-1710. DOI:10.1016/j.watres.2010.11.011 |
| Matthew J B, Lennie B, Yves T P, et al. 2014. Oxic water column methanogenesis as a major component of aquatic CH4 fluxes[J]. Natural Communications, 5: 5350. DOI:10.1038/ncomms6350 |
| Naqvi S W A, Bange H W, Farías L, et al. 2010. Marine hypoxia/anoxia as a source of CH4 and N2O[J]. Biogeosciences, 7(71): 2159-2190. |
| Oremland R S, Polcin S. 1982. Methanogenesis and sulfate reduction: competitive and noncompetitive substrates in estuarine sediments[J]. Applied and Environmental Microbiology, 44(6): 1270-1276. DOI:10.1128/AEM.44.6.1270-1276.1982 |
| Parkes J, Fiona B, Natasha B, et al. 2012. Changes in methanogenic substrate utilization and communities with depth in a salt-marsh, creek sediment in southern England[J]. Estuarine Coastal & Shelf Science, 96: 170-178. |
| Peeters F, Fernandez E J, Hofmann H. 2019. Sediment fluxes rather than oxic methanogenesis explain diffusive CH4 emissions from lakes and reservoirs[J]. Scientific Reports, 9: 243. DOI:10.1038/s41598-018-36530-w |
| Purdy K J, Munson M A, Nedwell D B, et al. 2002. Comparison of the molecular diversity of the methanogenic community at the brackish and marine ends of a UK estuary[J]. FEMS Microbiology Ecology, 39(1): 17-21. DOI:10.1111/j.1574-6941.2002.tb00902.x |
| Reeburgh W S. 2007. Oceanic methane biogeochemistry[J]. Chemical Reviews, 107(2): 486-513. DOI:10.1021/cr050362v |
| Scranton M I, Brewer P G. 1977. Occurrence of methane in the nearsurface waters of the western subtropical North-Atlantic[J]. Deep Sea Research, 24: 127-138. DOI:10.1016/0146-6291(77)90548-3 |
| Stocker T F, Qin D, Plattner G K, et al. 2013. Climate Change 2013:The Physical Science Basis.Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change[M]. New York: Cambridge University Press. |
| Treude T, Boetius A, Knittel K, et al. 2003. Anaerobic oxidation of methane above gas hydrates at Hydrate Ridge, NE Pacific Ocean[J]. Marine Ecology Progress Series, 264: 1-14. DOI:10.3354/meps264001 |
| Conference of the Parties. 2015. United Nations framework convention on climate change[Z]. Twenty-first session. |
| United Nations. 1998. Kyoto Protocol to the United Nation Framework Convention on Climate Change[Z]. |
| Valle D D, Karl D. 2014. Aerobic production of methane from dissolved water-column methylphosphonate and sinking particles in the North Pacific Subtropical Gyre[J]. Aquatic Microbial Ecology, 73: 93-105. DOI:10.3354/ame01714 |
| Vizza C, West W E, Jones S E, et al. 2017. Regulators of coastal wetland methane production and responses to simulated global change[J]. Biogeosciences, 14: 431-446. DOI:10.5194/bg-14-431-2017 |
| Wang C K, Luo X Z, Zhang H. 2013. Differences between the shares of greenhouse gas emissions calculated with GTP and GWP for major countries[J]. Climate Change Research, 9(1): 49-54. |
| Wang Q, Dore J, McDermott T R. 2017. Methylphosphonate metabolism by Pseudomonas sp.populations contributes to the methane oversaturation paradox in an oxic freshwater lake: Methylphosphonate and aquatic CH4 oversaturation[J]. Environment Microbiology, 19: 2366-2378. DOI:10.1111/1462-2920.13747 |
| Wik M, Crill P M, Bastviken D, et al. 2011. Bubbles trapped in arctic lake ice: Potential implications for methane emissions[J]. Journal of Geophysical Research, 116(3). DOI:10.1029/2011JG001761 |
| Xiao L, Xie B, Liu J, et al. 2017. Stimulation of long-term ammonium nitrogen deposition on methanogenesis by Methanocellaceae in a coastal wetland[J]. Science of the Total Environment, 595: 337-343. DOI:10.1016/j.scitotenv.2017.03.279 |
| Yao M, Henny C, Maresca J. 2016. Freshwater bacteria release methane as a by-product of phosphorus acquisition[J]. Applied Environment Microbiology, 82: 6994-7003. DOI:10.1128/AEM.02399-16 |
