 , 杨海龙, 周化斌
, 杨海龙, 周化斌

温州大学生命与环境科学学院, 温州 325000
收稿日期: 2020-06-01; 修回日期: 2020-07-22; 录用日期: 2020-07-22
基金项目: 温州市科技计划项目(No.W20170009)
作者简介: 刘方剑(1994-), 男, E-mail: lfj19941030@163.com
通讯作者(责任作者): 周化斌, E-mail: zhb@wzu.edu.cn
摘要:异养硝化-好氧反硝化细菌Acinetobacter junii WZ17脱氮效果良好,为确定其脱氮特性及动力学过程,利用“样条插值法”研究了菌株生长阶段,并采用Logistic模型和修正的Gompertz模型对菌株生长及氮素去除过程进行拟合,结合反硝化过程中间产物,分析菌株脱氮途径.结果显示,菌株WZ17以NH4+-N、NO3--N和NO2--N唯一氮源时,生长适应期分别为2.89、3.13和3.13 h,最大去除速率分别为8.47、5.76和5.18 mg·L-1·h-1,生长和底物去除过程分别符合Logistic模型(R2>0.9)和修正的Gompertz模型(R2>0.9).硝化过程中,NO3--N和NO2--N的积累量仅为0.13和0.14 mg·L-1,反硝化过程中,NO2--N的积累量为1.55 mg·L-1.“样条插值法”的运用可以准确地划分菌株WZ17的生长阶段,菌株WZ17对NH4+-N、NO3--N和NO2--N均具有较好的去除效果,反硝化途径为NO3--N→NO2--N→NxOy.
关键词:琼氏不动杆菌异养硝化-好氧反硝化动力学中间产物
Nitrogen removal and kinetics research by heterotrophic nitrification bacterium Acinetobacter junii WZ17
LIU Fangjian
 , YANG Hailong, ZHOU Huabin
, YANG Hailong, ZHOU Huabin

College of Life and Environmental Science, Wenzhou University, Wenzhou 325000
Received 1 June 2020; received in revised from 22 July 2020; accepted 22 July 2020
Abstract: Acinetobacter junii WZ17, a heterotrophic nitrification-aerobic denitrification bacterium, has good nitrogen removal efficiency. To explore its nitrogen removal characteristic and kinetics, the spline interpolation method was used to divide the growth stage of the strain, and the growth and nitrogen removal kinetics were fitted by logistic model and the modified Gompertz model, respectively. Furthermore, the nitrogen metabolic pathway of strain WZ17 was elucidated by analyzing the intermediates. The results showed that the lag phase of the strain was 2.89, 3.13 and 3.13 h, and the maximum nitrogen removal rate was 8.47, 5.76 and 5.18 mg·L-1·h-1 when NH4+-N, NO3--N and NO2--N was used as the sole nitrogen source, respectively. The growth and substrate removal processes well fitted by the logistic model (R2 > 0.9) and the modified Gompertz model (R2> 0.9), respectively. The accumulation of NO3--N and NO2--N was only 0.13 and 0.14 mg·L-1 during nitrification, respectively, while the accumulation of NO2--N was 1.55 mg·L-1 during denitrification. The growth stage of strain WZ17 is accurately divided by spline interpolation method. Strain WZ17 can efficiently remove NH4+-N, NO3--N and NO2--N, and the denitrification pathway is NO3--N→NO2--N→NxOy.
Keywords: Acinetobacter junii WZ17heterotrophic nitrification-aerobic denitrificationkineticintermediates
1 引言(Introduction)生物脱氮是废水中氮素去除的主要途径, 传统生物脱氮过程中, 硝化作用与反硝化作用分别在好氧和厌氧条件下进行, 要求脱氮体系至少需要一个好氧池和一个厌氧池, 存在水力停留时间长和构筑物成本高等弊端.异养硝化-好氧反硝化(heterotrophic nitrification-aerobic denitrification, HNAD)细菌可以使硝化和反硝化作用同时在好氧条件下完成.近年来, 越来越多的HNAD细菌被分离报道, 如假单胞菌属(Pseudomonas)(He et al., 2019)、芽孢杆菌属(Bacillus)(Rout et al., 2017)、脱氮副球菌属(Paracoccus)(Jaffer et al., 2019)等, 但目前对HNAD细菌的研究主要集中于脱氮效率、条件优化和含氮气体组成等方面, 关于HNAD细菌的动力学研究较少.对功能菌株生长及氮素去除动力学模型的研究, 可以深入了解菌株的生理特性, 为菌株的扩大培养和工程实践提供理论指导.
前期课题组筛选获得了脱氮效果良好的HNAD细菌Acinetobacter junii WZ17, 本文通过“样条插值法(spline interpolation method)”对菌株的生长阶段进行划分;并对Logistic方程进行优化, 建立菌株WZ17生长动力学基本方程, 利用修正的Gmopertz模型拟合菌株脱氮特性, 得到氮素去除过程的详细参数, 用于描述和预测菌株生长性能和脱氮效率, 为反应的放大提供参数支持.
2 实验材料与方法(Materials and methods)2.1 菌株来源Acinetobacter junii WZ17由本课题组(温州大学环境微生物技术实验室)筛选获得, 保藏于中国普通微生物菌种保藏管理中心, 编号:GCMCC17130.
2.2 培养基异养硝化培养基(1 L, pH为7.4)包含0.5 g (NH4)2SO4, 6.8 g乙酸钠和50 mL维氏盐溶液.
硝酸盐培养基(1 L, pH为7.4)包含0.72 g KNO3, 6.8 g乙酸钠和50 mL维氏盐溶液.
亚硝酸盐培养基(1 L, pH为7.4)包含0.49 g NaNO2, 6.8 g乙酸钠和50 mL维氏盐溶液.
维氏盐溶液配方为1 L溶液中含5 g K2HPO4, 2.5 g MgSO4·7H2O, 2.5 g NaCl, 0.05 g FeSO4·7H2O和0.05 g MnSO4·4H2O
2.3 生长动力学2.3.1 菌株生长阶段的划分以培养24 h的菌液为种子液, 按0.5%(体积比)接种于100 mL培养基中, 于26 ℃、160 r·min-1振荡培养48 h(溶解氧为5.2 mg·L-1).前4 h每隔1 h取样, 之后每隔4 h取样测定OD600(细菌培养液在600 nm波长处的吸光值, 描述细菌细胞密度).采用“样条插值法”对实验数据进行处理, 得到连续可导的光滑曲线, 对时间t分别求一阶导和二阶导, 得出菌株的瞬时生长速度
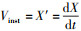
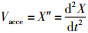
2.3.2 菌株世代时间在分批培养中, 处于对数生长期的菌株符合下列方程:
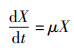 | (1) |
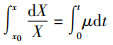 | (2) |
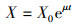 | (3) |
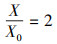 | (4) |
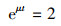 | (5) |
2.3.3 生长动力学模型运用Logistic方程拟合菌株生长曲线, Logistic(汤琳等, 2004)原始方程:
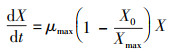 | (6) |
对式(6)积分可得:
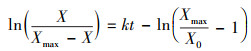 | (7) |
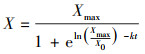 | (8) |
采用修正的Gompertz模型(Chen et al., 2016)(式(9))对底物去除过程进行拟合, 确定底物浓度与去除时间的关系.
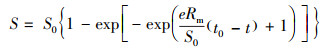 | (9) |
2.5 分析方法NH4+-N、NO2--N和NO3--N浓度均采用标准方法测定(国家环境保护总局, 2002);胞内氮含量的估算参照Wang等(2012)和Zhao等(2018b)的方法进行.在100 mL培养基中, 按0.5%(体积比)接种细菌, 于26 ℃, 160 r·min-1的条件下培养.设置4、8、12、16、20、24、28、36、42和48 h共10组实验, 菌液在4 ℃、12000 r·min-1条件下离心15 min后用纯水冲洗3次, 离心产物在105 ℃烘箱中干燥至恒重.将处于生长期的细胞干重W与OD600进行拟合, 得到方程如下:
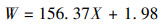 | (10) |
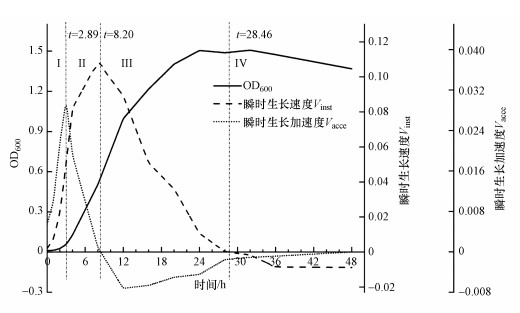
根据细菌的化学简式C5H8O2N对细胞干重的氮含量WN进行估算, 菌株WZ17细胞干重中氮含量与OD600的关系如下:
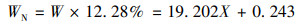 | (11) |
3 结果与讨论(Results and discussion)3.1 不同碳源对菌株WZ17去除氨氮的影响分别以甲醇(CH3OH)、葡萄糖(C6H12O6)、乙酸钠(C2H3O2Na)、丁二酸纳(C4H4Na2O4)和碳酸钠(Na2CO3)为唯一碳源配置异养硝化培养基, 不同碳源之间进行含碳量等摩尔替换, 以不添加碳源为对照组.不同碳源对菌株WZ17生长和脱氮效率的影响见图 1a.菌株在以碳酸钠为唯一碳源和不添加碳源的培养基中均不生长, 也不能去除NH4+-N, 说明菌株WZ17无法利用无机碳源, 与其他文献报道的不动杆菌属为异养菌的结论一致.葡萄糖作为最常用的碳源, 多数异养硝化细菌如Bacillus subtilis A1(Yang et al., 2011)、Pseudomonas stutzeri A1-1(文屹, 2010)和Providencia rettgeri strain YL(Zhao et al., 2010)均可利用葡萄糖, 而菌株WZ17以葡萄糖为碳源时, 生长缓慢, NH4+-N去除率仅为7.78%.以乙酸钠和丁二酸钠为唯一碳源时, 经24 h培养, OD 600分别达到1.495和1.179, NH4+-N去除率均达90%以上.菌株WZ17对乙酸钠和丁二酸纳的利用情况较好, 可能是因为这两种物质均属于羧酸盐, 直接参与三羧酸循环(Tricarboxylic Acid Cycle, TAC), 利用和产能途径更短;相比于丁二酸纳, 乙酸钠的分子结构更加简单, 与微生物优先选用分子量更小的有机物作为碳源的结论相符(陈茂霞等, 2013).
图 1(Fig. 1)
 |
| 图 1 不同碳源对菌株WZ17去除氨氮的影响 Fig. 1Effects of different carbon sources on the ammonia nitrogen removal of strain WZ17 |
为研究菌株WZ17脱氮过程中对有机物的去除情况, 以乙酸钠作为有机物来源, 对培养基中NH4+-N浓度和COD进行拟合, 结果如图 1b所示, NH4+-N和COD有较好的相关性, R2=0.989, COD和NH4+-N同时以平衡的速率被去除, 说明碳源是菌株生长和脱氮的必要条件(Lee et al., 2003).
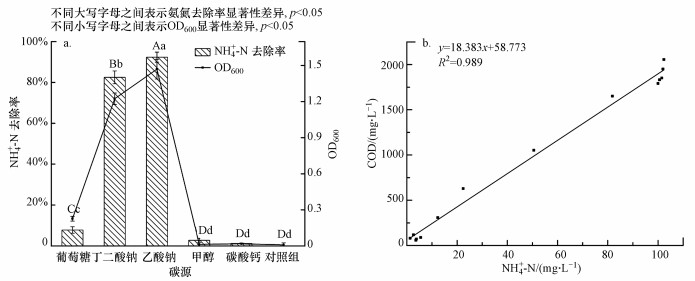
3.2 不同氨氮浓度对菌株WZ17生长及脱氮效率的影响NH4+-N作为菌株生长的氮源和硝化作用的底物, 其浓度过低, 不能满足菌株生长需求, 浓度过高, 则会在反应体系中产生游离氨(FA), 抑制菌株硝化作用(Anthonisen et al., 1976).分别设置初始NH4+-N浓度梯度为100、200和400 mg·L-1(实际分别为102.28、206.76和375.26 mg·L-1), 菌株WZ17的生长及NH4+-N去除曲线如图 2所示, NH4+-N起始浓度为100 mg·L-1时, 28 h内去除率为98.68%, 远高于菌株Bacillus subtilis A1(36.3%, 120 h)(Yang et al., 2011)和Pseudoxanthomonas sp.C2(78.87%, 24 h)(郝明辉等, 2016);NH4+-N起始浓度为200 mg·L-1时, 48 h内去除率为87.39%, 而菌株Acinetobacter sp.YN3在NH4+-N浓度为200 mg·L-1时, 几乎不能生长(颜薇芝等, 2017);当NH4+-N浓度升高至400 mg·L-1时, 去除率仍超过60%(66.10%), NH4+-N去除率随浓度升高而降低的现象与Yang等(2011)的研究结果一致.上述结果表明, 菌株WZ17脱氮效果优良, 具有处理高浓度NH4+-N废水的应用价值, 如养猪场废水、垃圾渗滤液和焦化废水等.
图 2(Fig. 2)
 |
| 图 2 不同初始氨氮浓度下菌株WZ17生长及基质去除曲线 Fig. 2The growth and substrate degradation of strain WZ17 under different initial ammonium concentrations |
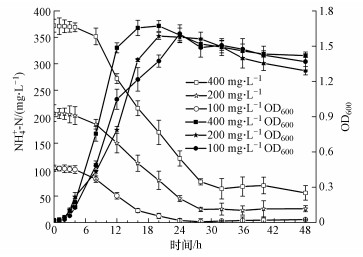
3.3 菌株WZ17异养硝化过程研究3.3.1 菌株WZ17异养硝化过程生长阶段划分以往对微生物生长过程的研究, 多使用观察法来划分生长阶段, 由比浊法测得的OD600是一定时间内菌株生长积累量的均值, 与取样时间有关, 而瞬时生长速度Vinst和瞬时生长加速度Vacce可以反映微生物在生长过程中的动态变化, 准确地对生长阶段进行划分, Vinst和Vacce采用origin 8.0“样条插值法”进行计算, 结果见表 1.本方法对微生物生长过程中所涉及的数学问题进行深入分析, 是研究微生物生长特性方面的一个创新性的探索.由表 1可知, 在接种后的2.89 h, Vacce达到最大值, 菌株由生长适应期(Ⅰ)进入对数生长期(Ⅱ);在8.20 h, Vinst达到最大值, 此后开始下降, 菌株进入减速生长期(Ⅲ);在28.46 h, Vinst趋近于0, 此后菌株进入衰亡期(Ⅳ).该方法的应用, 将传统微生物生长阶段划分的准确性提升了一个数量级.菌株WZ17各生长阶段划分如图 3所示.
表 1(Table 1)
| 表 1 菌株WZ17的瞬时生长速度Vinst及瞬时生长加速度Vacce Table 1 The instantaneous growth velocity Vinst and the instantaneous growth acceleration Vacce of strain WZ17 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 菌株WZ17的瞬时生长速度Vinst及瞬时生长加速度Vacce Table 1 The instantaneous growth velocity Vinst and the instantaneous growth acceleration Vacce of strain WZ17
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
图 3(Fig. 3)
 |
| 图 3 菌株WZ17不同生长阶段的划分 Fig. 3The different growth phases of strain WZ17 |
3.3.2 菌株WZ17异养硝化过程生长世代时间世代时间(Generation time, G)能够反映细菌的增殖速率, 是评价菌株适应性的重要指标(张姣惠等, 2019), 然而用于描述微生物生长的Logistic方程等众多S形生长方程均未给出“世代时间”这一参数.根据“菌株在对数生长期的代时是稳定的(杨国良等, 2016)”这一性质, 将菌株在对数生长期的OD600与时间t进行非线性拟合, 可以得出菌株WZ17硝化过程的世代时间.
根据式(3)对菌株WZ17对数生长期OD600与时间t进行非线性拟合, 得
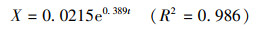 | (12) |
3.3.3 菌株WZ17的异养硝化动力学虽然Logistic方程适用于存在最大细胞浓度限度的微生物生长模型, 然而Logistic原始方程(6)仅描述了微生物比生长速率μ与时间t的关系, 本文对Logistic方程进行优化, 以OD600为生物量指标, 构建菌体浓度X、瞬时生长速度Vinst与时间t的关系.初始NH4+-N浓度为100 mg·L-1时, 根据式(8)对菌体浓度X和时间t的拟合结果如图 4a所示, 菌体浓度X与时间t的方程为:
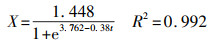 | (13) |
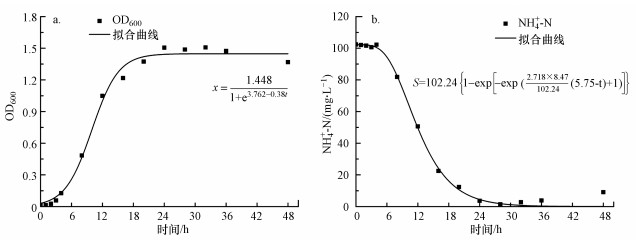 |
| 图 4 菌株WZ17的异养硝化动力学拟合曲线 Fig. 4Simulation of heterotrophic nitrification kinetics of strain WZ17 |
式(13)对t求导, 得菌株WZ17的瞬时生长速度Vinst与时间t的关系, 见式(14).
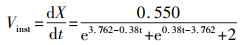 | (14) |
3.3.4 菌株WZ17的异养硝化过程研究菌株WZ17在26 ℃、pH为7.4和160 r·min-1培养条件下, 异养硝化过程各组分浓度变化如图 5所示, NH4+-N在28 h内去除率达到98.68%, 胞内氮由0.45 mg·L-1增加到26.51 mg·L-1(由式(11)得出), 占初始氮量的25.78%, 胞内氮含量远低于异养硝化菌株Pseudomonas putida YH(53%)(王旭辉等, 2019), 可知硝化作用为菌株WZ17的主要脱氮形式.NO3--N和NO2--N均从反应发生时开始积累, NO3--N在8 h达到最大积累量0.13 mg·L-1, 低于菌株P. stutzeri XL-2(4.0 mg·L-1)(Zhao et al., 2018a), 此后逐渐降低, 在28 h从体系中完全去除, 说明硝化作用的产物可作为反硝化作用的底物被利用, 初步证明菌株WZ17具有同步硝化反硝化的功能;NO2--N在12 h达到最大积累量0.13 mg·L-1, 与NH4+-N达到最大去除速率的时间一致, 说明NO2--N为硝化过程的主要产物, 此后NO2--N含量逐渐降低, 在28 h达到最低值0.04 mg·L-1.NO2--N含量出现先升后降再升的趋势, 是由于前期体系中NH4+-N含量充足, 以硝化作用为主, NO2--N出现累积, 随着反应进行, NH4+-N浓度逐渐降低, 体系中以反硝化作用为主, NO2--N被还原(许涛, 2018), 28 h后NO2--N和NH4+-N浓度均有所增加, 结合图 3可知, 菌株在28 h后进入衰亡期, 表明菌株在衰亡期对氮素的释放以NO2--N和NH4+-N为主.
图 5(Fig. 5)
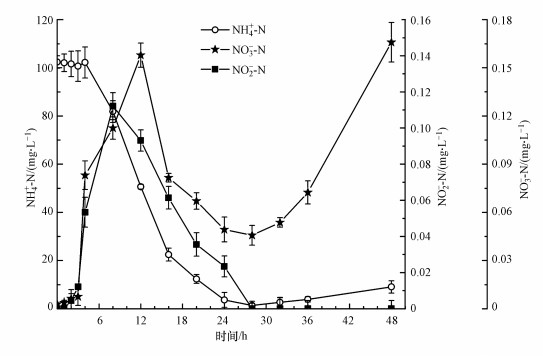 |
| 图 5 异养硝化体系各组分浓度变化 Fig. 5The concentration changes of different nitrogen component in the heterotrophic nitrification system |
3.4 菌株WZ17的好氧反硝化过程研究3.4.1 以NO3--N为唯一氮源为研究菌株WZ17以NO3--N作为唯一氮源时的生长特性, 在初始NO3--N浓度为100 mg·L-1时, 同3.3.1节, 对菌株WZ17生长阶段进行划分(图 6a), 经过3.13 h的生长适应期(Ⅰ)后, 菌株进入对数生长期(Ⅱ), OD600从0.0078迅速增加到0.63;在7.95 h, 瞬时生长速度Vinst达到最大值, 随后进入减速生长期(Ⅲ);在25.56 h, Vinst趋近于0, OD600达到最大值1.401, 此后, 菌株WZ17进入衰亡期(Ⅳ).
图 6(Fig. 6)
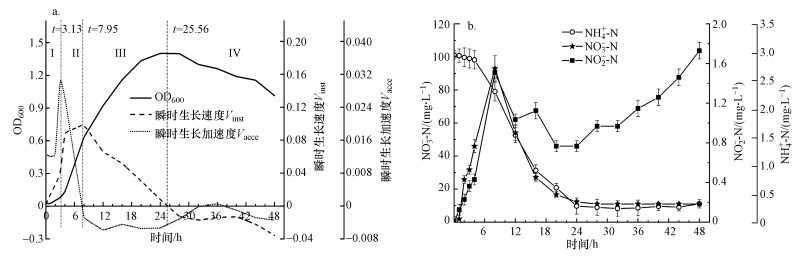 |
| 图 6 菌株WZ17以硝酸盐为氮源的生长曲线(a)及中间产物变化(b) Fig. 6Growth curve of strain WZ17 (a) and the concentration change of different nitrogen component (b) using nitrate as nitrogen source |
菌株WZ17以NaNO3为唯一氮源进行好氧反硝化时, 各组分随时间的变化如图 6b所示, NO3--N浓度从101.29 mg·L-1降低至11.09 mg·L-1, 去除率为89.05%.NO3--N最大去除速率为5.76 mg·L-1·h-1, 高于K. pneumoniae CF-S9(2.2 mg·L-1·h-1)(Padhi et al., 2013)和Rhodococcus sp. CPZ24 (0.93 mg·L-1·h-1)(Chen et al., 2012).NH4+-N和NO2--N的积累量均在8 h达到最大值, 分别为2.63和1.55 mg·L-1, He等(2016)报道的反硝化过程也有少量NH4+-N积累, 认为是部分NO3--N转化所致(Van et al., 1992).后续NH4+-N浓度持续增加, 结合图 6a可知, 24 h后菌株进入衰亡期发生自溶, 所释放的有机氮被转化为NH4+-N(杨垒等, 2020).
3.4.2 以NO2--N为唯一氮源以NO2--N为唯一氮源时, 同3.3.1节, 对菌株WZ17生长阶段进行划分(图 7a), 经过3.13 h的生长适应期(Ⅰ)后, 菌株进入对数生长期(Ⅱ), OD600从0.06迅速增加到0.62;在7.95 h, 瞬时生长速度Vinst达到最大值, 随后菌株进入减速生长期(Ⅲ);在23.87 h, 菌株的Vinst趋近于0, 此后, 菌株WZ17进入衰亡期(Ⅳ).WZ17以NO2--N作为唯一氮源进行反硝化作用时, 各组分随时间的变化如图 7b所示, 结合图 7a可知, NO2--N的去除发生在菌株WZ17的对数生长期, 最大去除速率为5.16 mg·L-1·h-1, NO3--N从反应发生时即开始累积, 在8 h达到最大积累量2.02 mg·L-1, 远小于菌株Defluvibacter lusatiensis str. DN7(21.83 mg·L-1)(肖继波等, 2012).NH4+-N同样在8 h达到最大积累量2.36 mg·L-1, 随后其浓度逐渐降低, 这与颜薇芝等(2017)和Li等(2015)报道的反硝化过程中具有少量NH4+-N积累一致, 24 h后, NH4+-N浓度上升与菌株进入衰亡期有关(杨垒等, 2020).
图 7(Fig. 7)
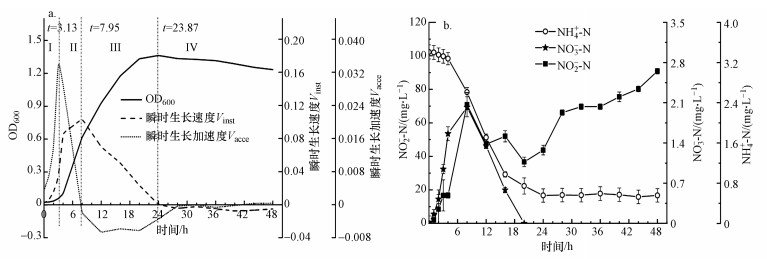 |
| 图 7 菌株WZ17以亚硝酸盐作氮源的生长曲线(a)及中间产物变化(b) Fig. 7Growth curve of strain WZ17 (a) and the concentration changes of different nitrogen component (b) using nitrite as nitrogen source |
相比于菌株Pseudomonas sp. yy7(Wan et al., 2011)在NO2--N浓度为50 mg·L-1时停止生长, Pseudomonas putida Y-11(何腾霞等, 2015)在NO2--N浓度为100 mg·L-1时, 去除率仅为40%, 菌株WZ17在NO2--N为浓度100 mg·L-1时, OD600可达1.363, 去除率为83.66%.研究表明, NO2--N可在溶液中产生游离亚硝酸(FNA), 抑制微生物的代谢.FNA浓度由式(15)计算(叶剑锋, 2006):
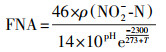 | (15) |
3.5 菌株WZ17生长及去除动力学分析不同氮源下, 菌株WZ17的动力学参数如表 2所示, 以NH4+-N、NO3--N和NO2--N为氮源时, 最大OD600分别为1.518、1.401和1.363, 与最大去除速率和最终去除率一致, 表明菌株对NH4+-N的利用优于NO3--N和NO2--N.
表 2(Table 2)
| 表 2 不同氮源下菌株WZ17的动力学参数与最终去除率 Table 2 Kinetic parameters and final removal efficiency of strain WZ17 under different nitrogen sources | ||||||||||||||||||||||||||||||||
表 2 不同氮源下菌株WZ17的动力学参数与最终去除率 Table 2 Kinetic parameters and final removal efficiency of strain WZ17 under different nitrogen sources
| ||||||||||||||||||||||||||||||||
不同氮源下, 菌株WZ17的世代时间不同, 说明氮源种类会影响菌株的生长.在以NH4+-N为氮源时, 世代时间最长, 比生长速率最小, 然而最大去除速率(8.47 mg·L-1·h-1)却高于以NO3--N为氮源(5.76 mg·L-1·h-1)和以NO2--N为氮源(5.18 mg·L-1·h-1), 可能是菌株WZ17的氨单加氧酶活性(AMO)高于好氧反硝化酶活性.
菌株对NO2--N的去除率(83.60%)低于对NH4+-N的去除率(98.68%), 可能与菌株在进行反硝化时需要更高的C/N有关(王孟等, 2017).本研究中, 反硝化体系所用的C/N与硝化体系相同, 所以碳源不足可能是NO2--N去除率较低的主要原因.
NO3--N和NO2--N同为反硝化过程的底物, 菌株对NO2--N去除率(83.60%)低于NO3--N的去除率(91.82%), 可能与氧化还原电位有关, 相比于NO2--N, NO3--N的氧化还原电位更高, 更容易被微生物利用(李卫芬等, 2011), 并且印证了3.3.4节菌株异养硝化过程中, NO3--N积累后, 很快被去除的现象.
4 结论(Conclusions)1) 利用“样条插值法”对试验数据进行处理, 通过研究菌株WZ17瞬时生长速度Vinst和瞬时生长加速度Vacce与细胞浓度OD600的关系, 能准确地对菌株的生长阶段进行划分.
2) 菌株WZ17在24 h内对NH4+-N的去除率高达98.68%, 并且以硝化作用为主.
3) 菌株WZ17能够以NO2--N和NO3--N为唯一氮源进行生长并去除氮素, 具有好氧反硝化特性, 以NO3--N为唯一氮源进行反硝化时, NO2--N为中间产物, 推测WZ17的反硝化途径为NO3--N→NO2--N→NxOy.下一步可从酶学角度或者功能基因层面对脱氮途径进行深入分析.
4) 采用Logistic方程和Gompertz分别拟合了菌株的生长和底物去除过程, 模型相关系数R2均在0.9以上, 相关参数可为反应的放大提供支持.
参考文献
| Anthonisen A C, Loehr R C, Prakasam T B, et al. 1976. Inhibition of nitrification by ammonia and nitrous acid[J]. Water Pollution Control Federation, 48(5): 835-852. |
| Chen J, Zhao B, An Q, et al. 2016. Kinetic characteristics and modelling of growth and substrate removal by Alcaligenes faecalis strain NR[J]. Bioprocess and Biosystems Engineering, 39(4): 593-601. DOI:10.1007/s00449-016-1541-9 |
| Chen P Z, Li J, Li Q X, et al. 2012. Simultaneous heterotrophic nitrification and aerobic denitrification by bacterium Rhodococcus sp. CPZ24[J]. Bioresource Technology, 116: 266-270. DOI:10.1016/j.biortech.2012.02.050 |
| 陈茂霞, 王欢, 周后珍, 等. 2013. 异养硝化-好氧反硝化菌HN-02的筛选及其特性[J]. 应用与环境生物学报, 19(4): 688-693. |
| 国家环境保护总局. 2002. 水和废水监测分析方法[M]. 第四版. 北京: 中国环境科学出版社, 701-705. |
| He T X, Li Z L, Sun Q, et al. 2016. Heterotrophic nitrification and aerobic denitrification by Pseudomonas tolaasii Y-11 without nitrite accumulation during nitrogen conversion[J]. Bioresource Technology, 200: 493-499. DOI:10.1016/j.biortech.2015.10.064 |
| He X L, Sun Q, Xu T Y, et al. 2019. Removal of nitrogen by heterotrophic nitrification-aerobic denitrification of a novel halotolerant bacterium Pseudomonas mendocina TJPU04[J]. Bioprocess and Biosystems Engineering, 42(5): 853-866. DOI:10.1007/s00449-019-02088-8 |
| 郝明辉, 于鲁冀, 李廷梅, 等. 2016. 一株异养硝化菌的筛选及生长特性研究[J]. 生物技术通报, 32(4): 168-174. |
| 何腾霞, 徐义, 李振轮, 等. 2015. 耐冷亚硝酸盐型反硝化菌Pseudomonas tolaasii Y-11的鉴定及其脱氮特性[J]. 微生物学报, 55(8): 991-1000. |
| Jaffer Y D, Kumar H S, Vinothkumar R, et al. 2019. Isolation and characterization of heterotrophic nitrification-aerobic denitrification and sulphur-oxidizing bacterium Paracoccus saliphilus strain SPUM from coastal shrimp ponds[J]. Aquaculture International, 27(5): 1513-1524. DOI:10.1007/s10499-019-00407-0 |
| Jiménez E, Giménez J B, Seco A, et al. 2012. Effect of pH, substrate and free nitrous acid concentrations on ammonium oxidation rate[J]. Bioresource Technology, 124: 478-484. DOI:10.1016/j.biortech.2012.07.079 |
| Li C, Yang J, Wang X, et al. 2015. Removal of nitrogen by heterotrophic nitrification-aerobic denitrification of a phosphate accumulating bacterium Pseudomonas stutzeri YG-24[J]. Bioresource Technology, 182: 18-25. DOI:10.1016/j.biortech.2015.01.100 |
| Li D, Liang X H, Jin Y, et al. 2019. Isolation and nitrogen removal characteristics of an aerobic heterotrophic nitrifying-denitrifying bacterium, Klebsiella sp. TN-10[J]. Applied Biochemistry and Biotechnology, 188(2): 540-554. DOI:10.1007/s12010-018-02932-9 |
| Lee K C, Rittmann B E. 2003. Effects of pH and precipitation on autohydrogenotrophic denitrification using the hollow-fiber membrane-biofilm reactor[J]. Water Research, 37(7): 1551-1556. DOI:10.1016/S0043-1354(02)00519-5 |
| 李伟光, 张多英, 刘苗, 等. 2014. 饮用水除氨氮功能菌株的筛选及降解特性[J]. 环境工程学报, 8(4): 1267-1272. |
| 李卫芬, 傅罗琴, 邓斌, 等. 2011. 1株好氧反硝化菌的分离鉴定及反硝化特性研究[J]. 环境科学, 32(8): 2403-2408. |
| Padhi S K, Tripathy S, Sen R, et al. 2013. Characterisation of heterotrophic nitrifying and aerobic denitrifying Klebsiella pneumoniae CF-S9 strain for bioremediation of wastewater[J]. International Biodeterioration & Biodegradation, 78: 67-73. |
| Rout P R, Bhunia P, Dash R R, et al. 2017. Simultaneous removal of nitrogen and phosphorous from domestic wastewater using Bacillus cereus GS-5 strain exhibiting heterotrophic nitrification, aerobic denitrification and denitrifying phosphorous removal[J]. Bioresource Technology, 244(1): 484-495. |
| 申秋璇. 2012. 冷冻干燥乳酸菌发酵剂的制备及其保藏过程中菌群生理活性变化的研究[D]. 济南: 山东大学 |
| 汤琳, 曾光明, 孙伟, 等. 2004. Logistic方程在微生物分批培养动力学中的应用[J]. 湖南大学学报: 自然科学版, 31(3): 23-28. |
| Vadivelu V M, Keller J, Yuan Z, et al. 2006. Effect of free ammonia and free nitrous acid concentration on the anabolic and catabolic processes of an enriched Nitrosomonas culture[J]. Biotechnology & Bioengineering, 95(5): 830-839. |
| Van Niel E W J, Braber K J, Robertson L A, et al. 1992. Heterotrophic nitrification and aerobic denitrification in Alcaligenes-Faecalisstrain TUD[J]. Antonie van Leeuwenhoek, 62(3): 231-237. DOI:10.1007/BF00582584 |
| Wan C L, Yang X, Lee D J, et al. 2011. Aerobic denitrification by novel isolated strain using NO2--N as nitrogen source[J]. Bioresource Technology, 102(15): 7244-7248. DOI:10.1016/j.biortech.2011.04.101 |
| Wang B, Wang W, Han H, et al. 2012. Nitrogen removal and simultaneous nitrification and denitrification in a fluidized bed step-feed process[J]. Journal of Environmental Sciences, 24(2): 303-308. DOI:10.1016/S1001-0742(11)60767-5 |
| 汪旭晖, 杨垒, 任勇翔, 等. 2019. 异养硝化细菌Pseudomonas putida YH的脱氮特性及降解动力学[J]. 环境科学, 40(4): 1892-1899. |
| 王孟. 2017. 异养硝化-好氧反硝化菌Diaphorobacter sp. PDB3的脱氮特性研究[D]. 太原: 太原理工大学 |
| 文屹. 2010. 两株异养硝化-好氧反硝化细菌的分离、筛选、鉴定和特性研究[D]. 广州: 华南理工大学 |
| 肖继波, 江惠霞, 褚淑祎, 等. 2012. 不同氮源下好氧反硝化菌Defluvibacter lusatiensis str. DN7的脱氮特性[J]. 生态学报, 32(20): 6463-6470. |
| 许涛, 王国英, 岳秀萍, 等. 2018. Diaphorobacter sp.PDB3菌好氧反硝化脱氮特性[J]. 中国环境科学, 38(6): 2321-2328. |
| Yang X P, Wang S M, Zhang D W, et al. 2011. Isolation and nitrogen removal characteristics of an aerobic heterotrophic nitrifying-denitrifying bacterium, Bacillus subtilisA1[J]. Bioresource Technology, 102(2): 854-862. DOI:10.1016/j.biortech.2010.09.007 |
| Yang L, Wang X H, Cui S, et al. 2019. Simultaneous removal of nitrogen and phosphorous by heterotrophic nitrification-aerobic denitrification of a metal resistant bacterium Pseudomonas putida strain NP5[J]. Bioresource Technology, 285: 121360. DOI:10.1016/j.biortech.2019.121360 |
| 杨国良, 梁爽, 张洪, 等. 2016. 副鸡禽杆菌发酵培养工艺研究[J]. 中国畜牧兽医, 43(1): 267-273. |
| 颜薇芝, 张汉强, 余从田, 等. 2017. 1株异养硝化好氧反硝化不动杆菌的分离及脱氮性能[J]. 环境工程学报, 11(7): 4419-4428. |
| 杨垒, 崔珅, 任勇翔, 等. 2020. 异养硝化细菌Pseudomonas aeruginosa YL的脱氮过程及N2O产生特性[J]. 环境科学, 41(02): 831-838. |
| 叶建锋. 2006. 废水生物脱氮处理新技术[M]. 北京: 化学工业出版, 50-51. |
| Zhao B, Ran X C, Tian M, et al. 2018a. Assessing the performance of a sequencing batch biofilm reactor bioaugmented with P. stutzeri strain XL-2 treating ammonium-rich wastewate[J]. Bioresource Technology, 270: 70-79. DOI:10.1016/j.biortech.2018.09.015 |
| Zhao B, Cheng D Y, Tan P, et al. 2018b. Characterization of an aerobic denitrifier Pseudomonas stutzeri strain XL-2 to achieve efficient nitrate removal[J]. Bioresource Technology, 250: 564-573. DOI:10.1016/j.biortech.2017.11.038 |
| Zhao B, He Y L, Huang J, et al. 2010. Heterotrophic nitrogen removal by Providencia rettgeri strain YL[J]. Journal of Industrial Microbiology & Biotechnology, 37(6): 609-616. |
| 张姣惠, 胡可慧, 陈珍珍, 等. 2019. 亚抑菌浓度氟苯尼考作用下质粒pSD11对大肠杆菌适应性的影响[J]. 应用与环境生物学报, 25(5): 1211-1214. |
| 张多英, 李伟光, 刘苗, 等. 2011. 降解水源水中有机物的优势菌筛选及其特性[J]. 哈尔滨工业大学学报, 43(8): 44-49. |
| 张自杰. 2000. 排水工程[M]. 第四版. 北京: 中国建筑工业出版社, 311-312. |
