 , 石明浩, 刘苏
, 石明浩, 刘苏

中国药科大学工学院环境科学教研室, 南京 211198
收稿日期: 2020-07-28; 修回日期: 2020-09-03; 录用日期: 2020-09-03
基金项目: 江苏省自然科学基金青年基金项目(No.BK20170633);中国药科大学基本科研业务费重点项目(No.2632020ZD12);中国药科大学大学生创新创业训练计划项目(No.201910316217)
作者简介: 王世豪(1998-), 男, E-mail:15713709875@163.com
通讯作者(责任作者): 刘苏, E-mail:suliu@cpu.edu.cn
摘要:在一些不连续生产的工业活动、畜禽养殖等间歇性排放废水的场景中,水环境中的盐酸四环素(Tetracycline,TET)和砷(Arsenic,As)可能会产生区别于单一或复合暴露的顺序暴露场景,从而导致复杂的生物毒性.本研究通过分析模式生物斑马鱼的表型数据(肥满度)、病理损伤(H&E染色实验)及氧化损伤(丙二醛和还原型谷胱甘肽含量),探究顺序暴露方式下TET和As(Ⅲ)的联合毒性效应.结果表明:50 μg·L-1 TET可造成肝脏和肠道的病理学损伤,并进一步诱导氧化损伤.100 μg·L-1 As(Ⅲ)可造成肝脏炎性细胞浸润及肝脏和肠道的氧化损伤.连续暴露TET和As(Ⅲ)导致斑马鱼肥满度降低,且氧化损伤明显加剧,这可能与TET损伤了抗氧化防御系统有关.值得注意的是,TET暴露后设置2周的恢复期,可减轻As(Ⅲ)对斑马鱼肝脏和肠道的损伤,其机理可能与生物对污染物的适应及交叉抗性相关.本研究的实验结果可为评估TET和As(Ⅲ)的联合毒性效应提供新的视角.
关键词:四环素As(Ⅲ)联合毒性顺序暴露斑马鱼
Combined toxicity of tetracycline and arsenic on zebrafish in sequential exposure scenarios
WANG Shihao
 , SHI Minghao, LIU Su
, SHI Minghao, LIU Su

Department of Environmental Science, School of Engineering, China Pharmaceutical University, Nanjing 211198
Received 28 July 2020; received in revised from 3 September 2020; accepted 3 September 2020
Abstract: In cases of intermittent wastewater discharge,such as industrial activities with discontinuous production and livestock and poultry breeding,Tetracycline (TET) and Arsenic (As) may not coexist in waters at the same time,resulting in sequential exposure which is different from single or combined exposure,leading to complex toxic effects on organisms. In this study,zebrafish was selected,and the possible sequential exposure in real scenarios was adopted to explore the combined toxic effects of TET and As (Ⅲ). The condition of zebrafish was measured. The pathological damage of liver and intestine were observed by hematoxylin-eosin staining. The oxidative damage was determined by measuring the contents of malondialdehyde (MDA) and glutathione (GSH). The results showed that two weeks of exposure of TET (50 μg·L-1) caused histopathological lesion in the liver and intestine,further induced oxidative damage. Exposure of As(Ⅲ) (100 μg·L-1) caused local inflammation in the liver and induced oxidative stress in zebrafish. Continuous exposure of TET and As(Ⅲ) resulted in reduced condition factor and up-regulated oxidative damage,which may be related to the damage of the antioxidant defense system caused by TET. It's worth noting that recovery treatment after exposure of TET can reduce the toxicity caused by As(Ⅲ) on liver and intestine. The underlying mechanism may associate with the adaptation and cross-resistance of organisms to pollutants. The results of this study will provide a new perspective for evaluating the combined toxic effects of TET and As(Ⅲ).
Keywords: tetracyclinearsenic(Ⅲ)combined toxicitysequential exposurezebrafish
1 引言(Introduction)四环素类抗生素(Tetracyclines, TCs)是20世纪40年代末发现的广谱抗生素, 主要包括四环素(Tetracycline, TET)、土霉素和金霉素, 具有预防疾病和促进动物生长的作用, 是动物医疗中应用最广泛的抗生素家族之一(Xia et al., 2019).中国使用TCs总量在2013年超过1200万吨, 远远高于其他国家(Zhang et al., 2015).然而, TCs等抗生素不能通过吸收或者代谢被完全去除, 其相当一部分在生物体内参与相关生化活动后自身不发生变化或部分代谢为活性物质, 随尿液、粪便等排泄物直接释放到水体环境中(Carvalho et al., 2016; Chen et al., 2017; Yang et al., 2018;Qiao et al., 2018).进入水体环境中的TCs对一些非目标生物同样具有生物有效性, 从而对生态系统构成潜在威胁.现有研究表明, TCs能够抑制或诱导与生理功能、药物代谢和氧化应激相关的生化指标, 如还原型谷胱甘肽(Glutathione, GSH)、丙二醛(Malondialdehyde, MDA)、乙酰胆碱酯酶、超氧化物歧化酶和过氧化氢酶的活性或含量, 并可能进一步对鱼类产生较严重的基因和免疫毒性(张浩等, 2008;Yan et al., 2018).TET作为重要的TCs之一, 在环境中的停留时间长、扩散范围广、积累浓度高(Grenni et al., 2018), 目前在长三角地区的太湖(35.23 ng·L-1)(Xu et al., 2018)、长江上游地区的三峡水库(26.29 ng·L-1)(He et al., 2017)和华北地区的海河流域(357 ng·L-1)(Chen et al., 2018)等地均有检出, 其在水体环境中的高检出率和高浓度水平已经引起人们的重视.
实际水环境中抗生素往往与多种污染物共存, 重金属是其中一类重要污染物.有关抗生素和重金属的联合毒性效应已经受到一些****的关注, 研究表明, 同时暴露四环素和铜可减弱铜造成的斑马鱼胚胎死亡率升高、孵化率降低及发育迟缓等毒性效应(章强等, 2015);同时暴露CuO纳米颗粒和磺胺甲噁唑可增强磺胺甲噁唑导致需氧氨氧化细菌生物活性降低的毒性效应(Zhang et al., 2019).然而, 现实场景可能会出现更加复杂的情况, 如废水的不定期排放造成水生生物间歇暴露四环素, 并可能再暴露其他污染物, 从而产生与采取单一暴露方式不同的生态毒性效应.在顺序暴露方式中夹杂着生物体对污染物的清除恢复, 单一暴露抗生素后应该考虑生物体在暴露后的恢复情况.然而此类研究目前十分有限.
砷(Aresnic, As)作为水环境中重要的类金属污染物, 有关其与TET的联合毒性效应研究尚未见报道.现有文献表明, 水环境中的重金属As已经造成了全球范围内的污染问题, 超过70个国家地下水As含量较高, 印度拉普蒂河流域地下含水层的As含量甚至高达239 μg·L-1(Yao et al., 2006; Singh et al., 2018; Zhao et al., 2019).尽管生物能够将无机砷转化为砷甜菜碱、砷糖等被认为无毒或低毒的有机砷化合物, 但长期的As暴露仍具有减缓鱼类等水生生物生长、抑制进食、引起肝脏等组织损伤并减少产卵量的作用(Pedlar et al., 2002b; 2002a; Boyle et al., 2008).
基于以上研究背景, 本文选取斑马鱼作为模式生物, 模拟现实场景中可能存在的顺序暴露方式, 探究TET和As(Ⅲ)的联合毒性效应.以期为TET和As(Ⅲ)的环境健康风险评价提供有力的科学依据, 同时也为复合污染的毒性效应评估方法提供新的思路.
2 材料和方法(Materials and methods)2.1 斑马鱼驯养实验用斑马鱼为4月龄, 使用容积为11 L、配有LED灯和曝气装置的鱼缸驯养, 每组鱼缸60~70条.光周期为14 h/10 h(昼/夜), 使用滤棉循环滤除残饵和粪便并定期更换.养殖水为紫外灯照射、除氯24 h的自来水, 水质条件为pH=7~8, 电导率为350~400 μS·cm-1, 水温控制在(24±1) ℃.每天喂食一次丰年虾幼虫(丰年虾卵在海盐水中孵化24 h后使用分离器过滤得到), 养殖水每天更换1/3左右, 及时清理鱼缸内壁和死亡的个体, 以免对斑马鱼的正常生长造成影响.
2.2 暴露实验设计在预实验基础上, 实验设置TET(盐酸四环素, 上海源叶生物科技有限公司)浓度为50 μg·L-1, As(Ⅲ)(As(Ⅲ) ICP-MS标准液, 上海安谱实验科技股份有限公司)浓度为100 μg·L-1.所有染毒组每日更换4 L养殖水, 以维持鱼缸内TET和As(Ⅲ)的浓度稳定及更新水质.按照上述染毒方法, 设置实验分组见图 1, 共分为TET2周暴露组(TET2)、TET2周暴露后2周As(Ⅲ)再暴露组(TET2As2)、TET2周暴露后2周恢复(即直接使用养殖水)组(TET2R2)、2周空白后As(Ⅲ)2周暴露组(R2As2)、TET2周暴露2周恢复后As(Ⅲ)2周再暴露组(TET2R2As2)及4周空白后As(Ⅲ)2周暴露组(R4As2), 同时分别设置了2周(CK2)、4周(CK4)及6周对照组(CK6).
图 1(Fig. 1)
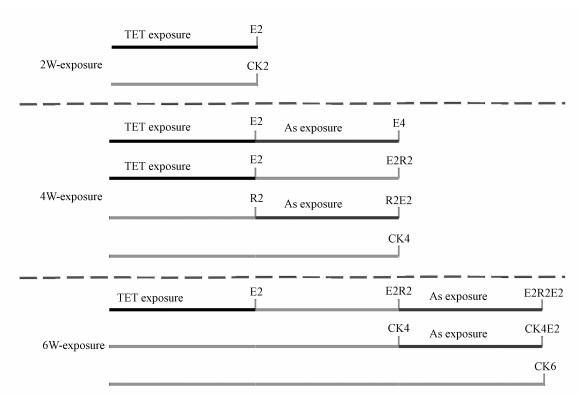 |
| 图 1 实验设计图 Fig. 1Schematic diagram of the experimental setup |
2.3 样品处理与保存肠道对生物体的生长发育、新陈代谢、营养和免疫系统起着重要作用, 已有研究表明, 抗生素能够引发斑马鱼肠道的炎症反应, 造成氧化损伤(Jung et al., 2018);肝脏是药物代谢的主要场所, 并且在生物体对外源污染物的解毒过程中起着重要作用.基于此, 本研究取斑马鱼肝脏和肠道器官展开实验, 以评价TET和As两种污染物的毒性效应.
染毒结束后, 使用冰块麻醉捕捞出的斑马鱼, 纸巾轻轻吸取表面水分, 使用分析天平(称量时将斑马鱼放置在锡箔纸上)和直尺分别量取体重、体长数据, 用于计算肥满度K, 具体见式(1).
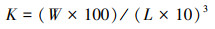 | (1) |
将斑马鱼固定于泡沫板上, 使用经高压蒸汽灭菌处理的剪刀和镊子取出肝脏和肠道组织, 放入冻存管或EP管中.操作过程中使用的泡沫板、锡箔纸、解剖用具及实验台面均需要使用75%医用酒精消毒, 操作人员需佩戴手套与口罩.每个实验组根据测定指标分装和保存样品, 并分别设置3组平行.放置于冻存管内的样品使用液氮速冻后置于-20 ℃冰箱保存待测, 在EP管内提前加入1 mL 10%福尔马林(4%甲醛)固定液(西陇科学股份有限公司), 加入样品后置于4 ℃冰箱保存待测.
2.4 组织病理学检测应用石蜡切片及HE染色技术对斑马鱼肝脏和肠道组织的形态进行观察.流水冲洗经10%福尔马林(4%甲醛溶液)固定液固定的肝脏和肠道组织, 经乙醇溶液逐级脱水, 并将脱水后的组织先后浸渍于无水乙醇和二甲苯混合液及纯二甲苯中透明, 最后石蜡包埋、切片、黏附于载玻片上烘干备用.切片在着色前需使用二甲苯脱蜡, 然后经乙醇溶液水化处理.本实验采用经典的苏木精和伊红染色法(HE染色法)使切片着色, 然后分别在100、200和400倍下对斑马鱼肠道和肝脏组织拍照, 记录其组织病理学变化.
2.5 氧化损伤分析准确称取冻存的斑马鱼肝脏和肠道组织样品, 按照1:9的质量体积比加入生理盐水(0.9%氯化钠水溶液)并在多样品组织研磨机(Ymnl-48, 南京以马内利设备有限公司)中匀浆, 所得组织匀浆液于2500 r·min-1、4 ℃下离心10 min, 取上清液待测.基于BCA法(蛋白质浓度测定试剂盒, 南京建成生物工程研究所)测定斑马鱼肠道及肝脏的蛋白质浓度.基于TBA法(丙二醛测定试剂盒, 南京建成生物工程研究所)测定斑马鱼肠道及肝脏的MDA含量, 测定结果使用式(2)计算.
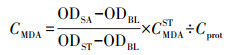 | (2) |
采用微板法(还原型谷胱甘肽测定试剂盒, 南京建成生物工程研究所)测定斑马鱼肝脏及肠道的GSH含量, 测定结果使用式(3)计算:
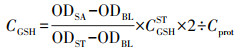 | (3) |
2.6 统计分析使用软件GraphPad Prism 8对实验所得数据进行统计分析, 对照组和每个处理组之间的差异采用单因素方差分析(One-way ANOVA), 检验方法为Tukey, 具有显著差异的组别以星号(*)表示.所有数据表示为平均值±标准偏差, 以p<0.05表示具有统计学意义.
3 结果(Results)3.1 TET和As暴露下斑马鱼表型变化本研究在暴露期间对各组斑马鱼定时定量喂食, 整个染毒过程中未观察到死亡个体, 各组斑马鱼存活率为100%.前述文献表明, TET和As(Ⅲ)能够改变鱼类肠道微生物菌群结构, 并可能造成肝肠等消化器官的病理学损伤, 进而对斑马鱼的消化功能造成影响.不同处理组肥满度是较为直观的表征斑马鱼生理健康的重要参数之一, 实验结束后每组随机取50条斑马鱼测量体重、体长, 并对肥满度进行分析讨论.从图 2可以看出, TET2组斑马鱼肥满度与CK2组无统计学差异(p>0.05), TET2As2、TET2R2及R2As2组斑马鱼肥满度均较CK4组低, TET2R2As2组斑马鱼肥满度与CK6组无统计学差异(p>0.05).综上, 连续暴露TET和As及As暴露导致斑马鱼肥满度降低, 而TET暴露和TET暴露后恢复As(Ⅲ)再暴露均可维持斑马鱼肥满度稳定.
图 2(Fig. 2)
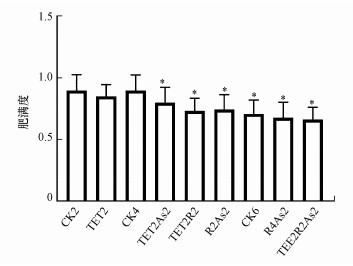 |
| 图 2 TET和As暴露对斑马鱼肥满度的影响 Fig. 2The effects of TET and As exposure on condition factor of zebrafish |
3.2 TET和As对肝脏和肠道组织的病理损伤本研究通过HE染色实验观察斑马鱼肝脏及肠道的组织病理学变化.斑马鱼肝脏的镜检结果显示(图 3), 对照组肝脏组织细胞边缘清晰可见, 排列规则整齐.与对照组(CK2)相比, TET2组大面积出现空白泡, 胞浆较亮, 细胞核被推向一侧(红色箭头), TET2R2组出现局部少量炎性细胞浸润(黄色箭头), 无其余明显病况.R2As2和R4As2组均出现广泛炎性细胞浸润, 细胞排列不整齐, 血管周围出现出血和充血现象(黄色圆圈).TET2As2组出现局部炎性细胞浸润及脂肪堆积(黄色箭头), TET2R2As2组未见明显损伤.斑马鱼肠道的镜检结果显示(图 4), 对照组肠道绒毛整体形态完整, 肠上皮细胞排列规则整齐, 无明显病理损伤.TET2组局部组织结构紊乱, TET2R2组无明显病理损伤, 其余处理组肠上皮细胞有轻微脱落, 无其他明显病理损伤.
图 3(Fig. 3)
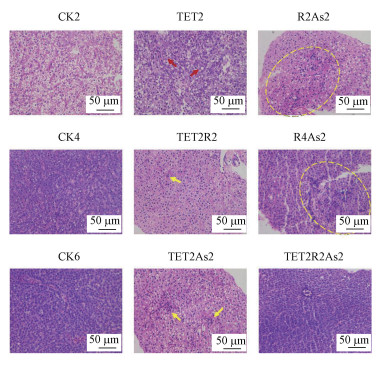 |
| 图 3 斑马鱼肝脏HE染色切片 Fig. 3HE staining section of zebrafish liver |
图 4(Fig. 4)
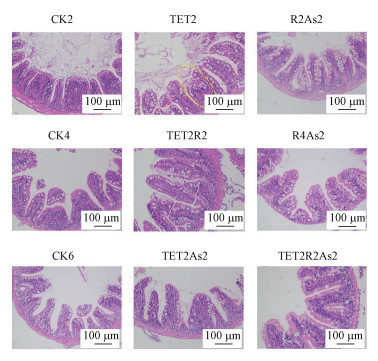 |
| 图 4 斑马鱼肠道HE染色切片 Fig. 4HE staining section of zebrafish intestine |
以上组织病理学结果表明, TET和As(Ⅲ)均诱导了斑马鱼肝脏和肠道的炎症反应.TET造成的器官损伤经过恢复处理可减轻或消失.TET暴露处理后再暴露As(Ⅲ), 造成了损伤的加剧, 但TET暴露后经过恢复再进行As(Ⅲ)暴露, 造成的损伤呈现出拮抗作用的效果.
3.3 TET和As(Ⅲ)对肝脏和肠道组织MDA和GSH含量的影响MDA作为机体内自由基与生物膜中的不饱和脂肪酸作用生成的脂质过氧化代谢产物, 在一定程度上代表了生物体的氧化损伤程度.GSH是重要的抗氧化剂, 与维生素C、维生素E、类胡萝卜素等抗氧化剂分子组成了生物体抗氧化防御系统的第一道防线(Jin et al., 2010).为进一步评价两种污染物对斑马鱼的氧化损伤毒性, 实验测定了斑马鱼肝脏与肠道组织中MDA和GSH的含量(图 5).由图 5a可知, 对照组(CK2)肝脏的MDA含量为(25.92±0.29) nmol·mg-1, TET暴露2周后MDA含量上升至(32.81±0.57) nmol·mg-1, 给予2周恢复时间后MDA含量趋于正常水平.As(Ⅲ)暴露2周及TET暴露后As(Ⅲ)再暴露(TET2As2)的MDA含量均上升, 其中, TET暴露后As(Ⅲ)再暴露组(TET2As2)的MDA含量差异最为显著, 为对照组的1.39倍, 而TET暴露后恢复As(Ⅲ)再暴露组(TET2R2As2)的MDA含量为(24.04±0.41) nmol·mg-1, 相比于对照组略有下降.肠道MDA含量测定结果如图 5b所示, 对照组的MDA含量为(2.54±0.05) nmol·mg-1, TET暴露2周后MDA含量上升至(3.07±0.19) nmol·mg-1, TET暴露后恢复2周的MDA含量与对照组无显著差异.As(Ⅲ)暴露组MDA含量为对照组的1.15倍, TET暴露后As(Ⅲ)再暴露(TET2As2)的MDA含量有显著上升, 为对照组的1.37倍.TET暴露后恢复As(Ⅲ)再暴露组(TET2R2As2)的MDA含量则略有下降, 为(2.31±0.02) nmol·mg-1.
图 5(Fig. 5)
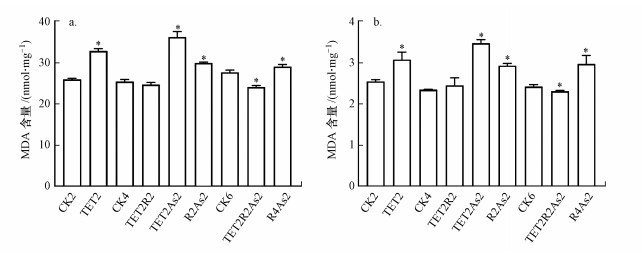 |
| 图 5 TET和As对肝脏(a)和肠道(b)组织MDA含量的影响 Fig. 5Effect of TET and As on MDA content in liver (a) and intestinal (b) tissues |
综上, TET和As(Ⅲ)暴露均可导致斑马鱼氧化损伤, 表现为MDA含量上升, 2周恢复时间可使MDA含量水平趋于正常, TET暴露后As(Ⅲ)再暴露的差异最为显著, TET暴露后恢复As(Ⅲ)再暴露组的MDA含量虽仍升高, 但与对照组的差异较小.
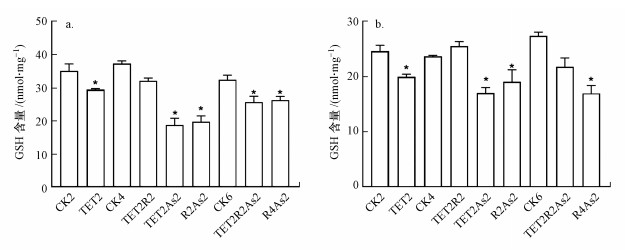
肝脏GSH含量测定结果如图 6a所示, 对照组的GSH含量为(35.11±2.13) nmol·mg-1, TET暴露2周后GSH含量下降至(29.48±0.28) nmol·mg-1, 给予2周恢复时间后趋于正常水平.As(Ⅲ)暴露2周的GAH含量下降至(22.58±0.68) nmol·mg-1, TET暴露后As(Ⅲ)再暴露(TET2As2)的GSH含量差异最为显著, 仅为对照组的0.53倍.TET暴露后恢复As(Ⅲ)再暴露组(TET2R2As2)肝脏中GSH含量同样下降, 为(25.66±1.78) nmol·mg-1.肠道GSH含量测定结果如图 6b所示, 对照组的GSH含量为(24.67±1.03) nmol·mg-1, TET暴露2周后GSH含量下降至(20.00±0.84) nmol·mg-1, 2周恢复后GSH含量恢复正常.As(Ⅲ)暴露2周后GSH含量下降至(18.02±1.82) nmol·mg-1, TET暴露后As(Ⅲ)再暴露组(TET2As2)的GSH含量显著下降至对照组的0.69倍, TET暴露后恢复As(Ⅲ)再暴露组(TET2R2As2)的GSH含量为(21.80±1.62) nmol·mg-1, 相比于对照组略有下降.
图 6(Fig. 6)
 |
| 图 6 TET和As对肝脏(a)和肠道(b)组织GSH含量的影响 Fig. 6Effect of TET and As on GSH content in liver (a) and intestinal (b) tissues |
结果表明, TET和As(Ⅲ)暴露可导致GSH含量下降, 连续暴露TET和As(Ⅲ)降低GSH含量的毒性效应相比于单一暴露更为显著, TET暴露后恢复As(Ⅲ)再暴露对GSH含量的影响较小.
4 讨论(Discussion)本研究基于斑马鱼开展了TET(50 μg·L-1)和As(Ⅲ)(100 μg·L-1)的单一暴露实验、TET暴露后恢复实验及包括连续暴露TET和As(Ⅲ)、TET暴露后恢复As(Ⅲ)再暴露2种暴露方式的顺序暴露实验.结果表明, TET和As(Ⅲ)暴露均可诱导斑马鱼肝脏和肠道的氧化应激反应, 并造成不同程度的局部组织损伤, 其中, TET暴露后恢复2周可明显改善上述症状.在顺序暴露实验中, 相较于TET暴露组和As(Ⅲ)暴露组, TET暴露后As(Ⅲ)再暴露组观察到了更加明显的毒性效应, 而TET暴露后恢复As(Ⅲ)再暴露虽仍诱导了氧化应激反应, 但其毒性效应有所降低.
随着TET在水环境中的频繁检出, 有关其生态毒性的研究也越来越多.研究表明, 斑马鱼暴露于1和100 μg·L-1浓度水平的TET中, 肝脏的一些脂质代谢途径, 如亚油酸代谢、酪氨酸代谢和蛋氨酸代谢等严重失调, 致使肝脏脂肪堆积(Keerthisinghe et al., 2020).本研究中, TET(50 μg·L-1)暴露2周后, 斑马鱼肝脏组织出现脂肪空泡, 这与Keerthisinghe等(2020)的结果相似.抗氧化防御系统是机体抵抗内外源污染物氧化损伤毒性的保护机制, 主要通过抗氧化酶的酶促反应或一些抗氧化剂分子与机体内产生的自由基形成一种动态平衡, 以此缓解有毒物质带来的氧化损伤(余晓玲, 2019).生物体可利用GSH与谷胱甘肽巯基转移酶(glutathione S-transferases, GST)、谷胱甘肽过氧化物酶(Glutathione peroxidase, GPx)协同有效清除氧自由基(Zhao et al., 2017).研究表明, TET可以引发斑马鱼等水生生物的氧化应激反应, 如诱导活性氧的产生(Zhang et al., 2015), 抑制SOD和GPx等抗氧化酶活性(余晓玲, 2019).本研究的结果同样证实斑马鱼受TET胁迫导致机体内氧自由基过多, 从而引发与生物膜不饱和脂肪酸的脂质过氧化作用, 最终导致MDA含量升高, 肝脏及肠道器官的GSH含量下降也说明了机体为减轻氧化损伤导致GSH作为还原性底物被快速分解.因此, 本研究证实了TET潜在生态毒性.
实际水体环境中, 生产的不连续性导致一些外源污染物的流入是间歇性的, 而水质特别是河流水体在不断更新, 这就导致水体环境中并不总是存在这些污染物, 其中的水生生物在暴露目标污染物后可能会获得恢复期.值得注意的是, 一些污染物在停止暴露后其毒性影响依然会持续一段时间, 例如斑马鱼暴露于142 μg·L-1三环唑后, 经过14 d恢复期, 斑马鱼的甘油酸脂和乳酸含量继续升高(Sancho et al., 2009);即使暴露结束, 伊马替尼对轮虫的摄食抑制也会持续(Yan et al., 2017).但在本研究中, TET暴露结束, 经过2周恢复, 对斑马鱼造成的病理学和氧化损伤均回复至正常水平.在这个过程中, 机体对体内污染物的清除及氧化应激水平的调节发挥了重要作用(余晓玲, 2019).
As是一种普遍存在的类金属元素, 随着人类生产活动和工业化进程, 大量As及其化合物进入水体环境, 其导致的生态毒性效应已经引起人们的高度关注.研究表明, 湖鳟鱼在摄入含As(Ⅲ)饲料后, 血浆内脂质过氧化物含量升高, 且肝、肾及小肠等器官出现病理损伤(Pedlar et al., 2002b).类似的实验中, 白鲑也出现了炎症反应和肝组织局部坏死(Pedlar et al., 2002a).本研究的实验结果表明, As(Ⅲ)暴露导致斑马鱼肝脏、肠道出现病理损伤.此外, 与Sarkar等(2014)的结果类似, As(Ⅲ)诱导了斑马鱼的氧化应激反应.研究表明, As(Ⅲ)可以与细胞中谷胱甘肽还原酶的巯基结合, 使其失去将氧化型谷胱甘肽转化为还原型谷胱甘肽的活性(Hirano et al., 2004).这可能是本研究中GSH含量下降的原因.实际水体环境中, As的毒性效应与其形态有着密切联系.通常认为无机砷的毒性强于有机砷, 水体中无机砷的主要存在形式为亚砷酸盐As(OH)3和砷酸盐AsO(OH)3, 其中, As(Ⅲ)的毒性往往强于As(Ⅴ)(刘香丽等, 2019).本研究中, As(Ⅲ)的染毒方式为将斑马鱼直接暴露于含As(Ⅲ)的水环境中, 然而由于曝气等措施所造成的富氧条件, 暴露过程中As(Ⅲ)不可避免地向As(Ⅴ)转化.因此, 本研究通过每日换水的方式尽量减少As(Ⅲ)形态变化所带来的影响, 同时确保每个实验组的换水体积、换水时间点与换水频率相同, 减少组间差异.
本研究中, 连续暴露TET和As(Ⅲ)后, 与TET、As(Ⅲ)单一暴露相比, 均造成了肝脏和肠道的病理学损伤, 而在氧化损伤方面表现出更为显著的毒性效应.基于GSH在抗氧化防御系统抵抗氧化损伤过程中的重要性, 本研究有以下推测:一方面, GSH能够与As(Ⅲ)及其甲基化物发生反应来抵御As(Ⅲ)诱导的毒性(Styblo et al., 1997; Bhattacharya et al., 2007), 而TET暴露诱导了机体用于清除自由基的GSH含量下降, 这可能是机体对重金属As(Ⅲ)的耐受性下降的原因;另一方面, 机体内过量的氧自由基不能及时清除时, MDA积累引起的氧化损伤增加, 进而导致体内抗氧化酶活性降低, 甚至导致其降解, 使得机体的抗氧化防御能力显著下降(Morcillo et al., 2016).
本研究中观察到TET暴露后给予2周恢复时间再暴露As(Ⅲ)虽仍出现MDA含量升高、GSH含量下降的变化, 但相较于TET暴露后As(Ⅲ)再暴露组和As(Ⅲ)暴露组, 更加接近于对照组的实验结果, 这表明机体抗氧化防御系统遭受破坏后, 给予恢复时间可能帮助机体更好地适应外源污染物造成的环境压力.通常生物体再次暴露同种污染物时对污染物的敏感性较低, 因为机体可能对目标污染物产生适应性(Boone et al., 2003).已有研究表明, 生物体可能存在共抗性及交叉抗性现象, 即重金属抗性基因与抗生素抗性基因位于同一质粒或染色体临近位置上表现出共抗性, 或生物体使用相同机制排除不同结构的化合物而表现出交叉抗性(薛喜枚等, 2019).例如, 从贝类中分离得到的副溶血性弧菌在经过Cu2+和Co2+预处理后增强了对四环素、庆大霉素等抗生素的抗性(Jo et al., 2020).本研究对TET暴露后恢复组进行As(Ⅲ)暴露处理后提高了斑马鱼对As(Ⅲ)的耐受性, 推测可能有以下原因:斑马鱼肠道微生物在其肠道屏障、毒素排出等方面发挥着重要作用, 在恢复阶段, 随着TET的清除其毒性效应消失, 经TET筛选后的肠道微生物菌群可能同时对重金属As(Ⅲ)存在抗性, 从而发挥对As(Ⅲ)的解毒作用;另一方面, TET在斑马鱼体内累积所产生的氧化损伤等毒性效应不利于机体防御新的外源污染物, 而在恢复阶段随着污染物的清除其氧化防御系统等的功能恢复正常, 并可能在基因表达等方面产生适应性.例如, 机体可能通过基因调控提高GST酶活性使得GSH与As(Ⅲ)诱导产生的氧自由基快速反应, 从而避免了积累MDA等过氧化产物对机体造成进一步损伤(Basica et al., 2019).相关的具体毒理机制还有待进一步研究.
5 结论(Conclusions)本研究通过对斑马鱼的表型数据(体重、体长)、组织病理学损伤(HE染色)和氧化应激损伤(MDA和GSH)的结果进行分析讨论, 发现TET可导致斑马鱼肝脏脂肪堆积, 肠绒毛结构破坏, 并造成一定程度的氧化损伤, 而停止暴露2周后其导致的病理学和氧化损伤均明显改善.As(Ⅲ)会引起肝脏局部炎症反应, 并导致氧化应激损伤.顺序暴露场景下TET暴露后是否存在恢复期对于后续As(Ⅲ)再暴露所产生的毒性具有重要影响.本实验的研究结果可为水环境中TET和As(Ⅲ)的毒性效应评估提供新的切入点.
参考文献
| Basica B, Mihaljevic I, Marakovic N, et al. 2019. Molecular characterization of zebrafish Gstr1, the only member of teleost-specific glutathione S-transferase class[J]. Aquatic Toxicology, 208: 196-207. DOI:10.1016/j.aquatox.2019.01.005 |
| Bhattacharya S, Bhattacharya A, Roy S. 2007. Arsenic-induced responses in freshwater teleosts[J]. Fish Physiology and Biochemistry, 33: 463-473. DOI:10.1007/s10695-007-9173-2 |
| Boone M D, Bridges C M. 2003. Effects of carbaryl on green frog (Rana clamitans) tadpoles:Timing of exposure versus multiple exposures[J]. Environmental Toxicology and Chemistry, 22: 2695-2702. DOI:10.1897/02-401 |
| Boyle D, Brix K V, Amlund H, et al. 2008. Natural arsenic contaminated diets perturb reproduction in fish[J]. Environmental Science & Technology, 42: 5354-5360. |
| Carvalho I T, Santos L. 2016. Antibiotics in the aquatic environments:A review of the European scenario[J]. Environment International, 94: 736-757. DOI:10.1016/j.envint.2016.06.025 |
| Chen H, Jing L, Teng Y, et al. 2018. Characterization of antibiotics in a large-scale river system of China:Occurrence pattern, spatiotemporal distribution and environmental risks[J]. Science of the Total Environment, 618: 409-418. DOI:10.1016/j.scitotenv.2017.11.054 |
| Chen Y, Zhou J L, Cheng L, et al. 2017. Sediment and salinity effects on the bioaccumulation of sulfamethoxazole in zebrafish (Danio rerio)[J]. Chemosphere, 180: 467-475. DOI:10.1016/j.chemosphere.2017.04.055 |
| Grenni P, Ancona V, Caracciolo A B. 2018. Ecological effects of antibiotics on natural ecosystems:A review[J]. Microchemical Journal, 136: 25-39. DOI:10.1016/j.microc.2017.02.006 |
| He X, Xu Y, Chen J, et al. 2017. Evolution of corresponding resistance genes in the water of fish tanks with multiple stresses of antibiotics and heavy metals[J]. Water Research, 124: 39-48. DOI:10.1016/j.watres.2017.07.048 |
| Hirano S, Kobayashi Y, Cui X, et al. 2004. The accumulation and toxicity of methylated arsenicals in endothelial cells:important roles of thiol compounds[J]. Toxicology and Applied Pharmacology, 198(3): 458-467. DOI:10.1016/j.taap.2003.10.023 |
| Jin Y, Zhang X, Shu L, et al. 2010. Oxidative stress response and gene expression with atrazine exposure in adult female zebrafish (Danio rerio)[J]. Chemosphere, 78: 846-852. DOI:10.1016/j.chemosphere.2009.11.044 |
| Jo S, Shin C, Shin Y, et al. 2020. Heavy metal and antibiotic co-resistance in Vibrio parahaemolyticus isolated from shellfish[J]. Marine Pollution Bulletin, 156. |
| Jung J Y, Ahn Y, Khare S, et al. 2018. An in vitro study to assess the impact of tetracycline on the human intestinal microbiome[J]. Anaerobe, 49: 85-94. DOI:10.1016/j.anaerobe.2017.12.011 |
| Keerthisinghe T P, Wang F, Wang M, et al. 2020. Long-term exposure to TET increases body weight of juvenile zebrafish as indicated in host metabolism and gut microbiome[J]. Environment International, 139. DOI:10.1016/j.envint.2020.105705 |
| 刘香丽, 汪倩, 宋超, 等. 2019. 不同砷形态在水产品中的毒理及转化研究进展[J]. 农学学报, 9(12): 33-38. |
| Morcillo P, Esteban M A, Cuesta A. 2016. Heavy metals produce toxicity, oxidative stress and apoptosis in the marine teleost fish SAF-1 cell line[J]. Chemosphere, 144: 225-233. DOI:10.1016/j.chemosphere.2015.08.020 |
| Pedlar R M, Ptashynski M D, Evans R, et al. 2002a. Toxicological effects of dietary arsenic exposure in lake whitefish (Coregonus clupeaformis)[J]. Aquatic Toxicology, 57: 167-189. DOI:10.1016/S0166-445X(01)00198-9 |
| Pedlar R M, Ptashynski M D, Wautier K G, et al. 2002b. The accumulation, distribution, and toxicological effects of dietary arsenic exposure in lake whitefish (Coregonus clupeaformis) and lake trout (Salvelinus namaycush)[J]. Comparative Biochemistry and Physiology C-Toxicology & Pharmacology, 131: 73-91. |
| Qiao M, Ying G G, Singer A C, et al. 2018. Review of antibiotic resistance in China and its environment[J]. Environment International, 110: 160-172. DOI:10.1016/j.envint.2017.10.016 |
| Ray A, Shelly A, Roy S, et al. 2020. Arsenic induced alteration in Mrp-1 like activity leads to zebrafish hepatocyte apoptosis:the cellular GSH connection[J]. Environmental Toxicology and Pharmacology, 79. DOI:10.1016/j.etap.2020.103427 |
| Sancho E, Fernandez-Vega C, Jose Villarroel M, et al. 2009. Physiological effects of tricyclazole on zebrafish (Danio rerio) and post-exposure recovery[J]. Comparative Biochemistry and Physiology C-Toxicology & Pharmacology, 150(1): 25-32. |
| Sarkar S, Mukherjee S, Chattopadhyay A, et al. 2014. Low dose of arsenic trioxide triggers oxidative stress in zebrafish brain:Expression of antioxidant genes[J]. Ecotoxicology and Environmental Safety, 107: 1-8. DOI:10.1016/j.ecoenv.2014.05.012 |
| Singh C K, Kumar A, Bindal S. 2018. Arsenic contamination in Rapti River Basin, Terai region of India[J]. Journal of Geochemical Exploration, 192: 120-131. DOI:10.1016/j.gexplo.2018.06.010 |
| Styblo M, Serves S V, Cullen W R, et al. 1997. Comparative inhibition of yeast glutathione reductase by arsenicals and arsenothiols[J]. Chemical Research in Toxicology, 10: 27-33. DOI:10.1021/tx960139g |
| Xia H, Chen J, Chen X, et al. 2019. Effects of tetracycline residuals on humification, microbial profile and antibiotic resistance genes during vermicomposting of dewatered sludge[J]. Environmental Pollution, 252: 1068-1077. DOI:10.1016/j.envpol.2019.06.048 |
| 薛喜枚, 朱永官. 2019. 土壤中砷的生物转化及砷与抗生素抗性的关联[J]. 土壤学报, 56(4): 763-772. |
| Xu Z, Li T, Bi J, et al. 2018. Spatiotemporal heterogeneity of antibiotic pollution and ecological risk assessment in Taihu Lake Basin, China[J]. Science of the Total Environment, 643: 12-20. DOI:10.1016/j.scitotenv.2018.06.175 |
| Yan Z, Yan K, He X, et al. 2017. The impact assessment of anticancer drug imatinib on the feeding behavior of rotifers with an integrated perspective:Exposure, post-exposure and re-exposure[J]. Chemosphere, 185: 423-430. DOI:10.1016/j.chemosphere.2017.07.043 |
| Yan Z, Yang Q, Jiang W, et al. 2018. Integrated toxic evaluation of sulfamethazine on zebrafish:Including two lifespan stages (embryo-larval and adult) and three exposure periods (exposure, post-exposure and re-exposure)[J]. Chemosphere, 195: 784-792. DOI:10.1016/j.chemosphere.2017.12.119 |
| Yang Y, Song W, Lin H, et al. 2018. Antibiotics and antibiotic resistance genes in global lakes:A review and meta-analysis[J]. Environment International, 116: 60-73. DOI:10.1016/j.envint.2018.04.011 |
| Yao Q Z, Zhang J, Qin X G, et al. 2006. The behavior of selenium and arsenic in the Zhujiang (Pearl River) Estuary, South China Sea[J]. Estuarine Coastal and Shelf Science, 67: 170-180. |
| 余晓玲.2019.猪场废水中四环素类抗生素对斑马鱼抗氧化效应毒理研究[D].南昌: 南昌大学 |
| 张浩, 罗义, 周启星. 2008. 四环素类抗生素生态毒性研究进展[J]. 农业环境科学学报, (2): 407-413. |
| 章强, 辛琦, 强丽媛, 等. 2015. 铜及其与四环素的联合暴露对斑马鱼胚胎的毒性效应[J]. 生态毒理学报, 10(5): 35-46. |
| Zhang Q, Cheng J, Xin Q. 2015. Effects of tetracycline on developmental toxicity and molecular responses in zebrafish (Danio rerio) embryos[J]. Ecotoxicology, 24(4): 707-719. DOI:10.1007/s10646-015-1417-9 |
| Zhang Q Q, Ying G G, Pan C G, et al. 2015. Comprehensive evaluation of antibiotics emission and fate in the river basins of china:source analysis, multimedia modeling, and linkage to bacterial resistance[J]. Environmental Science & Technology, 49: 6772-6782. |
| Zhang X, Chen Z, Ma Y, et al. 2020. Response of partial nitrification sludge to the single and combined stress of CuO nanoparticles and sulfamethoxazole antibiotic on microbial activity, community and resistance genes[J]. Science of the Total Environment, 712. DOI:10.1016/j.scitoenv.2019.135759 |
| Zhao L, Hu Q, Huang Y, et al. 2017. Response at genetic, metabolic, and physiological levels of maize (Zea mays) exposed to a Cu(OH)2 nanopesticide[J]. Acs Sustainable Chemistry & Engineering, 5: 8294-8301. |
| Zhao X, Li Z, Wang D, et al. 2019. Assessment of residents' total environmental exposure to heavy metals in China[J]. Scientific Reports, 9(1): 497-515. DOI:10.1038/s41598-018-36739-9 |
