
 , 倪佳鑫1, 冮苗苗1, 付艺伟2, 孙辉3, 鲁晶4
, 倪佳鑫1, 冮苗苗1, 付艺伟2, 孙辉3, 鲁晶41. 哈尔滨工业大学环境学院, 城市水资源与水环境国家重点实验室, 哈尔滨 150090;
2. 中国电建集团北京勘测设计研究院有限公司, 北京 100024;
3. 中山市水利水电勘测设计咨询有限公司, 中山 528403;
4. 深圳市水源环保建设有限公司, 深圳 518081
收稿日期: 2020-09-01; 修回日期: 2020-09-18; 录用日期: 2020-09-18
基金项目: 国家水体污染控制与治理科技重大专项(No.2017ZX07501002);国家自然科学基金(No.50808052)
作者简介: 刘冬梅(1973-), 女, 教授, E-mail:mei18@hit.edu.cn
通讯作者(责任作者): 刘冬梅, E-mail:ldm819@126.com
摘要:微藻是一种广泛存在、生长速度快、适宜大规模养殖的结构简单的植物.近年来,基于微藻的水污染控制技术被广泛研究并得到认可,其中,利用藻类吸附污染水体中的重金属类物质更被看作是一种极具前景的水处理手段.然而,当前的研究始终对藻类吸附重金属性能的决定性影响因素缺乏相对全面的探究,同时对藻类表面官能团在吸附过程中所起的作用也不明确.对此,本研究采取静态实验的方法,选取常见的淡水藻类小球藻Chlorella sp.和典型重金属Ni (Ⅱ)、Cr (VI)、Cd (Ⅱ),以藻细胞密度、重金属离子浓度、温度、pH作为影响因素,探究其对小球藻细胞吸附性能的影响.结果表明,小球藻对Ni (Ⅱ)、Cr (VI)、Cd (Ⅱ)均显示出了很好的吸附能力.在所选的几种藻细胞密度下,小球藻吸附性能差异不大.当溶液处于中性偏酸性、重金属浓度低于5 mg·L-1的情况下,小球藻吸附效果最好.在20~30℃范围内升高温度对吸附会产生有利影响.对小球藻进行红外光谱检测发现,官能团C—O、C=O、—COOH、—NH—在对重金属离子的吸附过程中起主要作用.
关键词:吸附重金属小球藻酸碱性温度官能团
Research on adsorption properties of several heavy metals by chlorella
LIU Dongmei1

 , NI Jiaxin1, GANG Miaomiao1, FU Yiwei2, SUN Hui3, LU Jing4
, NI Jiaxin1, GANG Miaomiao1, FU Yiwei2, SUN Hui3, LU Jing41. State Key Laboratory of Urban Water Resource and Environment, School of Environment, Harbin Institute of Technology, Harbin 150090;
2. China Power Construction Group Beijing Survey, Design and Research Institute Co., Ltd., Beijing 100024;
3. Zhongshan Water Conservancy&Hydropower Survey&Design Consulting Co., Ltd., Zhongshan 528403;
4. Shenzhen Water Source Protection and Construction Co., Ltd., Shenzhen 518081
Received 1 September 2020; received in revised from 18 September 2020; accepted 18 September 2020
Abstract: Microalgae is a widely-existing organism in water,which has the characteristics of rapid growth and reproduction,facile large-scale cultivating and so on. In recent years,algae-based methods for remediating of water pollution have been extensively studied. Among them. With the use of algae to absorb heavy metals in polluted water is regarded as a very promising water treatment method. However,the current research has always lacked a thorough understanding of the key factors influencing the adsorption of heavy metals by algae. At the same time,the function of functional groups surrounding the algae surface is also ambiguous. In this regard,a static experiment was conducted which select common Chlorella sp. and typical heavy metals Ni(Ⅱ),Cr(VI),and Cd(Ⅱ) as materials. Explored experimental variables included l algal cell densities,concentration of heavy metals,temperature and pH. The results showed that chlorella had good adsorption properties to three heavy metals. With the selected densities of several algal cells,the adsorption performance of Chlorella was not significantly different. When the solution was neutral or a little acidic and the heavy metal concentration was lower than 5 mg·L-1,Chlorella has the best adsorption effect. In the range of 20~30 ℃,the higher the temperature was,the better adsorption was. In addition,infrared spectroscopy revealed that the main functional groups of Chlorella vulgaris were C—O,C=O,—COOH,—NH—,etc.
Keywords: adsorptionheavy metalschlorellaacid and alkalitemperaturefunctional groups
1 引言(Introduction)社会经济的迅速发展使采矿等工业迅速崛起, 造成了重金属类物质的开采利用被不断扩大化的局面(张永江等, 2017), 更多的安全隐患也随之而来(方志青等, 2018;张清华等, 2018).重金属能够对环境和生命体健康造成持久性伤害(汪远丽等, 2012).作为生物生存不可或缺的物质, 水成为重金属污染最好的媒介(时春景等, 2017).对此, 我国对于各种含重金属废水均有明确的排放标准.然而, 局限于当前的水处理技术等原因, 仍旧有大量含重金属废水进入水体.此外, 即使重金属废水达标排放, 但鉴于其化学稳定性所造成的积累性污染也不容忽视(Li et al., 2002).
研究发现, 藻类对重金属具有优越的吸附富集能力(于芳等, 2015).在20世纪藻类就已经被应用于环境领域, 相比于传统物理、化学等方法, 利用藻类吸附重金属具备能耗低、来源广、吸附性能好等优势, 因而使用天然藻类作为吸附剂处理修复重金属污染废水, 具有很好的应用价值和前景(Anastopoulos et al.2015).其与物理、化学方法一同为重金属废水的处理提供了很好的技术手段(Anastopoulos et al.2015).
当前对藻类吸附重金属的研究取得了明显的成果.吴海锁等(2004)以小球藻细胞为原料制备粉末吸附剂, 并通过吸附试验发现其对铜、镉、锌的吸附作用显著.Deng等(2007)利用刚毛藻在不同条件下吸附Cu(II), 取得了较好的处理效果.Alam等(2015)根据其研究结果提出可将藻类对重金属的这种吸附性能用于水处理过程中.Anca等(2005)采用莱茵衣藻所制成的生物制剂对Cr(VI)进行吸附, 展示出生物制剂对Cr(VI)出色的吸附效果.Gómez-Jacinto等(2015)通过研究环境中Hg对小球藻的影响情况, 证明了小球藻可以有效吸附水环境中的重金属Hg.
藻类主要通过物理、化学、生物的共同作用, 从而达到吸附重金属的目的, 其吸附过程还会受到温度、pH值、离子含量等因素的影响(Lamai et al.2005).但当前的研究大多只考虑单一因素对藻类吸附重金属性能的影响而缺乏多因素的全面考量.此外, 藻类细胞壁上具有多种功能性基团如羧基(—COOH)、羟基(—OH)等(Vassilev et al.2016), 在吸附过程中, 藻类表面官能团所起到的作用也应该被明确.基于此, 本研究以常见的淡水藻类小球藻Chlorella sp.为吸附用藻种, 选择Ni(II)、Cr(VI)和Cd(II)作为典型重金属代表, 探究不同藻细胞密度、重金属浓度、温度及pH等因素对小球藻吸附过程的影响.同时, 采用红外光谱分析探究不同官能团在吸附过程中发挥的作用.以期明确藻类处理重金属废水的相关机理, 并为水环境中重金属污染处理提供技术支持.
2 材料和方法(Materials and methods)2.1 藻种及培养实验用普通小球藻(Chlorella vulgaris)购自中国科学院水生生物研究所淡水藻种库, 编号为FACHB-1068.将处于对数生长期的小球藻接种到高压灭菌后的BG11培养基中(霍书豪等, 2012)进行培养, 光照强度约为4000 lx, 光暗周期为14 h : 10 h, 温度为25 ℃, 每隔一段时间, 进行人工振荡, 以保证小球藻能够正常生长.K2Cr2O7、NiCl2·6H2O、CdCl2 · 2.5H2O等均为分析纯.
2.2 实验方法2.2.1 藻细胞密度对吸附性能影响实验Ni(II)、Cr(VI)、Cd(II)储备液均用去离子水配制而成, 浓度为2.5 g · L-1.选择处于对数生长期的小球藻进行接种培养, 培养体系分别为含5.0 mg · L-1 Ni(II)、Cr(VI)、Cd(II)的BG11培养基, 体积300 mL.小球藻的初始浓度分别约为1.0×105、5.0×105、10×105 cell · mL-1(刘志泉, 2012;王执伟等, 2016), 温度为25 ℃, pH=7.培养0~4 d内, 每24 h测定一次各组重金属离子浓度.
2.2.2 重金属浓度对吸附性能影响实验选取初始浓度约为5.0×105 cell · mL-1的小球藻, 将其分别接种于Ni(II)、Cd(II)浓度为0.1、1、10 mg · L-1的培养体系, 以及Cr(VI)浓度为1、5、10、20 mg · L-1的养体系, 选择反应温度为25 ℃, pH=7.培养0~5 d内, 每24 h测定一次各组重金属离子浓度并计算相应的吸附率.
2.2.3 pH值对吸附效能影响实验在小球藻初始浓度为5.0×105 cell · mL-1、重金属浓度为5.0 mg · L-1的条件下, 调整培养体系的pH分别为3、5、7、9进行吸附实验, 保持反应温度为25 ℃, 每24 h测定一次各组重金属离子浓度并计算96 h的吸附率.
2.2.4 温度对吸附效能影响实验设置小球藻初始浓度为5.0×105 cell · mL-1, 重金属浓度分别为1、10 mg · L-1, pH=7, 调整温度梯度为20、25、30 ℃, 在以上条件下进行培养.96 h后取培养液, 测定各组重金属离子浓度并计算各自吸附率.
2.2.5 微藻吸收的重金属的测定方法取小球藻培养液50 mL进行离心(11000 g, 10 min)操作, 留下沉淀部分并用去离子水补全至50 mL, 反复3遍.使用25 mL的比色管盛装藻泥, 并对其进行烘干处理.向比色管中加入10 mL浓硝酸、5 mL H2O2(30%), 在37 ℃条件下进行消化, 消化时间为24 h.之后用电炉加热到溶液剩下0.5~1.0 mL时, 加入含1%NH4H2PO4的2%硝酸, 用50 mL容量瓶定容, 即可得到藻细胞吸附的重金属, 通过电感耦合等离子体-发射光谱法(ICP-AES)对重金属浓度进行测定.
2.2.6 小球藻对重金属吸附率的计算采用公式(1)计算小球藻对重金属的吸附率I, 其中, C0为初始时溶液中重金属离子的浓度(mg · L-1), Ct为吸附一定时间后滤液中重金属离子的浓度(mg · L-1).
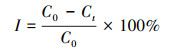 | (1) |
图 1(Fig. 1)
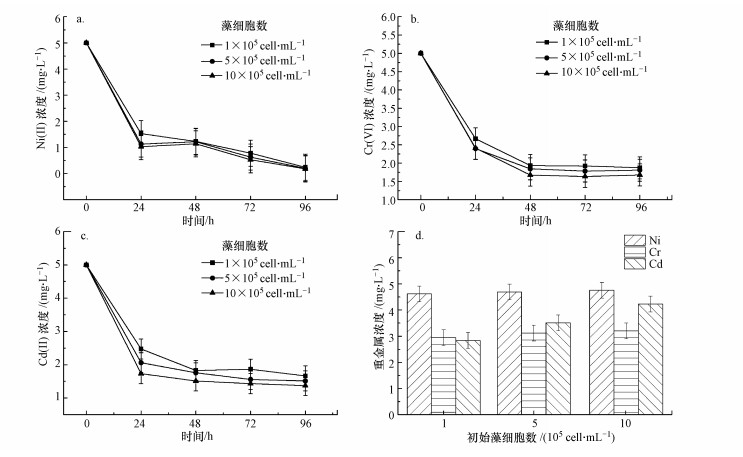 |
| 图 1 藻细胞密度对吸附性能的影响 Fig. 1The effect of algal cell density on adsorption performance |
由图可知, 培养液中重金属离子浓度的变化趋势不受藻细胞密度的影响, 都是随时间延长而减小且重金属的去除程度与藻细胞的初始浓度成正比, 即重金属的吸附位点会随藻细胞的增多而增多.但小球藻吸附重金属并未出现类似于无机吸附剂的剂量效应, 这是由于小球藻的藻细胞具有生命活性, 其吸附重金属是通过调节自身生理活动实现的.由图 1a~c还可以看出, 虽然初始时刻藻细胞浓度有明显区别, 但对于同种重金属, 每个时间点检测到的浓度相差不大.此外, 96 h时Ni(II)的浓度已经接近于0 mg · L-1, 而此时水中Cd(II)浓度约为1.5 mg · L-1, Cr(VI)浓度约为1.8 mg · L-1, 这说明小球藻对于不同种类重金属的吸附能力存在差异.
96 h后检测发现, 生长在不同重金属环境下的小球藻, 其内部均能检测到相应重金属.对图 1d中数据与图 1a~c中的数据进行比较, 发现存在于水中的Ni(II)浓度与藻细胞上的Ni(II)浓度的加和值接近于初始的Ni(II)浓度, 并且当初始小球藻细胞密度逐渐增加时, 所得到的加和值与初始Ni(II)浓度之间的差距逐步减小, 这说明水相中降低的Ni(II)有效地被小球藻的藻体表面所吸附.Cd(II)的情况与Ni(II)相同, 由此可知, 小球藻细胞对于Cd(II)、Ni(II)的吸附主要是通过其细胞表面.而Cr(VI)的情况却有所不同, 其两项加和值与初始的Cr(VI)浓度相比有所降低, 并且随着藻密度的增加, 这种差距也会稍微加大.这说明水中减少的Cr(VI)并未全部被吸附于小球藻细胞表面.考虑到铬的存在价态, 减少的Cr(VI)有可能是发生了价态的转化.
3.2 初始重金属浓度对吸附性能的影响设置不同初始浓度的Ni(II)进行实验, 并以2.2.5节中的方法检测小球藻细胞吸收的重金属, 结果如图 2a~c所示.此外, 每24 h计算不同初始浓度下当日小球藻相对于前一日的吸附率, 结果见图 2d.
图 2(Fig. 2)
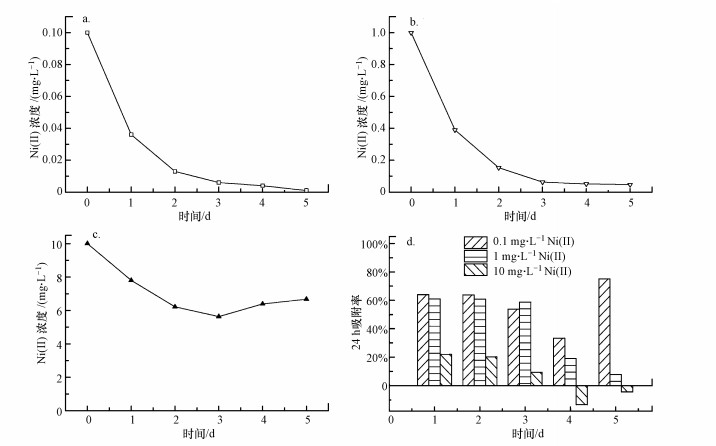 |
| 图 2 Ni(II)初始浓度对吸附性能的影响 Fig. 2Effect of Ni(II) concentration on adsorption performance |
由图 2a和2b可知, Ni(II)初始浓度为0.1 mg · L-1和1 mg · L-1情况下, 水中Ni(II)浓度随着时间延长而减小, 到第5 d时基本检测不到Ni(II)的存在.Ni(II)初始浓度为10 mg · L-1的情况下, 水中的Ni(II)浓度呈现先下降再升高的趋势(图 2c), 这是因为在Ni(II)浓度较高时, 会影响到小球藻自身的生长和其细胞活性.这说明小球藻细胞对Ni(II)的吸附作用还受小球藻细胞的活性和生理活动的影响.
通过对小球藻24 h吸附率的计算可以得出, 当Ni(II)浓度较低时, 小球藻吸附率没有明显差别, 而高浓度时出现了负吸附率(图 2d).这是因为小球藻在Ni(II)浓度较低时, 通过增殖产生新细胞继续作为吸附剂对其进行吸附, 因而Ni(II)浓度继续降低.而在高浓度(10 mg · L-1)环境条件下, 小球藻细胞会受到更大的毒害作用而影响到其细胞增殖, 因而已经吸附的Ni(II)也会再次被细胞释放出来, 出现Ni(II)浓度再次升高的现象.
图 3所示为不同初始浓度的Cr(VI)培养条件下, 溶液中不同价态Cr浓度的变化情况.由图中Cr元素的形态可见, 小球藻对Cr(VI)同时存在吸附和转化作用.在Cr初始浓度为1 mg · L-1条件下, 96 h后检测到总Cr的吸附率为24%, 然而溶液中Cr(VI)的浓度减少了48.73%.随着初始Cr浓度的升高, 小球藻细胞对Cr的吸附量增加的同时其吸附率却在下降, 同时降低的还有Cr(VI)的转化能力.这可能是因为当Cr浓度较高时, 小球藻会受到毒害作用, 从而导致这两种作用均在下降.在Cr初始浓度为20 mg · L-1时, 这两种形态Cr的降低程度基本一致, 此时溶液中的Cr(VI)即为总Cr.对比小球藻对Ni和Cr两种重金属的吸附可以发现, 小球藻对Ni(II)的吸附效果始终优于Cr.
图 3(Fig. 3)
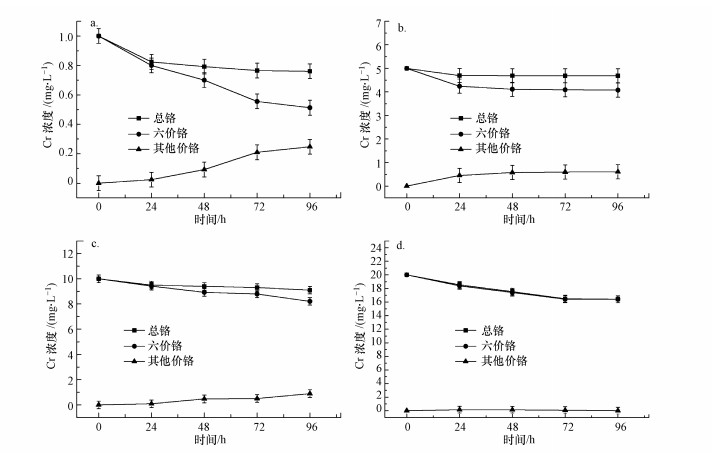 |
| 图 3 Cr初始浓度对吸附性能的影响 Fig. 3Effect of Cr concentration on adsorption performance |
在不同Cd(II)初始浓度条件下进行吸附实验, 结果如图 4 a~c所示.此外, 每24 h计算不同Cd(II)初始浓度下, 当日小球藻相对于初始时刻的吸附率, 结果见图 4d.
图 4(Fig. 4)
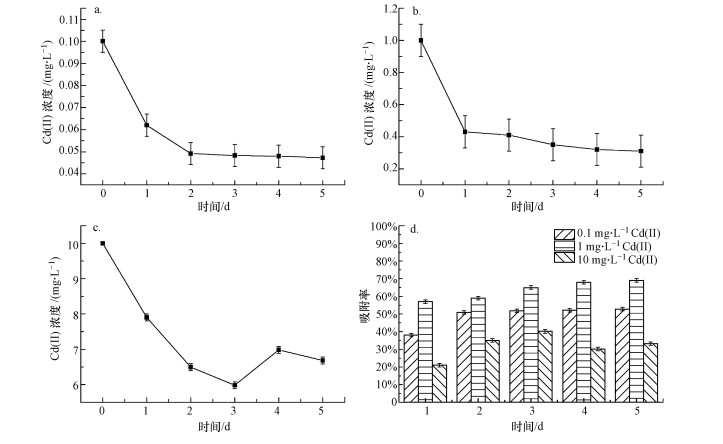 |
| 图 4 Cd(II)初始浓度对吸附性能的影响 Fig. 4Effect of Cd(II) concentration on adsorption performance |
由图可知, 在Cd(II)初始浓度不同的条件下, 溶液中的Cd(II)浓度却有着大致相同的变化趋势.培养液中Cd(II)在96 h后的去除率与其初始浓度有关.在高浓度Cd(II)(10 mg · L-1)条件下, 96 h时水中的Cd(II)浓度要比72 h时高, 即产生了负吸附.这是因为高浓度条件会抑制小球藻细胞的自身生长, 降低其细胞活性, 从而对Cd(II)的吸附也产生了影响.
由图 4d可知, 小球藻对Cd(II)的吸附效率随着Cd(II)初始浓度的增加呈现先上升后下降的趋势, 相同浓度下, 吸附率与时间呈正相关.当Cd(II)初始浓度为0.1 mg · L-1时, 24 h的吸附率增加到38.1%, 72 h的吸附率可以达到51.8%.Cd(II)初始浓度为1 mg · L-1时, 24 h的吸附率仅为57%, 72 h的吸附率达到65%.Cd(II)初始浓度为10 mg · L-1时, 24 h的吸附率仅为20.99%, 72 h的吸附率缓慢增长到33.17%.
综上可知, 小球藻细胞的吸附作用受溶液中Cd(II)初始浓度的影响较大, 这种影响主要是由溶液中Cd(II)的数量和小球藻表面的吸附电位决定的.当小球藻细胞密度为定值时, 藻体吸附金属离子的位点数量也是一定的.当Cd(II)初始浓度较低时, 其吸附位点不能得到充分利用.随着Cd(II)初始浓度的增加, 两者之间的碰撞几率也随之增加, 从而吸附效率有所提高.当Cd(II)初始浓度过高, 离子数量大于吸附位点数量, 吸附效率将会降低.
3.3 pH对吸附性能的影响pH值对小球藻细胞表面的吸附位点和重金属离子在溶液中的理化状态都会产生不同程度的影响.在不同的酸碱性条件下, 配制小球藻培养系统进行吸附实验.每日测定溶液中Ni(II)浓度, 测定方法按照2.2.5节中的小球藻细胞吸收重金属的检测方法, 并计算最终吸附效率, 结果如图 5所示.
图 5(Fig. 5)
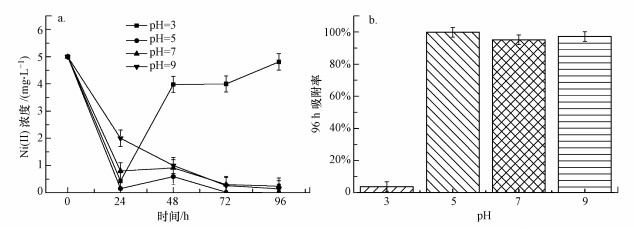 |
| 图 5 pH对Ni(II)吸附性能的影响 Fig. 5Effect of pH on Ni(II) adsorption |
第1天的几组实验中小球藻对Ni(II)都产生了不同程度的吸附作用.而第2天, 在pH=3的实验组中Ni(II)浓度开始升高, 这是因为被吸附的Ni(II)开始出现解吸现象, 而在其他pH条件下, 水中的Ni(II)浓度则是一直降低直至接近于0 mg · L-1.通过图中的结果可以看出, 在pH=5的环境条件下, 小球藻对Ni(II)的吸附效果最好.而当pH=3时, 酸性环境抑制了小球藻细胞的生命活性导致其生长较慢, 因而对水中的Ni(II)表现出较差的吸附效果, 这是由于酸性环境对藻细胞具有破坏作用(Lang et al.2008).
小球藻在中偏碱性环境(实验室要求pH=7.1)中可对Ni(II)产生抗性(Fernandes et al.1991).因此, 在pH=5条件下的吸附效果要比pH=7和pH=9条件下的吸附效果好.从化学的角度看, 当pH较低时, H3O+会占据小球藻细胞表面的吸附位点, 当pH值升高时, H3O+浓度开始降低, 吸附位点逐渐被带正电荷的重金属所占据, 因此, 其吸附能力增加(吕福荣等, 2003).
在酸碱性不同的条件下, 配制含Cr(VI)的小球藻培养系统, 并对水中的Cr浓度进行每日检测, 结果如图 6所示.由图 6a和6b可知, 水体中总Cr浓度在酸性环境条件下呈现先降低后升高的趋势, 在24 h时, 总铬浓度下降幅度最大, 而Cr(VI)浓度除了在第4天有轻微升高之外, 其余时间Cr(VI)浓度都是呈下降的状态.这是因为在低pH条件下, 小球藻细胞会因为H+较强的质子化作用而对金属阳离子产生斥力作用, 此时Cr(VI)能与藻体相互作用而被快速吸附(Jayakumar et al.2014).在中性条件下, 水体中总Cr浓度一直呈现下降的趋势, Cr(VI)浓度也一直在降低且下降幅度大于总Cr(图 6c).这是因为前24 h小球藻对水中的Cr元素进行吸附, 吸附与脱附之间逐渐达到平衡, 之后小球藻对Cr(VI)的价态会产生转化作用.在碱性条件下, 水体中Cr(VI)的价态转化基本不再发生, 而Cr元素浓度会出现略微下降的现象(图 6d).与酸性环境条件相比, 碱性溶液中的Cr会在OH-作用下被沉淀或被吸附.碱性条件下小球藻细胞因其较强的细胞活性而对Cr元素具有更高的去除效率(Gupta et al.2008).
图 6(Fig. 6)
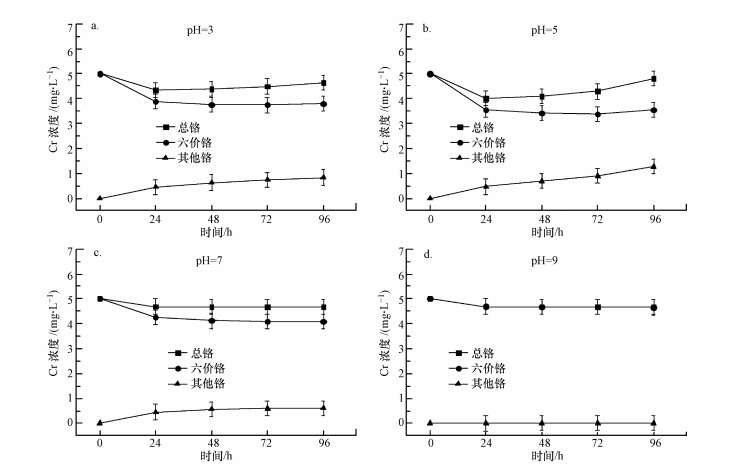 |
| 图 6 pH对Cr吸附性能的影响 Fig. 6Effect of pH on Cr adsorption |
在不同酸碱性条件下, 配制含Cd(II)的小球藻培养系统进行吸附实验, 每日测定水体中的Cd(II)浓度并计算最终吸附效率, 结果如图 7所示.由图可知, 当pH=5时, 小球藻对Cd(II)的吸附效率最高;之后当pH值增大时, Cd(II)的吸附效率却呈下降趋势;当pH=7时, 96 h后体系中的Cd(II)浓度从5 mg · L-1下降至1.13 mg · L-1;当pH=9溶液呈碱性时, 小球藻对Cd(II)的吸附效率最低, 96 h时的吸附效率为53.6%.
图 7(Fig. 7)
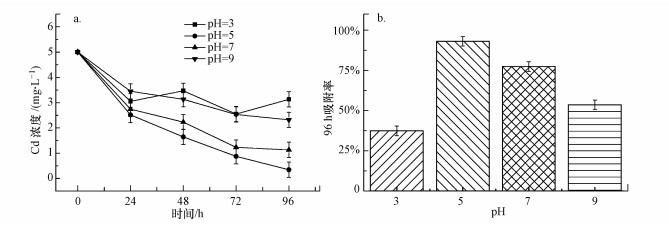 |
| 图 7 pH对Cd(II)吸附性能的影响 Fig. 7Effect of pH on Cd(II) adsorption |
由此看出, pH值对小球藻细胞的吸附效率具有显著的影响作用, 在酸性条件下, 其吸附效率随pH值升高而增加;高pH值下吸附效率随pH值的增加而减小.这是由于在低pH值下, 细胞壁配体与H3O+密切结合, 排斥力作用限制了藻细胞与Cd(II)的结合, 导致吸附量较低.pH值过高时, Cd(II)可能会被OH-包围, 或者与OH-生成沉淀, 这两种情况均会对藻体表面反应造成不利影响.
3.4 温度对吸附性能的影响温度会对小球藻的生理活性产生一定的影响, 同时, 吸附过程中会发生吸热或者放热反应.选取20、25、30 ℃作为温度梯度, 并按照2.2.5节中的方法在96 h后对培养液中的重金属离子浓度进行检测, 研究96 h的降解率变化, 结果如图 8所示.
图 8(Fig. 8)
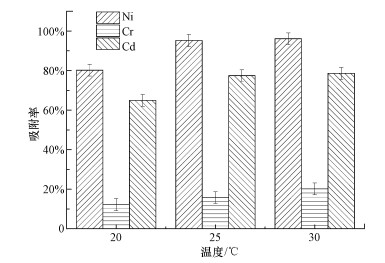 |
| 图 8 温度对吸附性能的影响 Fig. 8Effect of temperature on adsorption performance |
其他条件一定的情况下, 小球藻对重金属的吸附率随温度的升高而增大.对此, 原因可能有两种:一方面可能是在此温度范围内小球藻发生的是吸热反应, 温度升高, 小球藻对重金属吸附或转化效率也随之提高;另一方面可能是在20~30 ℃范围内小球藻的生长状态较好, 其体内各项活动都能够正常进行, 当温度升高时, 小球藻细胞生理活性增强可提高其对重金属离子的吸附与转化能力.
3.5 吸附过程主要作用官能团通过红外光谱对吸附过程中发挥重要作用的官能团进行鉴定分析, 图 9所示为小球藻细胞吸附3种重金属后及空白对照组的红外光谱图.将空白组与实验组进行对比发现, 每种金属的红外光谱图只是出现峰位置的偏移而浓度没有发生明显变化, 说明吸附过程中发挥作用的官能团是固定的.图中的吸收峰基团主要来源于脂类、糖类和蛋白质.
图 9(Fig. 9)
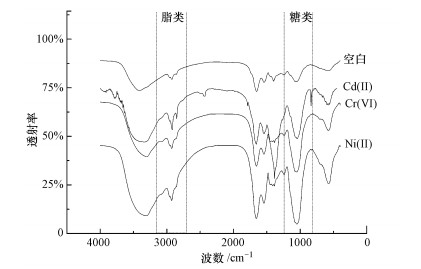 |
| 图 9 72 h后的红外光谱分析 Fig. 9FTIR spectrum analysis after 72 h |
通过对空白对照组的小球藻样品分析发现, 在1047 cm-1和1242 cm-1处的吸收峰是由来源于脂肪酸、糖类、蛋白质的C—O键的伸缩振动产生的.多糖中的C—OH基团在800~1100 cm-1之间产生了多个吸收峰.胺盐(—NH4+)在1430~1390 cm-1处产生了吸收峰, 1450 cm-1处的吸收峰是由C—OH或—CO—NH—伸缩振动引起的.1654 cm-1处的吸收峰是由蛋白质基团羰基(C=O)产生的.脂类基团甲基不对称伸缩振动及次甲基的反对称伸缩振动在2928 cm-1处产生了吸收峰.小球藻表面的羟基(—OH)在3340~3425 cm-1处产生了一些较宽较强的吸收峰(刘海静, 2013).磷酸基的存在可由指纹区的一些特征峰来证明.通过对比空白对照组的红外光谱图可知, 小球藻表面存在着较多种类的糖类、蛋白质, 而脂类物质含量相对较少.
吸附重金属后的红外光谱图的峰位和峰强度都发生了变化.位于1654 cm-1处的羰基峰在空白组的强度最大, 而吸附重金属离子后, 其峰强度不如1047 cm-1处的峰, 说明小球藻细胞表面的糖类含量有所增加而脂类含量却在下降.由图 9还可以看出, 小球藻细胞在吸附或转化Cr(VI)后, C—O基团峰和C=O基团峰都发生了偏移, 说明其在吸附过程中起到了较大作用.小球藻细胞吸附Ni(II)后, C=O基团峰发生了偏移, 而次甲基基团在2959.52 cm-1处出现了新的峰, 说明羰基在吸附过程中也扮演了重要角色.小球藻细胞在吸附Cd(II)前后, 其红外光谱图的峰位也发生了偏移.羟基基团从3374 cm-1经过3373 cm-1偏移了到3371 cm-1, 羰基基团从1653 cm-1偏移到了1644 cm-1, 胺基基团的波数从1548 cm-1到1546 cm-1.由此可见, 发生了较大峰变化的羟基、羧基和胺基在小球藻吸附Ni(II)、Cd(II)、Cr(VI)过程中都起到了较大作用.
4 结论(Conclusion)本文通过小球藻对Ni(II)、Cr(VI)、Cd(II)的吸附实验研究, 发现小球藻对Ni(II)的吸附能力最优, 对Cd(II)的吸附能力次之, 而对Cr(VI)不仅具有吸附能力, 还能将Cr(VI)转化为低价铬.当水体中藻细胞数量在规定的范围内时, 吸附效果受细胞数量的影响较小.小球藻细胞在中偏酸性(pH=5)、重金属浓度不超过5 mg · L-1的条件下具有很好的吸附转化能力, 在一定范围内, 升高温度对小球藻的吸附性能有较显著的提升效果.小球藻细胞对重金属离子的吸附及转化, 主要是糖类及蛋白质上的C—O、C=O、—NH—等基团发挥着作用, 而磷酸基团是通过络合作用对重金属离子进行吸附的.
参考文献
| Alam M A, Wan C, Zhao X, et al. 2015. Enhanced removal of Zn2+ or Cd2+ by the flocculating Chlorella vulgaris JSC-7[J]. Journal of Hazardous Materials, 289: 38-45. DOI:10.1016/j.jhazmat.2015.02.012 |
| Anastopoulos I, Kyzas G Z. 2015. Progress in batch biosorption of heavy metals onto algae[J]. Journal of Molecular Liquids, 209: 77-86. DOI:10.1016/j.molliq.2015.05.023 |
| Ar?ca M Y, Tüzün, Yal??n E, et al. 2005. Utilisation of native, heat and acid-treated microalgae Chlamydomonas reinhardtii preparations for biosorption of Cr (VI) ions[J]. Process Biochemistry, 40(7): 2351-2358. DOI:10.1016/j.procbio.2004.09.008 |
| Deng L, Zhu X, Wang X, et al. 2007. Biosorption of copper (Ⅱ) from aqueous solutions by green alga Cladophora fascicularis[J]. Biodegradation, 18(4): 393-402. DOI:10.1007/s10532-006-9074-6 |
| 方志青, 陈秋禹, 尹德良, 等. 2018. 三峡库区支流河口沉积物重金属分布特征及风险评价[J]. 环境科学, 39(6): 1-10. |
| Fernandes J C, Henriques F S. 1991. Biochemical, physiological, and structural effects of excess copper in plants[J]. The Botanical Review, 57(3): 246-273. DOI:10.1007/BF02858564 |
| Gómez-Jacinto V, García-Barrera T, Gómez-Ariza J L, et al. 2015. Elucidation of the defence mechanism in microalgae Chlorella sorokiniana under mercury exposure.Identification of Hg-phytochelatins[J]. Chemico-biological Interactions, 238: 82-90. DOI:10.1016/j.cbi.2015.06.013 |
| Gupta V K, Rastogi A. 2008. Biosorption of lead from aqueous solutions by green algae Spirogyra species:Kinetics and equilibrium studies[J]. Journal of Hazardous Materials, 152: 407-414. DOI:10.1016/j.jhazmat.2007.07.028 |
| 霍书豪, 陈玉碧, 刘宇鹏, 等. 2012. 添加沼液的BG11营养液微藻培养试验[J]. 农业工程学报, 28(8): 241-246. |
| Jayakumar R, Rajasimman M, Karthikeyan C. 2014. Sorption of hexavalent chromium from aqueous solution using marine green algae Halimeda gracilis:Optimization, equilibrium, kinetic, thermodynamic and desorption studies[J]. Journal of Environmental Chemical Engineering, 2(3): 1261-1274. DOI:10.1016/j.jece.2014.05.007 |
| Lamai C, Kruatrachue M, Pokethitiyook P, et al. 2005. Toxicity and accumulation of lead and cadmium in the filamentous green alga Cladophora fracta (O.F.Muller ex Vahl) Kutzing:A laboratory study[J]. Scienceasia, 31(2): 121-127. DOI:10.2306/scienceasia1513-1874.2005.31.121 |
| Li K, Li L, Hou H, et al. 2002. Study on toxicity of heavy metal ions to two species of marine unicellular algae[J]. Chinese Journal of Applied & Environmental Biology, (4): 395-398. |
| 刘海静.2013.基于红外光谱的螺旋藻品质分析及辐照特性研究[D].北京: 中国农业科学院.82 |
| 刘志泉.2012.水中铜绿微囊藻与硝基苯复合污染的特征和作用机制[D].哈尔滨: 哈尔滨工业大学.90-92 |
| 吕福荣, 杨海波, 李英敏, 等. 2003. 小球藻吸附镍离子的研究[J]. 生物技术, 13(3): 32-34. |
| 时春景, 李红霞, 张言, 等. 2017. 永定河上覆水、间隙水和沉积物中重金属的分布特征[J]. 环境化学, 36(1): 48-61. |
| Vassilev S V, Vassileva C G. 2016. Composition, properties and challenges of algae biomass for biofuel application:An overview[J]. Fuel, 181: 1-33. DOI:10.1016/j.fuel.2016.04.106 |
| 汪远丽, 曲克明, 单宝田, 等. 2012. 重金属在小球藻-菲律宾蛤仔食物链上的传递与累积[J]. 渔业科学进展, 33(1): 79-85. |
| 王执伟, 刘冬梅, 张文娟, 等. 2016. 溴酸盐对水生生物的急性毒性效应[J]. 环境科学, 37(2): 756-764. |
| 吴海锁, 张洪玲, 张爱茜, 等. 2004. 小球藻吸附重金属离子的试验研究[J]. 环境化学, 23(2): 173-177. |
| Yang L, Chen J P. 2008. Biosorption of hexavalent chromium onto raw and chemically modified Sargassum sp.[J]. Bioresource Technology, 99(2): 297-307. DOI:10.1016/j.biortech.2006.12.021 |
| 于芳, 李红艺, 刘廷凤, 等. 2015. 藻类在水处理中的资源化利用现状[J]. 广州化工, 43(12): 19-21. |
| 张清华, 韦永著, 曹建华, 等. 2018. 柳江流域饮用水源地重金属污染与健康风险评价[J]. 环境科学, 39(4): 1-14. |
| 张永江, 田川, 邓茂, 等. 2017. 典型锰矿开采冶炼区域重金属分布及潜在风险评价[J]. 环境影响评价, 39(4): 66-70. |
