 , 朱健1,3
, 朱健1,3
 , 王玉竹1, 谭淼1, 王沛颖1, 姚璐1, 王平1,3
, 王玉竹1, 谭淼1, 王沛颖1, 姚璐1, 王平1,3

1. 中南林业科技大学环境科学与工程学院, 长沙 410004;
2. 湖南恒凯环保科技投资有限公司, 长沙 410000;
3. 稻米品质安全控制湖南省工程实验室, 长沙 410004
收稿日期: 2019-12-06; 修回日期: 2020-02-12; 录用日期: 2020-02-12
基金项目: 国家重点研发计划(No.2016YFD0800805-4);国家自然科学基金(No.21707169);湖南省重点研发计划(No.2019SK2191,2017SK2273,2016SK2030);湖南省高校创新平台开放基金(No.19K107);湖南省教育厅科学研究一般项目(No.19C1900)
作者简介: 林晓敏(1994-), 女, E-mail:1193913244@qq.com
通讯作者(责任作者): 朱健(1983—), 男, 副教授, 硕士生导师, 主要从事土水污染防治与生物修复研究. E-mail:zhujian198312@163.com
王平(1964—), 男, 教授, 博士生导师, 主要从事环境生物技术与环境分子生物学研究. E-mail:csfuwp@163.com
摘要:农田土壤镉(Cd)污染日益加剧,严重威胁着农村生态安全与居民身体健康,而微生物修复被认为是一种行之有效的Cd污染土壤原位修复方法.为了给Cd污染土壤微生物修复提供功能菌株,采取平板划线从Cd污染土壤中分离纯化得到一株高耐性耐Cd菌株B-6,通过生理生化试验及16S rDNA对其进行了鉴定,并研究了菌株对Cd2+的吸收转运特性.经鉴定,高耐性耐Cd菌株B-6为伯克霍尔德菌属(Burkholderia cepacia),其对Cd2+的耐受阈值为850 mg·L-1.通过单因素优化培养发现,菌株B-6对Cd2+的吸收量随着培养温度的增加先增大后减小;随着培养液初始pH值的增大先增大后减小,同时发现菌株B-6能够有效调控系统的终点pH值;随着转速的增大先增大后减小.当初始浓度为400 mg·L-1,培养温度为30℃,培养液初始pH值为5.0,转速为120 r·min-1,培养时间为72 h时,菌株B-6对Cd2+的吸收效果最佳,达到51 mg·g-1.通过分析亚细胞组分Cd2+含量发现,Cd2+被菌体吸收后主要赋存于细胞壁.
关键词:耐Cd菌株分离鉴定吸收转运
Isolation and characterization of a cadmium-resistant bacterial strain (Burkholderia cepacia) and its cadmium-absorption and transport properties
LIN Xiaomin1,2,3
 , ZHU Jian1,3
, ZHU Jian1,3
 , WANG Yuzhu1, TAN Miao1, WANG Peiying1, YAO Lu1, WANG Ping1,3
, WANG Yuzhu1, TAN Miao1, WANG Peiying1, YAO Lu1, WANG Ping1,3

1. College of Environmental Science and Engineering, Central South University of Forestry and Technology, Changsha 410004;
2. Hunan Hengkai Environmental Protection Technology Investment Co., Ltd, Changsha 410000;
3. Hunan Engineering Laboratory for Control of Rice Quality and Safety, Changsha 410004
Received 6 December 2019; received in revised from 12 February 2020; accepted 12 February 2020
Abstract: Cadmium pollution in farmland soil is increasing and seriously threatens rural ecological security and residents' health. Microbial remediation is considered to be an effective method for in situ remediation of the cadmium contaminated soils. In order for bioremediation of the cadmium-contaminated soil, a highly cadmium-resistant bacterial strain was isolated and purified from the cadmium-contaminated soil by physiological, biochemical tests and 16S rDNA analysis. The cadmium-absorption and transport properties of the bacterial strain were characterized. The highly cadmium-resistant strain was identified as Burkholderia cepacia B-6 and its tolerance threshold to cadmium was 850 mg·L-1. Through the single-factor optimization, it was found that the cadmium uptake by the strain B-6 significantly increased first and then decreased with the increase of cultivation temperature. As the initial pH value of the culture solution increased, the pH of the culture system first increased, then decreased, and the strain B-6 could effectively regulate the end-point pH of the culture. With the increase of the flask-shaking speed, the cadmium absorption of the strain B-6 also first increased and then decreased. When the initial concentration of the cadmium in the culture solution was 400 mg·L-1, the incubation temperature was 30℃, the initial pH was 5.0, the rotating speed was 120 r·min-1, and the incubation time was 72 h, the absorption capacity of Cd2+ by the strain B-6 obtained the maximum at 51 mg·g-1. The analysis of Cd2+ content distribution in the cell demonstrated that Cd2+ mainly distributed in the cell wall after it was absorbed by the strain B-6. Clearly, the burkholderia cepacia B-6 is an excellent candidate bacterial strain for microbial remediation of the cadmium-contaminated soil.
Keywords: Cd resistant strainisolationcharacterizationabsorptiontransport
1 引言(Introduction)近年来, 随着工矿业的快速发展和农药化肥的广泛使用, 大量重金属进入生态系统, 造成了严重的重金属污染, 尤其是镉(Cd)污染(Oyetibo et al., 2015; 李明亮等, 2016; 赖星等, 2019), 严重威胁着生态安全和居民身体健康(Yang et al., 2016; Ouali et al, 2018).目前的水体Cd污染治理方法有化学沉淀法、膜分离法、离子交换法、微生物修复等, 其中, 微生物修复因具有效率高、周期短、能耗低、无二次污染等优势而得到普遍认可和广泛应用(Saher et al., 2016; Wu et al., 2016).微生物修复是利用微生物(特别是藻类、真菌、细菌)本身的化学结构及成分特性, 将Cd2+吸附到表面, 再通过细胞膜将其运输到体内积累, 从而达到去除的目的(张长平等, 2016).已有研究表明, 细菌(魏蓝等, 2016)、真菌(喻永泉等, 2017)对Cd2+具有较高的去除能力(徐淑霞等, 2017).目前已发现的耐Cd菌株有Arthrobacter(王京文等, 2015)、大肠杆菌(黄军等, 2016)、蜡状芽孢杆菌(李辉等, 2010)等.微生物对重金属的去除方式包括生物吸附和生物积累(刘爱民, 2005).生物吸附主要是利用细胞壁表面的羟基、羧基等基团与Cd2+配位和络合, 但不同的菌株其吸附Cd2+的能力也各不相同.沈秋悦等(2016)从土壤筛选了一株耐Cd2+浓度为50 mg · L-1的芽孢杆菌, 通过Langumir模型拟合得到的最大吸附容量为1.83 mg · g-1.邱云云等(2011)筛选了一株嗜麦芽窄食单胞菌并作为吸附剂吸附Cd2+, 发现其对Cd2+的吸附量为6.86 mg · g-1.李倩等(2019)从活性污泥中筛选了一株吸附能力较强的蜡样芽孢杆菌(Bacillus cereus), 其对Cd2+的吸附量为205 mg · g-1.已知的研究中多针对菌体对Cd2+的生物吸附, 而关于菌株对Cd2+的生物积累及其对Cd2+吸收转运特性的研究较少.生物积累简称吸收, 包括表面吸附及细胞对金属离子的吸收(Lin et al., 2012), 去除效果比单纯的生物吸附更好, 其可以利用活细胞本身来积累金属离子.生物积累与生物吸附相比, 除了表面吸附之外, 其细胞对金属离子的吸收随着细胞的生存代谢保留在细胞内, 金属离子掺入液泡和其他细胞内部位之前与细胞内蛋白质或螯合物结合, 而这些过程通常是不可逆转的, 不用担心重金属的二次污染(Mishra et al., 2013).因此, 筛选出一株耐性高、适应能力强的菌株, 研究其吸收能力及转运特性对于耐Cd菌株在Cd污染土壤修复中的应用具有重要意义.
伯克氏菌是一种植物促生菌, 可定植于植物根部和根际, 是一种很好的生物防治和生物降解试剂(杨森, 2006; 陆仲烟等, 2014).目前的研究多集中在伯克氏菌与植物联合修复重金属污染土壤方面.Dourado等(2013)证明了接种耐Cd伯克氏菌能促进番茄生长并降低根部对Cd2+的吸收.张亚经等(2017)研究了在水培条件下伯克氏菌D54与生态型东南景天(HE)和非超积累生态型东南景天(NHE)对Cd2+的吸收和富集.近年来对伯克氏菌的研究主要集中在微生物-植物协同修复方面, 尚未见有关伯克氏菌的生物积累和转运特性研究.因此, 本文采用平板划线法从Cd污染土壤中筛选得到一株高效耐Cd菌株, 纯化鉴定后确定为伯克氏菌, 研究培养条件对菌株吸收Cd2+的影响及Cd2+在菌株体内的赋存、转运特性, 以期为Cd污染土壤的微生物修复提供必要的技术支持和理论依据.
2 材料及方法(Materials and methods)2.1 试验材料2.1.1 土壤土壤样品采自湖南省长沙市北山试验基地附近(采样深度0~20 cm), 通过五点取样法收集土壤.经检测, 该土壤呈酸性, Cd2+含量为1.6 mg · kg-1, 基本理化性质见表 1.
表 1(Table 1)
| 表 1 供试土壤的基本理化性质 Table 1 Basic physical and chemical properties of the soil tested | ||||||||||
表 1 供试土壤的基本理化性质 Table 1 Basic physical and chemical properties of the soil tested
| ||||||||||
2.1.2 培养基牛肉膏蛋白胨固体和液体培养基:牛肉膏5 g、氯化钠5 g、蛋白胨10 g、琼脂20 g(固体培养基添加), 溶于1 L水中,121 ℃灭菌20 min后使用.
2.2 试验方法2.2.1 耐Cd菌株的分离、纯化将10 g土样加入到90 mL无菌水中, 设置摇床转速为150 r · min-1, 温度为28 ℃, 振荡45 min后静置30 min取上清液.采用稀释涂布法分别取100 μL上清液均匀涂布在Cd2+浓度为50 mg · L-1的牛肉膏蛋白胨固体培养基平板上, 于28 ℃恒温倒置培养2~3 d观察其生长状况, 每个浓度设置3个平行.将平板上形态各异的单菌落挑选出接种于Cd2+浓度为100 mg · L-1的牛肉膏蛋白胨固体培养基平板上并划线, 以100 mg · L-1为增量逐次递增培养基中Cd2+浓度, 以确定各菌株的耐受阈值.将分离出来的耐Cd菌株进行多次划线纯化, 保存备用.
2.2.2 菌悬液菌条件下, 使用接种环从固体培养基中挑选纯化好的菌株接种至液体培养基, 120 r · min-1、30 ℃的条件下培养20 h, 5000 r · min-1条件下离心15 min后弃去上清液, 无菌水洗涤菌体, 离心, 重复洗涤3次, 收集菌体制成菌悬液, 于4 ℃冰箱保存备用.
2.2.3 耐Cd菌株的优选将分离、纯化获得的3株耐Cd菌株制成菌悬液, 各取1 mL菌悬液分别接种于Cd2+浓度为100 mg · L-1的牛肉膏蛋白胨液体培养基中, 于30 ℃、120 r · min-1条件下培养24 h, 设置3个平行, 以接种1 mL无菌水为空白对照.培养完成后, 将菌悬液于5000 r · min-1转速下离心15 min, 取上清液测定Cd2+浓度, 并计算各菌株对Cd2+的去除率, 通过吸收率的大小对耐Cd菌株进行优选, 得到对Cd耐性高、吸收能力强的优选菌株.
2.2.4 耐Cd菌株的鉴定① 耐Cd菌株的形态观察及生理生化特性分析:将纯化后的优选菌株接种于牛肉膏蛋白胨液体培养基内, 于28 ℃、120 r · min-1条件下恒温培养24 h, 取100 μL菌液稀释1×10-6倍, 平板涂布.培养24 h后观察其形态, 进行革兰氏染色和生理生化特性分析.依据《伯杰氏细菌鉴定手册》(布坎南等, 1984)对菌株进行初步鉴定.
② 16S rDNA序列分析:采用Ezup柱式细菌基因组DNA抽提试剂盒(购自生工生物工程股份有限公司)提取优选菌株的总基因组DNA, 扩增优选菌株的16S rDNA, 设计引物为27F:AGTTTGA TCMTGGCTCAG和1492R:GGTTACCTTGTTACG ACTT. PCR反应体系为0.5 μL Template、2.5 μL 10× Buffer、1 μL dNTP、0.2 μL酶、0.5 μL F、0.5 μL R, 总反应体系为25 μL. PCR条件为:94 ℃预变性4 min;94 ℃变性45 s, 55 ℃退火45 s, 72 ℃延伸1 min, 共30个循环;72 ℃修复延伸10 min, 4 ℃终止反应.回收PCR扩增产物, 交由生工生物工程公司完成测序, 将测序结果在NCBI上进行BLAST分析, 并利用MEGA 5.0构建系统发育树.
2.2.5 耐Cd菌株Cd胁迫生长响应曲线取1 mL优选菌株菌液接种于Cd2+浓度分别为0、100、200、300、400、500、600、700、800、900、1000 mg · L-1的液体培养基中, 于30 ℃、120 r · min-1条件下恒温培养, 设置3个平行.分别于6、12、18、24、30、36、42 h时取样测定OD600, 根据测定结果绘制Cd胁迫生长响应曲线.
2.2.6 培养条件对耐Cd菌株吸收Cd2+的影响① 温度的影响:按照1%(V/V)接种量向Cd2+浓度为100 mg · L-1的液体培养基中接种优选菌株, 用NaOH和HCl调节培养体系初始pH值为7.0, 设置摇床转速为120 r · min-1, 分别于20、25、30、35、40 ℃下恒温培养48 h, 测定菌液光密度值OD600;另取部分菌液, 离心分离, 测定上清液Cd2+浓度和湿菌体质量, 计算菌体对Cd2+的吸收量.
② 转速的影响:按照1%(V/V)接种量向Cd2+浓度为100 mg · L-1的液体培养基中接种优选菌株, 用NaOH和HCl调节培养体系初始pH值为7.0, 将摇床转速分别设置为90、120、150、180、210 r · min-1, 于30 ℃下恒温培养48 h, 测定菌液光密度值OD600;另取部分菌液, 离心分离, 测定上清液Cd2+浓度和湿菌体质量量, 计算菌体对Cd2+的吸收量.
③ 初始pH值的影响:按照1%(V/V)接种量向Cd2+浓度为100 mg · L-1的液体培养基中接种优选菌株, 用NaOH和HCl调节培养体系初始pH值分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0, 设置摇床转速为120 r · min-1, 于30 ℃下恒温培养48 h, 每组pH均单独设置空白, 测定菌液光密度值OD600, 同时测定培养后pH值;另取部分菌液, 离心分离, 测定上清液Cd2+离子浓度和湿菌体质量, 计算菌体对Cd2+的吸收量.
④ 培养时间的影响:按照1%(V/V)接种量向Cd2+浓度为100 mg · L-1的液体培养基中接种优选菌株, 用NaOH和HCl调节培养体系初始pH值为5.0, 设置摇床转速为120 r · min-1, 于30 ℃下分别恒温培养24、48、72、96、120、144、168 h, 测定菌液光密度值OD600; 另取部分菌液, 离心分离, 测定上清液Cd2+浓度和湿菌体质量, 计算菌体对Cd2+的吸收量.
⑤ Cd2+初始浓度的影响:按照1%(V/V)接种量向Cd2+浓度分别为50、100、200、400、600 mg · L-1的液体培养基中接种优选菌株, 用NaOH和HCl调节培养体系初始pH值为5.0, 设置摇床转速为120 r · min-1, 于30 ℃下培养72 h, 测定菌液光密度值OD600;另取部分菌液, 离心分离, 测定上清液Cd2+浓度和湿菌体质量, 计算菌体对Cd2+的吸收量.
2.2.7 亚细胞组分分离方法采用差速离心法分离不同的细胞组分, 研究不同培养时间(12、24、48、72、96 h)和不同Cd胁迫浓度(20、50、100、300、400、600、700 mg · L-1)对优选菌株吸收转运Cd2+的影响.具体步骤为:取湿菌体0.5 g, 加入20 mL提取液(0.25 mol · L-1蔗糖+50 mmol · L-1Tris-HCl缓冲液(pH=7.5)+1 mmol · L-1二硫赤鲜糖醇), 研磨匀浆, 匀浆液在冷冻离心机中2000×g下离心80 s, 沉淀为细胞壁组分(F1);上清液在10000×g下离心30 min, 沉淀为细胞器组分(F2);上清液为可溶组分(F3), 包括细胞质、液泡内大分子及无机离子及核糖体.全部操作在4 ℃下进行, 各组分亚细胞中的Cd2+含量均消解以后进行测定.
2.3 分析方法用Thermo ICE3500 AA型火焰原子吸收分光光度法测定溶液中Cd2+浓度, 用UV2600型的紫外-可见光分光光度法测定菌液光密度值OD600.
2.4 数据处理菌体对Cd2+的吸收量(Q)与吸收率(R)的计算公式分别为:
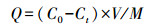 | (1) |
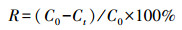 | (2) |
3 结果与讨论(Results and discussion)3.1 耐Cd菌株的优选本研究分离纯化得到12株耐Cd菌, 分别标记为B-2、B-3、B-5、B-6、B-9、B-10、B-11、B-12、B-14、B-16、B-17、B-20, 各菌株在不同浓度Cd2+胁迫下的生长情况见表 2.从表中可以看出, B-6、B-14、B-20 3株菌对Cd2+具有高耐受性(培养基Cd2+浓度为850 mg · L-1).为了进一步优选菌株, 通过摇床培养试验考察了上述3株耐Cd菌对Cd2+的吸收效率, 结果见图 1.由图可知, B-6、B-14、B-20对Cd2+的吸收率分别为40.1%、26.6%、7.3%, B-6对Cd2+的去除效率最高, 最终确定B-6为优选菌株.
图 1(Fig. 1)
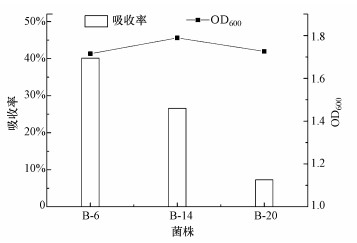 |
| 图 1 优选菌株的生长情况及其对Cd2+的吸收率 Fig. 1Growth of selected strains and their bioaccumulation rates for cadmium |
表 2(Table 2)
| 表 2 菌株在不同浓度Cd2+胁迫下的生长情况 Table 2 Growth of highly effective cadmium tolerant strains at different cadmium concentrations | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2 菌株在不同浓度Cd2+胁迫下的生长情况 Table 2 Growth of highly effective cadmium tolerant strains at different cadmium concentrations
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.2 耐Cd菌株B-6的鉴定3.2.1 菌株B-6的形态特征优化菌株B-6在无Cd2+的固体培养基上呈淡黄色, 在有Cd2+胁迫情况下黄色更浅(图 2).菌体呈杆状, 不透明, 菌丝光滑, 易挑起.革兰氏染色结果为阴性(图 3).
图 2(Fig. 2)
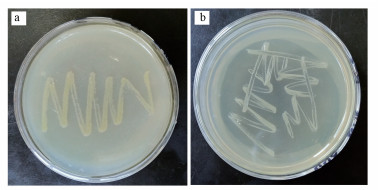 |
| 图 2 耐Cd菌株B-6的菌落形态 (a.不添加Cd2+, b.加Cd2+) Fig. 2Morphology of cadmium tolerant strain B-6 on solid medium (a.without Cd2+, b.with Cd2+) |
图 3(Fig. 3)
 |
| 图 3 耐Cd菌株B-6的微观形态(1000×) Fig. 3Micromorphology of the cadmium tolerant strain B-6 (1000×) |
3.2.2 菌株B-6生理生化鉴定由菌株生理生化试验结果可知(表 3), 革兰氏染色、淀粉水解、明胶水解、吲哚试验结果呈阴性, 柠檬酸盐利用、V-P试验结果呈阳性, 葡萄糖氧化发酵试验结果为发酵型.
表 3(Table 3)
| 表 3 耐Cd菌株B-6生理生化试验结果 Table 3 Physiological and biochemical results of the cadmium tolerant strain B-6 | ||||||||||||||||||
表 3 耐Cd菌株B-6生理生化试验结果 Table 3 Physiological and biochemical results of the cadmium tolerant strain B-6
| ||||||||||||||||||
3.2.3 菌株B-6 16S rDNA鉴定菌株测序结果通过NCBI(NCBI登陆号为MK418965)进行BLAST比对, 同时参考生理生化结果表明, B-6菌株遗传距离与伯克霍尔德菌最近, 具有99%同源性, 为同一属;其次是大肠杆菌与其拥有同一进化系, 且伯克霍尔德菌进化高于大肠杆菌, 与同样具有Cd抗性的枯草芽孢杆菌进化距离较远, 非同一祖先进化而来.由此系统进化树证明测序所得菌种为伯克霍尔德菌属.结合生理生化试验结果, 发现其与洋葱伯克霍尔德菌最为接近, 构建的系统发育树见图 4.
图 4(Fig. 4)
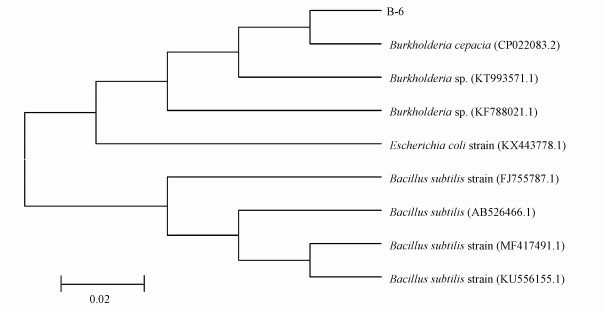 |
| 图 4 菌株B-6的系统发育树 Fig. 4Phylogenetic tree of the strain B-6 and other bacterial strains |
3.3 耐Cd菌株B-6 Cd2+胁迫下的生长曲线不同初始浓度Cd2+胁迫下耐Cd菌株B-6的生长情况如图 5所示.从图中可以看出, 当Cd2+初始浓度小于300 mg · L-1时, 菌株B-6生长基本不受影响, 超过300 mg · L-1后菌株生长受到明显抑制, 超过700 mg · L-1后菌株生长基本停止.综合平板实验观察可知, 菌株在液体培养基中的耐受阈值为700 mg · L-1, 固体培养基中的耐受阈值为850 mg · L-1.近年来, 利用微生物修复水体中重金属的研究很多, 但不同的微生物往往具有不同的特性.如陈雪姣等(2016)从污染水域筛选获得了一株耐性为100 mg · L-1的嗜碱性假单胞菌.许钦坤等(2015)从污染土壤中筛选出一株高度抗镉蜡状芽孢杆菌, 对Cd2+的耐受浓度高达600 mg · L-1.沈秋悦等(2016)从镉污染土地筛选了一株芽孢杆菌, 其最大Cd2+耐受浓度为50 mg · L-1.与其他菌株相比, B-6对Cd2+的适应能力更强.
图 5(Fig. 5)
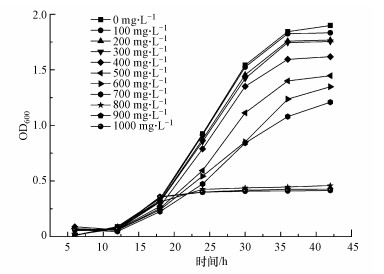 |
| 图 5 初始浓度对菌株生长(OD600)的影响 Fig. 5Effect of initial cadmium concentration on the growth of the strain B-6 |
3.4 培养条件对耐Cd菌株B-6吸收Cd2+的影响3.4.1 温度的影响温度对耐Cd菌株B-6生长及Cd2+吸收的影响如图 6a所示.由图可知, 随着温度的不断升高, 耐Cd菌株的OD600值不断升高, 在30 ℃时达到峰值, 而后略有下降.当培养温度为20~30 ℃时, 耐Cd菌株B-6存在明显的对数生长期, 超过30 ℃即进入生长停滞期.而耐Cd菌株B-6对Cd2+的吸收量则随温度的升高而先上升后下降, 在30 ℃时达到最大值(16.6 mg · g-1).温度对耐Cd菌株B-6吸收Cd2+的影响主要是通过影响耐Cd菌株的生长代谢实现的.有研究表明(徐淑霞等, 2017), 温度过高会破坏细胞结构, 致使蛋白质失活, 温度过低则会降低酶活性, 导致新陈代谢能力减弱.在菌体适应范围内, 温度的升高会促进菌体的代谢, 菌体吸收能力增强;一旦超过范围, 细胞壁将产生变形, 吸附位点会减少(喻永泉等, 2017).因此, 细菌吸收Cd2+的最佳温度为30 ℃.
图 6(Fig. 6)
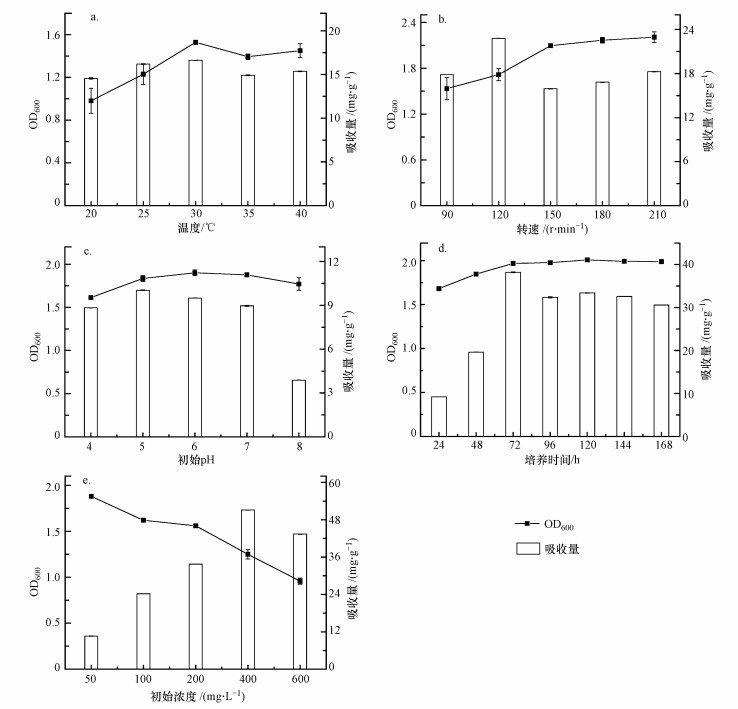 |
| 图 6 温度(a)、转速(b)、初始pH(c)、培养时间(d)和初始浓度(e)对耐Cd菌株B-6吸收Cd的影响 Fig. 6Effect of culture temperature(a), rotational speed(b), initial cultureal pH(c), incubation time(d) and initial concentration(e) on cadmium bioaccumulation by the strain B-6 |
3.4.2 转速的影响转速对耐Cd菌株B-6生长及Cd2+吸收的影响如图 6b所示.由图可知, 随着转速的不断提升, 菌株的OD600值不断升高, 而对Cd2+的吸收量则是先上升后下降, 在转速120 r · min-1时达到最大值(22.78 mg · g-1).在120~180 r · min-1范围内菌株的生物量不断增大, 而Cd2+吸收量不断下降, 表明120 r · min-1是菌株B-6对Cd2+吸收的零界点, 超过此转速不利于菌体对Cd2+的吸收.这是因为伯克氏菌是一种好氧菌, 氧气越充足, 生长越好, 转速的提高增大了菌株与Cd2+的接触频率, 利于菌株对Cd2+的吸收, 但过分剧烈的机械搅拌反而产生相反的作用力, 不利于Cd2+吸收(黄飞, 2013).因此, 菌株B-6吸收Cd2+的最佳转速为120 r · min-1.
3.4.3 初始pH值的影响初始pH对耐Cd菌株B-6生长及Cd2+吸收的影响如图 6c所示.由图可知, 随着pH的不断升高, OD600先上升后下降, 但变化不明显.耐Cd菌株B-6表现出对pH极强的适应能力, 一般的菌株很难适应如此广跨度的初始pH值.例如, 李辉等(2010)筛选出的一株蜡状芽孢杆菌只能在pH=6.5~7.5之间正常生长.菌株对Cd2+的吸收量则是先上升后下降, 在pH=5.0时达到最大值(10.03 mg · g-1).当培养体系初始pH值在4.0~8.0之间发生变化时, 体系的终点pH值都能稳定在碱性区间内(图 7), 说明B-6菌株对培养体系的酸碱环境具有很强的缓冲和适应能力, 能够通过自身的生长代谢对体系的pH值进行调控.原因可能如下:①B-6菌株的生长代谢过程能够充分利用体系的质子(H+)进行还原反应; ②B-6菌株表面存在大量的吸附位点, 能够与体系中的H+进行离子交换吸附.上述两方面的共同作用致使体系终点pH值能在培养结束时稳定在碱性区间(Oyetibo et al., 2013; 李明亮等, 2016).菌株对Cd2+的吸收量与细菌的生长有关, pH会改变细胞的通透性从而影响菌株生长(周赓, 2016).除此之外, 菌株对Cd2+的吸收量还与酶活性、细胞表面的结合位点、体系中的Cd2+含量有关.在pH=4.0~5.0范围内, 菌株对Cd2+吸收量的不断增大, 这可能是因为体系呈酸性时H+与Cd2+存在竞争机制, pH升高使得竞争机制弱化;而随着pH继续增大, Cd2+开始沉淀, 可转运的Cd2+浓度降低.这与Huang等(2013)的研究一致:pH>5.0以后, 随着pH的增大容易形成不易吸收的Cd(OH)2, 从而降低Cd2+吸收能力.在本研究中还发现, 菌株B-6对酸碱的适应能力极好, 在pH=4.0~8.0范围内均能生长良好.因此, 菌株吸收的最佳pH为5.0.
图 7(Fig. 7)
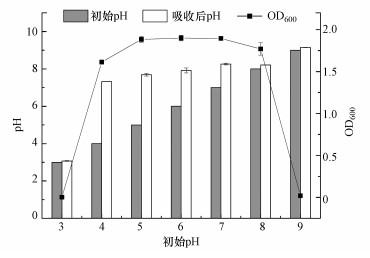 |
| 图 7 初始pH对吸收后pH的影响 Fig. 7Effect of initial pH on the pH changes of the B-6 strain culture system |
3.4.4 培养时间的影响培养时间对耐Cd菌株B-6生长及Cd2+吸收的影响结果如图 6d所示.由图可知, 随着培养时间的延长, 耐Cd菌株B-6的OD600不断增大, 在120 h时达到最大值(2.008), 之后趋于稳定, 对Cd2+的吸收量则呈先上升后下降的变化趋势.培养72 h后整个吸收过程基本完成, 吸收量达到最大值(38.1 mg · g-1), 而菌体对Cd2+的静态吸附一般在3 h内就能完成, 说明菌株对Cd2+的吸收需要更长的时间, 原因可能是菌株的吸收与其生长有关(Choi et al., 2009).研究表明, 菌株的吸收存在主动运输和被动运输两种方式(何环宇, 2017), 在菌株生长过程中细胞通过这两种方式转运Cd2+.反应初期由于细胞内外浓度差的存在, 细菌在生长过程中不断向细胞内转运Cd2+;随之细胞进入稳定期, 稳定期的细胞具有较高的代谢活性, 利于结合金属并有足够的能量用于运输Cd2+进入胞内(刘爱民, 2005);随着营养物质的消耗, 细菌主动运输能力减弱, 细胞之间存在对营养物质的竞争, 部分细胞衰亡失去转运能力, 同时被动运输会将细胞内的Cd2+送出.由此可知, 细菌吸收的最佳培养时间为72 h.
3.4.5 初始浓度的影响初始浓度对耐Cd菌株B-6生长及Cd2+吸收的影响结果如图 6e所示.由图可知, 随着初始浓度的不断增大, 耐Cd菌株的OD600显著降低.优化后, 在相同初始浓度下(100 mg · L-1)Cd2+的吸收量与之前相比有所提升.耐Cd菌株B-6对Cd2+的吸收量则随着初始浓度的升高呈先上升后下降的趋势, 在400 mg · L-1时达到最大值(51 mg · g-1).对于培养中的菌株而言, 初始浓度会同时影响其吸收量和生长状态.随着初始浓度的增加, 系统中Cd2+基数变大, 与吸附位点碰撞的机会变多, 细胞也在不断地吸收和积累Cd2+, 因此, 吸收量不断增大.但在系统浓度大于400 mg · L-1时, 吸收量出现了下降, 这可能与菌体的外排作用有关.刘爱民(2005)的研究发现, 外排对于控制细胞内重金属离子浓度起着至关重要的作用, 菌体对高浓度Cd2+有外排作用.另外, 高浓度重金属的毒害作用可能也是导致吸收量降低的原因之一(黄飞, 2013).综上, 菌株B-6在初始浓度为400 mg · L-1时吸收能力最佳.
经过单因素优化试验发现, 当初始浓度为400 mg · L-1, 培养温度为30 ℃, 转速为120 r · min-1, 培养时间为72 h, pH=5.0时, 菌株对Cd2+的吸收量达到最大值(51 mg · g-1).
3.5 亚细胞组分Cd2+含量分析3.5.1 培养时间对亚细胞Cd2+分布的影响培养时间对亚细胞各组分累积Cd2+的影响结果见图 8a, 随着时间的增加, 细菌对Cd2+的吸收量不断增大, 亚细胞各组分对Cd2+的积累量增多, 且细胞壁的Cd2+积累速率增长最快.细胞壁的Cd2+积累量随着时间的推移先上升后下降, 这与Lin等(2012)的研究结果一致.细胞在72 h时累积的Cd2+最多, 而后降低, 这可能是因为经过了稳定期的细胞进入了衰亡期, 其Cd2+积累能力开始降低.由图 8b分析可知, 在培养初期(12 h), 细胞壁和细胞器中Cd2+占比相近, 均为47%左右; 随着培养时间的延长, 细胞壁中Cd2+所占比例迅速增大, 并且保持相对稳定, 由12 h时的47%增加到96 h时的80%, 而细胞器中Cd2+占比降低, 由开始的47%降低到了15%左右.
图 8(Fig. 8)
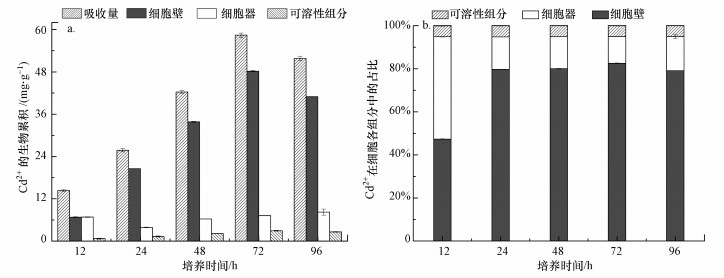 |
| 图 8 培养时间对菌株亚细胞组分累积Cd2+的影响(a)及Cd2+在菌株亚细胞组分中分配的影响(b) Fig. 8Effect of culture time on the accumulation of Cd2+(a) and distribution of Cd2+(b) in the subcellular fractions of the strain B-6 |
3.5.2 初始浓度对亚细胞Cd2+分布的影响初始浓度对亚细胞各组分积累Cd2+的影响结果见图 9a.由图可知, 随着Cd2+初始浓度的增大, Cd2+吸收量与亚细胞各组分积累Cd2+的量均呈先增大后减小的趋势, 在400 mg · L-1时吸收量达到最大值.亚细胞各组分Cd2+占比与初始浓度的关系见图 9b.由图可知, 在初始浓度较低时细胞器中Cd2+占比高于细胞壁;随着初始浓度的增大, 细胞壁中Cd2+占比先增大后保持稳定, 细胞器中Cd2+占比由开始的61%到最后降至7%左右;可溶性组分中Cd2+占比前后变化不大, 基本稳定在5%左右.细胞壁中Cd2+占比的提升可能与细胞壁的解毒作用有关, 随着Cd2+初始浓度的增大, 其对细胞的毒害性加大, 而Huang等(2013)的研究表明, 细胞表面积累的Cd2+越多越能减轻重金属对细胞质的伤害, 这可能也是菌株能够在高浓度Cd2+下生存的与原因之一.随着Cd2+浓度的升高, 细胞的活性受到抑制, 其细胞累积能力降低, Cd2+外排(刘爱民, 2005), 导致细胞器积累Cd2+量下降.当系统浓度接近耐受阈值时, 菌株代谢能力减弱, Cd2+吸收能力降低.
图 9(Fig. 9)
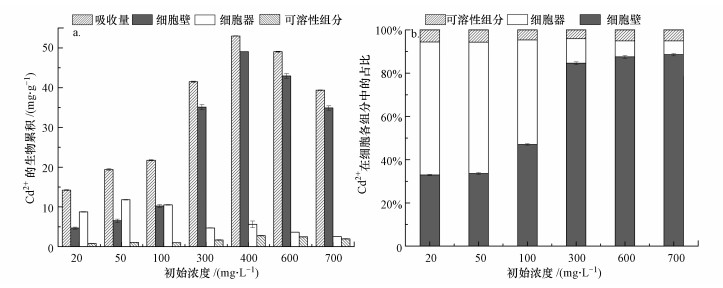 |
| 图 9 初始浓度对菌株亚细胞组分积累Cd2+的影响(a)及Cd2+在菌株亚细胞组分中分配的影响(b) Fig. 9Effect of initial concentration on the accumulation of Cd2+(a) and distribution of Cd2+(b) in the subcellular fractions of the strain B-6 |
从生物积累能力来看, 针对活细胞的相关研究多以吸附率为指标(喻涌泉等, 2017;邱云云等2011;徐淑霞2017).但吸附率受离子初始浓度的影响, 不适合用来衡量菌株的吸附能力.而本试验采用的吸收量, 能更准确地反映菌株的吸收能力.Huang等(2013)通过对活细胞的生物吸附进行Langmuir模型拟合, 得到的最大吸附值为24.01 mg · g-1, 本试验为51mg · g-1.与本文的试验方法比较后可知, 前者研究中的投加量是以最初投加的活细胞干重计算, 而本文是以收集吸收后的湿菌体来计算, 质量更大.相比用干重计算, 本文计算的最大吸附值偏低.由此看出, 本研究的生物积累量远高于Huang等(2013)的研究.此外, 现有的研究主要关注伯克氏菌在植物-微生物协同修复中的作用, 而忽略了对菌株自身的转运机理研究.本试验通过时间和初始浓度探究了细胞中Cd2+的转运机制, 对于今后的协同修复具有参考价值, 同时也可为其作为土壤修复功能菌株奠定基础.但在实际应用中仍有许多需要克服的难题, 需要进行更深层次的探索.
4 结论(Conclusions)1) 本文从Cd污染土壤中筛选了一株耐Cd能力较强的菌株, 命名B-6, 研究发现其对Cd2+耐受阈值为850 mg · L-1.菌株B-6是一株革兰氏阴性杆菌, 菌体呈黄色, 经鉴定后确定为伯克霍尔德氏菌.
2) 经过单因素优化后, 菌株B-6在初始浓度为400 mg · L-1, 培养时间72 h时, 对Cd2+对吸收量达到最大值51 mg · g-1.在研究中发现菌株B-6对酸碱的适应能力较强, 表明其可能具备对系统pH值调控的能力.
3) 通过亚细胞Cd2+含量分析试验可知, 细胞各组分协同配合吸收Cd2+, 可能利用细胞壁的赋存能力及细胞器向细胞壁转运来提升细胞对Cd2+的适应及吸收能力.
参考文献
| 布坎南R E, 吉本斯N E.1984.伯杰氏细菌鉴定手册(第八版)[M].北京: 科学出版社 |
| 陈雪姣, 郭雪玲, 南昊, 等. 2016. 一株耐镉假单胞杆菌的分离鉴定及其对镉的吸附研究[J]. 湖北农业科学, 55(11): 2765-2768+2773. |
| Choi J, Lee J Y, Yang J S. 2009. Biosorption of heavy metals and uranium by starfish and Pseudomonas putida[J]. Journal of Hazardous Ma Terials, 161(1): 157-162. |
| Dourado M, Martins P, Quecine M, et al. 2013. Burkholderia sp.SCMS54 reduces cadmium toxicity and promotes growth in tomato[J]. Annals of Applied Biology, 163(3): 494-507. |
| 何环宇.2017.重金属铜吸附优势菌株的筛选及其特性研究[D].成都: 西南交通大学 http://cdmd.cnki.com.cn/Article/CDMD-10613-1017138323.htm |
| 黄飞.2013.蜡状芽孢杆菌对水体中镉的吸附特性与机理研究[D].广州: 华南理工大学 http://cdmd.cnki.com.cn/Article/CDMD-10561-1014153379.htm |
| Huang F, Dang Z, Guo C L, et al. 2013. Biosorption of Cd (II) by live and dead cells of Bacillus cereus RC-1 isolated from cadmium-contaminated soil[J]. Colloids and Surfaces B:Biointerfaces, 107(4B): 11. |
| 黄军, 靳磊, 魏小武, 等. 2016. 一株高耐镉菌株的分离、鉴定及系统发育分析[J]. 湖南农业科学, (12): 15-17. |
| 赖星, 袁林, 黄银春, 等. 2019. 钝化处理对Cd污染水稻种植系统影响的能值效益分析[J]. 生态学杂志, 38(10): 2989-2996. |
| 李明亮, 李欢, 王凯荣, 等. 2016. Cd胁迫下丛枝菌根对花生生长、光合生理及Cd吸收的影响[J]. 环境化学, 35(11): 2344-2352. |
| 李倩, 张平, 廖柏寒, 等. 2019. 一株耐Cd菌株的分离、鉴定及基本特性[J]. 微生物学报, 59(1): 11-24. |
| 刘爱民.2005.耐镉细菌筛选与吸附镉机理研究及其在镉污染土壤修复中的应用[D].南京: 南京农业大学 http://cdmd.cnki.com.cn/Article/CDMD-10307-2006131562.htm |
| Lin Y, Wang X, Wang B, et al. 2012. Bioaccumulation characterization of zinc and cadmium by Streptomyces zinciresistens, a novel actinomycete[J]. Ecotoxicology and Environmental Safety, 77(6): 7-17. |
| 李辉, 张国芳, 石璐, 等. 2010. 耐镉蜡状芽孢杆菌SY的筛选鉴定及其培养条件优化[J]. 湖北农业科学, 49(6): 1353-1355. |
| 陆仲烟. 2014. 伯克氏菌和基因型对水稻及大麦镉积累特性的影响[M]. 北京: 中国农业科学院. |
| Malik A. 2014. Metal bioremediation through growing cells[J]. Environment International, 30(2): 78-261. |
| Mishra A, Malik A. 2013. Recent advances in microbial metal bioaccumulation[J]. Critical Reviews in Environmental Science and Technology, 43(11): 1162-1222. |
| Saher N, Siddiqui A. 2016. Comparison of heavy metal contamination during the last decade along the coastal sediment of Pakistan:Multiple pollution indices approach[J]. Marine Pollution Bulletin, 105(1): 403-410. |
| 沈秋悦, 曹志强, 朱月芳, 等. 2016. 一株耐镉细菌的分离鉴定及其吸附条件的优化[J]. 土壤, 48(3): 615-620. |
| Ouali N, Belabed B, Chenchouni H. 2018. Modelling environment contamination with heavy metals in flathead grey mullet Mugil cephalus and upper sediments from north African coasts of the Mediterranean Sea[J]. Science of the Total Environment, 639: 156-174. |
| Oyetibo G O, Ilori M O, Obayori O S, et al. 2015. Metal biouptake by actively growing cells of metal-tolerant bacterial strains[J]. Environmental Monitoring and Assessment, 187(8): 525. |
| Oyetibo G O, Ilori M, Obayori O, et al. 2013. Biodegradation of petroleum hydrocarbons in the presence of nickel and cobalt[J]. Journal of Basic Microbiology, (11): 917-927. |
| 邱云云, 尹华, 叶锦韶, 等. 2011. 嗜麦芽窄食单胞菌对镉的吸附[J]. 环境污染与防治, 33(4): 40-45. |
| 王京文, 李丹, 柳俊, 等. 2015. 耐镉菌株对土壤镉形态及土壤微生物群落结构的影响[J]. 农业环境科学学报, 34(9): 1693-1699. |
| 魏蓝, 朱月芳, 史广宇, 等. 2016. 壬基酚对一株铜绿假单胞菌吸附镉的影响[J]. 中国环境科学, 36(11): 3495-3501. |
| Wu H, Wu Q, Wu G, et al. 2016. Cd-resistant strains of B.cereus S5 with endurance capacity and their capacities for cadmium removal from cadmium-polluted water[J]. PloS One, 11(4): 1-10. |
| 许钦坤, 赵翠燕. 2015. 耐镉菌株的筛选及生物学特性[J]. 江苏农业科学, 43(2): 317-318. |
| 徐淑霞, 杜文涛, 王晓雅, 等. 2017. 1株耐Cd细菌的分离、鉴定及其吸附特性研究[J]. 河南农业科学, 46(5): 71-76. |
| 杨森.2006.一株用于生物防治的Burkholderia菌的基因改造和生长条件研究[D].西安: 西北大学 http://d.wanfangdata.com.cn/Thesis/Y894076 |
| Yang Z, Zhang Z, Chai L, et al. 2016. Bioleaching remediation of heavy metal-contaminated soils using Burkholderia sp.Z-90[J]. Journal of Hazardous Materials, 301: 145-152. |
| 喻涌泉, 黄魏魏, 董建江, 等. 2017. 硝基还原假单胞菌吸附重金属镉的机理研究[J]. 中国环境科学, 37(6): 2232-2238. |
| 张长平, 张彤, 王子月. 2016. 镉污染水处理技术及展望[J]. 化工技术与开发, 45(11): 47-50. |
| 张亚经, 马成仓, 郭军康, 等. 2017. 接种伯克氏菌D54对东南景天吸收富集Cd的影响[J]. 农业环境科学学报, 36(3): 449-457. |
| 周赓.2016.耐镉放线菌的筛选及特性研究[D].长沙: 湖南农业大学 http://cdmd.cnki.com.cn/Article/CDMD-10537-1017037021.htm |
