 , 伏小勇1, 陈学民1
, 伏小勇1, 陈学民1
 , 袁福林1, 朱琳1
, 袁福林1, 朱琳11. 兰州交通大学环境与市政工程学院, 兰州 730070;
2. 玉溪师范学院化学生物与环境学院, 玉溪 653100
收稿日期: 2019-07-27; 修回日期: 2019-09-29; 录用日期: 2019-09-29
基金项目: 国家自然科学基金(No.51168029);国家重点研发计划(No.2016YFC0400703)
作者简介: 秦洁(1984-), 女, E-mail:ynqinjie@126.com
通讯作者(责任作者): 陈学民, E-mail:fuxiaoyong7362@foxmail.com
摘要:采用实验对比和除趋势对应分析(DCA)等方法,以城镇污泥中的微型动物为对象,研究蚯蚓对堆肥过程微型动物群落演替的影响.结果表明,蚯蚓仅影响微型动物群落数量,对演替进程无明显影响.堆肥过程微型动物群落演替可分为3个阶段:第1阶段(0~10 d),固着类纤毛虫为优势类群阶段,该阶段微型动物变化多受限于环境的改变,蚯蚓影响较小;第2阶段(10~30 d),固着类纤毛虫和轮虫向肉足虫和线虫为优势类群的过渡阶段,该阶段蚯蚓对线虫数量有一定的限制;第3阶段(30 d后),肉足虫和线虫为优势类群阶段,该阶段蚯蚓对有壳肉足虫的增长产生了明显的抑制作用.群落多样性指数结果显示,蚯蚓在第1和第2阶段作用不明显,在第3阶段增加了微型动物的多样性和均匀度,减小了优势物种的优势程度.对固着类纤毛虫的同化作用是蚯蚓稳定堆肥环境、促进有机质降解的重要因素.
关键词:城镇污泥堆肥蚯蚓微型动物群落演替除趋势对应分析(DCA)
Effects of earthworms on the microfauna community succession during vermicomposting
QIN Jie1,2
 , FU Xiaoyong1, CHEN Xuemin1
, FU Xiaoyong1, CHEN Xuemin1
 , YUAN Fulin1, ZHU Lin1
, YUAN Fulin1, ZHU Lin11. School of Environmental and Municipal Engineering, Lanzhou Jiaotong University, Lanzhou 730070;
2. College of Chemistry Biology and Environment, Yuxi Normal University, Yuxi 653100
Received 27 July 2019; received in revised from 29 September 2019; accepted 29 September 2019
Abstract: Using experimental comparison and detrended correspondence analysis (DCA), this study investigated the effects of earthworms on succession in the microfauna community during vermicomposting. Results showed that earthworms only affected microfauna population numbers but had no significant effect on the succession process within the population. Succession in the microfauna community during the composting process could be seen in three distinct stages:Stage 1(0~10 d):During this stage, sessile ciliates were dominant in the microfauna population and microfauna diversity was mostly affected by environmental changes rather than the presence of earthworms. Stage 2(10~30 d):The dominant species gradually transitioned from sessile ciliates and rotifers to testate amoebae and nematodes. During this stage, the presence of earthworms played a role in limiting the nematode population. Stage 3(after 30 d); testate amoebae and nematodes became the dominant group of microfauna. During this stage, earthworms played a significant inhibitory effect on the growth of the nematode population. In conclusion, the community diversity index at the different stages showed that earthworms did not play a significant role in the first two stages of microfauna succession, but did serve to limit the growth of the dominant species of microfauna in the third stage and thereby increasing the diversity and spread of microfauna. The assimilation of earthworms in sessile ciliate populations was an important factor in stabilizing the sludge envrionment and promoting faster degradation of organic sludge matter.
Keywords: municipal sludge compostearthwormmicrofaunacommunity successionDCA
1 引言(Introduction)蚯蚓堆肥是一种低成本、“绿色”的有机废弃物处理方法(Iwai et al., 2013; Hao et al., 2016), 是通过蚯蚓与微型生物(微生物、微型动物)的相互作用对有机质进行生物氧化的过程(Villar et al., 2016; Mupambwa et al., 2018).在此过程中蚯蚓可以通过自身活动直接或间接地影响微型动物群落, 改变污泥微生物群落结构、数量及其活性(Gómez-Brandón et al., 2011; Fu et al., 2015; Fu et al., 2016), 提高微生物代谢速率, 加速有机质降解(伏小勇等, 2015), 促进污泥氨化和硝化进程(伏小勇等, 2017), 提高酸碱缓冲能力, 稳定微生物生存环境等(陈学民等, 2016).
污泥中有机营养物质矿化主要由微生物直接控制, 微生物的数量、活性、多样性等不仅受蚯蚓影响, 还受污泥中微型动物的调控.而微型动物群落会随着蚯蚓堆肥过程中堆肥环境和微生物群落的变化发生一定程度的演替, 主要表现为在种群内部和种间关系与外界环境中生态因子的综合作用下, 一个群落被另一个群落所取代, 并由此产生的生物群落在结构和功能等方面的变化(许士国, 2011).蚯蚓作为污泥碎屑食物链(网)中最高营养级的消费者, 既可通过级联效应作用于其他次级消费者, 影响基质理化性质(Oksanen et al., 1981; Schmitz, 1993; Wu et al., 2011), 又可通过耦合作用平衡食物链能量流通和转化效率, 减弱食物链中生物种群波动对基质造成的影响(Rooney et al., 2006).因此, 在蚯蚓-微型动物-微生物组成的共生体系中, 研究蚯蚓对城镇污泥微型动物群落演替的影响, 对于以碎屑食物链(网)为基础的蚯蚓堆肥系统具有普遍的指导意义.
目前, 对城镇污泥蚯蚓堆肥稳定化过程的研究多涉及蚯蚓对微生物(细菌、真菌)群落及活性的影响, 对污泥理化性质的影响, 以及对污泥重金属减量和钝化作用的影响等方面(Monroy et al., 2009; Yakushev et al., 2009; Lv et al., 2018; Usmani et al., 2018; Wu et al., 2018), 而对于城镇污泥蚯蚓堆肥中微型动物的研究鲜见报道.因此, 本文以添加蚯蚓作为处理组, 未添加蚯蚓作为对照组, 以微型动物为对象, 通过对比实验观察微型动物群落演替差异, 并结合DCA等分析方法, 研究蚯蚓对污泥食物链(网)中微型动物群落演替的影响, 以期为研究蚯蚓对污泥食物网的影响及在蚯蚓堆肥中的作用奠定基础.
2 材料与方法(Materials and methods)2.1 实验材料供试蚯蚓为实验室培养的赤子爱胜蚓(Eisenia foetida), 城镇污泥取自兰州市七里河污水厂的污泥脱水车间, 将污泥在实验室制成粒径约为5 mm的颗粒后使用.脱水污泥的初始理化性质见表 1.
表 1(Table 1)
| 表 1 脱水污泥初始理化性质 Table 1 Physico-chemical properties of initial pelletized dewatered sludge | |||||||||||||||||||||||||||||||||
表 1 脱水污泥初始理化性质 Table 1 Physico-chemical properties of initial pelletized dewatered sludge
| |||||||||||||||||||||||||||||||||
2.2 实验方法取直径为36 cm、深为11 cm的不锈钢容器6个, 每个容器内投加2.1 kg污泥.将6个容器分两组, 分别为处理组和对照组, 每组设置3个平行样品, 其中, 处理组每个容器中接种210 g蚯蚓(污泥与蚯蚓质量比为10:1), 对照组中不接种蚯蚓.将所有容器置于生物培养箱中, 培养箱温度设定为(20±1) ℃, 实验容器遮光、保湿, 含水率保持在76%~78%, 实验共进行70 d.每隔5 d采一次样, 阴干, 研磨, 过100目筛, 用于测定理化指标.OM采用灼烧法(550 ℃, 8 h)测定;DOC采用重铬酸钾氧化法(Fernández-Gómez et al., 2010)测定;微型动物每2 d观察一次, 查阅资料(沈韫芬, 1990; 马放等, 2010)并置于光镜下鉴定物种, 同时记录个体数量.
2.3 统计分析采用SPSS18.0软件, 通过单因素方差分析(ANOVA)方法分析不同实验组间的差异性, 并进行指标间的相关性分析, 显著性定义为p < 0.05.用Canoco 4.5软件以微型动物群落特征因子为指标, 以污泥降解时间为对象, 构建数据矩阵, 进行除趋势对应分析, 并制作二维排序图.数据处理及作图工具为Excel 2016和OriginPro 8.采用公式(1)~(4)分别计算Shannon-Wiener多样性指数(H′)、Pielou均匀度指数(J′)、Simpson优势度指数(D)、Margalef丰富度指数(R).
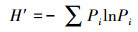 | (1) |
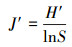 | (2) |
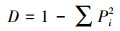 | (3) |
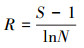 | (4) |
3 结果和讨论(Results and discussion)3.1 污泥堆肥中有机质和溶解性有机碳的变化两实验组有机质(OM)均呈不断下降的趋势, 处理组OM明显低于对照组, 差异显著(p < 0.05), 说明蚯蚓加速有机质降解的作用明显.处理组OM在0~10 d下降速度最快, 10~30 d略有变缓, 30~55 d下降速度再次增加, 55 d以后则趋于平缓.而对照组OM呈较均匀的下降速度, 55 d后对照组OM下降速率为4.07%, 高于处理组的1.35%.溶解性有机碳(DOC)是易被微生物利用的碳源(Fu et al., 2015a), 是其生长代谢过程中的重要供能物质, 对微生物活动有重要意义.0~15 d处理组与对照组DOC含量下降, 处理组降幅低于对照组;15~30 d处理组DOC快速增加, 且维持较高水平, 对照组DOC仍持续下降;30~55 d处理组DOC急速下降, 对照组则呈上升趋势, 55 d后处理组DOC低于对照组.
图 1(Fig. 1)
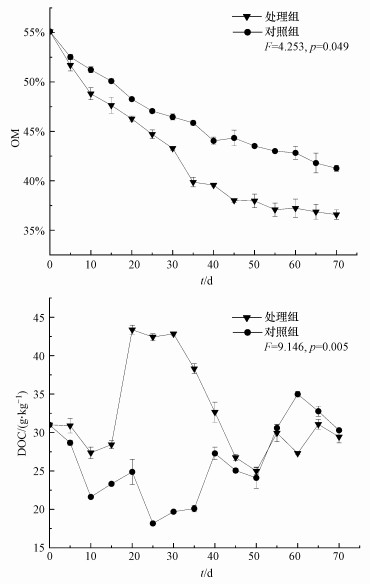 |
| 图 1 污泥堆肥过程中OM和DOC的变化趋势 Fig. 1Changes of OM and DOC during municipal sludge composting |
3.2 蚯蚓对微型动物数量的影响在处理组和对照组中分别观察到微型动物8种, 其中原生动物6种、后生动物2种.6种原生动物分属固着类纤毛虫和肉足虫两大类.固着类纤毛虫(Sessile ciliates)包括累枝虫(Epistylis)和盖虫(Opercularis), 肉足虫(Sarcodina)包括变形虫(Amoeba)、表壳虫(Arcella)、鳞壳虫(Euglypha)和匣壳虫(Centropyxis).后生动物分别为轮虫(Rotifera)和线虫(Nematoda).
处理组和对照组微型动物总数变化如图 2所示, 其中, 处理组数量低于对照组, 差异显著(p < 0.05).处理组和对照组微型动物数量分别为11.640×103~70.840×103 ind.·g-1和15.000×103~89.080×103 ind.·g-1, 平均分别为26.024×103ind.·g-1和37.856×103 ind.·g-1.两实验组微型动物变化在堆肥前期相似, 后期显著不同(图 2).蚯蚓对城镇污泥堆肥微型动物数量的影响集中在实验后期.产生如此差异可能有以下几方面原因:第一, 捕食作用, 蚯蚓作为污泥食物网最高级消费者, 可以通过捕食其他营养级生物影响其生长繁殖, 从而影响系统中的能量流动和营养物质循环(Tian et al., 2000; Koubová et al., 2015);第二, 间接作用, 蚯蚓改变了微生物的数量和群落结构(R?ty et al., 2003), 影响了以细菌、真菌等微生物为主要食物来源的消费者的数量, 同时通过肠道代谢作用及排泄物(蚯蚓粪)和分泌物改变污泥环境, 间接影响微型动物数量增长(Gómez-Brandón et al., 2010);第三, 资源竞争, 随着污泥有机质含量逐渐减少, 有限的资源条件使得各物种内和物种间资源竞争日趋激烈, 蚯蚓的下行效应逐渐增强, 导致堆肥后期蚯蚓对微型动物数量的影响异常明显.
图 2(Fig. 2)
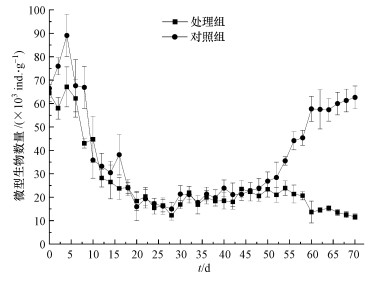 |
| 图 2 微型动物数量的变化趋势(n=3) Fig. 2Changes of microfauna quantity during the experimental process |
微型动物总数、OM、DOC和蚯蚓生物量的相关性分析结果显示(表 2), 处理组中微型动物总数与OM呈显著正相关, 与DOC无显著相关性;在对照组中, 微型动物总数则与OM无显著相关性, 仅与DOC呈显著正相关.在以碎屑-微生物-微型动物-蚯蚓构成的食物链(网)中, 微型动物不但受微生物制约, 还受蚯蚓生物量控制.由于微型动物多以细菌、表 2微型动物与OM、DOC的Pearson相关性分析真菌为食, 当无蚯蚓存在时(对照组), DOC含量高低会直接影响微生物数量, 进而影响微型动物的食物来源数量(沈韫芬, 1990).当有蚯蚓存在时(处理组), 丰富的DOC极大地促进了微生物的生长, 制约微型动物数量的主要因素是蚯蚓而非微生物, 从而弱化了微型动物与DOC相关性.因此, 蚯蚓在一定程度上具有促进微生物生长、限制微型动物数量的作用.
表 2(Table 2)
| 表 2 微型动物与OM、DOC的Pearson相关性分析 Table 2 Pearson correlative analysis between microfauna quantity, earthworm biomass, OM and DOC of the two groups | |||||||||||||||||||||||||||||||||||||||||||||||||
表 2 微型动物与OM、DOC的Pearson相关性分析 Table 2 Pearson correlative analysis between microfauna quantity, earthworm biomass, OM and DOC of the two groups
| |||||||||||||||||||||||||||||||||||||||||||||||||
3.3 蚯蚓对微型动物群落演替的影响根据DCA分析结果及微型动物在堆肥过程中优势种群的变化特征, 可将处理组与对照组微型动物群落演替分为3个阶段(图 3).第1阶段:0~10 d, 固着类纤毛虫为优势类群的阶段;第2阶段:10~30 d, 固着类纤毛虫和轮虫向肉足虫和线虫为优势类群过渡的阶段;第3阶段:30 d后, 肉足虫和线虫为优势类群的阶段.从处理组与对照组微型动物优势群落变化的时间节点可以看出, 蚯蚓并未改变微型动物群落演替进程, 但对各微型动物的数量产生了不同程度的影响.
图 3(Fig. 3)
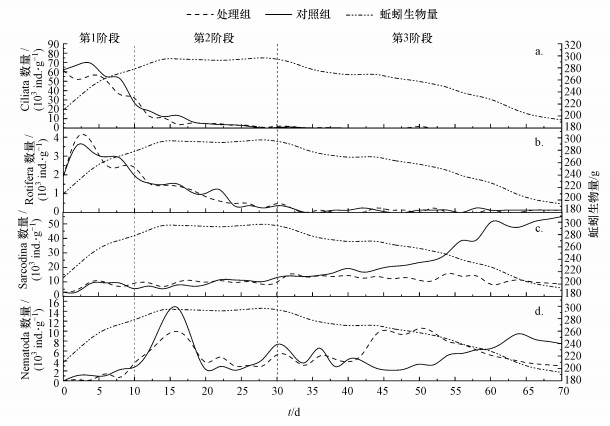 |
| 图 3 城镇污泥堆肥微型动物群落演替趋势 Fig. 3Succession trend of microfauna community during municipal sludge compost |
3.3.1 蚯蚓对固着类纤毛虫的影响两实验组固着类纤毛虫数量无明显差别, 均呈降低的趋势(图 3a).实验初始时两实验组固着类纤毛虫数量为61.56×103 ind.·g-1, 占微型动物总数的92.60%.至第10 d时, 处理组固着类纤毛虫数量为32.04×103 ind.·g-1, 占比为67.94%, 而对照组数量略有上升, 达到76.60×103 ind.·g-1, 占比为85.99%.第30 d时, 处理组固着类纤毛虫数量为1680 ind.·g-1, 占比为7.57%, 而对照组为600 ind.·g-1, 占比为2.81%.30 d以后处理组和对照组固着类纤毛虫仅偶尔出现.
整个实验过程中, 蚯蚓生物量呈现先增大后恒定, 最后又下降的趋势.蚯蚓生物量从开始时的210 g增加到第15 d的296.21 g, 15~30 d基本保持稳定, 30 d后持续下降, 实验结束时蚯蚓生物量为193.53 g, 较起始时的生物量减少了16.47 g.
相关性分析表明, 处理组固着类纤毛虫数量与蚯蚓生物量和OM呈显著正相关, 与DOC呈显著正相关关系(表 2).固着类纤毛虫是活性污泥中的常见种类, 是单细胞真核生物, 适应于水生环境, 对环境变化极其敏感(沈韫芬, 1990; 宁应之等, 1996).由于污泥脱水导致其生境发生变化, 使固着类纤毛虫在堆肥前期急速死亡, 而它作为微型动物的绝对优势类群, 数量庞大, 且其世代时间短, 每天大约可繁殖两代(崔振东等, 1989; 沈韫芬, 1990), 因此, 短期内大量的死亡必会对污泥堆肥环境产生巨大的影响.而蚯蚓作为堆肥食物网中最高级的消费者, 其无选择性摄食特征及强大的吞食能力, 可以迅速同化污泥中死亡的微型动物残体, 作为自身生物量持续增长的物质和能量基础(Suthar, 2009; Sharma et al., 2018), 其排泄物以易利用的形式释放到环境中, 可加快基质营养物质的循环利用.此阶段, 蚯蚓对固着类纤毛虫的同化作用是稳定污泥环境、促进有机质快速降解的重要因素.
3.3.2 蚯蚓对轮虫的影响两实验组轮虫数量都呈下降趋势(图 3b).实验初始时两实验组轮虫数量为1920 ind.·g-1, 占微型动物总数的2.89%.至第10 d时, 处理组轮虫数量为2400 ind.·g-1, 占比为5.08%, 而对照组数量略有上升, 达到1960 ind.·g-1, 占比为7.48%.第30 d时, 处理组轮虫数量为240 ind.·g-1, 占比为1.38%, 对照组为240 ind.·g-1, 占比为1.14%.30 d后轮虫仅偶尔出现.两实验组中, 轮虫数量均与OM呈显著正相关关系.轮虫是污水生物处理的指示生物, 对氧及含水率等指标变化有较大的敏感性(夏北成, 2002).蚯蚓可吞食轮虫作为自己的食物来源之一, 但结果显示(图 2b)两实验组轮虫数量接近, 且轮虫数量与蚯蚓生物量无显著相关关系, 说明蚯蚓对轮虫无显著影响.这可能是由于轮虫数量很少, 被蚯蚓的吞食概率相对较低, 轮虫数量的减少可能是由于污泥脱水引起的环境变化导致.
3.3.3 蚯蚓对肉足虫的影响本实验中肉足虫包括裸肉足虫(变形虫)和有壳肉足虫(表壳虫、鳞壳虫和匣壳虫).裸肉足虫在前期出现, 出现频次和数量极少, 后期消失.有壳肉足虫主要以微小的藻类、细菌和微小的有机质颗粒为食, 虫体被包裹在由蛋白质、凝胶、硅质或钙质成分组成的壳内(沈韫芬, 1990), 壳在保存体内水分上有独特的能力(Foissner, 1987), 与固着类纤毛虫相比, 可以更好地适应脱水的污泥环境, 使有壳肉足虫成为实验后期的优势类群.但由于有壳肉足虫壳的复制相对缓慢, 分裂周期大约为1周(崔振东等, 1989), 这一特性限制了其数量的增长速度(Hedley et al., 1976).处理组和对照组有壳肉足虫的变化存在明显差异(图 3c), 处理组肉足虫的数量先逐渐增大(0~16 d, (7666.7±2746) ind.·g-1), 然后趋于恒定(18~58 d, (12365.7±2125.6) ind.·g-1), 实验末期又有所下降(60~70 d, (9440.1±1698) ind.·g-1), 而对照组则持续增大(由0 d时的3840 ind.·g-1增大到70 d时的55080 ind.·g-1).可见蚯蚓对有壳肉足虫具有显著的抑制作用.
对照组肉足数量虫与OM呈显著负相关, 与DOC呈显著正相关(表 2).肉足虫在降解有机质的同时可产生大量的DOC, 具有加快污泥中营养物质循环的作用.但处理组中肉足虫与DOC无显著相关性, 表明蚯蚓的存在弱化了肉足虫在加快营养物质循环中的作用.这主要是因为蚯蚓的抑制作用在限制了肉足虫数量的同时, 也减少了其对DOC的产生量.另一个可能的原因是, 蚯蚓的生物量远大于肉足虫, 其对DOC的贡献也远远大于肉足虫, 因此, 尽管蚯蚓抑制了肉足虫的数量, 但并不影响污泥营养物质的循环利用.
3.3.4 蚯蚓对线虫的影响两实验组线虫数量波动较大(图 3d), 实验初始对照组和处理组线虫数量分别为1080 ind.·g-1和240 ind.·g-1, 分别占微型动物总数的1.43%和0.39%;第16 d时分别为14760 ind.·g-1和9960 ind.·g-1, 占比分别为38.68%和40.89%, 线虫数量达到峰值, 对照组大于处理组.两实验组线虫数量的增大与固着类纤毛虫和轮虫数量减少同步, 这可能与后者死亡可为线虫提供所需的物质和能量有关.而处理组中蚯蚓对线虫的抑制使其数量低于对照组(Domínguez et al., 2003).
16 d后两实验组线虫数量快速下降, 20 d时处理组和对照组数量均下降到较低水平, 分别为3720 ind.·g-1和2280 ind.·g-1, 在微型动物总数中占比分别为19.37%和14.02%.30 d开始处理组线虫数量逐渐增加, 第50 d时达到峰值, 数量为10560 ind.·g-1, 占比达到45.13%;而对照组在50 d后才开始增加, 第64 d达到峰值, 数量为9480 ind.·g-1, 占比为16.53%.至实验结束时处理组和对照组线虫数量分别减少到3000 ind.·g-1和7440 ind.·g-1, 占比分别为25.77%和11.80%.相较两实验组线虫数量的第二次波动时间, 对照组相对滞后.线虫一般分为食细菌线虫、食真菌线虫、捕食性线虫等, 食性较复杂(Yeates et al., 1993).蚯蚓对堆肥进程的促进作用(Fu et al., 2016), 有利于真菌的增殖(Singh et al., 2012; Chen et al., 2018), 从而促进食真菌线虫数量的增加, 这可能是导致处理组第二次线虫数量上升时间较对照组提前的主要原因.
3.4 微型动物群落多样性指数Shannon-Wiener多样性指数H′借用信息论的方法, 通过描述物种的个体出现的不确定性来测度物种多样性, 即不确定性越高, 多样性也就越高.均匀度指数J′可描述群落中不同物种个体数的分布格局, 不同物种个体数越接近, 均匀度越大.优势度指数D反映了生境中优势物种的优势程度, 数值越大, 表示优势度物种越小.丰富度指数R反映了群落内物种的数目大小(覃林, 2009).对处理组和对照组多样性指数分析发现, 30 d以前两实验组微型动物群落多样性指数较接近, 到实验末期差异较大.其中, 处理组的H′、J′和D远高于对照组, 两组的R差别较小(图 4).说明蚯蚓对微型动物的影响在实验后期更加显著, 导致这一结果的原因源自有壳肉足虫和线虫数量在两实验组中的差异.
图 4(Fig. 4)
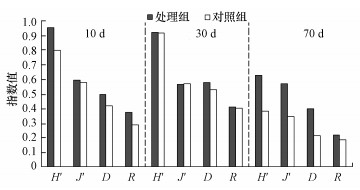 |
| 图 4 微型动物群落多样性指数的变化趋势 Fig. 4The diversity index changes of microfauna community |
3.5 群落相似性分析对两实验组微型动物群落进行DCA(Detrended Correspondence Analysis)分析, 结果如图 5所示, 图中展现出分布特征显著不同的4个区域.
图 5(Fig. 5)
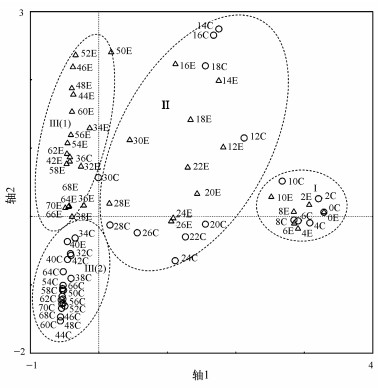 |
| 图 5 处理组和对照组的DCA二维排序图 (○表示对照组;△表示处理组;英文字母前的数字表示实验天数) Fig. 5Two-dimensional DCA ordination plot of sludge stabilization process in the two groups (The numbers mean experimental days, the cycles and the triangles represent the treatment group and control group, respectively) |
区域Ⅰ(0~10 d), 处理组和对照组的各点分布比较集中, 两实验组微型动物群落高度相似, 说明蚯蚓的影响小, 此阶段正是固着类纤毛虫和轮虫数量迅速减小的阶段.区域Ⅱ(11~30 d), 处理组和对照组的各点分布区域大且较为分散, 两实验组微型动物群落相似性降低, 固着类纤毛虫和轮虫逐渐消失, 肉足虫和线虫逐渐成为优势类群的阶段.区域Ⅲ(30 d后)包括2个独立的区域Ⅲ(1)区和Ⅲ(2)区, 处理组微型动物群落聚于Ⅲ(1)区, 对照组则聚于Ⅲ(2)区, 两实验组微型动物群落相似性最低, 主要体现在有壳肉足虫和线虫数量的明显差异, 说明蚯蚓对有壳肉足虫和线虫种群数量具有显著的影响.
为进一步明确两实验组间微型动物的差异, 对两实验组各微型动物进行差异性分析.结果显示, 两实验组间肉足虫数量差异显著(F=13.669, p=0.000), 其他微型动物无显著差异(p>0.05).经LSD多重比较分析, 结果表明两实验组肉足虫数量在第3阶段中差异显著(F=46.012, p=0.000), 其它阶段差异不显著(p>0.05).
4 结论(Conclusions)微型动物群落演替大致可分为3个阶段.第1阶段:0~10 d, 固着类纤毛虫和轮虫为优势类群的阶段, 其数量变化多受污泥环境改变的影响, 蚯蚓的影响甚微;第2阶段:10~30 d, 固着类纤毛虫和轮虫为优势类群向肉足虫和线虫为优势类群过渡的阶段, 蚯蚓对线虫数量有一定的限制, 对有壳类肉足虫几乎没有影响;第3阶段:30 d后, 肉足虫和线虫为优势类群的阶段.蚯蚓对有壳肉足虫的增长具有明显的抑制作用.蚯蚓对污泥中微型动物演替进程无显著影响, 但增加了微型动物的多样性和均匀度, 减小了优势物种的优势程度.蚯蚓对固着类纤毛虫的同化作用在稳定污泥环境、加速有机质降解中起重要作用.
参考文献
| 陈学民, 高承煜, 伏小勇, 等. 2016. 蚯蚓处理对城镇造粒污泥酸碱缓冲容量的影响[J]. 环境科学学报, 36(8): 2941-2946. |
| Chen Y, Chang S K C, Chen J, et al. 2018. Characterization of microbial community succession during vermicomposting of medicinal herbal residues[J]. Bioresource Technology, 249: 542-549. DOI:10.1016/j.biortech.2017.10.021 |
| 崔振东, 庞延斌, 张作人. 1989. 土壤原生动物[J]. 动物学杂志, (2): 43-47. |
| Domínguez J, Parmelee R W, Edwards C A. 2003. Interactions between Eisenia andrei (Oligochaeta) and nematode populations during vermicomposting[J]. Pedobiologia-International Journal of Soil Biology, 47(1): 53-60. |
| Fernández-Gómez M J, Romero E, Nogales R. 2010. Feasibility of vermicomposting for vegetable greenhouse waste recycling[J]. Bioresour Technol, 101(24): 9654-9660. DOI:10.1016/j.biortech.2010.07.109 |
| Foissner W. 1987. Soil Protozoa:Fundamental problems, ecological significance.adaptations in ciliates and tetaceans, bioindicators.and guide to the literature[J]. Progress in Protistology, 2: 69-212. |
| 伏小勇, 崔广宇, 陈学民, 等. 2015. 蚯蚓处理对污泥中微生物碳量及脱氢酶活性的影响[J]. 环境科学学报, 35(1): 252-256. |
| Fu X, Huang K, Chen X, et al. 2015a. Feasibility of vermistabilization for fresh pelletized dewatered sludge with earthworms Bimastus parvus[J]. Bioresource Technology, 175: 646-650. DOI:10.1016/j.biortech.2014.11.007 |
| Fu X, Huang K, Cui G, et al. 2015b. Dynamics of bacterial and eukaryotic community associated with stability during vermicomposting of pelletized dewatered sludge[J]. International Biodeterioration & Biodegradation, 104: 452-459. |
| Fu X, Cui G, Huang K, et al. 2016. Earthworms facilitate the stabilization of pelletized dewatered sludge through shaping microbial biomass and activity and community[J]. Environmental Science and Pollution Research, 23(5): 4522-4530. DOI:10.1007/s11356-015-5659-0 |
| 伏小勇, 张高升, 陈学民, 等. 2017. 城镇污泥蚯蚓堆肥硝化进程及其影响因素[J]. 环境科学学报, 37(8): 3010-3015. |
| Gómez-Brandón M, Aira M, Lores M, et al. 2011. Changes in microbial community structure and function during vermicomposting of pig slurry[J]. Bioresource Technology, 102(5): 4171-4178. DOI:10.1016/j.biortech.2010.12.057 |
| Gómez-Brandón M, Lazcano C, Lores M, et al. 2010. Detritivorous earthworms modify microbial community structure and accelerate plant residue decomposition[J]. Applied Soil Ecology, 44(3): 237-244. DOI:10.1016/j.apsoil.2009.12.010 |
| Hao X, Hu H, Li X, et al. 2016. Adaptability comparison of E.fetida in vermicomposting against sludge from livestock wastewater treatment plant based on their several growth stages[J]. Environmental Science and Pollution Research, 23(15): 15452-15459. DOI:10.1007/s11356-016-6300-6 |
| Hedley R H, Ogden C G, Mordan N J. 1976. Manganese in the shell of Centropyxis (Rhizopodea:Protozoa)[J]. Cell & Tissue Research, 171(4): 543-549. |
| Iwai C B, Ta-Oun M, Chuasavatee T, et al. 2013. Management of municipal sewage sludge by vermicomposting technology:Converting a waste into a bio fertilizer for agriculture[J]. International Journal of Environmental and Rural Development, 4(1): 169-174. |
| Koubová A, Chroňáková A, Pi?l V, et al. 2015. The effects of earthworms Eisenia spp.on microbial community are habitat dependent[J]. European Journal of Soil Biology, 68: 42-55. DOI:10.1016/j.ejsobi.2015.03.004 |
| Lv B, Xing M, Yang J. 2018. Exploring the effects of earthworms on bacterial profiles during vermicomposting process of sewage sludge and cattle dung with high-throughput sequencing[J]. Environmental Science and Pollution Research, 25(13): 12528-12537. DOI:10.1007/s11356-018-1520-6 |
| 马放, 杨基先, 魏利. 2010. 环境微生物图谱[M]. 北京: 环境科学出版社, 88-172. |
| Monroy F, Aira M, Domínguez J. 2009. Reduction of total coliform numbers during vermicomposting is caused by short-term direct effects of earthworms on microorganisms and depends on the dose of application of pig slurry[J]. Science of the Total Environment, 407(20): 5411-5416. DOI:10.1016/j.scitotenv.2009.06.048 |
| Mupambwa H A, Mnkeni P N S. 2018. Optimizing the vermicomposting of organic wastes amended with inorganic materials for production of nutrient-rich organic fertilizers:a review[J]. Environmental Science and Pollution Research, 25(11): 10577-10595. DOI:10.1007/s11356-018-1328-4 |
| 宁应之, 沈韫芬. 1996. 土壤原生动物[J]. 生物学通报, (3): 13-15. |
| Oksanen L, Fretwell S D, Arruda J, et al. 1981. Exploitation ecosystems in gradients of primary productivity[J]. The American Naturalist, 118(2): 240-261. DOI:10.1086/283817 |
| 覃林. 2009. 统计生态学[M]. 北京: 北京林业出版社, 61-75. |
| R?ty M, Huhta V. 2003. Earthworms and pH affect communities of nematodes and enchytraeids in forest soil[J]. Biology & Fertility of Soils, 38(1): 52-58. |
| Rooney N, Mccann K, Gellner G, et al. 2006. Structural asymmetry and the stability of diverse food webs[J]. Nature, 442(7100): 265-269. DOI:10.1038/nature04887 |
| Schmitz O J. 1993. Trophic exploitation in grassland food chains:simple models and a field experiment[J]. Oecologia, 93(3): 327-335. DOI:10.1007/BF00317874 |
| Sharma K, Garg V K. 2018. Comparative analysis of vermicompost quality produced from rice straw and paper waste employing earthworm Eisenia fetida (Sav.)[J]. Bioresource Technology, 250: 708-715. DOI:10.1016/j.biortech.2017.11.101 |
| 沈韫芬. 1990. 微型生物监测新技术[M]. 北京: 中国建筑工业出版社. |
| Singh D, Suthar S. 2012. Vermicomposting of herbal pharmaceutical industry waste:Earthworm growth, plant-available nutrient and microbial quality of end materials[J]. Bioresource Technology, 112: 179-185. DOI:10.1016/j.biortech.2012.02.101 |
| Suthar S. 2009. Vermicomposting of vegetable-market solid waste using Eisenia fetida:Impact of bulking material on earthworm growth and decomposition rate[J]. Ecological Engineering, 35(5): 914-920. DOI:10.1016/j.ecoleng.2008.12.019 |
| Tian G, Olimah J A, Adeoye G O, et al. 2000. Regeneration of earthworm populations in a degraded soil by natural and planted fallows under humid tropical conditions[J]. Soil Science Society of America Journal, 64(1): 222-228. DOI:10.2136/sssaj2000.641222x |
| UsmanI Z, Kumar V, Rani R, et al. 2018. Changes in physico-chemical, microbiological and biochemical parameters during composting and vermicomposting of coal fly ash:a comparative study[J]. International Journal of Environmental Science & Technology, 16: 4647-4664. |
| Villar I, Alves D, Pérez-Díaz D, et al. 2016. Changes in microbial dynamics during vermicomposting of fresh and composted sewage sludge[J]. Waste Management, 48: 409-417. DOI:10.1016/j.wasman.2015.10.011 |
| Wu D, Yu X, Chu S, et al. 2018. Alleviation of heavy metal phytotoxicity in sewage sludge by vermicomposting with additive urban plant litter[J]. Science of the Total Environment, 633: 71. DOI:10.1016/j.scitotenv.2018.03.167 |
| Wu X, Duffy J E, Reich P B, et al. 2011. A brown-world cascade in the dung decomposer food web of an alpine meadow:effects of predator interactions and warming[J]. Ecological Monographs, 81(2): 313-328. DOI:10.1890/10-0808.1 |
| 夏北成. 2002. 环境污染物生物降解[M]. 北京: 化学工业出版社, 7-8. |
| 许士国.2011.黄河三角洲土壤动物群落结构特征及演替[D].济南: 山东师范大学.22-23 |
| Yakushev A V, Blagodatsky S A, Byzov B A. 2009. The effect of earthworms on the physiological state of the microbial community at vermicomposting[J]. Microbiology, 78(4): 510-519. DOI:10.1134/S002626170904016X |
| Yeates G W, Bongers T, De Goede R G, et al. 1993. Feeding habits in soil nematode families and genera-an outline for soil ecologists[J]. Journal of Nematology, 25(3): 315-331. |
