, 姜恬, 周旭, 赵旭蕾, 陆隽鹤, 季跃飞
, 姜恬, 周旭, 赵旭蕾, 陆隽鹤, 季跃飞

南京农业大学, 资源与环境科学学院, 南京 210095
收稿日期: 2019-04-10; 修回日期: 2019-05-15; 录用日期: 2019-05-15
基金项目: 国家自然科学基金(No.21607077);江苏省自然科学基金(No.BK20160709);南京农业大学校级SRT项目(No.1813A11)
作者简介: 李轶涵(2000-), 女, E-mail:14816111@njau.edu.cn
通讯作者(责任作者): 季跃飞(1982—), 副教授, 硕士生导师, 主要从事环境化学方面的研究.已在国内外学术刊物上发表研究论文50余篇.E-mail: yuefeiji@njau.edu.cn
摘要: 硫酸根自由基(SO4·-)高级氧化技术(SR-AOPs)是一种新型的原位化学氧化技术(ISCO),在水处理领域具有广阔的应用前景,可用于治理土壤和地下水中抗生素污染.本研究采用热活化过硫酸盐(PS)产生SO4·-,考察其对水溶液中抗生素卡巴多司(CBX)和奥喹多司(OQX)的降解效果,评估操作参数和水质成分对CBX降解的影响,并对CBX的降解产物进行鉴定.结果表明,与OQX相比,CBX更容易被热活化PS工艺氧化降解,这可能是因为CBX含有富电子的腙支链,而OQX含有惰性的酰胺支链.升高温度、增加PS浓度和降低溶液pH值均可显著促进CBX的降解.HCO3-的存在对CBX降解有促进作用,可能是由于生成的碳酸根自由基(CO3·-)参与了反应.Suwannee河富里酸(SRFA)具有双重影响,低浓度时促进CBX降解,而高浓度时呈现抑制作用.NO3-的存在对CBX的降解没有明显影响,而NO2-的存在可以显著抑制其降解.CBX在天然地表水中的降解效率低于在地下水中的效率,可能与不同水质中天然有机质的含量有关.产物鉴定表明,热活化PS氧化降解CBX生成了羟基化、脱氧和支链断裂产物,表明氧化反应主要改变了CBX分子中的腙支链和N-O结构.研究表明,热活化PS工艺可有效降解水溶液中的CBX和OQX,但在该技术实际应用时应充分评估天然水质成分的影响.
关键词:卡巴多司奥喹多司过硫酸盐硫酸根自由基降解
Thermally activated persulfate oxidation of antibiotics carbadox and olaquindox in aqueous solution
LI Yihan
 , JIANG Tian, ZHOU Xu, ZHAO Xulei, LU Junhe, JI Yuefei
, JIANG Tian, ZHOU Xu, ZHAO Xulei, LU Junhe, JI Yuefei

College of Resources and Environmental Sciences, Nanjing Agricultural University, Nanjing 210095
Received 10 April 2019; received in revised from 15 May 2019; accepted 15 May 2019
Abstract: Sulfate radical (SO4·-)-based advanced oxidation processes (SR-AOPs) are promising in-situ chemical oxidation technologies (ISCO) that can be utilized for remediation of soil and groundwater contaminated by organic pollutants such as antimicrobial agents. This work reports the degradation of antimicrobial agents, i.e., carbadox (CBX) and olaquindox (OQX), in aqueous solution by SO4·- generated by thermally activated persulfate (PS) process. The effects of operational parameters and water constituents on the degradation of CBX were evaluated, and degradation products of CBX were identified. Experimental results show that CBX was more amenable toward oxidation by thermally activated PS process, presumably due to the electron-rich hydrazine side chain. Increasing temperature and PS dosage as well as decreasing solution pH enhanced the oxidation of CBX appreciably. The presence of bicarbonate (HCO3-) promoted the degradation of CBX, possible due to the involvement of carbonate radical (CO3·-). Suwannee river fulvic acid (SRFA) played a dual role as low concentration of SRFA promoted the degradation of CBX while high concentration inhibited the degradation. The presence of nitrate (NO3-) had no significant impact on CBX degradation; however, the presence of nitrite (NO2-) could remarkably inhibit the removal efficiency. The degradation efficiency of CBX in natural surface water was lower than that in ground water, possibly due to the difference in natural organic matter contents in water matrix. Degradation products of CBX, including hydroxylated, deoxygenated, and side chain cleaving products were identified, suggesting that oxidation mainly altered the structures of hydrazine chain and N-O moieties. Our contribution suggests that thermally activated PS process are effective for degradation of CBX and OQX; however, the impacts of natural water constituents should be carefully evaluated before using this technology for environmental remediation.
Keywords: carbadoxolaquindoxpersulfatesulfate radicaldegradation
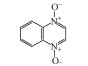
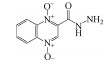
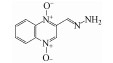
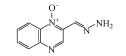
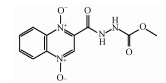
1 引言(Introduction)卡巴多司(CBX)和奥喹多司(OQX)是杂环氮氧化物抗生素, 广泛应用于畜牧和家禽养殖业, 可作为生长促进剂和抗菌剂(分子结构见图 1)(Walsh, 2003).CBX和OQX可通过农田施用动物粪便、饲料废物浸出和地表径流等多种途径进入地表水、地下水、土壤等环境介质, 从而对生态系统构成危害(Miao et al., 2004;Kummerer, 2009).一般而言, 环境中的抗生素会经历水解、吸附、生物转化和光解等过程, 从而影响其环境行为和归趋(Boxall et al., 2003).例如, CBX及其代谢物可吸附于土壤和沉积物, 且吸附量与有机碳和黏土矿物的含量密切相关(Strock et al., 2005).土壤矿物, 如水钠锰矿(δ-MnO2)能够氧化性降解CBX和OQX(Zhang et al., 2005).然而, 这些自然消减过程往往发生地非常缓慢, 对去除环境中抗生素污染作用有限.值得注意的是, 杂环氮氧化物及其衍生物对人和动物具有潜在致癌、致突变效应(Beutin et al., 1981).因此, 开发相关降解技术对治理杂环氮氧化物抗生素环境污染及消除其生态风险具有重要的现实意义.
图 1(Fig. 1)
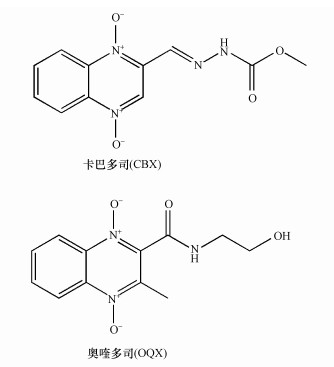 |
| 图 1 卡巴多司(CBX)和奥喹多司(OQX)的分子结构式 Fig. 1Molecular structures of carbadox (CBX) and olaquindox (OQX) |
在水处理工艺中, 氧化剂被广泛用于灭活病原微生物和去除有机污染物(Hommand et al., 2011).已有研究发现, 在典型的水处理条件下, CBX可与游离氯发生快速反应(Shah et al., 2006;Chamberlain et al., 2006), 其反应活性来源于分子结构中的腙官能团, 该活性位点在游离氯的攻击下可生成活性中间体, 进而在水质中其它亲核试剂的进攻下发生转化(Shah et al., 2006).然而, CBX的转化产物仍保留了N—O基团, 表明它们可能仍具有抗菌活性(Shah et al., 2006).目前, 利用其它氧化剂, 如高锰酸钾(KMnO4)、臭氧(O3)、羟基自由基(HO·)和硫酸根自由基(SO4·-)对CBX和OQX氧化降解的研究尚不多见.
硫酸根自由基高级氧化工艺(SR-AOPs)是近年来兴起的原位化学氧化技术(ISCO), 具有廉价高效、环境友好的优点, 在水处理和地下水修复领域具有广阔的应用前景(Matzek et al., 2016;Zhou et al., 2018;谷得明等, 2018).SO4·-可通过加热、紫外线、碱和过渡金属等方法激活过硫酸盐(PS, S2O82-)或过氧单硫酸盐(PMS, HSO5-)产生(Tistonaki et al., 2010;Devi et al., 2016).SO4·-是一种单电子氧化剂, 其氧化还原电位为2.5~3.1 V, 能够氧化许多有机污染物, 二级速率常数介于106~109 L·mol-1·s-1之间(Neta et al., 1977).已有研究表明, SR-AOPs可有效降解多种抗生素, 如磺胺类(Ji et al., 2015;Yang et al., 2017)、甲氧苄啶(Ji et al., 2016b)、氯霉素(Nie et al., 2014)、四环素(Ji et al., 2016a)和氟喹诺酮类(Jiang et al., 2016).研究发现, SO4·-能有效破坏抗生素的分子结构, 并使其抗菌活性丧失(Yang et al., 2017), 从而削弱其环境生态风险.
本研究以热活化PS工艺为反应体系, 评估SO4·-降解水溶液中CBX和OQX的效能, 系统考察温度、PS剂量、溶液pH值及天然水质成分对热活化PS降解CBX的影响.在此基础上, 通过质谱分析对CBX的降解产物进行鉴定, 并提出相应的反应机理与途径.本研究可为SR-AOPs用于修复环境中抗生素污染提供科学依据.
2 材料与方法(Materials and methods)2.1 试剂与材料卡巴多司(CBX, 99%)和奥喹多司(OQX, 99%)购自Sigma-Aldrich公司, 过硫酸钠(Na2S2O8, 99%)购自Aladdin公司, 色谱级甲醇和甲酸购自Burdick & Jackson公司, Suwannee河富里酸(SRFA, 1R101F)购自国际腐殖质协会(IHSS).其它试剂均为分析纯及以上级别.实验用水均为Milli-Q水(电阻率≥ 18 MΩ·cm).固相萃取(SPE)小柱(Oasis HLB, WAT106202)购自Waters公司.天然地表水及地下水分别采集自太湖及湖南浅层地下含水层, 经0.22 μm水相滤膜过滤后保存备用.2种天然水质的成分参见Jiang等(2016)的文献中.
2.2 降解实验所有反应均在33 mL EPA瓶中进行.反应液中CBX或OQX的初始浓度均为30 μmol·L-1, 溶液pH值用0.1 mol·L-1H2SO4或NaOH调节.将反应瓶置于恒温水浴锅中, 分别在0、10、20、30、45、60、90、120、180、240 min取出1 mL反应液和0.05 mL甲醇混合以终止反应, 待高效液相色谱仪(HPLC)分析.在上述反应体系中, 分别考察温度(50、60、70、80 ℃), Na2S2O8初始浓度(0.5、1、2、3 mmol·L-1), 溶液pH值(3、5、7、9、11), HCO3-浓度(1、10 mmol·L-1), SRFA浓度(1、5 mg·L-1), NO3-/NO2-浓度(0.2、2 mmol·L-1)对CBX降解的影响.部分实验采用实际天然水质, 不调节溶液pH值.所有动力学实验均设置3次平行, 取平均值计算.所有样品在HPLC分析前均置于4 ℃冰箱保存.
2.3 分析方法样品中的CBX及OQX浓度用Hitachi L-2000型HPLC进行分析.分析方法:Agilent Zorbax Eclipse Plus C18反相色谱柱(4.6 mm × 250 mm, 5 μm), 流动相为水(0.1%甲酸)和甲醇(0.1%甲酸)(体积比为65:35), 流速为1.0 mL·min-1, 进样量为10 μL, 采用二极管阵列检测器(DAD), 检测波长分别为302和257 nm.该分析条件下, CBX及OQX的保留时间分别为8.3和3.7 min.
2.4 产物鉴定配制100 mL反应液, 其中CBX初始浓度为30 μmol·L-1, Na2S2O8初始浓度为2 mmol·L-1, pH为7.0.将反应瓶置于60 ℃恒温水浴锅中反应240 min后取出, 置于冰水中冷却终止反应.
采用SPE对中间产物进行分离富集.依次用5 mL甲醇和5 mL超纯水活化HLB小柱, 然后将上述反应液移至HLB小柱中分离萃取, 最后用1 mL甲醇洗脱2次, 合并洗脱液.
采用配置电喷雾离子化接口(ESI)的Agilent 6410三重四极杆质谱仪(LC-MS/MS)对浓缩样品中的中间产物进行鉴定.首先, 在正离子模式下进行全扫描(50~500 m/z);随后对可能的产物进行产物离子扫描来确定其分子结构.质谱工作参数:毛细管电压为3.5 kV, 碎裂电压为135 V, 氮气(≥99.995%)作干燥气, 流速为10 L·min-1, 温度为350 ℃, 喷雾器压力为40 psi.液相工作参数:Agilent Zorbax Eclipse Plus C18反相色谱柱(2.1mm × 150 mm, 3.5 μm), 流动相A为水(0.1%甲酸), B为甲醇(0.1%甲酸)), 流速为0.25 mL·min-1, 进样量为10 μL, 采用梯度洗脱:0~1 min, 10%B;1~21 min, 10%~80%B;21~21.1 min, 80%~100%B;21.1~26 min, 100%B;26~26.1 min, 100%~10%B;26.1~30 min, 10%B.
3 结果与讨论(Results and discussion)3.1 温度的影响温度对热活化PS降解有机污染物的影响是至关重要的(Tistonaki et al., 2010).由图 2可知, 升高温度会使CBX降解速率明显加快.例如, 在温度为50 ℃、PS剂量为2 mmol·L-1条件下, 240 min内可以降解掉43.7%的CBX;当加热温度为60 ℃时, 在相同时间内可以降解掉98.6%的CBX.特别地, 当温度保持在80 ℃时, CBX在30 min内即被完全降解掉.预实验表明, CBX在单独加热情况下并不发生直接热解反应.
图 2(Fig. 2)
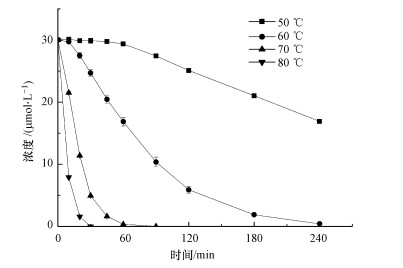 |
| 图 2 温度对热活化PS氧化降解CBX的影响 ([CBX]0=30 μmol·L-1; [PS]0=2 mmol·L-1; pH=7.0) Fig. 2Effects of temperature on the thermally activated PS oxidation of CBX |
在热活化PS过程中, 存在如下链式反应(式(1)~(4))(House, 1962):
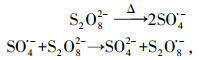 | (1) |
 | (2) |
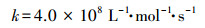 | (3) |
 | (4) |
值得注意的是, 在活化温度较低情况下, CBX的降解呈现出一个自催化行为, 即存在一个诱导加速阶段.如图 2所示, 加热温度为50 ℃时, 在反应的初始60 min内, 仅有极少量的CBX发生了转化;而在60~240 min这段时间内, CBX的降解速率显著加快.反应速率较慢的一段时间成为诱导期.当反应温度为60 ℃时, 亦可观察到诱导期的存在.但是与50 ℃相比, 60 ℃条件下的诱导期时间明显缩短.当反应温度设置为70 ℃或者80 ℃时, 没有发现诱导期的存在.
自催化的现象在前人研究Fenton氧化硝基苯的过程中被报道过, 其中半醌或羟醌中间体的生成促进了Fe3+还原为Fe2+, 进而与H2O2反应生成HO·, 从而加速了目标物的降解(Carlos et al., 2009).在此过程中, 半醌和羟醌中间体的生成成为整个反应的控速步骤, 它们在诱导期内慢慢生成和累积.据此推测, 本研究中CBX可能生成了某种中间产物, 促使PS分解生成SO4·-, 从而加速了其自身的降解.目前, CBX自催化的反应机制仍在进一步探究之中.
3.2 PS剂量的影响由图 3可知, PS剂量对热活化PS降解CBX具有重要影响.正如预期的那样, 增加PS剂量会促进CBX的降解, 这是由于高浓度PS可产生更多的氧化物种, 从而有利于CBX的降解(马京帅等, 2016).本研究中, 在60 ℃、0.5 mmol·L-1 PS条件下, 240 min内CBX的去除率仅为33%;而当PS剂量为2 mmol·L-1时, 在相同时间内CBX去除率高达98.6%.已有研究表明, 污染物降解速率与初始PS浓度成正比(Fan et al., 2015).然而, 进一步增加PS剂量可抑制CBX的降解, 可能由于副反应的加剧(式(2)和(3)).这些副反应可促进自由基与自由基反应, 从而降低自由基的利用效率, 进而抑制了目标物的降解(Tistonaki et al., 2010).
图 3(Fig. 3)
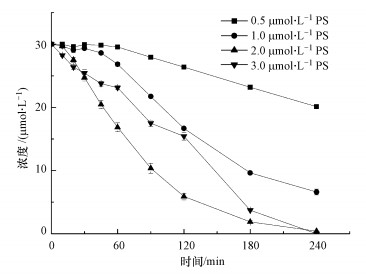 |
| 图 3 PS剂量对热活化PS氧化降解CBX的影响 ([CBX]0=30 μmol·L-1; [PS]0=2 mmol·L-1; pH=7.0) Fig. 3Effects of PS dosage on the thermally activated PS oxidation of CBX |
在低浓度PS条件下也观察到了CBX的自催化降解.此外, 随着PS用量的增加, CBX降解曲线的诱导期缩短.结果表明, 高浓度的PS有利于生成更多的SO4·-, 导致SO4·-氧化反应占据主导地位, 削弱了自催化反应的重要性.
3.3 溶液pH值的影响溶液的酸碱度对SO4·-氧化污染物起着重要作用.这是因为, 一方面pH值可改变活性自由基的分布;另一方面pH值可影响目标污染物的赋存状态和浓度(Liang et al., 2007).此外, 酸碱度也可能通过酸催化反应影响PS的分解, 酸催化反应可通过非自由基途径产生其它活性物质(House, 1961).
图 4表明, 随着溶液pH值的增加, CBX的降解率降低, 这与先前报道的热活化PS氧化其他污染物, 如甲基叔丁基醚(MTBE)和抗癫痫药物卡马西平(CBZ)所得到的结论相一致(Huang et al., 2002; Deng et al., 2013).由于CBX的pKa值为9.61, 在酸性溶液中, 其主要以质子化形态存在(腙官能团(—CH=Nα—NβH—)中的Nβ被质子化)(Zhang et al., 2005).胺基发生质子化后, 氮原子上的孤对电子被锁定, 从而不利于SO4·-的亲电攻击(Ji et al., 2015).因此, 在酸性条件下, CBX的较高降解率可能归因于PS的酸催化分解, 这可能产生了更多的活性物质, 促进了CBX降解(Kolthoff et al., 1951).
图 4(Fig. 4)
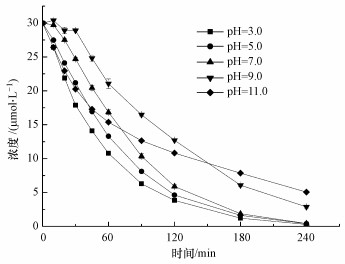 |
| 图 4 溶液pH值对热活化PS氧化降解CBX的影响 ([CBX]0=30 μmol·L-1; [PS]0=2 mmol·L-1; 温度=60 ℃) Fig. 4Effects of solution pH on the thermally activated persulfate oxidation of CBX |
有趣的是, CBX在pH 11.0时的初始降解速率比在pH 9.0时快.众所周知, 在碱性条件下, SO4·-可通过与H2O或OH-反应转化为HO·(式(5)和(6))(Peyton, 1993;Liang et al., 2007).不同于SO4·-, HO·是一种非选择性氧化剂, 与大多数有机化合物以扩散控制速率反应(1010 L·mol-1·s-1)(Buxton et al., 1988).据推测, HO·与CBX反应的二级速率常数可能大于SO4·-与CBX的反应.也有可能在pH为11.0时, 发生了碱活化PS过程(Furman et al., 2010), 这可能产生了额外的活性物质(SO4·-、HO·和O2·-), 从而促进了CBX的降解.以上原因可能解释了在pH为11.0条件下CBX的较高降解速率.然而, 在pH为11.0条件下, 240 min内CBX的去除效率低于在其它pH条件下获得的去除率, 这可能是由于随着反应的进行, 一部分HO·被降解产物所消耗, 从而抑制了母体的降解.
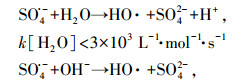 | (5) |
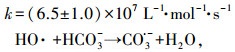 | (6) |
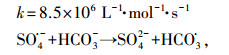 | (7) |
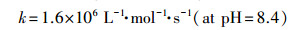 | (8) |
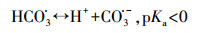 | (9) |
 |
| 图 5 HCO3-(pH=8.5)(a)和SRFA (pH=7.0)(b)的存在对热活化PS氧化降解CBX的影响 ([CBX]0=30 μmol·L-1; [PS]0=2 mmol·L-1; 温度=60 ℃) Fig. 5Effects of bicarbonate (pH=8.5) (a), and SRFA (pH=7.0) (b) on the thermally activated persulfate oxidation of CBX |
广泛存在于天然水体中的NOM可通过猝灭自由基、络合污染物、还原中间体自由基和激活PS等机制影响SR-AOPs对目标物的降解(Fang et al., 2013; Zhou et al., 2014; 马京帅等, 2016; Ji et al., 2017a).本实验选取SRFA作为NOM的典型代表, 研究其对热活化PS氧化CBX的影响, 结果如图 5b所示.由图可知, 低浓度(即1 mg·L-1)的SRFA促进了CBX的降解;而高浓度(即5 mg L-1)的SRFA则表现出抑制作用, 说明SRFA对热活化PS氧化CBX存在显著影响, 且影响机制与其浓度密切相关.
SRFA分子富含多种官能团, 如酚羟基、羧基和甲氧基等(Leenheer et al., 2003).其中, 酚羟基因其具有丰富的电子云密度而极易被亲电性的SO4·-攻击(Neta et al., 1977).SO4·-的攻击亦可导致SRFA分子中的羧基发生脱羧反应(Madhavan et al., 1978; Peyton, 1993).因此, SRFA对SO4·-的猝灭作用可以归因于这些活性官能团与SO4·-的反应活性.Zhou等(2017b)通过激光闪光光解技术(LFP)测量了一系列NOM与SO4·-的反应活性, 发现SRFA和SO4·-的反应速率常数高达(1.86 ± 0.26)× 103 L·mg·s-1.有趣的是, SRFA结构中的醌官能团也可对PS的活化产生重要影响.已有研究表明, 醌型化合物能够激活PS和PMS, 从而产生SO4·-, 进而促进有机污染物的转化(Fang et al., 2013; Zhou et al., 2014).此外, SRFA分子中的酚羟基和羧基部分可络合目标物或还原目标物自由基中间体, 从而抑制氧化反应的发生(Ji et al., 2017a).基于以上分析, 可以推测, 不同浓度SRFA对CBX降解的影响与其不同官能团的作用密切相关, 它们可以作为猝灭剂、络合剂、还原剂和活化剂.在低浓度条件下, SRFA可能作为活化剂发挥了重要的作用, 促进了CBX的降解(Fang et al., 2013).但在高浓度情况下, SRFA更多地扮演了猝灭剂的角色, 从而抑制了CBX的降解.
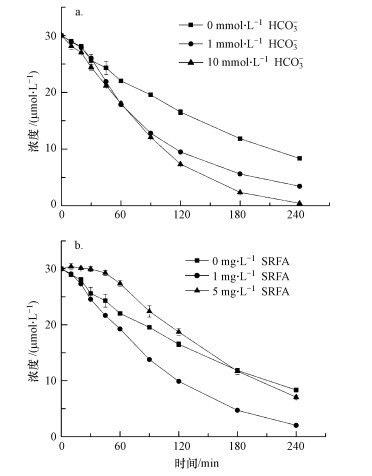
3.5 NO3-和NO2-的影响受农业和微生物活动的影响, 地表和地下水中通常含有较高浓度的NO3-和NO2-.因此, 研究NO3-和NO2-对热活化PS氧化CBX的影响是十分必要的.图 5表明, 0.2或2 mmol·L-1 NO3-的存在对CBX的降解无显著影响, 表明NO3-不能有效猝灭由热活化PS产生的活性自由基(SO4·-和HO·).该现象与NO3-的反应活性有关.NO3-是一种惰性的无机阴离子, 其与SO4·-反应的二级速率常数仅为2.1 × 100 L·mol-1·s-1(Neta et al., 1988).
 | (10) |
 | (11) |
图 6(Fig. 6)
 |
| 图 6 NO3-和NO2-的存在对热活化PS氧化降解CBX的影响 ([CBX]0=30 μmol·L-1; [PS]0=2 mmol·L-1; pH=7.0;温度=60 ℃) Fig. 6Effects of nitrate and nitrite on the thermally activated persulfate oxidation of CBX |
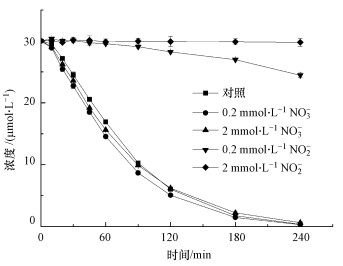
3.6 实际水质的影响通过采集地表水和地下水, 考察实际水质对热活化PS降解CBX的影响, 结果如图 7所示.由图可知, 在温度为60 ℃、PS剂量为2 mmol·L-1条件下, 反应240 min后, CBX在地表水和地下水中的去除率分别为63.2%和93.8%.该结果表明, CBX在地下水中的去除率明显高于在地表水中的去除率, 且前者与相同条件下纯水中的去除率相接近.这主要是由于地表水取自太湖, 受农业地表径流和人类活动影响显著, 含有较高浓度的天然有机质, TOC含量为13.19 mg·L-1;而地下水取自湖南浅层地下含水层, 含有较低浓度的天然有机质, TOC含量仅为4.05 mg·L-1 (Jiang et al., 2016).如上所述, 天然有机质可有效猝灭热活化PS过程中生成的活性自由基.可以推测, 在地表水质中, 高浓度的天然有机质可猝灭更多的活性自由基, 这可能是造成CBX去除率更低的原因.
图 7(Fig. 7)
 |
| 图 7 实际水质对热活化PS氧化降解CBX的影响 ([CBX]0=30 μmol·L-1; [PS]0=2 mmol·L-1; 温度=60 ℃) Fig. 7Effects of real water matrix on the thermally activated persulfate oxidation of CBX |
3.7 热活化PS降解OQX有机物的分子结构特征对热活化PS工艺的处理效率具有重要影响.与CBX相比, OQX在相同温度下的降解效率较低(图 8与图 2).例如, 在50 ℃、2 mmol·L-1 PS条件下, 大约43.7%的CBX在240 min内被降解;而仅有6.6%的OQX在相同时间内被去除.该结果可以由CBX与OQX的分子结构差异来解释.CBX和OQX均含有一个喹噁啉N, N′-二氧化物(喹叨啉)结构单元, 它们的区别在于侧链的不同:CBX具有一个腙支链, 而OQX拥有一个酰胺支链.虽然CBX的腙支链包含一个吸电子的羧基, 但Nβ具有很高的反应活性(Zhang et al., 2005).相比之下, OQX的酰胺支链不利于SO4·-的亲电攻击.例如, Zhou等(2017a)研究了UV/PS降解泛影酸, 发现SO4·-难以氧化其酰胺支链.此外, CBX的喹叨啉单元上面含有一个没有被取代的ɑ-碳位;而OQX分子中的ɑ-碳位被一个甲基所取代.已有研究表明, ɑ-碳位在喹叨啉的氧化降解中起着关键作用.例如, Zhang等(2005)研究发现, 在水钠锰矿(δ-MnO2)介导的CBX氧化过程中, α-碳位发生的取代反应是速率决定步骤.值得注意的是, 甲基取代基也可能因其空间位阻效应而阻碍OQX的氧化.上述原因可能共同导致了OQX较低的反应活性.必须注意, 单独加热不能导致OQX降解.此外, 在80 ℃条件下, OQX的降解效率类似于CBX, 这可能是由于高温条件下, 热活化PS产生大量活性自由基, 反应比较剧烈, 使得2种抗生素的降解差异性缩小.
图 8(Fig. 8)
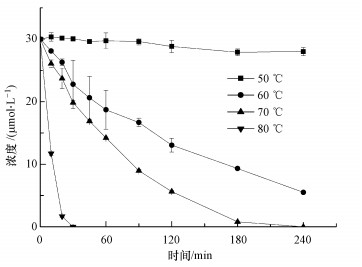 |
| 图 8 温度对热活化PS氧化降解OQX的影响 ([OQX]0=30 μmol·L-1; [PS]0=2 mmol·L-1; pH=7.0) Fig. 8Effects of temperature on the thermally activated persulfate oxidation of OQX |
表 1(Table 1)
| 表 1 CBX降解产物的质谱数据和推测的结构 Table 1 Mass spectrometry data and proposed structures of the degradation products of CBX | |||||||||||||||||||||||||||||||||||
表 1 CBX降解产物的质谱数据和推测的结构 Table 1 Mass spectrometry data and proposed structures of the degradation products of CBX
| |||||||||||||||||||||||||||||||||||
3.8 降解产物采用SPE-LC-MS/MS对热活化PS氧化CBX过程中的产物进行分析.依据降解产物的分子离子和二级碎片的质谱信息, 可以推测它们的分子结构.图 9为在正离子全扫描模式下CBX降解产物的总离子流色谱图(TIC).由图所示, 一共鉴定出6种产物, 分别以TP1~TP6表示, 它们的质谱数据及推测的可能结构列于表 1.比较产物与CBX的分子结构可知, 氧化反应主要改变了CBX分子中的腙支链和N—O结构.其中, TP1和TP3分别是CBX脱除整个腙支链和甲酸甲酯支链(—C(O)OCH3)的产物.TP4和TP6分别是CBX脱氧化物和羟基化产物.而TP2和TP5分别是TP6和TP4进一步脱除甲酸甲酯支链的产物.
图 9(Fig. 9)
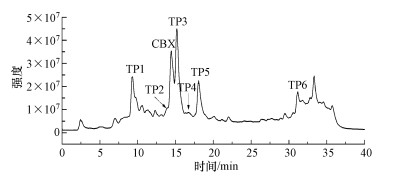 |
| 图 9 CBX降解产物的总离子流图 Fig. 9Total ion chromatogram (TIC) of CBX degradation products |
3.9 反应机理与途径热活化PS产生的活性自由基主要包括SO4·-和HO·, 其中SO4·-在酸性和中性条件下占据主导地位, 而在碱性条件下HO·是主要的自由基(Zhao et al., 2013;廖云燕等, 2014).如上所述, CBX分子结构中的腙官能团在其氧化降解中起着重要作用, 其中Nβ是活性位点, 易于遭受亲电试剂如SO4·-的进攻.SO4·-通常以单电子转移机制与富电子的胺反应, 生成氮阳离子自由基, 该自由基不稳定, 容易发生脱质子化反应, 生成较为稳定的氮中心自由基(Ji et al., 2015).据此推测, SO4·-进攻CBX腙官能团中的Nβ将生成相应的氮中心自由基, 由于腙官能团的特殊结构, 该自由基可通过共振作用生成碳中心自由基共振体, 从而得到进一步稳定, 见式(12)(Zhang et al., 2005).这些氮或碳中心自由基随后可能发生了键断裂反应, 生成了脱除整个腙支链(TP1)或脱除甲酸甲酯支链的产物(TP3).
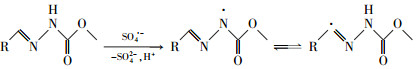 | (12) |
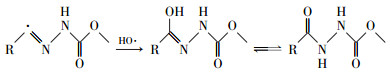 | (13) |
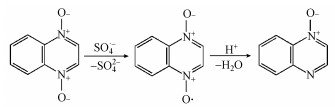 | (14) |
图 10(Fig. 10)
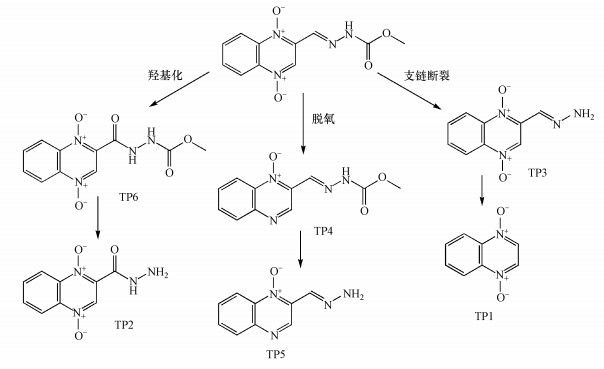 |
| 图 10 热活化PS氧化降解CBX的反应途径 Fig. 10Reaction pathways for the oxidative degradation of CBX by thermally activated PS process |
4 结论(Conclusions)热活化PS可有效降解水溶液中的抗生素CBX和OQX.与OQX相比, CBX更容易降解.升高温度、增加PS用量及降低溶液pH值均可显著促进CBX的降解.HCO3-的存在对CBX的降解起了促进作用, 而高浓度的SRFA则呈现抑制作用.NO3-的存在对CBX的降解没有显著影响, 但NO2-能显著抑制CBX降解.CBX在实际地下水中的降解效率高于在地表水中的效率.热活化PS降解CBX主要生成支链断裂、脱氧及羟基化产物.
参考文献
| Anipsitakis G P, Dionysiou D D, Gonzalez M A. 2006. Cobalt-mediated activation of peroxymonosulfate and sulfate radical attack on phenolic compounds. Implications of chloride ions[J]. Environmental Science & Technology, 40(3): 1000–1007. |
| Berlin A A. 1986. Kinetics of radical-chain decomposition of persulfate in aqueous solutions of organic compounds[J]. Kinetics Catalysis, 27: 34–39. |
| Beutin L, Preller E, Kowalski B. 1981. Mutagenicity of quindoxin, its metabolites, and two substituted quinoxaline-di-N-oxides[J]. Antimicrob Agents Chemother, 20(3): 336–343.DOI:10.1128/AAC.20.3.336 |
| Boxall A, Kolpin D, Holling-Sorensen B, et al. 2003. Are veterinary medicines causing environmental risks?[J]. Environmental Science & Technology, 37: 287A–294A. |
| Buxton G V, Greenstock C L, Helman W P, et al. 1988. Critical review of rate constants of hydrate electrons, hydrogen atoms and hydroxyl radicals (OH·/O·-) in aqueous solution[J]. Journal of Physics Chemistry Reference Data, 17: 513–886.DOI:10.1063/1.555805 |
| Canonica S, Kohn T, Mac M, et al. 2005. Photosensitizer method to determine rate constants for the reaction of carbonate radical with organic compounds[J]. Environmental Science & Technology, 39(23): 9182–9188. |
| Carlos L, Fabbri D, Capparelli A L, et al. 2009. Effect of simulated solar light on the autocatalytic degradation of nitrobenzene using Fe3+ and hydrogen peroxide[J]. Journal of Photochemistry Photobiology A: Chemistry, 201(1): 32–38.DOI:10.1016/j.jphotochem.2008.09.012 |
| Chamberlain E, Adams C. 2006. Oxidation of sulfonamides, macrolides, and carbadox with free chlorine and monochloramine[J]. Water Research, 40(13): 2517–2526.DOI:10.1016/j.watres.2006.04.039 |
| Deng J, Shao Y, Gao N, et al. 2013. Thermally activated persulfate (TAP) oxidation of antiepileptic drug carbamazepine in water[J]. Chemical Engineer Journal, 228: 765–771.DOI:10.1016/j.cej.2013.05.044 |
| Devi P, Das U, Dalai A J. 2016. In-situ chemical oxidation: Principle and applications of peroxide and persulfate treatments in wastewater systems[J]. Science of the Total Environment, 571: 643–657.DOI:10.1016/j.scitotenv.2016.07.032 |
| Fang G, Gao J, Dionysiou D D, et al. 2013. Activation of persulfate by quinones: free radical reactions and implication for the degradation of PCBs[J]. Environmental Science & Technology, 47(9): 4605–4611. |
| Fan Y, Ji Y, Kong D, et al. 2015. Kinetic and mechanistic investigations of the degradation of sulfamethazine in heat-activated persulfate oxidation process[J]. Journal of Hazardous Materials, 300: 39–47.DOI:10.1016/j.jhazmat.2015.06.058 |
| Furman O S, Teel A L, Watts R J. 2010. Mechanism of base activation of persulfate[J]. Environmental Science & Technology, 44(16): 6423–6428. |
| Geletii Y V, Strelets V V, Shafirovich V Y, et al. 1989. Cation radicals of heterocyclic N-oxides and their reactions[J]. Heterocycles, 28(2): 677–685.DOI:10.3987/COM-88-S113 |
| 谷得明, 郭昌胜, 冯启言, 等. 2018. 基于硫酸根自由基的高级氧化技术及其在环境治理中的应用[J]. 环境化学, 2018, 37(11): 2489–2508.DOI:10.7524/j.issn.0254-6108.2018012102 |
| Homem V, Santos L. 2011. Degradation and removal methods of antibiotics from aqueous matrices-a review[J]. Journal of Environmental Management, 92(10): 2304–2347.DOI:10.1016/j.jenvman.2011.05.023 |
| House D A. 1962. Kinetic and mechanisms of oxidations by peroxydisulfate[J]. Chemical Reviews, 62(3): 185–203.DOI:10.1021/cr60217a001 |
| Huang J P, Mabury S A. 2000. Steady-state concentrations of carbonate radicals in field waters[J]. Environmental Toxicology Chemistry, 19(9): 2181–2188.DOI:10.1002/etc.5620190906 |
| Huang K C, Couttenye R A, Hoag G E. 2002. Kinetics of heat-assisted persulfate oxidation of methyl tert-butyl ether (MTBE)[J]. Chemosphere, 49(4): 413–420.DOI:10.1016/S0045-6535(02)00330-2 |
| Ji Y, Fan Y, Liu K, et al. 2015. Thermo activated persulfate oxidation of antibiotic sulfamethoxazole and structurally related compounds[J]. Water Research, 87: 1–9.DOI:10.1016/j.watres.2015.09.005 |
| Ji Y, Shi Y, Dong W, et al. 2016a. Thermo-activated persulfate oxidation system for tetracycline antibiotics degradation in aqueous solution[J]. Chemical Engineer Journal, 298: 225–233.DOI:10.1016/j.cej.2016.04.028 |
| Ji Y, Shi Y, Wang L, et al. 2017a. Sulfate radical-based oxidation of antibiotics sulfamethazine, sulfapyridine, sulfadiazine, sulfadimethoxine, and sulfachloropyridazine: formation of SO2 extrusion products and effects of natural organic matter[J]. Science of the Total Environment, 593-594: 704–712.DOI:10.1016/j.scitotenv.2017.03.192 |
| Ji Y, Wang L, Jiang M, et al. 2017b. The role of nitrite in sulfate radical-based degradation of phenolic compounds: an unexpected nitration process relevant to groundwater remediation by in-situ chemical oxidation (ISCO)[J]. Water Research, 123: 249–257.DOI:10.1016/j.watres.2017.06.081 |
| Ji Y, Xie W, Fan Y, et al. 2016b. Degradation of trimethoprim by thermo-activated persulfate oxidation: reaction kinetics and transformation mechanisms[J]. Chemical Engineer Journal, 286: 16–24.DOI:10.1016/j.cej.2015.10.050 |
| Jiang C, Ji Y, Shi Y, et al. 2016. Sulfate radical-based oxidation of fluoroquinolone antibiotics: kinetics, mechanisms and effects of natural water matrices[J]. Water Research, 106: 507–517.DOI:10.1016/j.watres.2016.10.025 |
| Kolthoff I M, Miller I K. 1951. The chemistry of persulfate. Ⅰ. The kinetics and mechanism of the decomposition of the persulfate ion in aqueous medium[J]. Journal of the American Chemical Society, 73(7): 3055–3059.DOI:10.1021/ja01151a024 |
| Kümmerer K. 2009. Antibiotics in the aquatic environment-a review-Part Ⅰ[J]. Chemosphere, 75(4): 417–434.DOI:10.1016/j.chemosphere.2008.11.086 |
| Leenheer J A, Croué J P. 2003. Characterizing dissolved aquatic organic matter[J]. Environmental Science & Technology, 37(1): 19A–26A. |
| Liang C, Wang Z, Bruell C J. 2007. Influence of pH on persulfate oxidation of TCE at ambient temperature[J]. Chemosphere, 66(1): 106–113.DOI:10.1016/j.chemosphere.2006.05.026 |
| Liang C, Wang Z, Mohanty N. 2006. Influences of carbonate and chloride ions on persulfate oxidation of trichloroethylene at 20 ℃[J]. Science of the Total Environment, 370(2/3): 271–277. |
| 廖云燕, 刘国强, 赵力, 等. 2014. 利用热活化过硫酸盐技术去除阿特拉津[J]. 环境科学学报, 2014, 34(4): 931–937. |
| 马京帅, 吕文英, 刘国光, 等. 2016. 吉非罗齐在热活化过硫酸盐体系中的降解机制研究[J]. 环境科学学报, 2016, 36(10): 3774–3783. |
| Maddigapu P R, Vione D, Ravizzoli B, et al. 2010. Laboratory and field evidence of the photonitration of 4-chlorophenol to 2-nitro-4-chlorophenol and of the associated bicarbonate effect[J]. Environmental Science Pollution Research, 17(5): 1063–1069.DOI:10.1007/s11356-009-0260-z |
| Madhavan V, Levanon H, Neta P. 1978. Decarboxylation by SO4·- radicals[J]. Radiation Research, 76(1): 15–22.DOI:10.2307/3574923 |
| Matzek L W, Carter K E. 2016. Activated persulfate for organic chemical degradation: A review[J]. Chemosphere, 151: 178–188.DOI:10.1016/j.chemosphere.2016.02.055 |
| Miao X S, Bishay F, Chen M, et al. 2004. Occurrence of antimicrobials in the final effluents of wastewater treatment plants in Canada[J]. Environmental Science & Technology, 38(13): 3533–3541. |
| Neta P, Huie R E, Ross A B. 1988. Rate constants for reactions of inorganic radicals in aqueous solution[J]. Journal of Physical and Chemical Reference Data, 17(3): 1027–1284.DOI:10.1063/1.555808 |
| Neta P, Madhavan V, Zemel H, et al. 1977. Rate constants and mechanism of reaction of SO4·- with aromatic compounds[J]. Journal of the American Chemical Society, 99: 163–164.DOI:10.1021/ja00443a030 |
| Nie M, Yang Y, Zhang Z, et al. 2014. Degradation of chloramphenicol by thermally activated persulfate in aqueous solution[J]. Chemical Engineer Journal, 246: 373–382.DOI:10.1016/j.cej.2014.02.047 |
| Peyton G R. 1993. The free-radical chemistry of persulfate-based total organic carbon analyzers[J]. Marine Chemistry, 41(1/3): 91–103. |
| Shah A D, Kim J H, Huang C H. 2006. Reaction kinetics and transformation of carbadox and structurally related compounds with aqueous chlorine[J]. Environmental Science & Technology, 40(23): 7228–7235. |
| Strock T J, Sassman S A, Lee L S. 2005. Sorption and related properties of the swine antibiotic carbadox and associated N-oxide reduced metabolites[J]. Environmental Science & Technology, 39(9): 3134–3142. |
| Schwarzenbach R P, Gschwend P M, Imboden D M. 2003. Eds. Environmental Organic Chemistry [M]. John Wiley & Sons, Inc.: Hoboken, N.J |
| Tistonaki A, Petri B, Crimi M, et al. 2010. In situ chemical oxidation of contaminated soil and groundwater using persulfate: A review[J]. Critical Review in Environmental Science & Technology, 40(1): 55–91. |
| Waldemer R H, Tratnyek P G, Johnson R L, et al. 2007. Oxidation of chlorinated ethenes by heat-activated persulfate: Kinetics and products[J]. Environmental Science & Technology, 41(3): 1010–1015. |
| Walsh C. 2003. Antibiotics: action, origins, resistance[M]. ASM press, Washington, DC. |
| Yang Y, Lu X, Jiang J, et al. 2017. Degradation of sulfamethoxazole by UV, UV/H2O2 and UV/persulfate (PDS): Formation of oxidation products and effect of bicarbonate[J]. Water Research, 118: 196–207.DOI:10.1016/j.watres.2017.03.054 |
| Zhang H, Huang C H. 2005. Reactivity and transformation of antibacterial N-oxides in the presence of manganese oxide[J]. Environmental Science & Technology, 39(2): 593–601. |
| Zhang R, Sun P, Boyer T H, et al. 2015. Degradation of pharmaceuticals and metabolite in synthetic human urine by UV, UV/H2O2, and UV/PDS[J]. Environmental Science & Technology, 49(5): 3056–3066. |
| Zhao D, Liao X, Yan X, et al. 2013. Effect and mechanism of persulfate activated by different methods for PAHs removal in soil[J]. Journal of Hazardous Materials, 254-255: 228–235.DOI:10.1016/j.jhazmat.2013.03.056 |
| Zhou L, Ferronato C, Chovelon J M, et al. 2017a. Investigations of diatrizoate degradation by photo-activated persulfate[J]. Chemical Engineer Journal, 311: 28–36.DOI:10.1016/j.cej.2016.11.066 |
| Zhou L, Sleiman M, Ferronato C, et al. 2017b. Reactivity of sulfate radicals with natural organic matters[J]. Environmental Chemistry Letters, 15(4): 733–737.DOI:10.1007/s10311-017-0646-y |
| Zhou Y, Jiang J, Gao Y, et al. 2015. Activation of peroxymonosulfate by benzoquinone: a novel nonradical oxidation process[J]. Environmental Science & Technology, 49(21): 12941–12950. |
| Zhou Y, Xiang Y, He Y, et al. 2018. Applications and factors influencing of the persulfate-based advanced oxidation processes for the remediation of groundwater and soil contaminated with organic compounds[J]. Journal of Hazardous Materials, 359: 396–407.DOI:10.1016/j.jhazmat.2018.07.083 |