 , 程德义, 代静玉
, 程德义, 代静玉
 , 杜琪雯, 邵爱云
, 杜琪雯, 邵爱云南京农业大学资源与环境科学学院, 南京 210095
收稿日期: 2018-12-29; 修回日期: 2019-02-28; 录用日期: 2019-02-28
基金项目: 江苏省高校自然科学研究面上项目(No.15KJB610002)
作者简介: 杜超(1993-), 女, E-mail:2016103030@njau.edu.cn
通讯作者(责任作者): 代静玉, E-mail:daijy@njau.edu.cn
摘要: 溶解性有机质(DOM)在光辐射下可以吸收光能产生活性氧物质(Reactive oxygen species,ROS),如单线态氧(1O2),羟基自由基(HO·)及激发三线态DOM(3DOM*)等,这些ROS对污染物的光化学反应起着重要的作用.本实验在254 nm紫外光辐射下,利用特征ROS探针化合物,探究4种不同来源土壤DOM光致产生ROS能力的差异.通过XAD-8树脂分组将2种不同来源DOM分成5个组分,进一步探究DOM结构对ROS生成的影响.研究发现,来源于黄褐土、潮土的DOM分别产生1O2、HO·的能力较强,而来源于黄褐土的富里酸及潮土的胡敏酸产生3DOM*的能力较强,说明不同来源DOM在光辐射下产生ROS的能力不同.紫外光谱分析表明,分子量较大、腐殖化程度较高的腐殖酸产生ROS的能力较强,且富里酸与胡敏酸对ROS生成的影响存在差异.整体来看,2种腐殖酸的不同分组组分对ROS生成的影响趋势相似,水与乙醇组分所产生的影响非常小,低pH值组分对ROS生成的影响比高pH值大.结合红外光谱分析,研究发现,低pH值组分的腐殖酸羧基含量较高,脂肪族官能团含量低,含氧量高,可能具有较高的光化学活性,有利于ROS的生成.此外,2种腐殖酸不同组分对ROS生成的影响存在差异,说明DOM结构中官能团的可解离程度对ROS生成具有一定影响.
关键词:溶解性有机质活性氧物种探针化合物分组
Differences in the ability of dissolved organic matter from different sources to produce reactive oxygen species under light irradiation
DU Chao
 , CHENG Deyi, DAI Jingyu
, CHENG Deyi, DAI Jingyu
 , DU Qiwen, SHAO Aiyun
, DU Qiwen, SHAO Aiyun College of resources and Environmental Sciences, Jiang su Nanjing Agricultural University, Nanjing 210095
Received 29 December 2018; received in revised from 28 February 2019; accepted 28 February 2019
Abstract: Reactive oxygen species (ROS) photo-generated by dissolved organic matter (DOM) that absorbs light energy under radiation, such as singlet oxygen (1O2), hydroxyl radical (HO·) and excited triplet states of DOM (3DOM*), play important roles in the photochemical reaction of pollutants. In this experiment, the difference in ROS formation by irradiated DOM with four different sources of soil was investigated by using special probe compounds under 254 nm UV radiation. According to the XAD-8 fractionation, the DOM from two different sources was divided into five components to further explore the influence of DOM structure on ROS formation. We found that DOM derived from yellow clunamon soil and fluvo-aquic soil had stronger ability to produce 1O2 and HO·, respectively; while the fulvic acid derived from yellow cinnamon soil and the humic acid from fluvo-aquic soil had strong ability to produce 3DOM*. These results suggested that different sources of DOM had different abilities to produce ROS under light radiation. Ultraviolet spectrum analysis showed that the humic acid with higher molecular weight and higher degree of humification had stronger ability to produce ROS, and the effect between fulvic acid and humic acid on ROS formation was different. Overall, the effects of different components of the two humic acids on ROS formation were similar, the effects of water and ethanol components were negligible, and the low pH component had a greater effect on ROS formation than the high pH component. Combined with the analysis of infrared spectroscopy, we found that the low pH component had high content of carboxyl group and low content of the aliphatic functional group and, therefore, the content of oxygen was high, which had high photo-activity. In addition, there was a difference in the formation of ROS between the two components of humic acid, indicating that the dissociation degree of functional groups in DOM structure had a certain influence on ROS formation.
Keywords: dissolved organic matterreactive oxygen speciesprobe compoundsgrouping
1 引言(Introduction)溶解性有机质(Dissolved Organic Matters, DOM)是普遍存在于自然环境中, 由动植物残体经生物、化学及生物化学过程产生的芳香族化合物和脂肪族化合物的复杂混合物, 其结构与成分非常复杂, 并且具有一定的地域差异性.腐殖酸是溶解性有机质的主要成分, 其包括富里酸(FA)和胡敏酸(HA)(Chen et al., 2002; 何伟等, 2017).腐殖酸能通过其吸附及络合作用改变污染物的环境行为及存在状态, 并且, 腐殖酸是活跃于地表水体与土壤中的天然光敏化剂, 其自身的光学性质在污染物的光化学反应途径中起着至关重要的作用(Dalrymple et al., 2010).因此, DOM的环境行为备受环境化学领域的关注.
大多数DOM含有大量的苯环、羧基、羟基等发色基团, 可以直接吸收特定波长的光能, 产生单线态氧(1O2)、羟基自由基(HO·)和激发三重态(3DOM*)等活性氧物种(Reactive Oxygen Species, ROS), 这些活性氧物种可以诱导有机污染物发生一系列光化学反应而使其降解(Dutta Majumdar et al., 2017).有研究表明, 多环芳烃菲与不同来源DOM反应的光降解速率受1O2含量的影响, 1O2含量增多可以促进菲的光降解(Cai et al., 2017); 不同来源的腐殖酸对17β-雌二醇(E2)光降解速率的影响不同主要是由于HO·的作用(杨小霞等, 2015); 不同来源DOM对抗生素磺胺嘧啶(SMR)降解的影响不同, SMR的降解速率与3DOM*的稳态浓度呈显著相关(Batista et al., 2016); 通过与3DOM*光化学反应, 消除了地表水中大量苯基脲除草剂, 并且1O2, HO·参与不同污染物的消除(Lester et al., 2013).因此, ROS在有机污染物光化学转化中的重要作用值得我们对其进行更加深入的了解.
DOM的结构十分复杂, 不同来源DOM的结构不同, 分子量大小不同, 所含基团不同, 并且, 在不同的化学条件下, 由于其解离和质子化程度不同, 其水溶性、亲疏水性、极性均不同(Yu et al., 2008; Hodgkins et al., 2016), 这决定了DOM结构与ROS生成之间的复杂性.使用13C核磁共振光谱(NMR)测定出腐殖酸的芳香性与产生活性氧物种含量之间未观察到相关性, 羧基的相对丰度和DOM中活性氧物种含量之间观察到正指数关系, 而烷基碳的相对丰度和活性氧物种含量之间观察到负指数关系(Yabuta et al., 2008), 用电子顺磁共振(EPR)结合化学探针方法测定出来自于生物质炭的DOM中的醌类结构是影响1O2和HO·在光照下形成的主要因素(Fang et al., 2015).这些研究结果表明在光辐射下ROS的产生与DOM的结构有关.由于DOM组成及结构的复杂性, 有研究将DOM按照分子量, 极性或亲疏水性进一步分组, 从而减小研究DOM对有机污染物影响的复杂性, 而DOM的极性或亲疏水性主要是由含氧官能团决定的(Maizel et al., 2017).有研究表明, 腐殖酸对2, 4-二氯苯氧乙酸的光解抑制作用是强极性组分比弱极性组分更明显(Rezaei et al., 2016), XAD-4树脂分组DOM的5个亚组分, 疏水性有机酸(HPO-A)在通过1O2机制促进体中菲光降解方面最有效(Xue et al., 2018).这些研究成果均将DOM的组成和结构与ROS的生成紧紧联系在一起, 然而, 这方面的研究相对较少.
因此, 考虑到对腐殖酸光学性质影响最大的是腐殖酸的分子结构和特征官能团, 本研究通过XAD-8树脂分级的方法, 根据腐殖酸不同的解离程度及亲水性质将其分为5个组分(Charles et al., 2012), 从而减小腐殖酸结构的复杂性, 并利用在光辐射下与活性氧物种结合的特定探针化合物(Lester et al., 2013)与腐殖酸及其各个组分反应, 探究不同来源土壤中的DOM在光辐射下产生ROS能力的不同, 以及这些不同来源DOM的光学性质与ROS形成之间的关系.
2 材料与方法(Materials and methods)2.1 实验材料糠醇(FFA), 对氯苯甲酸(pCBA)、2, 4, 6-三甲基苯酚(TMP)、磷酸氢二钾(KH2PO4)、叔丁醇、叠氮化钠、标准腐殖酸(Humic acid, FA>99%)均为分析纯, 甲醇、甲酸、磷酸均为色谱纯.
供试土壤来源于潮土, 采自于北京大兴区水稻土(土壤pH为7.25, 有机碳含量为16.03 g·kg-1); 红壤采自于江西鹰潭旱地农田土(土壤pH为4.84, 有机碳含量为25.23 g·kg-1); 黄棕壤采自于云南曲靖耕地土(土壤pH为7.18, 有机碳含量为30.01 g·kg-1); 黄褐土采自于江苏南京紫金山森林土壤(土壤pH为6.71, 有机碳总量为32.26 g·kg-1).
2.2 实验方法2.2.1 土壤中富里酸和胡敏酸的提取和纯化腐殖酸的提取参照国际腐殖酸协会推荐的方法(IHSS):供试土壤经稀硫酸洗涤后, 在酸洗过的待试土壤中加入一定量的1 mol·L-1 NaOH溶液后充分振荡均匀, 用pH计测量溶液的pH, 直到溶液的pH值为13后, 再加入0.1 mol·L-1 NaOH溶液浸提, 振荡4 h后静置过夜(可加入无水Na2SO4帮助沉淀)后离心分离, 重复操作直至上清液呈淡黄色或者无色.收集上清液, 用4 mol·L-1 H2SO4溶液调整pH至2以下, 静置过夜后离心分离, 上清液为富里酸, 沉淀部分为胡敏酸.同时进一步对富里酸和胡敏酸进行纯化处理, 将富里酸通过阳离子交换树脂以去除结合在腐殖酸上的金属离子, 利用HCl-HF混合液反复处理胡敏酸以除去其灰分, 并将胡敏酸通过透析膜以除去游离的金属离子和小分子物质.所有的腐殖酸样品包括来源于黄褐土的富里酸(F1)和胡敏酸(H1), 来源于潮土的富里酸(F2)和胡敏酸(H2), 来源于黄棕壤的富里酸(F3)和胡敏酸(H3)和来源于红壤的富里酸(F4)和胡敏酸(H4).
2.2.2 富里酸F1(来源于黄赫土)和标准腐殖酸N0(FA>99%)的分组采用XAD-8树脂分组法将来源于黄褐土的富里酸F1和对照的标准腐殖酸N0(FA>99%)分组, 腐殖酸通过XAD-8树脂并被吸附在树脂上, 用pH4.8、pH7、pH11的通用缓冲液以及水和乙醇按顺序淋洗吸附在XAD-8树脂上的腐殖酸, 得到pH4.8、pH7、pH11、水和乙醇5个组分, 经冷冻干燥后备用.
2.2.3 活性氧物种(1O2, ·OH, 3DOM*)的检测方法理想的探针化合物应该对目标反应物质具有选择性, 并且在紫外光辐射下较为稳定, 不会轻易衰变(Timko et al., 2014).有研究表明, 通常单氧自由基(1O2)的生成由化合物糠醇(FFA)探测, FFA可与1O2发生选择性反应; 选择对氯苯甲酸(pCBA)作为HO·的探针化合物pCBA的直接光解相对较慢; 使用2, 4, 6-三甲基苯酚(TMP)来检测3DOM*(Scully et al., 2010; Fadi et al., 2010); 这3种化合物均可以用灵敏度较高的高效液相色谱(HPLC)进行测定.
2.2.4 光化学实验光化学实验在BL-GHX-V光化学反应仪中进行, 采用定制的波长为254 nm的紫外汞灯作为光源, 光源与反应体系的距离是固定不可调的, 紫外灯与反应体系的距离为8 cm, 反应箱连通冷却循环水, 控制反应温度为(25±1) ℃, 反应溶液置于定制的石英试管待反应.添加的FFA、pCBA、TMP的浓度分别为24、15、0.5 mmol·L-1, 所用的腐殖酸溶液的浓度均为1.5 mg·L-1.所有的光化学实验均至少一式两份进行实验.
2.2.5 分析方法在特定的光照时间30 min下取样, 置于棕色液相小瓶中, 使用含有不同百分比甲醇的水进行等度洗脱, 然后使用高效液相色谱仪HPLC-UV(Agilent, 型号1260, XDB-8 C18柱4.6 mm×150 mm)对探针化合物FFA、pCBA和TMP的降解进行测定.使用TOC分析仪测定不同来源土壤的富里酸和胡敏酸, 及富里酸F1和标准腐殖酸N0的各分组组分的总有机碳(TOC)的含量.使用Lambda35型号UV-VIS分光光度计测定腐殖酸的紫外可见吸收光谱.使用β1-8 LD冷冻干燥仪将腐殖酸冷冻干燥.使用Nexus 870型傅里叶变换红外光谱仪测定腐殖酸的红外光谱.
3 结果与讨论(Results and discussion)3.1 不同来源DOM及按XAD-8树脂分组组分的特征分析3.1.1 不同来源土壤DOM紫外可见吸收光谱分析由图 1可知, 溶解性有机质的紫外光谱图中并无明显的特征峰, 整体上, 样品吸光度随着波长的增大呈单调下降趋势, 并且不同来源土壤DOM的吸光度值具有一定的差异性.
图 1(Fig. 1)
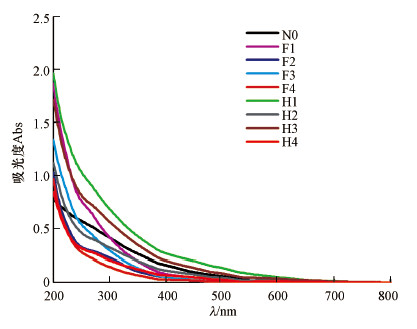 |
| 图 1 不同来源溶解性有机质的紫外可见吸收光谱图 (注:N0、F1、F2、F3、F4、H1、H2、H3、H4依次表示为标准腐殖酸、黄褐土富里酸、潮土富里酸、黄棕壤富里酸、红壤富里酸、黄褐土胡敏酸、潮土胡敏酸、黄棕壤胡敏酸、红壤胡敏酸.) Fig. 1UV-VIS absorption spectra of dissolved organic matter from different sources |
在300~600 nm波长范围内, 同种土壤胡敏酸的吸光度均大于富里酸, 其中, 黄褐土的胡敏酸H1吸光度最高.常用于分析紫外可见光谱的指标有:254 nm处的DOM单位有机碳吸光度(SUVA254, mg·L-1·m-1)和250 nm与365 nm处吸光度的比值(E2/E3)可以用来表征DOM分子量大小, DOM分子量的大小与SUVA254的值呈正相关, 与E2/E3的值呈负相关(Helms et al., 2008); 280 nm处的DOM单位有机碳吸光度(SUVA280, mg·L-1·m-1)可以间接反映DOM的腐殖化程度, 且两者呈正相关关系(Fu et al., 2010); 350 nm与550 nm处吸光度的比值(E3/E5)及465 nm与665 nm处吸光度的比值(E4/E6)也是评价DOM芳香化或腐殖化程度的潜在因素, 并且DOM芳香化或腐殖化程度的大小与E3/E5及E4/E6呈负相关(Zhu et al., 2017).由表 1的数据分析可知, 不同来源土壤DOM的分子量大小及腐化程度均不同, 来源于同种土壤的胡敏酸分子量一般大于富里酸, 并且F1>F3>F2>F4, H1>H3>H2>H4, 说明所用的土壤样本中腐殖酸分子量大小是黄褐土>黄棕壤>潮土>红壤; 来源于同种土壤中胡敏酸的腐殖化程度一般大于富里酸, 黄褐土中腐殖酸的腐殖化程度最大, 这与分子量大小趋势的分析结果相似, 一般来说, 腐殖酸的腐殖化程度增大或者其结构中苯环增多, 腐殖酸的分子量也会随之增大; 标准腐殖酸N0的分子量大小及腐殖化程度均处在富里酸及胡敏酸之间.
表 1(Table 1)
| 表 1 不同来源溶解性有机质紫外参数特征分析 Table 1 Analysis of ultraviolet parameter characteristics of dissolved organic matter from different sources | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 不同来源溶解性有机质紫外参数特征分析 Table 1 Analysis of ultraviolet parameter characteristics of dissolved organic matter from different sources
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.1.2 XAD-8树脂分组的富里酸F1和标准腐殖酸N0各组分含量分析本文选取来源于黄褐土的富里酸及标准腐殖酸N0, 因为用XAD-8树脂分组法(Dai et al., 2006)无法将富里酸及胡敏酸同时分级成5个组分, 由于胡敏酸自身性质, 只溶于碱不溶于酸, 无法分组出pH4.8组分.因此本文选择了TOC相对高的黄褐土F1和作为对照的标准腐殖酸N0(FA>99%), 以对比腐殖酸分组后的结构差异, 胡敏酸的分组在本文暂不讨论.
由表 2可知, 经过淋洗液对腐殖酸的依次淋洗, 各组分含量依次降低, 其中pH 4.8、pH 7及pH 11的含量的占比和超过了总含量的90%, pH4.8组分占比最多, 水和乙醇组分的含量低于总含量的10%, 乙醇组分占比最少, 这与腐殖酸的解离程度有关, 说明腐殖酸存在着大量可解离基团.
表 2(Table 2)
| 表 2 富里酸F1及腐殖酸N0各组分占其总含量的比值 Table 2 The ratio of the components of fulvic acid F1 and humic acid N0 to their total content | ||||||||||||||||||||||||
表 2 富里酸F1及腐殖酸N0各组分占其总含量的比值 Table 2 The ratio of the components of fulvic acid F1 and humic acid N0 to their total content
| ||||||||||||||||||||||||
各组分占总含量的比值由公式(1)计算得到.
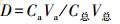 | (1) |
3.1.3 XAD-8树脂分组的富里酸F1和标准腐殖酸N0各组分红外光谱分析由于水与乙醇组分占腐殖酸总含量比不超过10%, 含量非常低, 所以未对水与乙醇组分做出红外光谱的分析.傅里叶变换红外光谱是用来表征DOM结构中官能团特征的手段之一, 参照红外吸收光谱相似吸收峰的归属(Stevenson et al., 1982; 张玉兰等, 2010)对上述光谱图进行分析.由图 2可知, 腐殖酸各组分的光谱图具有相似的变化规律, 说明各组分腐殖酸的结构相似, 在3700~2500 cm-1波数段的谱峰可归属于强而宽的缔合醇羟基—OH伸缩振动吸收, 在1717 cm-1波数附近存在着羧基和羰基官能团的—C=O伸缩振动, 在1650 cm-1附近存在着芳香环的骨架C=C振动, 在1450~1440 cm-1波数段的谱峰可归属于脂肪族CH3和CH2中C—H的振动, 羧基上的不对称伸缩振动或C—OH的变形振动, 1250 cm-1附近存在着羧酸官能团的C—O伸展振动和O—H变形振动, 这表明腐殖酸是由大量的含氧不饱和官能团及脂肪族基团构成.
图 2(Fig. 2)
 |
| 图 2 富里酸(F1)与腐殖酸(N0)的pH 4.8、pH 7、pH 11组分的红外光谱图 Fig. 2FTIR spectra of various fractions(pH4.8, pH7, pH11) isolated from the fulvic acid(F1) and humic acid(N0) |
各组分的结构虽然相似但存在着差异, 在2600 cm-1波数附近各组分均存在一个吸收肩峰, 强度按照pH4.8、pH7、pH11依次减弱, 在1717 cm-1附近出现的吸收峰也随着组分pH的增大降低, 这些现象说明各组的腐殖酸中含氧不饱和官能团含量不同, 羧基含量不同, pH4.8组分中这些基团的含量高于其他两个组分, 在1650 cm-1附近的吸收峰按照pH 4.8、pH7、pH11依次增强, 并且在1450~1400 cm-1波数段附近出现的吸收峰是pH值越大吸收峰越强, 这说明pH值高的组分中的脂肪族官能团含量更高.这与前人(刘本定等, 2007)的研究结果基本一致.
3.2 不同来源DOM在光辐射下产生活性氧基团的情况分析图 3中探针化合物的光化学降解符合伪一级动力学规律, 表 3中的k值表示探针化合物去除直接光解的一级速率常数.通过图 3中探针化合物的光降解曲线的不同可知, 不同来源DOM在光辐射下产生活性氧基团的能力是不同的, 根据上述对DOM结构的分析, 这些不同很大程度是因为不同来源DOM结构的差异.
图 3(Fig. 3)
 |
| 图 3 不同来源富里酸和胡敏酸中探针化合物FFA、pCBA、TMP的光降解曲线 Fig. 3Photodegradation curves of probe compounds (FFA, pCBA, TMP) from fulvic acid and humic acid from different sources |
表 3(Table 3)
| 表 3 不同来源富里酸和胡敏酸中探针化合物FFA、pCBA、TMP的光降解动力学参数 Table 3 Photodegradation kinetic parameters of probe compounds (FFA, pCBA, TMP) from fulvic acid and humic acid from different sources | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 3 不同来源富里酸和胡敏酸中探针化合物FFA、pCBA、TMP的光降解动力学参数 Table 3 Photodegradation kinetic parameters of probe compounds (FFA, pCBA, TMP) from fulvic acid and humic acid from different sources
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
由图 3a及表 3可知, 在光辐射条件下不同DOM产生1O2能力的大小分别是F1>F3>F2>F4, H1>H3>H2>H4, 并且同一来源土壤中的富里酸产生1O2的能力均大于胡敏酸; 由图 3b及表 2可知, 在光辐射条件下不同DOM产生HO·能力的大小分别为F2>F1>F3>F4, H2>H1>H3>H4, 这与上述分析的1O2的情况有所不同, 其中在F4和H4作为反应背景液的体系中, 对氯苯甲酸的降解缓慢, 甚至小于对氯苯甲酸的直接光解, 我们猜测这一现象的出现可能是由于F4与H4反应体系中没有HO·的产生, 导致降解缓慢, 并且有文献指出腐殖酸在太阳光谱(>290 nm)中具有很强的吸光度, 可以与共存的有机污染物或化合物竞争光能(Xia et al., 2009; Zhang et al., 2011), 这说明在这一体系中腐殖酸F4与H4大分子竞争能量和光子的能力可能较强, 与对氯苯甲酸竞争能量和光子, 导致其降解甚至小于对氯苯甲酸的直接光解.与1O2相同, 同一来源土壤中的富里酸产生HO·的能力是大于胡敏酸的; 由图 3c及表 2可知, 在光辐射条件下不同来源DOM产生3DOM*的能力大小为F1>F2>F3>F4, H2>H1>H3>H4, 这与上述不同来源DOM产生1O2和HO·能力的分析都不同, 然而同一来源土壤中富里酸产生3DOM*的能力也是大于胡敏酸的.由以上分析可知, 不同来源土壤DOM分别诱导产生1O2、HO·、3DOM*的能力不同, 对1O2、HO·、3DOM*分别产生的影响规律不同.这一结果进一步阐述了不同来源DOM对多环芳烃、抗生素类等有机污染物的光化学降解的影响是不同的这一现象可能存在的原因(Batista et al., 2016; Cai et al., 2017).其中, 来源于黄褐土的DOM产生1O2的能力最强, 来源于潮土的DOM产生HO·的能力最强, 而来源于黄褐土的富里酸和潮土的胡敏酸产生3DOM*的能力最强, 并且富里酸与胡敏酸对ROS生成的影响也不同.
结合上述对于DOM紫外光谱的分析, 我们猜测, 不同来源富里酸和胡敏酸产生ROS的能力与其腐殖化程度及分子量大小有关, 也有研究表明, 活性氧物质特别是单线态氧和羟基自由基的生成与陆地腐殖质类物质的腐殖化程度密切相关(Timko et al., 2014).分别比较可以得出富里酸和胡敏酸产生ROS的能力基本随着腐殖化程度及分子量的增大而增大, 而将同一来源富里酸与胡敏酸相比较也发现了其中的差异性.这些结果均表明不同来源DOM对ROS产生影响的不同很大程度是由于其结构的差异性, 为了进一步探究DOM结构对ROS产生的影响, 对来源于黄褐土的富里酸F1及标准腐殖酸N0的分组组分进行ROS产生的光化学研究.
3.3 XAD-8树脂分组组分在光辐射下产生活性氧基团的情况分析由图 4各组分中探针化合物的降解曲线可知, 通过XAD-8分组后的不同组分在光辐射下产生活性氧物种的能力是不同的, 水和乙醇组分对ROS的产生的影响很小, 几乎可以忽略不计, pH4.8、pH7、pH11组分对ROS生成的影响相比较水与乙醇组分而言较为显著, 且这3个组分中的探针化合物的降解曲线之间的差距并不大.这可能是由于腐殖酸在通过梯度淋洗分组后, 不同分组组分间的结构会发生变化, 同一分组组分的腐殖酸结构变得相对均匀(Dai et al., 2006).表 4中的k值表示探针化合物去掉直接光解反应后的一级反应速率常数, 由表 4可知, 在2种不同腐殖酸的分级组分中, 3种探针化合物的光降解规律相似, 均是在pH4.8组分中降解最快, 表明pH4.8组分光致产生ROS的能力最强, 其次是pH7及pH11组分, 水和乙醇组分中的探针化合物降解非常缓慢, 接近直接光降解反应, 故这两个组分对ROS生成的影响很小.这些结果表明各组分的解离程度不同, 所有的含氧官能团不同, 光致产生ROS的能力也不同.
图 4(Fig. 4)
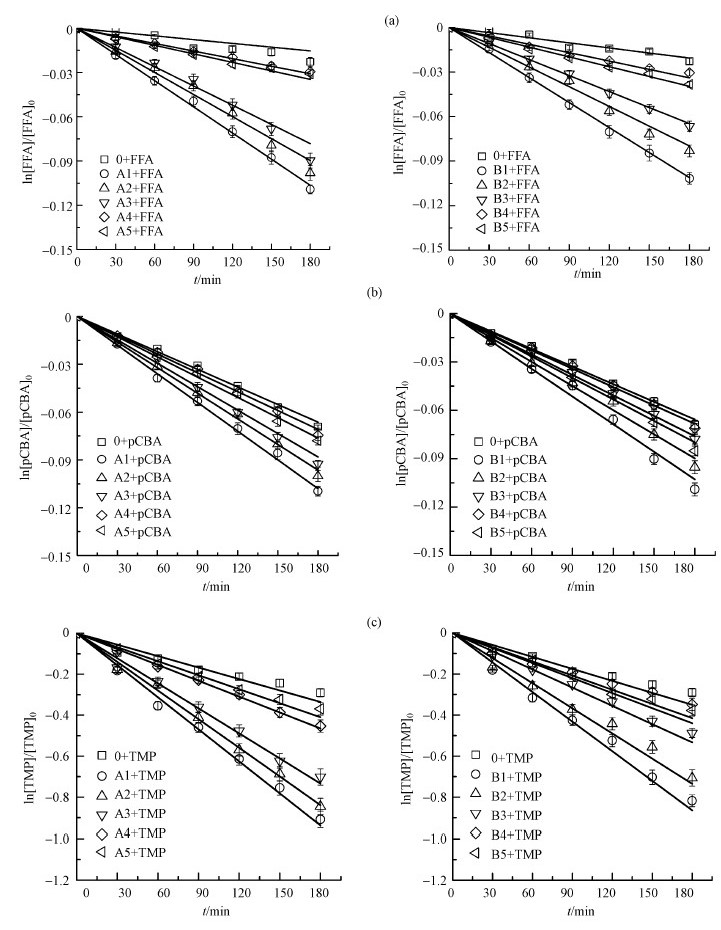 |
| 图 4 富里酸F1和腐殖酸N0各组分中探针化合物FFA、pCBA、TMP的光降解曲线 Fig. 4Photodegradation curves of probe compounds (FFA, pCBA, TMP) various fractions isolated from in fulvic acid(F1) and humic acid(N0) |
表 4(Table 4)
| 表 4 富里酸F1和腐殖酸N0各组分中探针化合物FFA、pCBA、TMP的光降解动力学参数 Table 4 Photodegradation kinetic parameters of probe compounds (FFA, pCBA, TMP) in various fractions isolated from fulvic acid(F1) and humic acid(N0) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 4 富里酸F1和腐殖酸N0各组分中探针化合物FFA、pCBA、TMP的光降解动力学参数 Table 4 Photodegradation kinetic parameters of probe compounds (FFA, pCBA, TMP) in various fractions isolated from fulvic acid(F1) and humic acid(N0)
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
虽然2种腐殖酸的不同组分对ROS生成的影响规律整体相似, 但其中也存在着差异, 将标准腐殖酸N0的pH 4.8、pH 7、pH 11 3种组分B1、B2、B3之间相互比较, 对于ROS生成影响的差异性比富里酸F1的3种组分A1、A2、A3之间的差异性大, 由图 4和表 4可知, 对于1O2, B1与B2和B2与B3之间的k值差分别为0.00011和0.00009, 而A1与A2和A2与A3之间的k值差分别为0.00008和0.00005;对于HO·, B1与B2和B2与B3之间的k值差分别为0.00079和0.00081, 而A1与A2和A2与A3之间的k值差分别为0.00055和0.00036;对于3DOM*, B1与B2和B2与B3之间的k值差分别为0.00074和0.00108, 而A1与A2和A2与A3之间的k值差分别为0.00046和0.00064.由此可见, B1、B2、B3 3种组分之间降解曲线之间的差距及k值差均大于A1、A2、A3之间的差距, 这说明不同腐殖酸按照相同的方法分组之后组分之间存在着一定的差异性, 从而对ROS生成的影响不同.
结合各组分的傅里叶变换红外光谱分析, 从整体来看, 低pH值组分中羧基含量较高, 而高pH值组分中脂肪族官能团含量较高.我们猜测, 低pH值组分中, 由于其羧基成分含量较高, 含氧量较高, 而脂肪族官能团含量较低, 光解产生活性氧物种的能力高于高pH值腐殖酸组分, 这与已有研究表明, 在光辐射条件下, 含氧基团在吸收光能后可以激发产生更多的1O2和HO·的结论相一致(Maddigapu et al., 2011).并且, B1、B2、B3 3种组分的红外光谱图之间的差异也比A1、A2、A3三者之间的差异大, 说明N0各分组组分之间的组成成分及结构差异较大, 这可能是N0各组分对ROS生成影响的差异性比F1各组分大的原因.
4 结论(Conclusions)1) 在来源不同的4种土壤中提取的腐殖酸在光辐射下对ROS生成的影响不同, 来源于黄褐土的富里酸F1和胡敏酸H1光致产生1O2的能力最强, 来源于潮土的富里酸F2和胡敏酸H2光致产生HO·的能力最强, 来源于黄褐土的富里酸F1和潮土的胡敏酸H2光致产生3DOM*的能力最强, 这说明不同来源DOM在光辐射下产生活性氧物种的能力不同, 并且富里酸与胡敏酸对ROS生成的影响有一定的差异, 结合紫外光谱分析得出, 分子量大及腐殖化程度高的富里酸和胡敏酸产生ROS的能力较强.
2) 通过XAD-8分组的各组分腐殖酸对ROS生成的影响不同, 整体来看2种腐殖酸分组组分对于ROS生成的影响规律相似, 结合红外光谱的分析, 水与乙醇组分所产生影响非常小, 低pH值组分的腐殖酸羧基含量较高, 脂肪族官能团含量低, 含氧量高, 光辐射下生成ROS的能力比高pH值组分强, 但2种腐殖酸各组分之间对于ROS生成影响的差异性是不同的, N0各组分B1、B2、B3之间相互比较, 对ROS生成影响的差异性比富里酸F1各组分A1、A2、A3之间的差异性大, 由红外光谱图得知, N0各组分之间的组成及结构差异性比F1各组分大.这说明DOM结构中含氧官能团的可解离程度对ROS的生成有一定影响.
参考文献
| Batista A P, Teixeira A C, Cooper W J, et al. 2016. Correlating the chemical and spectroscopic characteristics of natural organic matter with the photodegradation of sulfamerazine[J]. Water Research, 93: 20–29.DOI:10.1016/j.watres.2015.11.036 |
| Cai D, Yang X, Wang S, et al. 2017. Effects of dissolved organic matter derived from forest leaf litter on biodegradation of phenanthrene in aqueous phase[J]. Journal of Hazardous Materials, 324: 516–525. |
| Charles M. Sharpless. 2012. Lifetimes of triplet dissolved natural organic matter (DOM) and the effect of nabh4 reduction on singlet oxygen quantum yields:Implications for DOM photophysics[J]. Environmental Science & Technology, 46(8): 4466–4473. |
| Chen J, Gu B, Leboeuf E J, et al. 2002. Spectroscopic characterization of the structural and functional properties of natural organic matter fractions[J]. Chemosphere, 48(1): 59–68.DOI:10.1016/S0045-6535(02)00041-3 |
| Dai J, Ran W, Xing B, et al. 2006. Characterization of fulvic acid fractions obtained by sequential extractions with pH buffers, water, and ethanol from paddy soils[J]. Geoderma, 135: 284–295.DOI:10.1016/j.geoderma.2006.01.003 |
| Dalrymple R M, Carfagno A K, Sharpless C M. 2010. Correlations between dissolved organic matter optical properties and quantum yields of singlet oxygen and hydrogen peroxide[J]. Environmental Science & Technology, 44(15): 5824. |
| Dutta Majumdar R, Bliumkin L, Lane D, et al. 2017. Analysis of DOM phototransformation using a looped NMR system integrated with a sunlight simulator[J]. Water Research, 120: 64–76.DOI:10.1016/j.watres.2017.04.067 |
| Fadi A H, Davide V, Serge C, et al. 2010. Reactive photoinduced species in estuarine waters. Characterization of hydroxyl radical, singlet oxygen and dissolved organic matter triplet state in natural oxidation processes[J]. Photochemical & Photobiological Sciences, 9(1): 78–86. |
| Fang G, Zhu C, Dionysiou D D, et al. 2015. Mechanism of hydroxyl radical generation from biochar suspensions:Implications to diethyl phthalate degradation[J]. Bioresource Technology, 176: 210–217.DOI:10.1016/j.biortech.2014.11.032 |
| Fu P Q, Mostofa K M G, Wu F C, et al. 2010. Excitation-emission matrix characterization of dissolved organic matter sources in two eutrophic lakes (Southwestern China Plateau)[J]. Geochemical Journal Gj, 44(2): 99–112.DOI:10.2343/geochemj.1.0047 |
| Helms J R, Stubbins A, Ritchie J D, et al. 2008. Absorption spectral slopes and slope ratios as indicators of molecular weight, source, and photobleaching of chromophoric dissolved organic matter[J]. Limnology & Oceanography, 53(3): 955–969. |
| Hodgkins S B, Tfaily M M, Podgorski D C, et al. 2016. Elemental composition and optical properties reveal changes in dissolved organic matter along a permafrost thaw chronosequence in a subarctic peatland[J]. Geochimica Et Cosmochimica Acta, 187: 123–140.DOI:10.1016/j.gca.2016.05.015 |
| 何伟, 白泽琳, 李一龙, 等. 2016. 溶解性有机质特性分析与来源解析的研究进展[J]. 环境科学学报, 2016, 36(2): 359–372. |
| 刘本定, 李夏, 代静玉. 2007. XAD树脂分组水稻土富里酸组分的脂肪族特性[J]. 光谱学与光谱分析, 2007, 27(10): 2032–2037. |
| Lester Y, Sharpless C M, Mamane H, et al. 2013. Production of photo-oxidants by dissolved organic matter during UV water treatment[J]. Environmental Science & Technology, 47(20): 11726–11733. |
| Maizel A C, Remucal C K. 2017. Molecular Composition and Photochemical Reactivity of Size-Fractionated Dissolved Organic Matter[J]. Environmental Science & Technology, 51(4): 2113–2123. |
| Mostafa A M, Rosario-Ortiz F I. 2013. Singlet oxygen formation from wastewater organic matter[J]. Evironmental Science & Technology, 47(15): 8179–8186. |
| Rezaei R, Mohseni M. 2016. Impact of natural organic matter on the degradation of 2, 4-dichlorophenoxy acetic acid in a fluidized bed photocatalytic reactor[J]. Chemical Engineering Journal, 310(2): 457–463. |
| Scully N M, Cooper W J, Tranvik L J. 2010. Photochemical effects on microbial activity in natural waters:the interaction of reactive oxygen species and dissolved organic matter[J]. Fems Microbiology Ecology, 46(3): 353–357. |
| Stevenson F J. 1982. Humus chemistry:genesis, composition, reactions[J]. Soil Science, 135(2): 129–130. |
| Timko S A, Romera-Castillo C, Rudolf Jaffé, et al. 2014. Photo-reactivity of natural dissolved organic matter from fresh to marine waters in the Florida Everglades, USA[J]. Environmental Science:Processes & Impacts, 16(4): 866–878. |
| Xia X, Li G, Yang Z, et al. 2009. Effects of fulvic acid concentration and origin on photodegradation of polycyclic aromatic hydrocarbons in aqueous solution:Importance of active oxygen[J]. Environmental Pollution, 157(4): 1352–1359. |
| Xue S, Sun J, Liu Y, et al. 2018. Effect of dissolved organic matter fractions on photodegradation of phenanthrene in ice[J]. Journal of Hazardous Materials, 361: 30–36. |
| Yabuta H, Fukushima M, Kawasaki M, et al. 2008. Multiple polar components in poorly-humified humic acids stabilizing free radicals:Carboxyl and nitrogen-containing carbons[J]. Organic Geochemistry, 39(9): 1319–1335.DOI:10.1016/j.orggeochem.2008.05.007 |
| Yu C H, Wu C H, Lin C H, et al. 2008. Hydrophobicity and molecular weight of humic substances on ultrafiltration fouling and resistance[J]. Separation & Purification Technology, 64(2): 206–212. |
| 杨小霞, 马晓冬, 顾丽鹏, 等. 2015. DOM结构特征及其对17β-雌二醇光降解的影响[J]. 中国环境科学, 2015, 35(5): 1375–138.DOI:10.3969/j.issn.1000-6923.2015.05.012 |
| Zhang S, Chen J, Xie Q, et al. 2011. Comment on "Effect of dissolved organic matter on the transformation of contaminants induced by excited triplet states and the hydroxyl radical"[J]. Environmental Science & Technology, 45(18): 7945–7946. |
| Zhu Y, Song Y, Yu H, et al. 2017. Characterization of dissolved organic matter in Dongjianghu Lake by UV-visible absorption spectroscopy with multivariate analysis[J]. Environmental Monitoring & Assessment, 189(9): 443. |
| 张玉兰, 孙彩霞, 陈振华, 等. 2010. 红外光谱法测定肥料施用26年土壤的腐殖质组分特征[J]. 光谱学与光谱分析, 2010, 30(5): 1210–1213.DOI:10.3964/j.issn.1000-0593(2010)05-1210-04 |
