 , 杜青平1
, 杜青平1
 , 刘涛1, 石瑛2, 李嘉懿1, 彭皇强1, 林俊熙1, 秦春怡1
, 刘涛1, 石瑛2, 李嘉懿1, 彭皇强1, 林俊熙1, 秦春怡11. 广东工业大学环境科学与工程学院, 广州 510006;
2. 太原师范学院生物系, 太原 030619
收稿日期: 2018-09-04; 修回日期: 2018-12-03; 录用日期: 2018-12-03
基金项目: 广东省科技计划项目(No.2015A020215031);山西省科技基础条件平台建设项目(No.2015091004-0102);2013年高校"131"领军人才工程优秀中青年拔尖创新人才项目
作者简介: 刘倩(1993-), 女, E-mail:2312277344@qq.com
通讯作者(责任作者): 杜青平, E-mail:qpdu2008@126.com
摘要: 采用半静态暴露的方法,以大型溞的死亡率、显微结构损伤、蜕皮率、游泳行为等作为毒性测试终点,研究不同浓度纳米氧化锌(ZnONP)对大型溞(Daphnia magna)的毒性效应.结果显示,ZnONP水溶液稳定性差,在溶液中沉降率随着浓度增大而增大,Zeta电位降低.ZnONP对大型溞处理48 h的半数致死浓度LC50为3 mg·L-1,ZnONP致大型溞的死亡率呈现一定的时间-效应关系;ZnONP暴露会使大型溞肠道和体表损伤.经显微结构观察发现,ZnONP可粘附在大型溞体表面,并引起大型溞游泳的垂直高度升高,大型溞蜕皮时间延迟,成功蜕皮率降低.结果表明ZnONP对大型溞个体和行为产生一定的毒性效应,其毒性效应的机理与其颗粒物对大型溞肠道和体表粘附有直接的关系,研究结果对合理地评价纳米材料对水生生物的影响有一定的理论参考价值.
关键词:纳米氧化锌大型溞毒性效应蜕皮
Study on the toxicity effects of nanometer zinc oxide on Daphnia magna
LIU Qian1
 , DU Qingping1
, DU Qingping1
 , LIU Tao1, SHI Ying2, LI Jiayi1, PENG Huangqiang1, LIN Junxi1, QIN Chunyi1
, LIU Tao1, SHI Ying2, LI Jiayi1, PENG Huangqiang1, LIN Junxi1, QIN Chunyi1 1. School of Environmental Science and Engineering, Guangdong University of Technology, Guangzhou 510006;
2. Biology Department, Taiyuan Normal University, Taiyuan 030619
Received 4 September 2018; received in revised from 3 December 2018; accepted 3 December 2018
Abstract: The potential toxicity effects of nanometer zinc oxide (ZnONP) concentration on Daphnia magna were investigated with semi-static exposure method. The toxicity assessment was determined by the main endpoints which were indicated by the following, factors like mortality rate, surface structure damage, molting successful rate, swimming behavior and etc. The results showed that the stability of ZnONP in solution was poor. The settling rate of ZnONP particles increased with the increasing concentrations of ZnONP in solution while the zeta potential decreased. LC50 of Daphnia magna being exposed to ZnONP solution for 48 h was 3 mg·L-1. The mortality of Daphnia magna increased with the ZnONP exposure time, which presented a relationship between time and the effect. Under the microscopy, it was found that the damage of intestinal tract and body surface was caused by the exposure of Daphnia magna to ZnONP solution. ZnONP particles were adhered on the surface of Daphnia magna body. In addition, the vertical height of the swimming of the magna increased, the molting time of Daphnia magna was delayed and the successful molting rates were declined. The results revealed that ZnONP had potential toxicity effects on Daphnia magna and their behaviors. The toxicity mechanism of ZnONP on Daphnia magna was directly related to the damage of intestines and the surface adhesion of Daphnia magna. The results have a certain theoretical reference value for the reasonable evaluation of nanomaterials on aquatic organisms.
Keywords: nano-zinc oxideDaphnia magnatoxicity effectsmolting
1 引言(Introduction)金属纳米材料由于其独特的性质而被广泛应用, 纳米氧化锌(nanometer zinc oxide, ZnONP)是最常用的纳米金属材料之一, 主要应用于塑料、陶瓷、玻璃、遮光剂、医药及食品等领域(De et al., 2013), 在其大量生产和使用过程中, 不可避免的通过呼吸、皮肤、消化道等进入生物体内, 具有潜在的生物毒性效应(Zhu et al., 2012).水体是人工纳米材料的主要归宿, 其在水体中对水生生物的个体行为和生物安全引起极大关注(Xiao et al., 2015; Adam et al., 2015).研究报道羊角月牙藻(Selenastrum capricornutum)在浓度为45 mg·L-1的ZnONP悬浮液暴露24 h, 其生长抑制率高达95%, 细胞数量降低, 且ZnONP对藻细胞产生氧化胁迫, 破坏了细胞的抗氧化酶系统平衡(刘建新等, 2016).Kaya等(2015; 2016)发现, 不同粒径的ZnONP会造成尼罗罗非鱼(Oreochromis niloticus)的器官损伤, 10~30 nm粒径比100 nm粒径的ZnONP毒性更高, 呈现了严重的氧化应激症状, 且在罗非鱼肠道积累最高.朱小山等(2008)研究了不同纳米材料对大型溞的毒性大小, 发现ZnONP对大型溞的毒性最大, 为剧毒, 而纳米氧化铝最小, 基本无毒或低毒.因此ZnONP对水生生态具有潜在的毒性, 但其对水生生物种群, 尤其是低等水生动物的毒性效应特征尚不明确.
大型溞(Daphnia magna)作为国际公认的标准试验生物(Adema, 1978), 具有生命周期短、繁殖快、饲养经济、对环境中多种化学物质的变化非常敏感等优点(Liu et al., 2017), 同时其以藻类为食物, 是水生生态系统中的初级消费者, 又是鱼类等的重要饵料, 在淡水食物链中具有重要的作用(Harris et al., 2014), 目前已被广泛应用于水体环境污染监测和水生生物毒性试验和评价(Li et al., 2010; Fan et al., 2011).因此本研究选用大型溞作为试验生物, 以不同浓度的ZnONP作为研究对象, 以死亡率、显微结构损伤、蜕皮率、游泳行为作为毒性效应终点指标, 试图探究ZnONP对大型溞的毒性效应特征, 为合理的评价纳米材料对水生生物的潜在毒性提供科学依据.
2 材料和方法(Material and methods)2.1 实验动物大型溞取自广东省微生物研究所, 已在本实验室培养多代, 并保持良好的生长状态, 使其繁殖被约束在孤雌生殖的状态.培养水为经自然曝气至少24 h的稀释液, 水温控制在(21±1) ℃, 光强为2000 lx, 光照周期为光照16 h:黑暗8 h, 培养用水每周换3次, 每天喂食斜生栅藻(Scenedesmus obliquus).
2.2 ZnONP悬浮液的配制及表征2.2.1 试验药品CaCl2·2H2O、MgSO4·7H2O、NaHCO3、KCl等均为分析纯, ZnONP购自上海麦克林公司, 干燥粉末状, 纯度> 99%, 粒径为(30 ± 5) nm.
2.2.2 人工稀释液的配制① 标准稀释液的制备在使用前一天进行.制备标准稀释液的试剂为分析纯, 去离子水电导率≤ 10 μS·cm-1.配制方法如下:将11.76 g氯化钙(CaCl2·2H2O)、4.93 g硫酸镁(MgSO4·7H2O)、2.59 g碳酸氢钠(NaHCO3)、0.23 g氯化钾(KCl)分别溶解于去离子水中, 并稀释到1000 mL, 作为贮备液;在900 mL去离子水中依次加入以上4种贮备液各25 mL, 混合均匀即为稀释液.
② 使用前, 对稀释液强化曝气, 使稀释液中溶解氧含量大于空气饱和值的80%以上, 用氢氧化钠溶液或盐酸溶液调节pH值为(7.8 ± 0.2), 硬度为(250± 25) mg·L-1(以CaCO3计).取粒径为30 nm的ZnONP, 加入经过曝气的稀释液中, 边加入边超声搅拌, 配制成240 mg·L-1储备液.正式实验前储备液超声30 min, 并配制到实验浓度后再超声搅拌30 min后, 获得纳米悬液用于实验.
2.2.3 ZnONP的表征及稳定性研究配制24 mg·L-1的ZnONP悬液, 超声30 min, 用一次性滴管取几滴悬浮液滴于锡箔纸上, 自然干燥后, 制成SEM样品, 用扫描电镜观察ZnONP在水体中的表面形貌.ZnONP的沉降行为采用纳米悬浮液吸光度的变化来表征.将不同浓度ZnONP悬液超声分散后, 分别在0、2、4、8、24、48 h时用分光光度计378 nm波长下测定吸光度变化.ZnONP在水体中的团聚行为通过分析悬液中纳米颗粒粒度的变化来获得.具体做法为将装有不同浓度ZnONP悬液的比色皿放入Zeta电位分析仪中进行测定, 室温下检测3 min, 得到ZnONP的表面电位值.
2.3 染毒处理及毒性效应指标观察试验前选择已怀卵的母溞置于烧杯中, 选取孵化6~24 h的幼溞, 采用静水暴露的方式, 暴露周期为48 h, 暴露期间不喂食, 每24 h换水.根据预实验的结果, 正式实验浓度设置为0、1.5、3、6、12、24 mg·L-1, 每个浓度3个平行组, 实验容器为200 mL的烧杯, 实验溶液的体积为100 mL, 每个烧杯中放置10只大型溞.倒置显微镜下观察大型溞生长状态, 拍照、记录, 统计大型溞死亡率、蜕皮率, 用扫描电镜对大型溞表面结构表征, 用摄像机记录大型溞游泳的垂直高度.
在相同的条件下配制同上述试验浓度的ZnONP悬浮液静置24 h后, 再用高速离心机(KDH-140HR, H240.5)以20000 g的离心力离心35 min, 取上清液, 用0.22 μm的滤膜过滤, 用火焰原子吸收法(AAS)测定锌离子.根据结果配制相同锌离子浓度的硫酸锌溶液, 同上述方法对大型溞染毒, 观察并记录大型溞死亡情况, 以评估ZnONP溶解的锌离子对大型溞的毒性效应.
2.4 数据统计分析利用SPSS及Sigmaplot进行数据统计分析, 使用origin 8.5进行作图.
3 结果与讨论(Results and discussion)3.1 ZnONP形貌表征及稳定性用纯水和稀释液分别配制ZnONP处理液在电镜下进行形貌观察, 结果如图 1所示.纯水分散后的ZnONP与稀释水分散后的ZnONP颗粒大小无显著差异, ZnONP经过分散后放置会发生严重的团聚现象, 团聚体大小不一, 形态多为块状和颗粒状.平均直径大于30 nm, 最大颗粒直径达到50~60 μm.
图 1(Fig. 1)
 |
| 图 1 纳米氧化锌在溶液中的表面形貌 (a.纯水配制, b.稀释液配制) Fig. 1Surface morphology of ZnONP in solution (a. pure water preparation, b. dilution preparation) |
图 2为不同浓度纳米ZnONP在不同时间静置下的沉降情况, A/A0越小(A、A0分别为实时吸光度值和初始吸光度值), 纳米颗粒沉降越明显.
图 2(Fig. 2)
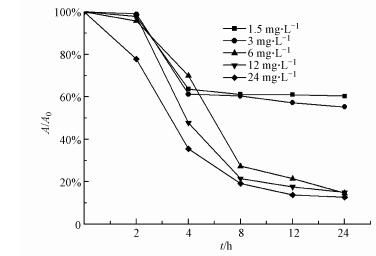 |
| 图 2 不同浓度的ZnONP随时间变化的沉降行为 (A、A0分别为实时吸光度值和初始吸光度值) Fig. 2Sedimentation behavior of ZnONP at different concentrations with time (A, A0 are real-time absorbance values and initial absorbance values, respectively) |
从图 2可见, 不同浓度的ZnONP随着时间的延长均出现了沉降行为, 1.5、3 mg·L-1的ZnONP沉降速率较慢, 在24 h后有40%发生了沉降, 高浓度组(6、12、24 mg·L-1)在24 h后有近90%以上发生了沉降, 这表明ZnONP稳定性极差, 进一步对其Zeta电位进行测试, 结果见图 3.
图 3(Fig. 3)
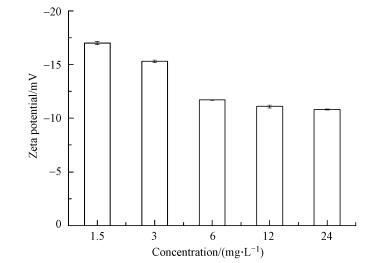 |
| 图 3 ZnONP在不同浓度下的Zeta电位 Fig. 3Zeta potential of ZnONP at different concentrations |
Zeta电位的大小与纳米颗粒的分散性和稳定性密切相关, 研究表明当Zeta电位(绝对值)>30 mV时, 溶液具有良好的分散性和稳定性.从图 3可知, ZnONP的Zeta电位(绝对值)均<30 mV, 再次证明ZnONP颗粒悬液稳定性差.浓度为1.5、3、6 mg·L-1时的电位随浓度的升高而减小, 浓度为6 mg·L-1时其Zeta电位为-11.7 mV, ZnONP悬液浓度≥ 6 mg·L-1后各组的Zeta电位变化不大, 说明24 h后颗粒分散性很差, 这与图 2的沉降行为结果一致.
3.2 ZnONP对大型溞死亡率的影响ZnONP染毒后大型溞死亡率随时间的变化如图 4所示.从图 4可见, 随着暴露时间的延长, 大型溞的死亡率均升高, 呈现一定的时间-效应关系.在同一浓度下, 3~24 mg·L-1的处理组暴露48 h后的死亡率比暴露24 h的死亡率增加了30%~60%.染毒24 h时, 大型溞的死亡率随着浓度的升高先升高后减小, 在6 mg·L-1的暴露组, 大型溞的死亡率最高, 达到40%, 且与对照组相比呈现极显著差异;染毒48 h后, 大型溞的死亡率随着浓度的升高而升高, 当ZnONP浓度≥ 6 mg·L-1时, 死亡率均大于85%以上, 与对照组相比, 呈现极显著性差异.采用概率对数法计算, 获得ZnONP对大型溞48 h的半数致死率LC50约为3 mg·L-1.
图 4(Fig. 4)
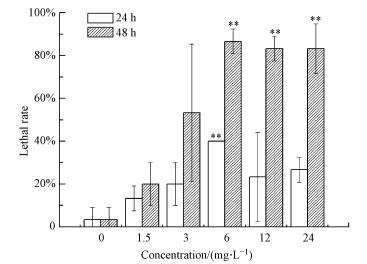 |
| 图 4 不同浓度的ZnONP对大型溞的致死率 (*表示p < 0.05, 与对照组之间有显著性差异, **表示p < 0.01, 与对照组之间有极显著性差异, n=4) Fig. 4The lethal rate of ZnONP to Daphnia at different concentration |
有报道ZnONP毒性可能与溶液中溶出的锌离子有关(Min-Li et al., 2004; Zhu et al., 2008).采用原子吸收法对各浓度组ZnONP溶液中溶解的锌离子进行测定, 分别为1.23、1.25、1.42、1.50、1.58 mg·L-1.对ZnONP溶解的Zn2+对大型溞的毒性测定, 并与对应的ZnONP进行比较, 结果见图 5.
图 5(Fig. 5)
 |
| 图 5 不同浓度ZnONP及其溶解的锌离子对大型溞致死率 (x轴小括号内数字代表相对应浓度组ZnONP溶解的锌离子浓度; *表示p < 0.05, 与对照组之间有显著性差异, **表示p < 0.01, 与对照组之间有极显著性差异n=4, 下同) Fig. 5The lethal rate of ZnONP and dissolved zinc ions of ZnONP to Daphnia (numbers in brackets under X-axis represent the concentrations of dissolved zinc ions of ZnONP in the corresponding concentrations) |
从图 5可见, 1.5、3 mg·L-1 Zn2+处理组没有死亡, 大于6 mg·L-1 Zn2+处理组死亡率随浓度的升高逐渐增高, 24 mg·L-1的处理组死亡率最高与对照组之间有显著性差异.但是最高浓度组的死亡率低于15%.与相应浓度的ZnONP造成的致死率相比, 溶解的锌离子造成的死亡率显著低于ZnONP处理组的死亡率, 这说明ZnONP对大型溞产生的毒性不完全是锌离子造成的, ZnONP在溶液中形成的颗粒可能是导致大型溞死亡的主要原因.
3.3 ZnONP对大型溞镜检结果为了进一步分析ZnONP对大型溞的毒性效应, 用显微镜观察结果如图 6所示.随着ZnONP浓度增加, 大型溞肠道中的绿色消失, 肠道颜色逐渐变深, 呈灰黑色.尽管并不能在大型溞肠道内看见ZnONP, 但结果表明ZnONP处理组大型溞肠道出现阻塞和内含物改变(图 6红色箭头所指).另一方面, ZnONP粘附在大型溞表面, 随着处理浓度的增加大型溞表面颗粒物增多(图 6蓝色圆圈).这表明ZnONP对大型溞的主要作用靶点为肠道和体表.大型溞属于滤食性动物(<50 μm), 会根据物质大小、形状和质地选择食物, 正常情况下它们通过胸肢腿部而滤食水中碎屑和藻类(范文宏等, 2016).大型溞在ZnONP处理液觅食过程中, 不可避免的摄入纳米颗粒摄食导致ZnONP在体内聚合难以排出.有研究报道(Jacobasch et al., 2014;Stanley et al., 2016), 对大型溞暴露在氧化石墨烯中, 氧化石墨烯会引起大型溞肠道堵塞, 阻止大型溞进食, 进而引起大型溞死亡.这与我们的研究结果相似.朱小山等(2008)研究发现, 由于纳米材料具有较大的表面积和亲电性, 会使其在大型溞肠道内形成高浓度致密的聚合物而难以排出, 进而导致纳米材料的积累, 还可能进一步攻击肠道组织细胞导致相应的病变, 最终导致大型溞死亡.光学显微观察结果表明, ZnONP颗粒对大型溞肠道的损伤可能是其损伤主因之一.
图 6(Fig. 6)
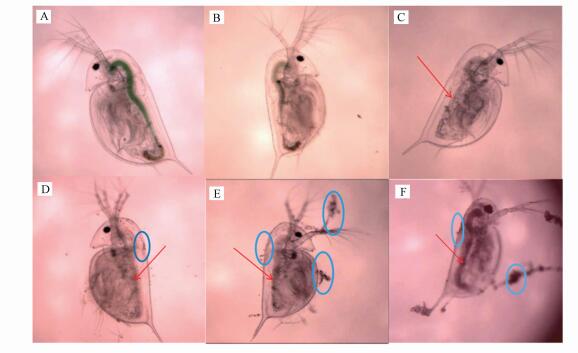 |
| 图 6 大型溞对不同浓度ZnONP的积累 (A~F分别为0、1.5、3、6、12、24 mg·L-1, 红色箭头为肠道病变, 蓝色圆圈为ZnONP颗粒) Fig. 6Accumulation of ZnONP by Daphnia with different concentration (A~F is 1.5、3、6、12、24 mg ·L-1 respectively, red arrow for intestinal lesions, blue circle for ZnONP) |
3.4 ZnONP对大型溞表面结构损伤表征为了进一步观察粘附在大型溞体表的ZnONP对大型溞产生的毒性效应, 采用扫描电镜对暴露48 h的大型溞进行扫描电镜观察, 结果如图 7所示.
图 7(Fig. 7)
 |
| 图 7 在不同浓度ZnONP暴露下大型溞扫描电镜图 (A:对照组;B:1.5 mg·L-1;C~D:3 mg·L-1;E~G:分别为6、12、24 mg·L-1;H~I:濒临死亡的大型溞) Fig. 7Scanning electron microcopy (SEM) image of the Daphnia with different concentration (A:control group; B:1.5 mg·L-1:C~D:3 mg·L-1; E~G:6、12、24 mg·L-1 respectively; H~I: deading Daphnia) |
从图 7可知, 对照组大型溞表面规则分布, 纹路清晰(7A), 低浓度处理(1.5、3 mg·L-1)组的大型溞表面出现褶皱, 有些斑块上出现少量颗粒物(图 7B、7C、7D), 高浓度(6、12、24 mg·L-1)处理组的大型溞表面出现较为严重的腐蚀损伤, 纹路界限比较模糊, 结构不规则, 有大量颗粒物粘附在大型溞的体表(图 7E、7F、7G).图 7H和图 7I为濒临死亡的大型溞体表的扫描电镜图, 可见大型溞体表已出现严重褶皱, 失去原本的形状.研究结果表明, 高浓度组、大颗粒的ZnONP确实可以聚集粘附于大型溞的体表导致大型溞的体表损伤, 从而与大型溞的死亡有直接关系.这与Lovern等(2007)、Chen等(2017)报道的结果类似.
3.5 ZnONP对大型溞游泳行为的影响近年来, 有****将大型溞的游泳行为作为行为毒理学的一个重要研究指标(Brausch et al., 2015;Bownik, 2017).为了研究粘附在大型溞体表的ZnONP对大型溞游泳行为的影响, 本文用不同浓度ZnONP处理大型溞10 h左右, 在大型溞已适应处理环境, 游泳行为趋于平稳后, 用摄像机记录每只大型溞游泳部位与烧杯底部的垂直距离, 对大型溞分布的垂直高度进行观察和统计, 结果如图 8所示.
图 8(Fig. 8)
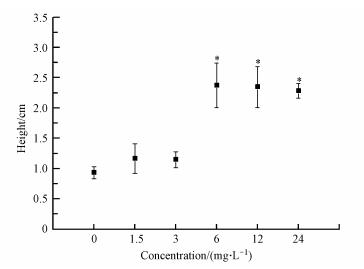 |
| 图 8 不同浓度ZnONP暴露下大型溞分布的垂直高度 Fig. 8The vertical position (cm) of Daphnia in different concentration of ZnONP |
从图 8可知, 处理组大型溞游泳高度均高于对照组.与对照组相比, 1.5 mg·L-1和3 mg·L-1 ZnONP处理组, 大型溞游泳的垂直高度与对照组没有显著区别, 当ZnONP处理浓度≥6 mg·L-1大型溞游泳高度升高, 大型溞垂直分布的高度到杯底的距离增大.与对照组相比, 浓度大于6 mg·L-1处理组大型溞的游泳高度垂直分布距离与对照组之间呈显著差异性.Dabrunz等(2011)研究发现, 大型溞可以与溶液中纳米颗粒的碰撞, 使纳米颗粒稳定粘附在大型溞体表, 进一步腐蚀大型溞的身体, 直到大型溞死亡.有研究报道(Lampert et al., 2003;Wiklund et al., 2012), 大型溞可以感知食物和周围环境物质的垂直梯度分布来优化自身所处深度来觅食, 从而减少自身能量消耗.高浓度的ZnONP在溶液中逐渐在烧杯底部沉降聚集成颗粒, 该处理组大型溞提升自身游泳的垂直高度, 可能是一种应激性行为的反映.另外, 6 mg·L-1处理组大型溞24 h后死亡率最高, 可能是由于6 mg·L-1的ZnONP溶液颗粒的分散性较高, 更高浓度的ZnONP(12、24 mg·L-1)颗粒的碰撞率提高, 发生聚集的机会大而沉降到容器底部.
3.6 ZnONP对大型溞蜕皮的影响大型溞蜕皮行为是大型溞生长调节的机制之一, 也与周围环境中污染物含量具有一定的关联性(Nasser et al., 2016b), 为了研究粘附大型溞体表的ZnONP对大型溞蜕皮产生的影响, 对大型溞成功蜕皮频率进行统计, 结果如图 9所示.
图 9(Fig. 9)
 |
| 图 9 大型溞随时间变化的成功蜕皮率 Fig. 9Successful molting rate of Daphnia with time |
从图 9可知, 对照组大型溞4 h开始蜕皮, 各处理组的大型溞蜕皮时间均比对照组推迟4 h, 处理组大型溞在8 h后才开始蜕皮.各组大型溞8 ~12 h的成功蜕皮率均保持不变, 经处理24 h后, 除6 mg·L-1的处理组大型溞因死亡数目多而蜕皮率没有增加, 对照组和其他处理组大型溞成功蜕皮率均增加, 对照组大型溞成功蜕皮率最高.结果表明, ZnONP处理过程延迟了大型溞的蜕皮时间, 并降低其蜕皮率.其原因可能在于ZnONP粘附在大型溞体表而导致大型溞负重生存而无法成功蜕皮致死亡, 有部分大型溞在蜕皮过程中, 头部未能蜕皮即死亡证实了这一结论.这与Coors等(2004)、Nasser等(2016)对纳米材料引发大型溞蜕皮异常的研究结果一致.关于ZnONP引起大型溞游泳行为改变和蜕皮率降低的分子机制还需要深入探究.
4 结论(Conclusions)1) ZnONP在水溶液中的稳定性差, 颗粒之间会发生凝集而沉降, Zeta随浓度升高而电位逐渐降低.对大型溞48 h的半数致死浓度LC50为3 mg·L-1, 高浓度处理组(6、12、24 mg·L-1)大型溞的死亡率可高达80%以上, ZnONP对大型溞的毒性作用呈现一定的时间-效应关系.
2) ZnONP释放的锌离子在低浓度(1.5、3 mg·L-1)处理组对大型溞的死亡率无影响, 在高浓度(6、12、24 mg·L-1)处理组的死亡率低于15%, 而相对应的ZnONP致大型溞的死亡高于80%, 这说明ZnONP释放的锌离子对大型溞具有一定的毒性, 但不是ZnONP引发大型溞毒性的主要因素.
3) 通过对大型溞个体光学显微镜和扫描电镜观察可见, 导致大型溞死亡的主要因素与其对ZnONP的摄食导致肠道损伤和ZnONP会粘附于大型溞体表导致体表损伤有关.
4) ZnONP处理会导致大型溞游泳垂直高度升高, 大型溞蜕皮行为延迟, 成功蜕皮率下降, 这与ZnONP在水溶液中和大型溞体表的聚集粘附有直接关联性.
参考文献
| Adam N, Leroux F, Knapen D, et al. 2015. The uptake and elimination of ZnO and CuO nanoparticles in Daphnia magna under chronic exposure scenarios[J]. Water Research, 68(6): 249–261. |
| Adams L K, Lyon D Y, Alvarez P J. 2006. Comparative eco-toxicity of nanoscale TiO2, SiO2, and ZnO water suspensions[J]. Water Research, 40(19): 3527–3532.DOI:10.1016/j.watres.2006.08.004 |
| Adema D M M. 1978. Daphnia magna as a test animal in acute and chronic toxicity tests[J]. Hydrobiologia, 59(2): 125–134.DOI:10.1007/BF00020773 |
| Bownik A. 2017. Daphnia swimming behaviour as a biomarker in toxicity assessment:A review[J]. Science of the Total Environment, 601: 194–205. |
| Brausch K A, Anderson T A, Smith P N, et al. 2015. The effect of fullerenes and functionalized fullerenes on Daphnia magna phototaxis and swimming behavior[J]. Environmental Toxicology & Chemistry, 30(4): 878–884. |
| Chen Y, Wu F, Li W, et al. 2017. Comparison on the effects of water-borne and dietary-borne accumulated ZnO nanoparticles on Daphnia magna[J]. Chemosphere, 189: 94–103.DOI:10.1016/j.chemosphere.2017.08.132 |
| Coors A, Hammerswirtz M, Ratte H T. 2004. Adaptation to environmental stress in Daphnia magna simultaneously exposed to a xenobiotic[J]. Chemosphere, 56(4): 395–404.DOI:10.1016/j.chemosphere.2004.04.025 |
| Dabrunz A, Duester L, Prasse C, et al. 2011. Biological surface coating and molting inhibition as mechanisms of TiO2 nanoparticle toxicity in Daphnia magna[J]. Plos One, 6(5): e20112.DOI:10.1371/journal.pone.0020112 |
| De A I, Barone F, Zijno A, et al. 2013. Comparative study of ZnO and TiO2 nanoparticles:physicochemical characterisation and toxicological effects on human colon carcinoma cells[J]. Nanotoxicology, 7(8): 1361–1372.DOI:10.3109/17435390.2012.741724 |
| Fan W, Cui M, Liu H, et al. 2011. Nano-TiO2 enhances the toxicity of copper in natural water to Daphnia magna[J]. Environmental Pollution, 159(3): 729–734.DOI:10.1016/j.envpol.2010.11.030 |
| 范文宏, 刘通, 史志伟, 等. 2016. 立方体和八面体微/纳米氧化亚铜对大型水蚤(Daphnia magna)的氧化胁迫和生理损伤[J]. 生态毒理学报, 2016, 11(5): 40–48. |
| Harris K D, Bartlett N J, Lloyd V K. 2014. Daphnia as an emerging epigenetic model organism[J]. Genetics Research International, 2012(2): 147892. |
| Jacobasch C, V?lker C, Giebner S, et al. 2014. Long-term effects of nanoscaled titanium dioxide on the cladoceran Daphnia magna over six generations[J]. Environmental Pollution, 186: 180–186.DOI:10.1016/j.envpol.2013.12.008 |
| Kaya H, Ayd?n F, Gürkan M, et al. 2015. Effects of zinc oxide nanoparticles on bioaccumulation and oxidative stress in different organs of tilapia (Oreochromis niloticus)[J]. Environmental Toxicology & Pharmacology, 40(3): 936–947. |
| Kaya H, Ayd?n F, Gürkan M, et al. 2016. A comparative toxicity study between small and large size zinc oxide nanoparticles in tilapia (Oreochromis niloticus):Organ pathologies, osmoregulatory responses and immunological parameters[J]. Chemosphere, 144: 571–582.DOI:10.1016/j.chemosphere.2015.09.024 |
| Lampert W, Mccauley E, Manly B F. 2003. Trade-offs in the vertical distribution of zooplankton:ideal free distribution with costs?[J]. Proceedings Biological Sciences, 270(1516): 765–773.DOI:10.1098/rspb.2002.2291 |
| Li L X, Xu Z L, Wu J Y, et al. 2010. Bioaccumulation of heavy metals in the earthworm Eisenia fetida in relation to bioavailable metal concentrations in pig manure[J]. Bioresource Technology, 101(10): 3430–3436.DOI:10.1016/j.biortech.2009.12.085 |
| 刘建新, 杜青平, 陈展明, 等. 2016. 纳米氧化锌对羊角月牙藻毒性效应及其在藻细胞内外的分布[J]. 生态毒理学报, 2016, 11(5): 103–110. |
| Liu Y, Wang L, Pan B, et al. 2017. Toxic effects of diclofenac on life history parameters and the expression of detoxification-related genes in Daphnia magna[J]. Aquatic Toxicology, 183: 104–113.DOI:10.1016/j.aquatox.2016.12.020 |
| Lovern S B, Strickler J R, Klaper R. 2007. Behavioral and physiological changes in Daphnia magna when exposed to nanoparticle suspensions (titanium dioxide, nano-C60, and C60HxC70Hx)[J]. Environmental Science & Technology, 41(12): 4465–4470. |
| Min-Li Q U, Jiang W C. 2004. Investigation of the antibacterial mechanism of nanometer zinc oxide[J]. Textile Auxiliaries, 6: 45–46. |
| Nasser F, Davis A, Valsamijones E, et al. 2016a. Shape and charge of gold nanomaterials influence survivorship, oxidative stress and moulting of Daphnia magna[J]. Nanomaterials, 6(12): 222.DOI:10.3390/nano6120222 |
| Stanley J K, Laird J G, Kennedy A J, et al. 2016. Sublethal effects of multiwalled carbon nanotube exposure in the invertebrate Daphnia magna[J]. Environmental Toxicology & Chemistry, 35(1): 200–204. |
| Xiao Y, Vijver M G, Chen G, et al. 2015. Toxicity and accumulation of Cu and ZnO nanoparticles in Daphnia magna[J]. Environmental Science & Technology, 49(7): 4657–4664. |
| Zhu X, Tian S, Cai Z. 2012. Toxicity assessment of iron oxide nanoparticles in zebrafish (Danio rerio) early life stages[J]. Plos One, 7(9): e46286.DOI:10.1371/journal.pone.0046286 |
| Zhu X, Zhu L, Duan Z, et al. 2008. Comparative toxicity of several metal oxide nanoparticle aqueous suspensions to Zebrafish (Danio rerio) early developmental stage[J]. Journal of Environmental Science & Health Part A, 43(3): 278–284. |
| 朱小山, 朱琳, 田胜艳, 等. 2008. 三种金属氧化物纳米颗粒的水生态毒性[J]. 生态学报, 2008, 28(8): 3507–3516.DOI:10.3321/j.issn:1000-0933.2008.08.003 |
