 , 龚久平1, 张伟1, 张雪梅1, 朱金山3, 宋玉芳2
, 龚久平1, 张伟1, 张雪梅1, 朱金山3, 宋玉芳2
 , 柴勇1, 刘剑飞1
, 柴勇1, 刘剑飞11. 重庆市农业科学院农业质量标准与检测技术研究所, 重庆 401329;
2. 中国科学院沈阳应用生态研究所, 沈阳 110016;
3. 长江师范学院, 重庆 408100
收稿日期: 2018-09-27; 修回日期: 2018-12-12; 录用日期: 2018-12-12
基金项目: 重庆市基础研究与前沿探索项目(No.cstc2018jcyjAX0613);重庆市基本科研项目(No.2016cstc-jbky-00523);“食品安全研发技术”重大研发项目课题(No.2017YFC1602004)
作者简介: 杨晓霞(1985-), 女, 助理研究员(博士), E-mail:yxxhwj@live.cn
通讯作者(责任作者): 宋玉芳, songyufang@iae.ac.cn
摘要: 将赤子爱胜蚓(Eisenia fetida)暴露于亚致死剂量(1.0、5.0、25.0 mg·kg-1)汞污染土壤中4周,以蚯蚓个体(致死率、体重增长率)及小分子代谢物(代谢组)为指标研究其对汞的动态毒性响应,并采用最小二乘判别分析(OPLSA-DA)对暴露组及对照组的代谢物进行分类,进而识别潜在的标记物.结果表明,蚯蚓对汞的吸收尚未达到稳态,蚯蚓体内代谢物的响应依赖于暴露剂量及暴露时间.暴露1周时,蚯蚓体重略有增长但不显著;最低暴露剂量(1.0 mg·kg-1)导致蚯蚓体内亮氨酸、异亮氨酸、色氨酸、组氨酸、酪氨酸、5-氧脯氨酸、2-脱氧肌苷显著低于对照水平,柠檬酸、肌苷酸与腺苷在5.0、25.0 mg·kg-1剂量下显著高于对照水平;暴露4周时,最高暴露剂量(25 mg·kg-1)显著抑制了蚯蚓的生长;汞添加组的蚯蚓体内谷氨酸、酪氨酸、马来酸、2-脱氧肌苷水平显著低于对照.上述代谢物对汞的动态变化表明它们可作为潜在生物标记物,用于诊断土壤汞污染.对代谢途径分析发现,1.0~25.0 mg·kg-1汞即可破坏蚯蚓正常氨基酸代谢、三羧酸循环,扰乱能量代谢,对蚯蚓产生氧化损伤.本研究结果表明,相比个体水平的受试终点,代谢组学指标比个体水平指标能更敏感地响应较低剂量汞,是土壤汞污染生态毒性效应诊断的有效指标.另外,本研究结果可为土壤汞污染的风险评估及相关环境标准的修订提供大量基础数据.
关键词:汞蚯蚓毒性效应代谢组学亚致死剂量
The toxicity of Hg in soil with sublethal doses to earthworms based on the metabolomics
YANG Xiaoxia1,2
 , GONG Jiuping1, ZHANG Wei1, ZHANG Xuemei1, ZHU Jinshan3, SONG Yufang2
, GONG Jiuping1, ZHANG Wei1, ZHANG Xuemei1, ZHU Jinshan3, SONG Yufang2
 , CHAI Yong1, LIU Jianfei1
, CHAI Yong1, LIU Jianfei1 1. Institute of Agricultural Quality Standard and Testing Technology, Chongqing Academy of Agricultural Sciences, Chongqing 401329;
2. Institute of Applied Ecology, Chinese Academy of Sciences, Shenyang 110016;
3. Yangtze Normal University, Chongqing 408100
Received 27 September 2018; received in revised from 12 December 2018; accepted 12 December 2018
Abstract: In this study, earthworms (Eisenia fetida) were exposed to soil with sublethal doses of Hg (with concentration of 1.0, 5.0 and 25.0 mg·kg-1 soil) for 4 weeks. Dynamic responses of the individuals (mortality and weight growth rate) and the small molecular metabolites (the metabolomics) were studied. The supervised orthogonal partial lease squares discriminant method (OPLS-DA) was used to analyze the metabolites in the exposed groups and the control group, by which the potential biomarkers can be identified. Experimental results indicate that Hg accumulation in earthworms has not reached a steady state for 4 weeks exposure, and the responses of the metabolites depend on the exposure dose and the exposure time. After 1 week, the weight of earthworms increased insignificantly. For the lowest exposure dose (1.0 mg·kg-1), the concentration of leucine, isoleucine, tryptophan, histidine, tyrosine, 5-oxyproline and 2-deoxyinosine in the exposure group were significantly lower than those in the control group. While, for 5.0, 25.0 mg·kg-1 dose, the concentration of citrate, inosine and adenosine in the exposure group were significantly higher than those in the control group. After 4 weeks, the worms' growth was significantly inhibited at the highest exposure dose (25.0 mg·kg-1). In addition, the concentration of glutamic acid, tyrosine, maleic acid and 2-deoxyinosine in the exposure group were significantly lower than those of the control. The dynamic responses of above metabolites suggest that they can be used as potential biomarkers for the diagnosis of Hg-contaminated soil. Analysis on metabolic pathways revealed that 1.0~25.0 mg·kg-1 Hg could disrupt the normal amino acid metabolism, the tricarboxylic acid cycle and the energy metabolism, thus leading to oxidative damage to earthworms. The results of this study suggest that metabolomics are more sensitive and effective than individual endpoints in response to lower-dose Hg. In addition, our results provide a large amount of basic data for the risk assessment of Hg-contaminated soil and the revision of environmental standards.
Keywords: Hgearthwormstoxic effectsthe metabolomicssublethal doses
1 引言(Introduction)由于具有高挥发性、持久性及多态性, 汞成为全球关注度极高的一种剧毒重金属(Colacevich et al., 2011).土壤是陆地生态系统污染物的“汇”, 伴随着城市化、工业化和现代农业化的日益发展, 表层土壤汞积累明显(Driscoll et al., 2013).据文献报道, 我国长江流域表层土壤汞含量在0.001~0.901 mg·kg-1之间(张成等, 2014; 张文新等, 2017), 南方典型设施菜地中汞的平均含量普遍超标, 最高超标9~10倍(胡文友等, 2014).土壤汞污染对生态环境安全与人类健康具有潜在危害, 因此, 研究较低剂量汞的毒性对实际评价其在土壤中的环境风险具有重要的应用价值.
从目前发表的文献来看, 对汞的毒性效应、生物富集等研究多集中于水生生物(Berntssen et al., 2003; Fu et al., 2010; Kim et al., 2011), 对陆生生物的毒性研究较少.蚯蚓是土壤中普遍存在的生物, 约占土壤总生物量的60%~80%(Blouin et al., 2013).由于蚯蚓不仅可通过体表充分接触土壤, 而且能够通过摄食接触土壤, 因而成为土壤污染毒性效应研究的指示生物, 其中, 赤子爱胜蚓是国际公认的土壤毒理实验的模式生物(OECD, 1984).研究人员通常采用半数致死剂量(LC50)(Zhu et al., 2011; 杨道丽, 2013)、致死率(Brkovi?-Popovi? et al., 1977)等作为受试终点, 研究汞对蚯蚓的急性毒性;还有****研究了汞对蚯蚓产茧的半数有效浓度(EC50)(Lock et al., 2001)、逃避行为及呼吸(Tang et al., 2016)、抗氧化酶(如超氧化酶、过氧化氢酶等)(杨道丽, 2013), 以及氧化/还原谷胱甘肽的比值对亚致死剂量汞(2~128 mg·kg-1)的响应, 进而识别其作为生物标记物的可能性, 进而监测土壤汞污染.然而, LC50、致死率、逃避行为、呼吸、抗氧化酶这些指标通常适用于高剂量暴露评价, 存在敏感性差、通量低等缺点, 不能满足较低剂量环境污染物毒性分析与风险评价的需求.
代谢组学是研究生物体整体内源代谢物随外因或内因变化的科学.代谢组学的高通量筛选特征使其在研究药物的毒性及作用机制或寻找某种疾病的指示标记物方面具有巨大优势(Kaddurah-Daouk et al., 2009; Hocher et al., 2017), 近年来开始在环境毒理学研究中得到应用.基于代谢组学, 研究人员发现1/15~1/5 LC50的敌敌畏可导致金鱼大脑中的谷氨酸、乳酸, 以及肝脏中的谷胱甘肽、葡萄糖等呈现明显的量-效关系(刘岩, 2016);亚致死剂量的铅导致蚯蚓体内亮氨酸、异亮氨酸、缬氨酸等显著低于对照水平, 蚯蚓的正常能量代谢与核酸代谢被严重破坏(Chen et al., 2016).然而, 关于蚯蚓代谢组对较低剂量汞响应的研究报道很少.
因此, 本文根据土壤中汞对蚯蚓的LC50(Zhu et al., 2011; 杨道丽, 2013)、土壤环境质量标准(GB15618—1995)及我国土壤中汞的含量范围, 采用外源添加的方式, 设置汞的剂量梯度分别为1.0、5.0、25.0 mg·kg-1, 将赤子爱胜蚓在土壤中培养4周, 监测蚯蚓个体生长与吸收汞情况.同时, 运用LC-MS/MS及多元统计分析相结合的代谢组学技术, 分析蚯蚓体内的代谢组对汞的毒性响应及模式, 判别潜在生物标记物.以期通过相关代谢途径的分析揭示亚致死剂量汞对蚯蚓的毒性作用机制, 为土壤中汞风险评估及相关标准的修订及提供理论依据.
2 材料与方法(Materials and methods)2.1 仪器与试剂仪器:低温超速离心机(日立)、受控环境生长箱、高效液相色谱串联质谱联用仪(LC-MS/MS)(热电, 美国)、双通道原子荧光光度计(北京吉天)、超纯水机(赛多利斯, 德国).
试剂:HgCl2为国产分析纯, 代谢物标准品及甲酸均购自Sigma公司(中国上海), 甲醇与乙腈购自Merck公司.
2.2 土壤暴露实验赤子爱胜蚓(Eisenia fetida)购于重庆长江师范学院.选用2~3月龄、体重300~400 mg的带有环带的健康蚯蚓作为受试生物, 暴露实验前培养于清洁土壤中.受试土壤来自重庆市农业科学院试验站, 为0~20 cm的表层清洁土壤, 风干后磨细过1 mm筛备用, 其理化性质见表 1.该土壤中汞含量为0.032 mg·kg-1, 远低于土壤环境质量标准(GB15618—1995)中汞的一级标准值, 未检测到镉、铅、镍等重金属.
表 1(Table 1)
| 表 1 供试土壤的理化性质 Table 1 Physical and chemical properties of test soil | ||||||||||||||
表 1 供试土壤的理化性质 Table 1 Physical and chemical properties of test soil
| ||||||||||||||
将一定浓度的HgCl2水溶液与500 g土壤(盛装于184 cm×128 cm×72 cm的培养盒中)充分混合, 设计3个暴露剂量:1.0、5.0、25.0 mg·kg-1, 另设1个空白对照组, 加水至土壤最大持水量(25%).开展暴露实验前, 对土壤中的添加剂量进行验证(表 2).每个培养盒中加入10条蚯蚓, 置于(20±2) ℃、湿度80%的生长箱中以光暗比(16 h:8 h)交替培养.同一剂量处理在同一暴露时间设置6个平行(即该实验共有6×4×2=48个培养盒).在将蚯蚓转移到汞污染土壤中前, 将其用超纯水冲洗, 滤纸吸干表体水分, 于20 ℃下在湿润的滤纸上放置72 h记录体重, 并计算平均体重(Winitial)后, 转移到土壤中.
表 2(Table 2)
| 表 2 土壤中汞的实际测定含量及蚯蚓体内汞的积累(n=6) Table 2 The measured concentration of Hg in soil and Hg accumulation in earthworms | |||||||||||||||||||||||||||||||||||||
表 2 土壤中汞的实际测定含量及蚯蚓体内汞的积累(n=6) Table 2 The measured concentration of Hg in soil and Hg accumulation in earthworms
| |||||||||||||||||||||||||||||||||||||
2.3 蚯蚓预处理从培养盒中取出的蚯蚓用超纯水冲洗后, 滤纸吸干表体水分, 于20 ℃下在湿润的滤纸上放置72 h, 使其排净体内的物质, 称重;计算平均体重(Wexpo)后快速放入液氮中冷冻研磨成粉末后于-80 ℃下保存, 用于代谢物提取, 或进行蚯蚓体内汞的测定.
2.4 蚯蚓体重增长率的计算暴露1周或4周后, 蚯蚓体重增长率R采用以下公式计算:
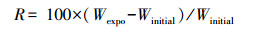 | (1) |
2.5 土壤及蚯蚓体内总汞的测定土壤中总汞的测定:土壤风干, 磨细过100目筛后, 保存于密封袋中.称取0.25 g土壤于25 mL比色管中, 加入5 mL王水(HCl/HNO3)后静置过夜.之后于沸水浴中加热2.0 h, 期间振摇3次.冷却后用超纯水稀释至刻度.取静置后的上清液1.0 mL于25 mL容量瓶中, 采用蒸馏水定容至25 mL后, 用原子荧光光度计分析测定总汞的含量.
蚯蚓体内总汞的测定:称取蚯蚓冷冻粉末0.5 g, 加入4 mL王水静置过夜, 之后的步骤类似于土壤中总汞的测定(GB-T 5009.17—2014).
2.6 蚯蚓代谢组的分析2.6.1 代谢物提取每100 mg蚯蚓粉末加入1 mL冰甲醇(80%, 4 ℃)漩涡5 min, 随后将混合物于15000×g下离心10 min, 将上清液转移到2 mL离心管中冷冻干燥.随后加入0.4 mL甲醇-水溶液(体积比为1:1), 于4 ℃下溶解样品, 采用0.22 μm膜过滤后得到待测样品, 用于LC-MS/MS上机分析.
2.6.2 LC-MS/MS测定条件及数据预处理色谱条件:采用Waters ACQUITY UPLC, 使用ACQUITY UPLC HSS T3 (1.8 μm, 2.1 mm×150 mm)色谱柱, 自动进样器温度设为4 ℃, 流速为0.25 mL·min-1, 柱温为40 ℃, 进样量为6 μL, 流动相为0.1%甲酸水(A)+0.1%甲酸乙腈(B).梯度洗脱程序:0~1 min, 2% B;1~9.5 min, 2%~50% B;9.5~14 min, 50%~98% B;14~15 min, 98% B;15~15.5 min, 98%~2% B;15.5~17 min, 2% B.
质谱条件:色谱为Thermo LTQ Orbitrap XL, 电喷雾离子源(ESI), 负离子喷雾电压为4.50 kV, 鞘气为7.88 MPa, 辅助气为2.63 MPa.毛细管温度为325 ℃, 毛细管电压为15 V, 管透镜电压为50 V, 以分辨率60000进行全扫描, 扫描范围为50~1000, 并采用CID进行二级裂解, 碰撞电压为30 eV, 同时采用动态排除去除无必要的MS/MS信息, 动态排除时间设置为15 s.
通过Proteowizard软件将获得的原始数据转换为mz XML格式, 采用XC-MS软件进行峰值自动检测、保留时间校准与峰对齐, 对峰面积进行归一化, 获得包括质荷比、保留时间及峰面积在内的数据阵.将数据阵导入Simca-P(Version 13.0)进行多元统计分析.
2.7 数据分析2.7.1 多元统计分析对获得的代谢组数据矩阵(包括质荷比、保留时间及峰面积), 首先采用无监督的模式识别方法——主成分分析(Principal Component Analysis, PCA)进行数据分析.之后采用最小二乘判别分析(Orthogonal Projections to Latent Structures Discriminant Analysis, OPLS-DA)进行数据分析, 并采用置换验证防止OPLS-DA模型的过度拟合.通过模型预测率Q2确定模型的有效性.
2.7.2 单因素分析及潜在生物标记物筛选与鉴定对于代谢物, 选择p≤0.05且VIP(Variable importance in projectuin, OPLS-DA, 第一主成分变量重要性值投影)≥1的离子, 作为潜在生物标记物.根据精确分子量进行潜在生物标记物的鉴定确认(分子量误差为小于20 ppm).然后根据自建标准品数据库, 对比MS/MS碎片模式, 并在Human Metabolome Database(HMDB)(http://www.hmdb.ca)、Metlin(http://metlin.scripps.edu)、Massbank(www.massbank.jp)数据库分析生物标志物的生物学意义.
对于鉴别出的潜在生物标记物, 运用单因素方差(One way ANOVA)分析相同暴露时间下Hg剂量对差异代谢物的影响.在进行单因素方差分析前, 首先对差异代谢物的质谱归一化强度值进行正态分布检验, 采用Kolmogornov-Smirnov检验数据是否符合正态分布, 采用Levene′s tests进行方差齐次性检验.所有数据集经检验后, 符合正态分布与方差齐次性, 采用单因素方差分析暴露剂量对蚯蚓体重的影响, p≤0.05视为具有显著差异.采用软件origin 8.0进行曲线模拟及绘图.
3 结果与分析(Results and analysis)3.1 蚯蚓致死率及体重增长率实验进行过程中, 未观察到蚯蚓死亡.汞对蚯蚓体重的影响如图 1所示.暴露1周时, 蚯蚓的生长增长率呈钟形, 1.0、5.0 mg·kg-1汞处理的蚯蚓体重增长率分别为19.42%、16.70%, 与对照组的增长水平无显著差异;最高剂量汞(25.0 mg·kg-1)暴露下, 蚯蚓体重的增长率为7.56%, 尽管低于对照组的增长水平, 但差异不显著.暴露4周时, 蚯蚓体重增长率随着汞暴露浓度的增加而降低.1.0、5.0 mg·kg-1剂量下, 蚯蚓的平均体重增长率分别为-15.09%、-20.36%, 最高暴露剂量下的蚯蚓平均体重增长率为-25.36%, 显著低于对照组的增长水平(-5.11%), 表明该剂量下蚯蚓个体生长受到显著抑制.
图 1(Fig. 1)
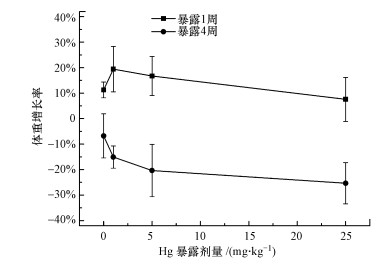 |
| 图 1 不同暴露时间下蚯蚓的平均体重增长率(数据采用平均值±标准误差方法表示, n=6, 星号代表同一暴露时间下暴露组蚯蚓体重增长率与对照组存在显著差异(p < 0.05) Fig. 1The growth rate of average weight of earthworms exposed to 1.0, 5.0, 25.0 mg·kg-1 Hg and the control soil(ck), respectively |
3.2 蚯蚓体内汞的积累表 2为土壤中汞的实际测定值及蚯蚓体内汞的积累.由表 2可知, 相同暴露时间下, 汞生物累积系数随着暴露剂量的提高而增加;相同剂量下, 汞生物累积系数则随着暴露时间的延长而增加.实验结束时, 生物累积系数并未达到稳定, 表明蚯蚓体内的汞累积尚未达到稳态.此外, 暴露1周和4周时, 蚯蚓体内汞含量(y)与实际暴露剂量(x)可分别用以下公式表示:y=0.253x-0.093(R2=0.999)和y=0.434x-0.090(R2=0.999), 可见蚯蚓体内汞含量随着土壤中汞含量的增加而线性增加.
3.3 蚯蚓代谢组OPLS-DA是一种模式识别方法, 相比于主成分分析法(PCA), OPLS-DA是将正交信号校正方法与最小二乘法(PLS)相结合, 同时对PLS进行改进的方法.它的优势在于利用正交信号校正滤除自变量矩阵(x)与因变量矩阵(Y)无关的信息或随机噪声, 因此, 可更好地区别组间差异, 提高模型的有效性和解析能力.图 2为蚯蚓分别在暴露1周(图 2a)、4周(图 2b)的OPLS-DA得分图.该图中1个点即代表1个样品, 通过此图可获知暴露1周或4周时, 对照组与3个汞剂量添加组的分离情况.若添加组与对照组分离度越大, 表明汞暴露对蚯蚓的影响越明显.由图 2a与图 2b可见, 4组都呈现出很好的分离趋势.其中, 暴露1周时, 汞添加组与对照之间分离明显(图 2a);暴露4周时, 汞添加组与对照组间分离明显, 其中, 最高剂量添加组的分离更明显(图 2b).通过对模型有效性评估, 图 2a得到的模型的解释能力R2(Y)=0.99, 预测能力Q2(Y)=0.72;图 2b得到的模型解释能力R2(Y)=0.98, 预测能力Q2(Y)=0.78.图 2a与2b的R2、Q2均高于0.5, 表明模型的拟合准确性均较高.
图 2(Fig. 2)
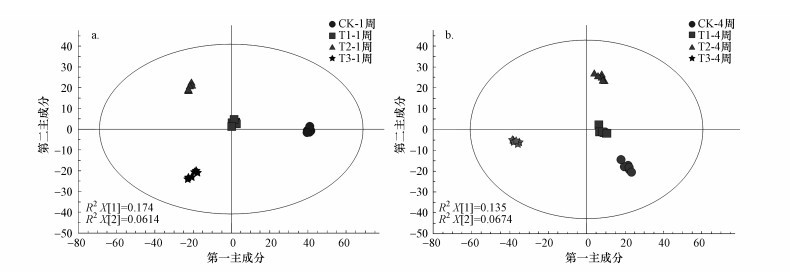 |
| 图 2 基于OPLS-DA的蚯蚓分别暴露于汞1周(a)及4周(b)后的样品分离得分图(n=6;样品都处于95%置信区间内(Hotelling′s T2 Ellipse(95%));R2X[1]、R2X[2]分别为模型在第一主成分、第二主成分的贡献度;T1、T2、T3分别代表暴露浓度1.0、5.0、25.0 mg·kg-1) Fig. 2The score plots of OPLS-DA model for the extracts of earthworms exposed to 1.0(T1), 5.0(T2), 25.0(T3) mg·kg-1 Hg and the control soil(ck) for 1 week(a) and 4 weeks(b) |
暴露1周时, 鉴定出10种潜在小分子代谢标记物(表 3).图 3为暴露1周时10种潜在小分子代谢标记物的响应, 纵坐标为代谢物在质谱上的归一化强度值相比对照组的变化率, 正值表示高于对照水平, 负值表示低于对照水平.由图 3可知, 每个潜在生物标记物对汞的响应并不一致.最低暴露剂量(1.0 mg·kg-1)下, 蚯蚓体内7种代谢物(亮氨酸、异亮氨酸、酪氨酸、色氨酸、组氨酸、5-氧脯氨酸、2-脱氧肌苷)分别显著低于对照水平, 但柠檬酸、肌苷酸与腺苷与对照组差异不显著.鉴定的10种潜在生物标记物对最高暴露剂量(25.0 mg·kg-1)及中等暴露剂量(5.0 mg·kg-1)的响应模式类似:亮氨酸、异亮氨酸、酪氨酸、色氨酸、组氨酸、5-氧脯氨酸及2-脱氧肌苷等7种代谢物水平均分别显著低于对照水平, 但柠檬酸、肌苷酸与腺苷均显著高于对照水平.本研究发现, 氨基酸类、2-脱氧肌苷这些显著低于对照的代谢物, 在5.0 mg·kg-1剂量下达到最低值, 然而显著高于对照的小分子代谢物(柠檬酸、肌苷酸与腺苷), 却恰在此剂量下达到最高值.另外, 亮氨酸、色氨酸、5-氧脯氨酸3个代谢物响应-剂量存在相似性, 它们在质谱上的归一化强度(y)与蚯蚓体内汞累积量(x)的关系可分别用以下公式表示:y=2×106(x2-10x+1)(R2=0.744)、y=24004x2-2×106x+3×106(R2=0.765)、y=24094x2-207890x+3345000(R2=0.789).
表 3(Table 3)
| 表 3 蚯蚓暴露于汞1周后鉴定的潜在标记物 Table 3 The identification of potential biomarkers of earthworms exposed to Hg for 1 week | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 3 蚯蚓暴露于汞1周后鉴定的潜在标记物 Table 3 The identification of potential biomarkers of earthworms exposed to Hg for 1 week
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
图 3(Fig. 3)
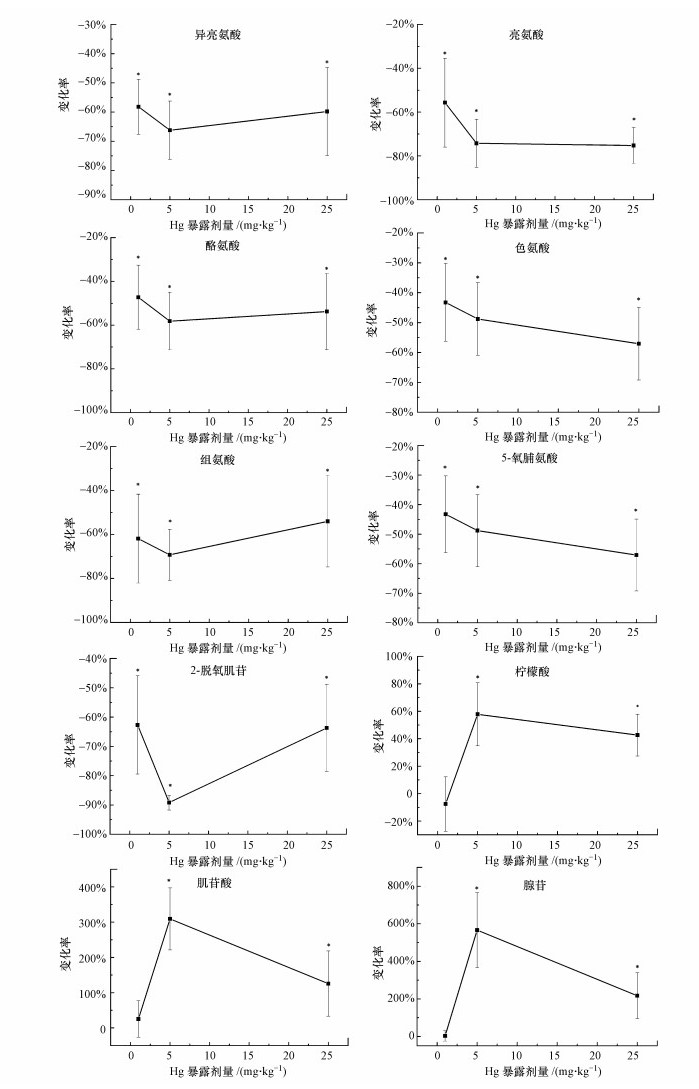 |
| 图 3 暴露1周后蚯蚓体内潜在生物标记物对汞的响应(n=6;*代表与对照组存在显著差异(p < 0.05), 下同) Fig. 3The responses of differential metabolites in earthworms exposed to Hg for 1 week |
暴露4周时, 5种代谢物(谷氨酸、酪氨酸、2-脱氧肌苷、精胺、马来酸)被鉴定为潜在的生物标记物(表 4).生物标记物的数量相比暴露1周时有所减少.图 4为上述差异代谢物对汞的响应模式.类似于暴露1周, 5种潜在生物标记物对暴露剂量的响应趋势仍然不同.其中, 酪氨酸与马来酸随着暴露剂量的增加而水平降低, 酪氨酸、马来酸在质谱上的归一化强度与蚯蚓体内汞累积量间的关系可分别用以下公式表示:y=2135x2-26790x+2×106(R2=0.813)、y=10308x2-1×106x+5×105(R2=0.879).暴露4周时, 所有汞添加处理组的蚯蚓体内谷氨酸、酪氨酸、2-脱氧肌苷与马来酸均分别显著低于对照水平.精胺在最低暴露剂量下均与对照组无显著差异.
表 4(Table 4)
| 表 4 蚯蚓暴露于汞4周后鉴别的潜在生物标记物 Table 4 The identification of potential biomarkers of earthworms exposed to Hg for 4 weeks | ||||||||||||||||||||||||||||||||||||||||||||||||
表 4 蚯蚓暴露于汞4周后鉴别的潜在生物标记物 Table 4 The identification of potential biomarkers of earthworms exposed to Hg for 4 weeks
| ||||||||||||||||||||||||||||||||||||||||||||||||
图 4(Fig. 4)
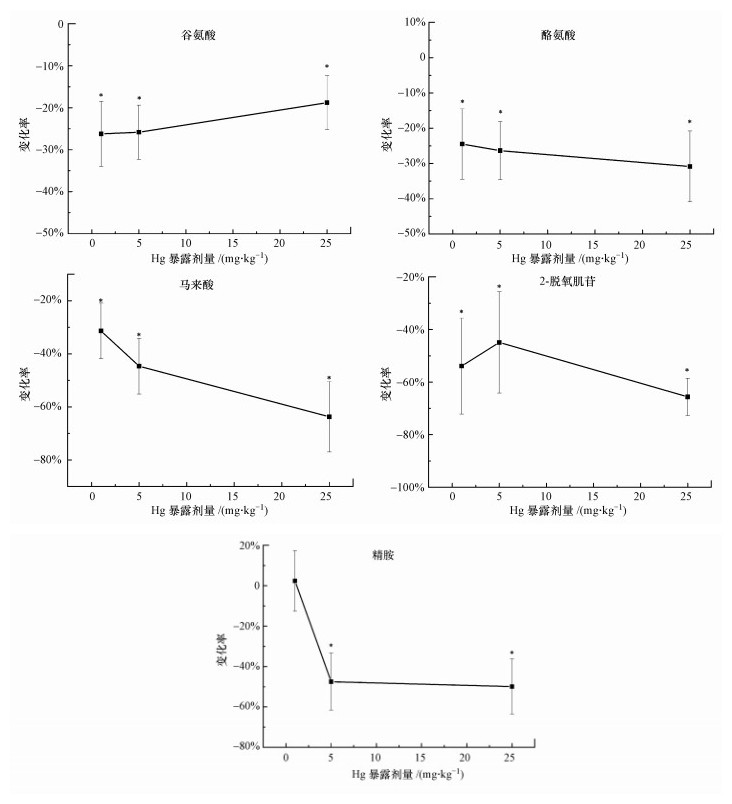 |
| 图 4 暴露4周后蚯蚓体内潜在生物标记物对汞的响应(n=6) Fig. 4The responses of differential metabolites in earthworms exposed to Hg for 4 weeks |
4 讨论(Discussion)在进行暴露实验前进行了回收率实验(表 2), 汞的回收率为91.5%~116%.本研究中, 暴露1周或4周时, 蚯蚓对汞的积累随着土壤汞实际剂量的增加而线性增加, 蚯蚓对汞的生物累积系数随着剂量的提高而增加;相同剂量下, 蚯蚓对汞的生物累积系数随着时间的增长而增加.类似地, Dang等(2016)发现暴露于75 mg·kg-1汞污染土壤中的蚯蚓, 对无机汞或甲基汞的吸收呈现直线增长.本研究中1.0~25.0 mg·kg-1汞暴露1周时略促进蚯蚓体重的增长, 暴露4周时25.0 mg·kg-1汞处理则抑制了蚯蚓生长, 这可能是因为蚯蚓对汞的吸收随着汞暴露的不断持续而增加且毒性效应增强所致.另外, 本研究还发现暴露4周后, 蚯蚓对汞的吸收并未达到稳态.之前有研究人员采集了汞高污染土壤(含量244 mg·kg-1), 外源添加50 mg·kg-1汞后, 发现蚯蚓对汞的吸收在4周内亦未达到稳态(álvarez et al., 2014).然而, 蚯蚓对镉的吸收在4周内可达到稳态(Yang et al., 2012), 这可能与重金属种类及暴露剂量有关.此外, 实验期间并未出现蚯蚓死亡现象, 表明致死率作为受试终点, 不能有效诊断较低浓度汞污染土壤的毒性效应.
目前, 利用代谢组学, 通过水生生物体内代谢物水平的降低或提高来识别潜在生物标记物, 同时揭示环境污染物毒害机理的研究较多(Berntssen et al., 2003; Kim et al., 2016; Nagato et al., 2016).近年来, 研究土壤污染物对陆生生物(如蚯蚓)的代谢毒性的报道开始增多, 蚯蚓暴露于多环芳烃(萘、菲和芘)、重金属(铅)、表面活性剂(全氟辛酸和全氟辛烷磺酸), 其稳态被破坏, 导致代谢物(如氨基酸类、三羧酸类等)水平提升或降低(Brown et al., 2009; Baylay et al., 2012; Lankadurai et al., 2012), 这些代谢物的动态变化可因此作为土壤污染物毒性损伤的标记物.Mckelvie等(2010)发现, 蚯蚓代谢组可对土壤低剂量菲作出持续响应, 且响应与土壤中可提取菲总量间呈现很好的相关性;Lankadurai等(2015)发现, 蚯蚓氨基酸类(亮氨酸、异亮氨酸、缬氨酸、苯丙氨酸)、三羧酸类(苹果酸、延胡索酸)及肌苷可作为监测土壤C60污染的敏感生物标记物.
氨基酸是蛋白质的基本组成单位, 氨基酸水平的变化与蛋白质合成或降解紧密相关.目前文献报道中, 生物体内(如鱼、蚯蚓)氨基酸类代谢物被发现是一类可用于监测环境污染的潜在生物标记物.Nagato等(2016)观察到二嗪酮(0.045、0.09 g·L-1)与马拉硫磷(0.08 g·L-1)可导致大型溞氨基酸如酪氨酸、谷氨酸、谷氨酰胺、苯基丙氨酸减少.Lankadurai等(2015)发现暴露于300~3000 mg·kg-1 C60污染土壤2 d后, 蚯蚓体内亮氨酸、异亮氨酸、缬氨酸等氨基酸显著低于对照, 因此, 推断它们可作为土壤C60污染的潜在生物标记物.本研究中, 暴露1周后蚯蚓体内亮氨酸、异亮氨酸、酪氨酸、色氨酸、5-氧脯氨酸等氨基酸水平等均显著低于对照, 柠檬酸、肌苷酸与腺苷在5.0、25.0 mg·kg-1 Hg剂量下显著高于对照水平;暴露4周后谷氨酸、酪氨酸水平显著低于对照.由此推断它们可作为亚致死剂量汞暴露的潜在生物标记物.
暴露1周时, 5-氧脯氨酸显著降低, 表明谷氨酰胺及谷胱甘肽代谢受到抑制, 佐证了氧化应激的产生.唐浩等(2017)研究发现, 土壤中32~50 mg·kg-1汞可显著抑制蚯蚓体内谷胱甘肽过氧化物酶活性, 认为蚯蚓对氧自由基的清除能力减弱, 氧化损伤产生, 这一结论与本实验结果一致.亮氨酸、组氨酸、色氨酸等不仅是必须的氨基酸, 还是三羧酸循环中间产物的前体.本研究中亮氨酸、异亮氨酸、组氨酸、色氨酸、酪氨酸等水平在暴露1周内显著低于对照水平, 一方面可能是由于它们被用于合成蛋白质如氧化还原酶或DNA修复酶, 以修复因汞引起的氧化损伤(包括蛋白质氧化、脂质氧化及DNA损伤);另一方面可能与它们的分解有关, 柠檬酸显著增加这一现象便验证了这一推断.类似地, Tang等(2018)认为由于蚯蚓可富集土壤中的汞或甲基汞, 需要能量去抵抗汞或甲基汞的毒性, 蛋白质代谢因此受到影响, 进而导致氨基酸水平显著降低.Lankadurai等(2015)分析认为, C60导致蚯蚓氨基酸类代谢物水平显著降低在于能量代谢被扰乱.有****研究了葡萄牙汞严重污染海域(总汞含量(1.9±0.5) ng·kg-1)中野生鱼体内的代谢组后发现, 氨基酸类代谢物对汞响应敏感(Brand?o et al., 2015), 但敏感响应的氨基酸类型不同于蚯蚓, 这表明代谢组的污染诱导响应同时依赖于受试生物与其生长环境.
暴露4周时, 各处理组的谷氨酸含量显著低于对照, 表明蚯蚓糖酵解这一代谢过程的加强.另外, 谷氨酸是一种神经递质.在外界压力的胁迫下受体介导的去极化与钙流入, 使神经元中的谷氨酸的转运受到影响从而导致细胞凋亡(Nagato et al., 2016).本研究中各处理组谷氨酸的显著降低表明重金属离子会进入中枢神经系统引起谷氨酰胺-谷氨酸代谢紊乱, 产生神经毒性.类似地, Kim等(2016)发现镉暴露导致斑马鱼谷氨酸水平显著降低, 对斑马鱼产生了神经毒性.本研究中1.0~25.0 mg·kg-1汞持续暴露4周, 导致蚯蚓体内酪氨酸水平显著低于对照, 表明蚯蚓的酪氨酸的正常代谢与合成途径受到严重干扰, 可能是由于氧化压力的持续产生, 直接对蛋白质结构造成损伤, 进而导致酪氨酸水平显著降低.Chen等(2016)发现, 5.0~20 μg·cm-2铅导致蚯蚓体内酪氨酸显著低于对照水平, 亦认为铅导致蚯蚓活性氧过度生成, 致使蛋白质结构受损甚至碎片化.本研究中4周的25.0 mg·kg-1汞暴露导致蚯蚓生长受到显著抑制, 也从个体水平上证实蚯蚓已受到毒害.
三羧酸循环(TCA)是生物体内普遍存在的代谢途径, 不仅是糖类、脂类、蛋白质及核酸代谢的联络与转化的枢纽, 而且是生物体获得能量的最有效的方式.柠檬酸是三羧酸循环(TCA)的第一步产物.5.0、25.0 mg·kg-1汞暴露1周后导致蚯蚓体内柠檬酸含量均显著高于对照, 表明蚯蚓的能量代谢被干扰, 这可能是因为蚯蚓需要能量抵抗汞在蚯蚓体内累积造成的毒害压力, 部分氨基酸水平降低的现象可佐证此推断.类似地, 有研究报道, C60或低剂量汞短期暴露(2~14 d)导致氨基酸含量发生显著变化, 蚯蚓三羧酸循环中间产物如苹果酸、富马酸等水平亦显著区别于对照, 蚯蚓能量代谢遭到干扰(Lankadurai et al., 2015; Tang et al., 2016).实验结束时, 1.0 mg·kg-1汞暴露导致蚯蚓体内马来酸含量显著低于对照, 且随着剂量的增加马来酸含量不断降低, 这表明蚯蚓体内汞的持续富集导致能量代谢严重失衡.然而, 汞暴露造成蚯蚓三羧酸循环哪个环节中断目前尚不清楚.
腺苷(Adenosine)本身是一种神经调节剂, 还是用于合成三磷酸腺苷(ATP)、腺苷酸的重要中间体, 参与能量代谢.肌苷酸(IMP)是一种核苷酸, 主要由肌肉中的ATP降解而产生.2-脱氧肌苷则是肌苷酸的衍生物.本研究发现, 1.0 mg·kg-1汞可扰乱蚯蚓核酸嘧啶类代谢, 如暴露1周时, 肌苷酸与腺苷分别显著高于对照;然而此时氨基酸类的响应趋势恰好相反, 表明酪氨酸、组氨酸等氨基酸水平降低的机理途径可能与肌苷酸、腺苷提高的机理途径紧密关联(Nagato et al., 2016).精胺(Spermine)与核酸有关, 被认为稳定了螺旋机构, 还参与免疫细胞的分化及炎症反应的调节过程(Zhao et al., 2016).本研究中5.0 mg·kg-1汞暴露4周后蚯蚓精胺水平显著低于对照, 表明蚯蚓核酸代谢受到影响, 已对蚯蚓产生不可逆转的毒性危害.
本研究还发现, 潜在生物标记物的响应依赖于暴露剂量与暴露时间, 但剂量-响应二者间呈现非线性关系.类似发现之前也有报道, 如大型水蚤代谢物变化对海水中的有机磷暴露呈现非线性(Nagato et al., 2016), 蚯蚓代谢物如苹果酸、延胡索酸等的变化依赖于土壤中C60的浓度(Lankadurai et al., 2015), 但未呈线性关系.生物标记物的反应与暴露浓度之间呈现非线性关系, 这可能是由于涉及到多种复杂的生物化学机制(Lankadurai et al., 2015; Nagato et al., 2016).因此可推测, 不同毒物涉及的毒性作用模式不同, 同时也表明代谢组学指标在监测环境污染物及评价其毒性方面具有较好的选择性.
本文基于代谢组学研究了亚致死剂量汞对蚯蚓的代谢毒性, 发现仅暴露1周时, 最低暴露剂量(1.0 mg·kg-1)即可导致蚯蚓体内亮氨酸、异亮氨酸、色氨酸、组氨酸、酪氨酸、5-氧脯氨酸、2-脱氧肌苷显著低于对照水平, 柠檬酸、肌苷酸与腺苷在5.0 mg·kg-1剂量下显著高于对照水平, 蚯蚓氨基酸代谢、核酸嘧啶类代谢紊乱, 三羧酸循环受阻.这表明小分子代谢物对低剂量汞能更敏感地响应, 本研究也进一步证实了代谢组学指标可有效用于评估较低剂量污染毒性.
5 结论(Conclusions)研究结果表明, 蚯蚓代谢组的响应依赖于暴露时间与暴露剂量.1.0 mg·kg-1汞暴露7 d后, 蚯蚓体内亮氨酸、异亮氨酸、酪氨酸、色氨酸、组氨酸、5-氧脯氨酸、2-脱氧肌苷显著降低, 柠檬酸、腺苷与肌苷酸显著提高;该剂量延时暴露导致蚯蚓谷氨酸、酪氨酸、精胺、2-脱氧肌苷显著下降, 这表明上述代谢物可作为土壤较低剂量汞污染潜在敏感小分子生物标记物, 从而提升了人们对土壤较低剂量汞对蚯蚓的毒性的认知.研究发现, 土壤中1.0~25.0 mg·kg-1汞可破坏蚯蚓正常氨基酸代谢、能量代谢、核酸嘧啶类代谢.本文的研究结果可为土壤汞污染监测及土壤环境标准的修订提供理论依据.
参考文献
| álvarez C R, Moreno M J, Bernardo F J G, et al. 2014. Mercury methylation, uptake and bioaccumulation by the earthworm Lumbricus terrestris(Oligochaeta)[J]. Applied Soil Ecology, 84: 45–53.DOI:10.1016/j.apsoil.2014.06.008 |
| Baylay A J, Spurgeon D J, Svendsen C, et al. 2012. A metabolomics based test of independent action and concentration addition using the earthworm Lumbricus rubellus[J]. Ecotoxicology, 21(5): 1436–1447.DOI:10.1007/s10646-012-0897-0 |
| Berntssen M H G, Aatland A, Handy R D, et al. 2003. Chronic dietary mercury exposure causes oxidative stress, brain lesions, and altered behaviour in Atlantic salmon(Salmo salar) parr[J]. Aquatic Toxicology, 65(1): 55–72. |
| Blouin M, Hodson M E, Delgado E A, Baker G, et al. 2013. A review of earthworm impact on soil function and ecosystem services[J]. European Journal of Soil Science, 64(2): 161–182. |
| Brand?o F, Cappello T, Raimundo J, et al. 2015. Unravelling the mechanisms of mercury hepatotoxicity in wild fish(Liza aurata) through a triad approach:bioaccumulation, metabolomic profiles and oxidative stress[J]. Metallomics, 7(9): 1352–1363.DOI:10.1039/C5MT00090D |
| Brkovi?-Popovi? I, Popovi? M. 1977. Effects of heavy metals on survival and respiration rate of tubificid worms:Part Ⅰ-Effects on survival[J]. Environmental Pollution, 13(1): 65–72.DOI:10.1016/0013-9327(77)90034-9 |
| Brown S A E, Simpson A J, Simpson M J, et al. 2009. 1H NMR metabolomics of earthworm responses to sub-lethal PAH exposure[J]. Environmental Chemistry, 6(5): 432–440.DOI:10.1071/EN09054 |
| Chen T, Liu Y, Li M H, et al. 2016. Integrated 1H NMR-based metabolomics analysis of earthworm responses to sub-lethal Pb exposure[J]. Environmental Chemistry, 13(5): 792–803.DOI:10.1071/EN15192 |
| Colacevich A, Sierra M J, Borghini F, et al. 2011. Oxidative stress in earthworms short-and long-term exposed to highly Hg-contaminated soils[J]. Journal of Hazardous Materials, 194(5): 135–143. |
| Dang F, Zhao J, Zhou D. 2016. Uptake dynamics of inorganic mercury and methylmercury by the earthworm Pheretima guillemi[J]. Chemosphere, 144: 2121–2126.DOI:10.1016/j.chemosphere.2015.10.111 |
| Driscoll C T, Mason R P, Chan H M, et al. 2013. Mercury as a global pollutant:sources, pathways, and effects[J]. Environmental Science & Technology, 47(10): 4967–4983. |
| Fu Z, Wu F, Amarasiriwardena D, et al. 2010. Antimony, arsenic and mercury in the aquatic environment and fish in a large antimony mining area in Hunan, China[J]. Science of the Total Environment, 408(16): 3403–3410.DOI:10.1016/j.scitotenv.2010.04.031 |
| Hocher B, Adamski J. 2017. Metabolomics for clinical use and research in chronic kidney disease[J]. Nature Reviews Nephrology, 13(5): 269–284.DOI:10.1038/nrneph.2017.30 |
| 胡文友, 黄标, 马宏卫, 等. 2014. 南方典型设施蔬菜生产系统镉和汞累积的健康风险[J]. 土壤学报, 2014, 51(5): 1045–1055. |
| Kaddurah-Daouk R, Krishnan K R. 2009. Metabolomics:A global biochemical approach to the study of central nervous system diseases[J]. Neuropsychopharmacology, 34(1): 173–186.DOI:10.1038/npp.2008.174 |
| Kim S H, Jung M Y, Lee Y M. 2011. Effect of heavy metals on the antioxidant enzymes in the marine ciliate Euplotes crassus[J]. Toxicology and Environmental Health Sciences, 3(4): 213–219.DOI:10.1007/s13530-011-0103-4 |
| Kim S, Yoon D, Lee M, et al. 2016. Metabolic responses in zebrafish(Danio rerio) exposed to zinc and cadmium by nuclear magnetic resonance-based metabolomics[J]. Chemistry and Ecology, 32(2): 136–148.DOI:10.1080/02757540.2015.1125891 |
| Lankadurai B P, Simpson A J, Simpson M J. 2012. 1H NMR metabolomics of Eisenia fetida responses after sub-lethal exposure to perfluorooctanoic acid and perfluorooctane sulfonate[J]. Environmental Chemistry, 9(6): 502–511.DOI:10.1071/EN12112 |
| Lankadurai B P, Nagato E G, Simpson A J, et al. 2015. Analysis of Eisenia fetida earthworm responses to sub-lethal C60 nanoparticle exposure using 1H-NMR based metabolomics[J]. Ecotoxicology & Environmental Safety, 120: 48–58. |
| Lock K, Janssen C. 2001. Ecotoxicity of mercury to Eisenia fetida, Enchytraeus albidus and Folsomia candida[J]. Biology and Fertility of Soils, 34(4): 219–221.DOI:10.1007/s003740100392 |
| 刘岩.2016.基于1H NMR代谢组学方法研究敌敌畏对金鱼的毒性及作用机制[D].南京: 南京理工大学http://cdmd.cnki.com.cn/Article/CDMD-10288-1016225258.htm |
| Mckelvie J R, Wolfe D M, Celejewski M, et al. 2010. Correlations of Eisenia fetida metabolic responses to extractable phenanthrene concentrations through time[J]. Environmental Pollution, 158(6): 2150–2157.DOI:10.1016/j.envpol.2010.02.022 |
| Nagato E G, Simpson A J, Simpson M J. 2016. Metabolomics reveals energetic impairments in Daphnia magna exposed to diazinon, malathion and bisphenol-A[J]. Aquatic Toxicology, 170: 175–186.DOI:10.1016/j.aquatox.2015.11.023 |
| OECD.1984.Proposal for Updating Guideline 207: Earthworm, Acute Toxicity Tests2 OECD Guideline for Testing of Chemicals 207.European Committe, Pairs[EB/OL].Pairs: European Committee.2015-06-12.https://www.oecd.org/env/ehs/testing/Draft-Updated-Test-Guildeline-222-Earthworm-reproduction-Test.pdf |
| Tang H, Yan Q, Wang X, et al. 2016. Earthworm(Eisenia fetida) behavioral and respiration responses to sublethal mercury concentrations in an artificial soil substrate[J]. Applied Soil Ecology, 104: 48–53.DOI:10.1016/j.apsoil.2015.12.008 |
| Tang R, Ding C, Dang F, et al. 2018. NMR-based metabolic toxicity of low-level Hg exposure to earthworms[J]. Environmental Pollution, 239: 428–437.DOI:10.1016/j.envpol.2018.04.027 |
| 唐浩, 刘钊钊, 李银生, 等. 2017. 土壤汞污染胁迫对蚯蚓体内几种抗氧化酶活性的影响[J]. 上海交通大学学报(农业科学版), 2017, 35(3): 17–23.DOI:10.3969/J.ISSN.1671-9964.2017.03.003 |
| Yang X X, Song Y F, Ackland M L, et al. 2012. Biochemical responses of earthworm Eisenia fetida exposed to cadmium-contaminated soil with long duration[J]. Bulletin of Environmental Contamination & Toxicology, 89(6): 1148–1153. |
| 杨道丽.2013.汞与溴苯腈复合污染对赤子爱胜蚓及球肾白线蚓的生态毒理效应研究[D].上海: 上海交通大学http://cdmd.cnki.com.cn/Article/CDMD-10248-1013020656.htm |
| Zhao L, Huang Y, Hannah-Bick C, et al. 2016. Application of metabolomics to assess the impact of Cu(OH)2 nanopesticide on the nutritional value of lettuce(Lactuca sativa):Enhanced Cu intake and reduced antioxidants[J]. Nanoimpact, 3-4: 58–66.DOI:10.1016/j.impact.2016.08.005 |
| Zhu J, Li Z G, Yang D L, et al. 2011. Acute toxicological effects of Hg pollution on earthworm Eisenia Foetida[J]. Journal of Shanghai Institute of Technology, 11(2): 95–99. |
| 张成, 陈宏, 王定勇, 等. 2014. 三峡库区消落带土壤汞形态分布与风险评价[J]. 环境科学, 2014, 35(3): 1060–1067. |
| 张文新, 陈勇, 齐誉, 等. 2017. 新疆玛河流域土壤和蔬菜汞分布特征与生态、人体健康风险评价[J]. 环境化学, 2017, 36(11): 2441–2450.DOI:10.7524/j.issn.0254-6108.2017031302 |
