 , 杜青平1
, 杜青平1
 , 刘嵩2, 吕慧3, 彭皇强1, 刘倩1, 苏俊朋1, 刘涛1
, 刘嵩2, 吕慧3, 彭皇强1, 刘倩1, 苏俊朋1, 刘涛11. 广东工业大学环境科学与工程学院, 广州 510006;
2. 仲恺农业工程学院环境科学与工程学院, 广州 510225;
3. 中山大学环境科学与工程学院, 广州 510006
收稿日期: 2017-11-04; 修回日期: 2017-12-07; 录用日期: 2017-12-24
基金项目: 广东省科技计划项目(No.2015A020215031);广东省青年创新人才项目(No.KA1514970);国家国际科技合作专项(No.2011DFB91560)
作者简介: 李嘉懿(1994-), 男, E-mail:2362804329@qq.com
通讯作者(责任作者): 杜青平, E-mail:qpdu2008@126.com
摘要: 以短程硝化系统为研究对象,实际垃圾沥滤液为反应物,序批式生物反应器(Sequencing Batch Reactor,SBR)为基础,研究了短程硝化反应系统的启动过程及不同进水有机负荷对短程硝化系统的影响,并对经高有机负荷冲击后短程硝化系统恢复期污泥的脱氮功能基因和微生物群落进行分析.结果表明:采用实际垃圾沥滤液在较短的时间内成功启动了短程硝化反应系统,于第15.5 d时系统的氨氮去除速率(ARR)达到652 mg·L-1·d-1,亚硝酸盐积累率(NAR)达到91.4%.该系统在受高有机负荷冲击后,降低有机负荷,系统仍能恢复高效短程硝化反应.对受冲击后恢复稳定的短程硝化系统中微生物相进行分析,结果发现,短程硝化系统具有完整的脱氮功能基因(AOB amoA、nxrB、nirS、nor、nosZ).污泥中细菌主要功能菌属是索氏菌属(Thauera)和亚硝化单胞菌属(Nitrosomonas),前者为异养菌,可进行反硝化,相对丰度为27.6%,后者是氨氧化菌(AOB),相对丰度为9.6%;此外,还存在一定比例的其他功能菌属.研究表明,采用短程硝化系统处理实际垃圾沥滤液,增强其脱氮效能具有潜在的研究价值.
关键词:垃圾沥滤液短程硝化有机物浓度功能基因微生物相
Effect of organic loading on partial nitrification system for the treatment of fresh incineration leachate and analysis of microbial phases
LI Jiayi1
 , DU Qingping1
, DU Qingping1
 , LIU Song2, Lü Hui3, PENG Huangqiang1, LIU Qian1, SU Junpeng1, LIU Tao1
, LIU Song2, Lü Hui3, PENG Huangqiang1, LIU Qian1, SU Junpeng1, LIU Tao1 1. College of Environmental Science and Engineering, Guangdong University of Technology, Guangzhou 510006;
2. College of Environmental Science and Engineering, Zhongkai University of Agriculture and Engineering, Guangzhou 510225;
3. College of Environmental Science and Engineering, Sun Yat-sen University, Guangzhou 510006
Received 4 November 2017; received in revised from 7 December 2017; accepted 24 December 2017
Supported by the Guangdong Science and Technology Project (No.2015A020215031), the Guangdong Province Innovative Talents Project for Youth (No. KA1514970) and the International Science & Technology Cooperation Program of China (No. 2011DFB91560)
Biography: LI Jiayi(1994—), male, E-mail:2362804329@qq.com
*Corresponding author: DU Qingping, E-mail:qpdu2008@126.com
Abstract: This paper focused on the study of partial nitrification system based on sequencing batch reactor (SBR) for fresh incineration leachate treatment, which included investigating its start-up process and the effects of different organic loadings on the system. The functional nitrogen removal genes and microbial community were analyzed while the partial nitrification system after short-term shock with high organic loading. The investigation has indicated that the partial nitrification system was fast started-up in a short period of time using fresh incineration leachate, and achieved 652 mg·L-1·d-1 of ammonium removal rate (ARR) and 91.4% of nitrite accumulation after 15.5 days start-up. Partial nitrification in SBR can be recovered quickly by reducing influent organic loading after suffering the shock of high organic loading. The whole functional denitrification genes (AOB amoA, nxrB, nirS, nor, nosZ) were detected in this SBR system. The main functional bacteria groups were heterotrophic denitrifying bacteria-Thauera and autotrophic ammonium oxidizing bacteria (AOB) -Nitrosomonas with relevant abundances of 27.6% and 9.6%, respectively. This study showed that partial nitrification system for fresh incineration leachate treatment was of a potential scientific research value of enhancing its nitrogen removal efficacy.
Key words: fresh incineration leachatepartial nitrificationthe concentration of organic mattersfunctional genesmicrobial phase
1 引言(Introduction)垃圾焚烧发电是目前实现生活垃圾减量化、资源化的一种高效处理方式(Dang et al., 2013).而垃圾焚烧前的筛检、堆酵等处理会产生大量垃圾沥滤液, 其水质复杂、易波动, 一般具有较高的COD、BOD, 且氨氮含量高.目前常用传统的全程硝化反硝化工艺(A/O)对垃圾沥滤液进行脱氮处理, 但存在反应时间长、耗能较大等问题.
短程硝化反硝化作为一种经济、高效的新型脱氮工艺, 与传统脱氮工艺相比减少了NO2-→NO3-过程, 可以节省25%的曝气量、40%的碳源、30%的反应时间, 从而降低60%的总能量需求(吴莉娜等, 2016; Soliman et al., 2016).短程硝化反硝化工艺的关键在于先通过短程硝化获得稳定的NO2--N积累, 富集反应器中氨氧化菌(Ammonia Oxidizing Bacteria, AOB), 抑制亚硝酸盐氧化菌(Nitrite Oxidizing Bacteria, NOB)(Fukushima et al., 2013).目前, 国内外对于短程硝化已有较多研究(Yang et al., 2017; Qian et al., 2017; Dong et al., 2017), 而关于如何利用实际垃圾沥滤液启动短程硝化系统及启动后获得系统效能的生物机理的研究报道较少.实际垃圾沥滤液组分较模拟废水复杂, 且水质波动大, 因此, 本文以实际垃圾沥滤液为研究对象, 采用序批式生物反应器(SBR)启动短程硝化, 考察实际沥滤液中有机物浓度对反应器运行性能的影响, 同时对受高有机负荷冲击后污泥中的脱氮功能基因和微生物群落进行分析, 探讨短程硝化系统对实际垃圾沥滤液处理效能影响的生物机理, 以期为短程硝化高效处理垃圾沥滤液提供技术支持.
2 材料与方法(Materials and methods)2.1 垃圾沥滤液及接种污泥来源试验用垃圾沥滤液取自佛山某垃圾焚烧发电厂, 试验用污泥取自广州某污水处理厂的硝化池, 为全程硝化污泥, 反应器接种污泥浓度(MLSS)为5500 mg·L-1.
2.2 试验装置及运行短程硝化反应装置如图 1所示, 主体是由有机玻璃制成的圆柱体, 直径14 cm, 高28 cm, 工作体积2 L.反应器附有搅拌装置、曝气装置、温控装置和简单的自控装置, 并配有pH和溶解氧(DO)探头.
图 1(Fig. 1)
 |
| 图 1 SBR装置示意图 Fig. 1Schematic diagram of the lab-scale SBR |
SBR反应周期为12 h, 排水比50%, 水力停留时间(HRT)为24 h, 污泥停留时间(SRT)为25 d, 具体运行方式为:进水(曝气)60 min, 曝气反应600 min, 沉淀40 min, 出水20 min.反应温度控制在(28±1) ℃, 启动前2.5 d DO浓度为0.60~0.80 mg·L-1, 之后控制在0.25~0.45 mg·L-1, 不调节进水pH.根据NH4+-N浓度要求, 用自来水稀释垃圾沥滤液原液获得试验进水.启动初期进水NH4+-N浓度为(250±1) mg·L-1, 之后逐步提高进水NH4+-N浓度至(760±5) mg·L-1.
2.3 水质分析测定方法COD、BOD5、NH4+-N、NO2--N、NO3--N、TN、总碱度等测定均采用国家标准方法(国家环境保护总局《水和废水监测分析方法》编委会, 2002).pH、DO、温度采用多参数分析仪(上海雷磁)测定.
氨氮去除速率按公式(1)计算, 亚硝酸盐积累率按公式(2)计算, 离氨(FA)和游离亚硝酸盐(FNA)浓度分别按公式(3)和(4)计算.
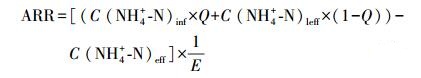 | (1) |
 | (2) |
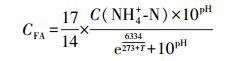 | (3) |
 | (4) |
2.4 脱氮功能基因分析取运行第62 d反应器内污泥, 采用土壤基因组DNA提取试剂盒(Fast DNA Spin kit for soil)提取DNA, 然后用特定的功能基因引物(表 1)用PCR仪(Mastercycler nexus, Eppendorf)进行扩增, 委托华大基因股份有限公司进行PCR反应引物合成工作.对获得的PCR产物进行琼脂糖凝胶电泳(DYY-6C, 北京市六一仪器厂), 于凝胶成像系统(EC3 410, UVP)下观察其条带情况.
表 1(Table 1)
| 表 1 功能基因名称及引物 Table 1 Functional gene and The PCR primer pairs | |||||||||||||||||||||||||||||||||||||||||||
表 1 功能基因名称及引物 Table 1 Functional gene and The PCR primer pairs
| |||||||||||||||||||||||||||||||||||||||||||
2.5 高通量测序分析取运行第62 d反应器内污泥混合液作为样本, 采用CTAB或SDS方法对样本的基因组DNA进行提取, 琼脂糖凝胶电泳检测DNA的纯度和浓度, 取适量样品于离心管中, 使用无菌水稀释样品至1 ng·μL-1.以稀释后的基因组DNA为模板, 使用带Barcode的特异引物、New England Biolabs公司的Phusion? High-Fidelity PCR Master Mix with GC Buffer和高效高保真酶进行PCR扩增, 引物为515F(5′-GTGCCAGCMGCCGCGGTAA-3′) -926R(5′-CCGTCAATTCMTTTGAGTTT-3′).PCR产物使用2%琼脂糖凝胶进行电泳检测;对目的条带使用qiagen公司提供的胶回收试剂盒回收产物.使用TruSeq? DNA PCR-Free Sample Preparation Kit建库试剂盒构建文库, 构建好的文库经过Qubit和Q-PCR定量, 合格后, 使用HiSeq2500 PE250进行上机测序.委托诺禾致源生物信息科技有限公司进行高通量测序.
3 结果与讨论(Results and discussion)3.1 垃圾沥滤液水质实际垃圾沥滤液水质变化受垃圾来源、含水量及天气等多种因素影响, 因此, 对试验用实际垃圾沥滤液的水质进行测定, 结果见表 2.由表 2可知, 原液中COD、BOD较高, COD在3324~8250 mg·L-1之间变化, BOD在1262~5563 mg·L-1之间浮动, 表明沥滤液中碳含量波动较大;NH4+-N浓度基本维持在1000 mg·L-1左右, 亚硝态氮和硝态氮浓度较低, NO2--N浓度基本为0 mg·L-1, NO3--N浓度维持在23~33 mg·L-1, 表明垃圾沥滤液中氮素污染物含量较为稳定;原液pH在7.97左右, 说明实际垃圾沥滤液偏碱性, 有利于氨氧化菌(AOB)的生长(Villaverde et al., 1997), 由于硝化过程会消耗碱度, 而废水碱度较高, 最高可达9016 mg·L-1, 能为硝化提供充足碱度.
表 2(Table 2)
| 表 2 垃圾沥滤液水质 Table 2 Characteristics of leachate | |||||||||||||||||||||||||||
表 2 垃圾沥滤液水质 Table 2 Characteristics of leachate
| |||||||||||||||||||||||||||
垃圾沥滤液在实际放置过程中会发生自然降解, 因此, 本实验对取得的3批垃圾沥滤液水样(A、B、C)于室温下自然放置过程中氨氮浓度及COD、BOD的变化进行了测定, 结果见图 3.由图 3可知, 同一批水中, COD和BOD随放置时间延长而逐渐降低.批次A的水样在15 d内COD从3324 mg·L-1降至1419 mg·L-1, BOD从1262 mg·L-1降至254 mg·L-1;批次B的水样在35 d内COD从5126 mg·L-1降至992 mg·L-1, BOD从2482 mg·L-1降至191 mg·L-1;12 d内, 批次C水样的COD从8250 mg·L-1降至3418 mg·L-1, BOD从5563 mg·L-1降至1702 mg·L-1.而同一批水中NH4+-N浓度基本不变, 因此, 本实验以实际垃圾沥滤液为进水, 探究一定进水NH4+-N浓度下(保持水质的氨氮浓度一致)不同有机物浓度对短程硝化系统的影响.
图 2(Fig. 2)
 |
| 图 2 垃圾沥滤液放置于室温下氨氮、COD和BOD变化 Fig. 2The concentration variation of ammonia, COD and BOD in the leachate kept at ambient temperature |
图 3(Fig. 3)
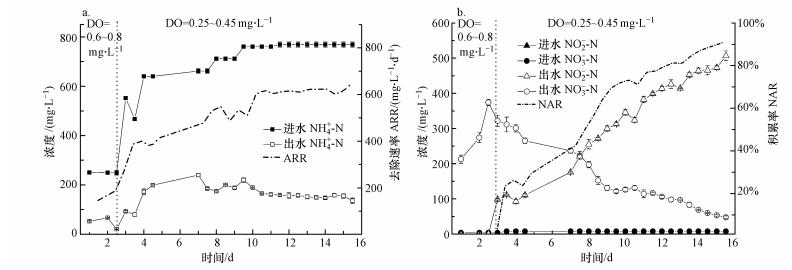 |
| 图 3 系统启动过程中氨氮降解情况(a)及亚硝化情况(b) Fig. 3Ammonia nitrogen degradation(a) and nitrification(b) during system start-up |
3.2 短程硝化系统的启动对系统启动阶段进出水NH4+-N浓度及氨氮去除速率(ARR)的变化进行测定, 结果见图 3a.从图 3a可见, 前2.5 d以NH4+-N负荷((250±5) mg·L-1)较低的进水启动反应器, 溶解氧(DO)浓度控制在0.60~0.80 mg·L-1, 这一阶段主要使污泥适应水质, 过程中出水NH4+-N浓度较低, 最低浓度为20.7 mg·L-1;ARR逐渐升高, 由146 mg·L-1·d-1提高至274 mg·L-1·d-1.当进水NH4+-N浓度从250 mg·L-1(第2.5 d)逐步提高至760 mg·L-1(第9.5 d), 此阶段由于进水NH4+-N浓度提高, 导致出水NH4+-N浓度上升并稍有波动.当进水NH4+-N维持在(765±4) mg·L-1(9.5~15.5 d)时, 出水的NH4+-N稳定在(146±10) mg·L-1.整个反应过程中ARR持续上升, 于第15.5 d获得最高ARR值为652 mg·L-1·d-1.表明垃圾沥滤液短程硝化系统启动过程中氨氮降解能力逐步提高, 驯化稳定后具有良好的氨氮降解性能.
测定16 d内进出水指标, 探讨短程硝化系统启动过程中进出水NO2-、NO3-浓度和亚硝酸盐积累率(NAR)的变化, 结果见图 3b.系统在启动过程中的进水COD为703~1624 mg·L-1, BOD为172~506 mg·L-1.启动过程中进水NO3--N浓度为3.8~7.6 mg·L-1, NO2--N浓度基本为0 mg·L-1.从图 3b可见, 启动初期的前2.5 d, 出水NO3--N浓度持续升高, 最高可达374 mg·L-1, 出水NO2--N浓度极低, 几乎检测不出, 表明该阶段系统仍处于全程硝化阶段, 无NO2--N积累.随着进水NH4+-N浓度提高及反应器内DO浓度降低至0.25~0.45 mg·L-1, 系统出水NO3--N浓度逐渐降低, 亚硝酸盐出现积累且积累率在不断提高, 表明系统开始由全程硝化向短程硝化转变, 在第15.5 d, 亚硝酸盐积累率(NAR)达到91.4%, 标志短程硝化系统启动成功.
3.3 进水有机物浓度对短程硝化系统的影响随着进水有机物(BOD、COD)浓度的改变, 短程硝化系统各指标的变化结果见图 4.由图 4可知, 在系统启动并稳定运行第16 d, 随着进水COD突然提高至4368 mg·L-1及进水BOD升高至2115 mg·L-1, 系统因遭受有机负荷冲击, ARR降至200 mg·L-1·d-1以下, 出水NO2--N浓度迅速下降至36 mg·L-1, 16.5 d时出水NO2--N基本为0 mg·L-1.说明系统氨氮降解性能迅速下降, 且伴有强烈的反硝化反应.随后进水BOD由2115 mg·L-1降至1566 mg·L-1, 短程硝化系统开始恢复, ARR与出水NO2--N浓度逐步升高, 此后进水BOD逐步降低至157 mg·L-1左右(第48 d).ARR在28 d后达到稳定期, 为(750±50) mg·L-1·d-1, 38 d后系统获得稳定浓度的出水NO2--N, 为(700±40) mg·L-1.第50.5 d, 进水有机负荷再一次提高, 进水COD和BOD分别为4691和3163 mg·L-1, 系统出水NO2--N浓度立刻下降至549 mg·L-1, 但ARR仍稳定在750 mg·L-1·d-1左右, 并保持了2 d, 第52.5 d才开始下降.原因可能为系统之前富集了大量的硝化细菌, 保证了系统的硝化性能, 使系统在高进水有机物浓度情况下仍能维持高效硝化一段时间, 之后由于反应器内异养菌数量的不断增加, 且增殖速率远高于硝化细菌, 硝化细菌逐渐受到抑制(尹军, 2007; 王晓莲等, 2009), 系统硝化性能急剧下降.在进水BOD降至2000 mg·L-1以下时短程硝化系统开始恢复, ARR和出水NO2--N浓度开始回升.这表明垃圾沥滤液短程硝化系统在受高有机负荷冲击影响后, 降低有机负荷, 短程硝化系统仍能恢复.
图 4(Fig. 4)
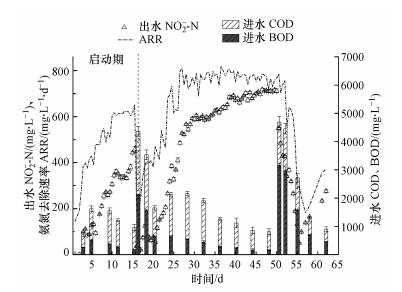 |
| 图 4 进水有机物浓度对短程硝化系统的影响 Fig. 4Effect of influent organic matter concentration on partial nitrification system |
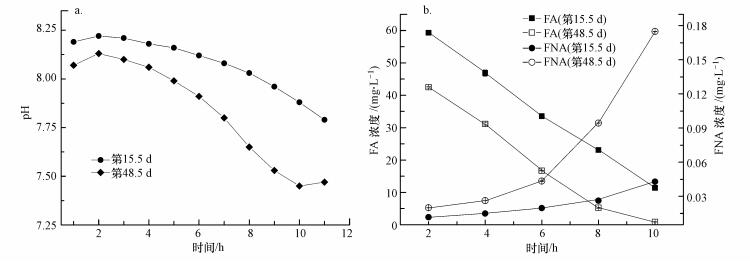
3.4 系统周期内pH、FA和FNA浓度变化对处于系统启动阶段(第15.5 d)和系统受高进水有机负荷冲击后恢复至稳定阶段(第48.5 d)两个周期内系统pH随反应时间的变化进行测定, 结果见图 5a.由图 5a可知, 第15.5 d时系统pH先升后降, 由进完水后的8.19升至8.22, 接着降至7.79(11 h), 过程中未出现“氨谷”(Gu et al., 2012);第48.5 d时, 一个反应周期内系统pH由进完水后的8.07升至8.13, 随后持续下降, 在反应进行10~11 h后出现“氨谷”, pH开始上升, 这表明此时氨氧化反应已完成.系统在具有更高进水氨氮负荷(第15.5 d进水NH4+-N浓度为769 mg·L-1, 第48.5 d进水NH4+-N浓度为782 mg·L-1)的情况下出现“氨谷”, 证明系统在受高进水有机负荷冲击后, 随着负荷的降低, 短程硝化系统可恢复并进行高效降解氨氮.
图 5(Fig. 5)
 |
| 图 5 第15.5 d和48.5 d反应周期内pH(a)和FA、FNA浓度(b)变化 Fig. 5The pH(a) and FA, FNA concentrations(b) varied during the 15.5 day and 48.5 day reaction period |
进一步对第15.5 d和第48.5 d时, 两个反应周期内系统FA和FNA浓度随反应时间的变化进行分析, 结果见图 5b.由图 5b可知, 第15.5 d和第48.5 d的两个反应周期内, 系统FA浓度均不断降低.第15.5 d的反应周期内系统FA从反应2 h时的59.3 mg·L-1降到反应10 h时的11.4 mg·L-1, 第48.5 d的反应周期内系统在反应2~10 h之间FA浓度由42.5 mg·L-1降至0.9 mg·L-1.而系统内FNA浓度逐步升高, 反应2~10 h内, 第15.5 d周期系统内FNA浓度由0.012 mg·L-1升至0.043 mg·L-1, 第48.5 d周期系统内FNA浓度由0.02 mg·L-1升至0.17 mg·L-1.文献报道, FA浓度为0.1~1.0 mg·L-1时, NOB活性受到抑制, 而AOB对FA的耐受浓度达10~150 mg·L-1(Anthonisen et al., 1976).FNA浓度达到0.011 mg·L-1时, 可对NOB产生较明显的抑制, 而当FNA浓度为0.50 mg·L-1左右时, AOB仍具有较高的活性(Vadivelu et al., 2006).故无论是FA浓度, 还是FNA浓度, 在反应阶段均可对NOB造成抑制, 从而使AOB成为反应器的优势菌, 成功实现短程硝化.此外, 本实验中低DO浓度(0.25~0.80 mg·L-1)也是实现短程硝化的一个重要因素(Wiesmann, 1994; Laanbroek et al., 1994).
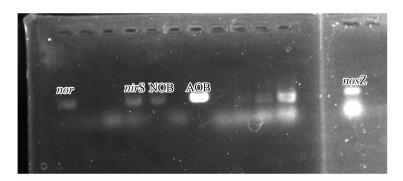
3.5 系统中脱氮功能基因和微生物群落分析对受高有机负荷冲击后恢复中(第62 d)的短程硝化污泥脱氮功能基因进行分析, 结果见图 6.结果表明, 氨氧化基因(AOB amoA)、亚硝酸盐氧化基因(NOB nxrB)、反硝化基因(nirS)、NO还原基因(nor)和NO2还原基因(nosZ)均有亮带, 说明系统具有实现NH4+→NOx→NO→N2O→N2的完整脱氮过程的脱氮基因.
图 6(Fig. 6)
 |
| 图 6 功能基因凝胶电泳条带 Fig. 6Functional gene gel electrophoresis bands |
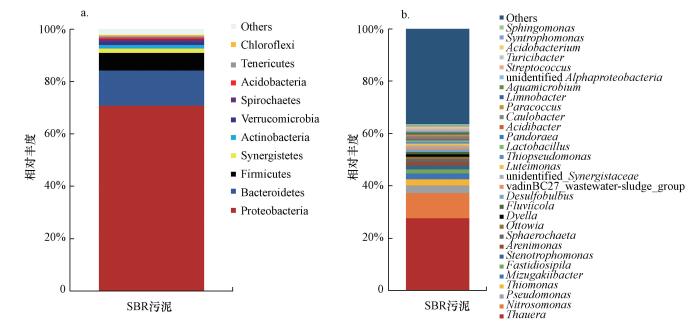
对第62 d的污泥提取DNA, 进行PCR扩增及16S rRNA测序研究, 结果如图 7所示.由图 7可见, 从菌群门水平上分析, 在本短程硝化反应体系中, 有3个门的细菌相对丰度较高, 其中, 菌群丰度最高的是Proteobacteria(变形菌门), 其所占比例接近总菌群的71%, 在废水中有机物的降解和脱氮过程中起重要作用;其次是Bacteroidetes(拟杆菌门)和Firmicutes(厚壁菌门), 分别占总菌群丰度的13.4%和6.7%.此外, 丰度大于1%的还有Synergistetes(互养菌门)、Actinobacteria(放线菌门)、Verrucomicrobia (疣微菌门)和Spirochaetes(螺旋体门).吕卓(2012)、彭青(2013)和Liu等(2017)对垃圾废液生物处理系统中微生物群落进行分析, 发现Proteobacteria(变形菌门)、Actinobacteria(放线菌门)、Chloroflexi (绿弯菌门)、Firmicutes(厚壁菌门)、Planctomycetes(浮霉菌门)及Bacterioidetes(拟杆菌门)为系统优势菌门, 与本研究中的情况基本相符.
图 7(Fig. 7)
 |
| 图 7 门(a)和属(b)分类水平物种的相对丰度 Fig. 7Distributions of bacteria in partial nitrification system at phylum level (a) and genus level (b) |
从菌群属水平上分析, 相对丰度排名前10的菌属有Thauera(索氏菌属)、Nitrosomonas(亚硝化单胞菌属)、Pseudomonas(假单胞菌)、Thiomonas、Mizugakiibacter、Fastidiosipila、Stenotrophomonas(寡养单胞菌属)、Arenimonas、Sphaerochaeta、Ottowia.其中, 索氏菌属和亚硝化单胞菌属为反应系统的主要优势功能菌属, 相对丰度分别为27.6%和9.6%.索氏菌属作为典型的异养菌, 具有反硝化功能, 并对多种芳香族污染物具有降解能力(侯爱月等, 2016), 广泛存在于活性污泥处理装置中(Kraigher et al., 2008), 垃圾沥滤液进水含有比较高的有机物, 且该短程硝化系统经过高有机负荷冲击是其成为优势功能菌属的主要原因.第二大菌属为Nitrosomonas属, 即氨氧化菌(AOB), 属快生型菌(r-strategists), 底物亲和力常数较高, 可以在高浓度底物下生长(Jubany et al., 2009), 在垃圾沥滤液短程硝化系统中作为优势功能菌保证了稳定的短程硝化性能, 与进水垃圾沥滤液的NH4+-N浓度相对较高有关.其属下鉴定出的Nitrosomonas europaea是一种特殊的具有自养反硝化功能的AOB, 可利用氢为电子供体, 亚硝酸盐为电子受体进行反硝化(Poth et al., 1985).此外, 本垃圾沥滤液短程硝化系统中鉴定出的其他菌属如Pseudomona属的细菌多具有分解蛋白质和脂肪等有机物能力, 其属下鉴定出的Pseudomonas pertucinogena(穿孔假单胞菌)具有高效降解有机物的能力(张多英等, 2011).除Pseudomona属细菌外, Stenotrophomonas属和Fastidiosipila属细菌同样具有降解有机物能力, 其中, Stenotrophomonas属细菌在偶氮染料降解污泥(解井坤等, 2014)和A2O工艺中的好氧池污泥(吕晶华等, 2012)中均有发现, Fastidiosipila属细菌出现于垃圾渗滤液生物处理反应器中(Xie et al., 2014).Ottowia属细菌可进行有机物降解, 一部分为兼性厌氧产N2O菌(孙法迁, 2013).
综上所述, 受高有机负荷冲击后的垃圾沥滤液短程硝化体系主要以异养的索氏菌属为主, 并具有一定数量的其他可进行有机物降解的菌属, AOB是第二大菌群, 是硝化过程中是优势菌群, 保证了高效的短程硝化性能.
4 结论(Conclusions)1) 垃圾沥滤液有机物含量高, 易波动, COD在3324~8250 mg·L-1之间变化, BOD在1262~5563 mg·L-1之间浮动;氨氮含量较为稳定, 为1000 mg·L-1左右.
2) 以垃圾沥滤液为处理对象, 接种全程硝化污泥, 15 d后成功实现短程硝化, 氨氮去除速率(ARR)为652 mg·L-1·d-1, 亚硝化积累率为91.4%.
3) 进水BOD较高时(>2000 mg·L-1)易对短程硝化系统造成影响, ARR降低, 但进水有机物浓度降低后系统可恢复.
4) 系统在稳定高效短程硝化阶段FA浓度为0.9~42.5 mg·L-1, FNA浓度为0.02~0.17 mg·L-1(第48.5 d).
5) 系统具有完整的脱氮功能基因, 第一大优势菌属为异养的索氏菌属(Thauera), 第二大菌群为亚硝化单胞菌属(Nitrosomonas).菌群结构与系统能遭受高有机负荷冲击及其硝化反硝化作用密切相关, 此外, 系统还存在一定比例的其他功能菌属.
参考文献
| Anthonisen A C, Srinath E G. 1976. Inhibition of nitrification by ammonia and nitrous-acid[J]. Journal-Water Pollution Control Federation, 48(5): 835–852. |
| Braker G, Tiedje J M. 2003. Nitric oxide reductase (norB) genes from pure cultures and environmental samples[J]. Applied & Environmental Microbiology, 69(6): 3476. |
| Dang Y, Ye J, Mu Y, et al. 2013. Effective anaerobic treatment of fresh leachate from MSW incineration plant and dynamic characteristics of microbial community in granular sludge[J]. Applied Microbiology and Biotechnology, 97(24): 10563–10574.DOI:10.1007/s00253-013-4792-2 |
| Dong H, Zhang K, Han X, et al. 2017. Achievement, performance and characteristics of microbial products in a partial nitrification sequencing batch reactor as a pretreatment for anaerobic ammonium oxidation[J]. Chemosphere, 183: 212–218.DOI:10.1016/j.chemosphere.2017.05.119 |
| Fukushima T, Whang L M, Chiang T Y, et al. 2013. Nitrifying bacterial community structures and their nitrification performance under sufficient and limited inorganic carbon conditions[J]. Applied Microbiology and Biotechnology, 97(14): 6513–6523.DOI:10.1007/s00253-012-4436-y |
| Gu S, Wang S, Yang Q, et al. 2012. Start up partial nitrification at low temperature with a real-time control strategy based on blower frequency and pH[J]. Bioresource Technology, 112(3): 34–41. |
| 国家环境保护总局《水和废水监测分析方法》编委会. 2002. 水和废水监测分析方法(第4版)[M]. 北京: 中国环境科学出版. |
| Hirsch M D, Long Z T, Song B. 2011. Anammox bacterial diversity in various aquatic ecosystems based on the detection of hydrazine oxidase genes (hzoA/hzoB)[J]. Microbial Ecology, 61(2): 264–276.DOI:10.1007/s00248-010-9743-1 |
| 侯爱月, 李军, 卞伟, 等. 2016. 不同短程硝化系统中微生物群落结构的对比分析[J]. 中国环境科学, 2016, 36(2): 428–436. |
| Jubany I, Lafuente J, Baeza J A, et al. 2009. Total and stable washout of nitrite oxidizing bacteria from a nitrifying continuous activated sludge system using automatic control based on oxygen uptake rate measurements[J]. Water Research, 43(11): 2761–2772.DOI:10.1016/j.watres.2009.03.022 |
| Kraigher B, Kosjek T, Heath E, et al. 2008. Influence of pharmaceutical residues on the structure of activated sludge bacterial communities in wastewater treatment bioreactors[J]. Water Research, 42(17): 4578–4588.DOI:10.1016/j.watres.2008.08.006 |
| Laanbroek H J, Bodelier P L E, Gerards S. 1994. Oxygen consumption kinetics of Nitrosomonas europaea and Nitrobacter hamburgensis grown in mixed continuous cultures at different oxygen concentrations[J]. Archives of Microbiology, 161(2): 156–162.DOI:10.1007/BF00276477 |
| Liu J, Zhang H, Zhang P, et al. 2017. Two-stage anoxic/oxic combined membrane bioreactor system for landfill leachate treatment:Pollutant removal performances and microbial community[J]. Bioresource Technology, 243: 738–746.DOI:10.1016/j.biortech.2017.07.002 |
| 吕晶华, 马挺, 郑先强, 等. 2012. PCR-DGGE技术解析A2/O工艺好氧单元中微生物群落结构[J]. 环境工程学报, 2012, 6(6): 1907–1914. |
| 吕卓. 2012. 处理渗滤液陈垃圾生物反应器脱氮功能微生物分子解析[D]. 上海: 华东师范大学 |
| 彭青. 2013. 陈垃圾反应器处理渗滤液脱氮功能微生物研究[D]. 上海: 华东师范大学 |
| Pester M, Maixner F, Berry D, et al. 2014. NxrB encoding the beta subunit of nitrite oxidoreductase as functional and phylogenetic marker for nitrite-oxidizing Nitrospira[J]. Environmental Microbiology, 16(10): 3055–3071.DOI:10.1111/emi.2014.16.issue-10 |
| Poth M, Focht D D. 1985. 15N kinetic analysis of N2O production by Nitrosomonas europaea:an examination of nitrifier denitrification[J]. Applied & Environmental Microbiology, 49(5): 1134–1141. |
| Qian Y, Peng D, Bo W, et al. 2017. Effect of free ammonium and free nitrous acid on the activity, aggregate morphology and EPS distribution of ammonium oxidizing bacteria in partial nitrification[J]. Journal of Bioscience & Bioengineering, 24(3): 319–326. |
| 孙法迁. 2013. 垃圾渗滤液原位与异位耦合脱氮工艺及其机理研究[D]. 杭州: 浙江大学http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2405206 |
| Soliman M, Eldyasti A. 2016. Development of partial nitrification as a first step of nitrite shunt process in a sequential batch reactor (SBR) using ammonium oxidizing bacteria (AOB) controlled by mixing regime[J]. Bioresource Technology, 221: 85.DOI:10.1016/j.biortech.2016.09.023 |
| Throb?ck I N, Enwall K, Jarvis A, et al. 2004. Reassessing PCR primers targeting nirS, nirK and nosZ genes for community surveys of denitrifying bacteria with DGGE[J]. Fems Microbiology Ecology, 49(3): 401–417.DOI:10.1016/j.femsec.2004.04.011 |
| Vadivelu V M, Yuan Z, Fux C, et al. 2006. The inhibitory effects of free nitrous acid on the energy generation and growth processes of an enriched nitrobacter culture[J]. Environmental Science & Technology, 40(14): 4442–4448. |
| Van D T, Lee T K, Shukla S K, et al. 2013. Increased nitrous oxide accumulation by bioelectrochemical denitrification under autotrophic conditions:Kinetics and expression of denitrification pathway genes[J]. Water Research, 47(19): 7087–7097.DOI:10.1016/j.watres.2013.08.041 |
| Villaverde S, García-Encina P A, Fdz-Polanco F. 1997. Influence of pH over nitrifying biofilm activity in submerged biofilters[J]. Water Research, 31(5): 1180–1186.DOI:10.1016/S0043-1354(96)00376-4 |
| 王晓莲, 彭永臻. 2009. A2/O法污水生物脱氮除磷处理技术与应用[M]. 北京: 科学出版社. |
| Wiesmann U. 1994. Biological nitrogen removal from wastewater[J]. Advances in Biochemical Engineering/Biotechnology, 51: 113–154.DOI:10.1007/BFb0008731 |
| 吴莉娜, 徐莹莹, 史枭, 等. 2016. 短程硝化-厌氧氨氧化组合工艺深度处理垃圾渗滤液[J]. 环境科学研究, 2016, 29(4): 587–593. |
| 解井坤, 朱超, 花莉. 2014. 脱水污泥中脱色偶氮染料功能菌群的驯化分离[J]. 微生物学通报, 2014, 41(12): 2432–2441. |
| Xie Z, Wang Z, Wang Q, et al. 2014. An anaerobic dynamic membrane bioreactor (AnDMBR) for landfill leachate treatment:performance and microbial community identification[J]. Bioresource Technology, 161(3): 29–39. |
| Yang Y, Chen Z, Wang X, et al. 2017. Partial nitrification performance and mechanism of zeolite biological aerated filter for ammonium wastewater treatment[J]. Bioresource Technology, 241: 473.DOI:10.1016/j.biortech.2017.05.151 |
| 尹军, 谭学军, 王雪峰, 等. 2007. 有机物降解和硝化过程中污泥摄氧速率的变化[J]. 中国环境科学, 2007, 27(4): 524–528. |
| Zhang Y, Chen L, Dai T, et al. 2015. The influence of salinity on the abundance, transcriptional activity, and diversity of AOA and AOB in an estuarine sediment:a microcosm study[J]. Applied Microbiology & Biotechnology, 99(22): 9825–9833. |
| 张多英, 李伟光, 刘苗. 2011. 降解水源水中有机物的优势菌筛选及其特性[J]. 哈尔滨工业大学学报, 2011, 43(8): 44–49.DOI:10.11918/j.issn.0367-6234.2011.08.010 |
