 , 赵群芬
, 赵群芬

宁波大学海洋学院, 宁波 315211
收稿日期: 2017-07-26; 修回日期: 2017-09-19; 录用日期: 2017-09-19
基金项目: 浙江省自然科学基金(No.ZX2013000355)
作者简介: 兰丽贞(1992—), 女, E-mail: 13484293951@163.com
通讯作者(责任作者): 赵群芬, 博士, 副教授, 硕士生导师, 主要研究方向为:纳米材料的生物学效应及其安全性, 环境生物学. E-mail: zhaoqunfen@nbu.edu.cn
摘要: 为了探讨纳米材料对植物的生理效应,以拟南芥(Arabidopsis thaliana)作为受试生物,研究了纳米TiO2在拟南芥中的富集、转运及对其生长和生理的影响.本研究将拟南芥分别暴露于浓度为0、0.05、0.1、0.5、1.0、1.5 mg·L-1的纳米TiO2中,通过ICP-MS测定纳米TiO2在根和叶中的生物积累量,并采用TEM技术观察纳米TiO2转运至叶片后对叶绿体结构的影响.在处理0、7和14 d后,测定拟南芥生物量、根系活力、叶片相对电导率和超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽(GSH)、活性氧自由基(ROS)等生长生理指标的变化.结果显示:拟南芥能吸收纳米TiO2并向地上部转运,但转运系数较低;TEM切片观察到纳米TiO2能进入拟南芥体内并造成叶绿体内囊体中质体小球数目增多、体积变大.与对照组相比,幼苗地上部生物量、叶片相对电导率、叶肉原生质体活力呈下降的趋势,地下部生物量及根系活力呈上升趋势;纳米TiO2还可引起叶片及根部活性氧(ROS)含量的变化,进而导致MDA、SOD、GSH等抗氧化体系酶活性的应激变化,同时与根部相比,叶片引起的毒性效应更强.说明纳米TiO2在拟南芥中富集并转运至地上部后,对拟南芥叶片的生长具有显著的抑制作用,诱导其产生氧化应激.同时,一定浓度的纳米TiO2胁迫下,拟南芥根部与叶片对纳米TiO2的响应不同,敏感度存在差异,叶生长受到抑制的同时却对根有促进作用.
关键词:纳米TiO2拟南芥富集生理
Accumulation, transport of nano-TiO2 and their effects on growth and physiology in Arabidopsis thaliana
LAN Lizhen
 , ZHAO Qunfen
, ZHAO Qunfen

School of Marine Sciences, Ningbo University, Ningbo 315211
Received 26 July 2017; received in revised from 19 September 2017; accepted 19 September 2017
Supported by the Natural Science Foundation of Zhejiang Province(No.ZX2013000355)
Biography: LAN Lizhen(1992—), female, E-mail: 13484293951@163.com
*Corresponding author: ZHAO Qunfen, E-mail: zhaoqunfen@nbu.edu.cn
Abstract: In order to investigate the impact of nano materials on plants, this investigation focused on the accumulation and transport of nano-TiO2 in Arabidopsis thaliana and their effects on the growth and physiological responses. In this study, Arabidopsis thaliana was exposed to nano-TiO2 of various concentrations (0, 0.05, 0.1, 0.5, 1.0, 1.5 mg·L-1), the accumulation of nano-TiO2 in roots and leaves were observed using ICP-MS, and the changes of chloroplast in leaves were observed using TEM. In the nano-TiO2 treatment for 0, 7 and 14 d, we measured the changes of biomass, root activity, leaf relative conductivity and superoxide dismutase (SOD), malondialdehyde (MDA), glutathione (GSH), and reactive oxygen species (ROS) in treated Arabidopsis thaliana. The experimental group showed that Arabidopsis absorbs nano-TiO2, which is then transported to the upper part; however, the transport coefficient was low. In addition, in the TEM slices, nano-TiO2 was observed in the body of Arabidopsis, which exhibited a larger volume and a larger number of plastids. In contrast, the control group exhibited a decreasing pattern for the aboveground biomass, relative electrical conductivity of leaves, and the activity of mesophyll protoplasts. We also obersed that nano-TiO2 leads to the change of reactive oxygen species (ROS) content in leaves, which further leads to the stress changes of MDA, SOD, GSH and other antioxidant enzymes. The results showed that the enrichment of nano-TiO2 in Arabidopsis thaliana and the transport to the shoot had a significant inhibitory effect on the growth of Arabidopsis leaves and induced oxidative stress. At the same time with the stress of a certain concentration of nano-TiO2, the response of root and leaf to nano-TiO2 was different, also the sensitivity.
Key words: nano-TiO2Arabidopsis thalianaaccumulationphysiology
1 引言(Introduction)纳米材料(Nanomaterials)是指颗粒的尺寸在三维结构中至少有一维是介于纳米尺度(1~100 nm)(Zuo et al., 2013), 因其在力学、热学、磁学、光学、电学及化学等方面显示出许多的特性(Nal et al., 2006), 而被广泛应用于能源、环境、材料、医药、电子、信息、农业及航空航天等领域(Zuo et al., 2006; Chang et al., 2015).纳米材料在生产、使用中引起的潜在生物毒性和生态效应及环境行为等问题已逐渐引起公众的广泛重视和讨论(李曼路等, 2015).目前, 关于纳米材料的生物毒性的研究主要集中于动物和微生物, 而对植物的纳米毒理研究依旧处于摸索阶段(Ma et al., 2010).植物作为食物链中的生产者, 是生态系统的重要组成部分, 同时也是动物和人类的食物来源, 是毒性物质蓄积的起点(Miralles et al., 2012), 纳米材料经由食物链进行积累、迁移、转化和生物放大, 对主要使用者特别是人类的健康产生不同程度的影响.因此, 研究植物对纳米材料的响应及纳米材料对植物的生物毒性效应和致毒的可能机制, 更易于了解纳米材料在进入生态系统后产生的影响, 对于进一步探讨纳米材料的生态毒理学具有重要的意义.
纳米TiO2作为常见的纳米材料, 被大规模地应用于生物、医疗、颜料、食品、护肤品、环境治理等行业中(Gottschalk et al., 2011).相关研究显示, 纳米TiO2能被植物吸收、转运和富集, 在植物根部呈现一定的分布格局(Kurepa et al., 2010), 对植物的根系生长、叶绿素和可溶性蛋白含量(Raliya et al., 2015)、净光合速率会产生影响(Gao et al., 2013), 可通过诱导产生过量ROS导致脂质、DNA和蛋白质等物质的氧化(Kohen et al., 2002), 或直接攻击细胞DNA(Wakefield et al., 2004), 导致细胞生理代谢紊乱, 最终死亡(Feng et al., 2000).但之前研究者采用的纳米材料浓度普遍较高, 与真实环境中纳米材料浓度存在差距, 且绝大多数研究都仅仅是集中于植物的萌发阶段或早期生长阶段, 暴露时间比较短.
本研究选择模式生物拟南芥(Arabidopsis thaliana)作为受试生物, 模拟环境中的纳米TiO2浓度, 研究环境中纳米颗粒对植物的毒性效应, 探讨水环境中纳米TiO2在植物体中的生物富集作用及其对植物生长发育的影响, 以期为深入研究纳米颗粒的植物分子致毒机制提供重要的基础数据, 同时为纳米材料的环境安全评价提供依据.
2 材料与方法(Materials and methods)2.1 材料纳米TiO2购于杭州大洋纳米新材料有限公司, 根据本实验室之前的研究(周占清等, 2013), 其粒径主要集中在(150±50) nm.拟南芥种子(Col-0)由朱世华教授实验室惠赠.SYBR? Premix Ex TaqTM Ⅱ (Tli RNaseH Plus)、RNAiso Plus试剂盒购于TaKaRa, 超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽(GSH)、活性氧自由基(ROS)测定试剂盒购于南京建成生物研究所.
2.2 方法2.2.1 染毒处理用去离子水配置纳米TiO2悬浮母液, 每次使用前先超声30 min至完全悬浮, 加入Hoagland营养液稀释, 配置成0.05、0.1、0.5、1.0、1.5 mg·L-1的纳米TiO2悬浮液进行水培.
2.2.2 拟南芥植株培养首先采用75%酒精对哥伦比亚生态型(Col-0)拟南芥种子进行表面消毒, 时间30 s, 而后用无菌水漂洗1次, 再用2.5%次氯酸钠溶液浸泡8 min后, 无菌水漂洗6次.种子消毒后用灭菌的镊子点播于1/2 MS固体培养基(3%蔗糖, 1%琼脂, pH=5.8)上, 每皿36粒种子(培养皿10 cm×10 cm).4 ℃春化48 h后竖直放入光照培养箱(光照强度6000 lx, 温度25 ℃, 空气湿度70%~80%)中进行培养(日光16 h, 黑暗8 h).培养10 d后, 选择长势一致的幼苗移入泡沫浮漂中进行缓苗, 缓苗2 d后, 转移到带孔的泡沫板上进行水培, 水培溶液采用1/4 Hoagland培养液, pH=5.8, 每周更换一次培养液.
2.2.3 纳米材料的吸收与转运参考吕继涛等(2011)的方法, 在浓度分别为0、0.05、0.1、0.5、1.0、1.5 mg·L-1的纳米TiO2悬浮液中处理0、7、14 d后进行幼苗中Ti含量测定, 具体操作为:分别取处理后的幼苗根和地上部分, 用去离子水冲洗根表面, 再用浓度为20 mmol·L-1的EDTA-2Na溶液浸泡根系15 min后用去离子水反复冲洗去除根表面吸附的离子和纳米TiO2;分别烘干根和地上部并研磨成粉, 用硝酸-过氧化氢消解法消解, 消解后的样品采用电感耦合离子体质谱仪(Agilent, 7500c ICP-MS)测定Ti含量, 每组设置3个平行样, 计算纳米TiO2的生物积累量和转运系数.Ti在拟南芥幼苗中的生物积累量用Ti的总积累量与总干重之比表示;生物转运系数用地上部分Ti总量与根系中Ti总量之比表示.
2.2.4 叶片中纳米TiO2转运及对叶绿体的影响参考周占清等(2013)的研究, 将纳米TiO2暴露14 d后, 将高浓度(1.5 mg·L-1)处理组与对照组的拟南芥叶片切成细小组织块, 置于2.5%戊二醛固定液中固定, 经脱水、包埋、固化、切片、染色后, 用透射电子显微镜(Transmission Electron Microscope, TEM)观察拟南芥叶片中纳米TiO2转运情况及对叶绿体的影响.
2.2.5 幼苗生长指标选择20日龄左右长势一致的幼苗进行实验, 对照组采用1/4 Hoagland培养液, 实验组在1/4 Hoagland培养液中添加不同浓度(0.05、0.1、0.5、1.0、1.5 mg·L-1)的纳米TiO2.在纳米TiO2处理后的7、14 d, 测定拟南芥幼苗生物量、叶片相对电导率(陈爱葵等, 2010)及根系活力(刘萍等, 2007), 每组设置3个平行样.
2.2.6 原生质体活力检测原生质体活力的检测参考赵严伟等(2011)的方法, 拟南芥在不同浓度(0、0.05、0.1、0.5、1、1.5 mg·L-1)的纳米TiO2暴露0、6、12、24、48 h后, 拟南芥叶片经酶解提取原生质体, 用WI培养液稀释成适当浓度, 用0.01%的荧光素双醋酸酯进行染色, 处理5 min后置于荧光显微镜下观察, 其中, 发绿色荧光的为具有活性的原生质体, 每组设3个平行.
2.2.7 抗氧化酶活性测定纳米TiO2暴露7、14 d后, 分开植株的叶片及根部, 按质量体积比1: 9(g: mL)的比例加入匀浆缓冲液(0.01 mol·L-1 Tris-HCl、0.001 mol·L-1 EDTA-2Na、0.01 mol·L-1蔗糖, pH=7.4)研磨, 3000 r·min-1离心, 取上清液, 用于生理指标的测定.采用考马斯亮蓝法测定蛋白浓度, 超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽(GSH)、活性氧自由基(ROS)等测定方法均按试剂盒说明书进行操作, 每组设置3个平行样.
2.3 实验数据处理对所有实验数据采用SPSS19.0软件进行统计分析, 方差分析采用One Way ANOVA, 并以Tukey's test多重比较;p<0.05为显著性差异, p<0.01为极显著差异.
3 结果(Results)3.1 拟南芥中纳米TiO2的含量图 1为暴露在不同浓度纳米TiO2下拟南芥根部(图 1a)和地上部(图 1b)中纳米TiO2含量随时间的变化.与对照组(CK)相比, 处理7、14 d, 根部纳米TiO2含量和地上部纳米TiO2含量均显著上升(p<0.01), 且纳米TiO2含量随着暴露时间的延长和处理浓度的增高而逐渐增多.暴露时间相同时, 地上部分中纳米TiO2含量均低于根部中TiO2含量.处理7、14 d时, 高浓度(1.5 mg·L-1)组地上部纳米TiO2含量仅为根部的13.02%、24.74%.
图 1(Fig. 1)
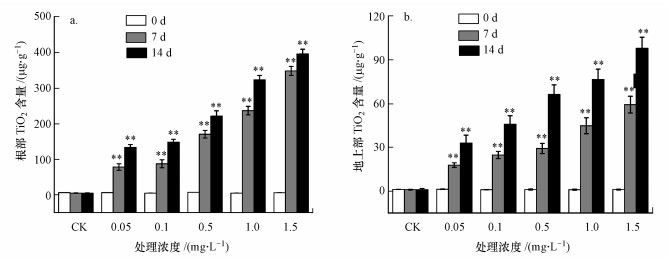 |
| 图 1 拟南芥根部(a)及地上部(b)TiO2累积量(与对照组比较:*p<0.05, **p<0.01, 下同) Fig. 1Accumulation of TiO2 in root (a) and shoot (b) of Arabidopsis thaliana |
3.2 叶片中纳米TiO2转运及对叶绿体的影响图 2为拟南芥叶片中叶绿体的TEM照片, 可以看出, 用1.5 mg·L-1纳米TiO2处理14 d后(图 2b), 与对照组相比(图 2a), 拟南芥叶绿体中存在纳米TiO2, 同时质体小球数目逐渐积累, 体积也增大.
图 2(Fig. 2)
 |
| 图 2 拟南芥叶片的透射电镜图(a.对照组, b.1.5 mg·L-1处理组) Fig. 2TEM image of Arabidopsis thaliana leaves(a.control, b.1.5 mg·L-1) |
3.3 纳米TiO2对拟南芥生物量的影响从表 1可知, 纳米TiO2对拟南芥幼苗地上部和地下部的鲜重没有显著性影响(p>0.05), 但随着处理浓度的增加, 与对照组相比, 地上部鲜重下降, 而地下部鲜重呈上升的趋势.
表 1(Table 1)
| 表 1 纳米TiO2对拟南芥地下部、地上部鲜重和干重的影响 Table 1 Effect of nano-TiO2 on Arabidopsis thaliana fresh weight of root and shoot | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 纳米TiO2对拟南芥地下部、地上部鲜重和干重的影响 Table 1 Effect of nano-TiO2 on Arabidopsis thaliana fresh weight of root and shoot
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.4 纳米TiO2对拟南芥叶片相对电导率、根系活力的影响从图 3可知, 与对照组相比, 处理7 d时, 1.5 mg·L-1纳米TiO2造成拟南芥相对电导率显著升高(p<0.05);在1.0和1.5 mg·L-1纳米TiO2处理14 d时均达到了极显著性水平(p<0.01).纳米TiO2对拟南芥幼苗根系活力的影响只在浓度为1.5 mg·L-1时对根系活力有促进作用, 且随着处理时间的延长, 促进程度增加.
图 3(Fig. 3)
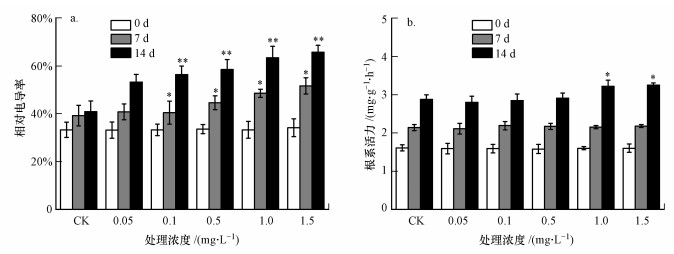 |
| 图 3 纳米TiO2对拟南芥相对电导率(a)、根系活力(b)的影响 Fig. 3Effect of nano-TiO2 on relative conductance rate (a) and root system activity (b) of Arabidopsis thaliana |
3.5 纳米TiO2对拟南芥原生质体活力的影响由图 4可知, 与对照组相比, 不同浓度纳米TiO2处理组均诱导拟南芥叶肉原生质体死亡, 且原生质体活力随着处理浓度和处理时间的增加而降低.1.5 mg·L-1纳米TiO2处理48 h后拟南芥叶肉原生质体活力仅为对照组的60.81%, 下降明显.
图 4(Fig. 4)
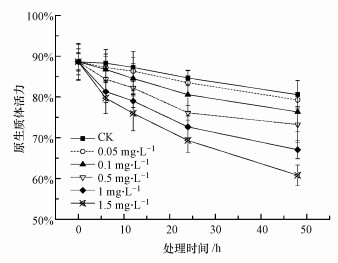 |
| 图 4 纳米TiO2对拟南芥原生质体活力的影响 Fig. 4Effect of nano-TiO2 on protoplast vitality of Arabidopsis thaliana |
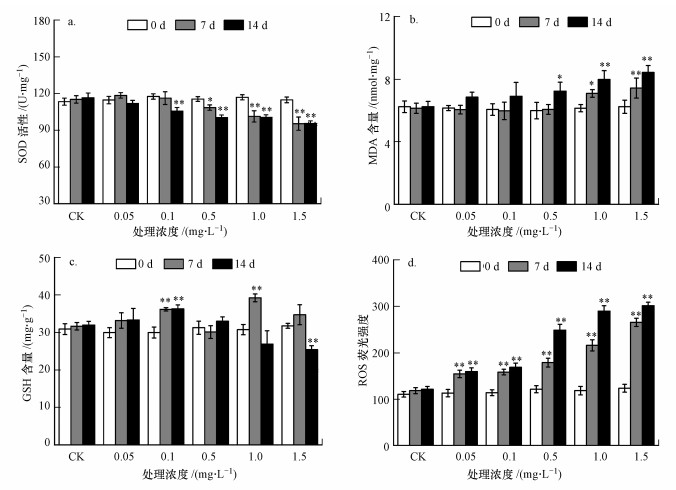
3.6 纳米TiO2对拟南芥SOD、MDA、GSH、ROS的影响图 5a、6a分别为纳米TiO2处理下拟南芥叶片及根部SOD活性(以protein计)的变化, 与对照组相比, 实验组中叶片及根部SOD活性均呈下降趋势;处理14 d, 1.5 mg·L-1处理组叶片及根部中SOD活性极显著降低(p<0.01), 达到最小, 分别为对照组的77.70%、95.61%;暴露时间内, 低浓度(0.05 mg·L-1)处理组拟南芥叶片及根部中SOD活性均无显著变化(p>0.05).
图 5(Fig. 5)
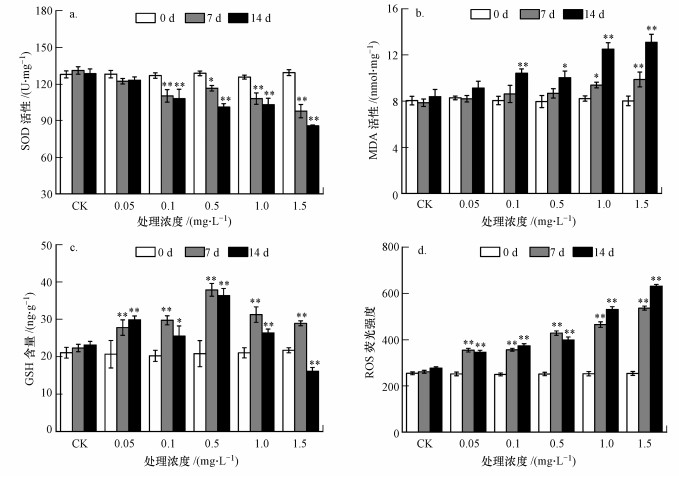 |
| 图 5 纳米TiO2对拟南芥叶片SOD(a)、MDA(b)、GSH(c)和ROS(d)的影响 Fig. 5Effect of nano-TiO2 on SOD(a), MDA(b), GSH(c) and ROS(d) of Arabidopsis thaliana leaf |
图 6(Fig. 6)
 |
| 图 6 纳米TiO2对拟南芥根部SOD(a)、MDA(b)、GSH(c)和ROS(d)的影响 Fig. 6Effect of nano-TiO2 on SOD(a), MDA(b), GSH(c) and ROS(d) of Arabidopsis thaliana root |
由图 5b、6b中看出, 处理7 d后低浓度(0.05、0.1 mg·L-1)处理组根部的MDA含量低于对照组, 其他实验组MDA含量均高于对照组, 且随着处理时间的延长和浓度的增加, MDA含量呈上升趋势;在暴露7 d时, 1.5 mg·L-1浓度组叶片及根部MDA含量极显著上升(p<0.01), 而其余浓度组中MDA含量略有上升(p>0.05);处理14 d后, 叶片及根部中MDA含量在1.5 mg·L-1浓度组中的增加趋势更为明显, 分别为对照组的1.56、1.35倍.
暴露于纳米TiO2下拟南芥中GSH活性变化如图 5c、6c所示, 处理7 d时, 随着浓度的增加, 拟南芥叶片中GSH含量呈先升高后降低的趋势, 且均显著性高于对照组(p<0.01), 分别增加了24.54%、33.27%、69.77%、40.12%和29.73%;处理7 d后, 根部GSH含量呈先升高后降低再升高再降低的趋势.处理14 d时, 1.5 mg·L-1浓度组中叶片及根部GSH含量均低于对照组, 达到最小值, 分别仅为对照组的69.59%、78.05%.
如图 5d、6d所示, 处理7 d和14 d时, 实验组拟南芥叶片及根部中ROS含量(本文使用每mg蛋白的ROS荧光强度表征ROS含量)均高于对照组, 且达到极显著性水平(p<0.01);在暴露相同时间下, 随着处理浓度的增加ROS含量增加, 且在暴露14 d后, 1.5 mg·L-1浓度组中ROS含量均最大, 叶片和根部中ROS含量分别为对照组的2.28和2.48倍.
4 讨论(Discussion)4.1 纳米材料的富集与转运许多研究认为, 吸附于植物根表的纳米材料可被植物根系吸收, 进入植物体内(Li et al., 2012; Miralles et al., 2012), 在根部内累积并呈现出一定的分布格局, 或通过共质体和质外体运输方式, 将纳米材料通过导管系统运输到茎叶中(Kurepa et al., 2010).本研究发现, 无论地上部还是地下部, 植物体内纳米TiO2的残留量随培养液中纳米TiO2浓度的增加而增高, 与Lin等(2008)研究黑麦草体内锌的残留量的结果相似.暴露7 d后, 拟南芥根部累积的纳米TiO2含量(78.15~348.06 μg·g-1)远远高于叶片中纳米TiO2的含量(17.84~59.29 μg·g-1);暴露14 d后, 随时间和浓度的增加呈剂量依赖效应, 但速率减缓.Birbaum等(2010)认为, 如果纳米颗粒只是通过吸附与根表作用, 根中纳米颗粒含量会在很短时间(2~4 h)内达到饱和.本研究表明, 在7 d内根中纳米TiO2仍未达到饱和, 因此, 可以认为前7 d纳米颗粒在根表的吸附是主导作用, 而此后根表的吸收占据主导.暴露于纳米TiO2 7、14 d后的转运系数(分别为0.0784~0.0906和0.0726~0.0821)也可说明拟南芥根部吸收纳米TiO2后可以向上运输到达地上部, 并蓄积在组织器官中, 但大部分颗粒仅仅吸附于根表面, 在植株体内的传输非常有限, 只有少量的纳米颗粒能转运至地上部.目前关于纳米颗粒在植物体内的转运机制还不清楚, 有****认为只有粒径<0.5 nm的颗粒才能在植物体内传输(Kurepa et al., 2010), 这也可能是本实验中转运系数低的主要原因.
随着叶片的衰老, 叶绿体中质体小球数量增多、体积增大的现象在白桦树(Betula pendula Roth)(Riikonen et al., 2003)、欧洲油菜(Brassica napus)(Ghosh et al., 2001)、英格兰松(Pinus sylvestris)(Minna et al., 2007)、黄瓜(Cucumis sativus) (Prakash et al., 2001)等植物中均有报道.本研究中利用透射电子显微镜发现, 纳米TiO2可以穿过拟南芥的细胞壁和细胞膜进入细胞内, 并作用于叶绿体, 导致叶绿体的类囊体产生了质体小球高电子密度脂滴逐渐积累的现象, 质体小球体积也随之增大, 这种现象是叶肉细胞衰老的特征(Riikonen et al., 2003).同时, 叶绿体内质体小球数量显著增多, 表明类囊体膜以降解为主(Biswal et al., 1995), 说明拟南芥吸收纳米TiO2后, 对植株体内的组织及器官产生了影响.
4.2 纳米TiO2对拟南芥生长的影响植物的生物量是衡量植物生长状况的重要生理指标之一.Musante和White(2012)分别用纳米Ag和常规Ag处理西葫芦, 发现纳米Ag组显示出更强的毒性, 导致生物量降低.Stampoulis等(2009)的研究也表明, AgNPs可抑制胡瓜根系生长, 降低蒸腾速率和生物量, 但0.01~100 mg·L-1纳米Ag却促进拟南芥的生长, 鲜生物量增加(Srinivas et al., 2012).根系活力显示了根系的组织代谢强度, 并与根系吸收、转运能力息息相关(Wang et al., 2012).郭敏等(2017)研究发现, 水稻在不同浓度的纳米ZnS处理下都显著提高了根系活力.在本研究中, 纳米TiO2处理对拟南芥的生物量较对照无明显差异, 但拟南芥地上部和地下部生物量对纳米TiO2浓度响应不同, 地上部生物量随纳米TiO2处理浓度和时间的增加而减少, 而地下部生物量呈递增趋势.同时, 纳米TiO2对拟南芥幼苗根系活力的影响在低浓度时未显示出明显差异, 但在浓度为1.5 mg·L-1时有促进作用, 且随着处理时间的延长, 促进程度增加.另外, 拟南芥幼苗叶片相对电导率上升, 说明纳米TiO2处理下植物细胞可能由于氧化应激而发生膜脂质过氧化、细胞膜受损、电解质外渗从而导致电导率增加.因此, 在本研究中可以发现, 拟南芥根部与叶片对纳米TiO2的响应不同, 且敏感度存在差异.推测存在这种差异的原因是由于根部自身的防御能力, 根部具有更强的耐胁迫能力, 更能抵御环境中的不良因素, 使得根部的防御系统的平衡更不容易被破坏.说明纳米材料对植物生长的影响机制是复杂的, 同一种纳米材料对植物不同组织器官具有不同的生物学效应.
4.3 纳米TiO2对拟南芥原生质体活力的影响植物原生质体无细胞壁, 被质膜包围(Galston et al., 1986), 具有完整细胞的生理特性, 能在细胞水平上揭示一系列生命过程的本质(Ratanasanobon et al., 2013), 不仅可以在细胞分裂和分化等方面发挥作用(Zhu et al., 2005), 还能进行导入外源基因、病毒侵染等操作(Reddy et al., 2006), 同时在调节植物生长、发育、代谢及适应环境中都有重要意义(Dodd et al., 2010).Serage等(2011)研究证明, 多壁碳纳米管(MWCNTs)通过直接穿刺进入到长春花原生质体中.Shen等(2010)研究表明, 单壁碳纳米管(SWCNTs)能影响拟南芥叶片原生质体, 在原生质体中注射入浓度为250 mg·L-1碳纳米管后, 染色质发生了凝缩, 并引起细胞死亡.另外, Lin等(2009)也发现拟南芥T78悬浮细胞子在多壁碳纳米管(MWCNTs)影响下显示出一定的毒性效应.本研究中同样证明纳米TiO2能抑制拟南芥原生质体的活力, 并且这种抑制作用具有浓度时间效应, 说明纳米TiO2对拟南芥存在细胞毒性, 而且浓度和处理时间是决定其毒性大小的重要因素.
4.4 纳米TiO2对拟南芥生理的影响超氧化物岐化酶(SOD)是生物体内重要的抗氧化酶, 具有特殊的生理活性(Oberd?rster et al., 2004).正常植物体中的叶绿体和线粒体在光合作用和呼吸作用过程中会产生自由基, SOD能清除超氧化物的阴离子自由基, 并产生歧化产物H2O2(Cerqueira et al., 2002).同时在胁迫条件下, 植物体内的氧自由基含量不同程度地提高, 导致SOD活性增强, 以清除植物体中O-2含量.SOD活性的提高是应对O-2含量增加的解毒措施, 可在一定范围内通过其调节使植物细胞免受毒害(Kelly et al., 1998).植物中SOD活性的高低可反映其抗不良环境因素的水平(Oberd?rster et al., 2004).研究发现, 纳米TiO2从活性氧方面积极影响菠菜保护叶绿体膜结构, 从而增加抗氧化酶(如SOD、CAT、POD)活性(Hong et al., 2005).本实验中, 不同剂量纳米TiO2对拟南芥叶片和根部SOD活性的影响基本表现为下降趋势, 说明纳米TiO2对拟南芥叶片和根部都有一定的毒性.14 d长时间胁迫后, 叶片中的SOD活性低于根部, 说明叶片细胞维持更高的O-2, 抑制了拟南芥叶片细胞内的相关活性物质, 毒性影响超出机体的耐受能力.SOD受到损伤致使活性持续下降, 是机体中毒响应的先兆.
丙二醛(MDA)是逆境条件下或植物器官衰老时, 机体在清除自由基中发生脂质过氧化的产物, 可改变细胞膜的流动性、结构和功能, 导致细胞被破坏(Li et al., 2013).根据MDA含量能评估组织的受损情况和受逆境伤害的程度, 因此, MDA作为氧化胁迫的生物标记物被广泛应用(Shaw et al., 2014).Nel等(2006)研究发现, 小麦根细胞在纳米CuO暴露下产生膜脂过氧化, 从而导致植物蛋白的合成受抑制, 造成含量下降.Wang等(2010)报道, 纳米TiO2产生明显的毒性作用是由于诱导了脂质过氧化产物丙二醛(MDA)的增加.本研究中拟南芥叶片及根部各处理组MDA含量呈逐渐增加的趋势, 这是由于随着胁迫的加深, SOD等抗氧化酶清除活性氧的能力有限, 细胞内的自由基不能及时清除而不断积累, 以致于不断攻击脂质膜, 从而使膜系统的脂质过氧化作用增强, 这表明一定的纳米TiO2胁迫后降低了保护酶的活性.同时在本研究中发现, 各处理组叶片中的MDA含量均高于根部, 说明纳米TiO2对叶片具有更强的毒性, 造成更严重的脂质过氧化.
生物体的防御体系中, 除了抗氧化酶参与酶性抗氧化系统外, 还有其它非酶性的抗氧化物质, 如谷胱甘肽(GSH)和维生素C等非酶类物质(Bhor et al., 2004).GSH是一种三肽巯基抗氧化剂(Weldy et al., 2012), 具有特殊的生物学功能, 可以直接清除自由基, 终止连锁反应, 也能作为GSH-PX的辅酶参与反应, 清除自由基造成的损伤.在低微的环境刺激下, GSH能被诱导, 而过量的刺激则会导致GSH的耗竭.因此, GSH在维持机体氧化状态的平衡中起重要作用, 是组织细胞抗氧化损伤的主要抗氧化物质, 能够敏感并综合反映组织的氧化应激能力及受损程度.本实验中发现, 随着纳米TiO2胁迫的加深, 叶片中GSH含量先上升后下降, 根部中GSH含量先上升后下降再上升再下降.GSH含量升高可能是由于拟南芥的自我保护机制, 暴露7 d后, 叶片中GSH含量高于根部, 说明叶片启动防御机制引起GSH含量升高以减轻对植株的损伤;而后随着胁迫时间的延长和浓度的提高, 叶片中GSH含量低于根部, 说明过量的诱导已经超出叶片GSH的清除能力并造成叶片中抗氧化酶系统的紊乱, 致使GSH含量开始下降.说明大量活性氧自由基攻击拟南芥细胞, 使平衡遭到破坏, 产生的活性氧自由基幵始抑制抗氧化酶的活性, 表现出酶活性的下降.
生物体周围环境的污染、紫外照射等多种不良刺激均能导致动植物体内产生自由基(ROS)(Gliszczynskaswiglo et al., 2006), 纳米粒子对细胞的毒性也可归因于活性氧的生成.Kohen等(2002)研究显示, 纳米颗粒的毒性机制与氧化胁迫指标存在相关性, 当细胞内蓄积纳米颗粒后, 可促进产生过量的ROS, 导致生物体内大量大分子物质(如脂质、DNA和蛋白质等)的氧化, 过量的ROS还可能直接攻击细胞DNA(Wakefield et al., 2004), 使细胞生理代谢紊乱, 最终导致细胞死亡(Feng et al., 2000).生物体的抗氧化系统能抵抗ROS诱导的氧化损伤(Svobodová et al., 2006).Ghosh等(2010)研究发现, 纳米TiO2可引起葱、烟草及人淋巴细胞细胞膜的脂质过氧化, 并进一步导致DNA损伤.Wang等(2010)认为纳米TiO2能够显著增强玉米幼苗抗氧化酶系统的活性.Tan等(2009)也证明在MWCNTs处理下, 水稻细胞内氧化自由基(ROS)水平显著升高.另有研究者(Zhao et al., 2007)在特定的环境条件下(紫外光照射等)发现, 纳米TiO2与有机体作用时可导致产生活性氧物质(ROS), 从而引起植物体内氧化胁迫防御机制的应答, 影响植物体内正常的生理代谢活动.本实验中发现ROS含量均升高, 而且随着处理时间的延长和浓度的增加呈现上升的趋势, 且叶片中ROS含量高于根部, 说明拟南芥在纳米TiO2胁迫下, ROS不断在拟南芥体内积累, 叶片更易引起活性氧的增加, 体内活性氧代谢系统受到影响, 细胞自由基(ROS)的产生和清除之间的平衡状态遭到破坏.
5 结论(Conclusions)本研究中拟南芥根对纳米TiO2有很强的吸收和累积, 累积量随暴露浓度的增加而增加.根部吸收纳米TiO2后可以向上运输到达地上部, 并蓄积在组织器官中, 但大部分颗粒仅仅吸附于根表面, 在植株体内的传输非常有限, 只有少量的纳米颗粒能转运至地上部.转运至拟南芥地上部的纳米TiO2对拟南芥的生长、生理具有显著的抑制作用, 可引起原生质体的细胞毒性, 导致活性氧代谢系统遭到破坏, 诱导体内产生过量自由基造成膜脂质过氧化, 使细胞膜受损, 电解质外渗.本研究还发现, 一定浓度的纳米TiO2胁迫下, 拟南芥根部与叶片对纳米TiO2的响应不同, 且敏感度存在差异, 叶片生长受到抑制的同时却对根有促进作用, 且纳米TiO2对叶片具有更强的毒性, 会引起抗氧化系统的破坏.因此, 纳米材料对植物生长的影响机制是复杂的, 同一种纳米材料对植物的不同组织器官具有不同的生物学效应.
参考文献
| Bhor V M, Raghuram N, Sivakami S. 2004. Oxidative damage and altered antioxidant enzyme activities in the small intestine of streptozotocin-induced diabetic rats[J]. International Journal of Biochemistry & Cell Biology, 36(1): 89–97. |
| Birbaum K, Brogioli R, Schellenberg M, et al. 2010. No evidence for cerium dioxide nanoparticle translocation in maize plants[J]. Environmental Science & Technology, 44(22): 8718–8723. |
| Biswal B. 1995. Carotenoid catabolism during leaf senescence and its control by light[J]. Journal of Photochemistry & Photobiology B Biology, 30(1): 3–13. |
| Cerqueira C C, Fernandes M N. 2002. Gill tissue recovery after copper exposure and blood parameter responses in the tropical fish Prochilodus scrofa[J]. Ecotoxicology & Environmental Safety, 52(2): 83–91. |
| Chang Y N, Ou X M, Zeng G M, et al. 2015. Synthesis of magnetic graphene oxide-TiO2 and their antibacterial properties under solar irradiation[J]. Applied Surface Science, 343: 1–10.DOI:10.1016/j.apsusc.2015.03.082 |
| 陈爱葵, 韩瑞宏, 李东洋, 等. 2010. 植物叶片相对电导率测定方法比较研究[J]. 广东教育学院学报, 2010, 30(5): 88–91. |
| Dodd A N, Kudla J, Sanders D. 2010. The language of calcium signaling[J]. Annual Review of Plant Biology, 61(1): 593–620.DOI:10.1146/annurev-arplant-070109-104628 |
| Feng Q L, Wu J, Chen G Q, et al. 2000. A mechanistic study of the antibacterial effect of silver ions on Escherichia coli and Staphylococcus aureus[J]. Journal of Biomedical Materials Research, 52(4): 662–668.DOI:10.1002/(ISSN)1097-4636 |
| Galston A W. 1986. Polyamine metabolism and osmotic stress:I.Relation to protoplast viability[J]. Plant Physiology, 82(2): 369–374.DOI:10.1104/pp.82.2.369 |
| Gao J, Xu G, Qian H, et al. 2013. Effects of nano-TiO2 on photosynthetic characteristics of Ulmus elongata seedlings[J]. Environmental Pollution, 176C(5): 63–70. |
| Ghosh M, Bandyopadhyay M, Mukherjee A. 2010. Genotoxicity of titanium dioxide (TiO2) nanoparticles at two trophic levels:plant and human lymphocytes[J]. Chemosphere, 81(10): 1253–1262.DOI:10.1016/j.chemosphere.2010.09.022 |
| Ghosh S, Mahoney S R, Penterman J N, et al. 2001. Ultrastructural and biochemical changes in chloroplasts during Brassica napus senescence[J]. Plant Physiology & Biochemistry, 39(9): 777–784. |
| Gliszczynskaswiglo A. 2006. Antioxidant activity of water soluble vitamins in the TEAC (trolox equivalent antioxidant capacity) and the FRAP (ferric reducing antioxidant power) assays[J]. Food Chemistry, 96(1): 131–136.DOI:10.1016/j.foodchem.2005.02.018 |
| Gottschalk F, Nowack B. 2011. The release of engineered nanomaterials to the environment[J]. J Environ Monit, 13(5): 1145–1155.DOI:10.1039/c0em00547a |
| 郭敏, 龚继来, 曾光明. 2017. 金属半导体纳米粒子对水培水稻幼苗的毒性及吸收转运规律[J]. 环境科学学报, 2017, 37(1): 395–404. |
| Hong F, Yang F, Liu C, et al. 2005. Influences of nano-TiO2 on the chloroplast aging of spinach under light[J]. Biological Trace Element Research, 104(3): 249–260.DOI:10.1385/BTER:104:3 |
| Kelly K A, Havrilla C M, Brady T C, et al. 1998. Oxidative stress in toxicology:established mammalian and emerging piscine model systems[J]. Environmental Health Perspectives, 106(7): 375–384.DOI:10.1289/ehp.98106375 |
| Kohen R, Nyska A. 2002. Oxidation of biological systems:oxidative stress phenomena, antioxidants, redox reactions, and methods for their quantification[J]. Toxicologic Pathology, 30(6): 620–650.DOI:10.1080/01926230290166724 |
| Kurepa J, Paunesku T, Vogt S, et al. 2010. Uptake and distribution of ultra-small anatase TiO2 Alizarin red S nanoconjugates in Arabidopsis thaliana[J]. Nano Letters, 10(7): 2296–2302.DOI:10.1021/nl903518f |
| Li F M, Zhao W, Li Y Y, et al. 2012. Toxic effects of nano-TiO2 on Gymnodinium breve[J]. Environmental Science, 33(1): 233–238. |
| 李曼璐, 姜玥璐. 2015. 人工纳米颗粒在水体中的行为及其对浮游植物的影响[J]. 环境科学, 2015, 36(1): 365–372. |
| Li Q, Hu X, Bai Y, Alattar M, et al. 2013. The oxidative damage and inflammatory response induced by lead sulfide nanoparticles in rat lung[J]. Food & Chemical Toxicology, 60(10): 213–217. |
| Lin C, Fugetsu B, Su Y, et al. 2009. Studies on toxicity of multi-walled carbon nanotubes on Arabidopsis T87 suspension cells[J]. Journal of Hazardous Materials, 170(2): 578–583. |
| Lin D, Xing B. 2008. Root uptake and phytotoxicity of ZnO nanoparticles[J]. Environmental Science & Technology, 42(15): 5580–5585. |
| 刘萍, 李明军. 2007. 植物生理学实验技术[M]. 北京: 科学出版社: 150–151. |
| 吕继涛, 罗磊, 张淑贞, 等. 2011. 玉米对纳米TiO2的吸收和累积[J]. 环境化学, 2011, 30(5): 903–907. |
| Ma X, Geiser-Lee J, Deng Y, et al. 2010. Interactions between engineered nanoparticles (ENPs) and plants:Phytotoxicity, uptake and accumulation[J]. Science of the Total Environment, 408(16): 3053–3061.DOI:10.1016/j.scitotenv.2010.03.031 |
| Minna K, Sirkka S. 2007. Microscopic structure of Scots pine (Pinus sylvestris (L.)) needles during ageing and autumnal senescence[J]. Trees, 21(6): 645–659.DOI:10.1007/s00468-007-0157-8 |
| Musante C, White J C. 2012. Toxicity of silver and copper to Cucurbita pepo:differential effects of nano and bulk-size particles[J]. Environmental Toxicology, 27(9): 510–517.DOI:10.1002/tox.v27.9 |
| Nel A, Xia T, M?dler L, et al. 2006. Toxic potential of materials at the nanolevel[J]. Science, 311(5761): 622–627.DOI:10.1126/science.1114397 |
| Oberd?rster E. 2004. Manufactured nanomaterials (fullerenes, C60) induce oxidative stress in the brain of juvenile largemouth bass[J]. Environmental Health Perspectives, 112(10): 1058–1062.DOI:10.1289/ehp.7021 |
| Prakash J S, Baig M A, Mohanty P. 2001. Senescence induced structural reorganization of thylakoid membranes in Cucumis sativus cotyledons; LHC Ⅱ involvement in reorganization of thylakoid membranes[J]. Photosynthesis Research, 68(2): 153–161.DOI:10.1023/A:1011876412537 |
| Raliya R, Biswas P, Tarafdar J C. 2015. TiO2 nanoparticle biosynthesis and its physiological effect on mung bean (Vigna radiata L.)[J]. Biotechnology Reports, 5: 22–26.DOI:10.1016/j.btre.2014.10.009 |
| Ratanasanobon K, Seaton K A. 2013. Protoplast isolation for species in the Chamelaucium group and the effect of antioxidant enzymes (superoxide dismutase and catalase) on protoplast viability[J]. In Vitro Cellular & Developmental Biology-Plant, 49(5): 593–598. |
| Reddy C R K, Dipakkore S, Kumar G R, et al. 2006. An improved enzyme preparation for rapid mass production of protoplast as seed stock for aquaculture of macrophytic marine green algae[J]. Aquaculture, 260(1/4): 290–297. |
| Riikonen J, Oksanen E, Peltonen P, et al. 2003. Seasonal variation in physiological characteristics of two silver birc[J]. Canadian Journal of Forest Research, 33(11): 2164–2176.DOI:10.1139/x03-136 |
| Serag M F, Kaji N, Gaillard C, et al. 2011. Trafficking and subcellular localization of multiwalled carbon nanotubes in plant cells[J]. Acs Nano, 5(1): 493–499.DOI:10.1021/nn102344t |
| Servin A D, Castillomichel H, Hernandezviezcas J A, et al. 2012. Synchrotron micro-XRF and micro-XANES confirmation of the uptake and translocation of TiO2 nanoparticles in cucumber (Cucumis sativus) plants[J]. Environmental Science & Technology, 46(14): 7637–7643. |
| Servin A D, Morales M I, Castillomichel H, et al. 2013. Synchrotron verification of TiO2 accumulation in cucumber fruit:a possible pathway of TiO2 nanoparticle transfer from soil into the food chain[J]. Environmental Science & Technology, 47(20): 11592–11598. |
| Shen C X, Zhang Q F, Li J, et al. 2010. Induction of programmed cell death in Arabidopsis and rice by single-wall carbon nanotubes[J]. American Journal of Botany, 97(10): 1602–1609.DOI:10.3732/ajb.1000073 |
| Srinivas A, Rao P J, Selvam G, et al. 2012. Oxidative stress and inflammatory responses of rat following acute inhalation exposure to iron oxide nanoparticles[J]. Human & Experimental Toxicology, 31(11): 1113–1131. |
| Stampoulis D, Sinha S K, White J C. 2009. Assay-dependent phytotoxicity of nanoparticles to plants[J]. Environmental Science & Technology, 43(24): 9473–9479. |
| Svobodová A, Walterová D, Psotová J. 2006. Influence of silymarin and its flavonolignans on HO-induced oxidative stress in human keratinocytes and mouse fibroblasts[J]. Burns Journal of the International Society for Burn Injuries, 32(8): 973–979.DOI:10.1016/j.burns.2006.04.004 |
| Tan X M, Lin C, Fugetsu B. 2009. Studies on toxicity of multi-walled carbon nanotubes on suspension rice cells[J]. Carbon, 47(15): 3479–3487.DOI:10.1016/j.carbon.2009.08.018 |
| Wakefield G, Green M, Lipscomb S, et al. 2004. Modified titania nanomaterials for sunscreen applications-reducing free radical generation and DNA damage[J]. Materials Science and Technology, 20(8): 985–988.DOI:10.1179/026708304225019803 |
| Wang J, Koo Y, Alexander A, et al. 2013. Phytostimulation of poplars and arabidopsis exposed to silver nanoparticles and Ag+ at sublethal concentrations[J]. Environmental Science & Technology, 47(10): 5442–5449. |
| Wang Z Y, Yu X L, Gao D M, et al. 2010. Effect of nano-rutile TiO2 and multiwalled carbon nanotubes on the growth of maize (Zea mays L.) seedlings and the relevant antioxidant response[J]. Environmental Science, 31(2): 480–487. |
| Weldy C S, Luttrell I P, White C C, et al. 2012. Glutathione (GSH) and the GSH synthesis gene Gclm modulate vascular reactivity in mice[J]. Free Radical Biology & Medicine, 53(6): 1264–1278. |
| Zhao X U, Li Z, Chen Y, et al. 2007. Solid-phase photocatalytic degradation of polyethylene plastic under UV and solar light irradiation[J]. Journal of Molecular Catalysis A Chemical, 268(1/2): 101–106. |
| 赵严伟, 黄志刚, 李合松. 2011. 洗液对拟南芥叶原生质体分离的影响[J]. 中国农学通报, 2011, 27(12): 187–190. |
| 周占清, 陈晓菲, 赵群芬. 2013. 纳米TiO2和ZnO对杜氏盐藻氧化损伤机理的研究[J]. 生物物理学报, 2013, 29(12): 925–936. |
| Zhu L Q, Wang B C, Zhou J, et al. 2005. Protoplast isolation of callus in Echinacea augustifolia[J]. Colloids & Surfaces B Biointerfaces, 44(1): 1–5. |
| Zuo G, Kang S G, Xiu P, et al. 2013. Interactions between proteins and carbon-based nanoparticles:exploring the origin of nanotoxicity at the molecular level[J]. Small, 9(9/10): 1546–1556. |
