2.济南大学水利与环境学院,济南 250022
1.Institute of Environment and Ecology, Shandong Normal University, Jinan 250358, China
2.School of Water Conservancy and Environment, University of Jinan, Jinan 250022, China
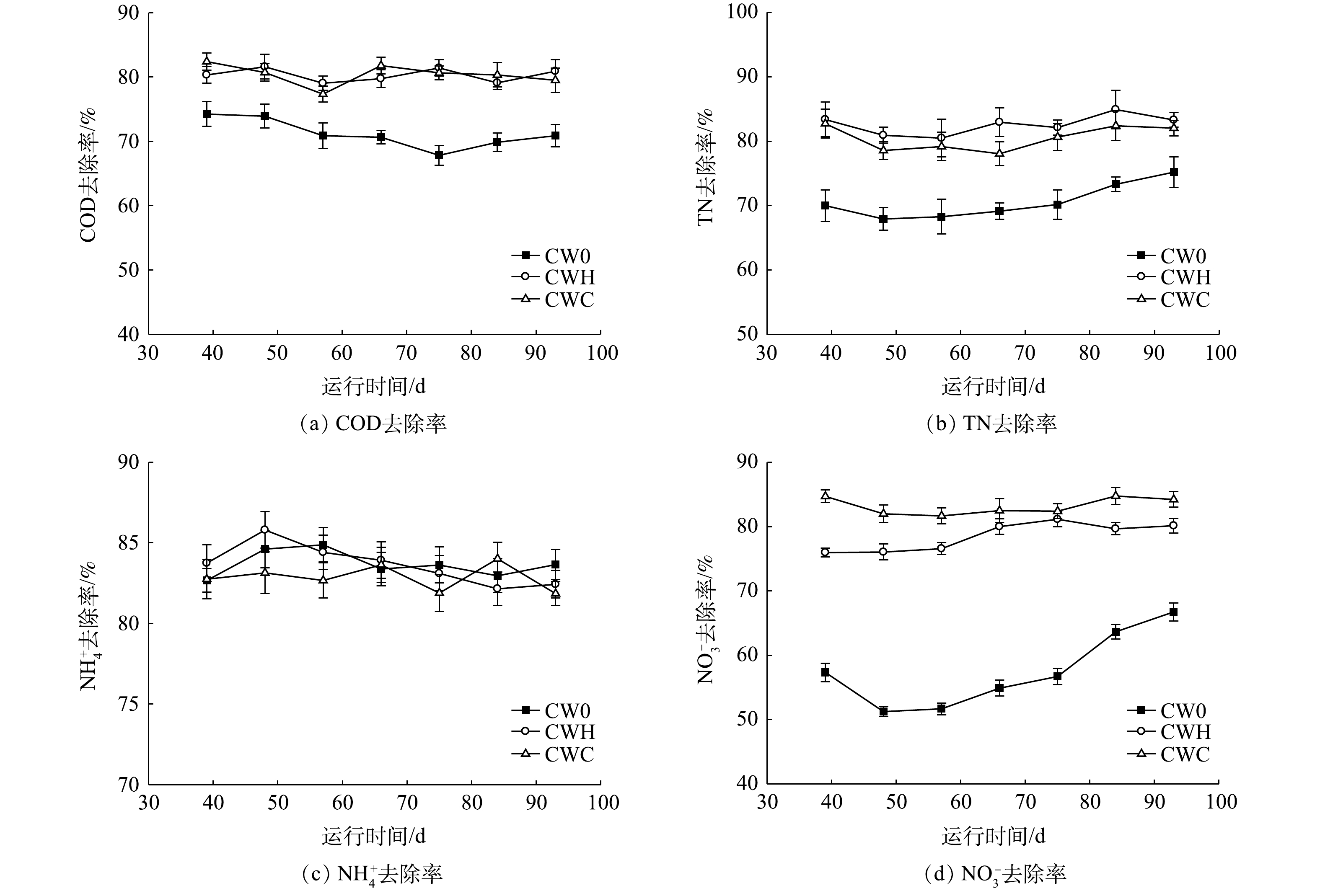
为提高潜流型人工湿地在低C/N条件下的污水处理效果,考察了在植物生长旺盛期曝气条件下不同C/N(0.9∶1、2∶1、4∶1)对污水的脱氮效率、微生物群落结构和功能微生物丰度的影响。结果表明:
去除率为57.48%~83.19%且随C/N的增加而增加;当C/N为2和4时,可提高COD和TN的去除率,COD和TN去除率均达到80%以上。当C/N为2和4处理组的
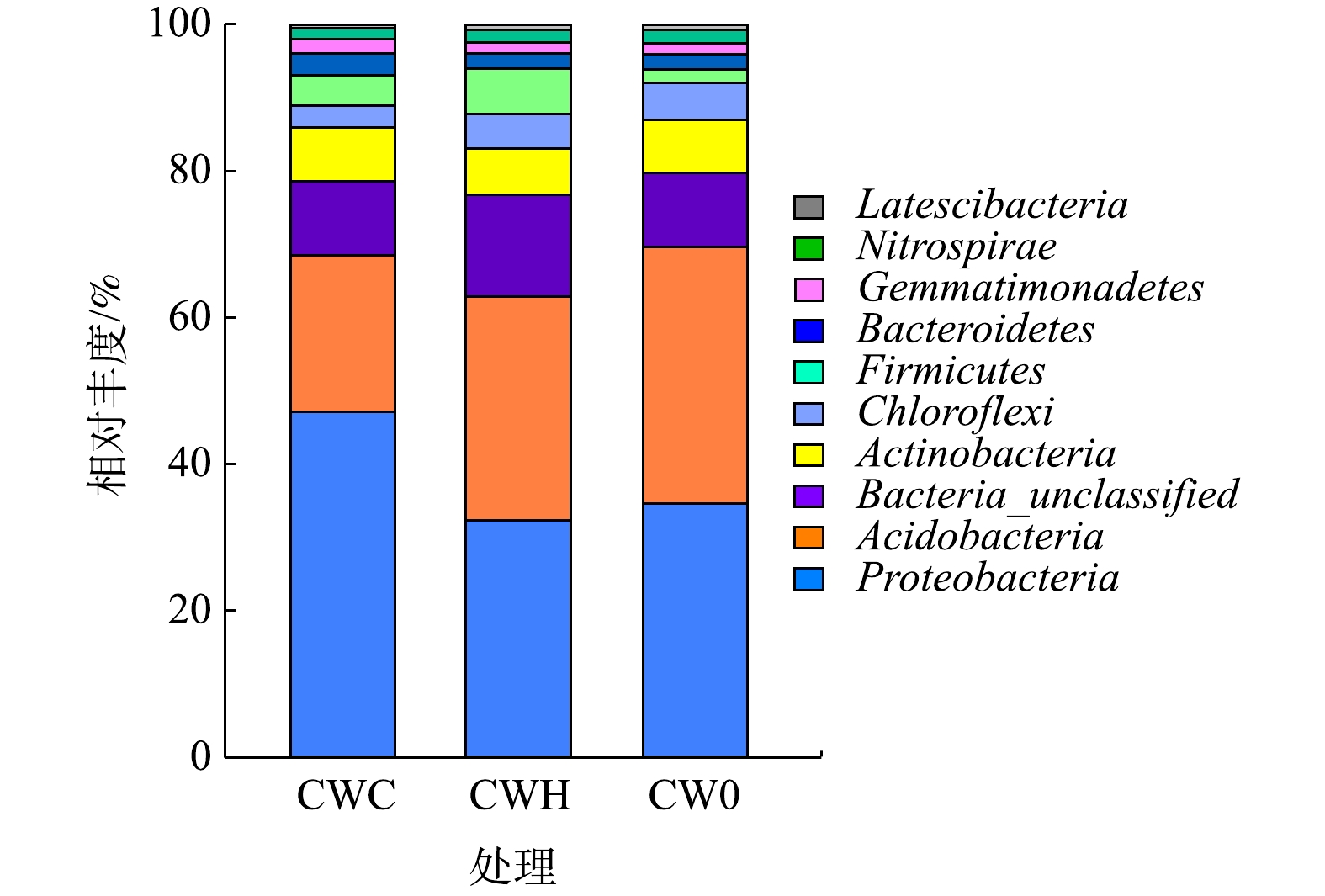
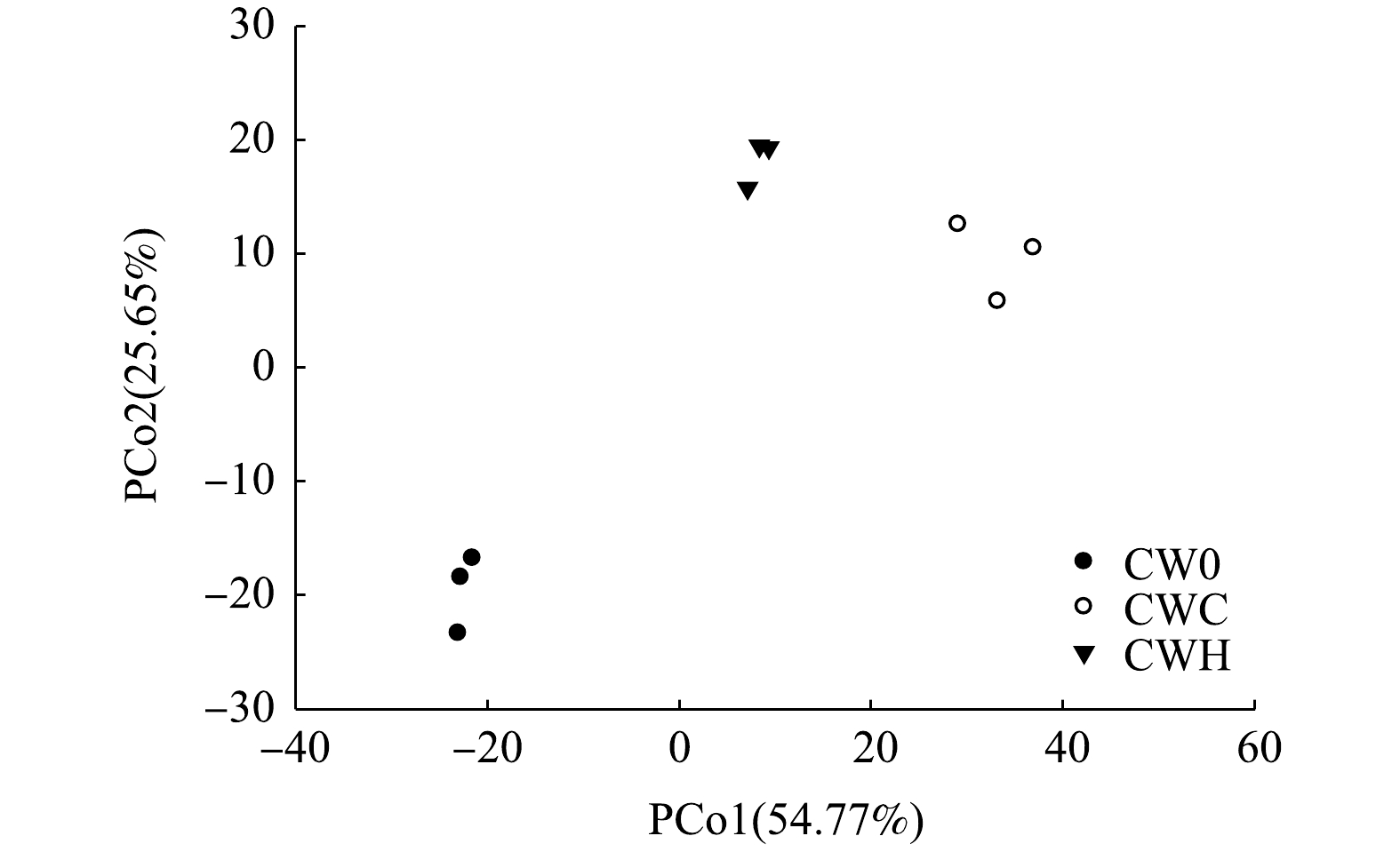
基因丰度随C/N增加而降低。物种数、Shannon-Wiener指数、Simpson指数、Chao1指数均随C/N的增加而增加。在不同处理组中相对丰度较高的细菌均为变形菌门和酸杆菌门,其占总细菌序列的62.89%~69.66%。对细菌群落结构进行PCoA分析,发现不同处理组间微生物群落组成结构差异较大。由此可见,在植物生长旺盛期,调节C/N为2和4均可显著提高污水处理效果,曝气和添加碳源强化措施可通过改变基质中氮转化功能微生物丰度和微生物群落结构来提高低C/N污水处理效率。
To improve the removal efficiency of the low C/N ratio sewage by subsurface flow constructed wetland, the influences of C/N ratios(0.9∶1, 2∶1, 4∶1) on the nitrogen removal rate, microbial community structure and functional microbial abundance under aeration condition in horizontal subsurface flow constructed wetlandsat the vigorous stage of plant growth were studied. The results were as follows: the removal rate of
was 57.48%~83.19%, and increased with the increase of C/N ratio. The removal rates of COD and TN increased as the C/N ratio increased to 2 and 4, and both of them were above 80%. The gene abundance of
and anammox bacterial 16S rRNA of the treatments with C/N ratios of 2 and 4 were significantly higher than that of the treatment with low C/N ratio (C/N=0.9) (
decreased as the C/N ratio increased. The bacterial species number, Shannon-Wiener index, Simpson index and Chao1 index increased with the increase of C/N ratio. The
were the dominant bacteria in all treatments, which accounted for 62.89%~69.66% of the total bacteria sequences. Principle coordinate analysis of bacterial communities showed that there were huge differences of microbial community among the three treatments. Thus, adjusting the C/N ratio to 2 and 4 could improve the removal efficiency of the sewage in the horizontal subsurface flow constructed wetland during the vigorously stage of plant growth. Adding carbon source and changing aeration condition could change the functional gene abundance and microbial community structure in the substrate to improve the removal efficiency of contaminants.
.
of different C/N ratio treatments
Copy number of functional genes related to nitrogen metabolism in different treatments
Taxonomy of the relative abundances of bacterial communities at phylum-level in the substrate of different constructed wetlands
不同C/N条件下微生物群落主坐标(PCoA)分析
Principal Coordinate Analysis of microbial communities at different C/N ratios
Richness and diversity indices of the microbial communities in different treatments
| [1] | WU H, FAN J, ZHANG J, et al. Large-scale multi-stage constructed wetlands for secondary effluents treatment in northern China: Carbon dynamics[J]. Environmental Pollution, 2018, 233: 933-942. doi: 10.1016/j.envpol.2017.09.048 |
| [2] | DU L, TRINH X T, CHEN Q R, et al. Enhancement of microbial nitrogen removal pathway by vegetation in integrated vertical-flow constructed wetlands (IVCWs) for treating reclaimed water[J]. Bioresource Technology, 2018, 249: 644-651. doi: 10.1016/j.biortech.2017.10.074 |
| [3] | HAN Z F, DONG J, SHEN Z Q, et al. Nitrogen removal of anaerobically digested swine wastewater by pilot-scale tidal flow constructed wetland based on in-situ biological regeneration of zeolite[J]. Chemosphere, 2019, 217: 364-373. doi: 10.1016/j.chemosphere.2018.11.036 |
| [4] | GAGNON V, CHAZARENC F, COMEAU Y, et al. Influence of macrophyte species on microbial density and activity in constructed wetlands[J]. Water Science and Technology, 2007, 56: 249-254. doi: 10.2166/wst.2007.510 |
| [5] | ZHUANG L, YANG T, ZHANG J, et al. The configuration, purification effect and mechanism of intensified constructed wetland for wastewater treatment from the aspect of nitrogen removal: A review[J]. Bioresource Technology, 2019, 293: 122086. doi: 10.1016/j.biortech.2019.122086 |
| [6] | SAEED T, SUN G Z. A review on nitrogen and organics removal mechanisms in subsurface flow constructed wetlands: dependency on environmental parameters, operating conditions and supporting media[J]. Journal of Environmental Management, 2012, 112: 429-448. doi: 10.1016/j.jenvman.2012.08.011 |
| [7] | PHILIPPOT L. Denitrifying genes in bacterial and Archaeal genomes[J]. Biochimica et Biophysica Acta: Biomembranes, 2002, 1577: 355-376. doi: 10.1016/S0167-4781(02)00420-7 |
| [8] | VYMAZAL J. Removal of nutrients in various types of constructed wetlands[J]. Science of the Total Environment, 2007, 380: 48-65. doi: 10.1016/j.scitotenv.2006.09.014 |
| [9] | LI Y, ZHU G, NG W J, et al. A review on removing pharmaceutical contaminants from wastewater by constructed wetlands: Design, performance and mechanism[J]. Science of the Total Environment, 2014, 468: 908-932. |
| [10] | ZHI W, JI G. Quantitative response relationships between nitrogen transformation rates and nitrogen functional genes in a tidal flow constructed wetland under C/N ratio constraints[J]. Water Research, 2014, 64: 32-41. doi: 10.1016/j.watres.2014.06.035 |
| [11] | LAI X S, ZHAO Y Q, PAN F X, et al. Enhanced optimal removal of nitrogen and organics from intermittently aerated vertical flow constructed wetlands: Relative COD/N ratios and microbial responses[J]. Chemosphere, 2020, 244: 125556. doi: 10.1016/j.chemosphere.2019.125556 |
| [12] | CHEN D Y, GU X S, ZHU W Y, et al. Denitrification- and anammox-dominant simultaneous nitrification, anammox and denitrification (SNAD) process in subsurface flow constructed wetlands[J]. Bioresource Technology, 2019, 271: 298-305. doi: 10.1016/j.biortech.2018.09.123 |
| [13] | HALLIN S, HELLMAN M, CHOUDHURY M I, et al. Relative importance of plant uptake and plant associated denitrification for removal of nitrogen from mine drainage in sub-arctic wetlands[J]. Water Research, 2015, 85: 377-383. doi: 10.1016/j.watres.2015.08.060 |
| [14] | PAN J, QI S, SUN Y, et al. Nitrogen removal and nitrogen functional gene abundances in three subsurface wastewater infiltration systems under different modes of aeration and influent C/N ratios[J]. Bioresource Technology, 2017, 241: 1162-1167. doi: 10.1016/j.biortech.2017.05.112 |
| [15] | LYU W, HUANG L, XIAO G, et al. Effects of carbon sources and COD/N ratio on N2O emissions in subsurface flow constructed wetlands[J]. Bioresource Technology, 2017, 245: 171-181. doi: 10.1016/j.biortech.2017.08.056 |
| [16] | WU J, ZHANG J, JIA W, et al. Impact of COD/N ratio on nitrous oxide emission from microcosm wetlands and their performance in removing nitrogen from wastewater[J]. Bioresource Technology, 2009, 100: 2910-2917. doi: 10.1016/j.biortech.2009.01.056 |
| [17] | ZHAO Y, LIU B, ZHANG W, et al. Performance of pilot-scale vertical flow constructed wetlands in responding to variation in influent C/N ratios of simulated urban sewage[J]. Bioresource Technology, 2010, 101: 1693-1700. doi: 10.1016/j.biortech.2009.10.002 |
| [18] | 国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002. |
| [19] | TSUSHIMA I, KINDAICHI T, OKABE S. Quantification of anaerobic ammonium-oxidizing bacteria in enrichment cultures by real-time PCR[J]. Water Research, 2007, 41(4): 785-794. doi: 10.1016/j.watres.2006.11.024 |
| [20] | JI G, ZHI W, TAN Y. Association of nitrogen micro-cycle functional genes in subsurface wastewater infiltration systems[J]. Ecological Engineering, 2012, 44: 269-277. doi: 10.1016/j.ecoleng.2012.04.007 |
| [21] | YAN T F, FIELDS M W, WU L Y, et al. Molecular diversity and characterization of nitrite reductase gene fragments (nirK and nirS) from nitrate-and uranium-contaminated groundwater[J]. Environmental Microbiology, 2003, 5(1): 13-24. doi: 10.1046/j.1462-2920.2003.00393.x |
| [22] | THROBACK I N, ENWALL K, JARVIS A, et al. Reassessing PCR primers targeting nirS, nirK and nosZ genes for community surveys of denitrifying bacteria with DGGE[J]. FEMS Microbiology Ecology, 2004, 49(3): 401-417. doi: 10.1016/j.femsec.2004.04.011 |
| [23] | SCALA D J and KERKHOF L J. Nitrous oxide reductase (nosZ) gene-specific PCR primers for detection of denitrifiers and three nosZ genes from marine sediments[J]. FEMS Microbiology Letters, 1998, 162(1): 61-68. doi: 10.1111/j.1574-6968.1998.tb12979.x |
| [24] | CHEN X, ZHU H, YAN B, et al. Optimal influent COD/N ratio for obtaining low GHG emissions and high pollutant removal efficiency in constructed wetlands[J]. Journal of Cleaner Production, 2020, 267: 122003. doi: 10.1016/j.jclepro.2020.122003 |
| [25] | COSKUN D, BRITTO D T, SHI W, et al. How plant root exudates shape the nitrogen cycle[J]. Trends in Plant Science, 2017, 22: 661-673. doi: 10.1016/j.tplants.2017.05.004 |
| [26] | ZHAI X, PIWPUAN N, ARIAS C A, et al. Can root exudates from emergent wetland plants fuel denitrification in subsurface flow constructed wetland systems?[J]. Ecological Engineering, 2013, 61: 555-563. doi: 10.1016/j.ecoleng.2013.02.014 |
| [27] | FRANK D A and GROFFMAN P M. Plant rhizospheric N processes: What we don’t know and why we should care[J]. Ecology, 2009, 90: 1512-1519. doi: 10.1890/08-0789.1 |
| [28] | WANG Q, XIE H J, NGO H H, et al. Microbial abundance and community in subsurface flow constructed wetland microcosms: Role of plant presence[J]. Environmental Science and Pollution Research, 2016, 23(5): 4036-4045. doi: 10.1007/s11356-015-4286-0 |
| [29] | LIU J, YI N K, WANG S, et al. Impact of plant species on spatial distribution of metabolic potential and functional diversity of microbial communities in a constructed wetland treating aquaculture wastewater[J]. Ecological Engineering, 2016, 94: 564-573. doi: 10.1016/j.ecoleng.2016.06.106 |
| [30] | ZHU H, YAN B, XU Y, et al. Removal of nitrogen and COD in horizontal subsurface flow constructed wetlands under different influent C/N ratios[J]. Ecological Engineering, 2014, 63: 58-63. doi: 10.1016/j.ecoleng.2013.12.018 |
| [31] | BRENZINGER K, D?RSCH P, BRAKER G. pH-driven shifts in overall and transcriptionally active denitrifiers control gaseous product stoichiometry in growth experiments with extracted bacteria from soil[J]. Frontier in Microbiology, 2015, 6: 961. |
| [32] | LI H F, LIU F, LUO P, et al. Stimulation of optimized influent C∶N ratios on nitrogen removal in surface flow constructed wetlands: Performance and microbial mechanisms[J]. Science of the Total Environment, 2019, 694: 133575. doi: 10.1016/j.scitotenv.2019.07.381 |
| [33] | GAO L, ZHOU W L, HUANG J C, et al. Nitrogen removal by the enhanced floating treatment wetlands from the secondary effluent[J]. Bioresource Technology, 2017, 234: 243-252. doi: 10.1016/j.biortech.2017.03.036 |
| [34] | CHEN C, XU X J, XIE P, et al. Pyrosequencing reveals microbial community dynamics in integrated simultaneous desulfurization and denitrification process at different influent nitrate concentrations[J]. Chemosphere, 2017, 171: 294-301. doi: 10.1016/j.chemosphere.2016.11.159 |



 下载:
下载: 
 点击查看大图
点击查看大图