全文HTML
--> --> --> 人工湿地具有处理污水效果好、运行费用低、且具有良好的景观效果等特点,因而被广泛应用于农村及小型城市中。然而,传统人工湿地在处理污水过程中由于溶解氧(DO)不足,因此易造成硝化反应不完全[1],致使系统中氮的去除效率不高,此外DO含量也决定了污水中有机物(COD)彻底分解量[2]。氧气是控制污水处理厂硝化和有机物降解的重要参数,但在传统的微生物脱氮反应中,由于微生物起主导作用,因而其脱氮效率往往受湿地碳源的限制[3]。近年来,生物炭被广泛应用于环境治理中,并取得了较好的效果。生物炭具有比表面积大、疏松多孔的特点,为微生物提供了更多的栖息地和适宜的生活环境[4],同时生物炭作为碳源也会影响微生物的生物量;生物炭还能调节系统内好氧-厌氧条件[5],并在其表面存在很强的π键,能够通过静电吸附和分子间的氢键对烃类和有机物进行吸收[6]。因此,生物炭可以有效地解决人工湿地系统中DO不足的问题,还可以作为碳源参与微生物脱氮过程。由于生物炭影响硝化-反硝化过程,进而也会影响N2O的排放,但目前关于生物炭对N2O排放的作用并未达成共识,其内在机理尚不明确,CAYUELA等[7]研究发现在土壤中添加生物炭会减少N2O的排放,但颜永毫等[8]则表明生物炭改善了通气状况后可能会增加N2O的排放。另外,铁的添加对人工湿地中碳氮循环有很大影响,但具体作用机制尚不清楚。BEAL等[9]发现湖底沉积物中的微生物有利用Mn4+和Fe3+作为电子受体对甲烷进行厌氧氧化的现象。由于Fe涉及到2个价态的转化,在氮的转换过程中充当电子受体和供体。Fe2+作为无机电子供体,提供给
为此,本研究通过添加生物炭、铁矿石、生物炭+铁矿石等方式构建潜流人工湿地,研究了其对污水COD去除效果、脱氮能力及其对CH4和N2O排放的影响,以期为人工湿地中污染物质的减排提供参考。
1.1. 实验装置
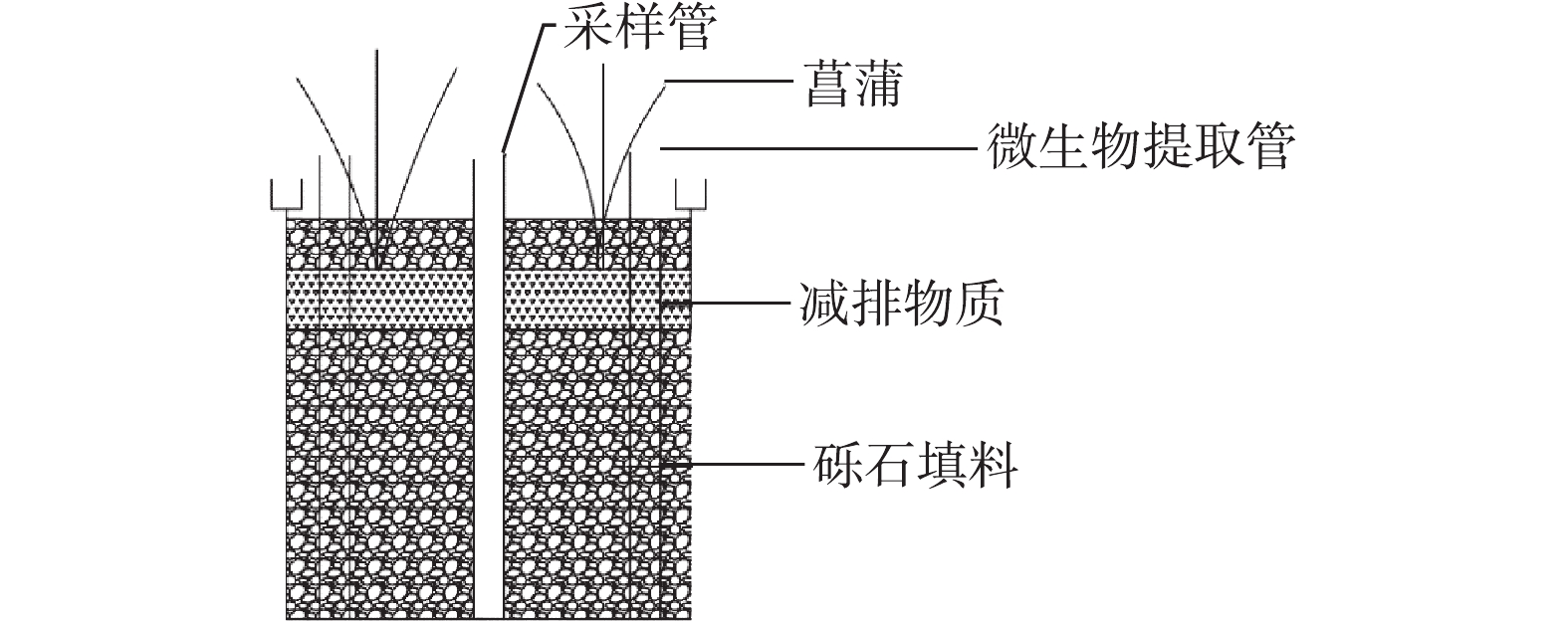
本实验装置在西南大学资源环境学院1号温室内进行(29°49′N,106°25′E),实验期间气温处于17~39 ℃,平均气温为26.4 ℃。实验装置如图1所示,其为聚乙烯塑料圆筒,桶的直径为35 cm,深为40 cm,基质填料厚度为40 cm,其中,减排物质的添加量各为基质填充体积的15%,分别为0、15%赤铁矿、15%生物炭、15%赤铁矿+15%生物炭(混合),放置于装置中上部,上下部皆由砾石填充(图1),上层砾石厚度为5 cm。4组湿地分别命名为空白-人工湿地(湿地Ⅰ)、铁矿石-人工湿地(湿地Ⅱ)、生物炭-人工湿地(湿地Ⅲ)、铁矿石+生物炭-人工湿地(湿地Ⅳ)。每个实验处理设置2个重复。所用砾石购买自北碚某石料厂,粒径为1~3 cm,水洗干净后填充;铁矿石从河北某公司购买,粒径为1~3 cm,水洗干净后填充;生物炭从广东某公司购买,粒径为0.8~1 cm,水洗干净后填充。湿地植物为菖蒲(Acorus calamus L.),种植密度为30株·m?2。桶中放置一根长45 cm、直径为5 cm的PVC穿孔管用于取水排水。本研究采用间歇进水的方式,设置水力停留时间(HRT)为4 d,在每个水力停留周期的第1天上午取样后,利用虹吸法排出装置内污水,将配好的进水分别从上部倒入14.5 L到每一个人工湿地系统中,完成进水。1.2. 系统运行
湿地系统自2019年4月17日开始运行,并在4月21日进行第一次水质测定,运行174 d,10月8日进行最后一次水质测定并停止运行。本实验进水模拟生活污水,固定COD/N进水比约为10∶1,采用周期进水的方式,每升进水中包括160 mg NH4Cl、22.5 mg KH2PO4、97.56 mg MgSO4·7H2O、58.28 mg CaCl2、10 mg蛋白胨、366.67 mg蔗糖、1.5 mg FeSO4·7H2O、0.1 ml微量元素。每毫升微量元素中包含3.5 mg EDTA-Na2、1.69 mg H3BO3、1.08 mg MnCl2·4H2O、1.32 mg ZnSO4·7H2O、0.39 mg CuSO4·5H2O、0.049 mg H2MoO4·4H2O。每升模拟进水中含(443.18±5.20) mg COD,(1.76±0.022) mg
1.3. 样品采集与分析方法
1)样品采集。系统稳定运行后,每4 d进行一次水质的采集与分析,固定在09:00—10:00进行采样,对进水和每个装置的出水分别采样。每隔一段时间选取一个周期作为典型周期进行水质测定,以进水零时刻为计时零点,分别设置采样节点0、1、2、4、8、12、24、28、36、48、54、60、72、76、84、96 h。N2O和CH4气体采集用静态暗箱法,将箱体设计成分节组合式标准箱,由顶箱,延长箱和底座组成,其顶箱和延长箱均由聚乙烯材料制成,箱体尺寸为ψ35 cm×50 cm。在典型周期进行温室气体的采样分析排放规律,参考周旭[14]和邓朝仁等[15]设计方案,设置13个采样时间节点,以进水零时刻为计时零点,分别为0、6、12、24、30、36、48、54、60、72、78、84和96 h,即典型周期内每天08:00、14:00、20:00进行采样,确保样品的代表性。
2)样品分析。水样指标COD、
气样采集每个时间节点采样持续时间为30 min,每隔10 min用体积为60 mL的塑料注射器采集一次气样,共4个样。利用Agilent 7890A气相色谱仪测定N2O通量和CH4通量,根据式(1)和(2)进行计算。
式中:
3)数据处理。数据表达采用平均数±标准误的形式。数据分析使用软件SPSS19.0,对象之间采用相关性分析并进行显著性检验,图标绘制采用Origin 8.5。
2.1. 不同添加物人工湿地的污水处理效果
系统稳定运行期间各项指标如表1所示。湿地Ⅰ、湿地Ⅱ、湿地Ⅲ和湿地Ⅳ的DO分别是(0.14±0.015)、(0.15±0.016)、(0.18±0.014)和(0.19±0.11) mg·L?1,生物炭的添加及铁矿石和生物炭的联合添加(以下简称铁-生联合添加)均对系统DO起显著的改善作用(P<0.05)。4组湿地平均出水COD分别为(34.99±1.60)、(35.57±1.69)、(30.87±1.65)和(27.52±2.37) mg·L?1,对应的COD去除率分别为92.10%、91.97%、93.03%和93.79%,铁矿石添加对COD的去除并无显著影响(P>0.05),但生物炭的添加和铁-生联合添加均显著提高COD的去除率(P<0.05)。4组人工湿地的平均出水
2.2. 典型周期内系统水质指标的变化
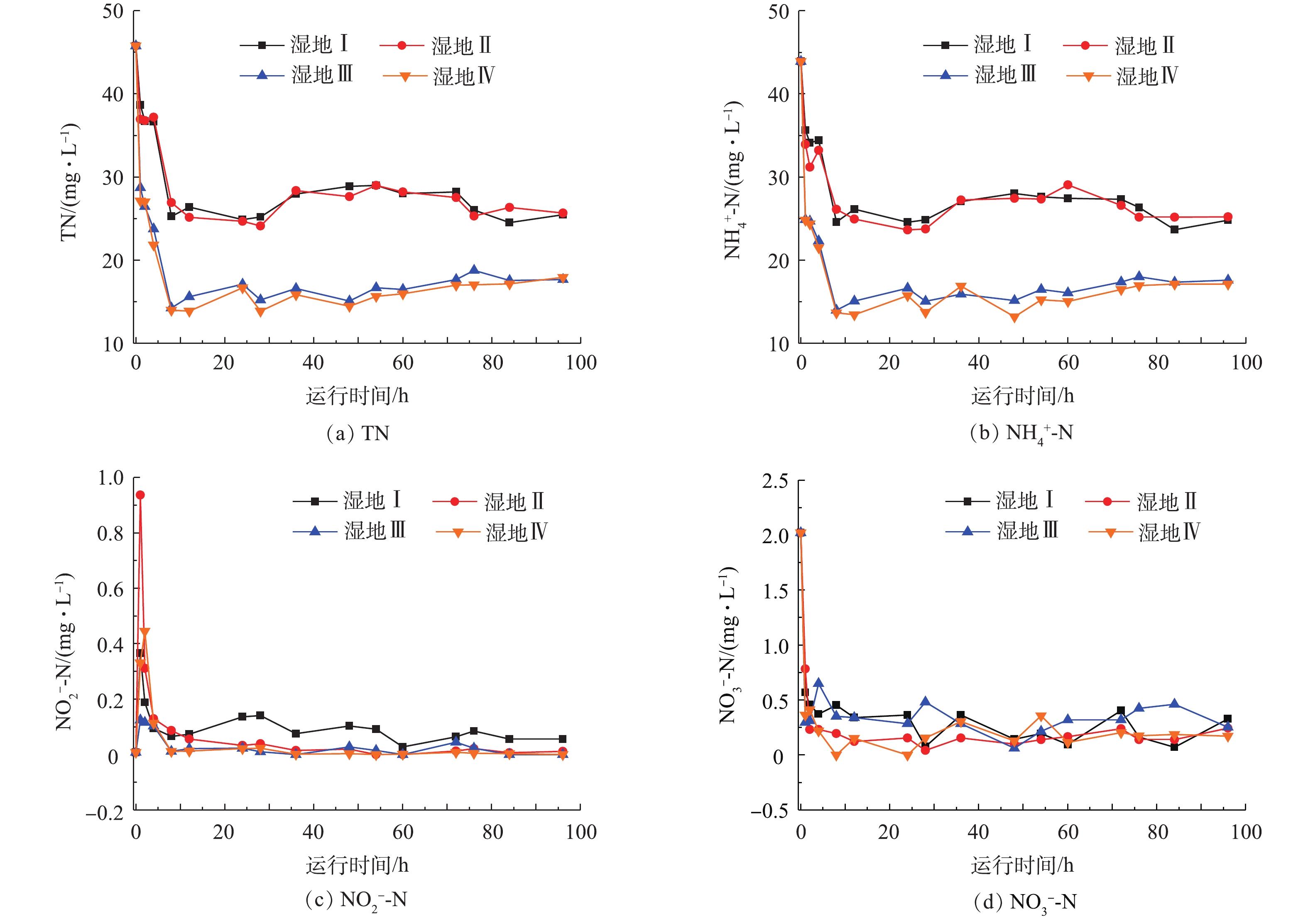
典型周期内温室内气温保持在23.4~34.0 ℃,平均气温26.5 ℃。湿地Ⅰ、湿地Ⅱ、湿地Ⅲ和湿地Ⅳ中DO和COD变化趋势相似(图2)。进水后2 h内DO浓度由7.97 mg·L?1迅速下降到0.15 mg·L?1左右,此后DO浓度一直维持在0.2 mg·L?1左右。4组湿地的进水COD为448.24 mg·L?1,进水后2 h内迅速下降,2 h后下降速度减慢,24 h后降至50 mg·L?1以下,此后一直稳定在这一水平,最终出水约为30 mg·L?1。图3反映了典型周期内不同湿地系统TN、
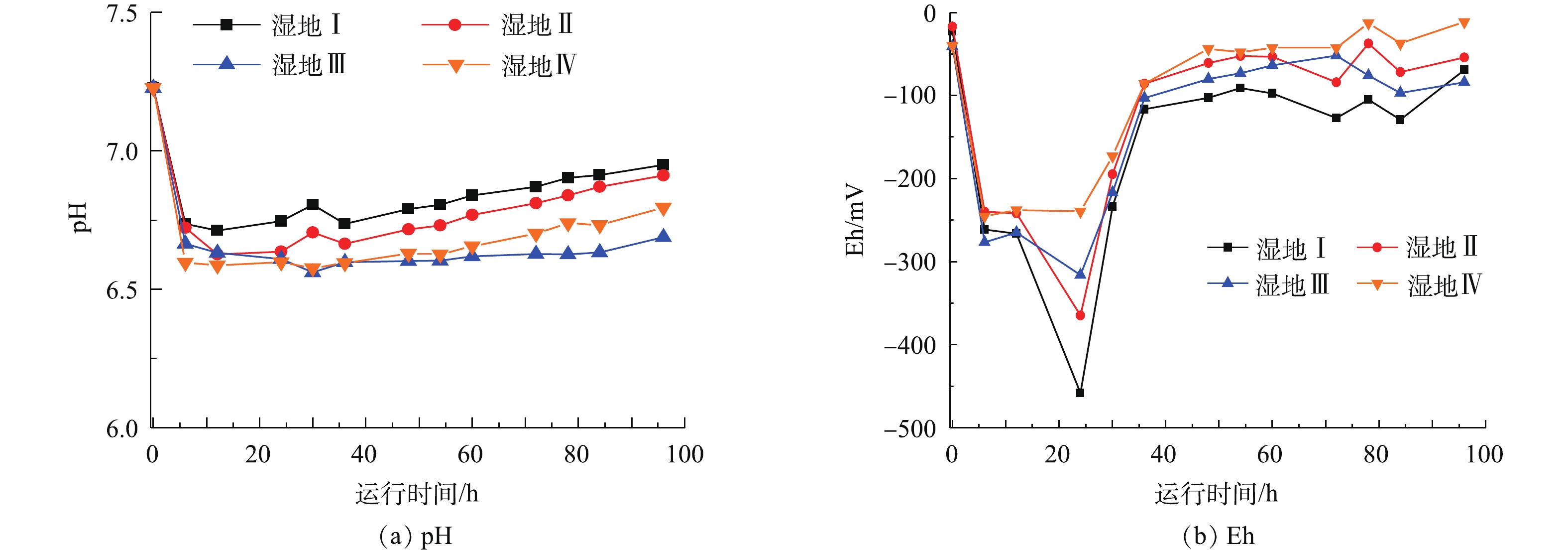
系统内的进水pH为7.23,呈现弱碱性,进水后pH迅速下降,之后又逐步回升,且出水pH低于进水(图4)。4组湿地出水pH分别为6.95、6.91、6.68、6.80。由图4可见,4组湿地的氧化还原电位(Eh)均呈现单峰型变化趋势,进水初期Eh迅速下降,在24 h达到最低点,分别是?458、?364.7、?315.9、?239 mV,在36 h迅速回升到?100 mV左右,之后系统Eh出现波动,回升速度减慢,且出水Eh分别为?69.2、?53.9、?83.9、?11.2 mV。
2.3. 典型周期CH4排放规律
各湿地系统在典型周期内CH4排放通量的变化趋势如图5所示。湿地Ⅰ和湿地Ⅱ的CH4排放通量的变化趋势基本一致,2组人工湿地的CH4排放通量分别为1.16~56.39 mg·(m2·h)?1和(1.86~48.19) mg·(m2·h)?1,2组系统的CH4排放通量均呈现出单峰型变化,排放峰值均出现在进水后30 h,峰值分别为56.39 mg·(m2·h)?1和48.19 mg·(m2·h)?1。湿地Ⅲ的CH4排放通量自进水后一直保持较低的水平,没有明显的峰值,排放通量为0.70~9.34 mg·(m2·h)?1。湿地Ⅳ的CH4排放通量变化趋势与湿地Ⅲ相似,并未出现明显峰值,排放通量为1.56~12.68 mg·(m2·h)?1。2.4. 典型周期N2O排放规律
进水之后湿地Ⅰ、湿地Ⅱ、湿地Ⅲ、湿地Ⅳ在典型周期内的N2O排放通量始终处于波动中,分别是81.93~313.95、118.19~323.60、48.42~179.25和102.47~295.26 μg·(m2·h)?1(图5)。湿地Ⅰ和湿地Ⅱ的N2O排放通量呈现出双峰型的变化趋势,湿地Ⅰ的峰值出现在12 h和72 h,分别为205.43 μg·(m2·h)?1和313.95 μg·(m2·h)?1,湿地Ⅱ的峰值出现在24 h和84 h,分别为207.75 μg·(m2·h)?1和323.60 μg·(m2·h)?1。湿地Ⅲ的N2O排放通量呈单峰型变化,在进水24 h时出现峰值,为179.25 μg·(m2·h)?1。湿地Ⅳ前期与湿地Ⅲ的N2O排放通量变化相似,在24 h出现峰值,为295.26 μg·(m2·h)?1,后期与湿地Ⅱ的变化趋势相似,但排放通量始终低于湿地Ⅱ。2.5. 典型周期内N2O和CH4的总排放量及其综合GWP
衡量不同温室气体对全球变暖的相对影响可用GWP来进行估算[17]。IPCC(2013)提供的数据表明,在100 a的时间尺度上,单位质量的CH4和N2O全球增温潜势分别是CO2的28倍和265倍[18]。以1 g·m?2 CO2的GWP为1,表2为各系统N2O和CH4的平均排放通量及典型周期内这2种气体所产生的综合GWP。就CH4排放通量而言,生物炭和铁矿石的添加在不同程度上实现了CH4的减排,湿地Ⅱ、湿地Ⅲ、湿地Ⅳ的排放通量分别为(22.80±3.90)、(5.50±0.89)、(5.89±1.20) mg·(m2·h)?1,相较于湿地Ⅰ的CH4排放通量(34.18±6.38) mg·(m2·h)?1分别减少了33.29%、83.91%和82.77%。湿地Ⅱ、湿地Ⅲ、湿地Ⅳ的CH4排放通量均显著低于湿地Ⅰ(P<0.05);湿地Ⅳ与湿地Ⅱ的差异显著(P<0.05),但与湿地Ⅲ的差异不显著(P>0.05)。对于N2O排放通量来说,不同减排物质的添加也在不同程度上减缓了N2O的排放,湿地Ⅱ、湿地Ⅲ、湿地Ⅳ的N2O排放通量分别是(338.00±36.67)、(312.67±36.64)、(345.70±34.27) μg·(m2·h)?1,均小于湿地Ⅰ((451.88±61.92) μg·(m2·h)?1),且相较于湿地Ⅰ分别降低了25.20%、30.80%和23.50%。对于水力停留周期内的人工湿地的综合GWP,湿地Ⅱ的GWP贡献量是69.88±10.42,相比湿地Ⅰ的(103.36±17.01)减少了32.39%,湿地Ⅲ的GWP贡献量为22.73±2.43,减少了78.01%,湿地Ⅳ的GWP贡献量是24.62±3.23,减少了76.18%。3.1. 生物炭和铁矿石对出水水质的影响
潜流人工湿地系统DO主要来自于植物根际泌氧、大气复氧和进水中的氧气。在不曝气的条件下,植物根际泌氧量和大气复氧量并不能满足系统需要[19-20],人工湿地DO不足,处于缺氧或厌氧状态。生物炭具有孔隙度大的特点,有利于DO的传递,因此,生物炭的添加一定程度上改善了系统内的DO不足,但因传递能力有限,因此湿地Ⅲ仍处于厌氧状态。湿地Ⅳ中DO浓度与湿地Ⅲ相似,生物炭起主要作用。4组湿地COD去除率均保持在90%以上,出水COD均低于50 mg·L?1,符合《城镇污水处理厂污染物排放标准》(GB 18918-2002)一级A(50 mg·L?1)标准。有机物的降解主要依赖微生物的好氧呼吸作用[21],因此,COD去除率与系统DO有密切联系,生物炭对改善DO有显著作用,因此生物炭的添加也显著提高了COD的去除率。湿地Ⅰ的TN去除率和刘冬等[25]的研究结果一致,不足50%。TN的去除需要硝化-反硝化过程共同作用,湿地系统DO不足,硝化过程受阻,因此,导致TN去除率不高。系统进水中TN主要以
在典型周期内,由于有机污染物主要进行好氧降解,进水时系统存在充足溶解氧,有助于有机物的好氧降解过程,此时COD的去除速率最大,此后由于有机物去除和硝化过程消耗,DO浓度在2 h内急剧降低,DO逐渐不足,COD由于DO的限制去除速率逐渐减小,直至最后稳定[26]。人工湿地系统最初的DO处于最大值,溶解氧充足,AOB作为好氧细菌充分发挥作用,将
3.2. 生物炭和铁矿石对CH4排放的影响
湿地Ⅲ和湿地Ⅳ的CH4排放通量大小相似,在湿地Ⅳ中对CH4排放影响最大的是生物炭的添加。湿地Ⅲ和湿地Ⅳ的CH4排放通量显著小于另外2个系统,这是因为生物炭具有疏松多孔和比表面积大的特点,有利于形成生物膜,促进微生物生命活动,加速CH4的氧化。此外,LIU等[28]的研究表明,生物炭还有可能会通过增强甲烷氧化菌活动,从而增加CH4的氧化,因此,湿地Ⅲ的CH4排放通量小于湿地Ⅰ和湿地Ⅱ。铁矿石的添加也在一定程度上改善了CH4的排放,这是因为Fe作为变价金属,Fe3+转化为Fe2+的同时作为电子受体,促进甲烷厌氧化菌将唯一的电子供体CH4氧化为CO2[29]。典型周期内,湿地Ⅰ和湿地Ⅱ的CH4排放通量在30 h出现波峰,Eh是影响CH4产生的重要因素,蔡祖聪等[30]研究表明当Eh低于-150~-160 mV时,产甲烷微生物开始明显活动而排放出CH4。Eh越低时,产CH4的速率越快[31]。由图4可知,湿地Ⅰ和湿地Ⅱ的系统Eh呈现单峰型波动,其波谷出现在24 h,说明此时产CH4速率最快,由于气体逸出系统需要一定时间,因此,在30 h监测到2个系统CH4排放通量峰值。而湿地Ⅲ和湿地Ⅳ的Eh变化相对平缓,因此,CH4在典型周期的排放过程并未出现明显的波峰。
3.3. 生物炭和铁矿石对N2O排放的影响
N2O是硝化过程的副产物同时也是反硝化过程中的中间产物。硝化过程中N2O排放受AOB和NOB生命活动的影响,不同的环境条件影响酶的活性,进而影响N2O的排放[32]。因此在硝化过程中,羟胺(NH2OH)和典型周期内,湿地系统均出现N2O排放通量峰值,这主要是因为N2O运输速率慢,生成的N2O在水中的扩散运输较慢[39],到白天时,随着温度上升,太阳辐射增强,使夜间产生并积累的N2O逐渐排出,形成峰值。湿地Ⅰ和湿地Ⅱ出现双峰型波动,湿地Ⅲ则为单峰型波动,这可能是因为生物炭的添加减少了N2O的排放通量,进而造成峰值并不明显。
2)生物炭的添加实现了CH4和N2O的减排,相较于空白分别减排了83.91%和30.80%;铁矿石在人工湿地中也实现了综合GWP的减少,但较生物炭减排效果并不突出。在铁矿石-生物炭共同存在的系统中,生物炭起主要作用,系统的污水处理能力和温室气体排放量和单独添加生物炭的效果相似,铁矿石的作用不大。
3)生物炭相较于铁矿石对于人工湿地系统水质净化和温室气体减排均具有很好的效果,是一种良好的减排物质。
参考文献



 下载:
下载: 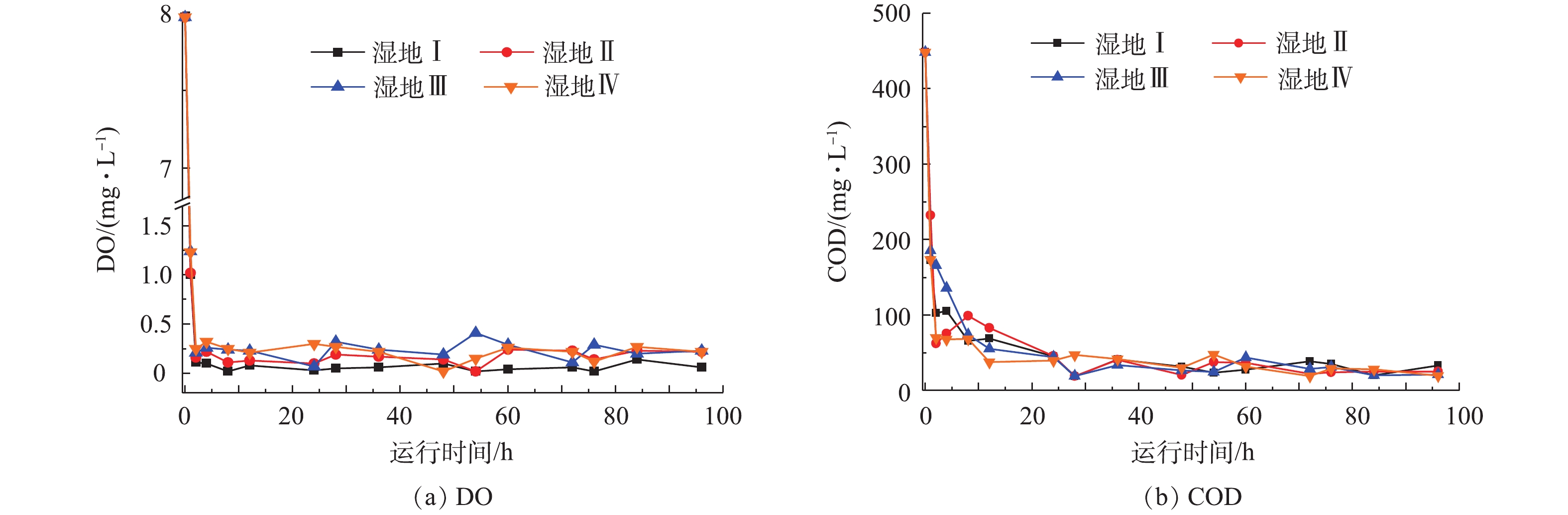










 点击查看大图
点击查看大图