全文HTML
--> --> --> 目前,填埋是我国最主要的生活垃圾处理方式。2018年,我国经填埋处理的生活垃圾量为1.2×108 t,占清运总量的52%[1]。生活垃圾含有大量可降解有机物,被微生物降解后产生会大量填埋气。在厌氧条件下,填埋气由甲烷(CH4)(体积分数55%~56%)、二氧化碳(CO2)(体积分数40%~45%)、含硫和含氮化合物等组成[2-4]。有研究[5]表明,CH4比CO2具有更强的温室效应。据估算,填埋场每年排放的CH4约占全球人为CH4排放总量的18%,因此,被认为是重要的长期CH4排放源之一[6]。填埋场不仅是最大的人为温室气体排放源,也是多种恶臭气体的排放源[7-8]。因大多数恶臭气体嗅阈值极低,即使填埋场排放的恶臭气体很少,仍会给附近居民造成不良影响。填埋场通常利用填埋气收集系统来控制填埋场气体排放[9-10]。然而,由于集气井数量、间距设置以及渗滤液淤积的影响,填埋场的气体收集效率约为55%~91%[11],部分填埋场还存在收集效率不足(2%~14%)的问题[12]。此外,集气装置一般要等到垃圾填埋达到一定高度完成土工膜覆盖后才进行安装或启用,与垃圾填埋并不同步,种种因素使得大量填埋气未能被收集而直接逸散到大气环境中[12-14]。
目前,许多研究集中于气体收集效率的提高方面[11, 13, 15];而有关堆体抽气造成的填埋气组分及排放量的影响的研究鲜有报道。因此,本研究采用垃圾堆体抽气收集填埋气的方式进行填埋气减排处理,与常规集气系统相比,该方法能够及时收集填埋气,减少填埋过程中污染气体的无序排放;同时,抽气操作将新鲜空气主动引入堆体内部,让垃圾内部同时存在厌氧、缺氧和好氧区域,有利于垃圾降解和稳定;实验中利用静态通量箱法探究不同抽气条件设置对填埋气中各组分排放通量的影响,可为我国填埋场温室气体和恶臭气体排放控制对策的制定提供参考。
1.1. 实验原料
实验中的混合垃圾按照典型生活垃圾的组成和比例配制,各组分的含水率、总固体(TS)、挥发性固体(VS)和比重(即相对密度,Gs)等基本性质,如表1所示。1.2. 实验装置
实验装置由敞口反应器、可拆卸加压系统及静态通量箱组成,如图1所示。反应器尺寸为800 mm×280 mm(高×直径),底部铺设50 mm砾石,并在其上交替填入混合垃圾和覆土。加压装置由千斤顶、加压圆盘和金属架组成。千斤顶由金属架固定并与液压泵连接,下接金属杆和圆盘,金属杆将作用力传导至圆盘并对垃圾进行加压,以模拟实际填埋场中不同深度处由垃圾自重造成的压缩。静态通量箱由箱盖和环形底座组成,箱盖顶部中心处装有电动风扇,用于混合盖内空气。通量箱只在测量通量期间插入上层覆土中,并在测量时向底座注水,保证底座与箱盖之间处于密封状态。1.3. 实验方法
本实验共有3个反应器,均含混合垃圾39 kg,分3层填埋,每层高度约300 mm,混合垃圾的密度约为777 kg·m?3。在填好每层垃圾后,都填充质量相同、高度约为50 mm的沙土,模拟填埋场覆土。分层填埋的目的是模拟实际填埋场在作业时填埋垃圾量随时间增加的过程,从而研究抽气量随垃圾量的增加而增加的动态控制效果。实验共进行了171 d,分为3个阶段。实验初始阶段为期10 d,期间对各个反应器进行无差别曝气,以缩短垃圾酸化时间,曝气流量为600 mL·min?1,时长为每次5 h,频率为每天2次。阶段1从第11天(停止曝气日)开始计算,共72 d,期间进行规律的通量监测实验。阶段2从第83天开始,首先对3个反应器同时施加42 kPa的压力持续24 h,施加该压力是为了模拟实际填埋场中约6 m深位置由垃圾自重造成的压缩[16]。在加压结束后,立即填埋第2层垃圾并进行覆土及通量监测。阶段3在反应第133天施加21 kPa的压力,模拟填埋场中约3 m深位置由垃圾自重造成的压缩,其他操作过程与第2层相同。按照抽气操作条件的不同,将3个反应器命名为C、E1和E2。C不进行抽气操作,E1中每1 h抽气量等于垃圾内部孔隙体积的50%,即阶段1、2和3的抽气量分别为2.5、3.75和5.0 L·h?1;E2中每1 h抽气量等于2倍孔隙体积,即阶段1、2和3的抽气量分别为10、15和20 L·h?1。为加强控制效果以及方便数据监测,对称设置抽气时间,即每日02:00—04:00和14:00—16:00[17-18]。
垃圾内部孔隙体积计算过程为:根据表1得到的实验初始时刻Gs计算实验中初始状态孔隙比e,计算方法如式(1)所示。
其中:V孔为垃圾体中孔隙的体积(包括液体的体积V水和空气占的体积V气),m3;ω为混合垃圾的平均含水率;ρw为4 ℃水的密度,kg·m?3;ρ为混合垃圾的体积密度,kg·m?3。
根据表1中的数据计算出的垃圾平均含水率,估算垃圾中所含水的质量,并以此算出垃圾中水的体积(V水)与垃圾中气体的体积(V气),其计算方法如式(2)~式(4)所示。
式中:m为混合垃圾质量,kg;ω为混合垃圾的平均含水率;ρw为4 ℃水的密度,kg·m?3;n为孔隙率;V为混合垃圾的总体积,m3。
1.4. 分析方法
本实验使用静态通量箱法测量垃圾排放的温室气体和含硫气体抽气前后的通量,测量频率随排放量减小而逐渐降低。温室气体通量测量的总取样时间为90 min,间隔为30 min,取样后,立即使用安捷伦气相色谱仪分析温室气体浓度;含硫气体通量测量的总取样时间为180 min,间隔为90 min,使用天美气相色谱仪分析。此外,为了解经堆体底部抽气期间获得的气体(以下简称“底部气体”)浓度与组成,在每层垃圾填埋后的第10、30和50天(第1层从停止曝气日算起),对底部气体进行检测。安捷伦气相色谱(7890B,美国)装有热导检测器,使用5A分子筛80/100色谱柱(G359180020),载气为高纯氦气(>99.999%),流速为2 mL·min?1,进样口、柱箱和检测器温度分别设定为120、100和250 ℃。
天美气相色谱仪(Scion 456-GC,荷兰)装有样品预浓缩装置(Scion,荷兰)和脉冲火焰光度检测器。将预浓缩装置与气相色谱仪设置方法一体化,采用Tenax-TA吸附材料在?30 ℃条件下对样品进行吸附和捕集,并在1.4 min内升温解吸,随后经惰性进样阀进入气相色谱进样口。气相色谱参数设置:进样口温度为280 ℃、载气为高纯氦气(>99.999%)、流速为2 mL·min?1、分流比为10∶1。柱温箱升温程序:初始温度为50 ℃,保持2 min,10 ℃·min?1升至230 ℃,保持5 min。脉冲火焰光度检测器条件:温度为250 ℃。气体流速:氢气流速为13 mL·min?1,空气1流速为17 mL·min?1,空气2流速为10 mL·min?1。
1.5. 排放通量计算
气体排放通量计算方法如式(5)所示。式中:dc/dt是箱内气体浓度的时间变化率,在本实验中,对120 min内气体浓度随时间变化的散点进行直线拟合,直线斜率即为dc/dt;M为气体分子摩尔质量,g·mol?1;
2.1. 抽气量对底部气体含有的CO2和CH4质量影响
反应器E1和E2中底部气体含有CO2,CH4和O2的质量随运行时间变化如图2所示。可以看出,在阶段2和阶段3中,E1和E2中均呈CO2质量逐渐减少而O2质量逐渐增大的趋势;E1和E2中CO2质量最大值都出现在填入第3层垃圾后,分别为2.78 g和9.08 g。与CO2趋势相反,CH4浓度在E1和E2中均随着反应的进行持续增大,在阶段3后期,分别达到了0.11 g和0.43 g。这可能因为:随垃圾层数的增加,E1和E2的垃圾内部厌氧区域不断增大,逐渐进行厌氧反应,对O2的需求量减小。由于产甲烷菌是严格的厌氧微生物,O2的存在会对产甲烷菌的活动造成严重抑制[19-20]。然而,也有研究[21]表明,产甲烷菌短时间(30 h)持续暴露在空气中不会出现群落数量的减少,主要原因是存在好氧菌和兼性厌氧菌消耗环境中的O2以及产甲烷菌自身具有对O2的耐受能力。因此,在停止抽气后,好氧菌和兼性厌氧菌逐渐将O2耗尽,产甲烷菌能够恢复产CH4活动。由图2可知,随垃圾量的增加,CH4质量增大,故抽气操作在实际应用中,其底部气体具有回收CH4资源的价值。2.2. 抽气对温室气体CO2和CH4排放通量的影响
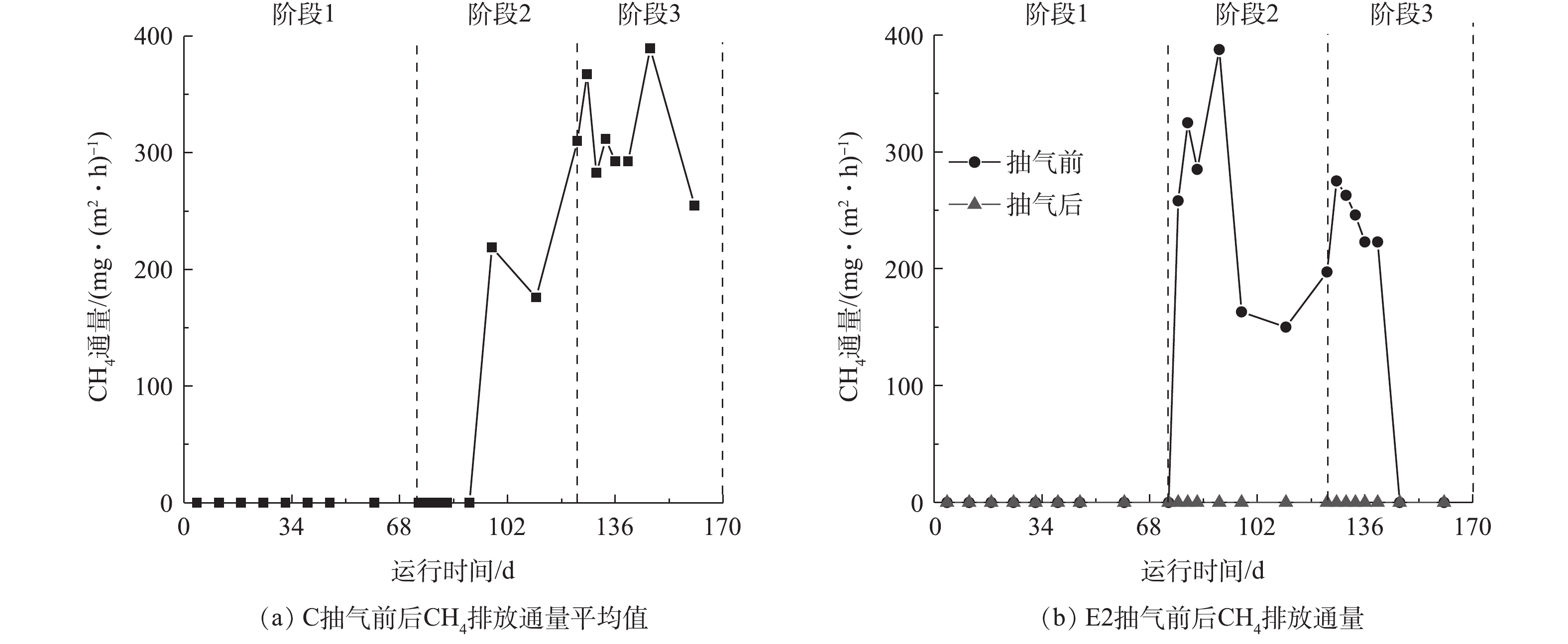
如图3所示,在完成垃圾填埋的短时间内,E2抽气前的CO2排放通量略高于C和E1。在阶段3初期,E2中通量达到最大值,为54 g·(m2·h)?1,而C和E1中分别是34和40 g·(m2·h)?1。随着反应的进行,E2的CO2减排效率趋于稳定,约为25%。这可能是因为垃圾刚填入反应器时,新鲜垃圾孔隙中含有大量O2,主要进行好氧反应;抽气操作引入O2,反而导致E2内部反应剧烈,使得CO2排放量剧增。然而,随着孔隙中O2被消耗,厌氧反应增强,好氧反应减弱,对O2的消耗能力减弱,E2对厌氧菌的抑制作用得到体现,所以逐渐表现出对CO2的控制作用[22-23]。同时,E1的减排效率呈下降趋势,甚至有促进CO2排放的情况出现。这可能是E1的抽气量较低,当垃圾在自身重力和降解作用下密度增大时[24],空气难以深入垃圾内部与之充分接触,因此,导致E1的减排效果在反应后期变差。图4展示了3个反应器中CH4通量随时间和抽气操作的变化情况。由图4可知,在反应进行的第77天左右,E2开始产生CH4;未进行抽气的C中CH4在第97天左右产生。虽然E2最早产生CH4,但其CH4排放量在填入垃圾后,短暂上升随即逐渐下降,而C的CH4排放量整体呈上升趋势。这可能是间歇性的抽气操作引入O2,加速了有机物水解及进入甲烷化阶段,但O2又对产甲烷菌的活性造成抑制,不断削弱其产CH4能力,CH4排放量逐渐减少[21, 25]。如图4所示,在抽气结束后,E2中的CH4排放量迅速减少至仪器检出限以下,表明抽气操作达到了减少CH4排放的目的。然而,反应器E1一直未检测到CH4,其渗滤液的pH与C接近,一直在5.7~6.5之间波动,低于E2(6.5~7.7);E1中氨氮浓度短暂上升后,稳定在5 000~5 700 mg·L?1,略低于E2,但比C中浓度更高。有研究[22-23, 26]表明,垃圾中的有机物首先在胞外水解酶的作用下生成有机酸,但产甲烷菌生长速度慢且容易受到O2和高浓度氨氮的抑制,不能及时利用水解产生的有机酸,使得有机酸大量积累,最终对产甲烷菌造成抑制[27]。此外,根据ZHU等 [28]的研究,引入O2量的不足不利于兼性菌的生长,会造成乳酸的积累对水解及甲烷化过程造成抑制。
如图4(b)所示,在第97天以后,E2的CH4通量总体呈下降趋势,并在第147天降低至仪器检出限之下。这可能是不断地引入O2,对垃圾内部的产甲烷菌造成反复刺激,减弱了其活性,也可能是由于在此期间环境温度较低(16~24 ℃)及随着反应的进行易利用的底物减少等原因,从而对甲烷菌的活动造成不利影响导致[29]。由图2可知,E2底部抽出气体中的CH4浓度不断增大,而E2中CH4的排放通量呈减小趋势。有研究[30-31]表明,O2浓度和土壤湿度是影响甲烷氧化菌的生长直接因素。CZEPIEL等[32]指出,在距表面5~10 cm处的土壤区域,CH4氧化活动最为强烈。本研究中反应器表层覆土(5 cm)直接与空气充分接触,保证了CH4氧化活动所需要的O2,而定期的模拟降雨操作保证了覆土中适宜的湿度条件。因此,E2中CH4的排放通量减小也可能是随着驯化时间的延长,覆土中甲烷氧化菌的氧化能力增强导致;而E1中未检测到CH4排放,但底部气体中检测到CH4的情况,也有可能是因为CH4产生量太少,被表层覆土全部氧化或者在覆土-空气界面被空气稀释以至于不能被仪器检出。综上所述,E1未测得排放通量,是由垃圾内部酸化,对产甲烷菌造成抑制,以及表层覆土中甲烷氧化菌的氧化作用和空气稀释作用共同导致的结果。
2.3. 抽气量对硫化物排放的影响
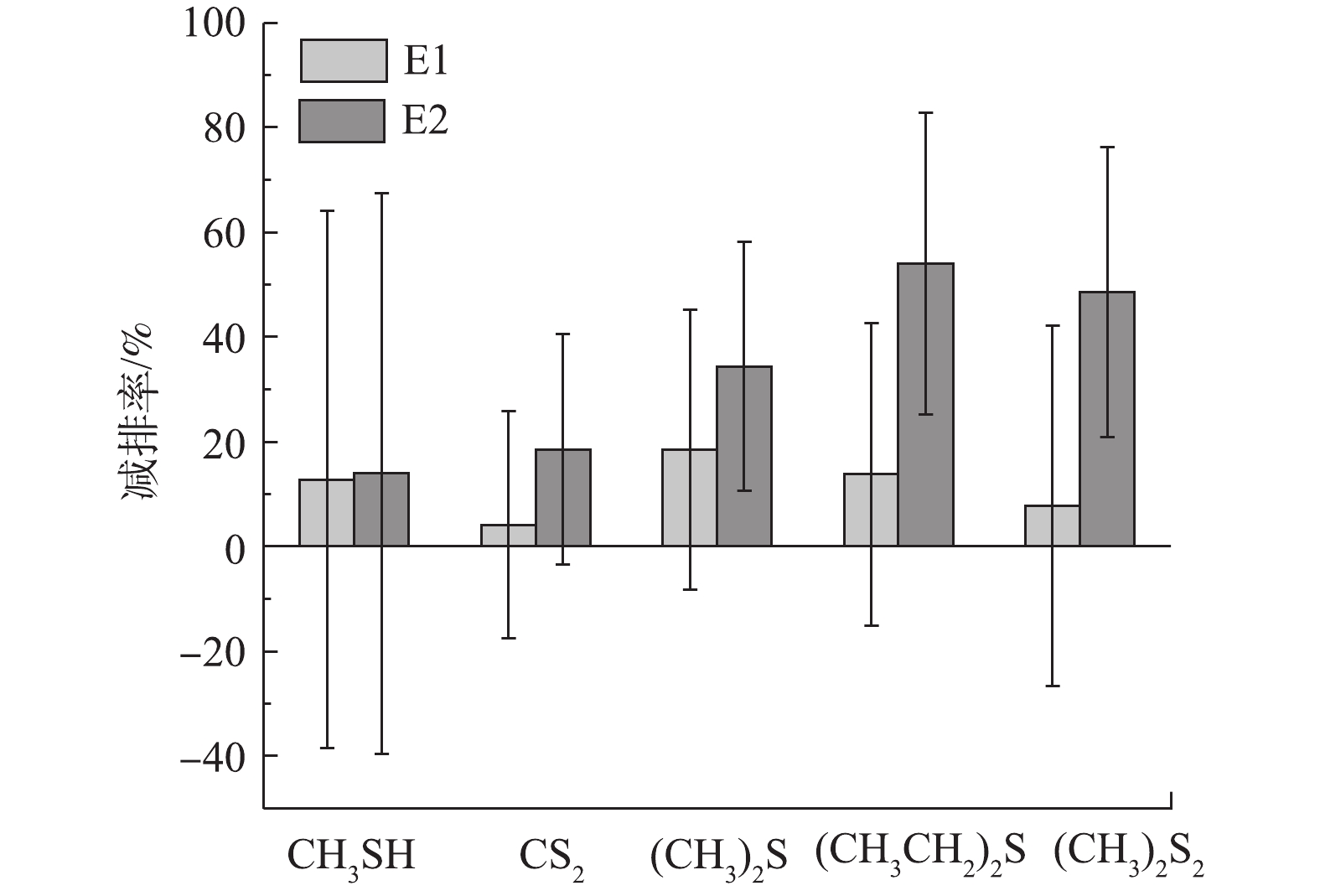
本研究分析了在阶段2和阶段3中抽气操作对5种恶臭含硫气体的平均减排率,并对其中2种有代表性的硫化物,即主要在厌氧条件下产生的甲硫醇(CH3SH)和在好氧条件下产生的二甲二硫醚((CH3)2S2)进行了具体分析。由图5可知,E1对甲硫醚((CH3)2S)的平均减排率最大,约为19%,对二硫化碳的平均减排率最小,约为4%;而E2对乙硫醚((CH3CH2)2S)的平均减排率最大,约为54%,对CH3SH的平均减排率最小,约为14%。与E1相比,E2对5种恶臭含硫气体的排放控制效果都更好;且E1中的5种恶臭含硫气体的排放通量均高于E2,甚至CH3SH的排放通量比C更高(见图6)。根据HIGGINS等[33]的研究,含硫蛋白质是主要的挥发性硫化物来源,含硫蛋白质的水解依赖厌氧微生物的作用。含硫蛋白质经水解生成的含硫氨基酸,主要是蛋氨酸和半胱氨酸在厌氧条件下分别被降解成硫化氢和CH3SH,并在厌氧或好氧微生物的作用下转化成其他硫化物[34-36]。因此,E2的减排作用可能是由于O2的引入对含硫蛋白质的降解造成抑制,使得后续反应无法进行,从而使E2中各类气态硫化物的排放量均很少。
如图6所示,CH3SH排放量随反应的进行呈减少趋势。在C、E1和E2中,CH3SH的最大值分别是0.73、1.46和0.12 mg·(m2·h)?1。E2中的CH3SH排放量低于C和E1,且由图6(c)可知,E2中的CH3SH浓度迅速降至仪器检出限以下,其排放很快得到控制。有研究[33, 37]表明,CH3SH主要来自于厌氧条件下,含硫氨基酸(主要是蛋氨酸和半胱氨酸)的降解和硫化氢的甲基化。因此,E2经抽气,将充足O2引入垃圾内部,对产生CH3SH的厌氧微生物造成抑制,可能是CH3SH排放得到控制的原因。KIENE等[38]的研究表明,微生物在缺氧环境中也可降解含硫氨基酸产生大量的CH3SH。与C相比,E1中可能同时存在厌氧和缺氧区域,供更多的产CH3SH微生物生存。
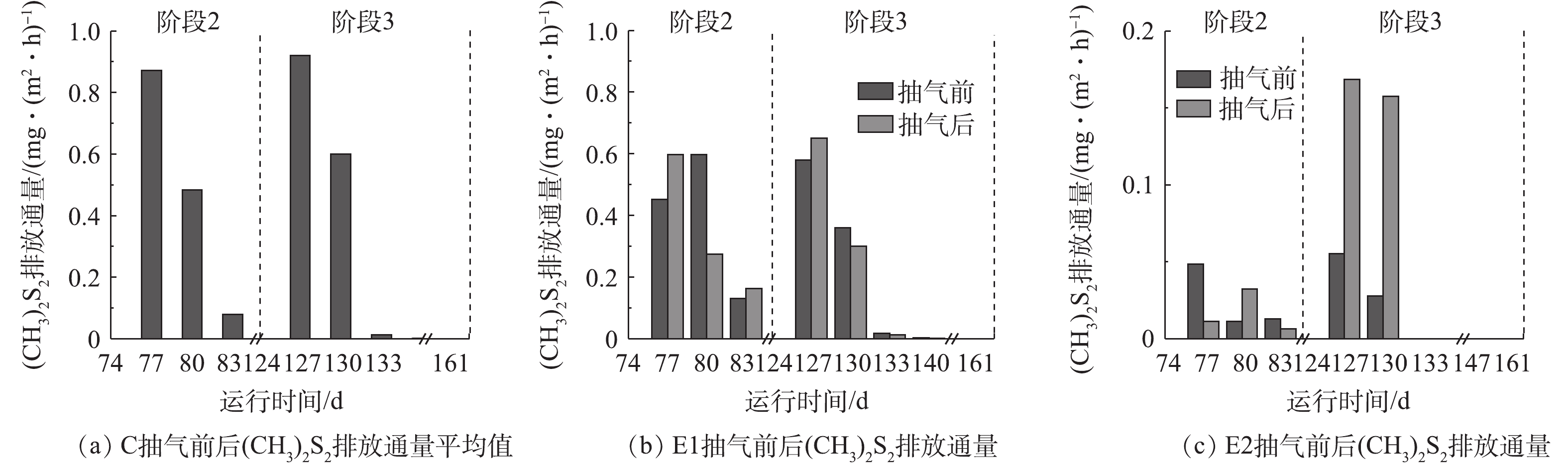
抽气对(CH3)2S2排放的影响如图7所示。在C、E1和E2中,(CH3)2S2通量的最大值分别是0.92、0.65和0.17 mg·(m2·h)?1。如图7(c)所示,E2中的抽气条件并不能很好地控制(CH3)2S2排放,会出现抽气后通量大于抽气前的情况。但与C和E1相比,E2的(CH3)2S2排放通量最低。其中的可能原因包括:1)在有氧条件下CH3SH中的巯基被氧化成二硫键,从而形成 (CH3)2S2[33, 39-40],但由图6可知,E2中CH3SH含量少,缺少转化原料可能导致了E2的(CH3)2S2产生量低于C和E1;2)E2提供了更多的O2,可能使得较多的(CH3)2S2被彻底氧化为硫酸根[41],导致E2中(CH3)2S2含量比C和E1更少;3)(CH3)2S2可在产甲烷菌的去甲基化作用下被转化成硫化氢[42-43],结合3.2节中E2的CH4排放情况可知,产甲烷菌较E1活跃,因此,可能是E2中(CH3)2S2发生转化使得排放低于E1。
2)在对含硫恶臭气体的控制中,高抽气量反应器对5种硫化物的减排效果都比低抽气量反应器更好。高抽气量反应器对(CH3CH2)2S的平均减排率最大为54%,而低抽气量反应器对(CH3)2S的平均减排率最大为19%。同时,与不抽气反应器相比,低抽气量反应器中CH3SH的排放更高,这可能是由于低抽气量反应器中的缺氧区和厌氧区的面积更大,有利于分解含硫有机物的微生物生存,从而加剧了含硫恶臭气体的产生。因此,应避免使用低抽气量反应器来控制填埋场含硫恶臭气体的排放。
参考文献


 下载:
下载: 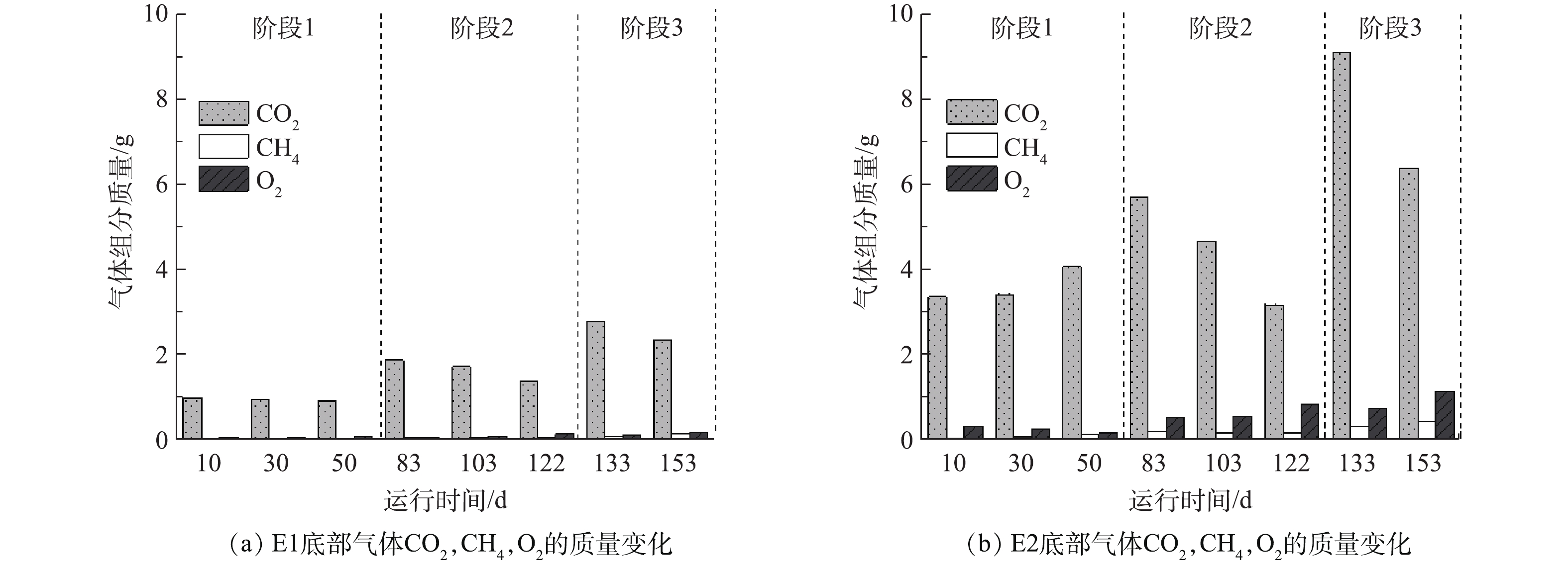


 点击查看大图
点击查看大图