全文HTML
--> --> --> 聚羟基脂肪酸酯(polyhydroxyalkanoate,PHA)是一类具有与传统石化塑料相似性质并可由多种微生物内源产生和降解的聚合物[1-2]。典型的三段式混合菌群生产PHA工艺可与现有废水废物处理系统耦合[3],在资源化回收碳源的同时,从根本上解决石化塑料过度使用带来的“白色污染”和“微塑料”等问题。餐厨垃圾是产量巨大且有机质含量丰富的废物资源[4],厌氧消化产甲烷是目前主流的餐厨垃圾资源回收处理工艺。然而由于餐厨垃圾中有机质含量高,厌氧发酵后的产酸液富含挥发酸,易抑制产甲烷过程,使得其厌氧消化过程极其不稳定[5]。PHA生产的适宜底物为小分子挥发酸[6-7],如结合餐厨垃圾水解酸化工艺及PHA合成工艺,不但充分利用生成的挥发酸,更为餐厨垃圾多途径资源回收提供了思路,目前已有少量研究进行了可行性探索[8-9]。然而,餐厨垃圾作为资源回收工艺底物还具盐含量高的特点[10],盐度是餐厨垃圾发酵液用于PHA生产工艺必须考虑和研究的因素。苟剑锋等[11]调查表明,天水市餐厨垃圾含盐率为1.4~6.4 g·L?1;吴爽[12]研究上海某地区餐厨垃圾发现,其干基含盐率约为20 g·L?1,湿基含盐率约为2 g·L?1,可见餐厨垃圾发酵液的含盐率受各地饮食差异和底物含水率影响,波动范围较大(为1~20 g·L?1)。目前,关于氯化钠对PHA生产过程的影响研究较少,现有的研究多集中在纯菌领域或瞬时投加的影响且研究结果不尽相同。PASSANHA等[13]发现,低浓度的氯化钠(5~9 g·L?1)可以提高而高浓度则会抑制纯菌Cupriavidusnecator的PHA合成能力;PALMEIRO-SáNCHEZ等[14]研究了不同盐度的瞬时投加对混合菌群PHA合成的影响,发现氯化钠的存在会抑制细菌活性同时降低PHA产量。为更好地考察氯化钠对混合PHA合成菌群富集的长期影响并为工程应用提供参考,本研究以模拟餐厨垃圾发酵液为底物,探讨不同盐浓度条件下污泥理化性能、工艺指标及PHA合成能力等方面的差异,分析盐度对混合菌PHA合成工艺的影响。本研究得出的最佳盐浓度可用于指导实际生产工艺,使工艺在合理的盐度范围内保持良好的污泥沉降性和PHA合成能力,有助于推动餐厨垃圾处理和PHA混菌生产耦合工艺的发展。
1.1. 底物和接种污泥
研究采用模拟餐厨垃圾发酵液,根据张玉静等[15]的研究,设置了各种挥发酸的配比,将C∶N∶P比设置为100∶9∶1。碳源由乙酸钠、丙酸钠、丁酸、戊酸和乙醇组成,其浓度分别为260.6、138.9、429.6、75.7和27.2 mg·L?1。氯化铵为氮源,进水浓度为160 mg·L?1。磷酸氢二钾和磷酸二氢钾为磷源,进水浓度分别为18 mg·L?1和8 mg·L?1。同时外加微量元素,具体配置方法参考已有的方法[16]。不同盐度下富集实验中所用的接种污泥皆来自以混合挥发酸为底物稳定运行的SBR富集反应器,无盐度,容积负荷(以COD计)为843 mg·(L·d)?1[17]。瞬时盐度批次实验中所用的污泥取自上述接种污泥在无盐度、容积负荷为1 300 mg·(L·d)?1、混合挥发酸为底物条件下驯化稳定的SBR。初始接种污泥浓度皆为(4 000±200) mg·L?1。1.2. 富集实验与批次实验
1)瞬时盐度批次实验。初步探索了无盐度富集下的污泥(1 300 mg·(L·d)?1负荷下富集)在不同瞬时盐度下的PHA合成表现差异,并由此实验结果确定了后续富集的盐度梯度设置。批次实验所用底物浓度(以COD计)为5 207 mg·L?1,分别添加0、2.5、5、10、15和20 g·L?1氯化钠,具体操作步骤与下文叙述的PHA最大合成能力批次实验一致。2)不同盐度富集实验。采用4个相同的序批式反应器(SBR)作为富集反应器,有效容积为2 L。根据瞬时盐度批次实验结果,氯化钠浓度分别设置为0、5、10、15 g·L?1。容积负荷为1 350 mg·(L·d)?1,污泥停留时间(SRT)为10 d,水力停留时间(HRT)为1 d。富集采用“饱食-饥饿”模式,一个运行周期时间为12 h,包括进水(10 min)、曝气(610 min)、排泥(5 min)、沉淀(90 min)和排水(5 min)。反应器温度控制在室温(21±2) ℃,进水pH控制在7.0±0.2。溶解氧(DO)和pH由在线设备实时监测。
3) PHA最大合成能力批次实验。实验在500 mL平底烧杯中进行,用于考察富集污泥的最高PHA合成含量。收集“饥饿”阶段末期的浓缩污泥200 mL,加入200 mL与富集底物碳源配比相同、浓度为2 700 mg·L?1的底物,不外加氮、磷,氯化钠浓度与对应富集反应器的浓度一致。曝气控制在为0.2~0.3 m3·h?1。反应1.5 h后沉淀,排出200 mL上清液后,再加入相同底物200 mL,重复上述操作共5次。每次底物加入后和沉淀前取样测试PHA含量。温度控制在室温(21±2) ℃,pH仅在第1次加入底物时调节至7.0±0.1,后续不再控制。
1.3. 分析方法
混合液悬浮固体浓度(MLSS)、污泥容积指数(SVI)、氨氮和溶解性COD按照国家标准方法[18]测量。挥发酸和PHA采用气相色谱法[19](GC7890N/FID,美国安捷伦)测试。胞外聚合物(EPS)可分为松散型(LB-EPS)和紧密型(TB-EPS),由污泥样品加入0.85%的氯化钠溶液后,分别在60 ℃短时间涡旋和70 ℃静态水浴处理下得到[20]。随后,LB-EPS和TB-EPS皆由蛋白质和多糖含量表示,蛋白质采用Lowery试剂盒法,多糖采用苯酚-硫酸法[21]。2.1. 瞬时盐度对污泥PHA合成的影响及盐度梯度的确定
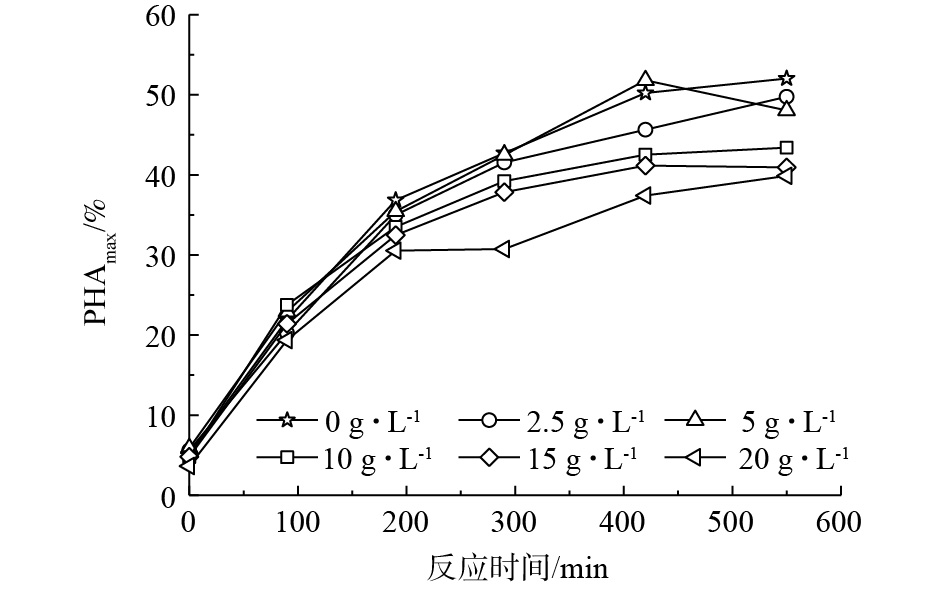
瞬时盐度批次实验分别按照0、2.5、5、10、15、20 g·L?1的盐浓度开展,污泥取自1.3 g·(L·d)?1负荷下稳定运行的SBR。在不同盐度下,污泥所能达到的最大合成量(PHAmax)分别为52.0%、49.8%、51.8%、43.4%、40.9%和39.9%(占污泥干重,结果见图1)。总体来说,盐度的添加对污泥的最大PHA合成量均有抑制作用,说明未经盐度富集的污泥在短时盐度的刺激下会降低PHA的合成。结果与PALMEIRO-SáNCHEZ等[14]的研究相一致,这可能是由于盐度使细胞质壁分离,对菌群活性产生抑制,因此,导致PHA产量下降[22]。但在低盐度(2.5、5 g·L?1)下,PHA最大合成量的降低并不明显,说明在此盐度范围内,PHA合成菌仍能保持较高活性和PHA合成能力。有研究[23]表明,胞内合成的PHA本身是细菌抗逆作用的具体表现之一,在低盐度的刺激下,这种抗逆性可能是PHA合成未受明显抑制的原因。因此,后续富集阶段不再设置2.5 g·L?1盐浓度。在10 g·L?1盐度条件下,PHA最大合成能力明显降低,抑制率达到16.5%,这可能是因为污泥未经盐分富集,该盐度条件已不适宜污泥维持活性,PHA合成受到抑制。在更高的盐度条件(15、20 g·L?1)下,对PHA合成的抑制效果更加明显。不过这2个盐度梯度的抑制效果类似,最大PHA含量分别降低21.3%和23.3%。考虑到实验的经济性和实际性,后续富集阶段仅采用15 g·L?1盐度。因此,通过瞬时的盐度刺激实验,确定后续富集的盐度梯度分别为0、5、10、15 g·L?1。2.2. 盐度对富集污泥理化特性的影响
EPS是包裹在细胞表面由细菌产生的物质,主要由多糖和蛋白组成,它在菌胶团的形成、抗逆等细菌生理活动中起着至关重要的作用[24]。一方面,菌群通过调节EPS的分泌来抵抗外界盐度带来的渗透压的变化,减少盐分对微生物细胞的破坏[25];另一方面,盐度会抑制细菌活性,破坏酶活,进一步抑制EPS的产生[26]。因此,EPS的含量会根据盐度对细菌生理活动的影响程度而变化。富集反应器稳定阶段混合液测得的EPS含量分别为45.2、49.8、47.7、33.8 mg·g?1(以VSS计),如图2(a)所示。在5 g·L?1盐度下,EPS含量有所增加并且主要来自于TB-EPS的增加,说明低盐度对菌群EPS分泌具有刺激作用,菌群分泌更多的EPS以抵抗逆境;在10 g·L?1盐度下,尽管EPS总量有小幅上升,但LB-EPS的含量有明显下降,表明了在此盐度下菌群仍能保持一定活性,但处于外围的EPS已经受到影响;在15 g·L?1盐度下,TB-EPS和LB-EPS含量的同时降低导致EPS总量的明显下降,说明菌群已处于被严重抑制的状态,内部的EPS分泌也受到剧烈影响。EPS对菌群具有保护作用,所以低盐度下最适菌群生存并保持稳定[27]。此外,EPS对污泥沉降性也具有一定影响,一般来说,表现污泥沉降性能的SVI值随EPS含量的增大而增大[23]。但本研究的结果略有不同,如图2(a)所示,尽管在低盐度和中等盐度(5、10 g·L?1)下,EPS含量增加,但污泥的SVI值始终随着盐度的增加而降低,说明污泥的沉降性随着盐度的增加而提升。这主要是由于中低盐度未使微生物活性受到明显抑制,并刺激了EPS分泌,使得菌群絮体更易凝聚形成小颗粒,污泥颗粒更加密实[28],因此更易沉降。这种现象可由显微镜直接观察得到。此外,活性污泥的Zeta电位也可显示活性污泥的聚集能力,负电位越大,则污泥聚集能力越低[29]。如图2(b)所示,污泥表面的Zeta电位随着盐度的增加而趋于更负,说明高盐度下富集出的颗粒化污泥不易聚集而更加稳定。此外,根据粒径测试结果,随着盐度的增加,污泥样品的表面积和体积平均粒径分别从26.989 μm和52.384 μm增长到103.759 μm和217.533 μm。
2.3. 盐度对富集过程中典型指标的影响
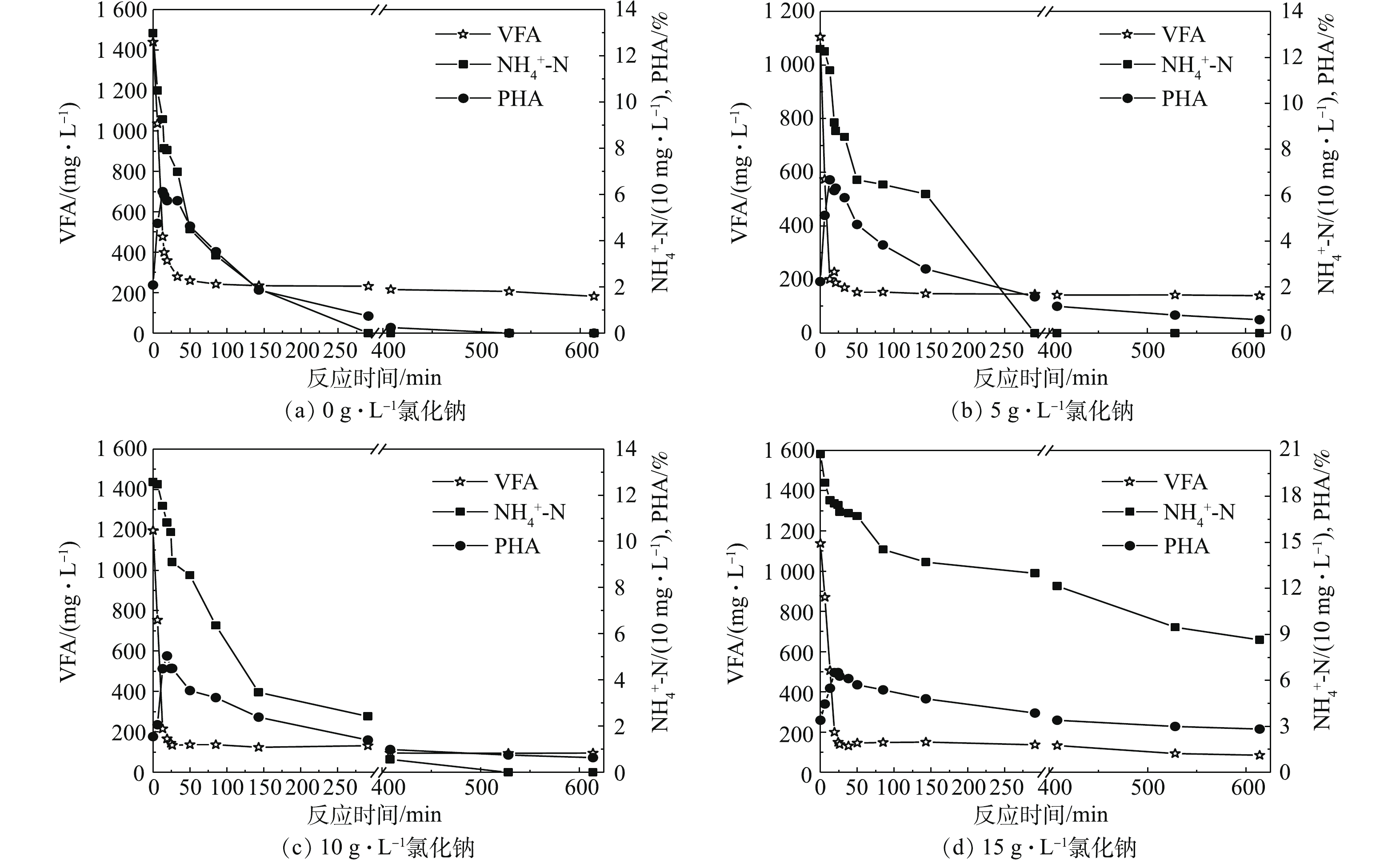
4组不同盐度的富集反应器稳定运行45 d后,一个典型的运行周期内各重要指标的变化见图3。尽管盐度的提升使得“饱食”时间即突越时间增加(分别为11、13、20和25 min),导致“饱食饥饿”时间比(F/F)增大,但F/F值始终保持在0.3~0.4以下,说明4个盐度条件下皆能提供良好的生态选择压力,以筛选PHA储存能力强的菌群[30]。不过,4组反应器都出现了挥发酸积累的现象,即挥发酸无法被完全消耗并导致后续运行周期开始时的底物浓度大于进水中底物浓度,说明长时间在盐度条件下富集后菌群处于活性较低的状态。而盐度对菌群利用氨氮的影响更加明显,15 g·L?1时氨氮剩余40%左右,类似现象也曾有报道[31]。由于反应器中加入了硝化抑制剂,氨氮的消耗直接显示了细菌的生长状况,因此,盐度的增加会抑制菌群的生长活性,而污泥的增殖速率慢会影响工艺最终的PHA产量。此外,高盐度下溶液密度的增大也会加剧污泥流失[32]。另外,在4组不同盐浓度的运行周期内,PHA的最大合成量皆在5%~6.5%,没有明显区别,说明各浓度下的菌群都已适应对应的盐度环境。因此,盐度的长期存在对于菌群的胁迫主要体现在生长活性的降低,但PHA菌群的富集依然可以完成。2.4. 盐度对菌群最大PHA合成能力和PHA产量的影响
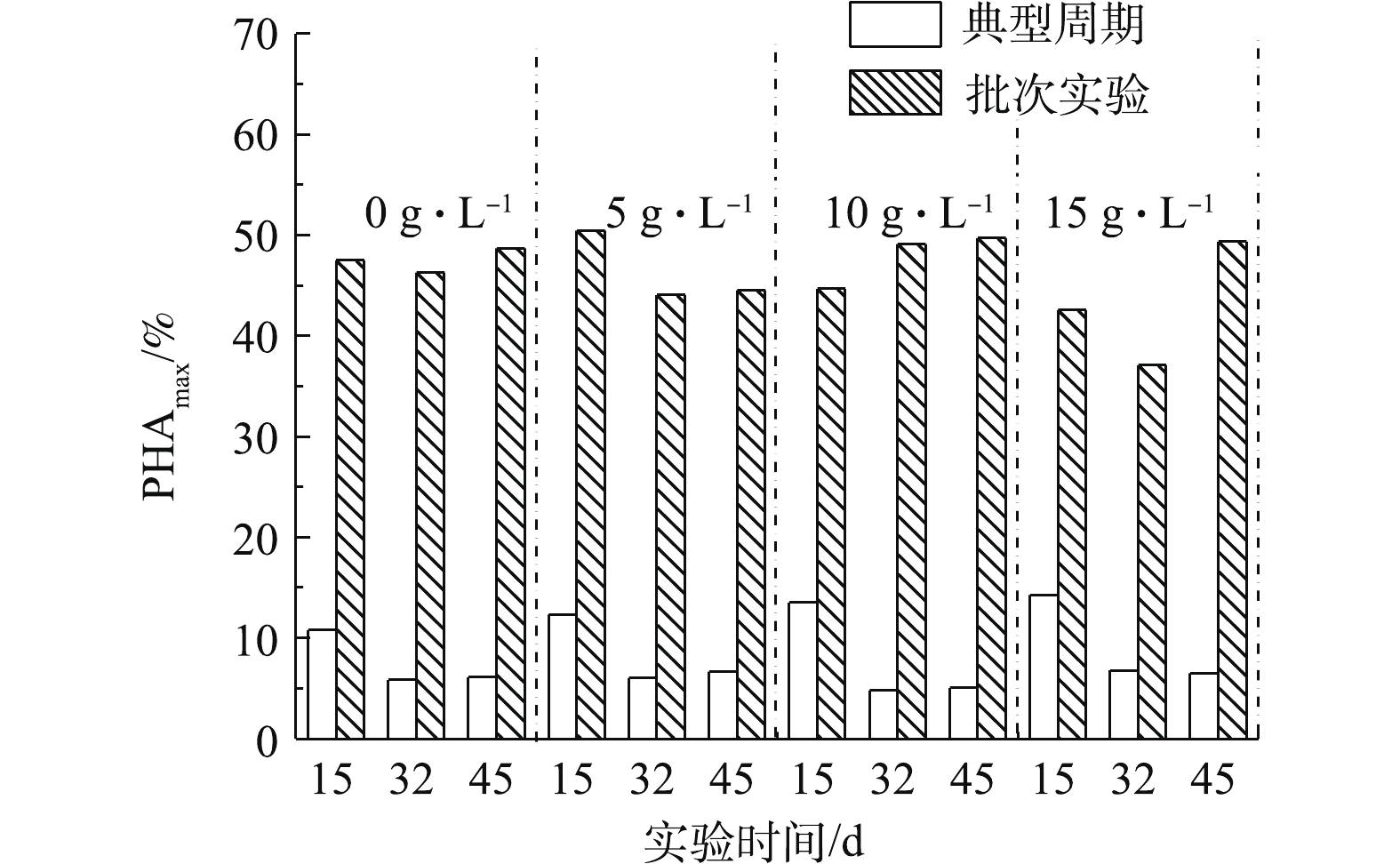
混合菌群PHA合成工艺的最终PHA产量取决于批次合成阶段的污泥浓度与污泥的最大PHA合成能力。经过45 d的稳定运行,富集期间的典型运行周期内PHA最高合成量和对应批次实验中污泥的最大PHA合成能力如图4所示。富集稳定的初期(第15天),运行周期内最大的PHA合成量在溶解氧突越点达到,并随着盐度的增加而增大。可能由于受到盐度冲击后,菌群合成更多的PHA,以抵御逆境[33],这有助于PHA合成菌的筛选。但对应的菌群PHA最大合成能力在5 g·L?1氯化钠富集条件下达到最高,达50.5%,说明短期的富集下盐度不宜过高,PHA最大合成能力受到高盐度的抑制。富集稳定的中后期(第32天和第45天),在各个盐浓度条件下的运行周期内,最大PHA合成量基本稳定且无明显差别,表明各盐度梯度下菌群皆富集成熟。与富集初期周期内PHA最大合成量的降低比较,显示出了菌群对于盐度的适应性。从菌群PHA最大合成能力来看,低盐度下PHA最大合成能力在中后期会下降,而高盐度下则会升高并达到与无盐处理相近的水平(约49%),说明高盐度富集条件需要更长的富集时间达到稳定运行,在高盐度下富集出的菌群同样具有较高的PHA合成能力。考虑到盐度对于菌群生长的抑制,尽管菌群在高盐度下仍能保持较高的PHA最大合成能力,但污泥的浓度较低。表1给出了不同盐度处理下短期(12~15 d)和长期运行(42~45 d)后各反应器PHA产量的变化。短期富集后,菌群PHA产量在低盐度(5 g·L?1)下有少许提升,但在更高盐度下皆明显降低,主要是由于污泥浓度和PHA最大合成量的降低。长期富集后,尽管由于菌群对高盐度的适应,PHA最大合成能力有所恢复,但污泥浓度处于较低水平,导致PHA产量仍然低于无盐度和低盐度的处理。2)盐度的增加会延长“饱食-饥饿”时间比,但仍能维持较高的生态筛选压力。高盐度对于菌群的胁迫主要体现在对其生长活性的抑制,但经过长时间的富集,菌群的PHA合成能力仍能达到较高水平。
3)短期富集下,低盐度的加入将会刺激PHA合成并有助于提高PHA产率。长期富集下,菌群可以适应高盐度并且能够维持较高的PHA合成能力,但由于菌群生长受到抑制,产量的降低将不利于PHA工艺的整体运行。
参考文献

 下载:
下载: 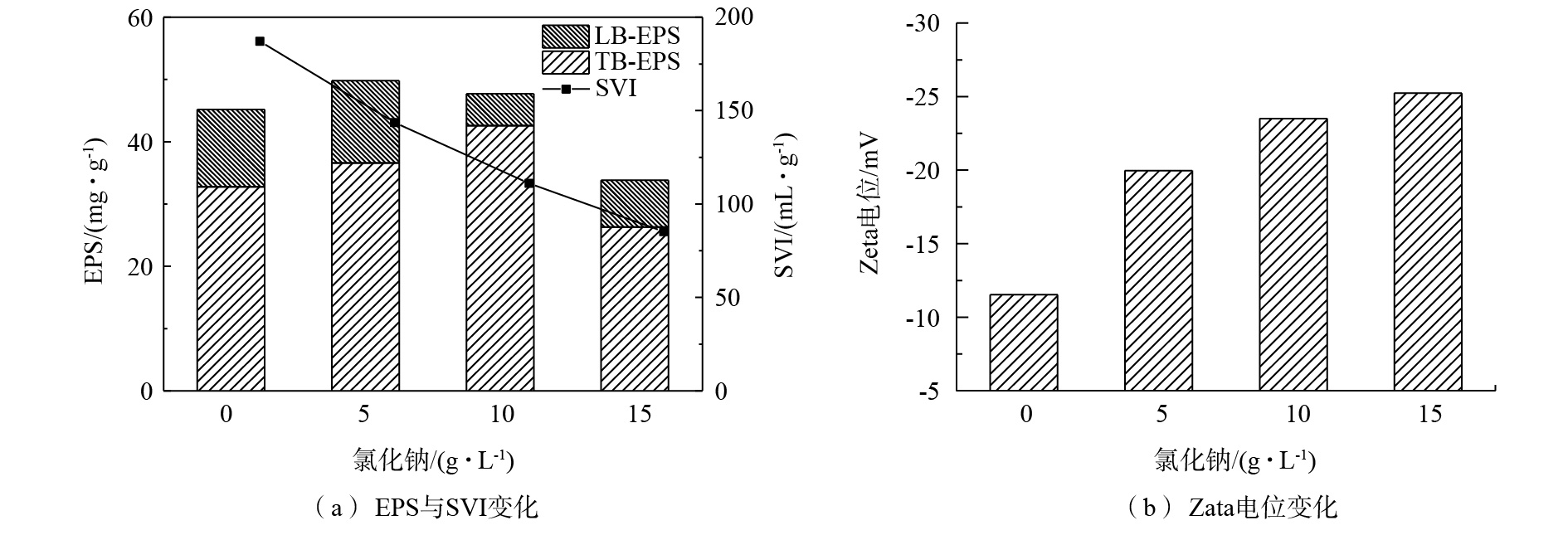
 点击查看大图
点击查看大图