
上海交通大学 材料科学与工程学院 金属基复合材料国家重点实验室, 上海 200240
2021-04-20 收稿, 2021-05-20 录用
*通讯作者: 陶可
摘要: 临床上最常用的钆基磁共振造影剂(GBCA)在检测疾病时缺乏特异性而难以区分病灶。大量的研究关注于生物响应性造影剂的开发,使得磁共振(MR)信号强弱随生理或病理环境的变化而改变。本文回顾了目前生物响应性GBCA的3种设计理念,阐述了其提高弛豫率的具体途径及其在影像诊断上的应用,对生物响应性GBCA的发展做出了展望,并指出了其在临床转化过程中需解决的问题。
关键词: 磁共振成像钆基磁共振造影剂生物响应性弛豫率疾病诊断
Recent Progress in Bio-responsive Gadolinium-based MRI Contrast Agent
LIU Yanyue, WU Yongjie, SUN Kang, TAO Ke

The State Key Lab of Metal Matrix Composites, School of Materials Science and Engineering, Shanghai Jiao Tong University, Shanghai 200240, P. R. China
*Corresponding author: TAO Ke
Abstract: The gadolinium-based contrast agent (GBCA), the most common contrast agent in clinical magnetic resonance (MR) imaging, lacks specificity when detecting diseases and thus makes it difficult to distinguish lesions. Many recent researches have focused on the development of bio-responsive contrast agents which can vary the intensity of MR signals with changes in physiological or pathological environment. This article reviews three current design concepts of bio-responsive GBCAs, expounds the specific methods of promoting relaxation rate and its application in imaging diagnosis, makes a prospect for the development of bio-responsive GBCA, and points out the problems to be solved in the conversion process for clinical application.
Key words: magnetic resonance imaging (MRI)gadolinium-based contrast agentbio-responsiverelaxation ratedisease diagnosis
磁共振(MR)成像是一种非侵入性体内临床诊断的重要技术[1, 2]。磁共振造影剂可以缩短组织中氢核的弛豫时间来使造影剂所在部位的磁共振信号与其他部位的信号相比有显著的变化,从而实现造影成像的增强[3, 4]。钆基磁共振造影剂(GBCA)因其含有的三价钆离子(Gd3+)能大幅缩短人体组织中氢核的纵向弛豫时间(T1),成为了目前应用最广泛的磁共振造影剂[5, 6]。现用于临床诊断的商用GBCA有钆喷酸葡胺(Gd-DTPA)、钆特酸葡胺(Gd-DOTA)等,T1弛豫率在3~10 mmol-1·L·s-1。然而,此类GBCA在体内为非特异性分布,在正常的人体组织和病灶处都有造影信号。这种非特异性使得病变诊断中的目标信号与背景信号的比值较小,难以区分病灶部位,并伴有假阳性诊断的风险。为获得较好的成像质量,有时需要在短时间内重复注射GBCA或加倍注射,但这也增加了Gd3+在体内的滞留,以及肾原性系统性纤维化(NSF)的患病风险[7, 8]。为解决上述问题,近年来众多研究侧重于生物响应性GBCA的开发,旨在对病灶部位进行特异性成像诊断[9-12]。相较于现有的商用GBCA,生物响应性GBCA在同等剂量注射时不仅拥有更显著的成像效果,还能适当延长其在体内的滞留时间,并拥有以亚毫米级的分辨率对组织内部的酶活性、离子通量、氧化还原状态、pH等特异性病理指标进行成像和定量的能力[13, 14]。这些特性大大提高了诊断的敏感性,避免了多次重复注射GBCA,并为疾病的早期精确诊断提供了可能。
1 生物响应性GBCA的设计理论生物响应性造影剂的设计原则是使其弛豫率能够随病变处的pH、金属离子浓度、酶活性等内源性生理指标的变化而变化。而GBCA作为T1磁共振造影剂,其纵向弛豫主要来自于直接与Gd3+配位的内层水分子提供的内层弛豫率(r1IS),约占GBCA总弛豫率的60%;其余的弛豫则来自外部水分子提供的外层弛豫率(r1OS)[15]。理想状态下造影剂在响应前后的成像状态由关闭(OFF)转为开启(ON),但目前对r1OS的影响因素仍缺乏认识,无法较好地调控r1OS,因此大多数的造影剂在初始状态下并不是完全的关闭状态,而是具有一个较低强度的r1OS信号,通过对刺激的响应来改变r1IS进而调控其总体的造影成像状态。根据SBM理论(Solomon-Bloembergen-Morgan theory),如图 1所示,r1IS主要有3个影响参数,即水分子滞留时间(τm)、旋转相关时间(τR)和配位水分子数(q)。现有的关于生物响应性GBCA的研究也集中在这3个参数的调控上。
图 1
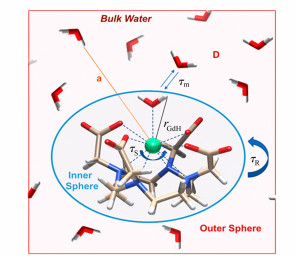 | 图 1 GBCA弛豫率的影响因素[15] |
2 提高生物响应性GBCA弛豫率的策略2.1 减少水分子滞留时间(τm)减少水分子滞留时间是最为常见的提高造影剂弛豫性能的策略。该策略的出发点是促进水分子与Gd3+之间的相互作用,具体来说包括促进水分子进入顺磁性中心,以及在刺激下触发顺磁性离子释放到水环境中这两种方法。但由于游离的Gd3+在体内毒性较大[4, 7, 8, 16],因此多以较高钆元素丰度的氧化钆来代替Gd3+进行释放。
2.1.1 促进水分子进入顺磁性中心钆顺磁性中心可以是纳米颗粒疏水核里的氧化钆纳米粒子或钆的小分子螯合物。对于氧化钆纳米粒子,一般会采用生物响应性的两亲胶束对其进行包封[9, 10]。例如,Zhu等[10]在氧化钆纳米颗粒的表面包裹了pH响应性嵌段共聚物,从而得到了一种pH响应性GBCA。当环境由中性转为弱酸性时,氧化钆表面的聚合物由疏水性转变为亲水性,促进了水与氧化钆之间的相互作用,增加了水分子交换速率(1/τm),从而带来弛豫率的增加。而当纳米颗粒疏水核是钆的小分子螯合物时,纳米颗粒在响应后的分解或是疏水核的膨胀都可以促进水分子与钆的小分子螯合物相互作用[17-19]。例如,在Kim等[17]的研究中,将甲氧基聚乙二醇-b-聚(L-组氨酸)[PEG-p(L-His)]和甲氧基聚乙二醇-b-聚乳酸-二亚乙基三氨基五乙酸二酐-钆螯合物[PEG-p(L-LA)-DTPA-Gd]组成pH响应性聚合物胶束。在弱酸性环境下,p(L-His)嵌段中咪唑基团的质子化,引发了胶束的分解。该分解促进了水分子与顺磁中心Gd-DTPA之间的相互作用,减少了水分子滞留时间,提高了T1弛豫效果。
2.1.2 增加钆的释放疏水性聚合物颗粒在受刺激后分解为可提供高弛豫率的亲水性氧化钆小颗粒,同样可以实现GBCA在响应前后造影成像的变化。例如,Viger等[20]将超小氧化钆纳米颗粒包裹在不同的刺激响应性聚合物基质中合成GBCA,分别实现了pH特异性响应和活性氧(ROS)特异性响应。如图 2(a)所示,在疏水性聚合物基质内部,氧化钆纳米颗粒极少与水分子作用,从而具有极低的(背底)信号。当受到酸性环境或双氧水的刺激后,聚合物基质裂解,氧化钆纳米颗粒被释放到水溶性环境中,如图 2(b,c)所示,其与水分子的交换速率(1/τm)大大增加,导致T1磁共振信号的“开启”。
图 2
 | 图 2 (a) 疏水性基质包裹的氧化钆纳米颗粒(紫色球)的刺激响应性释放;(b) 由中性环境变为酸性环境,激活后的pH响应造影剂释放氧化钆纳米颗粒使得弛豫率增加;(c) ROS响应造影剂随H2O2浓度的增加,不断释放氧化钆纳米颗粒使得T1弛豫率线性增大[20] |
2.2 增加旋转相关时间(τR)大多数小分子GBCA的旋转相关时间较短,导致其弛豫率较大分子GBCA有明显的不足。这是因为大分子复合物GBCA在溶液中有较好的稳定性,有效增加了旋转相关时间,使得Gd3+更有效地诱导水质子的弛豫;并且与小分子相比,分子量较大的复合物在体内的清除率通常会更低,使得大分子GBCA能够随时间的增长而在病灶处积累,从而进一步增强检测到的核磁信号。因此,对调节旋转相关时间的生物响应GBCA,常见的设计思路是通过激活绑定和自组装这两种途径将小分子GBCA变为分子量较大的复合物(图 3)。
图 3
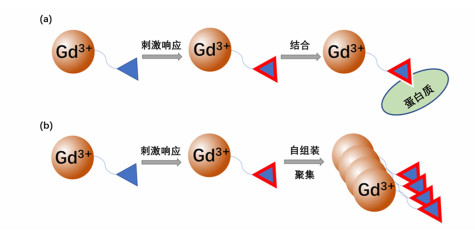 | 图 3 基于生物响应式(a)激活绑定机制,(b)自组装或聚合机制的GBCA的响应过程 |
(1) 激活绑定。如图 3(a)所示,GBCA受内部刺激而被激活,可与蛋白质结合,有效降低了GBCA的翻滚速率(1/τR),从而提高旋转相关时间,增加T1弛豫率。Sherry的团队通过将1, 4, 7, 10-四氮杂环十二烷-1, 4, 7-三乙酸钆(Gd-DO3A)与对Zn2+敏感性不同的配体进行缀合,得到了对Zn2+亲和力不同的一系列GBCA。由于Zn2+与人血清白蛋白的结合能力较强,造影剂在与Zn2+结合后,又与人血清白蛋白连接在一起,形成了较大的三元复合物,从而提高r1。因此此类GBCA可用于检测受到葡萄糖刺激后从体内胰腺β细胞中瞬时释放的Zn2+的浓度[21-23]。
(2) 自组装/聚集。含有反应性基团的GBCA,受内源性刺激而响应性自组装或聚集也可带来旋转相关时间的增加。如图 3(b)所示,这些反应性基团在激活时会在分子间或分子内发生反应,引发自组装或聚集,提高GBCA材料的刚性,进而降低其翻滚速率,提高T1弛豫率。一个早期的例子是Weissleder团队研发的可用于检测与炎症相关的髓过氧化物酶(MPO)活性的MPO-Gd[13, 24]。MPO-Gd由两个5-羟色胺(5-HT)基团与Gd-DTPA偶联组成。在MPO存在下,5-HT基团被氧化,形成自由基,并在分子间反应形成至多5个亚基的低聚物[13]。形成的自由基还可以与附近的蛋白质结合,延长GBCA在体内的滞留,进一步提高弛豫效果。
除自由基聚合外,小分子受生物响应激活的可控自组装是设计改变旋转相关时间的另一种途径。Rao的团队开发了一种半胱天冬氨酸酶(caspase)敏感的纳米自组装磁共振成像探针(C-SNAM),用于监测caspase-3和caspase-7介导的细胞凋亡,为肿瘤治疗以及临床前抗癌药物的选择提供宝贵信息[14, 25, 26]。如图 4所示,存在caspase-3/7和细胞内谷胱甘肽(GSH)时,C-SNAM经历分子内环化以形成大环。由于大环是刚性且疏水的,因此在水溶液中它可以进一步自组装成钆基纳米颗粒,延长旋转相关时间,提高了造影效果。
图 4
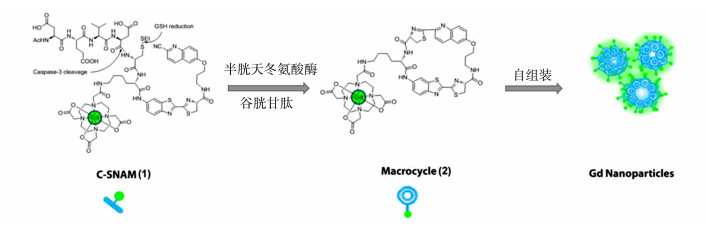 | 图 4 C-SNAM(1)的化学结构;在二硫键被还原和caspase-3触发的DEVD肽裂解后,C-SNAM通过2-氰基-6-羟基喹啉和D-半胱氨酸残基之间的生物相容性分子内环化反应转变为刚性和疏水的环化产物(2);大分子环(2)由于分子间作用力(即疏水相互作用和π-π堆积)的增加而自组装为钆基纳米颗粒,使得T1弛豫率相对于未激活响应的探针(1)有所增加[14] |
2.3 增加配位水分子数(q)由于内层弛豫率与配位水分子数成正比,因此当GBCA响应于刺激而增加配位水分子数,便可以增大内层弛豫率[27]。许多研究通过内源性刺激来改变水合环境,其中最为典型的是金属离子响应性GBCA和酶响应性GBCA。如图 5所示,在GBCA关闭状态下,由于封盖配体阻止配位,水分子进入GBCA内Gd3+中心的通道受阻,此时的配位水分子数为0或1;受内部刺激后,封盖配体与金属离子结合而被提起,或封盖配体被生物酶裂解,配位水分子数量大大提高,从而大幅增加弛豫率,以实现造影状态开启[28]。
图 5
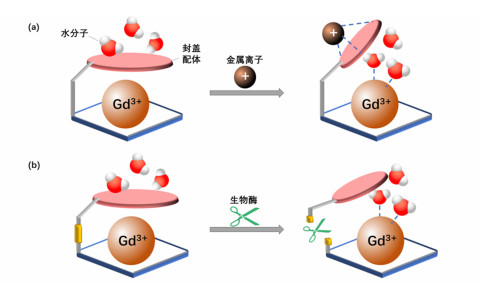 | 图 5 (a) 金属离子响应和(b)酶响应GBCA过程 |
(1) 金属离子响应。Ca2+、Cu2+和Zn2+等金属离子在细胞信号转导中起到重要作用。对特定离子的浓度变化产生响应的非侵入性成像有助于观测器官功能和病理状态。例如,由于前列腺组织对Zn2+的富集能力随肿瘤的恶化而衰退,因此通过监测葡萄糖刺激后从前列腺细胞中瞬时释放的Zn2+浓度,可有效区分肿瘤的病程[22]。Major等[29, 30]设计了一种带有亚氨基二乙酸酯侧基的Gd-DO3A的衍生物,可实现与Zn2+可逆结合。Zn2+的配位将Gd3+的配位水分子数从0变为1,激活状态下的r1值为未激活状态的121%。Dhingra等[31]所研发的对Ca2+响应的Gd-DOPTRA是由一个Gd-DO3A单元,配以邻氨基苯酚N, N, O-三乙酸酯(APTRA)侧链组成。不存在Ca2+时,APTRA单元与钆顺磁中心配位,形成配位水分子数为0的络合物;而存在Ca2+时,APTRA单元优先选择与Ca2+配位,导致了Gd3+与水分子的相互作用,使q增至1,r1值翻倍。Li等[32]则开发了一种Cu2+响应剂Gd-QDOTAMA,该试剂由Gd-DO3A衍生物和基于喹啉的侧基配体组成。当遇到病灶微环境中的Cu2+时,Cu2+的配位使得GBCA的配位水分子数从1增至2,r1值增幅达71%。
(2) 酶响应。另一类调节水合状态的GBCA为酶响应性造影剂。一个早期实例是Duimstra等[33]使用钆基螯合物来检测参与肿瘤的侵袭和转移过程的β-葡萄糖醛酸苷酶(β-glucuronidase)。该生物响应性造影剂是在Gd-DO3A上接β-葡萄糖醛酸侧基,侧基通过自消灭性连接子与大环相连。葡萄糖醛酸充当了可被酶裂解的部分,继而通过自牺牲的方式将封盖配体和钆基螯合物分裂成两个部分。被“释放”了的钆基螯合物因此拥有了更高的配位水分子数,被酶激活后,在模拟体内阴离子浓度的缓冲液中T1弛豫率提高17%。Giardiello等[34]利用Gd-DO3A配合物与体内的碳酸氢根离子结合形成配合物。带有3个乙基侧基的中性Gd-DO3A衍生物与碳酸氢盐形成稳定的配位水分子数为0的复合物;而当其通过细胞膜后暴露于猪肝酯酶(esterase)时,带有侧基乙酰氧基甲基酯的钆基配合物被激活,乙酯被水解以释放出3个侧基羧酸盐。所得的阴离子络合物排斥配位阴离子,从而使水分子结合至Gd3+所在的顺磁中心,配位水分子数增加到2,使得T1弛豫率增幅达84%。
2.4 组合调控多项参数上述的设计通过内部刺激分别改变了水分子滞留时间、旋转相关时间或配位水分子数这三项影响弛豫率的参数。而近年来,也有****开始尝试在响应刺激时改变多项参数,以期达到更好的造影效果。例如,Garello等[35]设计了一种钆基造影剂(LIPO-L-Gd),将配位水分子数的变化与旋转相关时间的变化相结合,从而更为精确地检测Ca2+浓度的变化。如图 6所示,可捕获Ca2+的螯合物被偶联至Gd-DO3A内核上,并一起连至脂质体双层上。当环境中的Ca2+饱和后,脂质体GBCA的r1值激增至不存在Ca2+时的4.2倍。这是因为当螯合剂与Ca2+结合后,配位引起两亲性配体的构象变化,一方面使Gd-DO3A部分的配位水分子数由0变1,另一方面减缓了分子高速的内旋转速度,增加了旋转相关时间,从而进一步增强了T1弛豫率。这也是据我们所知迄今为止报道的对Ca2+响应的GBCA中在T1弛豫率上达到的最高变化。通过总结了上述生物响应性GBCA的刺激源,被调控的弛豫率参数,T1弛豫率响应前后的变化及其增幅(表 1),我们猜测改变多项弛豫率参数有望实现更为理想的刺激响应性磁共振成像效果。
图 6
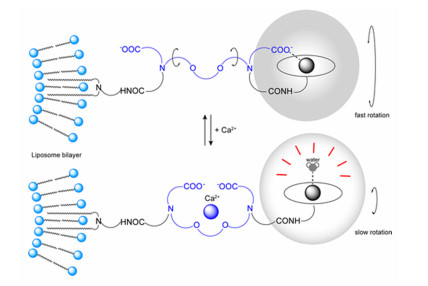 | 图 6 LIPO-L-Gd造影剂对Ca2+的响应机制[35] |
表1
| 表 1 生物响应性GBCA总结 |
3 生物响应性GBCA的应用3.1 肿瘤微环境(TME)的响应性成像在人体组织中,TME是一种特殊的局部环境,具有乏氧、弱酸性、氧化应激增强、酶过度表达等特点。生物响应性GBCA可根据TME的特性进行针对性设计,从而达到精确诊断的目的。根据Warburg效应,由于肿瘤细胞的无氧呼吸作用,肿瘤细胞经糖酵解产生的一系列酸性物质使得TME的pH相较于正常细胞环境偏低,约为6.5~6.9[36, 37]。而通过设计使得GBCA在此pH范围内发生膨胀、收缩、裂解等变化,改变其对水分子的亲和能力,便可对弱酸性的TME实现响应性成像,大幅提高了检测的特异性[10, 17, 20]。相较于正常人体组织,肿瘤导致的线粒体功能障碍、代谢速率提高等行为会破坏氧化还原环境,TME中过量分泌的内源性抗氧化剂导致活性氧(ROS)氧化应激增加[38-40]。在GBCA上搭载能与这些过量的H2O2、GSH等抗氧化剂发生氧化还原反应的基团,使得整体造影剂的性质发生响应性变化,可实现对肿瘤的精准成像[14, 20]。大多数肿瘤的发生都伴随着酶的异常表达,且表达水平随肿瘤的恶化而改变。酶对其底物表现出高选择性,因此将肿瘤相关的酶的底物与GBCA进行组合,可以得到对肿瘤特异性识别的造影剂[13, 14]。生物酶还能特异性地催化底物水解,因此将可催化的底物制成造影剂的“封盖”,在遇到与肿瘤相关的酶时,GBCA被解封激活,可实现对肿瘤组织的特异性成像[33, 34]。
为提高疗效,近年来研究者也开始设计对TME中的双重或多重内源性刺激作出响应的GBCA,并在此基础上,结合TME的特点综合设计,赋予了GBCA成像之外的功能。Fu等[41]研发了一种pH & GSH型钆基MR/荧光双模探针(DA-SN)。在弱酸性和高GSH浓度的TME中受分子间作用力(疏水作用和π-π堆积)影响,探针表面电荷发生转化,在激活造影能力的同时也提高了细胞对造影剂的摄取,有效实现了对肿瘤的响应性双模态造影。Song等[42]的研究开发了一种对pH和酶响应性MR成像和药物释放的钆基口服药物用于结肠癌的诊断和治疗。通过将pH敏感的聚丙烯酸和可被β-糖苷酶(β-glycosidase)降解的壳聚糖修饰在Gd3+掺杂的介孔羟基磷灰石纳米颗粒上,使纳米粒子达到结肠肿瘤部位,实现了响应性成像并防止了药物的提早释放。
3.2 其他疾病微环境响应除开肿瘤成像,生物响应性GBCA还能用作代谢显像剂为包括心脑血管疾病、内分泌疾病、泌尿系统疾病、精神类疾病等提供精准的成像诊断。例如,肾脏疾病常伴随有肾小管液酸碱水平异常,Raghunand等[43]依次对小鼠注射了具有相似药代动力学性质的非pH响应性GBCA(GdDOTP5-)和pH响应性GBCA(GdDOTA-4AmP5-)进行造影成像,如图 7(a,b)所示,实现了对肾脏尿碱及其周围组织代谢性酸中毒的精准诊断。分别展示了正常小鼠和全身代谢性酸中毒并伴有尿碱化的小鼠肾脏pH成像。关于心脑血管疾病,一个早期的例子是de Leon-Rodriguez等[44]使用pH响应性GBCA对心脏缺血情况进行检测。如图 7(c)所示,由于心脏缺血部位供氧不足,其pH略低于正常组织,因此GBCA在心脏的缺血部位响应激活,得到较高的MR信号。此外,随着近年来对Zn2+在催化作用、信号转导作用中的研究不断深入,发现组织中的Zn2+浓度失衡与糖尿病、前列腺癌、阿尔兹海默症等疾病相关,研究者们开发了一系列的Zn2+响应性GBCA对胰腺、前列腺等区域进行特异性成像[21-23, 29, 30]。
图 7
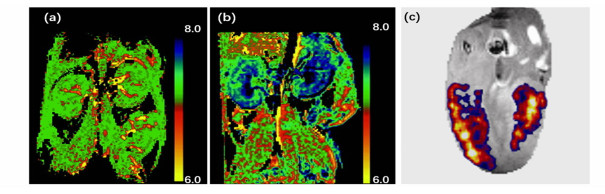 | 图 7 (a) 正常小鼠肾脏pH响应性成像;(b)全身代谢性酸中毒并伴有尿碱化的小鼠肾脏pH响应性成像;(c)心脏缺血部位pH响应性成像 |
4 总结与展望生物响应性GBCA,其响应特性可用于因病理性变化而被激活的磁共振成像,解决了现有GBCA成像时灵敏度低和特异性差的问题。本文详细阐述了生物响应性GBCA的设计、原理及其应用的最新进展,论证了其相较于其他磁共振造影剂的优越性。分别对调节水分子滞留时间、旋转相关时间和配位水分子数这3种改变弛豫率的策略展开讨论,猜测同时改变多项弛豫率的影响参数可进一步提高响应前后的弛豫率比值。另需注意,MR信号不仅取决于对生化刺激响应产生的弛豫率,同时也取决于造影剂的浓度,因此需确保MR信号的变化是响应刺激的结果。可采用比例法,使用不同浓度的生物响应性GBCA重复实验,以剔除造影剂浓度这一变量的影响;或采用对照组,连续注射具有相似结构和药代动力学性质的响应性及非响应性造影剂,使用非响应性造影剂的信号变化来估算响应性造影剂的浓度;也可研发双模态成像的生物响应性GBCA,通过另一种成像模式来测算造影剂浓度,对MR信号去卷积从而量化其对刺激响应的程度。
尽管生物响应性钆基磁共振造影剂在医学应用中具有巨大的潜力,但这些研究大多还都停留在实验室阶段,限制了其在临床上的深入应用。首先,应该考虑这些造影剂在合成和表面改性过程中的可再现性和可扩展性;其次,为评估这些造影剂的安全性,还需在生物相容性、生物降解性、药物代谢动力学和免疫学等方面进行深入研究;再者,研发时需考虑这些药物是否可以解决临床诊断中未满足的需求;最后,作为应用于体内的生物制剂该如何提高其递送效率,仍有待进一步探究。解决了上述需求,可以期待,生物响应性钆基磁共振成像造影剂将会被应用于更加广泛的领域。
参考文献
| [1] | Garg P, Swift A J, Zhong L, et al. Assessment of mitral valve regurgitation by cardiovascular magnetic resonance imaging[J]. Nature Reviews Cardiology, 2020, 17(5): 298-312. DOI:10.1038/s41569-019-0305-z |
| [2] | Na H B, Song I C, Hyeon T. Inorganic Nanoparticles for MRI Contrast Agents[J]. Advanced Materials, 2009, 21(21): 2133-2148. DOI:10.1002/adma.200802366 |
| [3] | Li H, Meade T J. Molecular magnetic resonance imaging with Gd(Ⅲ)-based contrast agents: challenges and Key advances[J]. Journal of the American Chemical Society, 2019, 141(43): 17025-17041. DOI:10.1021/jacs.9b09149 |
| [4] | Runge V M. Critical questions regarding gadolinium deposition in the brain and body after injections of the gadolinium-based contrast agents, safety, and clinical recommendations in consideration of the EMA's pharmacovigilance and risk assessment committee recommendation for suspension of the marketing authorizations for 4 linear agents[J]. Investigative Radiology, 2017, 52(6): 317-323. DOI:10.1097/RLI.0000000000000374 |
| [5] | Wang J, Jia Y H, Wang Q Y, et al. An ultrahigh-field-tailored T1-T2 dual-mode MRI contrast agent for high-performance vascular imaging[J]. Advanced Materials, 2021, 33(2): 2004917. DOI:10.1002/adma.202004917 |
| [6] | Chen H M, Qiu Y W, Ding D D, et al. Gadolinium-encapsulated graphene carbon nanotheranostics for imaging-guided photodynamic therapy[J]. Advanced Materials, 2018, 30(36): 1802748. DOI:10.1002/adma.201802748 |
| [7] | Grobner T. Gadolinium-a specific trigger for the development of nephrogenic fibrosing dermopathy and nephrogenic systemic fibrosis?[J]. Nephrology Dialysis Transplantation, 2006, 21(4): 1104-1108. DOI:10.1093/ndt/gfk062 |
| [8] | Marckmann P, Skov L, Rossen K, et al. Nephrogenic systemic fibrosis: suspected causative role of gadodiamide used for contrast-enhanced magnetic resonance imaging[J]. Journal of the American Society of Nephrology, 2006, 17(9): 2359-2362. DOI:10.1681/ASN.2006060601 |
| [9] | Mi P, Kokuryo D, Cabral H, et al. A pH-activatable nanoparticle with signal-amplification capabilities for non-invasive imaging of tumour malignancy[J]. Nature Nanotechnology, 2016, 11(8): 724-730. DOI:10.1038/nnano.2016.72 |
| [10] | Zhu L P, Yang Y, Farquhar K, et al. Surface modification of Gd nanoparticles with pH-responsive block copolymers for use as smart MRI contrast agents[J]. ACS Applied Materials & Interfaces, 2016, 8(7): 5040-5050. |
| [11] | Tang X X, Gong X Q, Ming J, et al. Fluorinated gadolinium chelate-grafted nanoconjugates for contrast-enhanced T1-weighted 1H and pH-activatable 19F dual-modal MRI[J]. Analytical Chemistry, 2020, 92(24): 16293-16300. DOI:10.1021/acs.analchem.0c04296 |
| [12] | Zhou T T, Wan G F, Li B, et al. Nanocomposites of ionic copolymer integrating Gd-containing polyoxometalate as a multiple platform for enhanced MRI and pH-response chemotherapy[J]. Journal of Materials Chemistry B, 2020, 8(30): 6390-6401. DOI:10.1039/D0TB00782J |
| [13] | Nahrendorf M, Sosnovik D, Chen J W, et al. Activatable magnetic resonance imaging agent reports myeloperoxidase activity in healing infarcts and noninvasively detects the antiinflammatory effects of atorvastatin on ischemia-reperfusion injury[J]. Circulation, 2008, 117(9): 1153-1160. DOI:10.1161/CIRCULATIONAHA.107.756510 |
| [14] | Nejadnik H, Ye D J, Lenkov O D, et al. Magnetic resonance imaging of stem cell apoptosis in arthritic joints with a caspase activatable contrast agent[J]. ACS Nano, 2015, 9(2): 1150-1160. DOI:10.1021/nn504494c |
| [15] | Wahsner J, Gale E M, Rodríguez-Rodríguez A, et al. Chemistry of MRI contrast agents: current challenges and new frontiers[J]. Chemical Reviews, 2019, 119(2): 957-1057. DOI:10.1021/acs.chemrev.8b00363 |
| [16] | Kanda T, Fukusato T, Matsuda M, et al. Gadolinium-based contrast agent accumulates in the brain even in subjects without severe renal dysfunction: evaluation of autopsy brain specimens with inductively coupled plasma mass spectroscopy[J]. Radiology, 2015, 276(1): 228-232. DOI:10.1148/radiol.2015142690 |
| [17] | Kim K S, Park W, Hu J, et al. A cancer-recognizable MRI contrast agents using pH-responsive polymeric micelle[J]. Biomaterials, 2014, 35(1): 337-343. DOI:10.1016/j.biomaterials.2013.10.004 |
| [18] | Pellico J, Ellis C M, Miller J, et al. Water gated contrast switching with polymer-silica hybrid nanoparticles[J]. Chemical Communications, 2019, 55(59): 8540-8543. DOI:10.1039/C9CC03312B |
| [19] | Hu X, Liu G, Li Y, et al. Cell-penetrating hyperbranched polyprodrug amphiphiles for synergistic reductive milieu-triggered drug release and enhanced magnetic resonance signals[J]. Journal of the American Chemical Society, 2015, 137(1): 362-368. DOI:10.1021/ja5105848 |
| [20] | Viger M L, Sankaranarayanan J, De Gracia Lux C, et al. Collective activation of MRI agents via encapsulation and disease-triggered release[J]. Journal of the American Chemical Society, 2013, 135(21): 7847-7850. DOI:10.1021/ja403167p |
| [21] | Esqueda A C, López J A, Andreu-De-Riquer G, et al. A new gadolinium-based MRI zinc sensor[J]. Journal of the American Chemical Society, 2009, 131(32): 11387-11391. DOI:10.1021/ja901875v |
| [22] | Lubag A J M, de Leon-Rodriguez L M, Burgess S C, et al. Noninvasive MRI of β-cell function using a Zn2+-responsive contrast agent[J]. PNAS, 2011, 108(45): 18400-18405. DOI:10.1073/pnas.1109649108 |
| [23] | Martins A F, Clavijo Leon-Rodriguez V, Bochner F, et al. Imaging insulin secretion from mouse pancreas by MRI is improved by use of a zinc-responsive MRI sensor with lower affinity for Zn2+ ions[J]. Journal of the American Chemical Society, 2018, 140(50): 17456-17464. DOI:10.1021/jacs.8b07607 |
| [24] | Su H S, Nahrendorf M, Panizzi P, et al. Vasculitis: Molecular imaging by targeting the inflammatory enzyme myeloperoxidase[J]. Radiology, 2012, 262(1): 181-190. DOI:10.1148/radiol.11110040 |
| [25] | Ye D, Shuhendler A J, Pandit P, et al. Caspase-responsive smart gadolinium-based contrast agent for magnetic resonance imaging of drug-induced apoptosis[J]. Chemical Science, 2014, 4(10): 3845-3852. |
| [26] | Shuhendler A J, Ye D, Brewer K D, et al. Molecular magnetic resonance imaging of tumor response to therapy[J]. Scientific Reports, 2015, 5: 14759. DOI:10.1038/srep14759 |
| [27] | ermann P, Kotek J, Kubí?ek V, et al. Gadolinium (Ⅲ) complexes as MRI contrast agents: ligand design and properties of the complexes[J]. Dalton Transactions, 2008(23): 3027-3047. DOI:10.1039/b719704g |
| [28] | Manus L M, Strauch R C, Hung A H, et al. Analytical methods for characterizing magnetic resonance probes[J]. Analytical Chemistry, 2012, 84(15): 6278-6287. DOI:10.1021/ac300527z |
| [29] | Major J L, Parigi G, Luchinat C, et al. The synthesis and in vitro testing of a zinc-activated MRI contrast agent[J]. PNAS, 2007, 104(35): 13881-13886. DOI:10.1073/pnas.0706247104 |
| [30] | Major J L, Boiteau R M, Meade T J. Mechanisms of ZnII-activated magnetic resonance imaging agents[J]. Inorganic Chemistry, 2008, 47(22): 10788-10795. DOI:10.1021/ic801458u |
| [31] | Dhingra K, Maier M E, Beyerlein M, et al. Synthesis and characterization of a smart contrast agent sensitive to calcium[J]. Chemical Communications, 2008(29): 3444-3446. DOI:10.1039/b801975d |
| [32] | Li W S, Luo J, Chen Z N. A gadolinium(Ⅲ) complex with 8-amidequinoline based ligand as copper(Ⅱ) ion responsive contrast agent[J]. Dalton Transactions, 2011, 40(2): 484-488. DOI:10.1039/C0DT01141J |
| [33] | Duimstra J A, Femia F J, Meade T J. A gadolinium chelate for detection of beta-glucuronidase: a self-immolative approach[J]. Journal of the American Chemical Society, 2005, 127(37): 12847-12855. DOI:10.1021/ja042162r |
| [34] | Giardiello M, Lowe M P, Botta M. An esterase-activated magnetic resonance contrast agent[J]. Chemical Communications, 2007(39): 4044-4046. DOI:10.1039/b711989e |
| [35] | Garello F, Vibhute S, Gündüz S, et al. Innovative design of ca-sensitive paramagnetic liposomes results in an unprecedented increase in longitudinal relaxivity[J]. Biomacromolecules, 2016, 17(4): 1303-1311. DOI:10.1021/acs.biomac.5b01668 |
| [36] | Warburg O, Wind F, Negelein E. The metabolism of tumors in the body[J]. The Journal of general physiology, 1927, 8(6): 519-530. DOI:10.1085/jgp.8.6.519 |
| [37] | Wojtkowiak J W, Verduzco D, Schramm K J, et al. Drug resistance and cellular adaptation to tumor acidic pH microenvironment[J]. Molecular Pharmaceutics, 2011, 8(6): 2032-2038. DOI:10.1021/mp200292c |
| [38] | Gupta S C, Hevia D, Patchva S, et al. Upsides and downsides of reactive oxygen species for cancer: the roles of reactive oxygen species in tumorigenesis, prevention, and therapy[J]. Antioxidants & Redox Signaling, 2012, 16(11): 1295-1322. |
| [39] | Gong F, Yang N L, Wang X W, et al. Tumor microenvironment-responsive intelligent nanoplatforms for cancer theranostics[J]. Nano Today, 2020, 32: 100851. DOI:10.1016/j.nantod.2020.100851 |
| [40] | Meng F H, Hennink W E, Zhong Z Y. Reduction-sensitive polymers and bioconjugates for biomedical applications[J]. Biomaterials, 2009, 30(12): 2180-2198. DOI:10.1016/j.biomaterials.2009.01.026 |
| [41] | Fu Y, Jang M S, Wang N N, et al. Dual activatable self-assembled nanotheranostics for bioimaging and photodynamic therapy[J]. Journal of Controlled Release, 2020, 327: 129-139. DOI:10.1016/j.jconrel.2020.07.045 |
| [42] | Song Q L, Jia J J, Niu X X, et al. An oral drug delivery system with programmed drug release and imaging properties for orthotopic colon cancer therapy[J]. Nanoscale, 2019, 11(34): 15958-15970. DOI:10.1039/C9NR03802G |
| [43] | Raghunand N, Howison C, Sherry A D, et al. Renal and systemic pH imaging by contrast-enhanced MRI[J]. Magnetic Resonance in Medicine, 2003, 49(2): 249-257. DOI:10.1002/mrm.10347 |
| [44] | de Leon-Rodriguez L M, Lubag A J M, Malloy C R, et al. Responsive MRI agents for sensing metabolism in vivo[J]. Accounts of Chemical Research, 2009, 42(7): 948-957. DOI:10.1021/ar800237f |
