 , 陈洁, 李宾毅, 邓成瑜
, 陈洁, 李宾毅, 邓成瑜 南宁市红十字会医院, 广西 南宁 530012
2021-01-11 收稿, 2021-05-25 录用
*通讯作者: 钱劲
摘要: 本文探讨非动脉炎性前部缺血性视神经病变(NAIOA)采用光学相干断层扫描血管成像(OCTA)联合彩超诊断的应用价值。选取78例单眼NAIOA患者作为研究对象,分别接受OCTA、彩超检查。经OCTA检查,患侧的上部黄斑部神经节细胞复合体(GCC)厚度、下部GCC厚度及平均GCC厚度测定值均低于健侧,差异具有统计学意义(P < 0.05);上方视盘周围视网膜神经纤维层(RNFL)厚度、下方RNFL厚度及平均RNFL厚度对比,患侧均低于健侧,差异显著(P < 0.05);经彩超检查,患侧眼动脉(OA)的PSV、EDV、RI测定值与健侧比较,差异均不具有统计学意义(P>0.05);患侧与健侧视网膜中央动脉(CRA)的EDV、RI测定值对比,差异无统计学意义(P>0.05),患侧眼CRA的PSV值低于健侧且差异显著(P < 0.05)。CRA-PSV联合平均RNFL厚度以及平均GCC厚度诊断NAIOA患者的灵敏度为95.27%、特异度为83.90%、ROC曲线下面积(AUC)为0.930。研究结果发现OCTA联合彩超在NAIOA患者的诊断中较单一诊断方式更有利于提高诊断的灵敏度。
关键词: 光学相干断层扫描彩超非动脉炎性前部缺血性视神经病变
Study on the Diagnostic Effect of Optical Coherence Tomography Angiography Combined with Color Doppler Ultrasound on Anterior Ischemic Optic Neuropathy
QIAN Jin
 , CHEN Jie, LI Binyi, DENG Chengyu
, CHEN Jie, LI Binyi, DENG Chengyu Nanning Red Cross Hospital, Nanning 530012, Guangxi, P. R. China
*Corresponding author: QIAN Jin
Abstract: The application value of optical coherence tomography angiography (OCTA) and color Doppler ultrasound in the diagnosis of non-arteritic anterior ischemic optic neuropathy (NAIOA) were explored in this study. A total of 78 monocular NAIOA patients admitted to our hospital were selected as the research subjects, and they received OCTA and color Doppler ultrasound examinations. After OCTA examination, the upper GCC thickness, lower GCC thickness and average macular ganglion cell complex (GCC) thickness of the affected side were all lower than those of the healthy side, and the difference was statistically significant (P < 0.05). Compared with the thickness of the retinal nerve fiber layer (RNFL) around the upper optic disc, the thickness of the lower RNFL and the average RNFL thickness of the affected side was lower than those of the healthy side (P < 0.05). After color Doppler ultrasound examination, the PSV, EDV and RI of OA on the affected side were compared with those of the healthy side (P>0.05). The EDV and RI of CRA were compared between the affected side and the healthy side, and the 637difference was not statistically significant (P>0.05). The PSV of CRA of the affected eye was lower than that of the healthy side (P < 0.05). The sensitivity of CRA-PSV combined with average RNFL thickness and average GCC thickness for diagnosis of NAIOA patients was 95.27%, the specificity was 83.90%, and the AUC value of the area under the ROC curve was 0.930. The results of the study showed that OCTA combined with color Doppler ultrasound is more conducive to improve the sensitivity of diagnostic indicators in the diagnosis of NAIOA patients.
Key words: optical coherence tomographycolor ultrasoundnon-arteritic anterior ischemic optic neuropathy
非动脉炎性前部缺血性视神经病变(non-arteritic anterior ischemic optic neuropathy, NAIOA)属于临床常见的视神经疾病,一般是由于视盘供血异常所致,导致筛板前后神经病变,患者出现突发无痛视力降低、视盘节段性水肿和视野缺损,好发于45岁以上人群,严重影响了患者的生活质量与身心健康[1]。临床认为对于本病应以预防为主,强调早期发现视盘与周围组织的缺血,传统的诊断方法如造影、CT、MRI均注重病变后血管表现,而且检测方法有创、烦琐。光学相干断层扫描血管成像(optical coherence tomography angiography, OCTA)技术可以对黄斑部位、视盘微血管与血流开展定量分析,具有可重复性,但是目前联合彩超诊断的价值临床报道相对少见,是否可以提升临床诊断效能尚未确定[2]。本研究分析了光学相干断层扫描联合彩超在非动脉炎性前部缺血性视神经病变的诊断价值,以期为临床提供指导和依据。
1 资料与方法1.1 一般资料选取2017年5月至2020年3月我院收治的78例单眼NAIOA患者进行临床研究。其中,男性患者42例、女性患者36例;年龄47~75岁,平均年龄(58.6±8.5) 岁;起病至接受诊察的时间3~14 d,平均(8.3±2.2) d;其中吸烟患者27例、饮酒患者22例,合并高血压患者21例、糖尿病患者9例。纳入标准:NAIOA患者的诊断参考2015年NAIOA诊断和治疗专家共识中的标准[3];患者年龄范围19~75岁;患者表现为突发性视力下降,经扩瞳后眼睛及前置眼底检查发现视盘局部或全周水肿,可表现为出血;均为单侧患病;本研究方案与相关医学伦理学要求无相悖之处。排除标准:糖尿病性眼底病变、高血压性视网膜病变等其他眼科疾病;获得性免疫缺陷综合征;白血病、淋巴瘤及其他类型的恶性肿瘤患者;动脉性AIOA患者;有青光眼及家族史;有眼科手术史。
1.2 方法OCTA检查:仪器选择Heidelberg Spectralis光学相干断层扫描仪。扫描模式:容积扫描,扫描面积:30°×25°,扫描线距离:240 μm。视盘水肿高度测量选用Thickness profile工具,测量并选取所有扫描层面的最高点,选取最大值,作为视盘水肿最高点的高度。采用德国Zeiss眼底荧光血管造影分析系统观察并记录眼底表现。检测对比患者健侧、患侧眼的上部黄斑部神经节细胞复合体(ganglion cell complex, GCC)厚度、下部GCC厚度及平均GCC厚度。检测对比患者健侧、患侧眼的视盘上方、下方周围视网膜神经纤维层(retinal nerve fiber layer, RNFL)厚度及平均RNFL厚度。
彩超检查:采用Philips iU22超声诊断仪器,探头为SL1543,频率为3~13 MHz,患者仰卧,叮嘱患者轻闭双眼,探头放置在眼睑,在水平和垂直双方向进行扫描,球后20~25 mm视神经颞侧进行眼动脉探查,记录眼动脉(ophthalmic artery, OA)及视网膜中央动脉(central retinal artery, CRA)的收缩末期血流速度(peak systolic velocity, PSV)、舒张末期血流速度(end diastolic velocity, EDV)、阻力指数(pulsatility index, RI),所有血流动力学参数为3次测量取平均值。检测对比患者健侧、患侧数据。
1.3 统计学处理数据处理软件使用SPSS 21.0,本研究中GCC厚度等计量指标均符合正态分布或近似正态分布采用平均值±标准差(x±s)表示;组间对比采用t检验;绘制受试者操作特征(ROC)曲线计算对应截断值下的诊断学指标及曲线下面积(AUC)。检验水准:α=0.05。
2 结果2.1 患侧与健侧的GCC厚度比较经OCTA检查,上部GCC厚度、下部GCC厚度及平均GCC厚度进行比较,患侧测定值均低于健侧且差异具有统计学意义(P < 0.05)。见表 1。
表1
| 表 1 患侧与健侧的GCC厚度比较 |
2.2 患侧与健侧的RNFL厚度比较经OCTA检查,上方RNFL厚度、下方RNFL厚度及平均RNFL厚度进行比较,患侧测定值均低于健侧且差异具有统计学意义(P < 0.05)。见表 2。
表2
| 表 2 患侧与健侧的RNFL厚度比较 |
2.3 患侧与健侧OA的血流参数比较经彩超检查,患侧眼OA的PSV、EDV、RI测定值与健侧比较,差异均不具有统计学意义(P>0.05)。见表 3。
表3
| 表 3 患侧与健侧OA的血流参数比较 |
2.4 患侧与健侧CRA的血流参数比较经彩超检查,患侧与健侧眼的CRA的EDV、RI测定值比较,差异无显著性(P>0.05),患侧眼CRA的PSV值低于健侧且差异有统计学意义(P < 0.05)。见表 4。
表4
| 表 4 患侧与健侧CRA的血流参数比较 |
2.5 诊断学价值分析根据ROC曲线,CRA-PSV值、平均RNFL厚度、平均GCC厚度测定值分别诊断NAIOA患者的诊断学价值指标,详见表 5,三者联合诊断NAIOA患者的灵敏度为95.27%、特异度为83.90%、ROC曲线下面积(AUC)为0.930。见表 5。
表5
| 表 5 诊断学价值指标 |
2.6 病例资料图 1为患者影像学资料。
图 1
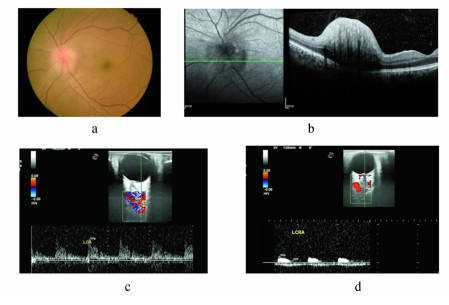 | 图 1 患者影像学资料.a. NAIOA患者眼底照相,视神经盘水肿;b. 视盘横向OCTA图像,视盘水肿;c、d. 眼动脉及视网膜中央动脉的超声图像及血流参数 |
3 讨论非动脉炎性前部缺血性视神经病变属于临床常见的突然视力减低、视野缺损以及视盘水肿的急性致盲性缺血性眼部疾病,一般好发于45岁以上中老年人群,影响其发生发展的因素多样[4]。生理研究显示前部视神经由视盘和筛板后区组成,视网膜中央动脉分支供应视盘表面层,筛板前区和筛板区视神经主要由相关区域视盘以及脉络膜后睫状动脉分支进行营养,非动脉炎性前部缺血性视神经病变主要发生在筛前、筛板以及近端筛后视神经,因此后睫状动脉是导致本病发生的关键[5]。由于人体眼内血管出现封闭的易感性差异大,后睫状动脉灌注压下降会造成筛前和筛板区视神经的血供发生关闭,筛板毛细血管分布在坚韧的纤维隔中,老年人群血管弹性下降,筛板和筛前缺乏自我调节能力的脉络膜血管易受管壁外压力的影响[6, 7]。还有****通过对病理组织学分析发现,非动脉炎性前部缺血性视神经病变患眼的视盘早期边界不清即水肿,筛板胶原纤维及视神经纤维束肿胀,一般以患者视神经轴突的中心部最容易受累,当灌注压降低,缺血性病变导致睫状动脉末梢循环中心相对应的视神经分水岭区出现病变[8]。
研究发现, 本病容易与视神经乳头炎难以区分,两者在临床表现相似之处较多,以往主要根据典型的疾病发作史、眼底荧光血管造影、视野等检查进行诊断,但是均为视网膜平面研究,并不能对视盘垂直横断面的变化进行了解,在对视盘水肿程度和形态判断主观性较强,缺乏量化的评判指标[9]。本研究采用光学相干断层扫描(OCTA)联合彩超进行诊断,OCTA属于高分辨率、无创性生物组织成像技术,能够获取眼底的纵向断层图像,提供客观断面形态学与量化指标[10]。OCTA用于测量非动脉炎性前部缺血性视神经病变患眼视盘周围视网膜神经纤维层(RNFL)厚度,病变同视野缺损之间呈对应关系,早期患者一般出现视盘全部或部分水肿,后期形成视神经萎缩[11]。OCTA检查视盘周围RNFL厚度对于了解非动脉炎性前部缺血性视神经病变病变过程中视神经纤维损害的范围、程度和变化过程具有一定意义。本研究显示患侧的上部GCC厚度、下部GCC厚度及平均GCC厚度测定值均低于健侧,提示NAIOA患者存在黄斑部神经节细胞复合体厚度降低。患侧的上方RNFL厚度、下方RNFL厚度及平均RNFL厚度测定值均低于健侧,提示NAIOA患者存在周围视网膜神经纤维层厚度降低。有****报道在水肿增厚的RNFL和视网膜色素上皮层之间均存在有低反射区域,并且随着视盘水肿的消退而消失,患者RNFL平均厚度比对侧眼和健康眼显著变薄,代表了神经纤维的萎缩[12]。还有****发现非动脉炎性前部缺血性视神经病变患者最常见的盘周RNFL变薄部位在颞上方,对应最明显的视野缺损部位在鼻下方,同本研究结果相似[13]。
本研究中彩超检查发现患侧眼CRA的PSV值低于健侧,提示NAIOA患者视网膜中央动脉收缩末期血流速度降低。绘制ROC曲线发现CRA-PSV+平均RNFL厚度+平均GCC厚度诊断NAIOA具有良好的诊断特异性和灵敏性。超声检查则具有便捷性、无创性和可重复性,PSV反映患者小动脉实际血流状况,EDV提示了血管下游组织血液供应障碍程度,RI则提示了远端血管阻力情况[14]。本研究出现PSV降低,主要是患者存在不同程度视盘水肿,视网膜中央动脉穿行视盘被挤压,血流降低,部分患者视神经缺血导致了代偿性扩张,造成了血流降低,这与以往研究报道一致。此外,还有研究发现,患者血流动力学降低,主要是后睫状动脉梗死血液供应障碍时鼻侧吻合支少,因此无法进行充分代偿,导致血流速度降低,这也是导致患者视盘象限水肿程度不一致的重要原因,同本研究结果相似[15]。
因此,采用OCTA联合彩超检查应用于NAIOA患者诊断中效果更好,可以分析视网膜脉络膜血管分布与血流情况,能够分析患者视盘和黄斑区不同区域不同层次血流灌注精准减少,可为NAIOA患者预防提供精准依据。OCTA联合彩超在NAIOA患者的诊断中较单一诊断方式更有利于提高诊断指标的灵敏度。但是,本研究入组患者数量少,且对于具体发病机制还需进一步明确,因此,未来还需开展多中心、大样本量进一步深入分析。
参考文献
| [1] | 陈凯, 周洪伟. 神经生长因子治疗非动脉炎性前部缺血性视神经病变的临床效果[J]. 中华眼视光学与视觉科学杂志, 2020, 22(10): 781-785. DOI:10.3760/cma.j.cn115909-20191228-00353 |
| [2] | 陶枳言, 马瑾, 钟勇. OCTA在非动脉炎性前部缺血性视神经病变诊断中的应用和研究现状[J]. 中华眼科杂志, 2019, 55(4): 306-310. |
| [3] | 中华医学会眼科学分会神经眼科学组. 我国非动脉炎性前部缺血性视神经病变诊断和治疗专家共识(2015年)[J]. 中华眼科杂志, 2015, 51(5): 323-326. DOI:10.3760/cma.j.issn.0412-4081.2015.05.002 |
| [4] | 邹文军, 武志峰, 张洁, 等. 非动脉炎性前部缺血性视神经病变患眼视盘周围及黄斑区视网膜血流参数变化特征[J]. 中华眼视光学与视觉科学杂志, 2018, 20(12): 737-742. DOI:10.3760/cma.j.issn.1674-845X.2018.12.007 |
| [5] | 吴子旭, 郑东萍, 潘陆平, 等. 非动脉炎性前部缺血性视神经病变患者临床特征和视盘形态分析[J]. 中国药物与临床, 2018, 18(9): 1490-1492. |
| [6] | Baek M S, Seo Y S, Kyung S E. The function of the fellow eye in patients with unilateral nonarteritic anterior ischemic optic neuropathy[J]. Journal of the Korean Ophthalmological Society, 2019, 60(9): 881. DOI:10.3341/jkos.2019.60.9.881 |
| [7] | Rizzo J F. Unraveling the Enigma of nonarteritic anterior ischemic optic neuropathy[J]. Journal of Neuro-Ophthalmology, 2019, 39(4): 529-544. DOI:10.1097/WNO.0000000000000870 |
| [8] | Augstburger E, Zéboulon P, Keilani C, et al. Retinal and choroidal microvasculature in nonarteritic anterior ischemic optic neuropathy: an optical coherence tomography angiography study[J]. Investigative Ophthalmology & Visual Science, 2018, 59(2): 870-877. |
| [9] | Distefano A G, Lam B L. Non-arteritic anterior ischemic optic neuropathy in pilots[J]. Aerospace Medicine and Human Performance, 2018, 89(11): 1005-1007. DOI:10.3357/AMHP.5177.2018 |
| [10] | Kim J H, Kang M H, Seong M, et al. Anomalous coagulation factors in non-arteritic anterior ischemic optic neuropathy with central retinal vein occlusion: a case report[J]. Medicine, 2018, 97(15): e0437. DOI:10.1097/MD.0000000000010437 |
| [11] | 李梦洋, 钱彤, 黎晓新, 等. 急性黄斑旁中心中层视网膜病变患眼临床特征及多模式影像特征观察[J]. 中华眼底病杂志, 2019, 35(4): 322-326. DOI:10.3760/cma.j.issn.1005-1015.2019.04.002 |
| [12] | 巩鸿霞, 王兰惠. 光相干断层扫描及其血管成像在非动脉炎性前部缺血性视神经病变中的应用研究现状及进展[J]. 中华眼底病杂志, 2018, 34(1): 80-82. |
| [13] | 汪宇涵, 马瑾, 干霖洋, 等. 不同病程非动脉炎性前部缺血性视神经病变视盘结构及血管密度的初步观察[J]. 中华眼科杂志, 2019, 55(9): 677-686. DOI:10.3760/cma.j.issn.0412-4081.2019.09.010 |
| [14] | 刘珏君, 陈长征, 李璐, 等. 非动脉炎性前部缺血性视神经病变视盘及黄斑血流灌注变化的观察[J]. 中华眼底病杂志, 2019, 35(3): 219-225. DOI:10.3760/cma.j.issn.1005-1015.2019.03.002 |
| [15] | 仲妍, 车慧欣. 光学相干断层扫描血管成像(OCTA)在原发性青光眼患者中的检测价值[J]. 眼科新进展, 2018, 38(4): 352-356. |
