 , 刘轼初1, 钟晓玲1, 刘荣彬2
, 刘轼初1, 钟晓玲1, 刘荣彬2 1. 深圳市坪山区人民医院, 广东 深圳 518118;
2. 中山大学 孙逸仙纪念医院, 广东 广州 510120
2020-04-17 收稿, 2020-07-21 录用
基金项目: 深圳市坪山区卫生系统科研项目(201818)资助
*通讯作者: 谭学礼
摘要: 甲状腺微小乳头状癌(PTMC)发病率逐年升高,中央区淋巴结转移是影响患者生存预后的重要危险因素。本研究通过回顾性收集经病理确诊为cN0期PTMC患者(肿瘤直径≤ 10 mm)198例,分析了患者一般临床特征、超声声像图特征、细针穿刺活检(FNAC)结果、BRAFV600E突变情况及病理等资料,利用单因素和多因素Logistic回归分析对中央区淋巴结转移相关危险因素进行统计。结果发现:单因素分析提示,年龄 < 45岁、男性、超声提示微小钙化、肿瘤直径≥ 5 mm、TI-RADS评分≥ 8分与PTMC患者发生中央区淋巴结转移有显著关系。多因素分析发现肿瘤直径≥ 5 mm、超声提示微小钙化、TI-RADS评分≥ 8分是中央区淋巴结转移的独立危险因素。因此,瘤体直径越大、TI-RADS评分升高的cN0期PTMC患者中央区淋巴结转移风险增加。本文结果可在临床医师制定治疗策略时提供参考依据。
关键词: 甲状腺微小乳头状癌中央区淋巴结转移微小钙化肿瘤直径TI-RADS评分
Risk Factors Related to Central Lymph Node Metastasis in Papillary Thyroid Microcarcinoma
TAN Xueli1
 , LIU Shichu1, ZHONG Xiaoling1, LIU Rongbin2
, LIU Shichu1, ZHONG Xiaoling1, LIU Rongbin2 1. Pingshan District People's Hospital, Shenzhen 518118, Guangdong, P. R. China;
2. Sun Yat-Sen Memorial Hospital, Sun Yat-Sen University, Guangzhou 510120, Guangdong, P. R. China
*Corresponding author: TAN Xueli
Abstract: The incidence of papillary thyroid microcarcinoma (PTMC) is increasing year by year. Central lymph node metastasis (CLNM) is one of the important prognostic factors for the patients of PTMC. A retrospective study was performed on 198 patients with cN0 PTMC (tumor diameter ≤ 10 mm). Basic data (e.g., gender, age, tumor location, tumor diameter) of eligible patients were extracted, as well as the pathology, ultrasound, fine-needle aspiration cytology (FNAC) results and BRAFV600E mutation analysis. The results of univariate analysis indicated that age < 45 years, male, punctate echogenic foci on sonography, tumor size ≥ 5 mm, and ACR TI-RADS scores ≥ 8 were related to predict CLNM in PTMC patients. The results of multivariate analysis indicated that tumor size ≥ 5 mm, punctate echogenic foci on sonography, and ACR TI-RADS scores ≥ 8 were independent risk factors for CLNM. Moreover, larger tumor volume and higher TI-RADS scores were associated with greater risk of CLNM in cN0 PTMC patients, whom clinicians should take a more radical treatment strategy for.
Key words: papillary thyroid microcarcinomacentral lymph mode metastasismicrocalcificationtumor sizeTI-RADS score
世界卫生组织(World Health Organization, WHO)定义甲状腺微小乳头状癌(papillary thyroid microcarcinoma, PTMC))为肿瘤最大直径≤10 mm的甲状腺乳头状癌。近年来研究数据显示甲状腺癌患病率显著升高,其中以PTMC的增长为主且增速最快,但是其死亡率并无明显增加[1, 2],这可能是由于超声诊断水平提高,可以发现更多无症状的PTMC并及早治疗。美国甲状腺协会(ATA)指南表明,谨慎观察是立即手术切除的安全有效替代方法[3],如果PTMC患者在临床上怀疑突破包膜或颈部淋巴结受累,必须在手术后切除肿瘤。PTMC诊断是依据肿瘤病理大小,而体积微小并不意味着侵袭性微小。相关研究报道PTMC中央区淋巴结转移率高达约28.0%~30.5%[4-6]。因此,术前评估PTMC的危险因素可能有助于中央淋巴结转移(central lymph node metastasis, CLNM)的治疗方案的选择。
在本回顾性研究中,我们分析了PTMC患者的临床和病理学特征、超声、细胞病理学结果、BRAF基因检测结果等,研究了CLNM相关的危险因素。
1 材料与方法1.1 一般资料以2016年1月~2018年4月期间在深圳市坪山区人民医院甲状腺外科行手术切除并获得病理结果的198例PTMC患者为研究对象,收集所有患者的术前病例情况、超声图像、细胞学和病理学特征及BRAFV600E基因检测结果。本研究经本院伦理委员会审批通过,术前均征得患者或授权委托人同意并签署知情同意书。
1.2 仪器与方法采用Philips iU22及Siemens ACUSON Sequoia红杉树超声诊断仪,选择浅表高频探头(L12-5、18L6),频率为5~12 MHz。患者取仰卧位,充分暴露颈部,观察甲状腺结节的数量、位置、大小、成分、形态、边缘以及回声情况等。根据2017年美国放射学会甲状腺影像报告和数据系统对甲状腺(主要包括结节)的五大指标进行评分[7],根据结节评分不同分为1~5类。
1.3 超声引导下甲状腺细针穿刺细胞学检查(fine-needle aspiration cytology, FNAC)细针穿刺由操作熟练的高年资医师在超声引导下进行。穿刺前需询问病史和体格检查,排除妊娠和有严重疾病不能耐受穿刺的患者。患者取仰卧位,垫高并充分暴露颈部,常规消毒铺巾,1%利多卡因局部麻醉,选用22 G细胞穿刺针。超声引导下穿刺针进入甲状腺结节内后,反复进退多部位穿刺抽吸,毎一个结节至少抽吸3次。抽吸到足够的穿刺物后打入固定液中固定并送细胞学病理检查。所有甲状腺细针穿刺细胞标本均按照Bethesda报告系统标准发放报告。
1.4 BRAF基因突变检测离心收集术前FNAC穿刺标本,经过常规的石蜡包埋过程制成细胞蜡块。利用QIAamp DNA FFPE Tissue Kit从石蜡组织切片(FFPE)中提取DNA,经PCR扩增BRAF基因15号外显子(人类BRAF基因V600E突变检测试剂盒,厦门安德生物),依据说明书对所得结果进行分析,得出BRAFV600E突变情况。
1.5 统计学分析采用SPSS 22.0统计软件进行分析。计量资料以(x±s)表示,采用独立样本t检验。计数资料以n(%)表示,采用χ2检验。PTMC灰阶超声表现与颈部淋巴结转移的相关性采用Logistic回归分析,P<0.05为差异有统计学意义。
2 结果2.1 临床病理学特征本研究共纳入198例PTMC病人,其中男性48例、150例女性,男女性别比为1:3.2,确诊年龄为22~73岁,平均(43.3±10.3)岁。具体数据见表 1。
表1
| 表 1 198例PTMC病人的一般资料和临床特征 |
2.2 PTMC中央区淋巴结转移单因素分析PTMC中央区淋巴结转移单因素分析结果显示:年龄、性别、肿瘤大小、TI-RADS评分、微小钙化与CLNM有显著关系(P<0.05),而CLNM与肿瘤位置、甲状腺癌侵犯被膜、血管浸润、桥本氏甲状腺炎、BRAFV600E突变、纵横比>1、形状、边界、成分和TBS分类等特征无关(P≥0.05),具体数据见表 2。
表2
| 表 2 cN0期PTMC患者发生CLMN的危险因素分析 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
2.3 PTMC中央区淋巴结转移的多因素Logistic回归分析将单因素分析中有统计学意义的5个因素纳入多因素Logistic回归分析,结果显示:肿瘤直径≥5 mm、超声提示微小钙化、TI-RADS评分≥8分是中央区淋巴结转移的独立危险因素(P<0.05);年龄、性别不是中央区淋巴结转移的独立危险因素(P>0.05),见表 3。进一步分析发现,随着肿瘤最大直径和TI-RADS评分的增大,颈部淋巴结转移率也增大,见图 1。
表3
| 表 3 198例cN0期PTMC患者发生CLMN的危险因素:单因素与多因素线性回归分析 |
图 1
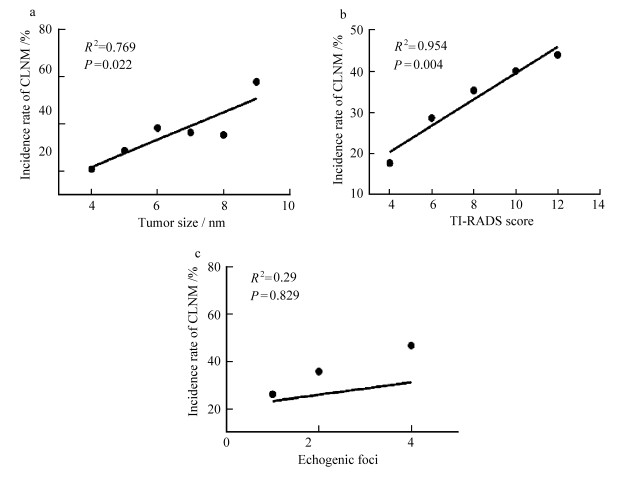 | 图 1 PTMC结节的最大直径、TI-RADS评分、钙化情况与颈部淋巴结转移率的关系 a.随PTMC结节的最大直径增大,CLMN转移率增加(R2=0.769);b.随PTMC结节的TI-RADS评分增大,CLMN转移率增加(R2= 0.954);c.无钙化、粗大钙化、边缘钙化和点状钙化与CLMN转移率的关系(横坐标为钙化分值,无钙化为0分,粗大钙化为1分,边缘钙化为2分,点状钙化为3分,一个结节中同时出现两种钙化情况,如粗大钙化合并微小钙化,则计4分) |
3 讨论近年来,关于PTMC诊疗的讨论越来越多,临床往往同时存在对其的治疗不足和过度治疗[8]。一方面大多数PTMC表现为惰性及无害,但另一方面却有极少数PTMC的恶性程度非常高,具有极强的侵袭性和转移能力[9]。相关研究报道PTMC中央区淋巴结转移率高达约28.0%~30.5%[6]。美国甲状腺协会(ATA)发布的2015版成人《甲状腺结节和分化型甲状腺癌诊治指南》[3]指出一般情况下对于活检明确的甲状腺癌患者仍采取手术治疗,对于低危患者可采取积极的临床随访监测来代替立即手术。但目前该指南并没有对如何筛选合适的随访观察对象进行更进一步的说明。“低危”的PTMC尚无明确定义[10],而且要明确真正意义上的“低危”并不容易[11]。
由于各国医疗政策和报销范围的不同,美国及日本的指南认为低风险的PTMC可以采取积极的观察(每年1~2次超声检査),病例岀现进展信号(如肿块增大>3 mm、颈部淋巴结转移征象等)后再进行手术切除也不晩。比如ATA发布的2015版成人《甲状腺结节和分化型甲状腺癌诊治指南》[3]就指出超声提示直径≤10 mm的可疑恶性甲状腺结节可密切随访,至结节直径>10 mm后再做FNAC,除非发现包膜侵犯或发现可疑转移淋巴结情况才需要立刻做FNAC。相对于《2015版ATA指南》对FNAC的谨慎,中国抗癌协会甲状腺癌专业委员会(CATO)发布的2016版《甲状腺微小乳头状癌诊断与治疗专家共识》[12]就推荐直径≥5 mm的结节就可行FNAC,而对于直径<5 mm的结节则不建议穿刺。因此,外科医师在临床工作应根据患者的自身条件制定个体化的诊疗方案。
本研究显示37.4%的cN0期PTMC患者发生了CLMN,发生CLMN相关5个危险因素分别为年龄<45岁、男性、超声提示微小钙化、肿瘤直径≥5 mm、TI-RADS评分≥8分,通过多因素回归分析发现肿瘤最大径≥5 mm、超声提示微小钙化、TI-RADS评分≥8分是CLMN的独立危险因素。多数研究认为肿瘤大小与中央区淋巴结转移密切相关[13-16],本研究发现肿瘤最大径≥5 mm与CLMN具有显著的相关性,而且随着结节最大径的增大,CLMN的风险也不断增加。
超声提示结节内微小钙化灶是甲状腺结节的一个重要恶性征象,约12%~68%的甲状腺乳头状癌会出现微钙化灶[17]。一般认为微小钙化产生是由于甲状腺癌的瘤体增长过快,中央区坏死组织堆积,导致钙盐沉积所致。因此术前超声提示PTMC内微小钙化一定程度上反应了肿瘤生物学行为,所以微小钙化灶不但可以特异性地诊断PTMC,还可以提示其淋巴结转移的风险。
ACR TI-RADS评分是美国放射学会推荐用于甲状腺结节超声评分与分级的一种方法,随着TI-RADS评分的增加,分级水平也增加,同时结节的恶性率也增加。当结节的分类为5类(≥7分),结节的恶性率为35.0%;当结节的评分≥10分时,结节的恶性率达到68.5%[18]。本研究发现TI-RADS评分增高会同时增加甲状腺癌发生淋巴结转移的风险,这与何等[19]报道相似。在74个发生淋巴结转移的病例中,有72例结节的TI-RADS评分≥ 8分,占比97.3%,只有2例结节TI-RADS评分小于8分(P=0.03)。因此,对≥8分的可疑恶性结节应该重点观察颈部淋巴结情况,避免遗漏。
本研究尚存在一定的局限性。由于统计的样本量较小,将来通过扩大样本量及对更多因素的观察分析,有望进一步确定PTMC患者发生CLNM的危险因素。
综上,虽然PTMC被认为是一种惰性肿瘤,但CLMN的风险并不低。本研究确定了肿瘤直径≥5 mm、超声提示微小钙化、TI-RADS评分≥8分是CLMN的独立危险因素,可以有效筛选出高危PTMC,为临床医师治疗策略决定提供参考依据。
参考文献
| [1] | Choi K Y, Kim J H, Park I S, et al. Predictive gene signatures of nodal metastasis in papillary thyroid carcinoma[J]. Cancer Biomarkers, 2018, 22(1): 35-42. DOI:10.3233/CBM-170784 |
| [2] | Wei X, Wang M, Wang X, et al. Prediction of cervical lymph node metastases in papillary thyroid microcarcinoma by sonographic features of the primary site[J]. Cancer Biology & Medicine, 2019, 16(3): 587-594. |
| [3] | Haugen B R, Alexander E K, Bible K C, et al. 2015 American thyroid association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer:the american thyroid association guidelines task force on thyroid nodules and differentiated thyroid cancer[J]. Thyroid, 2016, 26(1): 1-133. |
| [4] | Kim S K, Woo J W, Park I, et al. Propensity score-matched analysis of robotic versus endoscopic bilateral axillo-breast approach (BABA) thyroidectomy in papillary thyroid carcinoma[J]. Archives of Surgery, 2017, 402(2): 243-250. DOI:10.1007/s00423-016-1528-7 |
| [5] | 吴艳乐, 孙锦明, 张进军, 等. 甲状腺微小乳头状癌临床病理特征及中央区淋巴结转移危险因素分析[J]. 中华耳鼻咽喉头颈外科杂志, 2017, 52(6): 426-429. |
| [6] | 彭琛, 魏松锋, 郑向前, 等. 1401例甲状腺微小乳头状癌临床病理特征及中央区淋巴结转移危险因素分析[J]. 中国肿瘤临床, 2016, 3: 95-99. |
| [7] | Tessler F N, Middleton W D, Grant E G, et al. ACR thyroid imaging, reporting and data system (TI-RADS):white paper of the ACR TI-RADS committee[J]. Journal of the American College of Radiology, 2017, 14(5): 587-595. DOI:10.1016/j.jacr.2017.01.046 |
| [8] | Ito Y, Miyauchi A. Management of Low-Risk Papillary Thyroid Carcinoma and Papillary Microcarcinoma:The Japanese Experience:A Multidisciplinary Approach[M]. 2018. |
| [9] | Siddiqui S, White M G, Antic T, et al. Clinical and pathologic predictors of lymph node metastasis and recurrence in papillary thyroid microcarcinoma[J]. Thyroid, 2016, 26(6): 807-815. |
| [10] | 罗晓, 李安华. 甲状腺微小乳头状癌的管理:现状与争议[J]. 中华医学超声杂志(电子版), 2019, 16(1): 6-10. |
| [11] | Cho S J, Baek J H, Chung S R, et al. Thermal ablation for small papillary thyroid cancer:a systematic review[J]. Thyroid, 2019, 29(12): 1774-1783. DOI:10.1089/thy.2019.0377 |
| [12] | 程若川, 杨婷婷. 2016版中国甲状腺微小乳头状癌诊断与治疗专家共识解读[J]. 中国实用内科杂志, 2019, 39(4): 47-53. |
| [13] | Xiang D, Xie L, Xu Y, et al. Papillary thyroid microcarcinomas located at the middle part of the middle third of the thyroid gland correlates with the presence of neck metastasis[J]. Surgery, 2015, 157(3): 526-533. DOI:10.1016/j.surg.2014.10.020 |
| [14] | Yasmine A, Yeh M W, Livhits M J. Many physicians adopt active surveillance for low-risk papillary thyroid microcarcinomas at Kuma hospital[J]. Clinical Thyroidology, 2018, 30(6): 287-289. DOI:10.1089/ct.2018;30.287-289 |
| [15] | Ito Y, Miyauchi A, Oda H, et al. Revisiting low-risk thyroid papillary microcarcinomas resected without observation:was immediate surgery necessary?[J]. World Journal of Surgery, 2016, 40(3): 523-528. DOI:10.1007/s00268-015-3184-4 |
| [16] | 高虹, 孙丽丽, 佟凌霞. 甲状腺微小乳头状癌中央区淋巴结转移相关因素分析[J]. 中国实验诊断学, 2014(10): 1682-1684. |
| [17] | Lee Y C, Eun Y G, Sohn Y M, et al. Predictive factors for occult contralateral carcinoma in patients with unilateral papillary thyroid microcarcinoma by preoperative ultrasonographic and pathological features[J]. World Journal of Surgery, 2015, 39(7): 1736-1741. DOI:10.1007/s00268-015-3024-6 |
| [18] | Middleton W D, Teefey S A, Reading C C, et al. Multiinstitutional analysis of thyroid nodule risk stratification using the American college of radiology thyroid imaging reporting and data system[J]. American Journal of Roentgenology, 2017, 208(1): 1-11. DOI:10.2214/AJR.16.17519 |
| [19] | 何学森, 钟晓, 蔡华崧, 等. 基于ACR TI-RADS分类对甲状腺乳头状癌淋巴结转移风险模型的预测[J]. 中山大学学报医学版, 2018, 39(6): 941-947. |
