
重庆市巴南区人民医院 放射科, 四川 重庆 401320
2020-04-17 收稿, 2020-06-22 录用
*通讯作者: 朱晓玲
摘要: 为探究核磁共振(MRI)联合钆塞酸二钠(Gd-EOB-DTPA)对肝硬化背景下小肝癌的诊断价值,80名患者分别进行上腹部MRI及Gd-EOB-DTPA增强MRI检查,比较两种方法检出小肝癌的概率、ROC曲线,以及敏感性、阴性、阳性预测值。结果显示,80例患者共检出95枚小结节,其中76枚为肝细胞癌(HCC),19枚为良性结节。MRI结合Gd-EOB-DTPA诊断出小肝癌的概率和AUC值明显高于单独使用MRI成像(P < 0.05)。MRI结合Gd-EOB-DTPA的诊断小肝癌敏感性、阴性、阳性预测值均高于单独使用MRI,但无显著性差异(P>0.05)。Gd-EOB-DTPA增强MRI能够提高肝硬化背景下小肝癌的诊断率与敏感性,值得临床推广使用。
关键词: MRI肝硬化小肝癌钆塞酸二钠临床价值
Clinical Value of MRI in the Diagnosis of Small Hepatocellular Carcinoma with Disodium Gadolinium Sephate in the Context of Liver Cirrhosis
FAN Xiaoli, LING Qian, FANG Zheng, ZHU Xiaoling

Radiology Department, People's Hospital of Chongqing Banan District, Chongqing 401320, Sichuan, P. R. China
*Corresponding author: ZHU Xiaoling
Abstract: To explore the diagnostic value of MRI combined with Gd-EOB-DTPA for small liver cancer. 80 patients underwent upper abdominal MRI and Gd-EOB-DTPA enhanced MRI. The probability of detecting small liver cancer with two methods, ROC curve, and sensitivity, negative, positive predictive value were compared. The results showed that a total of 95 small nodules were detected in 80 patients, 76 were diagnosed with HCC, and 19 were benign nodules. The probability and AUC value of MRI combined with Gd-EOB-DTPA for the diagnosis of small hepatocellular carcinoma were significantly higher than those of MRI alone (P < 0.05). The sensitivity, negative and positive predictive values of MRI combined with Gd-EOB-DTPA for the diagnosis of small liver cancer are higher than those of MRI alone, but there is no significant difference (P>0.05).Gd-EOB-DTPA enhanced MRI can improve the diagnosis rate and sensitivity of small liver cancer in the background of cirrhosis, and it is worthy of clinical promotion.
Key words: MRIliver cirrhosissmall hepatocellular carcinomadisodium gadolinium sephateclinical value
肝细胞癌(hepatic cell carcinoma,HCC)是我国最常见的恶性肿瘤之一,其死亡率高居其他恶性肿瘤之首,严重威胁着人们的生命健康,越来越受到国内外研究者的关注[1]。HCC发病较为隐匿,早期症状不明显,发现就诊时大部分患者已为中晚期,造成患者较高的死亡率,影响患者预后和生活质量[2, 3]。HCC患者常常伴有乙、丙型肝炎病毒和肝硬化,肝硬化患者具有较高的肝癌发病率,故对肝硬化患者进行定期检查尽早发现小肝癌等其他疾病的存在十分必要[4]。小肝癌也被称为早期肝癌,其具有单个肿瘤结节直径≤3 cm,癌结节数≤2个,肿瘤直径总和≤3 cm的特征[5]。核磁共振(magnetic resonance imaging,MRI)是目前常用于检测HCC的常用工具,具有无创性、观察结果直观等优势[6],但是,随着病理学对肝硬化和HCC研究的不断深入,医护人员对影像学提出了更加严格的要求,欲在肝硬化结节尚未发展成为小肝癌前检测发现,以便早期发现具有恶性倾向的肝硬化结节,尽早开展治疗。钆塞酸二钠(Gd-EOB-DTPA)作为临床常用的靶向磁共振成像对比剂,只有功能正常的肝细胞能够较好的摄取该物质,而肿瘤细胞则不能,因而能够提高MRI发现,提高诊断小肝癌的敏感性,但是,关于两者联用的临床价值国内文献报道较少[7, 8]。本研究探讨在肝硬化背景下诊断小肝癌中MRI联用Gd-EOB-DTPA的临床价值。
1 资料与方法1.1 临床资料选取2018年6月~2019年12月于我院就诊的患者80例作为研究对象。纳入标准:结合既往病史,患者患有肝硬化;符合美国肝脏病研究协会肝细胞癌诊断标准[9];单个结节直径≤3 cm,结节数≤2个,所有结节直径总和≤3 cm;无影像学检查禁忌症状;常规超声下,结节可见;能够接受Gd-EOB-DTPA与MRI联用;患者及其家属同意参与本研究,并签署知情同意书。排除标准:合并有其他类型肿瘤患者;患有严重心、肾功能疾病者;检查前进行手术治疗者;不配合治疗者。
80例患者中,男性43例、女性37例;年龄23~69岁,平均(48.92±10.02)岁。所有患者分别进行上腹部MRI检查及Gd-EOB-DTPA增强MRI检查。
1.2 MRI检查采用GE 1.5 T磁共振扫描仪,扫描序列及参数如下:轴位呼吸触发FSET2WI+FS,TR为2个周期,TE为(90±10) ms,层间距8 mm,层厚2 mm,视野(FOV)42 cm×42 cm,NEX为2.00,矩阵288×224;单次激发SE-EPI DWI,TR为1000 ms,TE为71.9 ms,层间距8 mm,层厚2 mm,矩阵128×130,FOV为42 cm×42 cm,NEX为4.00;同反相位成像TR为200 ms,TE为2.1~4.1 ms,层间距8 mm,层厚2 mm,矩阵288×160,FOV为42 cm×42 cm,NEX为1.00;e-THRIVE动态增强扫描,平衡期为120 s,门静脉期为55~60 s,动脉期为15~18 s,TR为3.8 ms,TE为1.8 ms,层间距4.8 mm,层厚2 mm,矩阵288×192,FOV为42 cm×42 cm。根据肿瘤大小,大约12~15 s可以完成单期全肝扫描。
1.3 Gd-EOB-DTPA与MRI联用Gd-EOB-DTPA是一种即用型水溶液,无需稀释,通过大孔的注射针头或留置管(推荐用18-20G)静脉推注给药,注射剂量按照0.1 mL/kg标准,注射速度为1~2 mL/s。Gd-EOB-DTPA注射完成后立即使用生理盐水冲洗,保证Gd-EOB-DTPA全部注入患者体内,MRI扫描序列及参数同1.2。
1.4 图像分析所有图像均由两名经验丰富的从事腹部影像学诊断的高级职称医师在PHILIPS 1.5T MRI后处理工作站分析。主要分析病灶部位信号特征、增强表现,测量病灶最大直径。根据影像对病灶部位评分:确诊为小肝癌5分,可能为小肝癌为4分,不确定为3分,可能不是小肝癌为2分,肯定不是小肝癌为1分,没有发现小肝癌,但是存在病灶为0分。4分和5分可以作为敏感性及阳性预测值进行计算。
1.5 ROC曲线分析利用Medcalc软件对得到的影像进行ROC曲线分析,使用等级划分法评价影像诊断效能,图像的阴、阳性用医生给出的一系列信任等级诊断表示。ROC曲线下面积(AUC)表示诊断的准确度,AUC越大,该诊断结果价值越大,AUC大于0.9时,表示诊断准确性较高[10]。
1.6 统计学分析使用SPSS 19.0统计软件学进行处理,计量资料用(x±s)表示,符合正态分布的数据组间比较采用t检验,不符合正态分布数据比较采用Mann-Whitney秩和检验;计数资料用百分数(%)表示,组间比较采用χ2检验,两种方法之间ROC曲线分析利用Z检验,P<0.05为差异有统计学意义。
2 结果2.1 肝脏结节诊断结果80例患者共检出95枚肝脏小结节。76枚诊断为HCC:59枚根据美国肝脏病研究协会无创诊断标准诊断时检出,8枚在随访过程中检出,9枚在组织活检中检出。19枚为良性结节:8枚经组织活检检测未再生结节和肝硬化结节,11枚长期随访过程中表现稳定,未出现出HCC典型症状。肝脏结节检测结果见表 1。
表1
| 表 1 肝脏结节检测结果[n(%)] |
2.2 肝硬化背景下小肝癌诊断结果MRI检测T1WI上低信号73枚、等信号3枚;T2WI上所有信号均呈现高信号,Gd-EOB-DTPA增强扫描,动脉期70处病灶呈现不均匀强化,但是强化增强,69枚结节呈现高强化;门脉期67处病灶呈稍低信号;延时期72个结节信号低于肝实质;20 min后76个结节呈现低信号。MRI结合Gd-EOB-DTPA诊断出小肝癌的概率明显高于单独使用MRI成像,差异有统计学意义(χ2=10.165,P=0.001)。见表 2。
表2
| 表 2 肝硬化背景下小肝癌诊断结果[n(%)] |
2.3 ROC曲线分析MRI对小肝癌的诊断AUC=0.798,Gd-EOB-DTPA增强MRI后对小肝癌的诊断AUC=0.942,Gd-EOB-DTPA增强MRI诊断准确性较高,差异有统计学意义(P<0.05)。数据见表 3。ROC曲线见图 1。
表3
| 表 3 MRI和增强MRI的曲线下面积 |
图 1
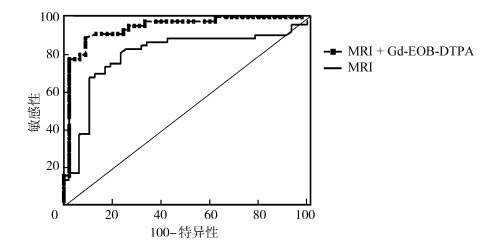 | 图 1 MRI和增强MRI的ROC曲线图 |
2.4 两种方法敏感性及阴性、阳性预测值根据病理切片结果显示,MRI结合Gd-EOB-DTPA的诊断小肝癌敏感性及阴性、阳性预测值均高于单独使用MRI诊断,但无显著差异(P>0.05)。见表 4。
表4
| 表 4 两种方法敏感性及阴性、阳性预测值比较[n(%)] |
3 讨论肝硬化背景下小肝癌是肝癌中的一种常见类型,该病发病较为隐匿,前期不易检测,患者确诊时大多数处于肿瘤中晚期[11]。早发现、早治疗是提高患者预后与生存质量的保障,故对小肝癌的早期诊断十分重要[12]。随着CT、MRI等诊断技术的飞跃性发展,MRI作为一种诊断效果好、诊断速度快的技术受到越来越多的欢迎,在HCC的诊断中得到广泛应用[13]。但是,由于肝硬化患者血流缓慢,某些对比剂含量居高不下,导致延迟期时对病灶检测信号常常存在干扰,此外,由于病灶中的门静脉参与供血,对比剂长时间存在,导致病灶处长时间表现为高信号,给肝硬化背景下小肝癌的诊断带来一定干扰[14, 15]。
Gd-EOB-DTPA既具有肝胆管细胞特异性造影特点,也具有磁共振动态增强所需细胞外造影剂的特点[16],其作为靶向MRI成像对比剂,具有与普通对比剂类似的生物学特性,同时,Gd-EOB-DTPA能够经肝细胞膜表面的OATP进入肝细胞内,经有机阴离子转运系统被肝细胞特异性摄取,在肝细胞中存在时间可高达24 h[17]。Gd-EOB-DTPA在肝细胞中长时间存在为MRI检查提供了较长时间的扫描窗,发挥作用后的Gd-EOB-DTPA可以经胆道系统排出体外[18, 19]。本研究结果显示,Gd-EOB-DTPA增强MRI后,小肝癌的检出率明显提高,提示Gd-EOB-DTPA可提高MRI对小肝癌的诊断准确性。由于小肝癌前期结节较小,检测存在较大困难,单独使用MRI可能错过较小结节的检测,但Gd-EOB-DTPA因能够作为细胞外间隙对比剂,又可以在肝胆期被肝脏特异性摄取,故可明显提高对肝脏小病灶处的检出率。肝脏Gd-EOB-DTPA动脉期大约在60~70 s达到强化峰值,肝胆期(注射对比剂20 min后)能够使正常肝细胞表现出均一化高度,病灶部位则呈现较低信号吸收[20]。Gd-EOB-DTPA的存在为提高结节性病灶的检出率、早期诊断发现小肝癌提供了有力支持。本研究结果与熊廷伟等[21]、富鹏等[22]的研究结果相近。ROC分析常常被用于评价两种或两种以上影像诊断差异[23],是能够伴随诊断界值动态变化的一种特异性、敏感性曲线[24]。本研究结果显示,Gd-EOB-DTPA增强MRI优于单纯使用MRI在诊断小肝癌上的准确度,能够提高诊断的敏感性与特异性。Gd-EOB-DTPA动态期与其他常规对比剂类似,但是肝胆期Gd-EOB-DTPA能够反应肝细胞的代谢状态,肝功能衰退或者降低的肝细胞不能摄取Gd-EOB-DTPA,导致肝胆期信号值降低,该特性对于提高对肝细胞的检测具有重要价值。许永生等[25]研究结果表明Gd-EOB-DTPA联用MRI敏感度为86%,本研究结果高于其及国外某些研究结果[26],这可能与样本量的选择及经验相关,但结果均说明Gd-EOB-DTPA增强MRI对于早期小肝癌的诊断具有较高的临床价值。
综上所述,MRI在肝硬化背景下诊断小肝癌中联用Gd-EOB-DTPA,能够提高MRI诊断的准确性、敏感性,具有较高的临床应用价值。
参考文献
| [1] | 刘东锋, 张峰. PET/CT多种示踪剂显像在肝细胞癌诊断中的研究进展[J]. 功能与分子医学影像学(电子版), 2017, 6(2): 1219-1222. |
| [2] | 张浩. 肝癌肝动脉栓塞用载药微球的研究现状及进展[J]. 医学临床研究, 2017, 34(2): 341-344. |
| [3] | Zheng H, Pomyen Y, Hernandez M O, et al. Single cell analysis reveals cancer stem cell heterogeneity in hepatocellular carcinoma[J]. Hepatology, 2018, 68(1): 127-140. DOI:10.1002/hep.29778 |
| [4] | Yagci T, Cetin M, Ercin P B. Cancer stem cells in hepatocellular carcinoma[J]. Journal of Gastrointestinal Cancer, 2017, 48(3): 241-245. DOI:10.1007/s12029-017-9960-7 |
| [5] | 丁芳, 顾红梅, 葛涌钱. 磁共振DWI及R2成像对小肝癌与硬化结节的鉴别诊断价值[J]. 临床放射学杂志, 2018(11): 1844-1847. |
| [6] | 白秀艳, 孙玉, 侯杰, 等. 钆塞酸二钠增强磁共振成像对肝脏局灶性病变的诊断价值分析[J]. 磁共振成像, 2018, 9(2): 102-107. |
| [7] | 苏赞瑞, 黄运福, 林建军, 等. DSA和钆塞酸二钠增强MRI对肝癌术后复发微小病灶诊断的比较研究[J]. 介入放射学杂志, 2017, 26(6): 559-563. |
| [8] | 佟晶, 卑贵光, 李玉泽, 等. 钆塞酸二钠增强MR与增强CT在肝脏局灶性病变诊断中的对比研究[J]. 中国临床医学影像杂志, 2017, 28(9): 642-646. |
| [9] | Zhang H Y, Luo S Q. Strategies for the management of hepatocellular carcinoma recommended by the American Association for the Study of Liver Diseases[J]. Chinese Journal of Hepatology, 2006, 14(7): 556-557. |
| [10] | 潘音桦, 黄瑜, 李杰华. 乳腺癌的超声与增强MRI应用ROC曲线对比研究[J]. 中国医学创新, 2017, 14(11): 37-40. |
| [11] | 于朝霞, 赵伟, 刘晓明, 等. 超声造影对于肝硬化背景下小肝癌的早期诊断价值[J]. 中国医疗设备, 2017, 32(10): 62-64. |
| [12] | 季如宁, 刘可夫, 王滢, 等. CT与MRI对肝硬化背景下小肝癌检出率的比较[J]. 现代生物医学进展, 2017, 17(29): 5732-5735. |
| [13] | 钟熹, 汤日杰, 李建生, 等. MRI纹理分析鉴别诊断肝硬化背景下小肝癌与增生结节[J]. 中国医学影像技术, 2018, 34(7): 1041-1045. |
| [14] | 沈莉红. 超声对肝硬化再生结节和小肝癌的诊断及鉴别诊断价值研究[J]. 中国卫生标准管理, 2017, 8(7): 107-108. |
| [15] | 沈祥春. 核磁共振成像在肝硬化再生结节和小肝癌中的鉴别诊断比较[J]. 影像研究与医学应用, 2018, 2(9): 97-98. |
| [16] | 刘冬.磁共振肝胆特异性对比剂Gd-EOB-DTPA在肝胆系统病变中的应用价值[D].苏州: 苏州大学, 2018. |
| [17] | 阮聪华. 肝脏MRI动态增强扫描:Gd-DTPA与Gd-EOB-DTPA的个体内对照研究[J]. 临床合理用药杂志, 2018, 11(14): 92-93. |
| [18] | Huang M Q, Liao B, Xu P, et al. Prediction of microvascular invasion in hepatocellular carcinoma:preoperative Gd-EOB-DTPA-dynamic enhanced MRI and histopathological correlation[J]. Contrast Media & Molecular Imaging, 2018:Article ID 9674565. |
| [19] | Juluru K, Talal A H, Yantiss R K, et al. Diagnostic accuracy of intracellular uptake rates calculated using dynamic Gd-EOB-DTPA-enhanced MRI for hepatic fibrosis stage[J]. Journal of Magnetic Resonance Imaging, 2017, 45(4): 1177-1185. DOI:10.1002/jmri.25431 |
| [20] | 戴志军, 吴小红, 郝宏毅. Gd-EOB-DTPA增强MRI对肝硬化肝功能评价的应用[J]. 宁夏医学杂志, 2017, 39(8): 691-693. |
| [21] | 熊廷伟, 龚明福, 廖翠薇, 等. Gd-EOB-DTPA增强MRI对肝硬化背景下小肝细胞癌的诊断价值[J]. 检验医学与临床, 2017, 14(23): 3441-3443. |
| [22] | 富鹏. Gd-EOB-DTPA增强MRI对肝硬化病理分级的诊断价值研究[J]. 中国CT和MRI杂志, 2018, 16(12): 101-103. |
| [23] | 王铭洁, 王峥, 杨伟, 等. 3.0T MRI联合带厚度指标对子宫腺肌症的诊断价值及ROC曲线分析[J]. 河北医药, 2018, 40(9): 61-63, 68. |
| [24] | 郑桦, 符孔, 李传资, 等. DWI和DCE-MRI鉴别不同乳腺炎性疾病类型的价值研究[J]. 河北医药, 2018, 40(21): 38-41. |
| [25] | 许永生, 刘海峰, 黎金葵, 等. Gd-EOB-DTPA增强MRI鉴别肝脏良恶性病灶的临床应用价值[J]. 磁共振成像, 2018, 9(7): 506-511. |
| [26] | Guo J, Seo Y, Ren S, et al. Diagnostic performance of contrastenhanced multidetector computed tomography and gadoxetic acid disodium-enhanced magnetic resonance imaging in detecting hepatocellular carcinoma:direct comparison and a meta-analysis[J]. Abdominal Radiology, 2016, 41(10): 1960-1972. DOI:10.1007/s00261-016-0807-7 |
